Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Eine 3D-Kultivierungsmethode von Sphäroiden embryonaler und Leberzebrafischzelllinien
In diesem Artikel
Zusammenfassung
Hier stellen wir ein effektives, einfaches und schnelles 3D-Kulturprotokoll für die Bildung von Sphäroiden von zwei Zebrafisch-Zelllinien (Danio rerio) vor: ZEM2S (Embryo) und ZFL (normaler Hepatozyten).
Zusammenfassung
Fischzelllinien sind vielversprechende In-vitro-Modelle für die Ökotoxizitätsbewertung; Herkömmliche Monolayer-Kultursysteme (2D-Kulturen) haben jedoch bekannte Einschränkungen (z. B. die Langlebigkeit der Kultur und die Aufrechterhaltung einiger in vivo zellulärer Funktionen). Daher wurden 3D-Kulturen, wie z. B. Sphäroide, vorgeschlagen, da diese Modelle gewebeähnliche Strukturen reproduzieren und die In-vivo-Bedingungen besser erfassen können. Dieser Artikel beschreibt ein effektives, einfaches und schnelles 3D-Kulturprotokoll für die Bildung von Sphäroiden mit zwei Zebrafisch-Zelllinien (Danio rerio): ZEM2S (Embryo) und ZFL (normaler Hepatozyten). Das Protokoll besteht darin, die Zellen in einer 96-Well-Platte mit rundem Boden und extrem niedriger Befestigung zu plattieren. Nach 5 Tagen unter orbitalem Schütteln (70 U/min) bildet sich ein einzelnes Sphäroid pro Well. Die gebildeten Sphäroide weisen eine stabile Größe und Form auf, und diese Methode vermeidet die Bildung mehrerer Sphäroide in einer Vertiefung. Daher ist es nicht notwendig, Sphäroide ähnlicher Größe von Hand auszuwählen. Die Einfachheit, Geschwindigkeit und Reproduzierbarkeit dieser Sphäroidmethode machen sie für In-vitro-Tests mit hohem Durchsatz nützlich.
Einleitung
Sphäroide sind kleine Zellkügelchen, die entstehen, wenn Zellen in engem Zell-zu-Zell-Kontakt in 3D-Kultur kultiviert werden. Die Fähigkeit von Sphäroiden, die in vivo Gewebeumgebung nachzuahmen, wurde bereits in einer Vielzahl von Zelllinien und Primärzellen untersucht 1,2. Obwohl Sphäroide für Toxizitätsstudien an Säugetieren gut entwickelt sind, ist die Entwicklung von Sphäroiden für Toxizitätsstudien mit Nicht-Säugetieren (z. B. Fischen) noch im Gange3. Für Fischzelllinien wurden Sphäroide durch eine Vielzahl verschiedener Methoden entwickelt, wie z. B. orbitales Schütteln (OS) unter Verwendung verschiedener Arten von Well-Platten 3,4,5,6,7 und die Methode der Magnetschwebetechnik unter Verwendung magnetischer Nanopartikel 8. Einige dieser Kulturmethoden für Sphäroide können jedoch mehr Nachteile haben als andere.
Beispielsweise können Kreiselmethoden in großen Mikrotiterplatten (24-Well-Platten) eine große Anzahl von Sphäroiden erzeugen, die sich in Größe und Form unterscheiden. In der Tat wurde die Bildung von Multi-Sphäroid-Strukturen nachgewiesen7. Dies erfordert intensive Bemühungen, Sphäroide mit ähnlicher Größe und Form für ein Experiment auszuwählen. Die 3D-Hängetropfen-Kulturmethode wird üblicherweise zur Erzeugung von Sphäroiden der Säugetierzelllinien 1,2,9,10,11 verwendet, wobei einzelne Sphäroide pro Tropfen erzeugt werden können, wodurch die oben beschriebenen Probleme vermieden werden. Eine modifizierte Hanging-Drop-Methode (Hanging Drop + Orbital Shaking) ist zwar in der Lage, mit einem kostengünstigen Verfahren ZFL-Sphäroide zu erzeugen, hat aber ihre Nachteile12. Die gebildeten zellulären Aggregate können in den Tropfen nicht über längere Zeiträume aufrechterhalten werden; Daher müssen sie auf Well-Platten übertragen werden. Dieser Prozess erfordert eine intensive Handhabung und lange Arbeitszeiten in einer Laminar-Flow-Haube, da er unter Verwendung einer Mikropipette12 tropfenweise durchgeführt wird. Darüber hinaus benötigt diese Methode 10 Tage, um die ZFL-Sphäroide vollständig zu bilden (5 Tage im hängenden Tropfen + 5 Tage im Betriebssystem)12. Diese Nachteile können die Anwendung von 3D-Fischsphäroiden für Toxizitätstests einschränken, insbesondere im Hinblick auf potenzielle Anwendungen für die Priorisierung von Chemikalien und die Nachhaltigkeit von Produkten.
Daher beschreibt dieser Artikel ein 3D-Kulturprotokoll, das in der Lage ist, einzelne Sphäroide von ZFL (D. rerio normal hepatozyten) und ZEM2S (D. rerio blastula phase embryo) Zelllinien zu erzeugen, basierend auf der kombinierten Verwendung von 96-Well-Ultra-Low-Attachment-Platten (ULA-Platten) und einem Orbitalschüttler (22 mm Rotationsdurchmesser). Die angewandte Methode ist einfach und reproduzierbar und kann in kurzer Zeit (5 Tage) eine große Anzahl von Sphäroiden ähnlicher Größe und Form erzeugen. Die Vorteile dieser Methode können die Anwendung von Fisch-3D-Modellen für aquatische Toxizitätsstudien sowohl in der Industrie als auch in der Wissenschaft sowie den Fortschritt bei der Implementierung alternativer Methoden für Ökotoxizitätstests unterstützen.
Protokoll
Die wichtigsten Schritte zur Erzeugung von 3D-Sphäroiden von ZFL- und ZEM2S-Zelllinien in einer 96-Well-Platte mit rundem Boden sind in Abbildung 1 dargestellt.
Anmerkungen: Einzelheiten zu allen in diesem Protokoll verwendeten Materialien finden Sie in der Materialtabelle und in Tabelle 1 zu den in diesem Protokoll verwendeten Lösungen und Nährmedien.
1. Zellkulturmedium und Monolayerkulturen
- Beide Zelllinien (ZFL, ZEM2S) werden als Monolayer in einem Inkubator bei 28 °C ohne CO2 gezüchtet und in einem Subkultivierungsverhältnis von 1:3 subkultiviert, wenn sie ~80% Konfluenz erreichen.
- Beginnen Sie mit einem T75-Kolben mit Zebrafischzellen bei ~80% Konfluenz, die wie oben beschrieben kultiviert wurden.
- Entfernen Sie das gesamte Medium und waschen Sie die Zellen, indem Sie 1x phosphatgepufferte Kochsalzlösung (PBS) (0,01 M) mit Hilfe einer Pipette in den Kulturkolben geben.
- Mit Hilfe einer Pipette 3 mL 1x Trypsin-0,5 mM EDTA (0,05 % [v/v]) in die Kulturkolben geben und 3 min bei 28 °C inkubieren, um die Zellen aus dem Kolben zu lösen.
- Klopfen Sie vorsichtig auf den Kolben, um die Zellen freizusetzen, und stoppen Sie dann den Trypsinaufschluss, indem Sie 3 ml des vollständigen Nährmediums in den Kolben geben.
- Die Zellsuspension wird mit einer Pipette in ein konisches 15-ml-Zentrifugenröhrchen überführt und 5 Minuten lang bei 100 × g zentrifugiert.
- Nach der Pelletbildung den Überstand vorsichtig entfernen, 1 ml des kompletten Mediums für die jeweils verwendete Zelllinie (ZFL oder ZEM2S) zugeben und mit einer Mikropipette resuspendieren. Nehmen Sie ein Aliquot für die Zellzählung.
2. Zellzählung mit Trypanblau-Farbstoff-Ausschlusstest
- Geben Sie 10 μl der Zellsuspension und 10 μl Trypanblau-Farbstoff in ein Mikroröhrchen, um die Zellen zu zählen und ihre Lebensfähigkeit zu bewerten. Mischen Sie die Zellsuspension und den Farbstoff mit einer Pipette.
- Übertragen Sie dann 10 μL dieser Mischung (Zellsuspension + Trypanblau) in eine Neubauer-Kammer und zählen Sie die Zellen in den vier großen Quadraten (Quadranten: Q), die an den Ecken der Kammer platziert sind, wobei Zellen, die kein Trypanblau aufnehmen, als lebensfähig betrachtet werden. Berechnen Sie die Anzahl der lebensfähigen Zellen mit Gleichung (1):
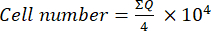 (1)
(1) - Um die endgültige Zellzahl in der Zellsuspension zu berechnen, multiplizieren Sie die mit Gleichung (1) ermittelte Zellzahl mit 2 (der Verdünnungsfaktor aufgrund der Verwendung von Trypanblau).
HINWEIS: Alternativ kann ein automatisiertes Zellzählsystem verwendet werden.
3. Zellbeschichtung in ULA-Platten
- Nachdem Sie die Zellzahl berechnet haben, stellen Sie die Zellsuspension auf die Platte 200 μL dieser Suspension pro Vertiefung einer 96-Well-ULA-Platte mit rundem Boden mit der Anzahl der Zellen ein, die für jede Zelllinie erforderlich ist, wie unten angegeben:
- Platte 7.000 brauchbare ZFL-Zellen /Bohrung; Verwenden Sie daher für die gesamte ULA-Platte 700.000 Zellen in 20 ml vollständigem Medium.
- Platte 3.500 lebensfähige ZEM2S-Zellen /Well; Verwenden Sie daher für die gesamte ULA-Platte 350.000 Zellen in 20 ml vollständigem Medium.
- Bereiten Sie die Zellsuspension mit der eingestellten Zellkonzentration in einem Mediumreservoir vor und mischen Sie sie mit einer Mehrkanal-Mikropipette, wobei darauf zu achten ist, dass sich kein Schaum oder Blasen bilden. Geben Sie mit der Mehrkanal-Mikropipette 200 μL der eingestellten Zellsuspension in jede Vertiefung der ULA-Platte.
Anmerkungen: Die Platte muss mit Parafilm oder selbstklebender Siegelfolie versiegelt werden, um eine Verdunstung des Nährmediums von der 96-Well-Platte zu vermeiden.
4. Sphäroidbildung
- Die ULA-Platte wird auf einem Orbitalschüttler bei 70 U/min für 5 Tage in einem 28 °C Inkubator inkubiert. Lassen Sie die Sphäroide über 5 Tage Orbitalschütteln entstehen (Abbildung 2) und erreichen Sie eine durchschnittliche Größe von ~225 μm Durchmesser (ZFL-Sphäroide) und ~226 μm Durchmesser (ZEM2S-Sphäroide)12.
HINWEIS: Nach 5 Tagen Inkubation (maximale Zirkularität) sind die Sphäroide gebrauchsfertig. - Um die Sphäroide länger als 5 Tage in Kultur zu halten, entfernen Sie alle 5 Tage 100 μl des verbrauchten Mediums und fügen Sie 100 μl frisches komplettes Nährmedium mit einer Mehrkanal-Mikropipette hinzu.
Anmerkungen: Achten Sie darauf, die Sphäroide während dieses Vorgangs nicht anzusaugen.
5. Messung der Größe (Durchmesser) und Form (Zirkularitätsindex) von Sphäroiden
- Erfassen Sie die Bilder.
- Unter einem Inverslichtmikroskop mit einem bildgebenden Erfassungssystem erhalten Sie ein Bild in einem definierten Maßstab.
HINWEIS: Verwenden Sie einen Mikroskoptisch-Kalibrierobjektträger oder einen Neubauer-Objektträger (bei dem die Quadrantengrößen bekannt sind), um die Skala zu erhalten. - Unter dem Mikroskop und mit der gleichen Objektivlinse, mit der das Bild der Skala aufgenommen wurde, erhalten Sie Bilder der vollständig ausgebildeten Sphäroide (d. h. 5 Tage alte Sphäroide).
HINWEIS: Alle Bilder müssen mit demselben Imaging-Erfassungssystem aufgenommen werden, da die Bildauflösung wichtig ist, um die Größe und Form der Sphäroide zu bestimmen, und sie kann sich je nach Systemtyp unterscheiden.
- Unter einem Inverslichtmikroskop mit einem bildgebenden Erfassungssystem erhalten Sie ein Bild in einem definierten Maßstab.
- Legen Sie die Skala fest.
- Öffnen Sie mit der ImageJ-Software das Bild des definierten Maßstabs (klicken Sie auf Datei | Öffnen).
- Wählen Sie den Geradenselektor aus der Symbolleiste aus und ziehen Sie mit der Maus eine Linie über die Verlängerung des definierten Maßstabs im Bild.
- Legen Sie den Maßstab fest, indem Sie Analysieren | Legen Sie die Skalierung fest und warten Sie, bis das Fenster " Skalierung festlegen" geöffnet wird.
- Füllen Sie im Fenster Skalierung festlegen das Leerzeichen von Bekannte Entfernung mit der bekannten Entfernung (μm), die der Geraden entspricht. Füllen Sie die Längeneinheit mit um für μm aus. Klicken Sie auf OK.
HINWEIS: Die Skalierung in Pixeln/μm wird am unteren Rand des Fensters angezeigt.
- Stellen Sie die Messparameter ein.
- Wählen Sie in der ImageJ-Software die Option Analysieren | Messungen festlegen, um das Fenster Messungen festlegen zu öffnen.
- Aktivieren Sie im Fenster Messungen festlegen die Kontrollkästchen für die gewünschten Messungen (d. h. Flächen- und Formdeskriptoren). Klicken Sie auf OK.
- Ermitteln Sie den Durchmesser und die Kreisförmigkeit der Sphäroide.
- Öffnen Sie das Bild eines Sphäroids (Menüpunkt Datei | Öffnen).
- Wählen Sie das Freihandauswahlwerkzeug in der Symbolleiste aus, und wählen Sie mit der Maus die Außenseite des Sphäroids aus, wie in Abbildung 3A dargestellt.
HINWEIS: Um das Bild zu vergrößern oder zu verkleinern, drücken Sie die Strg-Taste und scrollen Sie mit der Maus nach unten oder oben, oder drücken Sie die Strg-Taste und verwenden Sie die Aufwärts- oder Abwärtspfeiltasten auf der Tastatur. - Wählen Sie Analysieren | Messen , um das Ergebnisfenster zu öffnen, in dem die Messwerte angezeigt werden.
- Berechnen Sie mit dem Flächenwert die Größe (Durchmesser) der Sphäroide mit Gleichung (2):
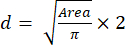 (2)
(2) - Der Zirkularitätsindex wird im Ergebnisfenster als "Circ." angegeben und von der Software automatisch mit Gleichung (3) berechnet:
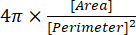 (3)
(3)
Anmerkungen: Der Zirkularitätsindex von 1,0 steht für eine perfekte Kugelform, während ein Wert nahe 0,0 für eine längliche Form13 steht.
Ergebnisse
Auf diese Weise werden einzelne Sphäroide pro Vertiefung mit stabiler Größe und Form gebildet. Abbildung 2 zeigt den Entstehungsprozess einzelner Sphäroide von ZFL- und ZEM2S-Zellen in einer Vertiefung einer ULA-Platte unter orbitalem Schütteln (70 rpm). Die ZFL- und ZEM2S-Zelllinien verhalten sich in der 3D-Kultur unterschiedlich. Die ZEM2S-Zelllinie weist Merkmale auf, die die Fähigkeit verleihen, seit dem ersten Tag des Orbitaschüttelns leicht eine kugelförmige Form zu bilden (Abb...
Diskussion
Dies ist eine einfache, leichte und schnelle Methode zur Erzeugung von Sphäroiden aus Leber- und Embryozelllinien von Zebrafischen. Diese Methode wurde von dieser Gruppe auf der Grundlage von Modifikationen bestehender 3D-Sphäroidmethoden entwickelt, um Probleme zu überwinden, die in wissenschaftlichen Studien im Zusammenhang mit der Sphäroidbildung berichtet wurden, sowie Unsicherheiten in der Datengenauigkeit von 3D-Sphäroid-Assays. Die berichteten Probleme liegen beispielsweise in Schwierigkeiten bei der Handhabu...
Offenlegungen
Die Autoren erklären, dass kein Interessenkonflikt besteht.
Danksagungen
In Gedenken an Dr. Márcio Lorencini, einen Mitautor dieser Arbeit, einen exzellenten Forscher auf dem Gebiet der Kosmetik, der sich der Förderung der kosmetischen Forschung in Brasilien verschrieben hat. Die Autoren danken dem Multi-User-Labor in der Abteilung für Physiologie (UFPR) für die Verfügbarkeit von Geräten und für die finanzielle Unterstützung der Koordination zur Verbesserung des Hochschulpersonals (CAPES, Brasilien) (Finance Code 001) und der Grupo Boticário.
Materialien
| Name | Company | Catalog Number | Comments |
| 96-well Clear Round Bottom Ultra-Low Attachment Microplate, Individually Wrapped, with Lid, Sterile | Corning | 7007 | |
| DMEM, powder, high glucose, pyruvate | Gibco | 12800-017 | |
| Ham's F-12 Nutrient Mix, powder | Gibco | 21700026 | |
| HEPES (1M) | Gibco | 15630080 | |
| Image Processing and analysis in Java (ImageJ) 1.52p software | National Institutes of Health, USA | Available at: https://imagej.nih.gov/ij/index.html | |
| Leibovitz's L-15 Medium, powder | Gibco | 41300021 | |
| Orbital shaker | Warmnest | KLD-350-BI | 22 mm rotation diameter |
| Dulbeccos PBS (10x) with calcium and magnesium | Invitrogen | 14080055 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140122 | |
| RPMI 1640 Medium | Gibco | 31800-014 | |
| FBS - Fetal Bovine Serum, qualified, USDA-approved regions | Gibco | 12657-029 | |
| Sodium bicarbonate, powder, bioreagent for molecular biology | Sigma-Aldrich | S5761 | |
| Trypan blue stain (0,4%) | Gibco | 15250-061 | |
| Trypsin-EDTA (0.5%), no phenol red | Gibco | 15400054 | |
| ZEM2S cell line | ATCC | CRL-2147 | This cell line was kindly donated by Professor Dr. Michael J. Carvan (University of Wisconsin, Milwaukee, USA) |
| ZFL cell line | BCRJ | 256 |
Referenzen
- Elje, E., et al. The comet assay applied to HepG2 liver spheroids. Mutation Research. Genetic Toxicology and Environmental Mutagenesis. 845, 403033 (2019).
- Kelm, J. M., Timmins, N. E., Brown, C. J., Fussenegger, M., Nielsen, N. K. Method for generation of homogeneous multicellular tumor spheroids applicable to a wide variety of cell types. Biotechnology and Bioengineering. 83 (2), 173-180 (2003).
- Baron, M. G., Purcell, W. M., Jackson, S. K., Owen, S. F., Jha, A. N. Towards a more representative in vitro method for fish ecotoxicology: morphological and biochemical characterisation of three-dimensional spheroidal hepatocytes. Ecotoxicology. 21 (8), 2419-2429 (2012).
- Alves, R. F., Rocha, E., Madureira, T. V. Fish hepatocyte spheroids - A powerful (though underexplored) alternative in vitro model to study hepatotoxicity. Comparative Biochemistry and Physiology. Toxicology & Pharmacology. 262, 109470 (2022).
- Baron, M. G., et al. Pharmaceutical metabolism in fish: using a 3-D hepatic in vitro model to assess clearance. PloS One. 12 (1), 0168837 (2017).
- Langan, L. M., et al. Spheroid size does not impact metabolism of the β-blocker propranolol in 3D intestinal fish model. Frontiers in Pharmacology. 9, 947 (2018).
- Lammel, T., Tsoukatou, G., Jellinek, J., Sturve, J. Development of three-dimensional (3D) spheroid cultures of the continuous rainbow trout liver cell line RTL-W1. Ecotoxicology and Environmental Safety. 167, 250-258 (2019).
- Jeong, Y., et al. Differential effects of CBZ-induced catalysis and cytochrome gene expression in three dimensional zebrafish liver cellculture. Journal of Environmental and Analytical Toxicology. 6, 2161 (2016).
- Foty, R. A simple hanging drop cell culture protocol for generation of 3D spheroids. Journal of Visualized Experiments. (51), e2720 (2011).
- Lee, W. G., Ortmann, D., Hancock, M. J., Bae, H., Khademhosseini, A. A hollow sphere soft lithography approach for long-term hanging drop methods. Tissue Engineering. Part C, Methods. 16 (2), 249-259 (2010).
- Timmins, N. E., Nielsen, L. K. Generation of multicellular tumor spheroids by the hanging-drop method. Methods in Molecular Medicine. 140, 141-151 (2007).
- de Souza, I. R., et al. Development of 3D cultures of zebrafish liver and embryo cell lines: a comparison of different spheroid formation methods. Ecotoxicology. 30 (9), 1893-1909 (2021).
- Ferreira, T., Rasband, W. ImageJ user guide. ImageJ/Fiji. 1, 151-161 (2012).
- Guidony, N. S., et al. ABC proteins activity and cytotoxicity in zebrafish hepatocytes exposed to triclosan. Environmental Pollution. 271, 116368 (2021).
- da Silva, N. D. G., et al. Interference of goethite in the effects of glyphosate and Roundup® on ZFL cell line. Toxicology In Vitro. 65, 104755 (2020).
- Yang, Y., et al. Temperature is a key factor influencing the invasion and proliferation of Toxoplasma gondii in fish cells. Experimental Parasitology. 217, 107966 (2020).
- Lopes, F. M., Sandrini, J. Z., Souza, M. M. Toxicity induced by glyphosate and glyphosate-based herbicides in the zebrafish hepatocyte cell line (ZF-L). Ecotoxicology and Environmental Safety. 162, 201-207 (2018).
- Lachner, D., Oliveira, L. F., Martinez, C. B. R. Effects of the water soluble fraction of gasoline on ZFL cell line: Cytotoxicity, genotoxicity and oxidative stress. Toxicology In Vitro. 30, 225-230 (2015).
- Morozesk, M., et al. Effects of multiwalled carbon nanotubes co-exposure with cadmium on zebrafish cell line: Metal uptake and accumulation, oxidative stress, genotoxicity and cell cycle. Ecotoxicology and Environmental Safety. 202, 110892 (2020).
- Dognani, G., et al. Nanofibrous membranes for low-concentration Cr VI adsorption: kinetic, thermodynamic and the influence on ZFL cells viability. Materials Research. , 24 (2021).
- ZEM2S (ATCC®CRL-2147™). American Type Culture Collection Available from: https://www.atcc.org/products/crl-2147 (2022)
- Bell, C. C., et al. Characterization of primary human hepatocyte spheroids as a model system for drug-induced liver injury, liver function and disease. Scientific Reports. 6, 25187 (2016).
- Gajski, G., et al. Genotoxic potential of selected cytostatic drugs in human and zebrafish cells. Environmental Science and Pollution Research International. 23 (15), 14739-14750 (2016).
- Meng, Q., Yeung, K., Chan, K. M. Toxic effects of octocrylene on zebrafish larvae and liver cell line (ZFL). Aquatic Toxicology. 236, 105843 (2021).
- Mueller-Klieser, W. Method for the determination of oxygen consumption rates and diffusion coefficients in multicellular spheroids. Biophysical Journal. 46 (3), 343-348 (1984).
- Glicklis, R., Merchuk, J. C., Cohen, S. Modeling mass transfer in hepatocyte spheroids via cell viability, spheroid size, and hepatocellular functions. Biotechnology and Bioengineering. 86 (6), 672-680 (2004).
- Ho, R. K., Kimmel, C. B. Commitment of cell fate in the early zebrafish embryo. Science. 261 (5117), 109-111 (1993).
- Biswas, S., Emond, M. R., Jontes, J. D. Protocadherin-19 and N-cadherin interact to control cell movements during anterior neurulation. The Journal of Cell Biology. 191 (5), 1029-1041 (2010).
- Bradford, C. S., Sun, L., Collodi, P., Barnes, D. W. Cell cultures from zebrafish embryos and adult tissues. Journal of Tissue Culture Methods. 16 (2), 99-107 (1994).
- He, S., et al. Genetic and transcriptome characterization of model zebrafish cell lines. Zebrafish. 3 (4), 441-453 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten