A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
عدوى الخلايا الظهارية الأنفية الأولية التي تنمو في واجهة الهواء السائل لتوصيف التفاعلات بين الإنسان والفيروس التاجي والمضيف
In This Article
Summary
ظهارة الأنف هي موقع الحاجز الأساسي الذي تواجهه جميع مسببات الأمراض التنفسية. هنا ، نوضح طرق استخدام الخلايا الظهارية الأنفية الأولية التي تزرع كمزارع واجهة الهواء السائل (ALI) لتوصيف التفاعلات بين الإنسان ومضيف فيروس كورونا في نظام ذي صلة من الناحية الفسيولوجية.
Abstract
ظهرت ثلاثة فيروسات تاجية بشرية شديدة الإمراض (HCoVs) - SARS-CoV (2002) و MERS-CoV (2012) و SARS-CoV-2 (2019) - وتسببت في أزمات صحية عامة كبيرة في السنوات العشرين الماضية. تسبب أربعة فيروسات HCoVs إضافية جزءا كبيرا من حالات نزلات البرد الشائعة كل عام (HCoV-NL63 و -229E و -OC43 و -HKU1) ، مما يسلط الضوء على أهمية دراسة هذه الفيروسات في الأنظمة ذات الصلة من الناحية الفسيولوجية. تدخل HCoVs إلى الجهاز التنفسي وتثبت العدوى في ظهارة الأنف ، وهو الموقع الأساسي الذي تواجهه جميع مسببات الأمراض التنفسية. نحن نستخدم نظام الثقافة الظهارية الأنفية الأولية التي تزرع فيها عينات الأنف المشتقة من المريض في واجهة الهواء والسائل (ALI) لدراسة التفاعلات بين المضيف والممرض في هذا الموقع الحارس المهم. تلخص هذه الثقافات العديد من ميزات مجرى الهواء في الجسم الحي ، بما في ذلك أنواع الخلايا الموجودة ، والوظيفة الهدبية ، وإنتاج المخاط. نصف طرقا لتوصيف التكاثر الفيروسي ، وانتحاء الخلية المضيفة ، والسمية الخلوية التي يسببها الفيروس ، والحث المناعي الفطري في مزارع ALI الأنفية بعد عدوى HCoV ، باستخدام العمل الأخير الذي يقارن بين HCoVs المميت والموسمي كمثال1. إن الفهم المتزايد للتفاعلات بين المضيف والممرض في الأنف لديه القدرة على توفير أهداف جديدة للعلاجات المضادة للفيروسات ضد HCoVs وفيروسات الجهاز التنفسي الأخرى التي من المحتمل أن تظهر في المستقبل.
Introduction
تم تحديد سبعة فيروسات تاجية بشرية (HCoVs) حتى الآن وتسبب مجموعة من أمراض الجهاز التنفسي2. عادة ما ترتبط HCoVs الشائعة أو الموسمية (HCoV-NL63 و -229E و -OC43 و -HKU1) بأمراض الجهاز التنفسي العلوي وتسبب ما يقدر بنحو 10٪ -30٪ من حالات نزلات البرد سنويا. على الرغم من أن هذا هو النمط الظاهري السريري النموذجي المرتبط ب HCoVs الشائعة ، إلا أن هذه الفيروسات يمكن أن تسبب مرضا أكثر أهمية في الجهاز التنفسي السفلي لدى السكان المعرضين للخطر ، بما في ذلك الأطفال وكبار السن والأفراد الذين يعانون من نقص المناعة 3,4. ظهرت ثلاثة من فيروسات فيروس كورونا الممرض وتسببت في حالات طوارئ صحية عمومية كبيرة في السنوات ال 20 الماضية، بما في ذلك المتلازمة التنفسية الحادة الوخيمة (سارس)، ومتلازمة الشرق الأوسط التنفسية (MERS)-CoV، وSARS-CoV-2. وترتبط فيروسات فيروس كورونا المفتاكة بأمراض الجهاز التنفسي الأكثر وخامة والتي يتضح بوضوح من معدل إماتة الحالات >34٪ المرتبط بحالات الإصابة بفيروس كورونا المسبب لمتلازمة الشرق الأوسط التنفسية (894 حالة وفاة من أكثر من 2500 حالة منذ ظهوره في عام 2012)5,6. من المهم ملاحظة أن فيروس التهاب الكبد الوبائي القاتل يسبب أيضا مجموعة من أمراض الجهاز التنفسي ، من الالتهابات عديمة الأعراض إلى الالتهاب الرئوي القاتل ، كما رأينا مع جائحة COVID-19 المستمرة7.
HCoVs ، مثل مسببات الأمراض التنفسية الأخرى ، تدخل الجهاز التنفسي وتؤسس عدوى منتجة في ظهارة الأنف8. يعتقد أن الانتشار إلى مجرى الهواء السفلي يرتبط بالشفط من تجويف الفم / الأنف إلى الرئة ، حيث تسبب HCoVs أمراضا أكثر أهمية في الجهاز التنفسي السفلي9،10،11. وبالتالي ، فإن الأنف بمثابة البوابة الأولية للدخول الفيروسي وهو الحاجز الأساسي للعدوى من خلال آلية إزالة الغشاء المخاطي الهدبي القوية وآليات المناعة الفطرية الفريدة التي تهدف إلى منع المزيد من انتشار الفيروس إلى مجرى الهواء السفلي12,13. على سبيل المثال ، تم الإبلاغ عن أن الخلايا الظهارية الأنفية تعبر عن مستويات قاعدية أعلى من المتوسط من الإنترفيرون المضاد للفيروسات والجينات المحفزة بالإنترفيرون ، مما يشير إلى أن الخلايا الأنفية قد تكون مهيأة للاستجابات المبكرة لفيروسات الجهاز التنفسي14،15،16.
لقد استخدمنا سابقا الخلايا الظهارية الأنفية الأولية المشتقة من المريض والتي نمت في واجهة الهواء السائل (ALI) لنمذجة تفاعلات مضيف HCoV في الأنف ، حيث تبدأ عدوى HCoV. تتساهل مزارع ALI الأنفية مع كل من مسببات الأمراض (SARS-CoV-2 و MERS-CoV) و HCoVs الشائعة (HCoV-NL63 و HCoV-229E) وتوفر مزايا مختلفة على خطوط الخلايا الظهارية في مجرى الهواء التقليدي مثل A549 (خط خلايا سرطان الرئة الغدي)16,17. بعد التمايز ، تحتوي مزارع ALI الأنفية على مجموعة خلوية غير متجانسة وتظهر العديد من الوظائف المتوقعة من ظهارة الأنف في الجسم الحي ، مثل آلية إزالة الغشاء المخاطيالهدبي 18. توفر الخلايا الأنفية أيضا مزايا على أنظمة زراعة مجرى الهواء السفلي (مثل الخلايا الظهارية للشعب الهوائية البشرية ، HBECs) ، حيث أن اكتساب الخلايا الظهارية الأنفية عن طريق تنظيف الخلايا بالفرشاة الخلوية أقل توغلا بشكل ملحوظ مقارنة باستخدام تقنيات مثل تنظير القصبات لتحقيق HBECs19،20،21.
تصف هذه الورقة طرق استخدام نظام زراعة ALI الأنفي هذا لتوصيف تفاعلات مضيف HCoV في ظهارة الأنف. لقد طبقنا هذه الأساليب في الأعمال المنشورة مؤخرا لمقارنة SARS-CoV-2 و MERS-CoV و HCoV-NL63 و HCoV-229E1،16،17. على الرغم من أن هذه الطرق والنتائج التمثيلية تؤكد على دراسة HCoVs في نموذج الخلايا الأنفية هذا ، إلا أن النظام قابل للتكيف بشكل كبير مع HCoVs الأخرى ، بالإضافة إلى مسببات الأمراض التنفسية الأخرى. علاوة على ذلك ، يمكن تطبيق هذه الطرق على نطاق أوسع على أنظمة زراعة ALI الأخرى من أجل التحقيق في التكاثر الفيروسي والانتحاء الخلوي ، وكذلك السمية الخلوية والحث المناعي الفطري بعد العدوى.
Protocol
تمت الموافقة على استخدام عينات الأنف من قبل مجلس المراجعة المؤسسية بجامعة بنسلفانيا (البروتوكول # 800614) ومجلس المراجعة المؤسسية في فيلادلفيا فيرجينيا (البروتوكول # 00781).
1. عدوى مزارع ALI الأنفية
ملاحظة: الحصول على العينات السريرية ، وكذلك نمو وتمايز مزارع ALI الأنفية ، خارج نطاق هذه الورقة. يمكن العثور على طرق محددة لزراعة الخلايا الظهارية الأنفية الأولية في الأعمال المنشورة مؤخرا باستخدام هذه الثقافات18،22،23. يمكن أيضا تطبيق البروتوكولات أدناه على مزارع ALI الظهارية الأنفية المتاحة تجاريا إذا رغبت في ذلك. تنطبق البروتوكولات والأحجام المفصلة أدناه على إدخالات البئر ذات 24 بئرا (قطر 6.5 مم ، مساحة سطح غشاء 0.33 سم2). في حالة استخدام مزارع ALI المزروعة على آبار نقل أكبر (أي ألواح 12 بئرا ، قطر 12 مم ، مساحة سطح 1.12 سم2) ، اضبط الأحجام بشكل متناسب لتعكس حجم البئر.
- قبل يوم من الإصابة:
- اغسل مزارع ALI 3x بمحلول ملحي مخزن بالفوسفات (PBS) قميا (أضف ~ 200 ميكرولتر من PBS الدافئ ، ضعه في حاضنة 37 درجة مئوية لمدة 5 دقائق ، انضح PBS ، وكرر).
- استبدل الوسط القاعدي (500 ميكرولتر).
- اسمح للمزارع بالتوازن عند درجة الحرارة التي سيتم فيها إجراء العدوى بين عشية وضحاها (على سبيل المثال ، إذا كانت العدوى عند 33 درجة مئوية ، ضع الثقافات في حاضنة 33 درجة مئوية بعد غسل برنامج تلفزيوني).
ملاحظة: تم الإبلاغ عن أن HCoVs المرتبطة بنزلات البرد مثل HCoV-229E و HCoV-NL63 تتكاثر بشكل أكثر كفاءة عند 33 درجة مئوية. بالإضافة إلى ذلك ، تبلغ درجة حرارة ظهارة الأنف في الجسم الحي 33 درجة مئوية (وهذا يختلف عن درجة حرارة الرئة ، وهي 37 درجة مئوية).
- قم بتخفيف الفيروس حسب الحاجة في وسط النسر المعدل (DMEM) الخالي من المصل من Dulbecco لتحقيق التعدد المطلوب للعدوى (MOI) في حجم لقاح إجمالي يبلغ 50 ميكرولتر.
ملاحظة: عادة ما يتم إجراء العدوى في MOI = 5 (ارتفاع MOI) ؛ ومع ذلك ، فقد تم أيضا استخدام العدوى في MOI = 0.5 (MOI منخفض) ل SARS-CoV-2 و HCoVs الشائعة المرتبطة بالبرد ، وينتج عن ذلك ذروة عيار فيروسي قابلة للمقارنة ، ولكن مع حركية متغيرة (إما MOI مقبول). - أضف اللقاح قميا ، وضع الثقافات مرة أخرى في الحاضنة لمدة 1 ساعة.
- ألواح الصخور برفق كل 15 دقيقة أثناء العدوى (أمسك الصفيحة بإحكام في كلتا اليدين ، والصخور للأمام والخلف ومن جانب إلى آخر لضمان امتصاص موحد لللقاح الفيروسي).
- بعد 1 ساعة من الحضانة ، نضح اللقاح الفيروسي ، واغسل كل مزرعة مصابة 3x باستخدام برنامج تلفزيوني لضمان إزالة اللقاح الفيروسي (لكل غسلة ، أضف 200 ميكرولتر من برنامج تلفزيوني ، واحتضان لمدة 5 دقائق ، ونضح أو إزالة باستخدام ماصة).
- إذا رغبت في ذلك ، اجمع غسل PBS الثالث لتأكيد الإزالة الكافية لفيروس الإدخال.
- استبدل الوسط القاعدي بوسط جديد على ALIs المصابة كل 72 ساعة أثناء الإصابة.
2. جمع سائل السطح القمي (ASL) ومعايرة فيروس السقيفة
- في نقاط زمنية محددة مسبقا بعد الإصابة ، أضف 200 ميكرولتر من برنامج تلفزيوني إلى الغرفة القمية لكل بئر مصاب.
ملاحظة: تختلف النقاط الزمنية ذات الصلة اعتمادا على HCoV ذات الأهمية وتتراوح من 24 ساعة إلى 192 ساعة بعد الإصابة (انظر قسم النتائج التمثيلية للحصول على بيانات تكاثر الفيروس لمختلف HCoVs). - ماصة PBS صعودا وهبوطا 5x لضمان أقصى جمع للفيروس القمي ، وجمع الحجم بالكامل في أنبوب طرد مركزي دقيق (هذه هي عينة ASL).
ملاحظة: يتضمن ASL جزيئات فيروسية متساقطة بالإضافة إلى المخاط والمنتجات الأخرى التي تفرز قميا من مزارع ALI. - تحديد كمية الفيروس المعدي في ASL عن طريق مقايسة البلاك الفيروسي القياسية (العينات المحتوية على الفيروس المخففة بشكل متسلسل من أجل تحديد تركيز الجسيمات الفيروسية).
ملاحظة: تعتمد أنواع الخلايا وفترة الحضانة المستخدمة لفحص البلاك على الفيروس المستخدم: SARS-CoV-2 (خلايا VeroE6) ؛ فيروس كورونا المسبب لمتلازمة الشرق الأوسط التنفسية (خلايا VeroCCL81)؛ HCoV-NL63 (خلايا LLC-MK2) ؛ HCoV-229E (خلايا Huh7). التفاصيل حول كيفية إجراء فحوصات البلاك الفيروسي خارج نطاق هذه المخطوطة ولكن تم تفصيلها سابقا في منشور مجلة التجارب المرئية (JoVE)24. - إذا رغبت في ذلك ، اجمع الوسط القاعدي في أوقات مختلفة بعد الإصابة لتأكيد عدم وجود فيروس تم إطلاقه بشكل أساسي. عادة ما يتم إطلاق HCoVs قميا من الخلايا الظهارية الأنفية ، ولكن تأكد من ذلك عن طريق مقايسة البلاك للوسط القاعدي غير المخفف.
- قم بتخزين عينات ASL عند -80 درجة مئوية إذا لم يحدث القياس الكمي بواسطة مقايسة البلاك في يوم التجميع.
3. القياس الكمي للفيروس داخل الخلايا
- بعد جمع عينة ASL ، انقل كل عملية نقل إلى صفيحة نظيفة مكونة من 24 بئرا محملة مسبقا ب 500 ميكرولتر من DMEM تحتوي على 2٪ مصل بقري جنيني (FBS) بشكل أساسي.
ملاحظة: يستخدم DMEM مع 2٪ FBS لتثبيت الفيروس أثناء دورات التجميد والذوبان اللاحقة. - اغسل كل جهاز ترانسويل 3x قميا باستخدام برنامج تلفزيوني لضمان الإزالة الكاملة للفيروس القمي.
- بعد الشفط لإزالة غسول PBS النهائي ، أضف 100 ميكرولتر من DMEM مع 2٪ FBS إلى الحجرة القمية.
- انقل اللوحة التي تحتوي على آبار مع كل من الوسائط القمية والقاعدية إلى مجمد -80 درجة مئوية ، وأكمل ثلاث دورات تجميد وذوبان متتالية لتحلل الخلايا.
- بعد دورة التجميد والذوبان النهائية ، قم بتجميع الوسائط القمية (100 ميكرولتر) والقاعدية (500 ميكرولتر) في أنبوب نظيف.
- جهاز طرد مركزي عند 500 × جم لمدة 10 دقائق عند 4 درجات مئوية لحبيبات أي حطام خلوي.
- جمع طاف . هذه هي عينة الفيروس داخل الخلايا للمعايرة عبر مقايسة البلاك القياسية.
ملاحظة: يحدث تخفيف ثلاثي الأضعاف أثناء عملية التجميع بالنسبة إلى جمع ASL ؛ يتم جمع عينات ASL في 200 ميكرولتر من PBS ، بينما يتم جمع عينة الفيروس داخل الخلايا في حجم إجمالي قدره 600 ميكرولتر.
4. قياس المقاومة الكهربائية عبر الظهارة (TEER)
ملاحظة: لقياس TEER ، يجب استخدام PBS المكمل بالكالسيوم والمغنيسيوم (PBS + Ca2 + / Mg2+). يتم استخدام فولت / أوم ظهاري مضبوط للقراءة بالأوم (انظر جدول المواد).
- تنظيف أداة EVOM وتوازنها وإفراغها وفقا لتعليمات الشركة الصانعة ؛ استخدم ترانسويل "فارغ" بدون إضافة خلايا أنفية للطعن. سجل قياس TEER فارغا.
ملاحظة: في حالة استخدام فيروسات متعددة ، يجب تنظيف أداة EVOM بشكل صارم بين الظروف لتجنب التلوث المتبادل (الغسول بنسبة 70٪ من الإيثانول متبوعا بالماء منزوع الأيونات يكفي). - انقل كل عملية نقل مصابة إلى صفيحة نظيفة مسبقا من 24 بئرا مع 500 ميكرولتر من PBS + Ca2 + / Mg2+ بشكل أساسي لغسل الوسط القاعدي المتبقي من الآبار.
- أضف 200 ميكرولتر من PBS + Ca 2+ / Mg2+ إلى المقصورة القمية لكل ترانسويل.
- أضف 1 مل من PBS + Ca2 + / Mg2+ إلى غرفة قياس Endohm-6.
- انقل كل عملية نقل إلى غرفة القياس Endohm-6 ، واستبدل غطاء الغرفة بحيث يستقر القطب القمي في 200 ميكرولتر من PBS في المقصورة القمية ؛ القطب القاعدي مدمج في الجزء السفلي من غرفة Endohm-6.
- اسمح لقراءة EVOM بالاستقرار ، وسجل قياس TEER الخام.
- اجمع عينة ASL كما هو موضح أعلاه بعد أخذ قياس TEER إذا كان المعايرة مطلوبا (اجمع في 200 ميكرولتر من PBS + Ca 2+ / Mg2+ التي تمت إضافتها لقياس TEER).
ملاحظة: يمكن أن يؤدي جمع عينات ASL إلى حدوث تمزقات دقيقة في الحاجز الظهاري قد تربك قراءات TEER ، لذلك يجب جمع ASL بعد قياس TEER. علاوة على ذلك، يجب عدم تغيير الوسط القاعدي مباشرة قبل قراءات TEER لأن ذلك قد يؤثر أيضا على قيم TEER. - لتحويل قراءات TEER الخام إلى قياسات نهائية بالأوم / سم2 ، اطرح قيمة TEER الفارغة ، واضرب هذه القيمة في مساحة سطح غشاء البئر باستخدام المعادلة (1):
TEER = [قراءة TEER - قيمة TEER فارغة] × (مساحة سطح المرسل) (1) - بالنسبة ل HCoVs ، قم بتقييم TEER كل 24 ساعة أو 48 ساعة بعد الإصابة. غالبا ما تختلف حركية تغييرات TEER بين الفيروسات وتتطلب استكشاف الأخطاء وإصلاحها في نقاط زمنية مختلفة.
- عند قياس TEER ، قم دائما بتضمين الثقافات المصابة بالوهمية وتقييمها في كل نقطة زمنية (التحكم السلبي).
ملاحظة: بالنسبة للثقافات الوهمية، ينبغي أن تظل قياسات TEER مستقرة أو قد تزيد قليلا عن خط الأساس بعد اكتمال تمايز الثقافات. ستختلف مساحة سطح الدعامات الغشائية اعتمادا على حجم ومصنع الآبار ؛ عادة ما يكون ل 24 بئرا مساحة سطح 0.33 سم2.
5. قياس السمية الخلوية أثناء العدوى عن طريق مقايسة نازعة هيدروجين اللاكتات (LDH)
ملاحظة: في هذا العمل ، تم قياس محتوى LDH في عينات ASL باستخدام مجموعة الكشف عن السمية الخلوية المتاحة تجاريا. غالبا ما كانت إشارة LDH في الوسط القاعدي أقل من حد الكشف وغالبا ما تكون أقل قابلية للتكرار من LDH الكمي في عينات ASL من الثقافات المصابة بفيروس التهاب الكبد الوبائي.
- إعداد ضوابط إضافية ضرورية لفحص LDH.
- التحكم في الخلفية: استخدم PBS (استخدم PBS الذي يحتوي على الكالسيوم والمغنيسيوم إذا تم جمع عينات ASL بهذه الطريقة).
- التحكم الإيجابي (قيمة السقف): تعامل مع ALIs قميا باستخدام Triton X-100. اجمع آبار التحكم في Triton (عادة ما تستخدم ثلاث ثقافات ALI لهذا في كل نقطة زمنية).
- أضف 200 ميكرولتر من 2٪ Triton X-100 في PBS مباشرة إلى المقصورة القمية للنقل.
- احتضان لمدة 10-15 دقيقة للسماح للخلايا بالتحلل تماما.
- اجمع الحجم بالكامل كعينة سقف Triton.
- التحكم السلبي (انخفاض التحكم / إطلاق LDH الأساسي): جمع ASL من ثقافات ALI المصابة بوهمية المشتقة من نفس المتبرع مثل الثقافات المصابة.
- جمع التحكم السلبي وهمية ASL بعد إجراء جمع ASL أعلاه.
ملاحظة: يمكن استخدام نفس المرسلات لهذا التحكم السلبي لجميع النقاط الزمنية ، في حين أن عمليات النقل الجديدة ستكون ضرورية لكل نقطة زمنية لعنصر تحكم Triton.
- جمع التحكم السلبي وهمية ASL بعد إجراء جمع ASL أعلاه.
- للسماح بالقياس الكمي لفيروس السقيفة بالإضافة إلى قراءات LDH من كل عينة ASL ، قم بتحميل لوحة سوداء مسطحة القاع ذات 96 بئرا واضحة بصريا على النحو التالي:
- تمييع جميع العينات في PBS ، باستخدام 45 ميكرولتر من العينة و 55 ميكرولتر من PBS (الحجم الإجمالي 100 ميكرولتر).
- تعامل مع التحكم الإيجابي في Triton وعينات التحكم في الخلفية الوهمية بنفس الطريقة.
ملاحظة: يسمح هذا التخفيف بتحميل ثلاثي لكل عينة تجريبية (45 ميكرولتر × 3) وحجم ASL متبقي كاف للمعايرة عبر مقايسة البلاك. - قم بتحميل لوحة LDH في ثلاث نسخ: سقف Triton ، والتحكم في الخلفية الوهمية ، والتحكم في PBS ، والعينات التجريبية.
- تحضير خليط التفاعل كما هو موضح من قبل الشركة المصنعة (محلول صبغ + محفز).
- أضف 100 ميكرولتر من خليط التفاعل إلى كل بئر ، واحتضن اللوحة في درجة حرارة الغرفة لمدة 20 دقيقة محمية من الضوء.
- بعد 20 دقيقة ، قم بقياس الامتصاص عند 492 نانومتر.
- احسب النسبة المئوية للسمية الخلوية بالنسبة إلى قيمة سقف Triton باستخدام المعادلة (2).
السمية الخلوية (٪) (2)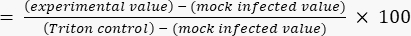
6. تحضير مزارع ALI الأنفية للتصوير المناعي (IF)
- انقل البئر إلى طبق جديد مكون من 24 بئرا ، واغسل 3 مرات قميا باستخدام PBS (اجمع أول غسل PBS ك ASL في حالة المعايرة ؛ بعد ذلك ، قم بإجراء غسلتين إضافيتين من PBS لإزالة فيروس التساقط الزائد الذي قد يعيق جودة IF)
- بعد غسل PBS النهائي ، قم بتغطية الترسويل قميا وأساسيا بنسبة 4٪ PFA.
- احتضان لمدة 30 دقيقة لإصلاح في 4 ٪ PFA ، ثم إزالة وغسل 3x مع PBS.
- قم باستئصال دعامة البئر التي تحتوي على الخلايا باستخدام شفرة حلاقة حادة أو مقص.
- لزيادة عدد أهداف IF لكل ترانسويل ، قم بقطع كل غشاء إلى النصف ، وقم بتلطيخ كل نصف بمجموعات مختلفة من الأجسام المضادة.
- تتخلل مع 0.2٪ Triton X-100 في PBS لمدة 10 دقائق.
- يوضع بمصل حمار عادي 10٪ و 1٪ BSA في PBST (PBS + 0.2٪ Triton X-100) لمدة 60 دقيقة في درجة حرارة الغرفة.
ملاحظة: احم العينات من التعرض للضوء من هذه الخطوة للأمام. - احتضان في محلول الأجسام المضادة الأولية طوال الليل عند 4 درجات مئوية. تمييع جميع الأجسام المضادة 1: 1,000 في منع العازلة.
ملاحظة: الأجسام المضادة التمثيلية لتلطيخ النيوكليوكابسيد HCoV ، وكذلك علامات نوع الخلية الظهارية والبقع الهيكلية الخلوية ، مذكورة أدناه (انظر جدول المواد للحصول على معلومات الشركة المصنعة وأرقام الكتالوج).- لتلطيخ مستضد HCoV ، استخدم الأجسام المضادة التي تستهدف النيوكليوكابسيد SARS-CoV-2 ، والنيوكليوكابسيد MERS-CoV ، و HCoV-NL63 nucleocapsid.
- لتحديد أنواع الخلايا الظهارية ، استخدم الأجسام المضادة التي تستهدف علامة الخلايا الكأسية MUC5AC وعلامة الخلية الهدبية من النوع الرابع β-توبولين.
- بالنسبة للعلامات الهيكلية الخلوية ، استخدم الأجسام المضادة الموجهة ضد phalloidin (يربط F-actin) وعلامة التصاق الخلايا الظهارية: EpCAM (CD326).
- احتضان في محلول الأجسام المضادة الثانوية لمدة 60 دقيقة في درجة حرارة الغرفة ؛ استخدم أصباغ الأجسام المضادة الثانوية المخففة بنسبة 1: 1000 في منع المخزن المؤقت.
- بعد اكتمال التلوين ، انقل الغشاء إلى شريحة زجاجية باستخدام ملعقة ، وقم بتوجيه البئر مع الجانب القمي نحو الشريحة ، وأضف محلول التثبيت. اتركيه لمدة 15-30 دقيقة قبل وضع طلاء الأظافر الشفاف حول الحواف.
- التقط الصور باستخدام مجهر متحد البؤر (خطوة المحور Z: 0.5 ميكرومتر ؛ المسح المتسلسل)1،16،17.
ملاحظة: بعد تثبيت الثقافات في 4٪ PFA والغسيل باستخدام PBS ، يمكن تخزين الثقافات الثابتة عند 4 درجات مئوية لأسابيع إلى أشهر قبل تلطيخها والتحضير للتصوير. بعد تلطيخ وتركيب الأغشية ، يمكن تخزين العينات على المدى الطويل (>2 سنوات) عند 4 درجات مئوية في الظلام.
7. جمع البروتين داخل الخلايا للنشاف المناعي الغربي أو الحمض النووي الريبي لتحليل RT-qPCR
- اجمع ASL كما هو موضح أعلاه في حالة تحديد كمية التتر الفيروسي (قسم البروتوكول 2).
- انقل البئر إلى لوحة نظيفة من 24 بئرا ، لأن كشط الغشاء يمكن أن يؤدي إلى كسر الإدخال.
- لتحليل اللطخة الغربية ، اجمع محللات البروتين الكلية في 125 ميكرولتر من محلول RIPA (50 mM Tris ، pH 8 ، 150 mM NaCl ، 0.5٪ deoxycholate ، 0.1٪ SDS ، 1٪ NP40) مع مثبطات الأنزيم البروتيني ومثبطات الفوسفاتاز.
- أضف 125 ميكرولتر من محلول RIPA إلى الحجرة القمية ، واحتضانها لمدة 5-10 دقائق.
- اكشط الغشاء باستخدام طرف ماصة P200 لإزالة أي خلايا متصلة متبقية ، وجمع الحجم بالكامل (اكشط بقوة عبر سطح الغشاء بالكامل ، ثم ماصة لأعلى ولأسفل عدة مرات لجمع العينة بأكملها).
- احتضان عينات تحلل البروتين على الثلج لمدة 10 دقائق ، ثم الطرد المركزي بأقصى سرعة (20000 × جم) لمدة 10 دقائق عند 4 درجات مئوية.
- امزج المادة الطافية مع 4x Laemmli عينة عازلة مع β-mercaptoethanol (عامل اختزال) وفقا لبروتوكولات الشركة المصنعة.
- اغلي عينات البروتين على حرارة 95 درجة مئوية لمدة 5 دقائق ، ثم اركضها باستخدام بروتوكولات النشاف الغربية التقليدية1،16،17.
- لجمع إجمالي الحمض النووي الريبي ، استخدم مجموعة استخراج الحمض النووي الريبي المتاحة تجاريا من اختيارك.
ملاحظة: المقصورة القمية لإدخالات 24 بئرا لها حجم أقصى ~ 200 ميكرولتر ؛ وبالتالي ، نقوم بإجراء غسلتين متتاليتين على كل ثقافة للوصول إلى إجمالي الحجم الموصى به. تتوافق التفاصيل أدناه مع المجموعة الموصى بها من عينات الحمض النووي الريبي بحجم إجمالي 350 ميكرولتر. - أضف 200 ميكرولتر من محلول التحلل إلى المقصورة القمية للبئر المصاب.
- اتركه لمدة 5-10 دقائق ، وكشط أي خلايا متبقية من الغشاء باستخدام طرف ماصة ، واجمع الحجم بالكامل في أنبوب طرد مركزي مسمى.
- أضف 150 ميكرولتر من محلول التحلل الإضافي إلى الحجرة القمية للبئر ، والماصة لأعلى ولأسفل قبل التجميع في نفس أنبوب الطرد المركزي الدقيق.
- استخراج الحمض النووي الريبي وفقا لبروتوكول الشركة المصنعة.
النتائج
الأرقام التمثيلية مقتبسة جزئيا من البيانات التي يمكن العثور عليها في المخطوطة Otter et al.1. أصيبت مزارع ALI الأنفية المشتقة من أربعة أو ستة متبرعين بواحد من أربعة HCoVs (SARS-CoV-2 و MERS-CoV و HCoV-NL63 و HCoV-229E) وفقا للبروتوكولات الموضحة أعلاه ، ويصور الشكل 1 أ متوسط التتر الفيروسي ?...
Discussion
تصف الطرق المفصلة هنا نظام الثقافة الظهارية الأولية التي تزرع فيها الخلايا الظهارية الأنفية المشتقة من المريض في واجهة الهواء السائل وتطبيقها على دراسة تفاعلات HCoV-host. بمجرد التمايز ، تلخص ثقافات ALI الأنفية هذه العديد من ميزات ظهارة الأنف في الجسم الحي ، بما في ذلك مجموعة خلوية غير مت?...
Disclosures
سوزان فايس عضو في المجالس الاستشارية العلمية لشركة Ocugen. يعمل نعوم كوهين مستشارا لشركة جلاكسو سميث كلاين وأسترازينيكا ونوفارتيس وسانوفي / ريجيرون وأويستر بوينت للأدوية، ولديه براءة اختراع أمريكية، "العلاج والتشخيص لعدوى الجهاز التنفسي" (10,881,698 B2، WO20913112865)، واتفاقية ترخيص مع GeneOne Life Sciences.
Acknowledgements
تحتوي هذه الدراسة على مصادر التمويل التالية: المعاهد الوطنية للصحة (NIH) R01AI 169537 (S.R.W. و N.A.C.) ، NIH R01AI 140442 (SRW) ، VA Merit Review CX001717 (N.A.C.) ، VA Merit Review BX005432 (S.R.W. و N.A.C.) ، مركز بن لأبحاث الفيروسات التاجية ومسببات الأمراض الناشئة الأخرى (SRW) ، مؤسسة Laffey-McHugh (SRW و N.A.C.) ، T32 AI055400 (CJO) ، T32 AI007324 (AF).
Materials
| Name | Company | Catalog Number | Comments |
| Alexa Fluor secondary antibodies (488, 594, 647) | Invitrogen | Various | |
| BSA (bovine serum albumin) | Sigma-Aldrich | A7906 | |
| cOmplete mini EDTA-free protease inhibitor | Roche | 11836170001 | |
| Cytotoxicity detection kit | Roche | 11644793001 | |
| DMEM (Dulbecco's Modified Eagle Media) | Gibco | 11965-084 | |
| DPBS (Dulbecco's Phosphate Buffered Saline) | Gibco | 14190136 | |
| DPBS + calcium + magnesium | Gibco | 14040-117 | |
| Endohm-6G measurement chamber | World Precision Instruments | ENDOHM-6G | |
| Epithelial cell adhesion marker (EpCAM; CD326) | eBiosciences | 14-9326-82 | |
| Epithelial Volt/Ohm (TEER) Meter (EVOM) | World Precision Instruments | 300523 | |
| FBS (Fetal Bovine Serum) | HyClone | SH30071.03 | |
| FV10-ASW software for imaging | Olympus | Version 4.02 | |
| HCoV-NL63 (Human coronavirus, NL63) | BEI Resources | NR-470 | |
| HCoV-NL63 nucleocapsid antibody | Sino Biological | 40641-V07E | |
| Hoescht stain | Thermo Fisher | H3570 | |
| Laemmli sample buffer (4x) | BIO-RAD | 1610747 | |
| LLC-MK2 cells | ATCC | CCL-7 | To titrate HCoV-NL63 |
| MERS-CoV (Human coronavirus, Middle East Respiratory Syndrome Coronavirus (MERS-CoV), EMC/2012) | BEI Resources | NR-44260 | |
| MERS-CoV nucleocapsid antibody | Sino Biological | 40068-MM10 | |
| MUC5AC antibody | Sigma-Aldrich | AMAB91539 | |
| Olympus Fluoview confocal microscope | Olympus | FV1000 | |
| Phalloidin-iFluor 647 stain | Abcam | ab176759 | |
| PhosStop easy pack (phosphatase inhibitors) | Roche | PHOSS-RO | |
| Plate reader | Perkin Elmer | HH34000000 | Any plate reader or ELISA reader is sufficient; must be able to read absorbance at 492 nm |
| RIPA buffer (50 mM Tris pH 8; 150 mM NaCl; 0.5% deoxycholate; 0.1% SDS; 1% NP40) | Thermo Fisher | 89990 | Can prep in-house or purchase |
| RNeasy Plus Kit | Qiagen | 74134 | |
| SARS-CoV-2 (SARS-Related Coronavirus 2, Isolate USA-WA1/2020) | BEI Resources | NR-52281 | |
| SARS-CoV-2 nucleocapsid antibody | Genetex | GTX135357 | |
| Triton-X 100 | Fisher Scientific | BP151100 | |
| Type IV β- tubulin antibody | Abcam | ab11315 | |
| VeroCCL81 cells | ATCC | CCL-81 | To titrate MERS-CoV |
| VeroE6 cells | ATCC | CRL-1586 | To titrate SARS-CoV-2 |
References
- Otter, C. J., et al. Infection of primary nasal epithelial cells differentiates among lethal and seasonal human coronaviruses. Proceedings of the National Academy of Sciences of the United States of America. 120 (15), 2218083120 (2023).
- Fehr, A., Perlman, S. Coronaviruses: An overview of their replication and pathogenesis. Methods in Molecular Biology. 1282, 1-23 (2015).
- Gaunt, E. R., Hardie, A., Claas, E. C. J., Simmonds, P., Templeton, K. E. Epidemiology and clinical presentations of the four human coronaviruses 229E, HKU1, NL63, and OC43 detected over 3 years using a novel multiplex real-time PCR method. Journal of Clinical Microbiology. 48 (8), 2940-2947 (2010).
- Kesheh, M. M., Hosseini, P., Soltani, S., Zandi, M. An overview on the seven pathogenic human coronaviruses. Reviews in Medical Virology. 32 (2), 2282 (2022).
- MERS-CoV Worldwide Overview. European Centre for Disease Prevention and Control Available from: https://www.ecdc.europa.eu/en/middle-east-respiratory-syndrome-coronavirus-mers-cov-situation-update (2022)
- Cao, Y., Liu, X., Xiong, L., Cai, K. Imaging and clinical features of patients with 2019 novel coronavirus SARS-CoV-2: A systematic review and meta-analysis. Journal of Medical Virology. 92 (9), 1449-1459 (2020).
- Vareille, M., Kieninger, E., Edwards, M. R., Regamey, N. The airway epithelium: Soldier in the fight against respiratory viruses. Clinical Microbiology Reviews. 24 (1), 210-229 (2011).
- Farzal, Z., et al. Comparative study of simulated nebulized and spray particle deposition in chronic rhinosinusitis patients. International Forum of Allergy and Rhinology. 9 (7), 746-758 (2019).
- Gaeckle, N. T., Pragman, A. A., Pendleton, K. M., Baldomero, A. K., Criner, G. J. The oral-lung axis: The impact of oral health on lung health. Respiratory Care. 65 (8), 1211-1220 (2020).
- Hou, Y., et al. SARS-CoV-2 reverse genetics reveals a variable infection gradient in the respiratory tract. Cell. 182, 429-446 (2020).
- Hariri, B. M., Cohen, N. A. New insights into upper airway innate immunity. American Journal of Rhinology and Allergy. 30 (5), 319-323 (2016).
- Hiemstra, P. S., McCray, P. B., Bals, R. The innate immune function of airway epithelial cells in inflammatory lung disease. European Respiratory Journal. 45 (4), 1150-1162 (2015).
- Hatton, C. F., et al. Delayed induction of type I and III interferons mediates nasal epithelial cell permissiveness to SARS-CoV-2. Nature Communications. 12 (1), 7092 (2021).
- Sungnak, W., et al. SARS-CoV-2 entry factors are highly expressed in nasal epithelial cells together with innate immune genes. Nature Medicine. 26 (5), 681-687 (2020).
- Li, Y., et al. SARS-CoV-2 induces double-stranded RNA-mediated innate immune responses in respiratory epithelial-derived cells and cardiomyocytes. Proceedings of the National Academy of Sciences of the United States of America. 118 (16), 2022643118 (2021).
- Comar, C. E., et al. MERS-CoV endoribonuclease and accessory proteins jointly evade host innate immunity during infection of lung and nasal epithelial cells. Proceedings of the National Academy of Sciences of the United States of America. 119 (21), 2123208119 (2022).
- Lee, R. J., et al. Bacterial D-amino acids suppress sinonasal innate immunity through sweet taste receptors in solitary chemosensory cells. Science Signaling. 10 (495), (2017).
- Brewington, J. J., et al. Brushed nasal epithelial cells are a surrogate for bronchial epithelial CFTR studies. JCI Insight. 3 (13), 99385 (2018).
- Comer, D. M., Elborn, J. S., Ennis, M. Comparison of nasal and bronchial epithelial cells obtained from patients with COPD. PLoS One. 7 (3), e32924 (2012).
- Vanders, R. L., Hsu, A., Gibson, P. G., Murphy, V. E., Wark, P. A. B. Nasal epithelial cells to assess in vitro immune responses to respiratory virus infection in pregnant women with asthma. Respiratory Research. 20 (1), 259 (2019).
- Lee, R. J., et al. Fungal aflatoxins reduce respiratory mucosal ciliary function. Scientific Reports. 6, 33221 (2016).
- Patel, N. N., et al. Fungal extracts stimulate solitary chemosensory cell expansion in noninvasive fungal rhinosinusitis. International Forum of Allergy and Rhinology. 9 (7), 730-737 (2019).
- Baer, A., Kehn-Hall, K. Viral concentration determination through plaque assays: Using traditional and novel overlay systems. Journal of Visualized Experiments. 93 (93), e52065 (2014).
- Robinot, R., et al. SARS-CoV-2 infection induces the dedifferentiation of multiciliated cells and impairs mucociliary clearance. Nature Communications. 12 (1), 4354 (2021).
- Whitsett, J. A. Airway epithelial differentiation and mucociliary clearance. Annals of the American Thoracic Society. 15, S143-S148 (2018).
- Gao, N., Raduka, A., Rezaee, F. Respiratory syncytial virus disrupts the airway epithelial barrier by decreasing cortactin and destabilizing F-actin. Journal of Cell Science. 135 (16), 259871 (2022).
- Schmidt, H., et al. IL-13 impairs tight junctions in airway epithelia. International Journal of Molecular Sciences. 20 (13), 3222 (2019).
- Huang, Z. Q., et al. Interleukin-13 alters tight junction proteins expression thereby compromising barrier function and dampens rhinovirus induced immune responses in nasal epithelium. Frontiers in Cell and Developmental Biology. 8, 572749 (2020).
- Saatian, B., et al. Interleukin-4 and interleukin-13 cause barrier dysfunction in human airway epithelial cells. Tissue Barriers. 1 (2), e24333 (2013).
- Coles, J. L., et al. A revised protocol for culture of airway epithelial cells as a diagnostic tool for primary ciliary dyskinesia. Journal of Clinical Medicine. 9 (11), 3753 (2020).
- Baldassi, D., Gabold, B., Merkel, O. M. Air−liquid interface cultures of the healthy and diseased human respiratory tract: Promises, challenges, and future directions. Advanced NanoBiomed Research. 1 (6), 2000111 (2021).
- Seibold, M. A. Interleukin-13 stimulation reveals the cellular and functional plasticity of the airway epithelium. Annals of the American Thoracic Society. 15, S98-S106 (2018).
- Morrison, C. B., et al. SARS-CoV-2 infection of airway cells causes intense viral and cell shedding, two spreading mechanisms affected by IL-13. Proceedings of the National Academy of Sciences of the United States of America. 119 (16), 2119680119 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved