A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
זיהום של תאי אפיתל אף ראשוניים הגדלים בממשק אוויר-נוזל כדי לאפיין אינטראקציות אנושיות בין נגיף הקורונה למארח
In This Article
Summary
אפיתל האף הוא אתר המחסום העיקרי בו נתקלים כל הפתוגנים הנשימתיים. במאמר זה אנו מתארים שיטות לשימוש בתאי אפיתל אף ראשוניים שגודלו כתרביות ממשק אוויר-נוזל (ALI) כדי לאפיין אינטראקציות אנושיות בין נגיף הקורונה למארח במערכת רלוונטית מבחינה פיזיולוגית.
Abstract
שלושה נגיפי קורונה אנושיים פתוגניים ביותר (HCoVs) - SARS-CoV (2002), MERS-CoV (2012) ו- SARS-CoV-2 (2019) - הופיעו וגרמו למשברים משמעותיים בבריאות הציבור ב -20 השנים האחרונות. ארבעה HCoVs נוספים גורמים לחלק משמעותי ממקרי הצטננות בכל שנה (HCoV-NL63, -229E, -OC43 ו-HKU1), מה שמדגיש את החשיבות של חקר הנגיפים האלה במערכות רלוונטיות מבחינה פיזיולוגית. HCoVs נכנסים לדרכי הנשימה ויוצרים זיהום באפיתל האף, האתר העיקרי בו נתקלים כל הפתוגנים הנשימתיים. אנו משתמשים במערכת תרבית אפיתל אף ראשונית שבה דגימות אף שמקורן במטופל גדלות בממשק אוויר-נוזל (ALI) כדי לחקור אינטראקציות מארח-פתוגן באתר זקיף חשוב זה. תרביות אלה משחזרות מאפיינים רבים של דרכי הנשימה in vivo , כולל סוגי התאים הנוכחיים, תפקוד ריסוני וייצור ריר. אנו מתארים שיטות לאפיון שכפול נגיפי, טרופיזם של תאים מארחים, ציטוטוקסיות הנגרמת על ידי וירוסים והשראת חיסון מולדת בתרביות ALI באף לאחר זיהום HCoV, תוך שימוש בעבודה שנערכה לאחרונה המשווה בין HCoVs קטלני ועונתי כדוגמה1. להבנה מוגברת של אינטראקציות מארח-פתוגן באף יש פוטנציאל לספק מטרות חדשות לטיפולים אנטי-ויראליים נגד HCoVs ונגיפים נשימתיים אחרים שסביר להניח שיופיעו בעתיד.
Introduction
שבעה נגיפי קורונה אנושיים (HCoVs) זוהו עד כה וגורמים למגוון מחלות נשימה2. HCoVs נפוצים או עונתיים (HCoV-NL63, -229E, -OC43 ו-HKU1) קשורים בדרך כלל לפתולוגיה של דרכי הנשימה העליונות וגורמים לכ-10%-30% ממקרי ההצטננות בשנה. למרות שזהו הפנוטיפ הקליני הטיפוסי הקשור ל- HCoVs הנפוץ, וירוסים אלה יכולים לגרום למחלות משמעותיות יותר בדרכי הנשימה התחתונות באוכלוסיות בסיכון, כולל ילדים, מבוגרים ואנשים מדוכאי חיסון 3,4. שלושה HCoVs פתוגניים הופיעו וגרמו למצבי חירום משמעותיים בתחום בריאות הציבור ב-20 השנים האחרונות, כולל תסמונת נשימה חריפה חמורה (SARS)-CoV, תסמונת הנשימה המזרח תיכונית (MERS)-CoV ו-SARS-CoV-2. HCoVs קטלניים קשורים לפתולוגיה חמורה יותר של דרכי הנשימה, אשר מודגמת בבירור על ידי שיעור התמותה של >34% הקשור למקרי MERS-CoV (894 מקרי מוות מיותר מ -2,500 מקרים מאז הופעתו בשנת 2012)5,6. חשוב לציין כי HCoVs קטלני גורם גם למגוון מחלות בדרכי הנשימה, החל מזיהומים אסימפטומטיים ועד דלקת ריאות קטלנית, כפי שניתן לראות עם מגיפת COVID-19 המתמשכת7.
HCoVs, כמו פתוגנים נשימתיים אחרים, נכנסים לדרכי הנשימה ויוצרים זיהום פרודוקטיבי באפיתל האף8. התפשטות לדרכי הנשימה התחתונות נחשבת קשורה לשאיפה מחלל הפה/אף לריאה, שם HCoVs גורם לפתולוגיה משמעותית יותר של דרכי הנשימה התחתונות 9,10,11. לפיכך, האף משמש כשער הראשוני לכניסה נגיפית והוא המחסום העיקרי לזיהום באמצעות מנגנון פינוי הליחה החזק שלו ומנגנוני החיסון המולדים הייחודיים שמטרתם למנוע התפשטות נגיפית נוספת לדרכי הנשימה התחתונות12,13. לדוגמה, תאי אפיתל האף דווחו כמבטאים רמות בסיסיות גבוהות מהממוצע של אינטרפרונים אנטי-ויראליים וגנים מעוררי אינטרפרון, דבר המצביע על כך שתאי האף עשויים להיות מוכנים לתגובות מוקדמות לנגיפים נשימתיים14,15,16.
בעבר השתמשנו בתאי אפיתל אף ראשוניים שמקורם במטופל שגודלו בממשק אוויר-נוזל (ALI) כדי למדל אינטראקציות HCoV-מארח באף, היכן שמתחילות זיהומי HCoV. תרביות ALI באף מתירניות הן לפתוגניות (SARS-CoV-2 ו-MERS-CoV) והן ל-HCoVs נפוצות (HCoV-NL63 ו-HCoV-229E) ומציעות יתרונות שונים על פני קווי תאי אפיתל מסורתיים של דרכי הנשימה כגון A549 (קו תאי אדנוקרצינומה של ריאות)16,17. לאחר ההתמיינות, תרביות ALI באף מכילות אוכלוסיית תאים הטרוגנית ומציגות רבים מהתפקודים המצופים מאפיתל האף in vivo, כגון מנגנון פינוי ליחה18. לתאי האף יש גם יתרונות על פני מערכות תרבית דרכי נשימה נמוכות יותר (כגון תאי אפיתל סימפונות אנושיים, HBECs), שכן רכישת תאי אפיתל באף באמצעות צחצוח ציטולוגי היא הרבה פחות פולשנית בהשוואה לשימוש בטכניקות כגון ברונכוסקופיה להשגת HBECs 19,20,21.
מאמר זה מתאר שיטות לשימוש במערכת תרבית אף זו כדי לאפיין אינטראקציות HCoV-מארח באפיתל האף. יישמנו שיטות אלה בעבודות שפורסמו לאחרונה כדי להשוות SARS-CoV-2, MERS-CoV, HCoV-NL63 ו- HCoV-229E 1,16,17. למרות ששיטות אלה ותוצאות מייצגות מדגישות את המחקר של HCoVs במודל תאי אף זה, המערכת ניתנת להתאמה גבוהה ל- HCoVs אחרים, כמו גם לפתוגנים נשימתיים אחרים. יתר על כן, שיטות אלה יכולות להיות מיושמות באופן רחב יותר במערכות תרבית אחרות של ALI על מנת לחקור שכפול נגיפי וטרופיזם תאי, כמו גם ציטוטוקסיות והשראת חיסון מולדת לאחר זיהום.
Protocol
השימוש בדגימות אף אושר על ידי מועצת הביקורת המוסדית של אוניברסיטת פנסילבניה (פרוטוקול # 800614) ומועצת הביקורת המוסדית של פילדלפיה VA (פרוטוקול # 00781).
1. זיהום של תרביות ALI באף
הערה: רכישת דגימות קליניות, כמו גם צמיחה והתמיינות של תרביות ALI באף, היא מחוץ לטווח של מאמר זה. שיטות ספציפיות לגידול תאי אפיתל ראשוניים באף ניתן למצוא בעבודות שפורסמו לאחרונה תוך שימוש בתרביות אלה 18,22,23. ניתן להחיל את הפרוטוקולים הבאים גם על תרביות אפיתל אפיתל אף זמינות מסחרית במידת הצורך. פרוטוקולים ונפחים המפורטים להלן חלים על תוספות טרנסוול צלחת 24 בארות (קוטר 6.5 מ"מ, 0.33 ס"משטח פנים של 2 ממברנה). אם אתה משתמש בתרביות ALI הגדלות על טרנסוולים גדולים יותר (כלומר, לוחות 12 בארות, קוטר 12 מ"מ, 1.12 ס"מ2 שטח פנים), התאם את הנפחים באופן יחסי כדי לשקף את גודל הטרנסוול.
- יום לפני ההדבקה:
- לשטוף תרביות ALI 3x עם מלוחים חוצצי פוספט (PBS) aply (להוסיף ~ 200 μL של PBS מחומם, מניחים באינקובטור 37 ° C למשך 5 דקות, שואפים PBS, וחוזרים).
- החלף מדיום בסיסי (500 μL).
- לאפשר לתרביות להתאזן בטמפרטורה שבה יתבצעו זיהומים במהלך הלילה (כלומר, אם מדביקים ב 33 מעלות צלזיוס, מקם את התרביות באינקובטור של 33 מעלות צלזיוס לאחר שטיפות PBS).
הערה: HCoVs הקשורים הצטננות כגון HCoV-229E ו- HCoV-NL63 מדווחים להשתכפל ביעילות רבה יותר ב 33 ° C. בנוסף, הטמפרטורה של אפיתל האף in vivo הוא 33 °C (75 °F) (זה שונה מהטמפרטורה של הריאה, שהיא 37 °C (77 °F).
- יש לדלל את הנגיף לפי הצורך במדיום הנשר המותאם (DMEM) של Dulbecco ללא סרום כדי להשיג את ריבוי הזיהום הרצוי (MOI) בנפח חיסון כולל של 50 μL.
הערה: זיהומים נערכו בדרך כלל ב MOI = 5 (MOI גבוה); עם זאת, זיהומים ב- MOI = 0.5 (MOI נמוך) שימשו גם עבור SARS-CoV-2 ו- HCoVs הקשורים להצטננות, ואלה גורמים לרמות שיא נגיפיות דומות, אך עם קינטיקה משתנה (או MOI מקובל). - מוסיפים את החיסון באופן אפי, ומחזירים את התרביות לחממה למשך שעה אחת.
- צלחות סלע בעדינות כל 15 דקות במהלך ההדבקה (מחזיק את הצלחת בחוזקה בשתי הידיים, מתנדנד קדימה ואחורה ומצד לצד כדי להבטיח ספיחה אחידה של החיסון הנגיפי).
- לאחר שעה של דגירה, יש לשאוף חיסון נגיפי, ולשטוף כל תרבית נגועה 3x עם PBS כדי להבטיח הסרה של חיסון ויראלי (עבור כל שטיפה, להוסיף 200 μL של PBS, לדגור במשך 5 דקות, ולשאוף או להסיר עם פיפטה).
- אם תרצה, אסוף את שטיפת PBS השלישית כדי לאשר הסרה נאותה של וירוס קלט.
- החלף את המדיום הבסיסי בתווך טרי על עלי נגוע כל 72 שעות במהלך ההדבקה.
2. איסוף נוזל משטח אפי (ASL) וטיטרציה של וירוס שפיכה
- בנקודות זמן קבועות מראש לאחר ההדבקה, יש להוסיף 200 μL של PBS לתא האפי של כל טרנסוול נגוע.
הערה: נקודות הזמן הרלוונטיות משתנות בהתאם ל- HCoV המעניין ונעות בין 24 שעות ל -192 שעות לאחר ההדבקה (עיין בסעיף התוצאות המייצגות לקבלת נתוני שכפול נגיפים עבור HCoVs שונים). - פיפטה PBS למעלה ולמטה 5x כדי להבטיח איסוף מקסימלי של וירוס apically לשפוך, ולאסוף נפח שלם לתוך צינור microcentrifuge (זוהי דגימת ASL).
הערה: ASL כולל חלקיקים נגיפיים שנשפכו בנוסף לליחה ומוצרים אחרים המופרשים באופן אפי מתרביות ALI. - כימות וירוס זיהומי ב- ASL באמצעות בדיקת רובד נגיפי סטנדרטי (דילול סדרתי של דגימות המכילות וירוסים על מנת לכמת את ריכוז החלקיקים הנגיפיים).
הערה: סוגי התאים ותקופת הדגירה המשמשים לבדיקת פלאק יהיו תלויים בנגיף המשמש: SARS-CoV-2 (תאי VeroE6); MERS-CoV (תאי VeroCCL81); HCoV-NL63 (תאי LLC-MK2); HCoV-229E (תאי Huh7). פרטים על אופן ביצוע בדיקות פלאק ויראלי הם מעבר לטווח של כתב יד זה, אך פורטו בעבר בפרסום Journal of Visualized Experiments (JoVE)24. - אם תרצה, לאסוף את המדיום הבסיסי בזמנים שונים לאחר ההדבקה כדי לאשר את היעדר וירוס משוחרר בסיסית. HCoVs משוחררים בדרך כלל באופן אפי מתאי אפיתל באף, אך מאשרים זאת באמצעות בדיקת פלאק של תווך בסיסי לא מדולל.
- אחסן דגימות ASL ב -80 ° C אם כימות על ידי בדיקת פלאק לא יתרחש ביום האיסוף.
3. כימות של וירוס תוך תאי
- לאחר איסוף דגימת ASL, העבר כל טרנסוול לצלחת נקייה של 24 בארות טעונה מראש עם 500 μL של DMEM המכיל 2% סרום בקר עוברי (FBS) בבסיס.
הערה: DMEM עם 2% FBS משמש לייצוב הנגיף במהלך מחזורי הקפאה-הפשרה הבאים. - יש לשטוף כל טרנסוול 3x aply עם PBS כדי להבטיח הסרה מלאה של וירוס apically shed.
- לאחר שאיפה להסיר את שטיפת PBS הסופית, להוסיף 100 μL של DMEM עם 2% FBS לתא apical .
- העבירו את הצלחת המכילה טרנסוולים עם מדיה אפית ובזאלית למקפיא בטמפרטורה של 80°C-, והשלימו שלושה מחזורי הקפאה-הפשרה רצופים כדי ללכוד את התאים.
- לאחר מחזור ההקפאה-הפשרה הסופי, אגרו את המדיה האפיקלית (100 μL) והבזאלית (500 μL) לתוך צינור נקי.
- צנטריפוגה ב 500 × גרם במשך 10 דקות ב 4 ° C כדי לזרוק כל פסולת תאית.
- לאסוף את supernatant. זוהי דגימת הנגיף התוך-תאי לטיטרציה באמצעות בדיקת פלאק סטנדרטית.
הערה: דילול משולש מתרחש בתהליך האיסוף ביחס לאיסוף ASL; דגימות ASL נאספות ב 200 μL של PBS, בעוד דגימת וירוס תוך תאי נאסף לתוך נפח כולל של 600 μL.
4. מדידת התנגדות חשמלית טרנסאפיתל (TEER)
הערה: למדידת TEER, יש להשתמש בתוסף PBS עם סידן ומגנזיום (PBS + Ca 2+/Mg2+). נעשה שימוש בוולט/אומטר אפיתל המוגדר לקריאה באוהם (ראה טבלת חומרים).
- לנקות, לאזן ולרוקן את מכשיר ה-EVOM בהתאם להוראות היצרן; השתמש בטרנסוול "ריק" ללא הוספת תאי אף לריקון. הקלט מדידת TEER ריקה.
הערה: אם משתמשים במספר וירוסים, יש לנקות את מכשיר ה-EVOM בקפדנות בין התנאים כדי למנוע זיהום צולב (שטיפות עם 70% אתנול ואחריו מים שעברו דה-יוניזציה מספיקות). - העבר כל טרנסוול נגוע לצלחת נקייה עם תווית מראש של 24 בארות עם 500 μL של PBS + Ca 2+/Mg2+ באופן בסיסי כדי לשטוף את התווך הבסיסי השיורי מהטרנסוולים.
- הוסף 200 μL של PBS + Ca 2+/Mg2+ לתא האפי של כל טרנסוול.
- הוסף 1 מ"ל PBS + Ca 2+/Mg2+ לתא המדידה Endohm-6.
- העבר כל טרנסוול לתא המדידה Endohm-6, והחלף את מכסה התא כך שהאלקטרודה האפיקלית תנוח ב- 200 μL של PBS בתא האפיקאלי; האלקטרודה הבסיסית מובנית בתחתית תא Endohm-6.
- אפשר לקריאת EVOM להתייצב והקלט מדידת TEER גולמית.
- אסוף דגימת ASL כמתואר לעיל לאחר לקיחת מדידת TEER אם יש צורך בטיטרינג (אסוף את 200 μL של PBS + Ca 2+/Mg2+ שנוסף למדידת TEER).
הערה: איסוף דגימות ASL יכול לגרום לקרעים זעירים במחסום האפיתל שעלולים לבלבל קריאות TEER, ולכן יש לאסוף ASL לאחר מדידת TER. יתר על כן, אין לשנות את המדיום הבסיסי מיד לפני קריאות TEER מכיוון שהדבר עשוי להשפיע גם על ערכי TEER. - כדי להמיר קריאות TEER גולמיות למדידות סופיות ב- Ohms/cm2, החסר ערך TEER ריק והכפל ערך זה בשטח הפנים של קרום הטרנסוול באמצעות משוואה (1):
TEER = [קריאת TEER - ערך TEER ריק] × (שטח הפנים של טרנסוול) (1) - עבור HCoVs, להעריך TEER כל 24 שעות או 48 שעות לאחר ההדבקה; הקינטיקה של שינויי TEER משתנה לעתים קרובות בין וירוסים ומחייבת פתרון בעיות בנקודות זמן שונות.
- בעת מדידת TEER, יש לכלול תמיד תרביות נגועות בדמה ולהעריך בכל נקודת זמן (בקרה שלילית).
הערה: עבור תרביות דמה, מדידות TEER צריכות להישאר יציבות או עשויות לעלות מעט מקו הבסיס לאחר השלמת ההבחנה של התרבויות. שטח הפנים של תומך הממברנה ישתנה בהתאם לגודל וליצרן של transwells; לטרנסוולים של 24 בארות יש בדרך כלל שטח פנים של 0.33 ס"מ2.
5. מדידת ציטוטוקסיות במהלך זיהום באמצעות בדיקת לקטט דהידרוגנאז (LDH)
הערה: בעבודה זו, תוכן LDH בדגימות ASL כומת באמצעות ערכה לזיהוי ציטוטוקסיות הזמינה מסחרית. אות LDH בתווך הבסיסי היה לעתים קרובות מתחת לגבול הגילוי ולעתים קרובות פחות ניתן לשחזור מאשר LDH שכומת בדגימות ASL מתרביות נגועות ב- HCoV.
- הכן בקרות נוספות הדרושות לבדיקת LDH.
- בקרת רקע: השתמש PBS (השתמש PBS המכיל סידן ומגנזיום אם דגימות ASL נאספו בדרך זו).
- שליטה חיובית (ערך תקרה): התייחסו ל-ALI באופן אפי עם Triton X-100. אספו בארות בקרה של טריטון (בדרך כלל השתמשו בשלוש תרביות ALI לשם כך בכל נקודת זמן).
- הוסף 200 μL של 2% Triton X-100 ב- PBS ישירות לתא האפי של הטרנסוול.
- יש לדגור במשך 10-15 דקות כדי לאפשר לתאים לשכב לחלוטין.
- אספו את כל הנפח כדגימת תקרת טריטון.
- בקרה שלילית (שליטה נמוכה/שחרור LDH בסיסי): איסוף ASL מתרביות ALI נגועות בדמה שמקורן באותו תורם כמו תרביות נגועות.
- אסוף ASL מדומה לבקרה שלילית בעקבות הליך איסוף ASL לעיל.
הערה: ניתן להשתמש באותם טרנסוולים עבור בקרה שלילית זו עבור כל נקודות הזמן, בעוד שטרנסוולים טריים יהיו נחוצים עבור כל נקודת זמן עבור בקרת טריטון.
- אסוף ASL מדומה לבקרה שלילית בעקבות הליך איסוף ASL לעיל.
- כדי לאפשר כימות של נגיף השפיכה בנוסף לקריאות LDH מכל דגימת ASL, טען צלחת שחורה 96 בארות שטוחה שקופה אופטית כדלקמן:
- לדלל את כל הדגימות ב- PBS, באמצעות 45 μL של דגימה ו- 55 μL של PBS (נפח כולל של 100 μL).
- התייחס לבקרת טריטון חיובית ודגימת בקרת רקע מדומה באותו אופן.
הערה: דילול זה מאפשר העמסה משולשת של כל דגימה ניסיונית (45 μL x 3) ונפח ASL שיורי מספיק עבור titering באמצעות בדיקת פלאק. - טען צלחת LDH במשולש: תקרת טריטון, בקרת רקע מדומה, בקרת PBS ודגימות ניסיוניות.
- הכן את תערובת התגובה כפי שצוין על ידי היצרן (תמיסת צבע + זרז).
- הוסיפו 100 מיקרוליטר של תערובת תגובה לכל באר, ודגרו על הצלחת בטמפרטורת החדר למשך 20 דקות כשהיא מוגנת מאור.
- לאחר 20 דקות, יש למדוד ספיגה ב-492 ננומטר.
- חשב אחוז ציטוטוקסיות ביחס לערך תקרת טריטון באמצעות משוואה (2).
ציטוטוקסיות (%)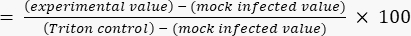 (2)
(2)
6. הכנת תרביות ALI באף להדמיית אימונופלואורסנציה (IF)
- העבירו את הטרנסוול לצלחת טרייה בת 24 בארות, ושטפו 3x באופן אפי עם PBS (אספו את שטיפת PBS הראשונה כ-ASL אם הטיטר; לאחר מכן, בצעו שתי שטיפות PBS נוספות כדי להסיר עודפי וירוס שעלולים לפגוע באיכות IF)
- לאחר שטיפת PBS הסופית, כסו את הטרנסוול באופן אפי ובסיסי ב-4% PFA.
- יש לדגור במשך 30 דקות כדי לתקן 4% PFA, ולאחר מכן להסיר ולשטוף 3x עם PBS.
- הבלו את תמיכת הטרנסוול המכילה את התאים באמצעות סכין גילוח מושחזת או מספריים.
- כדי להגדיל את מספר מטרות IF עבור כל טרנסוול, חתכו כל קרום לשניים, והכתימו כל חצי בשילובי נוגדנים שונים.
- חדיר עם 0.2% Triton X-100 ב-PBS למשך 10 דקות.
- יש לחסום עם 10% סרום חמור רגיל ו-1% BSA ב-PBST (PBS + 0.2% Triton X-100) למשך 60 דקות בטמפרטורת החדר.
הערה: הגן על דגימות מפני חשיפה לאור משלב זה ואילך. - יש לדגור בתמיסת נוגדנים ראשונית למשך הלילה ב-4°C. לדלל את כל הנוגדנים בקנ"מ 1:1,000 בחיץ חוסם.
הערה: נוגדנים מייצגים לצביעת נוקלאוקפסיד HCoV, כמו גם סמנים מסוג תאי אפיתל וכתמי שלד, מפורטים להלן (עיין בטבלת החומרים לקבלת מידע על היצרן ומספרים קטלוגיים).- עבור צביעת אנטיגן HCoV, השתמש בנוגדנים המכוונים לנוקלאוקפסיד SARS-CoV-2, נוקלאוקפסיד MERS-CoV ונוקלאוקפסיד HCoV-NL63.
- כדי לזהות סוגי תאי אפיתל, השתמש בנוגדנים המכוונים לסמן תאי גביע MUC5AC ולסמן תא ריסוני מסוג IV β-טובולין.
- עבור סמנים ציטו-שלד, השתמש בנוגדנים המכוונים נגד פאלואדין (קושר F-actin) וסמן היצמדות תאי אפיתל: EpCAM (CD326).
- לדגור בתמיסת נוגדנים משנית במשך 60 דקות בטמפרטורת החדר; השתמש בצבעי נוגדנים משניים מדוללים ביחס של 1:1,000 בחיץ חוסם.
- לאחר השלמת הצביעה, מעבירים את הממברנה למגלשת זכוכית עם מרית, מכוונים את הטרנסוול עם הצד האפי לכיוון המגלשה, ומוסיפים תמיסת הרכבה. יש להסתפק 15-30 דקות לפני מריחת לק שקוף סביב הקצוות.
- קבל תמונות באמצעות מיקרוסקופ קונפוקלי (צעד ציר Z: 0.5 מיקרומטר; סריקה רציפה)1,16,17.
הערה: לאחר קיבוע תרביות ב-4% PFA ושטיפה עם PBS, ניתן לאחסן תרביות קבועות בטמפרטורה של 4°C למשך שבועות עד חודשים לפני הצביעה וההכנה להדמיה. לאחר צביעה והרכבה של ממברנות, דגימות ניתן לאחסן לטווח ארוך (>2 שנים) ב 4 ° C בחושך.
7. איסוף חלבון תוך תאי לאימונובלוטינג מערבי או RNA לניתוח RT-qPCR
- אסוף ASL כמתואר לעיל אם מכמת טיטרים נגיפיים (פרוטוקול סעיף 2).
- העבירו את הטרנסוול לצלחת נקייה בת 24 בארות, שכן גירוד הממברנה עלול להוביל לשבירת האינספק.
- לניתוח כתמים מערביים, יש לאסוף את סך כל החלבון ליזט ב-125 מיקרוליטר של מאגר RIPA (50 mM Tris, pH 8, 150 mM NaCl, 0.5% deoxycholate, 0.1% SDS, 1% NP40) בתוספת מעכבי פרוטאז ומעכבי פוספטאז.
- מוסיפים 125 μL של חיץ RIPA לתא האפיקאלי, ודגרים במשך 5-10 דקות.
- גרדו את הממברנה באמצעות קצה פיפטה P200 כדי להסיר את התאים המחוברים שנותרו, ואספו את כל הנפח (גרדו במרץ על פני כל פני השטח של הממברנה, ולאחר מכן פיפטה למעלה ולמטה מספר פעמים כדי לאסוף את הדגימה כולה).
- דגרו דגימות חלבון ליזט על קרח במשך 10 דקות, ולאחר מכן צנטריפוגה במהירות מרבית (20,000 × גרם) למשך 10 דקות ב-4°C.
- ערבבו את הסופרנאטנט עם חיץ דגימה 4x Laemmli עם β-מרקפטואתנול (חומר מחזרים) בהתאם לפרוטוקולי היצרן.
- מרתיחים דגימות חלבון בטמפרטורה של 95°C למשך 5 דקות, ולאחר מכן רצים באמצעות פרוטוקולי הכתמה מערביים מסורתיים 1,16,17.
- לאיסוף הרנ"א הכולל, השתמשו בערכת מיצוי RNA זמינה מסחרית לפי בחירתכם.
הערה: התא האפי של תוספות טרנסוול 24 בארות הוא בעל נפח מקסימלי של ~ 200 μL; לכן, אנו מבצעים שתי שטיפות עוקבות על כל תרבית כדי להגיע לנפח הכולל המומלץ. הפרטים להלן מתאימים לאיסוף מומלץ של דגימות RNA בנפח כולל של 350 μL. - הוסף 200 μL של חיץ ליזיס לתא האפי של הטרנסוול הנגוע.
- השאירו למשך 5-10 דקות, גרדו את כל התאים שנותרו מהממברנה באמצעות קצה פיפטה, ואספו את כל הנפח לתוך צינור מיקרוצנטריפוגה מסומן.
- הוסף 150 μL של חיץ ליזיס נוסף לתא האפי של הטרנסוול, ופיפטה למעלה ולמטה לפני איסוף לתוך אותו צינור מיקרוצנטריפוגה.
- לחלץ RNA בהתאם לפרוטוקול היצרן.
תוצאות
הנתונים המייצגים לקוחים חלקית מנתונים שניתן למצוא בכתב היד Otter et al.1. תרביות ALI באף שמקורן בארבעה או שישה תורמים היו נגועות באחד מארבעה HCoVs (SARS-CoV-2, MERS-CoV, HCoV-NL63 ו-HCoV-229E) לפי הפרוטוקולים שתוארו לעיל, והטיטרים הנגיפיים הממוצעים שנשפכו עבור כל וירוס מתוארים באיור 1A. בע...
Discussion
השיטות המפורטות כאן מתארות מערכת תרבית אפיתל ראשונית שבה תאי אפיתל אף שמקורם במטופל גדלים בממשק אוויר-נוזל ומיושמים בחקר אינטראקציות HCoV-מארח. לאחר התמיינותן, תרביות ALI אפיפיוריות אף אלה משחזרות מאפיינים רבים של אפיתל האף in vivo , כולל אוכלוסייה תאית הטרוגנית עם תאים ריסניים, גביעים ותא?...
Disclosures
סוזן וייס חברה בוועדות המדעיות המייעצות של Ocugen. נועם א. כהן מייעץ ל-GSK, אסטרהזניקה, נוברטיס, סאנופי/רגרון ואויסטר פוינט פרמצבטיקה ויש לו פטנט אמריקאי, "טיפול ואבחון לזיהומים נשימתיים" (10,881,698 B2, WO20913112865), והסכם רישוי עם GeneOne Life Sciences.
Acknowledgements
למחקר זה יש את מקורות המימון הבאים: המכונים הלאומיים לבריאות (NIH) R01AI 169537 (S.R.W. ו- N.A.C.), NIH R01AI 140442 (S.R.W.), VA Merit Review CX001717 (N.A.C.), VA Merit Review BX005432 (S.R.W. ו- N.A.C.), מרכז פן לחקר וירוסי קורונה ופתוגנים מתעוררים אחרים (S.R.W.), קרן Laffey-McHugh (S.R.W. ו- N.A.C.), T32 AI055400 (CJO), T32 AI007324 (AF).
Materials
| Name | Company | Catalog Number | Comments |
| Alexa Fluor secondary antibodies (488, 594, 647) | Invitrogen | Various | |
| BSA (bovine serum albumin) | Sigma-Aldrich | A7906 | |
| cOmplete mini EDTA-free protease inhibitor | Roche | 11836170001 | |
| Cytotoxicity detection kit | Roche | 11644793001 | |
| DMEM (Dulbecco's Modified Eagle Media) | Gibco | 11965-084 | |
| DPBS (Dulbecco's Phosphate Buffered Saline) | Gibco | 14190136 | |
| DPBS + calcium + magnesium | Gibco | 14040-117 | |
| Endohm-6G measurement chamber | World Precision Instruments | ENDOHM-6G | |
| Epithelial cell adhesion marker (EpCAM; CD326) | eBiosciences | 14-9326-82 | |
| Epithelial Volt/Ohm (TEER) Meter (EVOM) | World Precision Instruments | 300523 | |
| FBS (Fetal Bovine Serum) | HyClone | SH30071.03 | |
| FV10-ASW software for imaging | Olympus | Version 4.02 | |
| HCoV-NL63 (Human coronavirus, NL63) | BEI Resources | NR-470 | |
| HCoV-NL63 nucleocapsid antibody | Sino Biological | 40641-V07E | |
| Hoescht stain | Thermo Fisher | H3570 | |
| Laemmli sample buffer (4x) | BIO-RAD | 1610747 | |
| LLC-MK2 cells | ATCC | CCL-7 | To titrate HCoV-NL63 |
| MERS-CoV (Human coronavirus, Middle East Respiratory Syndrome Coronavirus (MERS-CoV), EMC/2012) | BEI Resources | NR-44260 | |
| MERS-CoV nucleocapsid antibody | Sino Biological | 40068-MM10 | |
| MUC5AC antibody | Sigma-Aldrich | AMAB91539 | |
| Olympus Fluoview confocal microscope | Olympus | FV1000 | |
| Phalloidin-iFluor 647 stain | Abcam | ab176759 | |
| PhosStop easy pack (phosphatase inhibitors) | Roche | PHOSS-RO | |
| Plate reader | Perkin Elmer | HH34000000 | Any plate reader or ELISA reader is sufficient; must be able to read absorbance at 492 nm |
| RIPA buffer (50 mM Tris pH 8; 150 mM NaCl; 0.5% deoxycholate; 0.1% SDS; 1% NP40) | Thermo Fisher | 89990 | Can prep in-house or purchase |
| RNeasy Plus Kit | Qiagen | 74134 | |
| SARS-CoV-2 (SARS-Related Coronavirus 2, Isolate USA-WA1/2020) | BEI Resources | NR-52281 | |
| SARS-CoV-2 nucleocapsid antibody | Genetex | GTX135357 | |
| Triton-X 100 | Fisher Scientific | BP151100 | |
| Type IV β- tubulin antibody | Abcam | ab11315 | |
| VeroCCL81 cells | ATCC | CCL-81 | To titrate MERS-CoV |
| VeroE6 cells | ATCC | CRL-1586 | To titrate SARS-CoV-2 |
References
- Otter, C. J., et al. Infection of primary nasal epithelial cells differentiates among lethal and seasonal human coronaviruses. Proceedings of the National Academy of Sciences of the United States of America. 120 (15), 2218083120 (2023).
- Fehr, A., Perlman, S. Coronaviruses: An overview of their replication and pathogenesis. Methods in Molecular Biology. 1282, 1-23 (2015).
- Gaunt, E. R., Hardie, A., Claas, E. C. J., Simmonds, P., Templeton, K. E. Epidemiology and clinical presentations of the four human coronaviruses 229E, HKU1, NL63, and OC43 detected over 3 years using a novel multiplex real-time PCR method. Journal of Clinical Microbiology. 48 (8), 2940-2947 (2010).
- Kesheh, M. M., Hosseini, P., Soltani, S., Zandi, M. An overview on the seven pathogenic human coronaviruses. Reviews in Medical Virology. 32 (2), 2282 (2022).
- MERS-CoV Worldwide Overview. European Centre for Disease Prevention and Control Available from: https://www.ecdc.europa.eu/en/middle-east-respiratory-syndrome-coronavirus-mers-cov-situation-update (2022)
- Cao, Y., Liu, X., Xiong, L., Cai, K. Imaging and clinical features of patients with 2019 novel coronavirus SARS-CoV-2: A systematic review and meta-analysis. Journal of Medical Virology. 92 (9), 1449-1459 (2020).
- Vareille, M., Kieninger, E., Edwards, M. R., Regamey, N. The airway epithelium: Soldier in the fight against respiratory viruses. Clinical Microbiology Reviews. 24 (1), 210-229 (2011).
- Farzal, Z., et al. Comparative study of simulated nebulized and spray particle deposition in chronic rhinosinusitis patients. International Forum of Allergy and Rhinology. 9 (7), 746-758 (2019).
- Gaeckle, N. T., Pragman, A. A., Pendleton, K. M., Baldomero, A. K., Criner, G. J. The oral-lung axis: The impact of oral health on lung health. Respiratory Care. 65 (8), 1211-1220 (2020).
- Hou, Y., et al. SARS-CoV-2 reverse genetics reveals a variable infection gradient in the respiratory tract. Cell. 182, 429-446 (2020).
- Hariri, B. M., Cohen, N. A. New insights into upper airway innate immunity. American Journal of Rhinology and Allergy. 30 (5), 319-323 (2016).
- Hiemstra, P. S., McCray, P. B., Bals, R. The innate immune function of airway epithelial cells in inflammatory lung disease. European Respiratory Journal. 45 (4), 1150-1162 (2015).
- Hatton, C. F., et al. Delayed induction of type I and III interferons mediates nasal epithelial cell permissiveness to SARS-CoV-2. Nature Communications. 12 (1), 7092 (2021).
- Sungnak, W., et al. SARS-CoV-2 entry factors are highly expressed in nasal epithelial cells together with innate immune genes. Nature Medicine. 26 (5), 681-687 (2020).
- Li, Y., et al. SARS-CoV-2 induces double-stranded RNA-mediated innate immune responses in respiratory epithelial-derived cells and cardiomyocytes. Proceedings of the National Academy of Sciences of the United States of America. 118 (16), 2022643118 (2021).
- Comar, C. E., et al. MERS-CoV endoribonuclease and accessory proteins jointly evade host innate immunity during infection of lung and nasal epithelial cells. Proceedings of the National Academy of Sciences of the United States of America. 119 (21), 2123208119 (2022).
- Lee, R. J., et al. Bacterial D-amino acids suppress sinonasal innate immunity through sweet taste receptors in solitary chemosensory cells. Science Signaling. 10 (495), (2017).
- Brewington, J. J., et al. Brushed nasal epithelial cells are a surrogate for bronchial epithelial CFTR studies. JCI Insight. 3 (13), 99385 (2018).
- Comer, D. M., Elborn, J. S., Ennis, M. Comparison of nasal and bronchial epithelial cells obtained from patients with COPD. PLoS One. 7 (3), e32924 (2012).
- Vanders, R. L., Hsu, A., Gibson, P. G., Murphy, V. E., Wark, P. A. B. Nasal epithelial cells to assess in vitro immune responses to respiratory virus infection in pregnant women with asthma. Respiratory Research. 20 (1), 259 (2019).
- Lee, R. J., et al. Fungal aflatoxins reduce respiratory mucosal ciliary function. Scientific Reports. 6, 33221 (2016).
- Patel, N. N., et al. Fungal extracts stimulate solitary chemosensory cell expansion in noninvasive fungal rhinosinusitis. International Forum of Allergy and Rhinology. 9 (7), 730-737 (2019).
- Baer, A., Kehn-Hall, K. Viral concentration determination through plaque assays: Using traditional and novel overlay systems. Journal of Visualized Experiments. 93 (93), e52065 (2014).
- Robinot, R., et al. SARS-CoV-2 infection induces the dedifferentiation of multiciliated cells and impairs mucociliary clearance. Nature Communications. 12 (1), 4354 (2021).
- Whitsett, J. A. Airway epithelial differentiation and mucociliary clearance. Annals of the American Thoracic Society. 15, S143-S148 (2018).
- Gao, N., Raduka, A., Rezaee, F. Respiratory syncytial virus disrupts the airway epithelial barrier by decreasing cortactin and destabilizing F-actin. Journal of Cell Science. 135 (16), 259871 (2022).
- Schmidt, H., et al. IL-13 impairs tight junctions in airway epithelia. International Journal of Molecular Sciences. 20 (13), 3222 (2019).
- Huang, Z. Q., et al. Interleukin-13 alters tight junction proteins expression thereby compromising barrier function and dampens rhinovirus induced immune responses in nasal epithelium. Frontiers in Cell and Developmental Biology. 8, 572749 (2020).
- Saatian, B., et al. Interleukin-4 and interleukin-13 cause barrier dysfunction in human airway epithelial cells. Tissue Barriers. 1 (2), e24333 (2013).
- Coles, J. L., et al. A revised protocol for culture of airway epithelial cells as a diagnostic tool for primary ciliary dyskinesia. Journal of Clinical Medicine. 9 (11), 3753 (2020).
- Baldassi, D., Gabold, B., Merkel, O. M. Air−liquid interface cultures of the healthy and diseased human respiratory tract: Promises, challenges, and future directions. Advanced NanoBiomed Research. 1 (6), 2000111 (2021).
- Seibold, M. A. Interleukin-13 stimulation reveals the cellular and functional plasticity of the airway epithelium. Annals of the American Thoracic Society. 15, S98-S106 (2018).
- Morrison, C. B., et al. SARS-CoV-2 infection of airway cells causes intense viral and cell shedding, two spreading mechanisms affected by IL-13. Proceedings of the National Academy of Sciences of the United States of America. 119 (16), 2119680119 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved