Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Infection de cellules épithéliales nasales primaires cultivées à l’interface air-liquide pour caractériser les interactions entre le coronavirus humain et l’hôte
Dans cet article
Résumé
L’épithélium nasal est le principal site barrière rencontré par tous les agents pathogènes respiratoires. Ici, nous décrivons des méthodes pour utiliser des cellules épithéliales nasales primaires cultivées sous forme de cultures d’interface air-liquide (ALI) pour caractériser les interactions entre le coronavirus humain et l’hôte dans un système physiologiquement pertinent.
Résumé
Trois coronavirus humains hautement pathogènes (HCoV) - le SRAS-CoV (2002), le MERS-CoV (2012) et le SRAS-CoV-2 (2019) - ont émergé et provoqué d’importantes crises de santé publique au cours des 20 dernières années. Quatre autres HCoV sont à l’origine d’une part importante des cas de rhume chaque année (HCoV-NL63, -229E, -OC43 et -HKU1), ce qui souligne l’importance d’étudier ces virus dans des systèmes physiologiquement pertinents. Les HCoV pénètrent dans les voies respiratoires et établissent l’infection dans l’épithélium nasal, le site principal rencontré par tous les agents pathogènes respiratoires. Nous utilisons un système de culture épithéliale nasale primaire dans lequel des échantillons nasaux dérivés de patients sont cultivés à une interface air-liquide (ALI) pour étudier les interactions hôte-pathogène sur cet important site sentinelle. Ces cultures récapitulent de nombreuses caractéristiques des voies respiratoires in vivo , y compris les types de cellules présentes, la fonction ciliaire et la production de mucus. Nous décrivons des méthodes pour caractériser la réplication virale, le tropisme de la cellule hôte, la cytotoxicité induite par le virus et l’induction immunitaire innée dans les cultures nasales d’ALI après une infection par HCoV, en utilisant des travaux récents comparant les HCoV létaux et saisonniers comme exemple1. Une meilleure compréhension des interactions hôte-pathogène dans le nez a le potentiel de fournir de nouvelles cibles pour les thérapies antivirales contre les HCoV et d’autres virus respiratoires qui émergeront probablement à l’avenir.
Introduction
Sept coronavirus humains (HCoV) ont été identifiés à ce jour et provoquent une série de maladies respiratoires2. Les HCoV courants ou saisonniers (HCoV-NL63, -229E, -OC43 et -HKU1) sont généralement associés à une pathologie des voies respiratoires supérieures et causent environ 10 à 30 % des cas de rhume chaque année. Bien qu’il s’agisse du phénotype clinique typique associé aux HCoV courants, ces virus peuvent causer des maladies des voies respiratoires inférieures plus importantes dans les populations à risque, y compris les enfants, les personnes âgées et les personnes immunodéprimées 3,4. Au cours des 20 dernières années, trois HCoV pathogènes ont émergé et causé d’importantes urgences de santé publique, notamment le syndrome respiratoire aigu sévère (SRAS)-CoV, le syndrome respiratoire du Moyen-Orient (MERS)-CoV et le SRAS-CoV-2. Les HCoV létaux sont associés à une pathologie plus sévère des voies respiratoires, ce qui est clairement illustré par le taux de létalité de >34 % associé aux cas de MERS-CoV (894 décès pour plus de 2 500 cas depuis son apparition en 2012)5,6. Il est important de noter que les HCoV mortels causent également toute une série de maladies des voies respiratoires, allant des infections asymptomatiques à la pneumonie mortelle, comme on l’a vu avec la pandémie de COVID-19 en cours7.
Les HCoV, comme d’autres agents pathogènes respiratoires, pénètrent dans les voies respiratoires et établissent une infection productive dans l’épithélium nasal8. On pense que la propagation aux voies respiratoires inférieures est associée à l’aspiration de la cavité buccale/nasale vers le poumon, où les HCoV provoquent une pathologie plus importante des voies respiratoires inférieures 9,10,11. Ainsi, le nez sert de porte initiale pour l’entrée virale et constitue la principale barrière à l’infection grâce à sa robuste machinerie de clairance mucociliaire et à ses mécanismes immunitaires innés uniques visant à empêcher la propagation virale vers les voies respiratoires inférieures12,13. Par exemple, il a été rapporté que les cellules épithéliales nasales expriment des niveaux basaux plus élevés que la moyenne d’interférons antiviraux et de gènes stimulés par l’interféron, ce qui indique que les cellules nasales peuvent être préparées à des réponses précoces aux virus respiratoires14,15,16.
Nous avons déjà utilisé des cellules épithéliales nasales primaires dérivées de patients cultivées à l’interface air-liquide (ALI) pour modéliser les interactions HCoV-hôte dans le nez, où les infections HCoV commencent. Les cultures nasales d’ALI sont permissives pour les HCoV pathogènes (SRAS-CoV-2 et MERS-CoV) et communs (HCoV-NL63 et HCoV-229E) et offrent divers avantages par rapport aux lignées cellulaires épithéliales traditionnelles des voies respiratoires telles que A549 (une lignée cellulaire d’adénocarcinome pulmonaire)16,17. Après différenciation, les cultures nasales d’ALI contiennent une population cellulaire hétérogène et présentent de nombreuses fonctions attendues de l’épithélium nasal in vivo, telles que la machinerie de clairance mucociliaire18. Les cellules nasales offrent également des avantages par rapport aux systèmes de culture des voies respiratoires inférieures (tels que les cellules épithéliales bronchiques humaines, HBEC), car l’acquisition de cellules épithéliales nasales par brossage cytologique est nettement moins invasive que l’utilisation de techniques telles que la bronchoscopie pour atteindre les HBECs 19,20,21.
Cet article décrit les méthodes d’utilisation de ce système de culture ALI nasale pour caractériser les interactions HCoV-hôte dans l’épithélium nasal. Nous avons appliqué ces méthodes dans des travaux récemment publiés pour comparer le SARS-CoV-2, le MERS-CoV, le HCoV-NL63 et le HCoV-229E 1,16,17. Bien que ces méthodes et ces résultats représentatifs mettent l’accent sur l’étude des HCoV dans ce modèle de cellules nasales, le système est hautement adaptable à d’autres HCoV, ainsi qu’à d’autres agents pathogènes respiratoires. De plus, ces méthodes peuvent être appliquées plus largement à d’autres systèmes de culture ALI afin d’étudier la réplication virale et le tropisme cellulaire, ainsi que la cytotoxicité et l’induction immunitaire innée après l’infection.
Protocole
L’utilisation d’échantillons nasaux a été approuvée par le Conseil d’examen institutionnel de l’Université de Pennsylvanie (protocole # 800614) et le Conseil d’examen institutionnel de Philadelphie VA (protocole # 00781).
1. Infection des cultures nasales d’ALI
NOTE : L’acquisition d’échantillons cliniques, ainsi que la croissance et la différenciation des cultures nasales d’ALI, n’entrent pas dans le cadre du présent document. Des méthodes spécifiques pour la culture des cellules épithéliales nasales primaires peuvent être trouvées dans des travaux récemment publiés utilisant ces cultures 18,22,23. Les protocoles ci-dessous peuvent également être appliqués aux cultures d’ALI épithéliales nasales disponibles dans le commerce si vous le souhaitez. Les protocoles et volumes détaillés ci-dessous s’appliquent aux inserts de transwell à plaques à 24 puits (diamètre 6,5 mm, surface de membrane de 0,33 cm2). Si vous utilisez des cultures ALI cultivées sur des puits de plus grande taille (c.-à-d. des plaques à 12 puits, un diamètre de 12 mm, une surface de 1,12 cm2), ajustez les volumes proportionnellement pour refléter la taille du puits de transbordement.
- La veille de l’infection :
- Laver les cultures d’ALI 3 fois avec une solution saline tamponnée au phosphate (PBS) par voie apicole (ajouter ~200 μL de PBS réchauffé, placer dans un incubateur à 37 °C pendant 5 min, aspirer le PBS et répéter).
- Remplacer le milieu basal (500 μL).
- Laisser les cultures s’équilibrer à la température à laquelle les infections seront conduites pendant la nuit (c.-à-d. en cas d’infection à 33 °C, placer les cultures dans un incubateur à 33 °C après le lavage du PBS).
REMARQUE : Les HCoV associés au rhume, tels que le HCoV-229E et le HCoV-NL63, se répliquent plus efficacement à 33 °C. De plus, la température de l’épithélium nasal in vivo est de 33 °C (ce qui diffère de la température du poumon, qui est de 37 °C).
- Diluer le virus au besoin dans le milieu Eagle modifié (DMEM) de Dulbecco sans sérum pour obtenir la multiplicité d’infection (MOI) souhaitée dans un volume d’inoculum total de 50 μL.
NOTA : Les infections ont généralement été effectuées à un moment précis = 5 (moment d’inertie élevé) ; cependant, des infections à MOI = 0,5 (MOI faible) ont également été utilisées pour le SRAS-CoV-2 et les HCoV associés au rhume, et celles-ci donnent des titres viraux de pointe comparables, mais avec une cinétique variable (l’un ou l’autre MOI est acceptable). - Ajouter l’inoculum par voie apicale et remettre les cultures dans l’incubateur pendant 1 h.
- Balancez doucement les plaques toutes les 15 minutes pendant l’infection (en tenant fermement la plaque dans les deux mains, balancez-les vers l’avant et vers l’arrière et d’un côté à l’autre pour assurer une adsorption uniforme de l’inoculum viral).
- Après 1 h d’incubation, aspirer l’inoculum viral et laver chaque culture infectée 3 fois avec du PBS pour assurer l’élimination de l’inoculum viral (pour chaque lavage, ajouter 200 μL de PBS, incuber pendant 5 min et aspirer ou retirer avec une pipette).
- Si vous le souhaitez, prélever le troisième lavage PBS pour confirmer l’élimination adéquate du virus d’entrée.
- Remplacer le milieu basal par du milieu frais sur les ALI infectés toutes les 72 h pendant l’infection.
2. Collecte du liquide de surface apicale (ASL) et titrage du virus excrété
- À des moments prédéterminés après l’infection, ajouter 200 μL de PBS dans la chambre apicale de chaque puits trans infecté.
REMARQUE : Les points de temps pertinents varient en fonction de l’HCoV d’intérêt et vont de 24 h à 192 h après l’infection (voir la section sur les résultats représentatifs pour les données de réplication virale pour divers HCoV). - Pipeter le PBS de haut en bas 5 fois pour assurer une collecte maximale du virus excrété par voie apicale, et recueillir tout le volume dans un tube de microcentrifugation (il s’agit de l’échantillon ASL).
REMARQUE : L’ASL comprend les particules virales excrétées en plus du mucus et d’autres produits sécrétés apicalement par les cultures d’ALI. - Quantifier le virus infectieux dans l’ASL à l’aide d’un test de plaque virale standard (diluer en série des échantillons contenant des virus afin de quantifier la concentration de particules virales).
REMARQUE : Les types de cellules et la période d’incubation utilisés pour le dosage de la plaque dépendent du virus utilisé : SARS-CoV-2 (cellules VeroE6) ; MERS-CoV (cellules VeroCCL81) ; HCoV-NL63 (cellules LLC-MK2) ; HCoV-229E (cellules Huh7). Les détails sur la façon d’effectuer des tests de plaque virale dépassent le cadre de ce manuscrit, mais ont déjà été détaillés dans une publication du Journal of Visualized Experiments (JoVE)24. - Si vous le souhaitez, prélever le milieu basal à différents moments après l’infection pour confirmer l’absence de virus libéré par voie basale. Les HCoV sont généralement libérés apicalement par les cellules épithéliales nasales, mais confirment cela par un dosage de la plaque dans un milieu basal non dilué.
- Conserver les échantillons de LSA à −80 °C si la quantification par dosage de plaque n’a pas lieu le jour du prélèvement.
3. Quantification du virus intracellulaire
- Après avoir prélevé l’échantillon ASL, déplacer chaque transwell dans une plaque propre à 24 puits préchargée avec 500 μL de DMEM contenant 2 % de sérum de veau fœtal (FBS) par voie basale.
REMARQUE : Le DMEM avec 2 % de FBS est utilisé pour stabiliser le virus pendant les cycles de gel-dégel subséquents. - Lavez chaque transwell 3 fois apicalement avec du PBS pour assurer l’élimination complète du virus excrété apicalement.
- Après avoir aspiré pour retirer le dernier lavage PBS, ajoutez 100 μL de DMEM avec 2 % de FBS dans le compartiment apical.
- Déplacez la plaque contenant les transpuits avec des milieux apicaux et basaux dans un congélateur à −80 °C et effectuez trois cycles consécutifs de congélation-décongélation pour lyser les cellules.
- Après le dernier cycle de gel-dégel, mettre en commun le milieu apical (100 μL) et le média basal (500 μL) dans un tube propre.
- Centrifuger à 500 × g pendant 10 min à 4 °C pour granuler les débris cellulaires.
- Récupérez le surnageant. Il s’agit de l’échantillon de virus intracellulaire pour le titrage via un test de plaque standard.
NOTA : Une dilution trois fois se produit au cours du processus de collecte par rapport à la collecte de l’ASL ; Les échantillons d’ASL sont prélevés dans 200 μL de PBS, tandis que les échantillons de virus intracellulaires sont prélevés dans un volume total de 600 μL.
4. Mesure de la résistance électrique transépithéliale (TEER)
REMARQUE : Pour la mesure TEER, un PBS complété par du calcium et du magnésium (PBS + Ca 2+/Mg2+) doit être utilisé. Un volt/ohmmètre épithélial réglé pour lire en ohms est utilisé (voir le tableau des matériaux).
- Nettoyez, équilibrez et videz l’instrument EVOM conformément aux instructions du fabricant ; Utilisez un transbien « vide » sans ajout de cellules nasales pour l’obturation. Enregistrez la mesure FEER à blanc.
REMARQUE : En cas d’utilisation de plusieurs virus, l’instrument EVOM doit être nettoyé rigoureusement entre les conditions pour éviter la contamination croisée (des lavages à l’éthanol à 70% suivis d’eau déminéralisée suffisent). - Déplacer chaque transpuits infecté dans une plaque pré-étiquetée et propre à 24 puits avec 500 μL de PBS + Ca 2+/Mg2+ à la base pour laver le milieu basal résiduel des transpuits.
- Ajouter 200 μL de PBS + Ca 2+/Mg2+ dans le compartiment apical de chaque transwell.
- Ajouter 1 mL de PBS + Ca 2+/Mg2+ dans la chambre de mesure Endohm-6.
- Déplacez chaque transwell dans la chambre de mesure Endohm-6 et replacez le couvercle de la chambre de manière à ce que l’électrode apicale repose dans les 200 μL de PBS dans le compartiment apical ; l’électrode basale est intégrée dans le fond de la chambre Endohm-6.
- Laissez la lecture EVOM se stabiliser et enregistrez la mesure TEER brute.
- Prélever l’échantillon ASL comme décrit ci-dessus après avoir pris la mesure TEER si le titre est souhaité (prélever les 200 μL de PBS + Ca 2+/Mg2+ qui ont été ajoutés pour la mesure TEER).
REMARQUE : Le prélèvement d’échantillons d’ASL peut induire des micro-déchirures dans la barrière épithéliale qui peuvent confondre les lectures TEER, de sorte que l’ASL doit être prélevé après la mesure TEER. De plus, le milieu de base ne doit pas être modifié immédiatement avant les lectures TEER, car cela peut également avoir un impact sur les valeurs TEER. - Pour convertir les lectures brutes de TEER en mesures finales en Ohms/cm2, soustrayez la valeur TEER vide et multipliez cette valeur par la surface de la membrane de puits de transwell à l’aide de l’équation (1) :
TEER = [Lecture TEER - valeur TEER vide] × (surface du transwell) (1) - Dans le cas des HCoV, évaluer le TEER toutes les 24 h ou 48 h suivant l’infection ; la cinétique des changements TEER varie souvent d’un virus à l’autre et nécessite un dépannage à différents moments.
- Lors de la mesure de l’EFT, il faut toujours inclure des cultures infectées fictives et évaluer à chaque moment (contrôle négatif).
NOTA : Pour les cultures fictives, les mesures TEER doivent rester stables ou peuvent augmenter légèrement par rapport à la ligne de base une fois la différenciation des cultures terminée. La surface des supports membranaires varie en fonction de la taille et du fabricant des transgouffres ; Les transpuits à 24 puits ont généralement une surface de 0,33 cm2.
5. Mesure de la cytotoxicité au cours de l’infection par dosage de la lactate déshydrogénase (LDH)
NOTE : Dans ce travail, la teneur en LDH des échantillons d’ASL a été quantifiée à l’aide d’une trousse de détection de cytotoxicité disponible dans le commerce. Le signal de LDH dans le milieu basal était souvent inférieur à la limite de détection et souvent moins reproductible que la LDH quantifiée dans des échantillons d’ASL provenant de cultures infectées par le HCoV.
- Préparer les contrôles supplémentaires nécessaires pour le dosage de la LDH.
- Contrôle des antécédents : utiliser du PBS (utiliser du PBS contenant du calcium et du magnésium si des échantillons d’ASL ont été prélevés de cette façon).
- Contrôle positif (valeur plafond) : traiter les ALI apicalement avec Triton X-100. Collectez des puits de contrôle Triton (utilisez généralement trois cultures ALI pour cela à chaque point de temps).
- Ajouter 200 μL de Triton X-100 à 2 % dans du PBS directement dans le compartiment apical du transwell.
- Incuber pendant 10 à 15 minutes pour permettre aux cellules de se lyser complètement.
- Collectez l’ensemble du volume sous la forme d’un échantillon de plafond Triton.
- Témoin négatif (faible taux témoin/libération initiale de LDH) : prélever l’ASL à partir de cultures d’ALI infectées fictives dérivées du même donneur que les cultures infectées.
- Recueillir l’ASL fictive de contrôle négatif en suivant la procédure de collecte de l’ASL ci-dessus.
REMARQUE : Les mêmes puits peuvent être utilisés pour ce contrôle négatif pour tous les points temporels, tandis que des puits neufs seront nécessaires pour chaque point temporel pour le contrôle Triton.
- Recueillir l’ASL fictive de contrôle négatif en suivant la procédure de collecte de l’ASL ci-dessus.
- Pour permettre la quantification de l’excrétion du virus en plus des lectures de LDH à partir de chaque échantillon ASL, chargez une plaque noire à fond plat optiquement transparente à 96 puits comme suit :
- Diluer tous les échantillons dans du PBS, en utilisant 45 μL d’échantillon et 55 μL de PBS (100 μL de volume total).
- Traitez les échantillons de contrôle positif Triton et de contrôle d’arrière-plan simulé de la même manière.
REMARQUE : Cette dilution permet une charge triple de chaque échantillon expérimental (45 μL x 3) et un volume résiduel d’ASL suffisant pour le titrage par dosage de plaque. - Chargez la plaque LDH en trois exemplaires : plafond Triton, contrôle d’arrière-plan simulé, contrôle PBS et échantillons expérimentaux.
- Préparez le mélange réactionnel comme indiqué par le fabricant (solution colorante + catalyseur).
- Ajouter 100 μL de mélange réactionnel dans chaque puits, et incuber la plaque à température ambiante pendant 20 min à l’abri de la lumière.
- Après 20 min, mesurez l’absorbance à 492 nm.
- Calculer le pourcentage de cytotoxicité par rapport à la valeur plafond de Triton à l’aide de l’équation (2).
Cytotoxicité (%) (2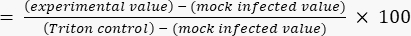 )
)
6. Préparation de cultures nasales d’ALI pour l’imagerie par immunofluorescence (IF)
- Déplacez le transwell dans une plaque fraîche à 24 puits et lavez-le 3 fois apicalement avec du PBS (collectez le premier lavage PBS en ASL si vous titrez ; ensuite, effectuez deux lavages PBS supplémentaires pour éliminer l’excès de virus excrété qui pourrait nuire à la qualité de l’IF)
- Après le dernier lavage PBS, couvrir le transwell apical et basal avec 4 % de PFA.
- Incuber pendant 30 min pour fixer 4% de PFA, puis retirer et laver 3x avec du PBS.
- Exciser le support de transwell contenant les cellules à l’aide d’une lame de rasoir aiguisée ou de ciseaux.
- Pour augmenter le nombre de cibles IF pour chaque doigt de gant, coupez chaque membrane en deux et colorez chaque moitié avec différentes combinaisons d’anticorps.
- Perméabiliser avec 0,2 % de Triton X-100 dans du PBS pendant 10 min.
- Bloquer avec 10 % de sérum d’ânesse normal et 1 % de BSA dans du PBST (PBS + 0,2 % Triton X-100) pendant 60 min à température ambiante.
REMARQUE : Protégez les échantillons de l’exposition à la lumière à partir de cette étape vers l’avant. - Incuber dans une solution d’anticorps primaire pendant une nuit à 4 °C. Diluer tous les anticorps 1 :1 000 dans un tampon bloquant.
REMARQUE : Les anticorps représentatifs de la coloration de la nucléocapside par HCoV, ainsi que les marqueurs de type de cellules épithéliales et les colorations du cytosquelette, sont énumérés ci-dessous (voir le tableau des matériaux pour obtenir des informations sur le fabricant et les numéros de catalogue).- Pour la coloration de l’antigène HCoV, utilisez des anticorps ciblant la nucléocapside du SRAS-CoV-2, la nucléocapside du MERS-CoV et la nucléocapside HCoV-NL63.
- Pour identifier les types de cellules épithéliales, utilisez des anticorps ciblant le marqueur caliciforme MUC5AC et le marqueur cellulaire cilié de type IV β-tubuline.
- Pour les marqueurs du cytosquelette, utiliser des anticorps dirigés contre la phalloïdine (se lie à l’actine F) et un marqueur d’adhésion des cellules épithéliales : EpCAM (CD326).
- Incuber dans une solution d’anticorps secondaire pendant 60 min à température ambiante ; Utilisez des colorants d’anticorps secondaires dilués 1 :1 000 dans un tampon de blocage.
- Une fois la coloration terminée, transférez la membrane sur une lame de verre à l’aide d’une spatule, orientez le transwell avec le côté apical vers la lame et ajoutez la solution de montage. Laisser reposer pendant 15 à 30 minutes avant d’appliquer le vernis à ongles transparent sur les bords.
- Acquisition d’images à l’aide d’un microscope confocal (pas de l’axe Z : 0,5 μm ; balayage séquentiel)1,16,17.
REMARQUE : Après la fixation des cultures dans du PFA à 4 % et le lavage avec du PBS, les cultures fixées peuvent être conservées à 4 °C pendant des semaines ou des mois avant la coloration et la préparation pour l’imagerie. Après la coloration et le montage des membranes, les échantillons peuvent être conservés à long terme (>2 ans) à 4 °C dans l’obscurité.
7. Collecte de protéines intracellulaires pour l’immunotransfert occidental ou d’ARN pour l’analyse RT-qPCR
- Prélever l’ASL comme décrit ci-dessus si l’on quantifie les titres viraux (section 2 du protocole).
- Déplacez le transwell sur une plaque propre à 24 puits, car le grattage de la membrane peut entraîner la rupture de l’insert.
- Pour l’analyse par transfert Western, prélever le lysat de protéines totales dans 125 μL de tampon RIPA (50 mM de Tris, pH 8, 150 mM de NaCl, 0,5 % de désoxycholate, 0,1 % de SDS, 1 % de NP40) complété par des inhibiteurs de protéase et des inhibiteurs de la phosphatase.
- Ajouter 125 μL de tampon RIPA dans le compartiment apical et incuber pendant 5 à 10 minutes.
- Grattez la membrane à l’aide d’une pointe de pipette P200 pour retirer les cellules restantes et prélevez tout le volume (grattez vigoureusement sur toute la surface de la membrane, puis pipetez de haut en bas plusieurs fois pour prélever l’échantillon entier).
- Incuber des échantillons de lysat de protéines sur de la glace pendant 10 minutes, puis centrifuger à vitesse maximale (20 000 × g) pendant 10 minutes à 4 °C.
- Mélanger le surnageant avec 4x tampon d’échantillon Laemmli avec du β-mercaptoéthanol (agent réducteur) selon les protocoles du fabricant.
- Faites bouillir des échantillons de protéines à 95 °C pendant 5 minutes, puis faites-les fonctionner en utilisant les protocoles traditionnels de transfert occidental 1,16,17.
- Pour la collecte de l’ARN total, utilisez un kit d’extraction d’ARN disponible dans le commerce de votre choix.
REMARQUE : Le compartiment apical des inserts transwell à 24 puits a un volume maximal de ~200 μL ; Ainsi, nous effectuons deux lavages séquentiels sur chaque culture pour atteindre le volume total recommandé. Les détails ci-dessous correspondent à la collecte recommandée d’échantillons d’ARN dans un volume total de 350 μL. - Ajouter 200 μL de tampon de lyse dans le compartiment apical du transwell infecté.
- Laisser reposer pendant 5 à 10 minutes, gratter les cellules restantes de la membrane à l’aide d’une pointe de pipette et recueillir tout le volume dans un tube de microcentrifugation étiqueté.
- Ajouter 150 μL de tampon de lyse supplémentaire dans le compartiment apical du transwell et pipeter de haut en bas avant de prélever dans le même tube de microcentrifugation.
- Extraire l’ARN selon le protocole du fabricant.
Résultats
Les figures représentatives sont partiellement adaptées des données que l’on peut trouver dans le manuscrit Otter et al.1. Les cultures nasales d’ALI provenant de quatre ou six donneurs ont été infectées par l’un des quatre HCoV (SRAS-CoV-2, MERS-CoV, HCoV-NL63 et HCoV-229E) selon les protocoles décrits ci-dessus, et les titres viraux moyens excrétés apicalement pour chaque virus sont représentés à la figure 1A. Alors que ces quatre HCoV se réplique...
Discussion
Les méthodes détaillées ici décrivent un système de culture épithéliale primaire dans lequel des cellules épithéliales nasales dérivées de patients sont cultivées à une interface air-liquide et appliquées à l’étude des interactions HCoV-hôte. Une fois différenciées, ces cultures nasales d’ALI récapitulent de nombreuses caractéristiques de l’épithélium nasal in vivo , y compris une population cellulaire hétérogène avec des cellules ciliées, caliciformes et basales représentées, ...
Déclarations de divulgation
Susan Weiss est membre du conseil consultatif scientifique d’Ocugen. Noam A. Cohen est consultant pour GSK, AstraZeneca, Novartis, Sanofi/Regeron et Oyster Point Pharmaceuticals et détient un brevet américain, « Therapy and Diagnostics for Respiratory Infection » (10 881 698 B2, WO20913112865), ainsi qu’un accord de licence avec GeneOne Life Sciences.
Remerciements
Cette étude bénéficie des sources de financement suivantes : National Institutes of Health (NIH) R01AI 169537 (S.R.W. et N.A.C.), NIH R01AI 140442 (S.R.W.), VA Merit Review CX001717 (N.A.C.), VA Merit Review BX005432 (S.R.W. et N.A.C.), Penn Center for Research on Coronaviruses and other Emerging Pathogens (S.R.W.), Laffey-McHugh Foundation (S.R.W. et N.A.C.), T32 AI055400 (CJO), T32 AI007324 (AF).
matériels
| Name | Company | Catalog Number | Comments |
| Alexa Fluor secondary antibodies (488, 594, 647) | Invitrogen | Various | |
| BSA (bovine serum albumin) | Sigma-Aldrich | A7906 | |
| cOmplete mini EDTA-free protease inhibitor | Roche | 11836170001 | |
| Cytotoxicity detection kit | Roche | 11644793001 | |
| DMEM (Dulbecco's Modified Eagle Media) | Gibco | 11965-084 | |
| DPBS (Dulbecco's Phosphate Buffered Saline) | Gibco | 14190136 | |
| DPBS + calcium + magnesium | Gibco | 14040-117 | |
| Endohm-6G measurement chamber | World Precision Instruments | ENDOHM-6G | |
| Epithelial cell adhesion marker (EpCAM; CD326) | eBiosciences | 14-9326-82 | |
| Epithelial Volt/Ohm (TEER) Meter (EVOM) | World Precision Instruments | 300523 | |
| FBS (Fetal Bovine Serum) | HyClone | SH30071.03 | |
| FV10-ASW software for imaging | Olympus | Version 4.02 | |
| HCoV-NL63 (Human coronavirus, NL63) | BEI Resources | NR-470 | |
| HCoV-NL63 nucleocapsid antibody | Sino Biological | 40641-V07E | |
| Hoescht stain | Thermo Fisher | H3570 | |
| Laemmli sample buffer (4x) | BIO-RAD | 1610747 | |
| LLC-MK2 cells | ATCC | CCL-7 | To titrate HCoV-NL63 |
| MERS-CoV (Human coronavirus, Middle East Respiratory Syndrome Coronavirus (MERS-CoV), EMC/2012) | BEI Resources | NR-44260 | |
| MERS-CoV nucleocapsid antibody | Sino Biological | 40068-MM10 | |
| MUC5AC antibody | Sigma-Aldrich | AMAB91539 | |
| Olympus Fluoview confocal microscope | Olympus | FV1000 | |
| Phalloidin-iFluor 647 stain | Abcam | ab176759 | |
| PhosStop easy pack (phosphatase inhibitors) | Roche | PHOSS-RO | |
| Plate reader | Perkin Elmer | HH34000000 | Any plate reader or ELISA reader is sufficient; must be able to read absorbance at 492 nm |
| RIPA buffer (50 mM Tris pH 8; 150 mM NaCl; 0.5% deoxycholate; 0.1% SDS; 1% NP40) | Thermo Fisher | 89990 | Can prep in-house or purchase |
| RNeasy Plus Kit | Qiagen | 74134 | |
| SARS-CoV-2 (SARS-Related Coronavirus 2, Isolate USA-WA1/2020) | BEI Resources | NR-52281 | |
| SARS-CoV-2 nucleocapsid antibody | Genetex | GTX135357 | |
| Triton-X 100 | Fisher Scientific | BP151100 | |
| Type IV β- tubulin antibody | Abcam | ab11315 | |
| VeroCCL81 cells | ATCC | CCL-81 | To titrate MERS-CoV |
| VeroE6 cells | ATCC | CRL-1586 | To titrate SARS-CoV-2 |
Références
- Otter, C. J., et al. Infection of primary nasal epithelial cells differentiates among lethal and seasonal human coronaviruses. Proceedings of the National Academy of Sciences of the United States of America. 120 (15), 2218083120 (2023).
- Fehr, A., Perlman, S. Coronaviruses: An overview of their replication and pathogenesis. Methods in Molecular Biology. 1282, 1-23 (2015).
- Gaunt, E. R., Hardie, A., Claas, E. C. J., Simmonds, P., Templeton, K. E. Epidemiology and clinical presentations of the four human coronaviruses 229E, HKU1, NL63, and OC43 detected over 3 years using a novel multiplex real-time PCR method. Journal of Clinical Microbiology. 48 (8), 2940-2947 (2010).
- Kesheh, M. M., Hosseini, P., Soltani, S., Zandi, M. An overview on the seven pathogenic human coronaviruses. Reviews in Medical Virology. 32 (2), 2282 (2022).
- MERS-CoV Worldwide Overview. European Centre for Disease Prevention and Control Available from: https://www.ecdc.europa.eu/en/middle-east-respiratory-syndrome-coronavirus-mers-cov-situation-update (2022)
- Cao, Y., Liu, X., Xiong, L., Cai, K. Imaging and clinical features of patients with 2019 novel coronavirus SARS-CoV-2: A systematic review and meta-analysis. Journal of Medical Virology. 92 (9), 1449-1459 (2020).
- Vareille, M., Kieninger, E., Edwards, M. R., Regamey, N. The airway epithelium: Soldier in the fight against respiratory viruses. Clinical Microbiology Reviews. 24 (1), 210-229 (2011).
- Farzal, Z., et al. Comparative study of simulated nebulized and spray particle deposition in chronic rhinosinusitis patients. International Forum of Allergy and Rhinology. 9 (7), 746-758 (2019).
- Gaeckle, N. T., Pragman, A. A., Pendleton, K. M., Baldomero, A. K., Criner, G. J. The oral-lung axis: The impact of oral health on lung health. Respiratory Care. 65 (8), 1211-1220 (2020).
- Hou, Y., et al. SARS-CoV-2 reverse genetics reveals a variable infection gradient in the respiratory tract. Cell. 182, 429-446 (2020).
- Hariri, B. M., Cohen, N. A. New insights into upper airway innate immunity. American Journal of Rhinology and Allergy. 30 (5), 319-323 (2016).
- Hiemstra, P. S., McCray, P. B., Bals, R. The innate immune function of airway epithelial cells in inflammatory lung disease. European Respiratory Journal. 45 (4), 1150-1162 (2015).
- Hatton, C. F., et al. Delayed induction of type I and III interferons mediates nasal epithelial cell permissiveness to SARS-CoV-2. Nature Communications. 12 (1), 7092 (2021).
- Sungnak, W., et al. SARS-CoV-2 entry factors are highly expressed in nasal epithelial cells together with innate immune genes. Nature Medicine. 26 (5), 681-687 (2020).
- Li, Y., et al. SARS-CoV-2 induces double-stranded RNA-mediated innate immune responses in respiratory epithelial-derived cells and cardiomyocytes. Proceedings of the National Academy of Sciences of the United States of America. 118 (16), 2022643118 (2021).
- Comar, C. E., et al. MERS-CoV endoribonuclease and accessory proteins jointly evade host innate immunity during infection of lung and nasal epithelial cells. Proceedings of the National Academy of Sciences of the United States of America. 119 (21), 2123208119 (2022).
- Lee, R. J., et al. Bacterial D-amino acids suppress sinonasal innate immunity through sweet taste receptors in solitary chemosensory cells. Science Signaling. 10 (495), (2017).
- Brewington, J. J., et al. Brushed nasal epithelial cells are a surrogate for bronchial epithelial CFTR studies. JCI Insight. 3 (13), 99385 (2018).
- Comer, D. M., Elborn, J. S., Ennis, M. Comparison of nasal and bronchial epithelial cells obtained from patients with COPD. PLoS One. 7 (3), e32924 (2012).
- Vanders, R. L., Hsu, A., Gibson, P. G., Murphy, V. E., Wark, P. A. B. Nasal epithelial cells to assess in vitro immune responses to respiratory virus infection in pregnant women with asthma. Respiratory Research. 20 (1), 259 (2019).
- Lee, R. J., et al. Fungal aflatoxins reduce respiratory mucosal ciliary function. Scientific Reports. 6, 33221 (2016).
- Patel, N. N., et al. Fungal extracts stimulate solitary chemosensory cell expansion in noninvasive fungal rhinosinusitis. International Forum of Allergy and Rhinology. 9 (7), 730-737 (2019).
- Baer, A., Kehn-Hall, K. Viral concentration determination through plaque assays: Using traditional and novel overlay systems. Journal of Visualized Experiments. 93 (93), e52065 (2014).
- Robinot, R., et al. SARS-CoV-2 infection induces the dedifferentiation of multiciliated cells and impairs mucociliary clearance. Nature Communications. 12 (1), 4354 (2021).
- Whitsett, J. A. Airway epithelial differentiation and mucociliary clearance. Annals of the American Thoracic Society. 15, S143-S148 (2018).
- Gao, N., Raduka, A., Rezaee, F. Respiratory syncytial virus disrupts the airway epithelial barrier by decreasing cortactin and destabilizing F-actin. Journal of Cell Science. 135 (16), 259871 (2022).
- Schmidt, H., et al. IL-13 impairs tight junctions in airway epithelia. International Journal of Molecular Sciences. 20 (13), 3222 (2019).
- Huang, Z. Q., et al. Interleukin-13 alters tight junction proteins expression thereby compromising barrier function and dampens rhinovirus induced immune responses in nasal epithelium. Frontiers in Cell and Developmental Biology. 8, 572749 (2020).
- Saatian, B., et al. Interleukin-4 and interleukin-13 cause barrier dysfunction in human airway epithelial cells. Tissue Barriers. 1 (2), e24333 (2013).
- Coles, J. L., et al. A revised protocol for culture of airway epithelial cells as a diagnostic tool for primary ciliary dyskinesia. Journal of Clinical Medicine. 9 (11), 3753 (2020).
- Baldassi, D., Gabold, B., Merkel, O. M. Air−liquid interface cultures of the healthy and diseased human respiratory tract: Promises, challenges, and future directions. Advanced NanoBiomed Research. 1 (6), 2000111 (2021).
- Seibold, M. A. Interleukin-13 stimulation reveals the cellular and functional plasticity of the airway epithelium. Annals of the American Thoracic Society. 15, S98-S106 (2018).
- Morrison, C. B., et al. SARS-CoV-2 infection of airway cells causes intense viral and cell shedding, two spreading mechanisms affected by IL-13. Proceedings of the National Academy of Sciences of the United States of America. 119 (16), 2119680119 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon