需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
在气液界面上生长的原代鼻上皮细胞的感染,以表征人类冠状病毒与宿主的相互作用
摘要
鼻上皮是所有呼吸道病原体遇到的主要屏障部位。在这里,我们概述了使用作为气液界面 (ALI) 培养物生长的原代鼻上皮细胞来表征生理相关系统中人类冠状病毒与宿主相互作用的方法。
摘要
在过去20年中,三种高致病性人类冠状病毒(HCoV)——SARS-CoV(2002年)、MERS-CoV(2012年)和SARS-CoV-2(2019年)——已经出现并引发了重大的公共卫生危机。另外四种HCoV每年导致很大一部分普通感冒病例(HCoV-NL63、-229E、-OC43和-HKU1),这凸显了在生理相关系统中研究这些病毒的重要性。HCoV进入呼吸道并在鼻上皮中建立感染,鼻上皮是所有呼吸道病原体遇到的主要部位。我们使用原代鼻上皮培养系统,其中患者来源的鼻腔样本在气液界面 (ALI) 生长,以研究这个重要前哨位点的宿主-病原体相互作用。这些培养物概括了 体内 气道的许多特征,包括存在的细胞类型、纤毛功能和粘液产生。我们描述了表征 HCoV 感染后鼻腔 ALI 培养物中病毒复制、宿主细胞嗜性、病毒诱导的细胞毒性和先天免疫诱导的方法,以最近比较致死性和季节性 HCoV 的工作为例1。对鼻子中宿主-病原体相互作用的了解的增加有可能为针对HCoV和其他呼吸道病毒的抗病毒疗法提供新的靶点,这些病毒可能会在未来出现。
引言
迄今为止,已发现七种人类冠状病毒 (HCoV),并引起一系列呼吸道疾病2。常见或季节性 HCoV(HCoV-NL63、-229E、-OC43 和 -HKU1)通常与上呼吸道病变相关,每年估计引起 10%-30% 的普通感冒病例。虽然这是与常见 HCoV 相关的典型临床表型,但这些病毒可在高危人群中引起更严重的下呼吸道疾病,包括儿童、老年人和免疫功能低下个体 3,4。在过去20年中,出现了三种致病性HCoV并造成了重大突发公共卫生事件,包括严重急性呼吸系统综合症(SARS)-CoV、中东呼吸系统综合症(MERS)-CoV和SARS-CoV-2。致命的HCoV与更严重的呼吸道病变有关,中东呼吸综合征冠状病毒病例的病死率为>34%(自2012年出现以来,2500多例病例中有894例死亡)5,6清楚地说明了这一点。值得注意的是,致命的HCoV还会引起一系列呼吸道疾病,从无症状感染到致命性肺炎,正如正在进行的COVID-19大流行所见7。
与其他呼吸道病原体一样,HCoV 进入呼吸道并在鼻上皮中建立生产性感染8。扩散到下气道被认为与从口腔/鼻腔到肺部的误吸有关,其中 HCoV 引起更显着的下呼吸道病变 9,10,11。因此,鼻子是病毒进入的初始门户,并且是感染的主要屏障,其强大的粘液纤毛清除机制和独特的先天免疫机制旨在防止病毒进一步传播到下气道12,13。例如,据报道,鼻上皮细胞表达高于平均水平的抗病毒干扰素和干扰素刺激基因的基础水平,这表明鼻细胞可能为对呼吸道病毒的早期反应做好准备14,15,16。
我们之前曾利用在气液界面 (ALI) 生长的患者来源的原代鼻上皮细胞来模拟 HCoV 感染开始的鼻子中的 HCoV 与宿主的相互作用。鼻腔 ALI 培养物对致病性(SARS-CoV-2 和 MERS-CoV)和常见 HCoV(HCoV-NL63 和 HCoV-229E)均有效,并且与传统的气道上皮细胞系(如 A549(一种肺腺癌细胞系))相比具有各种优势16,17。分化后,鼻ALI培养物包含异质性细胞群,并表现出体内鼻上皮预期的许多功能,例如粘膜纤毛清除机制18。与下气道培养系统(如人支气管上皮细胞,HBEC)相比,鼻细胞也具有优势,因为与使用支气管镜检查等技术获得HBECs相比,通过细胞学刷取鼻上皮细胞的侵入性要小得多19,20,21。
本文描述了利用这种鼻ALI培养系统来表征鼻上皮中HCoV-宿主相互作用的方法。我们在最近发表的作品中应用了这些方法来比较 SARS-CoV-2、MERS-CoV、HCoV-NL63 和 HCoV-229E1、16、17。尽管这些方法和代表性结果强调了该鼻细胞模型中HCoV的研究,但该系统对其他HCoV以及其他呼吸道病原体具有高度适应性。此外,这些方法可以更广泛地应用于其他ALI培养系统,以研究病毒复制和细胞嗜性,以及感染后的细胞毒性和先天免疫诱导。
研究方案
鼻腔标本的使用得到了宾夕法尼亚大学机构审查委员会(协议#800614)和费城弗吉尼亚州机构审查委员会(协议#00781)的批准。
1.鼻腔ALI培养物感染
注:临床标本的采集以及鼻腔ALI培养物的生长和分化不在本文的讨论范围之内。培养原代鼻上皮细胞的具体方法可以在最近发表的利用这些培养物的著作中找到 18,22,23。如果需要,以下方案还可以应用于市售的鼻上皮ALI培养物。下面详述的方案和体积适用于 24 孔板跨孔插入物(直径 6.5 mm,膜表面积 0.33 cm2)。如果使用在较大的跨孔(即 12 孔板,直径 12 mm,表面积 1.12 cm2)上生长的 ALI 培养物,则按比例调整体积以反映跨孔大小。
- 感染前一天:
- 用磷酸盐缓冲盐水(PBS)在顶端洗涤ALI培养物3次(加入~200μL加热的PBS,置于37°C培养箱中5分钟,吸出PBS,并重复)。
- 更换基础培养基 (500 μL)。
- 让培养物在感染过夜的温度下平衡(即,如果在33°C下感染,则在PBS洗涤后将培养物置于33°C培养箱中)。
注意:据报道,与普通感冒相关的HCoV,例如HCoV-229E和HCoV-NL63,在33°C下复制效率更高。 此外, 体内 鼻上皮的温度为33°C(这与肺的温度不同,肺的温度为37°C)。
- 根据需要在无血清 Dulbecco 改良的 Eagle 培养基 (DMEM) 中稀释病毒,以在 50 μL 的总接种体积中达到所需的感染多重性 (MOI)。
注意:感染通常在 MOI = 5(高 MOI)时进行;然而,MOI = 0.5(低 MOI)的感染也被用于 SARS-CoV-2 和普通感冒相关 HCoV,这些导致病毒峰值滴度相当,但动力学可变(任何一种 MOI 都是可以接受的)。 - 在顶端加入接种物,并将培养物放回培养箱中1小时。
- 感染期间每 15 分钟轻轻摇晃一次平板(双手牢牢握住平板,前后左右摇晃以确保病毒接种物的均匀吸附)。
- 孵育1小时后,吸出病毒接种物,并用PBS洗涤每个感染的培养物3次,以确保去除病毒接种物(每次洗涤,加入200μLPBS,孵育5分钟,并吸出或用移液管除去)。
- 如果需要,收集第三次PBS洗涤液以确认输入病毒的充分去除。
- 在感染期间,每 72 小时用感染的 ALI 上的新鲜培养基替换基础培养基。
2. 顶面液(ASL)的收集和脱落病毒的滴定
- 在感染后的预定时间点,向每个感染的transwell的顶端腔中加入200μLPBS。
注:相关时间点因感兴趣的HCoV而异,范围为感染后24小时至192小时(有关各种HCoV的病毒复制数据,请参阅代表性结果部分)。 - 上下移液PBS5次,以确保最大限度地收集顶端脱落的病毒,并将整个体积收集到微量离心管中(这是ASL样品)。
注意:除了ALI培养物顶端分泌的粘液和其他产物外,ASL还包括脱落的病毒颗粒。 - 通过标准病毒斑块测定(连续稀释含病毒的样品以量化病毒颗粒的浓度)定量ASL中的传染性病毒。
注意:用于斑块测定的细胞类型和孵育期取决于所使用的病毒:SARS-CoV-2(VeroE6细胞);MERS-CoV(VeroCCL81细胞);HCoV-NL63(LLC-MK2细胞);HCoV-229E(Huh7细胞)。关于如何进行病毒斑块测定的细节超出了本手稿的范围,但之前已在《可视化实验杂志》(JoVE)出版物24中进行了详细介绍。 - 如果需要,在感染后的不同时间收集基础培养基,以确认不存在基础释放的病毒。HCoV 通常从鼻上皮细胞的顶端释放,但 通过 未稀释的基础培养基的斑块测定来证实这一点。
- 将ASL样品储存在-80°C,如果在收集当天不会通过噬菌斑测定进行定量。
3. 细胞内病毒的定量
- 收集 ASL 样品后,将每个转孔移入预装有 500 μL 含有 2% 胎牛血清 (FBS) 的 DMEM 的干净 24 孔板中。
注:含有 2% FBS 的 DMEM 用于在随后的冻融循环中稳定病毒。 - 用PBS将每个transwell洗涤3次,以确保完全去除顶端脱落的病毒。
- 吸出除去最终的PBS洗涤液后,向顶端隔室中加入100μL含有2%FBS的DMEM。
- 将含有顶端和基础培养基的转孔板移入-80°C冰箱中,并完成三个连续的冻融循环以裂解细胞。
- 在最后的冻融循环后,将顶端(100μL)和基础(500μL)培养基汇集到干净的试管中。
- 在4°C下以500× g 离心10分钟以沉淀任何细胞碎片。
- 收集上清液。这是 通过标准噬菌斑测定滴定的细胞内病毒样品。
注意:相对于 ASL 收集,在收集过程中发生三倍稀释;将ASL样品收集在200μL的PBS中,而细胞内病毒样品收集到总体积为600μL的样品中。
4. 跨上皮电阻(TEER)测量
注:对于TEER测量,应使用补充有钙和镁(PBS + Ca 2+/Mg2+)的PBS。使用设置为以欧姆为单位读取的上皮伏特/欧姆表(参见材料表)。
- 根据制造商的说明对 EVOM 仪器进行清洁、平衡和空白;使用"空"Transwell,不添加鼻细胞进行消隐。记录空白TEER测量值。
注意:如果使用多种病毒,则必须在不同条件下严格清洁 EVOM 仪器,以避免交叉污染(用 70% 乙醇清洗,然后用去离子水清洗就足够了)。 - 将每个受感染的跨孔移入预先标记的干净的 24 孔板中,用 500 μL PBS + Ca 2+/Mg2+ 基底,以从跨孔中洗涤残留的基础培养基。
- 向每个转孔的顶端隔室中加入 200 μL PBS + Ca 2+/Mg2+。
- 向 Endohm-6 测量室中加入 1 mL PBS + Ca 2+/Mg2+。
- 将每个transwell移入Endohm-6测量室,并更换室的盖子,使顶端电极停留在顶端室的200μLP的PBS中;基底电极内置在Endohm-6腔室的底部。
- 让EVOM读数稳定下来,并记录原始TEER测量值。
- 如果需要滴定度,在进行TEER测量后,如上所述收集ASL样品(收集200μLPBS + Ca 2 + / Mg2 +,添加用于TEER测量)。
注意:ASL 样本采集会在上皮屏障中引起微撕裂,这可能会混淆 TEER 读数,因此必须在 TEER 测量后收集 ASL。此外,在TEER读数之前,不得立即更换基础培养基,因为这也可能影响TEER值。 - 要将原始TEER读数转换为以Ohms/cm2为单位的最终测量值,请减去空白TEER值,然后使用公式(1)将该值乘以transwell膜的表面积:
TEER = [TEER 读数 - 空白 TEER 值] ×(transwell 表面积) (1) - 对于 HCoV,感染后每 24 小时或 48 小时评估一次 TEER;TEER变化的动力学通常因病毒而异,需要在不同的时间点进行故障排除。
- 测量TEER时,始终包括模拟感染的培养物,并在每个时间点进行评估(阴性对照)。
注:对于模拟培养物,TEER 测量值应保持稳定,或者在培养物分化完成后可能较基线略有增加。膜支架的表面积将因 transwell 的尺寸和制造商而异;24 孔转孔的表面积通常为 0.33 cm2。
5. 通过乳酸脱氢酶 (LDH) 测定法测量感染期间的细胞毒性
注:在这项工作中,使用市售的细胞毒性检测试剂盒定量 ASL 样品中的 LDH 含量。基础培养基中的LDH信号通常低于检测限,并且通常比HCoV感染培养物的ASL样品中定量的LDH重现性差。
- 准备LDH测定所需的其他对照品。
- 背景控制:使用PBS(如果以这种方式收集ASL样本,则使用含有钙和镁的PBS)。
- 阳性对照(上限值):用Triton X-100在顶端处理ALI。收集Triton对照孔(通常在每个时间点使用三种ALI培养物)。
- 将 200 μL 的 2% Triton X-100 的 PBS 溶液直接加入 transwell 的顶端隔室。
- 孵育 10-15 分钟,让细胞完全裂解。
- 将整个体积收集为 Triton 天花板样本。
- 阴性对照(低对照/基线 LDH 释放):从与感染培养物来源于同一供体的模拟感染 ALI 培养物中收集 ASL。
- 按照上述 ASL 收集程序收集阴性对照模拟 ASL。
注意:对于所有时间点,相同的转孔可用于此阴性对照,而对于Triton对照,每个时间点都需要新鲜的转孔。
- 按照上述 ASL 收集程序收集阴性对照模拟 ASL。
- 除了每个 ASL 样品的 LDH 读数外,为了能够定量脱落的病毒,加载光学透明的平底黑色 96 孔板,如下所示:
- 使用 45 μL 样品和 55 μL PBS(总体积 100 μL)稀释 PBS 中的所有样品。
- 以相同的方式处理Triton阳性对照和模拟背景对照样品。
注:该稀释度允许每个实验样品(45μL x 3)一式三份上样,并有足够的残留ASL体积用于 通过斑块测定滴定。 - 一式三份加载 LDH 板:Triton 天花板、模拟背景对照、PBS 对照和实验样品。
- 按照制造商的指示制备反应混合物(染料溶液+催化剂)。
- 向每个孔中加入 100 μL 反应混合物,并将板在室温下避光孵育 20 分钟。
- 20分钟后,测量492nm处的吸光度。
- 使用公式(2)计算相对于Triton上限值的细胞毒性百分比。
细胞毒性 (%)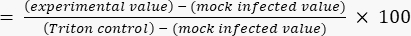 (2)
(2)
6. 用于免疫荧光 (IF) 成像的鼻腔 ALI 培养物的制备
- 将transwell移入新鲜的24孔板中,并用PBS进行3次顶端洗涤(如果滴度下降,则收集第一次PBS洗涤作为ASL;然后,再进行两次PBS洗涤以去除可能影响IF质量的过量脱落病毒)
- 在最终的PBS洗涤后,在4%PFA中覆盖Transwell的顶端和基底。
- 孵育 30 分钟以固定在 4% PFA 中,然后取出并用 PBS 洗涤 3 次。
- 使用锋利的剃须刀片或剪刀切除含有细胞的transwell支持物。
- 为了增加每个transwell的IF靶标数量,将每个膜切成两半,并用不同的抗体组合对每一半进行染色。
- 用 0.2% Triton X-100 在 PBS 中透化 10 分钟。
- 在室温下用 10% 正常驴血清和 1% BSA 在 PBST (PBS + 0.2% Triton X-100) 中封闭 60 分钟。
注意:从这一步开始,保护样品免受光照。 - 在4°C的一抗溶液中孵育过夜。 在封闭缓冲液中以 1:1,000 的比例稀释所有抗体。
注:下面列出了用于 HCoV 核衣壳染色的代表性抗体,以及上皮细胞类型标志物和细胞骨架染色剂(有关制造商信息和目录号,请参阅 材料表 )。- 对于 HCoV 抗原染色,使用靶向 SARS-CoV-2 核衣壳、MERS-CoV 核衣壳和 HCoV-NL63 核衣壳的抗体。
- 要鉴定上皮细胞类型,请使用靶向杯状细胞标志物 MUC5AC 和纤毛细胞标志物 IV 型 β-微管蛋白的抗体。
- 对于细胞骨架标志物,使用针对鬼笔环肽(结合 F-肌动蛋白)和上皮细胞粘附标志物的抗体:EpCAM (CD326)。
- 在室温下在二抗溶液中孵育60分钟;使用在封闭缓冲液中以 1:1,000 稀释的二抗染料。
- 染色完成后,用刮刀将膜转移到载玻片上,将顶端朝向载玻片的transwell定向,并加入封片溶液。静置 15-30 分钟,然后在边缘涂抹透明指甲油。
- 使用共聚焦显微镜(Z轴步长:0.5μm;顺序扫描)1,16,17获取图像。
注:在4%PFA中固定培养物并用PBS洗涤后,固定培养物可以在4°C下储存数周至数月,然后进行染色和成像准备。染色和膜封片后,样品可以在4°C下在黑暗中长期储存(>2年)。
7. 收集用于蛋白质免疫印迹的细胞内蛋白或用于RT-qPCR分析的RNA
- 如果定量病毒滴度,则如上所述收集 ASL(方案第 2 节)。
- 将transwell移至干净的24孔板上,因为刮擦膜会导致插入物断裂。
- 对于蛋白质印迹分析,在补充有蛋白酶抑制剂和磷酸酶抑制剂的 125 μL RIPA 缓冲液(50 mM Tris,pH 8,150 mM NaCl,0.5% 脱氧胆酸盐,0.1% SDS,1% NP40)中收集总蛋白裂解物。
- 向顶端隔室中加入 125 μL RIPA 缓冲液,孵育 5-10 分钟。
- 使用P200移液器吸头刮擦膜以去除任何剩余的附着细胞,并收集整个体积(在膜的整个表面上用力刮擦,然后上下多次移液以收集整个样品)。
- 将蛋白质裂解物样品在冰上孵育10分钟,然后在4°C下以最大速度(20,000× g)离心10分钟。
- 根据制造商方案,将上清液与4x Laemmli样品缓冲液与β-巯基乙醇(还原剂)混合。
- 将蛋白质样品在95°C下煮沸5分钟,然后使用传统的蛋白质印迹方案1,16,17运行。
- 对于总RNA的收集,请使用市售的RNA提取试剂盒。
注:24孔transwell插入物的顶端隔室的最大体积为~200μL;因此,我们对每种培养物进行两次连续洗涤,以达到总推荐体积。以下详细信息对应于总体积为 350 μL 的推荐 RNA 样品收集。 - 将 200 μL 裂解缓冲液加入受感染的 transwell 的顶端区室中。
- 静置5-10分钟,使用移液器吸头从膜上刮下任何剩余的细胞,并将整个体积收集到标记的微量离心管中。
- 向transwell的顶端隔室中加入150μL额外的裂解缓冲液,并在收集到同一微量离心管之前上下移液。
- 根据制造商的方案提取RNA。
结果
代表性数字部分改编自手稿 Otter 等人 1 中的数据。根据上述方案,来自四个或六个供体的鼻腔 ALI 培养物感染了四种 HCoV(SARS-CoV-2、MERS-CoV、HCoV-NL63 和 HCoV-229E)中的一种,每种病毒的平均顶端脱落病毒滴度如图 1A 所示。虽然所有这四种 HCoV 在鼻腔 ALI 培养物中都能有效复制,但 SARS-CoV-2 和 HCoV-229E 的复制效率最高。请注意,这些是平均病毒滴度,并且最近?...
讨论
这里详述的方法描述了一种原代上皮培养系统,其中患者来源的鼻上皮细胞在气液界面上生长,并应用于HCoV-宿主相互作用的研究。一旦分化,这些鼻 ALI 培养物概括了 体内 鼻上皮的许多特征,包括具有纤毛细胞、杯状细胞和基底细胞的异质性细胞群,以及完整的粘液纤毛功能,纤毛和粘液分泌物跳动强劲。与传统的呼吸道上皮细胞系相比,这种异质细胞群是该培养系统的一个关键优势,?...
披露声明
Susan Weiss 是 Ocugen 的科学顾问委员会成员。Noam A. Cohen 为 GSK、阿斯利康、诺华、赛诺菲/Regeron 和 Oyster Point Pharmaceuticals 提供咨询,并拥有美国专利"呼吸道感染的治疗和诊断"(10,881,698 B2,WO20913112865),并与 GeneOne Life Sciences 签订了许可协议。
致谢
本研究的资金来源如下:美国国立卫生研究院 (NIH) R01AI 169537(SRW 和 N.A.C.)、NIH R01AI 140442 (S.R.W.)、VA Merit Review CX001717 (N.A.C.)、VA Merit Review BX005432(S.R.W. 和 N.A.C.)、宾夕法尼亚大学冠状病毒和其他新兴病原体研究中心 (S.R.W.)、Laffey-McHugh 基金会(S.R.W. 和 N.A.C.), T32 AI055400 (CJO)、T32 AI007324 (AF)。
材料
| Name | Company | Catalog Number | Comments |
| Alexa Fluor secondary antibodies (488, 594, 647) | Invitrogen | Various | |
| BSA (bovine serum albumin) | Sigma-Aldrich | A7906 | |
| cOmplete mini EDTA-free protease inhibitor | Roche | 11836170001 | |
| Cytotoxicity detection kit | Roche | 11644793001 | |
| DMEM (Dulbecco's Modified Eagle Media) | Gibco | 11965-084 | |
| DPBS (Dulbecco's Phosphate Buffered Saline) | Gibco | 14190136 | |
| DPBS + calcium + magnesium | Gibco | 14040-117 | |
| Endohm-6G measurement chamber | World Precision Instruments | ENDOHM-6G | |
| Epithelial cell adhesion marker (EpCAM; CD326) | eBiosciences | 14-9326-82 | |
| Epithelial Volt/Ohm (TEER) Meter (EVOM) | World Precision Instruments | 300523 | |
| FBS (Fetal Bovine Serum) | HyClone | SH30071.03 | |
| FV10-ASW software for imaging | Olympus | Version 4.02 | |
| HCoV-NL63 (Human coronavirus, NL63) | BEI Resources | NR-470 | |
| HCoV-NL63 nucleocapsid antibody | Sino Biological | 40641-V07E | |
| Hoescht stain | Thermo Fisher | H3570 | |
| Laemmli sample buffer (4x) | BIO-RAD | 1610747 | |
| LLC-MK2 cells | ATCC | CCL-7 | To titrate HCoV-NL63 |
| MERS-CoV (Human coronavirus, Middle East Respiratory Syndrome Coronavirus (MERS-CoV), EMC/2012) | BEI Resources | NR-44260 | |
| MERS-CoV nucleocapsid antibody | Sino Biological | 40068-MM10 | |
| MUC5AC antibody | Sigma-Aldrich | AMAB91539 | |
| Olympus Fluoview confocal microscope | Olympus | FV1000 | |
| Phalloidin-iFluor 647 stain | Abcam | ab176759 | |
| PhosStop easy pack (phosphatase inhibitors) | Roche | PHOSS-RO | |
| Plate reader | Perkin Elmer | HH34000000 | Any plate reader or ELISA reader is sufficient; must be able to read absorbance at 492 nm |
| RIPA buffer (50 mM Tris pH 8; 150 mM NaCl; 0.5% deoxycholate; 0.1% SDS; 1% NP40) | Thermo Fisher | 89990 | Can prep in-house or purchase |
| RNeasy Plus Kit | Qiagen | 74134 | |
| SARS-CoV-2 (SARS-Related Coronavirus 2, Isolate USA-WA1/2020) | BEI Resources | NR-52281 | |
| SARS-CoV-2 nucleocapsid antibody | Genetex | GTX135357 | |
| Triton-X 100 | Fisher Scientific | BP151100 | |
| Type IV β- tubulin antibody | Abcam | ab11315 | |
| VeroCCL81 cells | ATCC | CCL-81 | To titrate MERS-CoV |
| VeroE6 cells | ATCC | CRL-1586 | To titrate SARS-CoV-2 |
参考文献
- Otter, C. J., et al. Infection of primary nasal epithelial cells differentiates among lethal and seasonal human coronaviruses. Proceedings of the National Academy of Sciences of the United States of America. 120 (15), 2218083120 (2023).
- Fehr, A., Perlman, S. Coronaviruses: An overview of their replication and pathogenesis. Methods in Molecular Biology. 1282, 1-23 (2015).
- Gaunt, E. R., Hardie, A., Claas, E. C. J., Simmonds, P., Templeton, K. E. Epidemiology and clinical presentations of the four human coronaviruses 229E, HKU1, NL63, and OC43 detected over 3 years using a novel multiplex real-time PCR method. Journal of Clinical Microbiology. 48 (8), 2940-2947 (2010).
- Kesheh, M. M., Hosseini, P., Soltani, S., Zandi, M. An overview on the seven pathogenic human coronaviruses. Reviews in Medical Virology. 32 (2), 2282 (2022).
- MERS-CoV Worldwide Overview. European Centre for Disease Prevention and Control Available from: https://www.ecdc.europa.eu/en/middle-east-respiratory-syndrome-coronavirus-mers-cov-situation-update (2022)
- Cao, Y., Liu, X., Xiong, L., Cai, K. Imaging and clinical features of patients with 2019 novel coronavirus SARS-CoV-2: A systematic review and meta-analysis. Journal of Medical Virology. 92 (9), 1449-1459 (2020).
- Vareille, M., Kieninger, E., Edwards, M. R., Regamey, N. The airway epithelium: Soldier in the fight against respiratory viruses. Clinical Microbiology Reviews. 24 (1), 210-229 (2011).
- Farzal, Z., et al. Comparative study of simulated nebulized and spray particle deposition in chronic rhinosinusitis patients. International Forum of Allergy and Rhinology. 9 (7), 746-758 (2019).
- Gaeckle, N. T., Pragman, A. A., Pendleton, K. M., Baldomero, A. K., Criner, G. J. The oral-lung axis: The impact of oral health on lung health. Respiratory Care. 65 (8), 1211-1220 (2020).
- Hou, Y., et al. SARS-CoV-2 reverse genetics reveals a variable infection gradient in the respiratory tract. Cell. 182, 429-446 (2020).
- Hariri, B. M., Cohen, N. A. New insights into upper airway innate immunity. American Journal of Rhinology and Allergy. 30 (5), 319-323 (2016).
- Hiemstra, P. S., McCray, P. B., Bals, R. The innate immune function of airway epithelial cells in inflammatory lung disease. European Respiratory Journal. 45 (4), 1150-1162 (2015).
- Hatton, C. F., et al. Delayed induction of type I and III interferons mediates nasal epithelial cell permissiveness to SARS-CoV-2. Nature Communications. 12 (1), 7092 (2021).
- Sungnak, W., et al. SARS-CoV-2 entry factors are highly expressed in nasal epithelial cells together with innate immune genes. Nature Medicine. 26 (5), 681-687 (2020).
- Li, Y., et al. SARS-CoV-2 induces double-stranded RNA-mediated innate immune responses in respiratory epithelial-derived cells and cardiomyocytes. Proceedings of the National Academy of Sciences of the United States of America. 118 (16), 2022643118 (2021).
- Comar, C. E., et al. MERS-CoV endoribonuclease and accessory proteins jointly evade host innate immunity during infection of lung and nasal epithelial cells. Proceedings of the National Academy of Sciences of the United States of America. 119 (21), 2123208119 (2022).
- Lee, R. J., et al. Bacterial D-amino acids suppress sinonasal innate immunity through sweet taste receptors in solitary chemosensory cells. Science Signaling. 10 (495), (2017).
- Brewington, J. J., et al. Brushed nasal epithelial cells are a surrogate for bronchial epithelial CFTR studies. JCI Insight. 3 (13), 99385 (2018).
- Comer, D. M., Elborn, J. S., Ennis, M. Comparison of nasal and bronchial epithelial cells obtained from patients with COPD. PLoS One. 7 (3), e32924 (2012).
- Vanders, R. L., Hsu, A., Gibson, P. G., Murphy, V. E., Wark, P. A. B. Nasal epithelial cells to assess in vitro immune responses to respiratory virus infection in pregnant women with asthma. Respiratory Research. 20 (1), 259 (2019).
- Lee, R. J., et al. Fungal aflatoxins reduce respiratory mucosal ciliary function. Scientific Reports. 6, 33221 (2016).
- Patel, N. N., et al. Fungal extracts stimulate solitary chemosensory cell expansion in noninvasive fungal rhinosinusitis. International Forum of Allergy and Rhinology. 9 (7), 730-737 (2019).
- Baer, A., Kehn-Hall, K. Viral concentration determination through plaque assays: Using traditional and novel overlay systems. Journal of Visualized Experiments. 93 (93), e52065 (2014).
- Robinot, R., et al. SARS-CoV-2 infection induces the dedifferentiation of multiciliated cells and impairs mucociliary clearance. Nature Communications. 12 (1), 4354 (2021).
- Whitsett, J. A. Airway epithelial differentiation and mucociliary clearance. Annals of the American Thoracic Society. 15, S143-S148 (2018).
- Gao, N., Raduka, A., Rezaee, F. Respiratory syncytial virus disrupts the airway epithelial barrier by decreasing cortactin and destabilizing F-actin. Journal of Cell Science. 135 (16), 259871 (2022).
- Schmidt, H., et al. IL-13 impairs tight junctions in airway epithelia. International Journal of Molecular Sciences. 20 (13), 3222 (2019).
- Huang, Z. Q., et al. Interleukin-13 alters tight junction proteins expression thereby compromising barrier function and dampens rhinovirus induced immune responses in nasal epithelium. Frontiers in Cell and Developmental Biology. 8, 572749 (2020).
- Saatian, B., et al. Interleukin-4 and interleukin-13 cause barrier dysfunction in human airway epithelial cells. Tissue Barriers. 1 (2), e24333 (2013).
- Coles, J. L., et al. A revised protocol for culture of airway epithelial cells as a diagnostic tool for primary ciliary dyskinesia. Journal of Clinical Medicine. 9 (11), 3753 (2020).
- Baldassi, D., Gabold, B., Merkel, O. M. Air−liquid interface cultures of the healthy and diseased human respiratory tract: Promises, challenges, and future directions. Advanced NanoBiomed Research. 1 (6), 2000111 (2021).
- Seibold, M. A. Interleukin-13 stimulation reveals the cellular and functional plasticity of the airway epithelium. Annals of the American Thoracic Society. 15, S98-S106 (2018).
- Morrison, C. B., et al. SARS-CoV-2 infection of airway cells causes intense viral and cell shedding, two spreading mechanisms affected by IL-13. Proceedings of the National Academy of Sciences of the United States of America. 119 (16), 2119680119 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。