Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Инфекция первичных эпителиальных клеток носа, выращенных на границе воздух-жидкость, для характеристики взаимодействия коронавируса человека с хозяином
В этой статье
Резюме
Эпителий носа является основным барьерным узлом, с которым сталкиваются все респираторные патогены. В этой статье мы опишем методы использования первичных эпителиальных клеток носа, выращенных в качестве культур границы раздела воздух-жидкость (ALI), для характеристики взаимодействия коронавируса человека с хозяином в физиологически значимой системе.
Аннотация
За последние 20 лет появились три высокопатогенных коронавируса человека (HCoV) – SARS-CoV (2002 г.), MERS-CoV (2012 г.) и SARS-CoV-2 (2019 г.), которые вызвали серьезные кризисы в области общественного здравоохранения. Еще четыре HCoV вызывают значительную часть случаев простуды каждый год (HCoV-NL63, -229E, -OC43 и -HKU1), что подчеркивает важность изучения этих вирусов в физиологически значимых системах. HCoV проникают в дыхательные пути и создают инфекцию в эпителии носа, который является основным местом, с которым сталкиваются все респираторные патогены. Мы используем систему культивирования первичного эпителия носа, в которой образцы носа, взятые у пациентов, выращиваются на границе воздух-жидкость (ALI) для изучения взаимодействия патогена-хозяина в этом важном дозорном участке. Эти культуры повторяют многие особенности дыхательных путей in vivo , включая присутствующие типы клеток, функцию цилиарных мышц и выработку слизи. Мы описываем методы характеристики репликации вируса, тропизма клеток хозяина, вирус-индуцированной цитотоксичности и врожденной иммунной индукции в назальных культурах ALI после инфекции HCoV, используя в качестве примера недавнюю работу, сравнивающую летальные и сезонные HCoV в качестве примера1. Более глубокое понимание взаимодействий между хозяином и патогеном в носу может стать новыми мишенями для противовирусной терапии против HCoV и других респираторных вирусов, которые, вероятно, появятся в будущем.
Введение
На сегодняшний день выявлено семь коронавирусов человека (HCoV), вызывающих целый ряд респираторных заболеваний2. Распространенные или сезонные HCoV (HCoV-NL63, -229E, -OC43 и -HKU1) обычно связаны с патологией верхних дыхательных путей и вызывают примерно 10–30% случаев простуды ежегодно. Несмотря на то, что это типичный клинический фенотип, ассоциированный с распространенным HCoV, эти вирусы могут вызывать более серьезные заболевания нижних дыхательных путей в группах риска, включая детей, пожилых людей и лиц с ослабленным иммунитетом 3,4. За последние 20 лет появились три патогенных HCoV, которые вызвали серьезные чрезвычайные ситуации в области общественного здравоохранения, включая тяжелый острый респираторный синдром (SARS)-CoV, ближневосточный респираторный синдром (MERS)-CoV и SARS-CoV-2. Летальные ГЦОФ ассоциируются с более тяжелой патологией дыхательных путей, что наглядно демонстрируется коэффициентом летальности >34%, связанным с БВРС-КоВ (894 случая смерти из более чем 2 500 случаев с момента его появления в 2012 г.)5,6. Важно отметить, что смертельные ГЦОФ также вызывают целый ряд заболеваний дыхательных путей, от бессимптомных инфекций до смертельной пневмонии, как это видно на примере продолжающейся пандемии COVID-197.
HCoV, как и другие респираторные возбудители, проникают в дыхательные пути и устанавливают продуктивную инфекцию в эпителии носа8. Считается, что распространение в нижние дыхательные пути связано с аспирацией из ротовой/носовой полости в легкие, где HCoV вызывают более выраженную патологию нижних дыхательных путей 9,10,11. Таким образом, нос служит начальными воротами для проникновения вируса и является основным барьером для инфекции благодаря своему надежному механизму мукоцилиарного клиренса и уникальным врожденным иммунным механизмам, направленным на предотвращение дальнейшего распространения вируса в нижние дыхательные пути12,13. Например, сообщалось, что эпителиальные клетки носа экспрессируют более высокие, чем в среднем, базальные уровни противовирусных интерферонов и интерферон-стимулированных генов, что указывает на то, что клетки носа могут быть подготовлены к раннему ответу на респираторные вирусы14,15,16.
Ранее мы использовали первичные эпителиальные клетки носа, полученные от пациентов, выращенные на границе раздела воздух-жидкость (ALI), для моделирования взаимодействия HCoV и хозяина в носу, где начинаются инфекции HCoV. Назальные бактериологические исследования ALI являются допускающими как патогенные (SARS-CoV-2 и MERS-CoV), так и распространенные HCoV (HCoV-NL63 и HCoV-229E) и обладают различными преимуществами по сравнению с традиционными линиями эпителиальных клеток дыхательных путей, такими как A549 (клеточная линия аденокарциномы легкого)16,17. После дифференцировки назальные культуры ALI содержат гетерогенную клеточную популяцию и демонстрируют многие функции, ожидаемые от эпителия носа in vivo, такие как механизм мукоцилиарного клиренса18. Клетки носа также имеют преимущества по сравнению с системами культивирования нижних дыхательных путей (такими как эпителиальные клетки бронхов человека, HBECs), поскольку получение эпителиальных клеток носа с помощью цитологической чистки является значительно менее инвазивным по сравнению с использованием таких методов, как бронхоскопия для получения HBECs 19,20,21.
В данной работе описаны методы использования этой назальной системы культивирования ALI для характеристики взаимодействия HCoV с хозяином в эпителии носа. Мы применили эти методы в недавно опубликованных работах для сравнения SARS-CoV-2, MERS-CoV, HCoV-NL63 и HCoV-229E 1,16,17. Несмотря на то, что эти методы и репрезентативные результаты подчеркивают важность изучения HCoV в этой модели клеток носа, система легко адаптируется к другим HCoV, а также к другим респираторным патогенам. Кроме того, эти методы могут быть более широко применены к другим системам культивирования ALI для изучения репликации вируса и клеточного тропизма, а также цитотоксичности и индукции врожденного иммунитета после инфекции.
Access restricted. Please log in or start a trial to view this content.
протокол
Использование образцов из носа было одобрено Институциональным наблюдательным советом Университета Пенсильвании (протокол #800614) и Институциональным наблюдательным советом Филадельфии (протокол #00781).
1. Инфицирование назальных посевов ALI
ПРИМЕЧАНИЕ: Получение клинических образцов, а также рост и дифференцировка назальных культур ALI выходят за рамки данной статьи. Конкретные методы культивирования первичных эпителиальных клеток носа можно найти в недавно опубликованных работах с использованием этих культур 18,22,23. При желании приведенные ниже протоколы могут быть дополнительно применены к коммерчески доступным посевам эпителия носа. Протоколы и объемы, подробно описанные ниже, применимы к 24-луночным пластинчатым трансвеллерным вставкам (диаметр 6,5 мм, площадь поверхности мембраны 0,33см2). При использовании культур ALI, выращенных на больших трансвеллах (т. е. 12-луночных планшетах, диаметре 12 мм, площади поверхности 1,12см2), отрегулируйте объемы пропорционально в соответствии с размером поперечной скважины.
- За день до заражения:
- Промыть культуры ALI 3 раза фосфатно-солевым буфером (PBS) апикально (добавить ~200 мкл подогретого PBS, поместить в инкубатор с температурой 37 °C на 5 мин, аспирировать PBS и повторить).
- Замените базальную среду (500 мкл).
- Дайте культурам уравновеситься при температуре, при которой будут проводиться инфекции в течение ночи (т. е. при заражении при 33 °C поместите культуры в инкубатор с температурой 33 °C после промывки PBS).
ПРИМЕЧАНИЕ: Сообщается, что HCoV, связанные с простудой, такие как HCoV-229E и HCoV-NL63, реплицируются более эффективно при 33 °C. Кроме того, температура эпителия носа in vivo составляет 33 °C (это отличается от температуры легких, которая составляет 37 °C).
- Разбавляйте вирус по мере необходимости в безсывороточной модифицированной орлиной среде (DMEM) Dulbecco для достижения желаемой множественности инфекции (MOI) в общем объеме инокулята 50 мкл.
ПРИМЕЧАНИЕ: Инфекции, как правило, проводились при MOI = 5 (высокий MOI); тем не менее, инфекции с MOI = 0,5 (низкий MOI) также использовались для SARS-CoV-2 и HCoV, ассоциированных с простудой, и это приводит к сопоставимым пиковым титрам вируса, но с различной кинетикой (любой MOI приемлем). - Добавьте посевной материал верхушечно и поместите культуры обратно в инкубатор на 1 ч.
- Осторожно раскачивайте пластины каждые 15 минут во время инфекции (крепко держа пластину обеими руками, раскачивайте вперед и назад и из стороны в сторону, чтобы обеспечить равномерную адсорбцию вирусного инокулята).
- Через 1 ч инкубации аспирируют вирусный посевной материал и промывают каждую инфицированную культуру 3 раза PBS, чтобы обеспечить удаление вирусного посевного материала (для каждой промывки добавляют 200 мкл PBS, инкубируют в течение 5 мин и аспирируют или удаляют пипеткой).
- При желании соберите третью промывку PBS, чтобы подтвердить адекватное удаление входного вируса.
- Заменяйте базальную среду свежей средой на инфицированных ALI каждые 72 часа во время инфекции.
2. Сбор апикальной поверхностной жидкости (ASL) и титрование выделенного вируса
- В определенные моменты времени после заражения добавляйте 200 мкл PBS в апикальную камеру каждого инфицированного трансвелла.
ПРИМЕЧАНИЕ: Соответствующие моменты времени варьируются в зависимости от интересующего HCoV и составляют от 24 до 192 ч после заражения (см. раздел «Репрезентативные результаты» для данных о репликации вируса для различных HCoV). - Пипетка PBS вверх и вниз 5 раз, чтобы обеспечить максимальный сбор апикально выделяемого вируса, и соберите весь объем в пробирку микроцентрифуги (это образец ASL).
ПРИМЕЧАНИЕ: ASL включает в себя выделяемые вирусные частицы в дополнение к слизи и другим продуктам, выделяемым апикально из культур ALI. - Количественное определение инфекционного вируса в ASL с помощью стандартного анализа вирусных бляшек (последовательное разбавление вируссодержащих образцов для количественного определения концентрации вирусных частиц).
ПРИМЕЧАНИЕ: Типы клеток и инкубационный период, используемые для анализа бляшек, будут зависеть от используемого вируса: SARS-CoV-2 (клетки VeroE6); БВРС-КоВ (клетки VeroCCL81); HCoV-NL63 (ячейки LLC-MK2); HCoV-229E (ячейки Huh7). Подробности проведения тестов на вирусные бляшки выходят за рамки данной рукописи, но были подробно описаны ранее в публикации24 журнала Journal of Visualized Experiments (JoVE). - При желании необходимо собрать базальную среду в разное время после заражения, чтобы подтвердить отсутствие базально высвобожденного вируса. HCoV обычно высвобождаются апикально из эпителиальных клеток носа, но подтверждают это с помощью бляшечного анализа неразбавленной базальной среды.
- Храните образцы ASL при температуре −80 °C, если количественное определение методом анализа бляшек не будет проведено в день сбора.
3. Количественная оценка внутриклеточного вируса
- После сбора образца ASL переместите каждую транслунцию в чистую 24-луночную планшет, предварительно загруженную 500 мкл DMEM, содержащего 2% фетальной бычьей сыворотки (FBS).
ПРИМЕЧАНИЕ: DMEM с 2% FBS используется для стабилизации вируса во время последующих циклов замораживания-оттаивания. - Промойте каждую транслунцию 3 раза верхушечно PBS, чтобы обеспечить полное удаление вируса, выделяемого апикально.
- После аспирации для удаления окончательной промывки PBS добавьте 100 мкл DMEM с 2% FBS в апикальный отсек.
- Переместите планшет, содержащий трансвеллы с апикальной и базальной средой, в морозильную камеру с температурой −80 °C и выполните три последовательных цикла замораживания-оттаивания, чтобы лизировать клетки.
- После окончательного цикла замораживания-оттаивания соедините апикальную (100 мкл) и базальную (500 мкл) среды в чистую пробирку.
- Центрифугу при 500 × г в течение 10 мин при 4 °C, чтобы гранулировать клеточный мусор.
- Соберите надосадочную жидкость. Это внутриклеточный образец вируса для титрования с помощью стандартного бляшечного анализа.
ПРИМЕЧАНИЕ: В процессе сбора происходит трехкратное разбавление по отношению к сбору ASL; Образцы ASL собираются в 200 мкл PBS, в то время как внутриклеточный образец вируса собирается в общий объем 600 мкл.
4. Измерение трансэпителиального электрического сопротивления (TEER)
ПРИМЕЧАНИЕ: Для измерения TEER следует использовать PBS, дополненный кальцием и магнием (PBS + Ca 2+ / Mg2+). Используется эпителиальный вольт/омметр, настроенный на считывание в омах (см. таблицу материалов).
- Очистите, уравновешивайте и заглушите инструмент EVOM в соответствии с инструкциями производителя; Используйте «пустой» трансвелл без добавления носовых клеток для гашения. Запись холостого измерения TEER.
ПРИМЕЧАНИЕ: При использовании нескольких вирусов инструмент EVOM должен быть строго очищен между условиями, чтобы избежать перекрестного загрязнения (достаточно промывки 70% этанолом с последующим деионизированной водой). - Переместите каждый инфицированный трансвелл в предварительно меченую, чистую 24-луночную планшет с 500 мкл PBS + Ca 2+/Mg2+ базально, чтобы смыть остаточную базальную среду из трансвеллов.
- Добавьте 200 мкл PBS + Ca 2+/Mg2+ в апикальный отсек каждого трансвелла.
- Добавьте 1 мл PBS + Ca 2+/Mg2+ в измерительную камеру Endohm-6.
- Переместите каждый трансвелл в измерительную камеру Endohm-6 и установите крышку камеры так, чтобы апикальный электрод находился в 200 мкл PBS в апикальном отсеке; базальный электрод встроен в нижнюю часть камеры Endohm-6.
- Подождите, пока показания EVOM стабилизируются, и запишите необработанное измерение TEER.
- Соберите образец ASL, как описано выше, после измерения TEER, если требуется титрование (соберите 200 мкл PBS + Ca2+/Mg2+ , который был добавлен для измерения TEER).
ПРИМЕЧАНИЕ: Сбор образцов ASL может вызвать микроразрывы в эпителиальном барьере, которые могут исказить показания TEER, поэтому ASL должен быть собран после измерения TEER. Кроме того, базальную среду нельзя менять непосредственно перед показаниями TEER, так как это также может повлиять на значения TEER. - Чтобы преобразовать необработанные показания TEER в конечные измерения в Омах/см2, вычтите пустое значение TEER и умножьте это значение на площадь поверхности мембраны трансвелла, используя уравнение (1):
TEER = [Чтение TEER - пустое значение TEER] × (площадь поверхности колодца) (1) - Для HCoV оценивают TEER каждые 24 ч или 48 ч после заражения; кинетика изменений TEER часто варьируется в зависимости от вируса и требует устранения неполадок в различные моменты времени.
- При измерении TEER всегда включайте фиктивные зараженные культуры и оценивайте их в каждый момент времени (отрицательный контроль).
ПРИМЕЧАНИЕ: Для макетов культур измерения TEER должны оставаться стабильными или могут немного увеличиться по сравнению с исходным уровнем после завершения дифференциации культур. Площадь поверхности мембранных опор будет варьироваться в зависимости от размера и производителя трансформаторов; 24-луночные скважины обычно имеют площадь поверхности 0,33см2.
5. Измерение цитотоксичности при инфекции с помощью анализа на лактатдегидрогеназу (ЛДГ)
ПРИМЕЧАНИЕ: В этой работе содержание ЛДГ в образцах ASL было количественно определено с помощью коммерчески доступного набора для определения цитотоксичности. Сигнал ЛДГ в базальной среде часто был ниже предела обнаружения и часто менее воспроизводим, чем ЛДГ, количественно выраженный в образцах ASL из культур, инфицированных HCoV.
- Подготовьте дополнительные средства контроля, необходимые для анализа ЛДГ.
- Фоновый контроль: используйте PBS (используйте PBS, содержащие кальций и магний, если образцы ASL были собраны таким образом).
- Положительный контроль (предельное значение): лечение АЛИ апикально с помощью Triton X-100. Соберите контрольные скважины Triton (обычно используйте для этого три культуры ALI в каждый момент времени).
- Добавьте 200 мкл 2% Triton X-100 в PBS непосредственно в апикальный отсек трансвелла.
- Инкубируйте в течение 10-15 минут, чтобы клетки полностью лизировались.
- Соберите весь объем в качестве образца потолка Тритона.
- Отрицательный контроль (низкий контроль/исходный уровень высвобождения ЛДГ): сбор ASL из фиктивно инфицированных культур ALI, полученных от того же донора, что и инфицированные культуры.
- Соберите фиктивный ASL с отрицательным управлением, следуя описанной выше процедуре сбора ASL.
ПРИМЕЧАНИЕ: Одни и те же трансвеллы могут быть использованы для этого отрицательного контроля для всех временных точек, в то время как свежие трансвеллы будут необходимы для каждого момента времени для элемента управления Triton.
- Соберите фиктивный ASL с отрицательным управлением, следуя описанной выше процедуре сбора ASL.
- Чтобы можно было количественно оценить выделяемый вирус в дополнение к показаниям LDH из каждого образца ASL, загрузите оптически прозрачную плоскодонную черную 96-луночную пластину следующим образом:
- Разбавьте все образцы в PBS, используя 45 мкл образца и 55 мкл PBS (общий объем 100 мкл).
- Таким же образом следует обращаться с положительным контролем Triton и имитацией фоновых контрольных образцов.
ПРИМЕЧАНИЕ: Это разбавление позволяет утроить загрузку каждого экспериментального образца (45 мкл x 3) и достаточный остаточный объем ASL для титрования с помощью бляшечного анализа. - Загрузите пластину LDH в трех экземплярах: потолок Тритона, имитация фонового контроля, контроль PBS и экспериментальные образцы.
- Приготовьте реакционную смесь, как указано производителем (раствор красителя + катализатор).
- Добавьте 100 мкл реакционной смеси в каждую лунку и инкубируйте планшет при комнатной температуре в течение 20 мин в защищенном от света месте.
- Через 20 мин измерьте поглощение на длине волны 492 нм.
- Рассчитайте процент цитотоксичности относительно предельного значения Тритона, используя уравнение (2).
Цитотоксичность (%)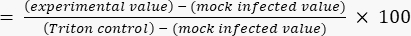 (2)
(2)
6. Подготовка назальных культур ALI для иммунофлуоресцентной (ИФ) визуализации
- Переместите трансвелл в свежую 24-луночную пластину и промойте 3 раза апикально PBS PBS (соберите первую промывку PBS как ASL, если титрование; затем выполните две дополнительные промывки PBS, чтобы удалить излишки вируса, который может повлиять на качество IF)
- После окончательной промывки PBS покройте трансвелл апикально и базально 4% PFA.
- Инкубируйте в течение 30 минут, чтобы закрепить в 4% PFA, а затем выньте и промойте 3 раза PBS.
- Иссеките опору для трансвелла, содержащую клетки, с помощью заточенного бритвенного лезвия или ножниц.
- Чтобы увеличить количество мишеней IF для каждого трансвелла, разрежьте каждую мембрану пополам и окрасьте каждую половину различными комбинациями антител.
- Пермеабилизацию с 0,2% Triton X-100 в PBS в течение 10 мин.
- Блок с 10% обычной ослиной сывороткой и 1% БСА в PBST (PBS + 0,2% Triton X-100) в течение 60 мин при комнатной температуре.
ПРИМЕЧАНИЕ: На этом этапе защищайте образцы от воздействия света. - Инкубируют в растворе первичных антител в течение ночи при температуре 4 °C. Разбавьте все антитела 1:1000 в блокирующем буфере.
ПРИМЕЧАНИЕ: Репрезентативные антитела для окрашивания нуклеокапсидами HCoV, а также маркеры типа эпителиальных клеток и окрашивание цитоскелета перечислены ниже (см. Таблицу материалов для информации о производителе и каталожных номерах).- Для окрашивания антигена HCoV используйте антитела, нацеленные на нуклеокапсид SARS-CoV-2, нуклеокапсид MERS-CoV и нуклеокапсид HCoV-NL63.
- Для определения типов эпителиальных клеток используют антитела, нацеленные на маркер бокаловидных клеток MUC5AC и маркер реснитчатых клеток IV типа β-тубулин.
- Для маркеров цитоскелета используют антитела, направленные против фаллоидина (связывает F-актин) и маркера адгезии эпителиальных клеток: EpCAM (CD326).
- Инкубируют во вторичном растворе антител в течение 60 мин при комнатной температуре; Используйте красители вторичных антител, разбавленные 1:1000 в блокирующем буфере.
- После завершения окрашивания перенесите мембрану на предметное стекло шпателем, сориентируйте трансвелл апикальной стороной к предметному стеклу и добавьте монтажный раствор. Дайте отстояться в течение 15-30 минут, прежде чем наносить прозрачный лак по краям.
- Получение изображений с помощью конфокального микроскопа (шаг по оси Z: 0,5 мкм; последовательное сканирование)1,16,17.
ПРИМЕЧАНИЕ: После фиксации культур в 4% PFA и промывки PBS фиксированные культуры можно хранить при 4 °C в течение нескольких недель или месяцев до окрашивания и подготовки к визуализации. После окрашивания и монтажа мембран образцы можно хранить длительное время (>2 года) при температуре 4 °C в темноте.
7. Забор внутриклеточного белка для вестерн-иммуноблоттинга или РНК для анализа ОТ-кПЦР
- Собирайте ASL, как описано выше, при количественном определении титров вируса (раздел 2 протокола).
- Переместите трансвелл на чистую 24-луночную пластину, так как соскабливание мембраны может привести к поломке пластины.
- Для вестерн-блоттинг-анализа собирают общий белковый лизат в 125 мкл буфера RIPA (50 мМ Tris, pH 8, 150 мМ NaCl, 0,5% дезоксихолат, 0,1% SDS, 1% NP40) с добавлением ингибиторов протеазы и ингибиторов фосфатазы.
- Добавьте 125 мкл буфера RIPA в апикальный отсек и инкубируйте в течение 5-10 мин.
- Соскребите мембрану с помощью наконечника пипетки P200, чтобы удалить оставшиеся прикрепленные клетки, и соберите весь объем (энергично соскребите по всей поверхности мембраны, а затем несколько раз проведите пипеткой вверх и вниз, чтобы собрать весь образец).
- Инкубируют образцы лизата белка на льду в течение 10 мин, а затем центрифугируют на максимальной скорости (20 000 × г) в течение 10 мин при 4 °C.
- Смешайте надосадочную жидкость с 4-кратным буфером образца Laemmli с β-меркаптоэтанолом (восстановителем) в соответствии с протоколами производителя.
- Прокипятите образцы белка при температуре 95 °C в течение 5 мин, а затем проработайте, используя традиционные протоколы вестерн-блоттинга 1,16,17.
- Для сбора общей РНК используйте коммерчески доступный набор для экстракции РНК.
ПРИМЕЧАНИЕ: Апикальный отсек 24-луночных трансвелловых вставок имеет максимальный объем ~200 мкл; Таким образом, мы выполняем две последовательные промывки каждой культуры до достижения общего рекомендуемого объема. Приведенные ниже данные соответствуют рекомендуемому сбору образцов РНК в общем объеме 350 мкл. - Добавьте 200 мкл лизисного буфера в апикальный отсек инфицированного трансвелла.
- Оставьте на 5-10 минут, соскребите оставшиеся клетки с мембраны с помощью наконечника пипетки и соберите весь объем в пробирку для микроцентрифуги с этикеткой.
- Добавьте 150 мкл дополнительного лизисного буфера в апикальный отсек трансвелла и пипетку вверх и вниз перед сбором в ту же микроцентрифужную пробирку.
- Извлекайте РНК в соответствии с протоколом производителя.
Access restricted. Please log in or start a trial to view this content.
Результаты
Репрезентативные рисунки частично адаптированы из данных, которые можно найти в рукописи Otter et al.1. Назальные культуры ALI, полученные от четырех или шести доноров, были инфицированы одним из четырех HCoV (SARS-CoV-2, MERS-CoV, HCoV-NL63 и HCoV-229E) в соответствии с протоколами, описанными выше, и...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Методы, подробно описанные здесь, описывают систему культивирования первичного эпителия, в которой эпителиальные клетки носа, полученные от пациентов, выращиваются на границе раздела воздух-жидкость и применяются для изучения взаимодействий HCoV с хозяином. После дифференцировки эти н...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Сьюзан Вайс входит в научно-консультативный совет Ocugen. Ноам А. Коэн консультирует GSK, AstraZeneca, Novartis, Sanofi/Regeron и Oyster Point Pharmaceuticals и имеет патент США «Терапия и диагностика респираторных инфекций» (10 881 698 B2, WO20913112865) и лицензионное соглашение с GeneOne Life Sciences.
Благодарности
Это исследование финансируется следующими источниками: Национальные институты здравоохранения (NIH) R01AI 169537 (S.R.W. и N.A.C.), NIH R01AI 140442 (S.R.W.), VA Merit Review CX001717 (N.A.C.), VA Merit Review BX005432 (S.R.W. и N.A.C.), Пенсильванский центр исследований коронавирусов и других новых патогенов (S.R.W.), Фонд Лаффи-Макхью (S.R.W. и N.A.C.), T32 AI055400 (CJO), T32 AI007324 (AF).
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Alexa Fluor secondary antibodies (488, 594, 647) | Invitrogen | Various | |
| BSA (bovine serum albumin) | Sigma-Aldrich | A7906 | |
| cOmplete mini EDTA-free protease inhibitor | Roche | 11836170001 | |
| Cytotoxicity detection kit | Roche | 11644793001 | |
| DMEM (Dulbecco's Modified Eagle Media) | Gibco | 11965-084 | |
| DPBS (Dulbecco's Phosphate Buffered Saline) | Gibco | 14190136 | |
| DPBS + calcium + magnesium | Gibco | 14040-117 | |
| Endohm-6G measurement chamber | World Precision Instruments | ENDOHM-6G | |
| Epithelial cell adhesion marker (EpCAM; CD326) | eBiosciences | 14-9326-82 | |
| Epithelial Volt/Ohm (TEER) Meter (EVOM) | World Precision Instruments | 300523 | |
| FBS (Fetal Bovine Serum) | HyClone | SH30071.03 | |
| FV10-ASW software for imaging | Olympus | Version 4.02 | |
| HCoV-NL63 (Human coronavirus, NL63) | BEI Resources | NR-470 | |
| HCoV-NL63 nucleocapsid antibody | Sino Biological | 40641-V07E | |
| Hoescht stain | Thermo Fisher | H3570 | |
| Laemmli sample buffer (4x) | BIO-RAD | 1610747 | |
| LLC-MK2 cells | ATCC | CCL-7 | To titrate HCoV-NL63 |
| MERS-CoV (Human coronavirus, Middle East Respiratory Syndrome Coronavirus (MERS-CoV), EMC/2012) | BEI Resources | NR-44260 | |
| MERS-CoV nucleocapsid antibody | Sino Biological | 40068-MM10 | |
| MUC5AC antibody | Sigma-Aldrich | AMAB91539 | |
| Olympus Fluoview confocal microscope | Olympus | FV1000 | |
| Phalloidin-iFluor 647 stain | Abcam | ab176759 | |
| PhosStop easy pack (phosphatase inhibitors) | Roche | PHOSS-RO | |
| Plate reader | Perkin Elmer | HH34000000 | Any plate reader or ELISA reader is sufficient; must be able to read absorbance at 492 nm |
| RIPA buffer (50 mM Tris pH 8; 150 mM NaCl; 0.5% deoxycholate; 0.1% SDS; 1% NP40) | Thermo Fisher | 89990 | Can prep in-house or purchase |
| RNeasy Plus Kit | Qiagen | 74134 | |
| SARS-CoV-2 (SARS-Related Coronavirus 2, Isolate USA-WA1/2020) | BEI Resources | NR-52281 | |
| SARS-CoV-2 nucleocapsid antibody | Genetex | GTX135357 | |
| Triton-X 100 | Fisher Scientific | BP151100 | |
| Type IV β- tubulin antibody | Abcam | ab11315 | |
| VeroCCL81 cells | ATCC | CCL-81 | To titrate MERS-CoV |
| VeroE6 cells | ATCC | CRL-1586 | To titrate SARS-CoV-2 |
Ссылки
- Otter, C. J., et al. Infection of primary nasal epithelial cells differentiates among lethal and seasonal human coronaviruses. Proceedings of the National Academy of Sciences of the United States of America. 120 (15), 2218083120(2023).
- Fehr, A., Perlman, S. Coronaviruses: An overview of their replication and pathogenesis. Methods in Molecular Biology. 1282, 1-23 (2015).
- Gaunt, E. R., Hardie, A., Claas, E. C. J., Simmonds, P., Templeton, K. E. Epidemiology and clinical presentations of the four human coronaviruses 229E, HKU1, NL63, and OC43 detected over 3 years using a novel multiplex real-time PCR method. Journal of Clinical Microbiology. 48 (8), 2940-2947 (2010).
- Kesheh, M. M., Hosseini, P., Soltani, S., Zandi, M. An overview on the seven pathogenic human coronaviruses. Reviews in Medical Virology. 32 (2), 2282(2022).
- MERS-CoV Worldwide Overview. European Centre for Disease Prevention and Control. , Available from: https://www.ecdc.europa.eu/en/middle-east-respiratory-syndrome-coronavirus-mers-cov-situation-update (2022).
- MERS Situation Update. World Health Organization Regional Office for the Eastern Mediterranean. , Available from: http://www.emro.who.int/health-topics/mers-cov/mers-outbreaks.html (2022).
- Cao, Y., Liu, X., Xiong, L., Cai, K. Imaging and clinical features of patients with 2019 novel coronavirus SARS-CoV-2: A systematic review and meta-analysis. Journal of Medical Virology. 92 (9), 1449-1459 (2020).
- Vareille, M., Kieninger, E., Edwards, M. R., Regamey, N. The airway epithelium: Soldier in the fight against respiratory viruses. Clinical Microbiology Reviews. 24 (1), 210-229 (2011).
- Farzal, Z., et al. Comparative study of simulated nebulized and spray particle deposition in chronic rhinosinusitis patients. International Forum of Allergy and Rhinology. 9 (7), 746-758 (2019).
- Gaeckle, N. T., Pragman, A. A., Pendleton, K. M., Baldomero, A. K., Criner, G. J. The oral-lung axis: The impact of oral health on lung health. Respiratory Care. 65 (8), 1211-1220 (2020).
- Hou, Y., et al. SARS-CoV-2 reverse genetics reveals a variable infection gradient in the respiratory tract. Cell. 182, 429-446 (2020).
- Hariri, B. M., Cohen, N. A. New insights into upper airway innate immunity. American Journal of Rhinology and Allergy. 30 (5), 319-323 (2016).
- Hiemstra, P. S., McCray, P. B., Bals, R. The innate immune function of airway epithelial cells in inflammatory lung disease. European Respiratory Journal. 45 (4), 1150-1162 (2015).
- Hatton, C. F., et al. Delayed induction of type I and III interferons mediates nasal epithelial cell permissiveness to SARS-CoV-2. Nature Communications. 12 (1), 7092(2021).
- Sungnak, W., et al. SARS-CoV-2 entry factors are highly expressed in nasal epithelial cells together with innate immune genes. Nature Medicine. 26 (5), 681-687 (2020).
- Li, Y., et al. SARS-CoV-2 induces double-stranded RNA-mediated innate immune responses in respiratory epithelial-derived cells and cardiomyocytes. Proceedings of the National Academy of Sciences of the United States of America. 118 (16), 2022643118(2021).
- Comar, C. E., et al. MERS-CoV endoribonuclease and accessory proteins jointly evade host innate immunity during infection of lung and nasal epithelial cells. Proceedings of the National Academy of Sciences of the United States of America. 119 (21), 2123208119(2022).
- Lee, R. J., et al. Bacterial D-amino acids suppress sinonasal innate immunity through sweet taste receptors in solitary chemosensory cells. Science Signaling. 10 (495), (2017).
- Brewington, J. J., et al. Brushed nasal epithelial cells are a surrogate for bronchial epithelial CFTR studies. JCI Insight. 3 (13), 99385(2018).
- Comer, D. M., Elborn, J. S., Ennis, M. Comparison of nasal and bronchial epithelial cells obtained from patients with COPD. PLoS One. 7 (3), e32924(2012).
- Vanders, R. L., Hsu, A., Gibson, P. G., Murphy, V. E., Wark, P. A. B. Nasal epithelial cells to assess in vitro immune responses to respiratory virus infection in pregnant women with asthma. Respiratory Research. 20 (1), 259(2019).
- Lee, R. J., et al. Fungal aflatoxins reduce respiratory mucosal ciliary function. Scientific Reports. 6, 33221(2016).
- Patel, N. N., et al. Fungal extracts stimulate solitary chemosensory cell expansion in noninvasive fungal rhinosinusitis. International Forum of Allergy and Rhinology. 9 (7), 730-737 (2019).
- Baer, A., Kehn-Hall, K. Viral concentration determination through plaque assays: Using traditional and novel overlay systems. Journal of Visualized Experiments. 93 (93), e52065(2014).
- Robinot, R., et al. SARS-CoV-2 infection induces the dedifferentiation of multiciliated cells and impairs mucociliary clearance. Nature Communications. 12 (1), 4354(2021).
- Whitsett, J. A. Airway epithelial differentiation and mucociliary clearance. Annals of the American Thoracic Society. 15, S143-S148 (2018).
- Gao, N., Raduka, A., Rezaee, F. Respiratory syncytial virus disrupts the airway epithelial barrier by decreasing cortactin and destabilizing F-actin. Journal of Cell Science. 135 (16), 259871(2022).
- Schmidt, H., et al. IL-13 impairs tight junctions in airway epithelia. International Journal of Molecular Sciences. 20 (13), 3222(2019).
- Huang, Z. Q., et al. Interleukin-13 alters tight junction proteins expression thereby compromising barrier function and dampens rhinovirus induced immune responses in nasal epithelium. Frontiers in Cell and Developmental Biology. 8, 572749(2020).
- Saatian, B., et al. Interleukin-4 and interleukin-13 cause barrier dysfunction in human airway epithelial cells. Tissue Barriers. 1 (2), e24333(2013).
- Coles, J. L., et al. A revised protocol for culture of airway epithelial cells as a diagnostic tool for primary ciliary dyskinesia. Journal of Clinical Medicine. 9 (11), 3753(2020).
- Baldassi, D., Gabold, B., Merkel, O. M. Air−liquid interface cultures of the healthy and diseased human respiratory tract: Promises, challenges, and future directions. Advanced NanoBiomed Research. 1 (6), 2000111(2021).
- Seibold, M. A. Interleukin-13 stimulation reveals the cellular and functional plasticity of the airway epithelium. Annals of the American Thoracic Society. 15, S98-S106 (2018).
- Morrison, C. B., et al. SARS-CoV-2 infection of airway cells causes intense viral and cell shedding, two spreading mechanisms affected by IL-13. Proceedings of the National Academy of Sciences of the United States of America. 119 (16), 2119680119(2022).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены