このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ヒトコロナウイルスと宿主の相互作用を特徴づけるための空気-液体界面で増殖した初代鼻上皮細胞の感染
要約
鼻上皮は、すべての呼吸器病原体が遭遇する主要なバリア部位です。ここでは、空気液界面(ALI)培養物として増殖させた初代鼻上皮細胞を用いて、生理学的に関連性の高いシステムにおけるヒトコロナウイルスと宿主の相互作用を特徴付ける方法について概説します。
要約
SARS-CoV(2002年)、MERS-CoV(2012年)、SARS-CoV-2(2019年)の3つの高病原性ヒトコロナウイルス(HCoV)が出現し、過去20年間に重大な公衆衛生上の危機を引き起こしました。毎年、風邪の症例のかなりの部分(HCoV-NL63、-229E、-OC43、-HKU1)がさらに4つのHCoVを引き起こしており、生理学的に関連するシステムでこれらのウイルスを研究することの重要性が強調されています。HCoVは気道に侵入し、すべての呼吸器病原体が遭遇する主要な部位である鼻上皮に感染を確立します。私たちは、患者由来の鼻サンプルを気液界面(ALI)で増殖させる一次鼻上皮培養システムを使用して、この重要なセンチネル部位での宿主と病原体の相互作用を研究しています。これらの培養物は、存在する細胞の種類、繊毛機能、粘液産生など、 in vivo 気道の多くの特徴を再現しています。HCoV感染後の経鼻ALI培養におけるウイルス複製、宿主細胞の向性、ウイルス誘発性細胞傷害性、および自然免疫誘導を特徴付ける方法を、致死性と季節性HCoVを比較した最近の研究を例に説明します1。鼻腔内の宿主と病原体の相互作用に関する理解が深まれば、HCoVやその他の呼吸器系ウイルスに対する抗ウイルス治療薬の新たな標的となる可能性があります。
概要
これまでに7種類のヒトコロナウイルス(HCoV)が確認されており、さまざまな呼吸器疾患を引き起こします2。一般的または季節性のHCoV(HCoV-NL63、-229E、-OC43、および-HKU1)は、通常、上気道の病理学に関連しており、毎年一般的な風邪症例の推定10%〜30%を引き起こします。これは一般的なHCoVに関連する典型的な臨床表現型ですが、これらのウイルスは、子供、高齢者、免疫不全の個人など、リスクのある集団でより重大な下気道疾患を引き起こす可能性があります3,4。過去20年間に、重症急性呼吸器症候群(SARS)-CoV、中東呼吸器症候群(MERS)-CoV、SARS-CoV-2の3つの病原性HCoVが出現し、重大な公衆衛生上の緊急事態を引き起こしています。致死的なHCoVは、より重篤な気道病変と関連しており、MERS-CoV症例に関連する致死率>34%(2012年の出現以来、2,500例以上で894例)5,6。致死的なHCoVは、現在進行中のCOVID-19パンデミックに見られるように、無症候性感染症から致死性肺炎まで、さまざまな気道疾患も引き起こすことに注意することが重要です7。
HCoVは、他の呼吸器病原体と同様に、気道に入り、鼻上皮に生産的な感染を確立します8。下気道への広がりは、口腔/鼻腔から肺への誤嚥に関連していると考えられており、HCoVはより重大な下気道病状を引き起こします9,10,11。したがって、鼻はウイルス侵入の最初のポータルとして機能し、その強力な粘膜繊毛クリアランス機構と、下気道へのウイルスのさらなる拡散を防ぐことを目的とした独自の自然免疫メカニズムにより、感染に対する主要な障壁となります12,13。例えば、鼻の上皮細胞は、抗ウイルスインターフェロンおよびインターフェロン刺激遺伝子の基底レベルが平均よりも高いことが報告されており、鼻細胞が呼吸器系ウイルスに対する早期応答の準備ができている可能性があることを示しています14,15,16。
私たちはこれまで、患者由来の初代鼻上皮細胞を気液界面(ALI)で増殖させ、HCoV感染が始まる鼻のHCoVと宿主の相互作用をモデル化しました。経鼻ALI培養は、病原性(SARS-CoV-2およびMERS-CoV)と一般的なHCoV(HCoV-NL63およびHCoV-229E)の両方に寛容であり、A549(肺腺癌細胞株)などの従来の気道上皮細胞株に比べてさまざまな利点があります16,17。分化後、鼻腔ALI培養物は不均一な細胞集団を含み、粘膜繊毛クリアランス機構など、in vivo鼻上皮に期待される機能の多くを示す18。鼻細胞は、細胞学的ブラッシングによる鼻上皮細胞の獲得は、HBECを達成するための気管支鏡検査などの技術の使用と比較して侵襲性が大幅に低いため、下気道培養システム(ヒト気管支上皮細胞、HBEC)よりも利点もあります19,20,21。
この論文では、この鼻腔ALI培養システムを利用して、鼻上皮におけるHCoVと宿主の相互作用を特徴付ける方法について説明します。これらの手法を最近発表された研究に適用し、SARS-CoV-2、MERS-CoV、HCoV-NL63、およびHCoV-229E 1,16,17を比較しました。これらの方法と代表的な結果は、この鼻細胞モデルにおけるHCoVの研究を強調していますが、このシステムは他のHCoVや他の呼吸器病原体にも高い適応性を持っています。さらに、これらの方法は、ウイルス複製と細胞向性、ならびに感染後の細胞毒性と自然免疫誘導を調査するために、他のALI培養系により広く適用することができます。
プロトコル
鼻標本の使用は、ペンシルベニア大学治験審査委員会(プロトコル#800614)およびフィラデルフィアVA治験審査委員会(プロトコル#00781)によって承認されました。
1. 鼻腔ALI培養の感染
注:臨床検体の取得、および鼻腔ALI培養の増殖と分化は、この論文の範囲外です。初代鼻上皮細胞を培養するための特定の方法は、これらの培養物を利用した最近発表された研究に見出すことができる18,22,23。以下のプロトコルは、必要に応じて、市販の鼻上皮ALI培養物にさらに適用できます。以下に詳述するプロトコルと容量は、24ウェルプレートトランズウェルインサート(直径6.5 mm、膜表面積0.33 cm2)に適用できます。より大きなトランズウェル(すなわち、12ウェルプレート、直径12 mm、表面積1.12 cm2)で増殖させたALI培養物を使用する場合は、トランジウェルのサイズを反映するように容量を比例的に調整します。
- 感染前日:
- ALI培養物をリン酸緩衝生理食塩水(PBS)で3回洗浄します(~200 μLの加温したPBSを加え、37°Cのインキュベーターに5分間入れ、PBSを吸引し、繰り返します)。
- 基礎培地(500 μL)を交換します。
- 一晩感染する温度で培養物を平衡化させます(つまり、33°Cで感染する場合は、PBS洗浄後に培養物を33°Cのインキュベーターに入れます)。
注:HCoV-229EやHCoV-NL63などの風邪に関連するHCoVは、33°Cでより効率的に複製されることが報告されています。 さらに、 in vivo 鼻上皮の温度は33°Cです(これは肺の温度である37°Cとは異なります)。
- 必要に応じて無血清ダルベッコのModified Eagle Medium(DMEM)でウイルスを希釈し、総接種量50 μLで所望の感染多重度(MOI)を達成します。
注:感染は通常、MOI = 5(高MOI)で行われてきました。しかし、SARS-CoV-2や風邪関連HCoVにはMOI = 0.5(低MOI)の感染が用いられており、これらのウイルス力価のピーク値は同等であるが、動態は変動する(どちらのMOIも許容される)。 - 接種物を先端に添加し、培養物をインキュベーターに1時間戻します。
- 感染中は15分ごとにプレートを静かにロックします(プレートを両手でしっかりと持ち、前後左右に揺らして、ウイルス接種物を均一に吸着させます)。
- 1時間のインキュベーション後、ウイルス接種物を吸引し、ウイルス接種を確実に除去するために、各感染培養物をPBSで3回洗浄します(各洗浄について、200 μLのPBSを加え、5分間インキュベートし、ピペットで吸引または除去します)。
- 必要に応じて、3回目のPBS洗浄を回収し、インプットウイルスの適切な除去を確認します。
- 感染中は、感染したALIの基底培地を72時間ごとに新しい培地と交換します。.
2. 頂端表面液(ASL)の採取と排出ウイルスの滴定
- 感染後の所定の時点で、感染した各トランズウェルの頂端チャンバーに200μLのPBSを添加します。
注:関連する時点は、関心のあるHCoVによって異なり、感染後24時間から192時間の範囲です(さまざまなHCoVのウイルス複製データについては、代表的な結果のセクションを参照してください)。 - PBSを5回上下にピペットで移し、頂端から排出されたウイルスを最大限に回収し、全容量を微量遠心チューブ(ASLサンプル)に収集します。
注:ASLには、ALI培養物から頂端に分泌される粘液やその他の生成物に加えて、排出されたウイルス粒子が含まれます。 - 標準的なウイルスプラークアッセイ(ウイルス粒子の濃度を定量するためにウイルス含有サンプルを段階希釈) により、ASL中の感染性ウイルスを定量します。
注:プラークアッセイに使用される細胞の種類とインキュベーション期間は、使用するウイルスによって異なります:SARS-CoV-2(VeroE6細胞);MERS-CoV(VeroCCL81細胞);HCoV-NL63(LLC-MK2細胞);HCoV-229E(Huh7細胞)。ウイルスプラークアッセイの実施方法の詳細は、この論文の範囲を超えていますが、以前にJournal of Visualized Experiments(JoVE)の出版物24で詳述されています。 - 必要に応じて、感染後のさまざまな時期に基礎培地を採取して、基底に放出されたウイルスがないことを確認します。HCoVは通常、鼻の上皮細胞から頂端に放出されますが、これは希釈されていない基礎培地のプラークアッセイ によって 確認されます。
- ASLサンプルは、採取日にプラークアッセイによる定量が行われない場合は、-80°Cで保管してください。
3. 細胞内ウイルスの定量
- ASLサンプルを採取した後、各トランズウェルを、2%ウシ胎児血清(FBS)を含む500 μLのDMEMをプリロードしたクリーンな24ウェルプレートに移します。
注:2% FBSを含むDMEMは、その後の凍結融解サイクル中にウイルスを安定化させるために使用されます。 - 各トランズウェルをPBSで3回洗浄し、末端から排出されたウイルスを完全に除去します。
- 吸引して最終PBS洗浄液を除去した後、2% FBSを含むDMEM100 μLを頂端コンパートメントに加えます。
- 頂端培地と基底培地の両方を含むトランズウェルを含むプレートを-80°Cの冷凍庫に移し、3回連続して凍結融解サイクルを完了して細胞を溶解します。
- 最後の凍結融解サイクルの後、頂端培地(100 μL)と基底培地(500 μL)を清潔なチューブにプールします。
- 500 × g 、4°Cで10分間遠心分離し、細胞破片をペレット化します。
- 上澄み液を採取します。これは、標準的なプラークアッセイ による滴定用の細胞内ウイルスサンプルです。
注:3倍希釈は、ASL収集と比較して収集プロセス中に発生します。ASLサンプルは200 μLのPBSで収集され、細胞内ウイルスサンプルは総容量600 μLに収集されます。
4. 経上皮電気抵抗(TEER)測定
注:TEER測定には、カルシウムとマグネシウムを添加したPBS(PBS + Ca 2+/Mg2+)を使用する必要があります。オームで読み取るように設定された上皮ボルト/オーム計が使用されます(材料表を参照)。
- 製造元の指示に従って、EVOM機器を洗浄し、平衡化し、ブランクにします。ブランキングのために鼻細胞を追加していない「空の」トランズウェルを使用してください。ブランクTEER測定を記録します。
注意:複数のウイルスを使用する場合は、クロスコンタミネーションを避けるために、EVOM装置を条件間で厳密に洗浄する必要があります(70%エタノールで洗浄した後、脱イオン水で十分です)。 - 感染した各トランズウェルを、500 μLのPBS + Ca 2+/Mg 2+を含む標識済みの清潔な24 ウェルプレートに移し、トランズウェルから残留基礎培地を洗浄します。
- 200 μLのPBS + Ca2+/Mg2+ を各トランズウェルの頂端区画に加えます。
- PBS + Ca2+/Mg2+ 1 mLをEndohm-6測定チャンバーに加えます。
- 各トランズウェルをEndohm-6測定チャンバーに移し、チャンバーの蓋を元に戻して、アピカル電極がアピカルコンパートメント内の200 μLのPBSに収まるようにします。基底電極は、Endohm-6チャンバーの底部に組み込まれています。
- EVOMの読み取り値を安定させ、生のTEER測定値を記録します。
- TEER測定後、力価測定が必要な場合は、上記のようにASLサンプルを採取します(TEER測定用に添加したPBS + Ca2+/Mg2+を200 μL採取します)。
注:ASLサンプルの収集は、TEERの読み取り値を混乱させる可能性のある上皮バリアの微小裂傷を誘発する可能性があるため、TEER測定後にASLを収集する必要があります。さらに、基礎培地は、TEER値にも影響を与える可能性があるため、TEER測定値の直前に変更しないでください。 - 生のTEER測定値をオーム/cm2の最終測定値に変換するには、ブランクTEER値を差し引き、式(1)を使用してこの値にトランズウェル膜の表面積を掛けます。
TEER = [TEER読み取り値-空白のTEER値]×(トランジスウェルの表面積)(1) - HCoV の場合、感染後 24 時間または 48 時間ごとに TEER を評価します。TEERの変化の動態はウイルスによって異なることが多く、さまざまな時点でトラブルシューティングが必要です。
- TEERを測定するときは、常に模擬感染培養を含め、各時点で評価します(ネガティブコントロール)。
注:模擬培養の場合、TEER測定値は安定しているか、培養の分化が完了した後、ベースラインからわずかに増加する可能性があります。メンブレンサポートの表面積は、トランズウェルのサイズとメーカーによって異なります。24ウェルトランズウェルの表面積は、通常0.33cm2です。
5. 乳酸デヒドロゲナーゼ(LDH)アッセイ による感染時の細胞毒性の測定
注:この研究では、市販の細胞毒性検出キットを使用して、ASLサンプル中のLDH含有量を定量しました。基礎培地中のLDHシグナルは、HCoV感染培養由来のASLサンプルで定量されたLDHよりも検出限界を下回ることが多く、再現性が低いことが多かった。
- LDHアッセイに必要な追加のコントロールを準備します。
- バックグラウンドコントロール:PBSを使用します(ASLサンプルをこの方法で収集した場合は、カルシウムとマグネシウムを含むPBSを使用します)。
- ポジティブコントロール(上限値):ALIをTriton X-100でアプライに治療する。Triton コントロールウェルを収集します (通常、各時点で 3 つの ALI 培養を使用します)。
- 200 μL の 2% Triton X-100 in PBS をトランズウェルの頂端コンパートメントに直接添加します。
- 10〜15分間インキュベートして、細胞を完全に溶解させます。
- 全ボリュームを Triton 天井サンプルとして収集します。
- ネガティブコントロール(低コントロール/ベースラインLDH放出):感染した培養と同じドナーに由来する模擬感染ALI培養からASLを収集します。
- 上記の ASL 収集手順に従って、ネガティブコントロール模擬 ASL を収集します。
注:このネガティブコントロールにはすべての時点で同じトランズウェルを使用できますが、トリトンコントロールでは各ポイントに新しいトランズウェルが必要になります。
- 上記の ASL 収集手順に従って、ネガティブコントロール模擬 ASL を収集します。
- 各ASLサンプルからのLDH測定値に加えて、排出ウイルスの定量を可能にするには、光学的に透明な平底の黒色の96ウェルプレートを次のようにロードします。
- 45 μL のサンプルと 55 μL の PBS (総容量 100 μL) を使用して、すべてのサンプルを PBS で希釈します。
- Triton ポジティブコントロールサンプルとモックバックグラウンドコントロールサンプルを同じ方法で処理します。
注:この希釈により、各実験サンプル(45 μL x 3)を3回ロードし、プラークアッセイ による力価測定に十分なASL残量を確保できます。 - LDHプレートをTritonシーリング、模擬バックグラウンドコントロール、PBSコントロール、実験サンプルの3回に分けてロードします。
- メーカーの指示に従って反応混合物(染料溶液+触媒)を調製します。
- 各ウェルに100μLの反応混合物を添加し、プレートを室温で20分間インキュベートし、光から保護します。
- 20分後、492nmの吸光度を測定します。
- 式 (2) を使用して、Triton の上限値に対する細胞毒性の割合を計算します。
細胞毒性(%)(2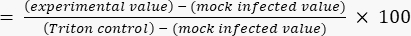 )
)
6. 免疫蛍光(IF)イメージングのための経鼻ALI培養液の調製
- トランズウェルを新しい 24 ウェルプレートに移し、PBS で先端に 3 回洗浄します(力価を上げている場合は、最初の PBS 洗浄液を ASL として収集し、その後、さらに 2 回の PBS 洗浄を行って、IF 品質を妨げる可能性のある過剰な脱落ウイルスを除去します)
- 最後のPBS洗浄後、トランズウェルを頂端および基底部を4% PFAで覆います。
- 30分間インキュベートして4%PFAで固定し、その後、PBSで3回除去して洗浄します。
- 細胞を含むトランズウェル支持体を、鋭利なカミソリの刃またははさみを使用して切除します。
- 各トランズウェルのIFターゲットの数を増やすには、各メンブレンを半分に切断し、それぞれ半分を異なる抗体の組み合わせで染色します。
- 0.2% Triton X-100 in PBS で 10 分間透過処理します。
- 10%正常ロバ血清と1%BSA含有PBST(PBS + 0.2% Triton X-100)で室温で60分間ブロックします。
注:このステップ以降、サンプルを光の暴露から保護します。 - 一次抗体溶液中で4°Cで一晩インキュベートします。 すべての抗体をブロッキングバッファーで1:1,000に希釈します。
注:HCoVヌクレオカプシド染色用の代表的な抗体、上皮細胞タイプマーカー、細胞骨格染色剤を以下にリストアップします(メーカー情報およびカタログ番号については、 材料表 を参照してください)。- HCoV抗原染色には、SARS-CoV-2ヌクレオカプシド、MERS-CoVヌクレオカプシド、およびHCoV-NL63ヌクレオカプシドを標的とする抗体を使用します。
- 上皮細胞の種類を同定するには、杯細胞マーカーMUC5ACおよび繊毛細胞マーカーIV型β-チューブリンを標的とする抗体を使用します。
- 細胞骨格マーカーには、ファロイジン(F-アクチンに結合)に対する抗体と上皮細胞接着マーカーであるEpCAM(CD326)を使用します。
- 二次抗体溶液中で室温で60分間インキュベートします。ブロッキングバッファーで1:1,000に希釈した二次抗体色素を使用してください。
- 染色が完了したら、メンブレンをスパチュラでスライドガラスに移し、頂端側をスライドに向けてトランズウェルを向け、封入液を追加します。端の周りに透明なマニキュアを塗る前に、15〜30分間落ち着かせます。
- 共焦点顕微鏡(Z軸ステップ:0.5μm、シーケンシャルスキャン)で画像を取得1,16,17。
注:培養物を 4% PFA で固定し、PBS で洗浄した後、固定培養物を 4 °C で数週間から数か月保存してから、染色およびイメージングの準備を行うことができます。メンブレンを染色してマウントした後、サンプルは暗所で4°Cで長期(>2年)保存できます。
7. ウェスタンイムノブロッティング用の細胞内タンパク質またはRT-qPCR解析用のRNAの採取
- ウイルス力価を定量化する場合は、上記のようにASLを収集します(プロトコルセクション2)。
- メンブレンをこすり落とすとインサートが破損する可能性があるため、トランズウェルを清潔な24ウェルプレートに移動します。
- ウェスタンブロット解析では、プロテアーゼ阻害剤およびホスファターゼ阻害剤を添加した125 μLのRIPAバッファー(50 mM Tris、pH 8、150 mM NaCl、0.5%デオキシコール酸、0.1% SDS、1% NP40)に総タンパク質ライセートを採取します。
- 125 μLのRIPAバッファーを頂端コンパートメントに加え、5〜10分間インキュベートします。
- P200ピペットチップを使用してメンブレンをこすり落とし、付着した細胞を除去し、全容量を回収します(メンブレンの表面全体を激しくこすり、その後、ピペットを複数回上下させてサンプル全体を回収します)。
- タンパク質ライセートサンプルを氷上で10分間インキュベートした後、最高速度(20,000 × g)で4°Cで10分間遠心分離します。
- メーカーのプロトコルに従って、上清を4x Laemmliサンプルバッファーとβ-メルカプトエタノール(還元剤)と混合します。
- タンパク質サンプルを 95 °C で 5 分間煮沸し、従来のウェスタンブロッティングプロトコル 1,16,17 を使用して分析します。
- トータルRNAの採取には、市販のRNA抽出キットをご使用ください。
注:24ウェルトランズウェルインサートの頂端コンパートメントの最大容量は~200 μLです。したがって、各培養物で2回連続して洗浄を行い、総推奨量に達します。以下の詳細は、総容量 350 μL の RNA サンプルの推奨収集に対応しています。 - 200 μLの溶解緩衝液を感染したトランズウェルの頂端コンパートメントに加えます。
- 5〜10分間放置し、ピペットチップを使用してメンブレンから残りの細胞をこすり落とし、全容量をラベル付き微量遠心チューブに集めます。
- トランズウェルの頂端コンパートメントに150 μLの溶解緩衝液を追加し、ピペットで上下させてから、同じ微量遠心チューブに集めます。
- メーカーのプロトコルに従ってRNAを抽出します。
結果
代表的な数値は、Otter et al.1の原稿に見られるデータから部分的に改作されています。4人または6人のドナー由来の経鼻ALI培養物を、上記のプロトコルに従って4つのHCoV(SARS-CoV-2、MERS-CoV、HCoV-NL63、およびHCoV-229E)のいずれかに感染させ、各ウイルスの平均頂端排出ウイルス力価を 図1Aに示します。これら4つのHCoVはすべて経鼻ALI培養で生産的に複製されま?...
ディスカッション
ここで詳述する方法は、患者由来の鼻上皮細胞を空気と液体の界面で増殖させ、HCoVと宿主の相互作用の研究に適用する一次上皮培養システムについて説明しています。分化されると、これらの鼻腔ALI培養物は、繊毛細胞、杯細胞、基底細胞が表される不均一な細胞集団や、繊毛と粘液分泌を頑強に鼓動する無傷の粘膜繊毛機能など、 in vivo 鼻上皮の多くの特徴を再現します。この不均...
開示事項
Susan Weissは、Ocugenの科学諮問委員会のメンバーです。ノーム・A・コーエンは、GSK、アストラゼネカ、ノバルティス、サノフィ/レジェロン、オイスター・ポイント・ファーマシューティカルズのコンサルティングを担当し、米国特許「Therapy and Diagnostics for Respiratory Infection」(10,881,698 B2, WO20913112865)を取得し、GeneOne Life Sciencesとライセンス契約を結んでいます。
謝辞
この研究には、次の資金源があります:国立衛生研究所(NIH)R01AI 169537(SRWおよびN.A.C.)、NIH R01AI 140442(S.R.W.)、VA Merit Review CX001717(N.A.C.)、VA Merit Review BX005432(S.R.W.およびN.A.C.)、Penn Center for Research on Coronaviruses and other Emerging Pathogens(S.R.W.)、Laffey-McHugh Foundation(S.R.W.およびN.A.C.)、 T32 AI055400 (CJO)、T32 AI007324 (AF)。
資料
| Name | Company | Catalog Number | Comments |
| Alexa Fluor secondary antibodies (488, 594, 647) | Invitrogen | Various | |
| BSA (bovine serum albumin) | Sigma-Aldrich | A7906 | |
| cOmplete mini EDTA-free protease inhibitor | Roche | 11836170001 | |
| Cytotoxicity detection kit | Roche | 11644793001 | |
| DMEM (Dulbecco's Modified Eagle Media) | Gibco | 11965-084 | |
| DPBS (Dulbecco's Phosphate Buffered Saline) | Gibco | 14190136 | |
| DPBS + calcium + magnesium | Gibco | 14040-117 | |
| Endohm-6G measurement chamber | World Precision Instruments | ENDOHM-6G | |
| Epithelial cell adhesion marker (EpCAM; CD326) | eBiosciences | 14-9326-82 | |
| Epithelial Volt/Ohm (TEER) Meter (EVOM) | World Precision Instruments | 300523 | |
| FBS (Fetal Bovine Serum) | HyClone | SH30071.03 | |
| FV10-ASW software for imaging | Olympus | Version 4.02 | |
| HCoV-NL63 (Human coronavirus, NL63) | BEI Resources | NR-470 | |
| HCoV-NL63 nucleocapsid antibody | Sino Biological | 40641-V07E | |
| Hoescht stain | Thermo Fisher | H3570 | |
| Laemmli sample buffer (4x) | BIO-RAD | 1610747 | |
| LLC-MK2 cells | ATCC | CCL-7 | To titrate HCoV-NL63 |
| MERS-CoV (Human coronavirus, Middle East Respiratory Syndrome Coronavirus (MERS-CoV), EMC/2012) | BEI Resources | NR-44260 | |
| MERS-CoV nucleocapsid antibody | Sino Biological | 40068-MM10 | |
| MUC5AC antibody | Sigma-Aldrich | AMAB91539 | |
| Olympus Fluoview confocal microscope | Olympus | FV1000 | |
| Phalloidin-iFluor 647 stain | Abcam | ab176759 | |
| PhosStop easy pack (phosphatase inhibitors) | Roche | PHOSS-RO | |
| Plate reader | Perkin Elmer | HH34000000 | Any plate reader or ELISA reader is sufficient; must be able to read absorbance at 492 nm |
| RIPA buffer (50 mM Tris pH 8; 150 mM NaCl; 0.5% deoxycholate; 0.1% SDS; 1% NP40) | Thermo Fisher | 89990 | Can prep in-house or purchase |
| RNeasy Plus Kit | Qiagen | 74134 | |
| SARS-CoV-2 (SARS-Related Coronavirus 2, Isolate USA-WA1/2020) | BEI Resources | NR-52281 | |
| SARS-CoV-2 nucleocapsid antibody | Genetex | GTX135357 | |
| Triton-X 100 | Fisher Scientific | BP151100 | |
| Type IV β- tubulin antibody | Abcam | ab11315 | |
| VeroCCL81 cells | ATCC | CCL-81 | To titrate MERS-CoV |
| VeroE6 cells | ATCC | CRL-1586 | To titrate SARS-CoV-2 |
参考文献
- Otter, C. J., et al. Infection of primary nasal epithelial cells differentiates among lethal and seasonal human coronaviruses. Proceedings of the National Academy of Sciences of the United States of America. 120 (15), 2218083120 (2023).
- Fehr, A., Perlman, S. Coronaviruses: An overview of their replication and pathogenesis. Methods in Molecular Biology. 1282, 1-23 (2015).
- Gaunt, E. R., Hardie, A., Claas, E. C. J., Simmonds, P., Templeton, K. E. Epidemiology and clinical presentations of the four human coronaviruses 229E, HKU1, NL63, and OC43 detected over 3 years using a novel multiplex real-time PCR method. Journal of Clinical Microbiology. 48 (8), 2940-2947 (2010).
- Kesheh, M. M., Hosseini, P., Soltani, S., Zandi, M. An overview on the seven pathogenic human coronaviruses. Reviews in Medical Virology. 32 (2), 2282 (2022).
- MERS-CoV Worldwide Overview. European Centre for Disease Prevention and Control Available from: https://www.ecdc.europa.eu/en/middle-east-respiratory-syndrome-coronavirus-mers-cov-situation-update (2022)
- Cao, Y., Liu, X., Xiong, L., Cai, K. Imaging and clinical features of patients with 2019 novel coronavirus SARS-CoV-2: A systematic review and meta-analysis. Journal of Medical Virology. 92 (9), 1449-1459 (2020).
- Vareille, M., Kieninger, E., Edwards, M. R., Regamey, N. The airway epithelium: Soldier in the fight against respiratory viruses. Clinical Microbiology Reviews. 24 (1), 210-229 (2011).
- Farzal, Z., et al. Comparative study of simulated nebulized and spray particle deposition in chronic rhinosinusitis patients. International Forum of Allergy and Rhinology. 9 (7), 746-758 (2019).
- Gaeckle, N. T., Pragman, A. A., Pendleton, K. M., Baldomero, A. K., Criner, G. J. The oral-lung axis: The impact of oral health on lung health. Respiratory Care. 65 (8), 1211-1220 (2020).
- Hou, Y., et al. SARS-CoV-2 reverse genetics reveals a variable infection gradient in the respiratory tract. Cell. 182, 429-446 (2020).
- Hariri, B. M., Cohen, N. A. New insights into upper airway innate immunity. American Journal of Rhinology and Allergy. 30 (5), 319-323 (2016).
- Hiemstra, P. S., McCray, P. B., Bals, R. The innate immune function of airway epithelial cells in inflammatory lung disease. European Respiratory Journal. 45 (4), 1150-1162 (2015).
- Hatton, C. F., et al. Delayed induction of type I and III interferons mediates nasal epithelial cell permissiveness to SARS-CoV-2. Nature Communications. 12 (1), 7092 (2021).
- Sungnak, W., et al. SARS-CoV-2 entry factors are highly expressed in nasal epithelial cells together with innate immune genes. Nature Medicine. 26 (5), 681-687 (2020).
- Li, Y., et al. SARS-CoV-2 induces double-stranded RNA-mediated innate immune responses in respiratory epithelial-derived cells and cardiomyocytes. Proceedings of the National Academy of Sciences of the United States of America. 118 (16), 2022643118 (2021).
- Comar, C. E., et al. MERS-CoV endoribonuclease and accessory proteins jointly evade host innate immunity during infection of lung and nasal epithelial cells. Proceedings of the National Academy of Sciences of the United States of America. 119 (21), 2123208119 (2022).
- Lee, R. J., et al. Bacterial D-amino acids suppress sinonasal innate immunity through sweet taste receptors in solitary chemosensory cells. Science Signaling. 10 (495), (2017).
- Brewington, J. J., et al. Brushed nasal epithelial cells are a surrogate for bronchial epithelial CFTR studies. JCI Insight. 3 (13), 99385 (2018).
- Comer, D. M., Elborn, J. S., Ennis, M. Comparison of nasal and bronchial epithelial cells obtained from patients with COPD. PLoS One. 7 (3), e32924 (2012).
- Vanders, R. L., Hsu, A., Gibson, P. G., Murphy, V. E., Wark, P. A. B. Nasal epithelial cells to assess in vitro immune responses to respiratory virus infection in pregnant women with asthma. Respiratory Research. 20 (1), 259 (2019).
- Lee, R. J., et al. Fungal aflatoxins reduce respiratory mucosal ciliary function. Scientific Reports. 6, 33221 (2016).
- Patel, N. N., et al. Fungal extracts stimulate solitary chemosensory cell expansion in noninvasive fungal rhinosinusitis. International Forum of Allergy and Rhinology. 9 (7), 730-737 (2019).
- Baer, A., Kehn-Hall, K. Viral concentration determination through plaque assays: Using traditional and novel overlay systems. Journal of Visualized Experiments. 93 (93), e52065 (2014).
- Robinot, R., et al. SARS-CoV-2 infection induces the dedifferentiation of multiciliated cells and impairs mucociliary clearance. Nature Communications. 12 (1), 4354 (2021).
- Whitsett, J. A. Airway epithelial differentiation and mucociliary clearance. Annals of the American Thoracic Society. 15, S143-S148 (2018).
- Gao, N., Raduka, A., Rezaee, F. Respiratory syncytial virus disrupts the airway epithelial barrier by decreasing cortactin and destabilizing F-actin. Journal of Cell Science. 135 (16), 259871 (2022).
- Schmidt, H., et al. IL-13 impairs tight junctions in airway epithelia. International Journal of Molecular Sciences. 20 (13), 3222 (2019).
- Huang, Z. Q., et al. Interleukin-13 alters tight junction proteins expression thereby compromising barrier function and dampens rhinovirus induced immune responses in nasal epithelium. Frontiers in Cell and Developmental Biology. 8, 572749 (2020).
- Saatian, B., et al. Interleukin-4 and interleukin-13 cause barrier dysfunction in human airway epithelial cells. Tissue Barriers. 1 (2), e24333 (2013).
- Coles, J. L., et al. A revised protocol for culture of airway epithelial cells as a diagnostic tool for primary ciliary dyskinesia. Journal of Clinical Medicine. 9 (11), 3753 (2020).
- Baldassi, D., Gabold, B., Merkel, O. M. Air−liquid interface cultures of the healthy and diseased human respiratory tract: Promises, challenges, and future directions. Advanced NanoBiomed Research. 1 (6), 2000111 (2021).
- Seibold, M. A. Interleukin-13 stimulation reveals the cellular and functional plasticity of the airway epithelium. Annals of the American Thoracic Society. 15, S98-S106 (2018).
- Morrison, C. B., et al. SARS-CoV-2 infection of airway cells causes intense viral and cell shedding, two spreading mechanisms affected by IL-13. Proceedings of the National Academy of Sciences of the United States of America. 119 (16), 2119680119 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved