Method Article
فهم تأثير البكتيريا المعتدلة على الليزوجينات من خلال علم النسخ
In This Article
Summary
يتيح هذا البروتوكول الكشف عن تأثير النبوءات على مضيفيها. تتم مزامنة الثقافات البكتيرية باستخدام الظروف التي تدعم الحالة المحللة بشكل أفضل ، مما يحد من الحث التلقائي. يميز RT-qPCR بشكل لا لبس فيه الجينات المقيدة بالبعوض وتلك غير المنفصلة عن التحكم في العاثيات عن تلك التي يتم التعبير عنها أثناء دورة النسخ المتماثل الليتي.
Abstract
تم العثور على العاثيات المعتدلة مدمجة كنبوءات في غالبية الجينومات البكتيرية. بعض النبوءات خفية وثابتة في الكروموسوم البكتيري ، لكن البعض الآخر نشط ويمكن تشغيله في شكل تكراري إما تلقائيا أو عن طريق التعرض لعوامل محفزة. ترتبط النبوءات عادة بالقدرة على منح إنتاج السموم أو غيرها من السمات المرتبطة بالفوعة على الخلية المضيفة. وقد أظهرت الدراسات الحديثة أنها يمكن أن تلعب دورا أكبر بكثير في تغيير فسيولوجيا مضيفيها. مكنتنا التقنية الموصوفة هنا من التحقيق في كيفية تأثير النبوءات على التعبير الجيني في البكتيريا الانتهازية Pseudomonas aeruginosa.
في هذا العمل ، تمت مقارنة نمو سلالة P. aeruginosa من النوع البري PAO1 مع نمو المحللين متساوي المنشأ الذي يحمل مجموعات مختلفة من النبوءات من سلالة ليفربول الوبائية (LES) LESB58. في مزرعة الليزوجين ، ستدعم نسبة من الخلايا البكتيرية تكرار البكتيريا lytic (الحث التلقائي) بمستوى عال من التعبير لكل خلية من جينات العاثية المتأخرة ، مثل تلك المرتبطة بتجميع جزيئات العاثية ، وبالتالي إخفاء التعبير الجيني منخفض المستوى المرتبط بالتعبير الجيني المقيد بالليزوجين. وبالتالي فإن تأثير الحث التلقائي يمكن أن يحجب التعبير الجيني للبعوض عبر مجموعة من الليزوجين.
تم استخدام تجارب تنميط النمو لتحديد الحث التلقائي ، والذي كان ضئيلا خلال مرحلة النمو الأسي المبكرة. توضح هذه الدراسة كيفية تحضير مزارع العينات خلال مرحلة النمو الأسي المبكرة وكيفية إعداد ضوابط كافية على الرغم من انخفاض أعداد الخلايا. تضمن هذه البروتوكولات مقارنة موثوقة وقابلة للتكرار بين البكتيريا من النوع البري والبكتيريا المحللة في ظل ظروف مختلفة ، وبالتالي تحسين التنميط النسخي لجينومات البروفاج والمساعدة في تحديد وظائف النبوءة غير المعترف بها سابقا.
Introduction
في الآونة الأخيرة ، ولد العلاج بالعاثيات لمعالجة مقاومة مضادات الميكروبات1 وتحرير الجينات2 القائم على كريسبر-كاس اهتماما متجددا بأبحاث البكتيريا. مرة أخرى ، مكنت التطورات في التكنولوجيا الحيوية من إجراء تحقيق أعمق في التفاعلات بين البكتيريا والعاثيات3. ومع ذلك ، فإن الاستخدام العلاجي للعاثية ("العلاج بالعاثيات") يعوقه مخاوف بشأن عمل العاثيات كعناصر وراثية متحركة مع القدرة على نقل جينات الفوعة والمقاومة أفقيا4. إن اتساع "المادة المظلمة"5 (جينات ذات وظائف غير معروفة) أمر مقلق وجذاب على حد سواء. تعتبر المادة المظلمة فجوة في فهمنا لبيولوجيا العاثيات وموردا غير مستغل إلى حد كبير للأدوات الجزيئية والعلاجات الجديدة المحتملة6. يعمل تطوير تقنيات التسلسل عالية الإنتاجية ، جنبا إلى جنب مع تحسين التعليقات التوضيحية الجينية7،8،9 وخوارزميات طي الببتيدالجديدة 10 ، على تحسين الكشف عن جينات العاثيات ووصفها والتنبؤ الوظيفي بها. ومع ذلك ، لا يزال العلم بعيدا عن التحقق من صحة وظائف الجينات لمعظم العاثيات في الثقافة أو في العالم الحقيقي.
يمكن لتسلسل الحمض النووي الريبي (RNA-Seq) رسم خريطة عالمية للتعبير الجيني أثناء الإصابة بالعاثيات وقد حسن بشكل كبير فهم كل من العاثيات والعناصر البكتيرية المشاركة في الدورات المحللة والحالة11,12. أثناء العمليات المحللة ، يتم دمج جينومات العاثية المعتدلة في الحمض النووي البكتيري لتصبح نبوءات13. يمكن استخدام تجارب التنميط الجيني العالمية لتحديد الجينات المقيدة بالبعوض التي يتم ترميزها على جينومات العاثية المعتدلة ولكن يتم التعبير عنها فقط خلال الحالة المحللة11. هذه الجينات لا تشفر البروتينات الهيكلية للعاثيات ولا تشارك في أي عمليات عدوى العاثيات. يمكن استخدام RNA-Seq لتحديد تلك الجينات التي من المرجح أن تؤثر على بيولوجيا المضيف البكتيري ، إما عن طريق إحداث اكتساب الوظيفة أو تنظيم الجينات البكتيرية الموجودة ، وبالتالي تمكين البكتيريا في كثير من الأحيان من التكيف مع البيئات المتغيرة. لذلك ، يمكن دراسة قدرة النبوءات على العمل كسادة دمى ميكروبية ، والتحكم في مجموعة من الوظائف البكتيرية.
هناك نوعان من العوائق الرئيسية أمام التحليل الفعال للتعبير الجيني المقيد بالبوفاج. أولا ، يعد توفر المضيفين المعرضين للخطر مشكلة رئيسية. بحكم التعريف ، يتم دمج النبوءات بالفعل في جينوم المضيف المحدد ، لذلك من الصعب العثور على مضيف من النوع البري حساس لمقارنة التعبير الجيني العالمي في وجود النبوءة وغيابها. يمكن تحقيق ذلك إما من خلال الإصابة الجديدة لمضيف آخر حساس أو حذف النبوءة من العزلة الأصلية من النوع البري ، دون تعطيل بقية الجينوم المضيف. الحاجز الثاني يكمن في الطبيعة غير المتجانسة للسكان lysogenic. تتحلل بعض النبوءات من خلال الطفرة أو إعادة التركيب لتصبح "خفية" ، مما يعني أنها ثابتة في موقع معين من الجينوم البكتيري. ومع ذلك ، فإن النبوءات الأخرى "نشطة" ويمكن تحريضها في دورة تكرارية ، تحلل تلقائيا أو بعد التعرض لعوامل محفزة. في العديد من الثقافات المحللة ، يعني معدل الحث التلقائي أن نسبة من الخلايا البكتيرية تخضع دائما لتكرار العاثية lytic14،15،16. يخفي المستوى العالي من التعبير عن جينات العاثيات المتأخرة في هذه المجموعات التعبير الجيني منخفض المستوى المرتبط بالتعبير الجيني المقيد بالليسوجين11,17. قد تختلف نسبة الليزوجينات التي تخضع لتحريض النبوء التلقائي باختلاف حالة النمو أو ظروف النمو أو المحفزات الأخرى. لذلك ، لدراسة تأثيرات النبوءات على الليزوجين ، يجب تقليل أحداث تحريض النبوء التلقائي قدر الإمكان عن طريق تحسين ظروف النمو لصالح الحالة الليزوجينية.
تقدم هذه الدراسة تقريرا عن العمل التحضيري المنجز للتحقيق في تأثير مجموعة من نبوءات التعايش من سلالة ليفربول الوبائية (LES) من Pseudomonas aeruginosa. تم تحفيز النبوءات النشطة وعزلها من LES واستخدامها لإصابة سلالة مضيف P. aeruginosa النموذجية ، PAO116،18،19. تم تسلسل الجينومات الكاملة لسلالة P. aeruginosa من النوع البري ، PAO1 ، و lysogen ، PAO1Φ2 ، (على عمق تغطية 30x) لضمان هوية السلالة البرية وللتأكد من أن الليزوجين كان متساوي المنشأ. ارتبط LES بزيادة المراضة والوفيات لدى مرضى التليف الكيسي ، وقد تم اقتراح LESphages 19 للمساعدة في التكيف مع بيئة الرئة التليف الكيسي16،19،20. على الرغم من الأدلة القوية على أن هذه النبوءات تؤثر على بيولوجيا مضيفها20,21 ، فإن غالبية وظائفها الجينية لم يتم توصيفها بعد ، والآليات المحددة للتفاعل غير مفهومة بشكل جيد. يمكن لنهج النسخ أن يكشف تجريبيا عن وظائف جين النبوءة في خلفية مضيف خاضعة للرقابة. نظرا لأن الحث التلقائي يمكن أن يؤثر على ملفات تعريف التعبير ، توضح هذه المقالة كيفية تحسين ظروف النمو لصالح الحالة الليزوجينية. يمكن التحقق من صحة هذا التزامن للثقافات بواسطة تفاعل البوليميراز المتسلسل في الوقت الفعلي لتحديد مستويات التعبير عن العلامات الجينية الرئيسية المرتبطة بالمراحل الحاسمة من تكرار العاثية LES في PAO1. تم استخدام نفس النهج سابقا لتحديد الوظائف المقيدة للبوفاج للعاثيات السامة Shiga التي تؤثر على الحركة ومقاومة الأحماض ومقاومة مضادات الميكروبات في الإشريكية القولونية 11،17،21،22.
Protocol
1. إنشاء مضيف مؤشر قابل للتحديد (الشكل 1)
ملاحظة: يمكن أن تحتوي محللات زراعة العاثيات على خلايا ملوثة من المضيف البكتيري الأصلي. يسمح وجود سلالة مؤشر مقاومة للمضادات الحيوية بالتمييز بين سلالة المؤشر والمضيف البكتيري الأصلي للبوفاج. يتيح استخدام سلالة مؤشر قابلة للتحديد التعداد الدقيق لجزيئات العاثية المعدية دون الحاجة إلى خطوات الطرد المركزي أو الترشيح لإزالة العاثية من خلايا الليزوجين باتباع خطوات تضخيم العاثيات. تقلل سلالة مضيف المؤشر القابلة للتحديد أيضا من وقت وعدد خطوات تعداد العاثيات بحيث يمكن تجربة حالات متعددة في وقت واحد.
- تحديد مؤشر مناسب سلالة المضيف عرضة للعدوى lytic و lysogenic من قبل العاثية المعتدلة ذات الأهمية. تم استخدام سلالة مختبر P. aeruginosa PAO118,20 وهي عرضة للعاثيات الثلاثة LES (LESΦ2 و LESΦ3 و LESΦ4).
- اختر عاملا انتقائيا مناسبا (تم استخدام ريفامبيسين هنا) ، وقم بإجراء مقايسة تخفيف المرق لتحديد الحد الأدنى للتركيز المثبط (MIC) لمضيف المؤشر (16 ميكروغرام · مل −1 هو MIC ل PAO1) 23,24.
- تعريض الثقافات المضيفة للمؤشر بالتتابع لزيادة تركيزات العامل الانتقائي في مرق الليزوجيني (LB) ، بدءا من أسفل MIC (في هذه الحالة 5 ميكروغرام · مل − 1) ، لمدة 18-24 ساعة ، مع الاهتزاز ، وعند 37 درجة مئوية.
- نقل المزرعة التي تنمو بأعلى تركيز بنسبة 1: 100 (لقاح إلى متوسط) إلى تركيزات متزايدة مرتين من العامل الانتقائي (18-24 ساعة في كل مرة) حتى يتم زيادة MIC بشكل كاف. أصبح PAO1 سلالة مقاومة للريفامبيسين (PAO1-RifR) عند 300 ميكروغرام · مل − 1 ريفامبيسين.
2. التعداد الزمني المباشر للتحريض التلقائي (الشكل 2)
- قم بإعداد مزارع بداية ليلية لكل من الليزوجين (على سبيل المثال ، P. aeruginosa PAO1 lysogen الذي يؤوي عاثيات LES) ومضيف المؤشر (PAO1-RifR) عن طريق تلقيح مستعمرة واحدة في 5 مل من LB ، واحتضانها عند 37 درجة مئوية مع الاهتزاز عند 180 دورة في الدقيقة (18-24 ساعة).
- قم بإعداد مزارع مضيفة الليزوجين والمؤشرات الطازجة عن طريق تلقيح المزارع الليلية في 100 مل من LB بنسبة 1: 100 ، واحتضانها عند 37 درجة مئوية مع الاهتزاز (180 دورة في الدقيقة).
- مراقبة نمو الليزوجين عن طريق قياس OD600 وعدد قابل للحياة باستخدام تقنية مايلز ميسرا25. للقيام بذلك ، اجمع عينة 1 مل من كل مزرعة ليسوجين كل ساعة من نقطة التلقيح لمدة 8 ساعات.
- قم بتخفيف العينة بشكل تسلسلي مباشرة بعد جمعها بإضافة 100 ميكرولتر من العينة إلى 900 ميكرولتر من الوسط المعني. دوامة جيدا بأقصى سرعة ، وتجاهل الطرف عند كل تخفيف ، واستمر في سلسلة التخفيف من 10−1 إلى 10−9.
- ضع 10 ميكرولتر من التخفيفات المطلوبة في ثلاث نسخ على صفيحة أجار LB ، واتركها تجف ، واحتضانها عند 37 درجة مئوية لمدة 18-24 ساعة.
- لحساب عدد الخلايا البكتيرية القابلة للحياة ، ابحث عن تخفيف مع مستعمرات يمكن عدها بسهولة. احسب عدد المستعمرات في كل بقعة ، ثم استخدم الصيغة التالية:

ملاحظة: مع نمو ثقافة الليزوجين ، سيتم إنتاج جزيئات العاثية النشطة عن طريق الحث التلقائي. يعني إنتاج العاثيات المعدية أن النسخ الخاص بالسكان المحلزوجين ملوث الآن بالتعبير الجيني المرتبط بدورة التكاثر التحلل من إشارة تكرار العاثية المحللة واستجابة الخلية المضيفة المقابلة. وبالتالي ، من المهم تحديد مرحلة النمو التي تكون فيها نسبة الخلايا المحللة لتحرير جزيئات العاثيات المعدية أعلى من أجل الحد من أكبر قدر ممكن من ضوضاء النسخ الخلفية (الناتجة عن نسخ العاثيات lytic) قدر الإمكان في مجموعة البيانات.
- لتعداد جزيئات العاثيات المعدية في كل عينة زمنية ، قم بتلقيح 5 مل من الآجار البكتريولوجي المعقم بنسبة 0.4٪ في LB (أجار علوي) مع 100 ميكرولتر من مضيف مؤشر الطور الأسي المتوسط (OD600: 0.4-0.5 ؛ في هذه الحالة ، PAO1-RifR) في وجود عامل انتقائي مناسب (50 ميكروغرام · مل −1 ريفامبيسين في هذه الحالة ، حيث أن ميكروفون مضيف PAO1 هو 16 ميكروغرام · مل − 1 ؛ انظر جدول المواد ، الصف 8 والصف 9)
- ضع 10 ميكرولتر من نفس التخفيف التسلسلي (انظر الخطوة 2.2.2) على طبقة الآجار العلوية الملقحة ، واتركها تجف قبل الحضانة عند 37 درجة مئوية لمدة 18-24 ساعة.
- لحساب جزيئات العاثيات المعدية ، ابحث عن تخفيف مع لويحات يمكن عدها بسهولة. احسب عدد اللويحات في كل بقعة.

- ابحث عن الوقت / الحالة التي يكون فيها الحث التلقائي لكل CFU (وحدة تشكيل المستعمرة) ضئيلا للخطوات التجريبية الإضافية.
3. تحضير مزارع الليزوجين غير المستحثة والمستحثة لاستخراج الحمض النووي الريبي (الشكل 3)
- قم بإعداد مزرعة ليلية جديدة عن طريق تلقيح مستعمرة واحدة من الليزوجين في 5 مل من LB ، واحتضانها عند 37 درجة مئوية مع الاهتزاز (180 دورة في الدقيقة) لمدة 18-24 ساعة.
- الاستزراع الفرعي الاستزراع الليلي في 80 مل من LB بنسبة 1: 100 في ثماني قوارير سعة 250 مل.
- تسمية القارورة الأولى بأنها "غير مستحثة" والأخرى على أنها "مستحثة" ، جنبا إلى جنب مع النقاط الزمنية التي يجب فيها حصاد كل عينة (على سبيل المثال ، "t المستحث = 0" ، "t المستحث = 10 دقائق" ، "t المستحث = 20 دقيقة" ، إلخ ؛ الشكل 3).
- بعد 90 دقيقة من الحضانة ، عندما يكون OD600 بين 0.1-0.2 ، أو في وقت الحد الأدنى من الحث التلقائي (انظر المناقشة) ، أضف 4 ميكرولتر من حمض الخليك الجليدي 1٪ (v / v) إلى القارورة غير المستحثة (الشكل 3).
ملاحظة: نظرا لأن العامل المستحث في هذا العمل تم تصنيعه باستخدام حمض الخليك الجليدي بنسبة 1٪ كمذيب ، فقد تمت إضافة نفس الكمية من المذيب بمفردها كخطوة تحكم. يمكن النظر في ضوابط بديلة اعتمادا على إعداد محفزات مختلفة. - أضف مزرعة 80 مل من الدورق غير المستحث إلى 720 مل من LB المعقم ، وأضف على الفور محلول التوقف (الجليد البارد 5٪ [v / v] الفينول ، الرقم الهيدروجيني 4.3 ، 95٪ [v / v] الإيثانول) باستخدام حجم 20٪ من حجم المزرعة (160 مل) ، واحتضان على الجليد لمدة لا تقل عن 30 دقيقة ولا تزيد عن 2 ساعة لتثبيت نسخ الحمض النووي الريبي12 ، 26,27. هذه هي العينة غير المستحثة.
- حث المزارع المتبقية في سبع قوارير سعة 250 مل (الشكل 3) باستخدام ميكروفون عامل محفز مناسب (في هذه الحالة ، 25 مجم · مل −1 نورفلوكساسين ، محضر في حمض الخليك الجليدي 1٪ [w / v] ، يستخدم بتركيز نهائي قدره 1 ميكروغرام · مل −1) ، واخلطه جيدا ، واحتضنه عند 37 درجة مئوية مع الاهتزاز عند 180 دورة في الدقيقة لمدة ساعة واحدة.
ملاحظة: ستجبر هذه الخطوة ثقافة الليزوجين على الدخول في حالة أكثر تنسيقا من النسخ المتماثل. ستبدأ معظم الخلايا في المزرعة في الخضوع لإنتاج lytic لجزيئات العاثيات المعدية. - اسمح للخلايا بالتعافي عن طريق إضافة 80 مل من المزرعة من القارورة المستحثة إلى 720 مل من LB المعقم ، مما يخفف بشكل فعال العامل المحرض. احصد الخلايا البكتيرية من كل قارورة كل 10 دقائق من الوقت 0 حتى 1 ساعة عن طريق إضافة محلول توقف ، كما هو مذكور في الخطوة 3.5.
ملاحظة: يعمل محلول التوقف على استقرار الحمض النووي الريبي لمدة تصل إلى 2 ساعة. ومع ذلك ، لتعزيز استقرار العينة ، قم بإجراء جميع الخطوات الإضافية عند 4 درجات مئوية. - الحصاد عن طريق الطرد المركزي عند 10000 × جم لمدة 15 دقيقة عند 4 درجات مئوية في أسرع وقت ممكن ، لا يتجاوز 2 ساعة بعد المعالجة لتجنب تدهور الحمض النووي الريبي.
- تخلص من المادة الطافية ، وأعد تعليق الكريات البكتيرية برفق في السائل المتبقي باستخدام ماصة أوتوماتيكية قابلة للتعديل قبل نقل كل عينة إلى أنبوب ميكروفوج سعة 1.5 مل.
- أجهزة الطرد المركزي أنابيب microfuge بسرعة عالية (13000 × جم) في microfuge عند 4 °C لمدة 1 دقيقة ، وتجاهل الطافية المتبقية.
- قم بتجميد الكريات بسرعة عن طريق غمر كل أنبوب ميكروفوج مغلق في النيتروجين السائل. سيساعد هذا في التحلل الفعال للخلايا لاستخراج الحمض النووي الريبي.
- أضف TRIzol (1 مل) إلى كل حبيبة مجمدة ، وقم بتجانس التعليق عن طريق السحب (لا دوامة). يخزن في درجة حرارة -80 درجة مئوية حتى يصبح جاهزا لإجراء استخراج الحمض النووي الريبي لجميع العينات.
ملاحظة: يمكن إيقاف البروتوكول مؤقتا عند هذه النقطة. - كرر الخطوات من 3.1 إلى 3.13 مع ثلاث نسخ بيولوجية.
4. عزل الحمض النووي الريبي من مزارع الليزوجين غير المستحثة والمستحثة
حرج: يجب تنفيذ كل هذه الخطوات في بيئة خالية من RNase28. يجب مسح طاولات العمل بنسبة 10٪ NaClO أو معطل RNase الخاص. يجب معالجة أدوات المختبر بمثبطات RNase مثل علاج DEPC ، ويجب استخدام الماء الخالي من النيوكلياز في جميع التفاعلات.
- قم بإذابة الكريات المجمدة المعالجة ب TRIzol من الخطوة 3.12 على الثلج ، وأضف 400 ميكرولتر من الكلوروفورم من درجة البيولوجيا الجزيئية.
- حرك القوارير جيدا عن طريق الانعكاس لمدة 10 ثوان لإكمال تحلل جميع الخلايا ( لا دوامة). ثم احتضان في درجة حرارة الغرفة (21 درجة مئوية) لمدة 2-5 دقائق.
- افصل الطبقة المائية عن مزيج تريزول / كلوروفورم عن طريق الطرد المركزي باستخدام وحدة ميكروفوج مبردة على سطح الطاولة عند 4 درجات مئوية و 13000 × جم لمدة 15 دقيقة.
- اجمع الطور المائي (~ 500 ميكرولتر ، الطبقة العليا) باستخدام ماصة 1000 ميكرولتر ، مع الحرص على عدم إزعاج الطور البيني أو الطور العضوي (الطبقة السفلية). نقل إلى أنبوب microfuge جديد 1.5 مل.
- أضف 450 ميكرولتر من الأيزوبروبانول بدرجة البيولوجيا الجزيئية إلى الطور المائي المنفصل ، واخلطه جيدا عن طريق الانعكاس ( لا دوامة) ، واحتضنه في درجة حرارة الغرفة (21 درجة مئوية) لمدة 30 دقيقة.
- استعادة الحمض النووي الريبي عن طريق الطرد المركزي باستخدام جهاز طرد مركزي مبرد عند 4 درجات مئوية و 13000 × جم لمدة 30 دقيقة.
- تخلص من المادة الطافية دون إزعاج حبيبات الحمض النووي الريبي ، واغسل الحبيبات مرتين ب 800 ميكرولتر من الإيثانول بنسبة 70٪ المحضر بماء خال من النيوكلياز (لا تقم بسحب الماصة لأعلى ولأسفل). تأكد من استقرار حبيبات الحمض النووي الريبي عن طريق تكرار خطوة الطرد المركزي لمدة 5 دقائق بعد كل غسلة.
- تخلص من الإيثانول وجفف الحبيبات بالهواء.
ملاحظة: قم بنضح الإيثانول حول الحبيبات بعناية باستخدام طرف دقيق سعة 10 ميكرولتر ، وجفف الحبيبات عن طريق قلب الأنبوب على ورق نشاف نظيف. يجب أن تتحول حبيبات الحمض النووي الريبي إلى اللون ، ويجب أن تظهر الحواف مكشكشة ومرئية. يمكن أن يؤدي التجفيف القليل جدا إلى ترك الإيثانول المتبقي الذي يمكن أن يؤثر على عمليات المصب ، وتجفيف الحبيبات كثيرا يمكن أن يجعل إعادة التعليق صعبة. - أعد تعليق الحمض النووي الريبي في ماء خال من النيوكلياز (50 ميكرولتر) عن طريق الحضانة عند 65 درجة مئوية على شاكر حراري مع خلط متقطع (كل 30 ثانية) لمدة 3-5 دقائق.
الحرجة: مجموعة 2'- OH من الحمض النووي الريبي قادرة على تحفيز الانقسام الذاتي لخيوط الحمض النووي الريبي عند درجة حرارة عالية أعلى من 65 درجة مئوية ودرجة حموضة عالية. درجات الحرارة أقل من 65 درجة مئوية ستؤخر إعادة تعليق الحمض النووي المتبقي ، مما يحد من كمية الحمض النووي التي يجب هضمها في مرحلة لاحقة مع هضم DNase I. وبالتالي ، فإن الحفاظ على درجة الحرارة عند 65 درجة مئوية أمر بالغ الأهمية للحصول على أفضل العينات.
ملاحظة: يمكن إيقاف البروتوكول مؤقتا عند هذه النقطة ، ويمكن تخزين العينات عند -80 درجة مئوية.
5. إزالة الحمض النووي الملوث من الحمض النووي الريبي عن طريق علاج DNase
- لإزالة الحمض النووي الملوث من إجمالي الحمض النووي الريبي قبل تخليق cDNA من الشريط الأول ، أضف حجم 0.1 من 10x DNase buffer و 1 μL من إنزيم DNase إلى 10 ميكروغرام من إجمالي الحمض النووي الريبي. اخلطي الأنبوب برفق واحتضنه على حرارة 37 درجة مئوية لمدة 30 دقيقة.
- أعد تعليق كاشف تعطيل DNase ، وأضف ما لا يقل عن 2 ميكرولتر أو حجم 10٪ من إجمالي حجم التفاعل. تخلط جيدا ، وتحضن العينات لمدة 5 دقائق في درجة حرارة الغرفة (21 درجة مئوية) أثناء إعادة تشتت كاشف تعطيل DNase.
- قم بتكسير كواشف DNase عن طريق الطرد المركزي باستخدام جهاز طرد مركزي دقيق على سطح الطاولة عند 10000 × جم لمدة 1.5 دقيقة.
- انقل المادة الطافية التي تحتوي على الحمض النووي الريبي إلى أنبوب جديد دون إزعاج الحبيبات.
ملاحظة: تحقق من جودة الحمض النووي الريبي باستخدام مقياس الطيف الضوئي للأشعة فوق البنفسجية بمقياس 1 ميكرولتر ومحلل كمبيوتر الحمض النووي القائم على الموائع الدقيقة وفقا لتعليمات الشركة المصنعة ؛ يمكن تخزين إجمالي الحمض النووي الريبي المنقى عند -80 درجة مئوية. بالنسبة ل qRT-PCR ، يمكن استخدام الحمض النووي الريبي مباشرة في هذه المرحلة. بالنسبة لعمليات المصب الأكثر حساسية ، مثل تسلسل الحمض النووي الريبي ، والتي تتطلب جودة عينة صارمة ، يجب الوصول إلى نسبةA 260/230 من ε 2.0 للمضي قدما. - قم بتكوين حجم محلول الحمض النووي الريبي الخالي من الحمض النووي إلى 500 ميكرولتر باستخدام الماء الخالي من النيوكلياز.
- أضف 50 ميكرولتر من خلات الصوديوم 3M الخالية من النيوكلياز (درجة الحموضة 5.3) و 495 ميكرولتر من الأيزوبروبانول. تخلط جيدا ، واحتضان في درجة حرارة الغرفة لمدة 30 دقيقة.
ملاحظة: هذه الخطوة سوف تعجل الحمض النووي الريبي. - استعادة الحمض النووي الريبي عن طريق الطرد المركزي عند 13000 × جم و 4 درجات مئوية لمدة 30 دقيقة.
- اغسل حبيبات الحمض النووي الريبي ثلاث مرات بإيثانول 70٪ بارد عن طريق الطرد المركزي للعينات عند 13000 × جم و 4 درجات مئوية لمدة 5 دقائق بعد كل غسلة لإزالة الأملاح تماما.
- تحقق من جودة الحمض النووي الريبي باستخدام مقياس الطيف الضوئي للأشعة فوق البنفسجية بمقياس 1 ميكرولتر ومحلل كمبيوتر الحمض النووي القائم على الموائع الدقيقة وفقا لتعليمات الشركة الصانعة ؛ يمكن تخزين إجمالي الحمض النووي الريبي المنقى عند -80 درجة مئوية.
ملاحظة: تم استخدام الدليل29 لتحقيق معايير جودة الحمض النووي الريبي. إذا كانت النسبةA 260/230 هي <2.0 ، فكرر الخطوات من 5.5 إلى 5.9.
6. التحليل النوعي والكمي للحمض النووي الريبي الخالي من DNase
- التحقق من كفاءة معالجة DNase لكل عينة عن طريق إجراء تفاعل البوليميراز المتسلسل الكمي باستخدام بادئات 16S rRNA (الجدول 2) مع 1 ميكروغرام من إجمالي الحمض النووي الريبي ، والتأكد من عدم إنتاج منتج تضخيم.
ملاحظة: البادئات المثالية لتقييم تلوث gDNA هي الاشعال المصممة للصلب عند تقاطعات intron-exon أو المناطق التنظيمية في بدائيات النوى أو في المواقع غير النشطة نسخيا30,31. - حدد رقم سلامة الحمض النووي الريبي (RIN) باستخدام محلل كمبيوتر الحمض النووي القائم على الموائع الدقيقة وفقا لتعليمات الشركة المصنعة.
ملاحظة: يجب استخدام العينات التي تظهر RIN ≥ 9 لتخليق الشريط الأول. يجب التخلص من العينات التي تظهر RIN < 9 ، ويجب تكرار خطوات العزل (1.1-5.4). - حدد إجمالي تركيز الحمض النووي الريبي باستخدام مجموعة فحص الحمض النووي الريبي HS ومقياس الفلوري وفقا لتعليمات الشركة المصنعة.
7. تخليق cDNA من الشريط الأول
- قم بإعداد خليط تمهيدي للحمض النووي الريبي لكل عينة عن طريق خلط 1 ميكروغرام من إجمالي الحمض النووي الريبي مع 1 ميكرولتر من السداسيمرات العشوائية (50 نانوغرام · ميكرولتر −1) و 1 ميكرولتر من مزيج 10 mM dNTP. بعد ذلك ، اضبط الحجم الإجمالي على 10 ميكرولتر باستخدام الماء الخالي من النيوكلياز.
- احتضان التفاعل عند 65 درجة مئوية لمدة 5 دقائق ، ووضعه على الثلج لمدة 1 دقيقة.
- تحضير مزيج تخليق cDNA لكل عينة عن طريق إضافة 2 ميكرولتر من المخزن المؤقت RT 10x ؛ 4 ميكرولتر من 25 mM MgCl2 ؛ 2 ميكرولتر من 0.1 متر DTT ؛ 1 ميكرولتر من مثبط RNase (40 U · μL − 1) ؛ و 1 ميكرولتر من كاشف النسخ العكسي (200 U · μL − 1) بالترتيب المشار إليه.
- أضف مزيج تخليق cDNA إلى خليط الحمض النووي الريبي / التمهيدي. تخلط برفق ، وأجهزة الطرد المركزي العينات لفترة وجيزة لجمع المكونات في الجزء السفلي من الأنبوب.
- قم بتحضير المزيج عن طريق احتضان العينات لمدة 10 دقائق عند 25 درجة مئوية ، تليها 50 دقيقة عند 50 درجة مئوية. قم بإنهاء التفاعلات عن طريق الحضانة عند 85 درجة مئوية لمدة 5 دقائق ، ثم تبرد على الجليد.
- أضف 1 ميكرولتر من RNase H إلى كل أنبوب ، واحتضانه عند 37 درجة مئوية لمدة 20 دقيقة لإزالة الحمض النووي الريبي من الحمض النووي: الحمض النووي الريبي الهجين.
- أخيرا ، قم بتخفيف تفاعل تخليق cDNA إلى حجم إجمالي قدره 80 ميكرولتر ، وقم بتخزينه عند -80 درجة مئوية حتى الاستخدام مرة أخرى.
ملاحظة: يمكن إيقاف البروتوكول مؤقتا عند هذه النقطة.
8. المنحنى القياسي والكمي (q) -PCR لتحديد مستويات التعبير عن جينات الواسمات التي تشير إلى مراحل مختلفة من تكرار العاثيات
- حدد مجموعة من الجينات المستهدفة التي يمكن أن تعمل كعلامات لكل مرحلة من مراحل تكرار العاثية محل الاهتمام. في حالتنا ، كانت هذه كما هو مفصل في الجدول 2.
- تضخيم كل جين من الجينات المستهدفة من قالب الحمض النووي الجينومي باستخدام البادئات ذات الصلة واستخدام تفاعل البوليميراز المتسلسل مع شروط التضخيم التالية: تمسخ أولي عند 95 درجة مئوية لمدة 2 دقيقة ؛ تمسخ عند 95 درجة مئوية لمدة 30 ثانية ؛ التلدين عند درجة حرارة التلدين المثلى اعتمادا على البادئات (تم استخدام 58 درجة مئوية هنا) لمدة 30 ثانية ؛ تمديد عند 72 درجة مئوية لمدة 1 دقيقة ؛ والتمديد النهائي عند 72 درجة مئوية لمدة 5 دقائق.
- قم بتنقية كل amplicon باستخدام مجموعة تنقية PCR ، واستنساخها في ناقل استنساخ TA وفقا لتعليمات الشركة المصنعة. تحقق من تسلسل كل منتج مستنسخ عن طريق تسلسل سانجر.
ملاحظة: يمكن إيقاف البروتوكول مؤقتا عند هذه النقطة. - احسب رقم النسخ للبلازميدات الفردية باستخدام المعادلة التالية20:
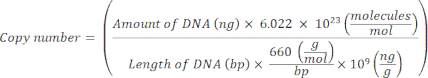
- قم بإعداد قالب قياسي لكل جين علامة عن طريق تخفيف الحمض النووي البلازميد بشكل متسلسل من 109 نسخ / ميكرولتر إلى 10 2 نسخة / ميكرولتر في H2O العقيم الخالي من النيوكلياز الجزيئي.
- إجراء تفاعل البوليميراز المتسلسل الكمي وفقا لتعليمات الشركة الصانعة لنظام qPCR المفضل مع 1 ميكرولتر من cDNA (من الخطوة 7.7) لكل عينة في ثلاث نسخ ، جنبا إلى جنب مع معايير البلازميد ذات الصلة في ثلاث نسخ ؛ قم بإجراء تفاعل البوليميراز المتسلسل في لوحة 96 بئرا لكل هدف.
- ارسم رقم نسخة Log DNA (المحور السيني) مقابل عتبة الدورة (المحور ص ، Ct) ، واستخدم نظاما أساسيا مناسبا مثل Excel أو R لإجراء حساب الانحدار الخطي لعرض معامل التحديد (R2) ومعادلة خطية.
ملاحظة: يجب أن يكون معامل التحديد أعلى من 0.98. - تقدير رقم النسخ لكل هدف باستخدام المعادلة الخطية (y = mx + b) المشتقة من الانحدار الخطي (الخطوة 8.7) ، حيث y هي CT المقدرة ؛ x هو رقم نسخة الحمض النووي للسجل ؛ m هو ميل الخط ، الذي يحدد التغيير في Ct فيما يتعلق برقم نسخة الحمض النووي ؛ و b هو تقاطع المحور ص الذي يمثل Ct المقدر لنسخة DNA واحدة32.
- لكل جين علامة ، احسب كفاءة تضخيم PCR (E) باستخدام المعلمات من الانحدار الخطي للمنحنى القياسي والمعادلة التالية ، حيث m هو الميل المشتق من الخطوة 8.7 والخطوة 8.8:
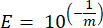
- تحقق من صحة جميع البادئات من حيث كفاءتها المئوية باستخدام المعادلة التالية:
ملاحظة: يجب أن تكون الكفاءة في حدود 90٪ -110٪.
- احسب عدد النسخ المطلق للحمض النووي باستخدام الصيغة التالية:
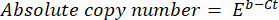
حيث Ct (الخطوة 8.8) هي عتبة الدورة ، و b هي التقاطع (الخطوة 8.8) ، و m هي المنحدر (الخطوة 8.8) ، و E هي كفاءة تضخيم تفاعل البوليميراز المتسلسل (الخطوة 8.9).
حرج: عند مقارنة تضخيم هدفين أو أكثر بواسطة q-PCR ، يجب حساب كفاءة تفاعل البوليميراز المتسلسل لكل هدف من أجل مقارنة أرقام نسخ الحمض النووي المطلقة. - في هذه الدراسة ، تم استخدام جينات 16S rRNA و proC و rpoD كضوابط داخلية عامة ، وتم استخدام gyrB كعنصر تحكم تحريضي33،34،35.
ملاحظة: عند اختيار عناصر التحكم الداخلية من بيانات تسلسل الحمض النووي الريبي ، من الأفضل تحديد عناصر التحكم الداخلية التي لا تتغير في مستويات التعبير للظروف التي تم اختبارها. إن النظر بعناية في الضوابط المناسبة مهم دائما للتفسير الهادف للنتائج.
النتائج
في هذا العمل ، تم استخدام التعداد الزمني المباشر لإنتاج العاثيات من ثقافة الليزوجين PAO1 LESΦ2 المزروعة في ظل ظروف غير محفزة لتحديد تأثير الحث التلقائي LESΦ2. كانت كثافة العاثيات في أدنى نقطة لها بمتوسط ~ 2.61 × 106 وحدات تشكيل البلاك (PFU) · mL − 1 2 h بعد الاستزراع الفرعي في وسط جديد خلال المرحلة الأسية المبكرة من النمو ، مما يشير إلى أن الليزوجيني كان الحالة السائدة. زاد عيار LESΦ2 بسرعة إلى متوسط ~ 2.4 × 108 PFU · mL − 1 في غضون 4 ساعات ووصل إلى أعلى كثافة بعد 6 ساعات (متوسط ~ 5.83 × 109 PFU · mL − 1 ؛ الشكل 4).
لوحظ الحد الأدنى من الحث التلقائي خلال مرحلة السجل المبكرة لنمو الليزوجين (بعد 2 ساعة). ومع ذلك ، فإن الوجود القابل للقياس للعاثيات في وسط الاستزراع كان نتيجة للعديد من الأحداث السابقة ، بما في ذلك ما يلي: تعبئة الأحماض النووية في رؤوس البروتين ، وتجميع البروتينات في جزيئات العاثية ، والتعبير عن جينات العاثية المتأخرة ، وجينات العاثية في المرحلة المتوسطة ، وجينات العاثيات التنظيمية المبكرة. كان من المهم التقاط الخلايا المصابة قبل التعبير عن أحداث التكاثر المرتبطة بالعاثيات. ومن ثم ، تم اختيار 90 دقيقة للسماح للثقافة بالنمو قبل الاستقراء. لالتقاط ملف تعريف التعبير الجيني ل PAO1 ، تم حصاد عينات LESΦ2 lysogen من مزرعة ما قبل الحث وبعد الحث على مدى فترة 90 دقيقة ، كما هو مذكور في الخطوة 3.4. هذه النقطة الزمنية البالغة 90 دقيقة هي قبل وقت طويل من اكتشاف مستويات عالية من الحث التلقائي للبروفاج المقيم بواسطة مقايسة البلاك من الخطوة 2.3.2. نظرا لأن كثافة الخلايا البكتيرية كانت منخفضة أثناء النمو الأسي المبكر ، فقد تم توسيع أحجام الثقافة إلى 800 مل لضمان وجود مواد وافرة لدراسات التعبير الجيني. تم جمع العينات من المزرعة غير المستحثة والمزارع المستحثة كل 10 دقائق ، وتم استخراج الحمض النووي الريبي لتعيين ملف تعريف التعبير للعلامات الرئيسية للتكاثر الليزوجيني والتكاثر الليتيكي أثناء نمو البكتيريا. تم تنقية إجمالي الحمض النووي الريبي والتحقق من صحته لعدم وجود الحمض النووي الجينومي باستخدام مقايسات qPCR التي تستهدف جين 16S rRNA (الخطوة 6.1). اجتازت العينات التي تصل إلى RIN ≥ 9 مراقبة الجودة وتم تحويلها إلى cDNA.
تم فحص جينوم LESΦ2 المشروح لتحديد الجينات المعروفة جيدا في دورات التكاثر المحللة والانحلالية للعاثيات المعتدلة. ثم تم استخدام هذه الجينات المحددة للتحقق من صحة qRT-PCR للتعبير عن التنميط للجينات المقيدة بدورة الليسوجين والمرتبطة بدورة التحلل من الثقافات المستحثة وغير المستحثة. قمنا بقياس عدد نسخ الحمض النووي المطلق وأجرينا اختبار رتبة ويلكوكسون الموقعة باستخدام R36 لمقارنة مستويات التعبير في الثقافات غير المستحثة والمستحثة (الشكل 5). لوحظت زيادة ملحوظة في التعبير عن جين cro (علامة مبكرة للتكرار الليتيكي) من ~ 2.31 × 109 نسخ في الثقافات غير المستحثة إلى ~ 3.02 × 1011 نسخة بعد 30 دقيقة بعد الاستقراء (اختبار رتبة ويلكوكسون الموقع: p < 0.01). وبالمثل ، أظهرت بروتينات O وبروتينات P ، وهي علامات منتصف المرحلة للتكرار الليتي (ومن المتوقع أن تشارك في تكرار جينوم العاثيات) ، تنظيما كبيرا من ~ 1.74 × 108 إلى ~ 1.25 × 10 10 نسخ (اختبار رتبة توقيع ويلكوكسون: p < 0.01) ومن ~ 6.05 × 102 إلى ~ 5.68 ×10 5 نسخ (اختبار رتبة ويلكوكسون الموقع: p < 0.01) ، على التوالي. أخيرا ، تم استخدام الجينات الهيكلية المرتبطة بالذيل كعلامات متأخرة لدورة النسخ المتماثل الليتي. مرة أخرى ، لاحظنا زيادة كبيرة في التعبير من ~ 2.31 × 106 نسخ في الثقافات غير المستحثة إلى ~ 4.38 × 108 نسخ 30 دقيقة بعد الاستقراء (اختبار رتبة ويلكوكسون الموقع: p < 0.01). وهكذا ، أكدت بيانات RT-PCR الكمية أن التعبير الجيني لجينات العلامات الراسخة للتكرار الليتي اتبع الاتجاه المتوقع ، حيث تظهر العلامات المبكرة والمتوسطة والمتأخرة تعبيرا تفاضليا متعدد الطيات بالترتيب المتوقع (الشكل 5). نظرا لأن التعبير عن علامات النسخ المتماثل للتحلل قد تم تنظيمه بعد 30 دقيقة من الشفاء ، فإن هذا يعتبر نقطة زمنية تمثيلية مناسبة لدراسة المشهد النسخي للعاثيات المعتدلة النشطة ومضيفيها البكتيرية خلال الدورة المعزولة.
لاحظنا بعض التعبير عن الجينات الحالة في ظروف غير مستحثة ، مما يؤكد أن بعض الحث التلقائي يحدث دائما ، حتى في الثقافات المحسنة التي يتم فيها تمثيل أرقام الليزوجين بأعلى نسبة من CFU إلى PFU المفرج عنه في مرحلة السجل المبكرة. هذا يعني أنه سيكون هناك دائما مستوى معين من "الضوضاء" في بيانات النسخ ، مما يعزز أهمية الضوابط المعدة بعناية ، بما في ذلك الثقافات المستحثة وغير المستحثة. يعتمد الاختيار المناسب لجينات التحكم الداخلي لتحديد تغيرات الطيات في التعبير على فحص بيانات النسخ بعناية لتحديد الجينات التي يتم التعبير عنها بنفس المستوى في كل من العينات غير المستحثة والمستحثة. تشير نتائجنا الأولية إلى أن rpoD كان جين التحكم الأكثر موثوقية الذي تم اختباره وكان له التعبير الأكثر استقرارا (~ 1.71 × 10 5 نسخ قبل الحث و ~ 3.33 × 105 نسخ 30 دقيقة بعد الحث. اختبار رتبة ويلكوكسون: p = 0.3594) مقارنة بجينات 16S rRNA أو proC (الشكل 5). أدى تباين التعبير عن الضوابط الداخلية إلى قياس الأعداد المطلقة للنصوص. وسيدعم الفحص المستقبلي لبيانات النسخ اختيار الضوابط الداخلية المناسبة لمزيد من التحقق.
تم استخدام جين cI في تمرين التنميط الجيني لدينا ، لأنه علامة معروفة جيدا للتحلل الجيني. بالمقارنة مع علامات التكرار الليتي ، كان التعبير عن جين cI مستقرا نسبيا (الشكل 5) ، لكن عدد نسخ هذا الجين كان مرتفعا بشكل مطمئن في الثقافات غير المستحثة مقارنة بتلك الخاصة بعلامات التكرار الليتي. تتفق هذه البيانات مع أرقام PFU المنخفضة في نفس العينات ، مما يؤكد أن التعبير المثبط العالي كان مرتبطا بمستويات أقل من إنتاج العاثيات. توضح البيانات الواردة هنا أن التعبير عن نسخة cI لهذه العاثية المعينة لا يتم تنظيمه بشكل كبير بعد الحث ، كما هو موضح في Stx phages11,17. عادة ما يتم التحكم في نشاط المثبط على كل من مستويات النسخ وما بعد الترجمة ، لذلك يمكن نسخ جين الكابت ، لكن البروتين الناتج يتعرض على الفور للانقسام الذاتي. هناك حاجة إلى مزيد من التجارب للتحقق من صحة ضوابط النسخ وما بعد الترجمة. علاوة على ذلك ، من منحنى المعيار لدينا ، يبدو أن الحد الأدنى للكشف عن qPCR هو ~ 102 نسخة.
معا ، تؤكد النتائج التي توصلنا إليها من فحوصات البلاك و qRT-PCR صحة استراتيجيتنا للثقافة وإعداد عينات الحمض النووي الريبي لتوليد مدخلات يتم التحكم فيها جيدا لتجارب RNA-Seq. أظهرت الثقافات غير المستحثة في المرحلة الأسية المبكرة مستويات منخفضة من الحث التلقائي والتعبير الجيني الليتيكي ، مما يشير إلى هيمنة الليزوجيني. في المقابل ، أظهرت الثقافات المعزولة بعد 30 دقيقة من الحث زيادات كبيرة في التعبير عن جينات العلامة التي تشير إلى هيمنة التكاثر الليتيكي.
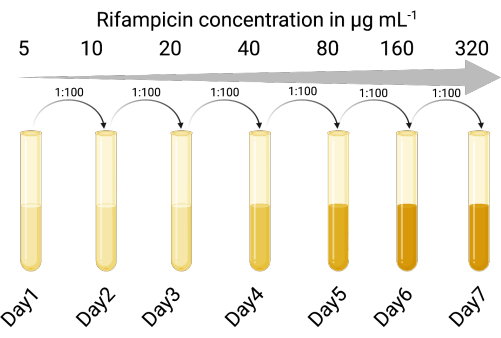
الشكل 1: بروتوكول إنشاء مضيف مؤشر مقاوم للريفامبيسين (تم إنشاؤه باستخدام BioRender.com). يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 2: التصميم التجريبي لتعداد PFU و CFU للليسوجين من نفس العينة. (تم الإنشاء باستخدام BioRender.com) يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
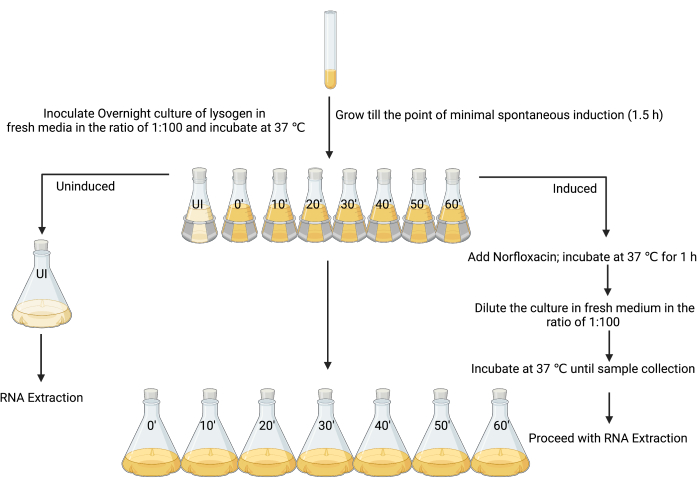
الشكل 3: التصميم التجريبي لأخذ العينات من المستحضر المستحث وغير المستحث لعزل الحمض النووي الريبوزي (RNA). (تم الإنشاء باستخدام BioRender.com) يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
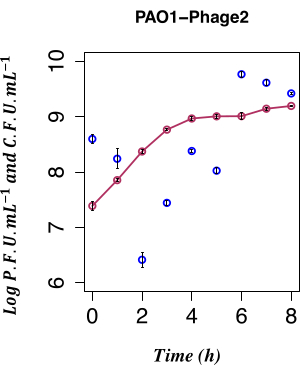
الشكل 4: التعداد الزمني للحث التلقائي. التعداد الزمني لإنتاج نبوءة LES التلقائي باستخدام PFU من PAO1 Φ2 lysogen مع CFU المتزامن ، n = 8 (نسختان بيولوجيتان وأربع نسخ تقنية) ؛ تمثل أشرطة الخطأ الانحراف المعياري. تشير النقاط الحمراء الداكنة إلى CFU · mL − 1 في LB ؛ تشير النقاط الزرقاء الداكنة إلى PFU·mL−1 في LB. يكون الإطلاق التلقائي للعاثية المعدية φ2 بواسطة الليزوجينات عند أدنى مستوى قابل للقياس عند 2 ساعة بعد التلقيح. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: عدد النسخ المطلق لجينات العلامة المستهدفة. يؤكد عدد النسخ المطلق لجينات علامات العاثيات أنماط التعبير المتوقعة ، المشتقة باستخدام RT-qPCR ، للجينات المتوقع أن تلعب أدوارا مهمة في دورات التحلل والانحلال. تمثل النقاط ثلاثة مكررات بيولوجية وثلاث مكررات تقنية (ن = 9). (أ) يمثل المربع الأحمر علامة الليزوجيني ، cI. (ب) يمثل اللون الأخضر العلامة الانحلالية المبكرة ، cro ؛ (C,D) يمثل اللون الأزرق علامات التحلل المتوسطة، جينات تضاعف الحمض النووي؛ (ه) يمثل اللون الأرجواني العلامة الانحلالية المتأخرة ، والجينات التركيبية للذيل ؛ يمثل اللون الرمادي (F-H) علامات المضيف التي تم استخدامها كعناصر تحكم داخلية ، ويمثل اللون الأبيض (I) جيراز الحمض النووي B ، والذي تم استخدامه كعنصر تحكم تحريضي. توضح الخطوط الأفقية الصلبة وسيط التوزيع. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: الاشعال المصممة في هذه الدراسة. يتم توفير تسلسلات البادئات المحددة لجينات العلامة والضوابط الداخلية المستخدمة في هذه الدراسة ، جنبا إلى جنب مع معرفات الانضمام NCBI المقابلة لها. الرجاء الضغط هنا لتنزيل هذا الجدول.
جدول 2: كفاءة البادئات المستخدمة في هذه الدراسة المحسوبة باستخدام المنحنى القياسي qPCR. الرجاء الضغط هنا لتنزيل هذا الجدول.
Discussion
تم وصف إنشاء مضيف مؤشر قابل للاختيار ، كان يستخدم سابقا في مقايسات البلاك لتحديد الحث التلقائي للعاثية Stx بدقة أكبر من E. coli MC106137،38،39 ، هنا ل P. aeruginosa phage LESΦ2. هذا التدخل له فائدة إضافية تتمثل في تقليل خطوات ووقت معالجة العينات ، وبالتالي تمكين التقييم المتزامن لمعدلات الحث التلقائي في ظروف الاستزراع المتعددة. هناك خطر من توليد طفرات أخرى أثناء إنشاء متغيرات مقاومة للريفامبيسين40 ؛ ومع ذلك ، في هذا العمل ، تم استخدام السلالة المتطورة فقط كمضيف مؤشر لتعداد اللوحات من الثقافات ذات الأهمية ولم يتم تضمينها في تحليل النسخ. طالما أن سلالة المؤشر القابلة للاختيار تظل عرضة بنفس القدر للإصابة بالعاثية ذات الاهتمام ، فلا داعي للقلق بشأن الطفرات المكتسبة الأخرى. ومع ذلك ، لم يتم الكشف عن أي اختلافات في ملامح تعدد الأشكال لطول جزء التقييد من خلال تحليل الرحلان الكهربائي لمجال النبض (PFGE) ل PAO1WT و PAO1RIF (البيانات غير معروضة).
عند اختيار الخلايا المضيفة ، من النادر العثور على سلالة مؤشر لا تحتوي بالفعل على نبوءات. وكمثال على ذلك ، فإن PAO1 يؤوي البروفاج الخيطي Pf4. تم تصميم الضوابط التجريبية لهذه الدراسة لتكون قادرة على الفحص المباشر للتعبير الجيني لعاثيات معينة (في هذه الحالة ، LES prophage 2) وتأثيرات هذه العاثية على التعبير الجيني البكتيري. في مقارنة النصوص من PAO1 التي تحمل نبوءة LES 2 وتفتقر إلى نبوءة LES 2 (يحمل كل من الليزوجين وغير الليزوجين Pf4 الداخلي) ، والتي تعمل كضوابط داخلية لاستبعاد تأثير Pf4 على المضيف. بالإضافة إلى ذلك ، فقد ثبت أن Pf4 عادة لا يسبب التحلل في الخلية المضيفة41 ، وبالتالي فهو غير قادر على إرباك نتائج هذه التجارب.
من الثابت أن مراقبة الجودة الدقيقة أمر بالغ الأهمية في إعداد العينات لإنتاج بيانات omics ذات مغزى42. ومع ذلك ، كما هو موضح سابقا11 ، نادرا ما يتم إجراء التوصيف الدقيق لنشاط النبوءة في إعداد ثقافات الليسوجين لمثل هذه الدراسات. هنا ، نقوم بتفصيل بروتوكولاتنا المنهجية لإعداد مجموعة من الثقافات التي يتم التحكم فيها جيدا والمحسنة للدراسات النسخية لاستكشاف التفاعلات بين البكتيريا والعاثيات المعتدلة بشكل أفضل. تم التحكم في تزامن السكان عن طريق جلب الثقافة من خلال أربعة مضاعفة على الأقل قبل معالجتها بالمضاد الحيوي المستحث نورفلوكساسين. من خلال تحديد MIC للنورفلوكساسين للسلالة في الدراسة ، يمكننا التأكد من أن تركيز العامل المحفز كان أعلى بقليل من MIC للعلاج "التعريفي". ثم تم تخفيف الخلايا المعالجة 1:10 لخفض تركيز النورفلوكساسين تحت MIC بعد العلاج لمدة ساعة واحدة من أجل السماح للخلايا باستعادة وإكمال عملية تكرار العاثية ، وتنتهي بتحلل الخلية وإطلاق ذرية العاثية المعدية. تدخل الخلايا فقط في دورة النسخ المتماثل بعد تحفيز الحث بمجرد أن يتم نقل تركيز النورفلوكساسين إلى ما دون MIC خلال فترة الاسترداد. في هذه الحالة ، فإن تجاوز 1 ميكروغرام · مل − 1 نورفلوكساسين يعني أنه لا يمكن تخفيف الدواء بشكل فعال تحت MIC ، حيث أن MIC للنورفلوكساسين ل PAO1 هو 0.19 ميكروغرام · مل −1. يجب موازنة مستوى تخفيف المحفز مع الحاجة إلى استعادة الليسوجين والاحتفاظ بكثافة الثقافة لحصاد الحمض النووي الريبي. توضح البيانات التي تمت مناقشتها هنا أنه من الممكن مزامنة الثقافات لإنشاء عينات يهيمن فيها الليزوجيني ، وبالتالي تقليل الضوضاء الناتجة عن الحث التلقائي وتمكين الكشف عن التغيرات الحقيقية التي يحركها الليزوجيني في التعبير الجيني. نظرا لأن الحالة المحللة هي السائدة في المرحلة الأسية المبكرة من النمو عندما تكون كثافة الخلايا البكتيرية منخفضة ، فإننا نقترح توسيع نطاق الثقافات لحصاد ما يكفي من الحمض النووي الريبي لدراسات التعبير الجيني اللاحقة مثل RNA-Seq.
تم الإبلاغ عن استخدام النورفلوكساسين كعامل محفز لإجبار الثقافات على الدخول في الدورة lytic بشكل جيد43,44 ؛ ومع ذلك ، سيؤثر هذا أيضا على التعبير عن الجينات البكتيرية الأخرى في العملية45,46. للتخفيف من ذلك ، يجب تضمين مكتبات الحمض النووي الريبي من الثقافات البرية الضابطة التي تزرع في ظل نفس الظروف المحفزة وغير المحفزة في تجارب RNA-Seq. يعد استخدام الضوابط الداخلية وجينات العلامات الرئيسية للتحقق من صحة مراحل تكرار العاثيات بواسطة qRT-PCR أمرا بالغ الأهمية لإجراء مقارنات دقيقة. لا يمكن تفسير التنميط الكمي RT-PCR من خلال مقارنة الأعداد المطلقة للنسخ لكل جين في نقاط زمنية مختلفة. إنه شكل الملف الشخصي الذي يهم. أولا ، تم أخذ عينات من منطقة صغيرة واحدة فقط في النسخة لأي جين ، لذا فإن ما إذا كان عنصرا قصير العمر أو أطول عمرا غير معروف27. بالتأكيد ، يظهر رسم خرائط RNA-Seq للنصوص أن كثافة بيانات رسم الخرائط تختلف اختلافا كبيرا على طول الجين. ثانيا ، هو شكل ملف تعريف التعبير الجيني الذي يجب تفسيره لجين علامة مرتبط بالدورة lytic أو نمط الحياة lysogenic أو حتى غير مفصول عن الدوائر التنظيمية للعاثيات11. يعد الحث التلقائي مشكلة حقيقية في ثقافة الليزوجين وسيؤدي دائما إلى التعبير عن الجينات المرتبطة بالدورة اللايتيكية. ومع ذلك ، يظهر التنميط أن الجينات المرتبطة بدورة التكرار الليتي يتم قمعها في تعبيرها قبل الحث (على الأقل طيتان لوغاريتم) والتنظيم بعد الاستقراء.
تدعم التحليلات النسخية التي أجريت سابقا لتفاعلات Stx phage مع الإشريكية القولونية فهما شاملا لجينات العاثية المشاركة في الحفاظ على الليزوجيني وإطلاق الدورة lytic11,17. حاليا ، تم شرح عاثيات LES من P. aeruginosa ، لكن وظائفها الجينية الرئيسية أقل فهما جيدا. ستمكن الدراسات النسخية من إعادة شرح نبوءات LES وتحسين فهمنا للجينات المشاركة في دورة lysogeny و lytic. يمثل ربط تسلسل الجينات بالوظيفة تحديا كبيرا في دراسة النبوءات الجديدة ، مما يسلط الضوء بشكل أكبر على الحاجة إلى مزيد من الدراسات لتأكيد وظائف الجينات العاثية لإنتاج أدوات شرح أفضل47. يمكن أن يساعد التطبيق والتكيف الأوسع للبروتوكولات وتدابير مراقبة الجودة الإضافية المفصلة في مقالة الفيديو هذه في الكشف عن وظائف النبوءة المختلفة ، وبالتالي تحسين خطوط أنابيب التعليقات التوضيحية وتحويل فهمنا للعاثيات والبيولوجيا البكتيرية.
Materials
| Name | Company | Catalog Number | Comments |
| PAO1 | 6 | ||
| LESB58 | 6 | ||
| LES phages | Induced and purified from LESB58 using Norfloxacin. | This study | |
| Lysogeny Broth (LB) | Merck | 1.10285.500 | |
| LB Agar | Merck | 1.10283.500 | |
| Agar Agar | Fisher | A/1080/53 | |
| Top Agar | 0.4 g Agar Agar+2.5 g LB Broth in 100 mL water; autoclave and use. | - | |
| Rifampicin | Sigma (Stock: 50 mg/mL in Methanol- Mix well and use 0.22µm filter to sterilize and store it in -20°C until use) | R3501 | |
| Glacial Acetic Acid | Fisher 1% (v/v) in water | 10060000 | |
| Norfloxacin | Sigma (Stock: 25 mg/mL of 1% Glacial Acetic Acid-Mix well and use 0.22µm filter to sterilize and store it in -20°C until use;To avoid freeze thaw cycles, store as small aliquotes) | N9890 | |
| Phenol saturated with citrate buffer pH 4.3 | Sigma | P-4682 | |
| Molecular Biology grade Ethanol | Fisher | 16695992 | |
| TRIzol | Invitrogen | 12044977 | |
| Chloroform | Fisher | 11398187 | |
| Isopropanol | Fisher | 17150576 | |
| Nuclease-free H2O | Invitrogen | 10526945 | |
| 10X TURBO DNase | Ambion | AM1907 | |
| Qubit RNA HS, BR Kit | Invitrogen | Q10210 | |
| Agilent RNA 6000 Nano Kit | Agilent | 5067-1511 | |
| SuperScriptIII first strand synthesis kit | Invitrogen | 18080051 | |
| PCR Reagents | Bioline Mytaq Red 2X | BIO-25043 | |
| qPCR Reagents | Sensifast SYBR Hi Rox | BIO-92020 | |
| PCR purification kit | Isolate II PCR and Gel Kit | BIO-52060 | |
| TA cloning kit | TA Cloning Kit, with pCR 2.1 Vector, without competent cells | K202040 | |
| StepOne Real Time PCR system | Thermo Fisher Scientific | 4376600 |
References
- Lin, D. M., Koskella, B., Lin, H. C. Phage therapy: An alternative to antibiotics in the age of multi-drug resistance. World Journal of Gastrointestinal Pharmacology and Therapeutics. 8 (3), 162-173 (2017).
- Jiang, W., Marraffini, L. A. CRISPR-Cas: New tools for genetic manipulations from bacterial immunity systems. Annual Review of Microbiology. 69 (1), 209-228 (2015).
- Santos, S. B., Azeredo, J. Bacteriophage-based biotechnological applications. Viruses. 11 (8), 737(2019).
- Rodríguez-Rubio, L., Jofre, J., Muniesa, M. Is genetic mobilization considered when using bacteriophages in antimicrobial therapy. Antibiotics. 6 (4), 32(2017).
- Hatfull, G. F. Dark Matter of the biosphere: The amazing world of bacteriophage diversity. Journal of Virology. 89 (16), 8107-8110 (2015).
- Yukgehnaish, K., et al. PhageLeads: Rapid assessment of phage therapeutic suitability using an ensemble Machine Learning approach. Viruses. 14 (2), 342(2022).
- Seemann, T. Prokka: Rapid prokaryotic genome annotation. Bioinformatics. 30 (14), 2068-2069 (2014).
- Arndt, D., et al. PHASTER: A better, faster version of the PHAST phage search tool. Nucleic Acids Research. 44, W16-W21 (2016).
- Banerjee, S., et al. FINDER: An automated software package to annotate eukaryotic genes from RNA-Seq data and associated protein sequences. BMC Bioinformatics. 22 (1), 205(2021).
- Jumper, J., et al. Highly accurate protein structure prediction with AlphaFold. Nature. 596 (7873), 583-589 (2021).
- Veses-Garcia, M., et al. Transcriptomic analysis of Shiga-toxigenic bacteriophage carriage reveals a profound regulatory effect on acid resistance in Escherichia coli. Applied and Environmental Microbiology. 81 (23), 8118-8125 (2015).
- Owen, S. V., et al. A window into lysogeny: revealing temperate phage biology with transcriptomics. Microbial Genomics. 6 (2), e000330(2020).
- Davies, E. V., Winstanley, C., Fothergill, J. L., James, C. E. The role of temperate bacteriophages in bacterial infection. FEMS Microbiology Letters. 363 (5), 015(2016).
- Livny, J., Friedman, D. I. Characterizing spontaneous induction of Stx encoding phages using a selectable reporter system. Molecular Microbiology. 51 (6), 1691-1704 (2004).
- Fogg, P. C. M., et al. Identification of multiple integration sites for Stx-phage Φ24B in the Escherichia coli genome, description of a novel integrase and evidence for a functional anti-repressor. Microbiology. 153 (12), 4098-4110 (2007).
- James, C. E., et al. Differential infection properties of three inducible prophages from an epidemic strain of Pseudomonas aeruginosa. BMC Microbiology. 12, 216(2012).
- Riley, L. M., et al. Identification of genes expressed in cultures of E. coli lysogens carrying the Shiga toxin-encoding prophage Φ24B. BMC Microbiology. 12 (1), 42(2012).
- Stover, C. K., et al. Complete genome sequence of Pseudomonas aeruginosa PAO1, an opportunistic pathogen. Nature. 406 (6799), 959-964 (2000).
- Winstanley, C., et al. Newly introduced genomic prophage islands are critical determinants of in vivo competitiveness in the Liverpool Epidemic Strain of Pseudomonas aeruginosa. Genome Research. 19 (1), 12-23 (2009).
- Davies, E. V., et al. Temperate phages enhance pathogen fitness in chronic lung infection. The ISME Journal. 10 (10), 2553-2555 (2016).
- Allison, H. E. Stx-phages: drivers and mediators of the evolution of STEC and STEC-like pathogens. Future Microbiology. 2 (2), 165-174 (2007).
- Allison, H. E., et al. Immunity profiles of wild-type and recombinant Shiga-like toxin-encoding bacteriophages and characterization of novel double lysogens. Infection and Immunity. 71 (6), 3409-3418 (2003).
- Mori, N., et al. A peptide based on homologous sequences of the β-barrel assembly machinery component BamD potentiates antibiotic susceptibility of Pseudomonas aeruginosa. Journal of Antimicrobial Chemotherapy. 67 (9), 2173-2181 (2012).
- Chojnacki, M., et al. A novel, broad-spectrum antimicrobial combination for the treatment of Pseudomonas aeruginosa corneal infections. Antimicrobial Agents and Chemotherapy. 63 (10), e00777(2019).
- Miles, A. A., Misra, S. S., Irwin, J. O. The estimation of the bactericidal power of the blood. Epidemiology & Infection. 38 (6), 732-749 (1938).
- Srikumar, S., et al. RNA-seq brings new insights to the intra-macrophage transcriptome of Salmonella Typhimurium. PLoS Pathogens. 11 (11), e1005262(2015).
- Kröger, C., et al. The transcriptional landscape and small RNAs of Salmonella enterica serovar Typhimurium. Proceedings of the National Academy of Sciences of the United States of America. 109 (20), E1277-E1286 (2012).
- Green, M. R., Sambrook, J. How to win the battle with RNase. Cold Spring Harbor Protocols. (2), (2019).
- Koetsier, G. A practical guide to analyzing nucleic acid concentration and purity with microvolume spectrophotometers. New England BioLabs Inc. , Available from: https://www.neb.com/-/media/nebus/files/application-notes/technote_mvs_analysis_of_nucleic_acid_concentration_and_purity.pdf?rev=c24cea043416420d84fb6bf7b554dbbb (2019).
- Saunders, N. A., Lee, M. A. Real-Time PCR: Advanced Technologies and Applications. , Caister Academic Press. Norfolk, UK. (2013).
- Bustin, S. A. A-Z of Quantitative PCR. , International University Line. La Jolla, CA. (2004).
- Ruijter, J. M., et al. Efficiency correction is required for accurate quantitative PCR analysis and reporting. Clinical Chemistry. 67 (6), 829-842 (2021).
- Fothergill, J. L., Neill, D. R., Loman, N., Winstanley, C., Kadioglu, A. Pseudomonas aeruginosa adaptation in the nasopharyngeal reservoir leads to migration and persistence in the lungs. Nature Communications. 5 (1), 4780(2014).
- Huang, J., et al. Temperature-dependent expression of phzM and its regulatory genes lasI and ptsP in rhizosphere isolate Pseudomonas sp. strain M18. Applied and Environmental Microbiology. 75 (20), 6568-6580 (2009).
- Savli, H., et al. Expression stability of six housekeeping genes: a proposal for resistance gene quantification studies of Pseudomonas aeruginosa by real-time quantitative RT-PCR. Journal of Medical Microbiology. 52 (5), 403-408 (2003).
- Kassambara, A. rstatix: Pipe-Friendly Framework for Basic Statistical Tests. , Available from: https://CRAN.R-project.org/package=rstatix (2022).
- McDonald, J. E., et al. High-throughput method for rapid induction of prophages from lysogens and its application in the study of Shiga toxin-encoding Escherichia coli strains. Applied and Environmental Microbiology. 76 (7), 2360-2365 (2010).
- Smith, D. L., et al. Short-tailed Stx phages exploit the conserved YaeT protein to disseminate Shiga toxin genes among Enterobacteria. Journal of Bacteriology. 189 (20), 7223-7233 (2007).
- James, C. E., et al. Lytic and lysogenic infection of diverse Escherichia coli and Shigella strains with a verocytotoxigenic bacteriophage. Applied and Environmental Microbiology. 67 (9), 4335-4337 (2001).
- Rees, V. E., et al. Characterization of hypermutator Pseudomonas aeruginosa isolates from patients with cystic fibrosis in Australia. Antimicrobial Agents and Chemotherapy. 63 (4), e02538(2019).
- Li, Y., et al. Excisionase in Pf filamentous prophage controls lysis-lysogeny decision-making in Pseudomonas aeruginosa. Molecular Microbiology. 111 (2), 495-513 (2019).
- Van Kampen, A. H. C., Moerland, P. D. Taking bioinformatics to systems medicine. Systems Medicine. 1386, 17-41 (2016).
- Matsushiro, A., Sato, K., Miyamoto, H., Yamamura, T., Honda, T. Induction of prophages of enterohemorrhagic Escherichia coli O157:H7 with norfloxacin. Journal of Bacteriology. 181 (7), 2257-2260 (1999).
- James, C. E., et al. Lytic activity by temperate phages of Pseudomonas aeruginosa in long-term cystic fibrosis chronic lung infections. The ISME Journal. 9 (6), 1391-1398 (2015).
- Shaw, K. J., et al. Comparison of the changes in global gene expression of Escherichia coli induced by four bactericidal agents. Microbial Physiology. 5 (2), 105-122 (2003).
- Long, H., et al. Antibiotic treatment enhances the genome-wide mutation rate of target cells. Proceedings of the National Academy of Sciences of the United States of America. 113 (18), E2498-E2505 (2016).
- González-Tortuero, E., et al. VIGA: A sensitive, precise and automatic de novo VIral Genome Annotator. bioRxiv. , (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved