Method Article
הבנת ההשפעה של בקטריופאג'ים ממוזגים על הליזוגנים שלהם באמצעות שעתוק
In This Article
Summary
פרוטוקול זה מאפשר לחשוף את ההשפעה של פרופג'ים על המארחים שלהם. תרביות חיידקים מסונכרנות באמצעות תנאים התומכים בצורה הטובה ביותר במצב הליזוגני, ומגבילים את ההשראה הספונטנית. RT-qPCR מבדיל באופן חד-משמעי בין גנים מוגבלים לפאגים לבין אלה שאינם מצומדים מבקרת פאגים לבין אלה המתבטאים במהלך מחזור השכפול הליטי.
Abstract
פאגים ממוזגים נמצאים משולבים כפרופאגים ברוב הגנומים של חיידקים. חלק מהפרופג'ים הם קריפטיים ומקובעים בכרומוזום החיידקי, אך אחרים פעילים ויכולים להיות מופעלים לצורה משוכפלת באופן ספונטני או על ידי חשיפה לגורמים מעוררים. פרופג'ים קשורים בדרך כלל ליכולת להעניק ייצור רעלנים או תכונות אחרות הקשורות לאלימות על התא המארח שלהם. מחקרים עדכניים יותר הראו שהם יכולים לשחק תפקיד הרבה יותר גדול בשינוי הפיזיולוגיה של המארחים שלהם. הטכניקה המתוארת כאן אפשרה לנו לחקור כיצד פרופג'ים משפיעים על ביטוי גנים בחיידק האופורטוניסטי Pseudomonas aeruginosa.
בעבודה זו, הגידול של זן הבר P. aeruginosa PAO1 הושווה לזה של ליסוגנים איזוגניים הנושאים שילובים שונים של פרופג'ים מזן המגיפה ליברפול (LES) LESB58. בתרבית ליזוגן, חלק מתאי החיידקים יתמכו בשכפול בקטריופאג' ליטי (אינדוקציה ספונטנית) עם רמת ביטוי גבוהה לכל תא של גנים מאוחרים של פאגים, כגון אלה הקשורים להרכבה של חלקיקי פאגים, ובכך יסוו את ביטוי הגנים ברמה נמוכה הקשור לביטוי גנים מוגבלים בליזוגן. ההשפעה של אינדוקציה ספונטנית יכולה אפוא לטשטש את ביטוי הגנים של פרופאג' באוכלוסיית ליזוגן.
ניסויי פרופיל גדילה שימשו לזיהוי אינדוקציה ספונטנית, שהייתה מינימלית בשלב הצמיחה המעריכית המוקדמת. מחקר זה מדווח כיצד להכין תרביות מדגם במהלך שלב הצמיחה המעריכית המוקדמת וכיצד להגדיר בקרות נאותות למרות מספר התאים הנמוך. פרוטוקולים אלה מבטיחים השוואה אמינה וניתנת לשחזור של חיידקים מסוג בר וליזוגניים בתנאים שונים, ובכך משפרים את פרופיל השעתוק של גנומים פרופאגים ומסייעים בזיהוי פונקציות פרופאגים שלא הוכרו בעבר.
Introduction
לאחרונה, טיפול בפאגים להתמודדות עם עמידות מיקרוביאלית1 ועריכת גנים מבוססת CRISPR-Cas2 עוררו עניין מחודש במחקר הבקטריופאג'ים. שוב, ההתקדמות בביוטכנולוגיה אפשרה חקירה עמוקה יותר של יחסי הגומלין בין חיידקים ופאגים3. עם זאת, השימוש הטיפולי בפאגים ("טיפול בפאגים") נפגע על ידי חששות לגבי פאגים הפועלים כאלמנטים גנטיים ניידים עם יכולת להעביר גנים של אלימות והתנגדות אופקית4. המרחב של "החומר האפל"5 (גנים בעלי תפקידים לא ידועים) מטריד ומפתה. החומר האפל נחשב לפער בהבנתנו את הביולוגיה של הפאגים ולמשאב בלתי מנוצל במידה רבה לכלים מולקולריים ולטיפולים חדשניים פוטנציאליים6. הפיתוח של טכניקות ריצוף בתפוקה גבוהה, יחד עם ביאור גנים משופר 7,8,9 ואלגוריתמים חדשים לקיפול פפטידים 10, משפר את האיתור, התיאור והחיזוי הפונקציונלי של גני פאגים. עם זאת, המדע עדיין רחוק מלאמת את תפקודי הגנים של רוב הפאגים בתרבית או בעולם האמיתי.
ריצוף RNA (RNA-Seq) יכול למפות באופן גלובלי ביטוי גנים במהלך זיהום פאגים ושיפר באופן משמעותי את ההבנה הן של הפאגים והן של יסודות חיידקיים המעורבים במחזורים ליטיים וליזוגניים11,12. במהלך תהליכים ליזוגניים, גנומים של פאגים ממוזגים משולבים בדנ"א חיידקי והופכים לפרופג'ים13. ניתן להשתמש בניסויי פרופיל ביטוי גנים גלובליים כדי לזהות גנים מוגבלים לפאג'ים המקודדים על גנום פאגים ממוזגים אך באים לידי ביטוי רק במצב ליזוגני11. גנים כאלה אינם מקודדים חלבונים מבניים של פאגים ואינם מעורבים בתהליכי זיהום פאגים כלשהם. RNA-Seq יכול לשמש לזיהוי אותם גנים בעלי סבירות גבוהה יותר להשפיע על הביולוגיה של החיידק המארח, בין אם על ידי גרימת רווח של תפקוד או ויסות הגנים החיידקיים הקיימים, ובכך לעתים קרובות מאפשר לחיידקים להסתגל לסביבות משתנות. לכן, ניתן לחקור את יכולתם של פרופג'ים לפעול כמאסטרים של בובות מיקרוביאליות, השולטים במגוון תפקודים חיידקיים.
ישנם שני חסמים עיקריים לניתוח יעיל של ביטוי גנים מוגבלים על ידי פרופג'ים. ראשית, הזמינות של מארחים רגישים היא נושא מפתח. בהגדרה, פרופג'ים כבר משולבים בגנום המארח הספציפי שלהם, ולכן מאתגר למצוא פונדקאי רגיש מסוג בר כדי להשוות את ביטוי הגנים העולמי בנוכחות ובהיעדר הפרופאג'. ניתן להשיג זאת באמצעות הדבקה דה נובו של פונדקאי רגיש אחר או מחיקת הפרופאג' מהמבודד המקורי מסוג פרא, מבלי לשבש את שאר הגנום המארח. המחסום השני טמון באופי ההטרוגני של אוכלוסיות ליזוגניות. חלק מהפרופג'ים מתפרקים באמצעות מוטציה או רקומבינציה והופכים ל"קריפטיים", כלומר הם קבועים במיקום מסוים של גנום החיידק. עם זאת, פרופג'ים אחרים הם "פעילים" וניתן להשרות אותם למחזור רפליקטיבי, ליטי באופן ספונטני או לאחר חשיפה לגורמים מעוררים. בתרביות ליזוגניות רבות, קצב האינדוקציה הספונטנית פירושו שחלק מתאי החיידק עוברים תמיד שכפול פאגים ליטי14,15,16. רמה גבוהה של ביטוי גנים מאוחרים של פאגים באוכלוסיות אלה מסווה את ביטוי הגנים ברמה נמוכה הקשור לביטוי גנים מוגבלים בליזוגן11,17. שיעור הליזוגנים העוברים אינדוקציה פרופגית ספונטנית עשוי להשתנות בהתאם למצב הגדילה, תנאי הצמיחה או גורמים אחרים. לכן, כדי לחקור את ההשפעות של פרופג'ים על הליזוגן, יש למזער ככל האפשר אירועי אינדוקציה ספונטניים של פרופאגים על ידי אופטימיזציה של תנאי הגידול לטובת המצב הליזוגני.
מחקר זה מדווח על עבודת ההכנה שנעשתה כדי לחקור את ההשפעה של קבוצה של פרופג'ים החיים יחד מזן המגיפה ליברפול (LES) של Pseudomonas aeruginosa. פרופג'ים פעילים הושרו ובודדו מ-LES ושימשו להדבקת זן המארח P. aeruginosa, PAO116,18,19. כל הגנום של זן P. aeruginosa מסוג פראי, PAO1, והליזוגן שלו, PAO1Φ2, רוצפו (בעומק כיסוי של פי 30) כדי להבטיח את זהות הזן הפראי וכדי לאשר שהליזוגן איזוגני. LES נקשר לתחלואה ותמותה מוגברת בחולי סיסטיק פיברוזיס, והוצע כי LES phages 19 מסייע להסתגלות לסביבת הריאה של סיסטיק פיברוזיס16,19,20. למרות ראיות חזקות לכך שפרופג'ים אלה משפיעים על הביולוגיה של המאכסן שלהם20,21, רוב תפקודי הגנים שלהם עדיין לא מאופיינים, ומנגנוני האינטראקציה הספציפיים אינם מובנים היטב. גישת שעתוק יכולה לחשוף אמפירית את תפקודי גן הפרופאג' ברקע מארח מבוקר. מכיוון שאינדוקציה ספונטנית יכולה להשפיע על פרופילי ביטוי, מאמר זה מתאר כיצד לייעל את תנאי הגידול לטובת המצב הליזוגני. סנכרון כזה של תרביות יכול להיות מאומת על ידי PCR בזמן אמת כדי לכמת את רמות הביטוי של סמנים גנטיים מרכזיים הקשורים לשלבים מכריעים של שכפול פאגים LES ב- PAO1. אותה גישה שימשה בעבר לזיהוי הפונקציות המוגבלות של פאגים שיגה-טוקסיגניים המשפיעים על תנועתיות, עמידות לחומצה ועמידות מיקרוביאלית ב- Escherichia coli11,17,21,22.
Protocol
1. צרו מארח מחוון לבחירה (איור 1)
הערה: ליזטים של תרביות פאג'ים יכולים להכיל תאים מזהמים מהפונדקאי המקורי. קיומו של זן אינדיקטור עמיד לאנטיביוטיקה מאפשר הבחנה בין זן האינדיקטור לבין המארח החיידקי המקורי של הפרופאג'. שימוש בזן חיווי ברירה מאפשר ספירה מדויקת של חלקיקי הפאגים המזהמים ללא צורך בשלבי צנטריפוגה או סינון כדי להסיר את הפאגים מתאי הליזוגן לאחר שלבי הגברת הפאגים. זן מארח המחוון הניתן לבחירה גם מפחית את הזמן ומספר השלבים לספירת פאגים, כך שניתן לנסות מצבים מרובים בו זמנית.
- זהה זן מארח אינדיקטור מתאים הרגיש לזיהום ליטי וליזוגני על ידי הפאג הממוזג של עניין. נעשה שימוש בזן המעבדה P. aeruginosa PAO118,20 והוא רגיש לשלושת הפאגים של LES (LESΦ2, LESΦ3 ו-LESΦ4).
- בחר סוכן סלקטיבי מתאים (ריפמפיצין שימש כאן), ובצע בדיקת דילול מרק כדי לקבוע את הריכוז המעכב המינימלי (MIC) עבור מארח מחוון (16 מיקרוגרם ·מ"ל−1 הוא ה- MIC עבור PAO1)23,24.
- ברצף לחשוף את תרביות מארח אינדיקטור לריכוזים הולכים וגדלים של סוכן סלקטיבי במרק lysogeny (LB), החל מתחת MIC (במקרה זה 5 מיקרוגרם ·mL−1), במשך 18-24 שעות, עם רעיד, וב 37 ° C.
- מעבירים את התרבית הגדלה בריכוז הגבוה ביותר ביחס של 1:100 (אינוקולום לבינוני) לריכוזים מוגברים פי שניים של החומר הסלקטיבי (18-24 שעות בכל פעם) עד שהמיקרופון גדל מספיק. PAO1 הפך לזן עמיד לריפמפיצין (PAO1-RifR) במינון של 300 מיקרוגרם·מ"ל−1 ריפמפיצין.
2. ספירה זמנית ישירה של אינדוקציה ספונטנית (איור 2)
- הגדר תרביות התחלה למשך הלילה הן של הליזוגן (למשל, P. aeruginosa PAO1 lysogen המכיל LES phages) והן של מארח אינדיקטור (PAO1-RifR) על ידי חיסון מושבה אחת ב 5 מ"ל של LB, ודגור ב 37 ° C עם טלטול ב 180 סל"ד (18-24 שעות).
- הגדר תרביות מארחות ליזוגן ואינדיקטור טריות על ידי חיסון תרביות הלילה ב-100 מ"ל ליברות ביחס של 1:100, ודגרה ב-37 מעלות צלזיוס עם רעידות (180 סל"ד).
- עקוב אחר צמיחת הליזוגן על ידי מדידת OD600 וספירה בת קיימא באמצעות טכניקת מיילס מיסרה25. לשם כך, לאסוף דגימה של 1 מ"ל מכל תרבית ליזוגן בכל שעה מנקודת החיסון במשך 8 שעות.
- לדלל באופן סדרתי את הדגימה מיד לאחר האיסוף על ידי הוספת 100 μL של הדגימה לתוך 900 μL של המדיום המתאים. מערבלים היטב במהירות המרבית, משליכים את החוד בכל דילול, וממשיכים את סדרת הדילול מ-10-1 ל-10-9.
- יש למקם 10 μL מהדילולים הנדרשים בטריפליקט על צלחת אגר LB, לאפשר להתייבש ולדגור בטמפרטורה של 37°C למשך 18-24 שעות.
- כדי לחשב את מספר תאי החיידקים בני קיימא, מצא דילול עם מושבות קלות לספירה. ספור את מספר המושבות בכל נקודה ולאחר מכן השתמש בנוסחה הבאה:

הערה: ככל שתרבות הליזוגן גדלה, חלקיקי פאגים פעילים ייווצרו על ידי אינדוקציה ספונטנית. ייצור פאגים זיהומיים פירושו שהשעתוק של אוכלוסיית הליזוגן מזוהם כעת בביטוי גנים הקשורים למחזור שכפול ליטי מאות שכפול הפאגים הליטיים ומתגובת התא המארח המתאימה. לכן, חשוב לזהות את שלב הגידול שבו היחס בין תאים ליזוגניים לחלקיקי פאגים זיהומיים חופשיים הוא הגבוה ביותר על מנת להגביל כמה שיותר רעשי שעתוק רקע (שנוצרו על ידי תעתיק הפאגים הליטיים) במערך הנתונים.
- כדי למנות את חלקיקי הפאגים המזהמים בכל דגימה זמנית, חסן 5 מ"ל של אגר בקטריולוגי סטרילי 0.4% ב- LB (אגר עליון) עם 100 μL של מארח מחוון פאזה מעריכית בינונית (OD600: 0.4-0.5; במקרה זה, PAO1-RifR) בנוכחות סוכן סלקטיבי מתאים (50 מיקרוגרם·מ"ל−1 ריפמפיצין במקרה זה, מכיוון שהמיקרופון של מארח PAO1 הוא רק 16 מיקרוגרם·מ"ל−1; ראה טבלת חומרים, שורה 8 ושורה 9)
- יש לנקוב ב-10 μL של אותו דילול סדרתי (ראה שלב 2.2.2) על שכבת האגר העליונה המחוסנת, ולאפשר להתייבש לפני הדגירה ב-37°C למשך 18-24 שעות.
- כדי לחשב את חלקיקי הפאגים המזהמים, מצא דילול עם פלאקים הניתנים לספירה. ספור את מספר הלוחות בכל נקודה.

- מצא את הזמן/מצב שבו האינדוקציה הספונטנית לכל CFU (יחידת יצירת מושבה) היא מינימלית לשלבי הניסוי הבאים.
3. הכנת תרביות ליזוגן לא מושרות ומושרות למיצוי רנ"א (איור 3)
- הקימו תרבית לילה רעננה על ידי חיסון מושבה אחת של הליזוגן ב-5 מ"ל של LB, ודגרו בטמפרטורה של 37 מעלות צלזיוס עם טלטול (180 סל"ד) למשך 18-24 שעות.
- תת-תרבית תרבית הלילה ב-80 מ"ל LB ביחס של 1:100 בשמונה צלוחיות של 250 מ"ל.
- תייגו את הבקבוק הראשון כ"לא מושרה" ואת האחרים כ"מושרה", יחד עם נקודות הזמן שבהן יש לקצור כל דגימה (כלומר, "מושרה t = 0", "מושרה t = 10 דקות", "מושרה t = 20 דקות" וכו '; איור 3).
- לאחר 90 דקות של דגירה, כאשר OD600 הוא בין 0.1 ל-0.2, או בזמן אינדוקציה ספונטנית מינימלית (ראו דיון), הוסיפו 4 μL של 1% חומצה אצטית קרחונית (v/v) לבקבוק הלא מושרה (איור 3).
הערה: מכיוון שהגורם המשרה בעבודה זו נעשה באמצעות חומצה אצטית קרחונית 1% כמו הממס, אותה כמות של ממס נוספה לבדה כשלב בקרה. ניתן לשקול בקרות חלופיות בהתאם להכנת גורמים שונים. - הוסף את תרבית 80 מ"ל מהבקבוק הלא מושרה ל- 720 מ"ל של LB סטרילי, והוסף מיד את תמיסת העצירה (פנול קר כקרח 5% [v/v], pH 4.3, 95% [v/v] אתנול) באמצעות נפח שהוא 20% מנפח התרבית (160 מ"ל), ודגר על קרח למשך מינימום של 30 דקות ולא יותר משעתיים כדי לייצב את תעתיקי הרנ"א12, 26,27. זהו המדגם הלא מושרה.
- השרית התרביות הנותרות בשבע צלוחיות של 250 מ"ל (איור 3) עם מיקרופון של חומר משרה מתאים (במקרה זה, 25 מ"ג·מ"ל−1 נורפלוקסצין, מוכן בחומצה אצטית קרחונית 1% [w/v], בשימוש בריכוז סופי של 1 מיקרוגרם·מ"ל−1), ערבבו היטב ודגרו בטמפרטורה של 37°C ועם ניעור ב-180 סל"ד למשך שעה אחת.
הערה: צעד זה יאלץ את תרבות הליזוגן למצב מתואם יותר של שכפול ליטי. רוב התאים בתרבית יתחילו לעבור ייצור ליטי של חלקיקי פאגים זיהומיים. - לאפשר לתאים להתאושש על ידי הוספת 80 מ"ל של תרבית מן הבקבוק המושרה ל 720 מ"ל של LB סטרילי, אשר ביעילות מדלל את סוכן השראות. קצרו את תאי החיידקים מכל בקבוק כל 10 דקות מזמן 0 עד שעה על ידי הוספת תמיסת עצירה, כפי שהוזכר בשלב 3.5.
הערה: תמיסת העצירה מייצבת את הרנ"א למשך עד שעתיים. עם זאת, כדי לשפר את יציבות הדגימה בצע את כל השלבים הנוספים ב -4 ° C. - קציר על ידי צנטריפוגה ב 10,000 x גרם במשך 15 דקות ב 4 ° C בהקדם האפשרי, לא יעלה על 2 שעות לאחר הטיפול כדי למנוע השפלה RNA.
- יש להשליך את הסופרנטנט, ולהשהות בעדינות את כדוריות החיידקים בנוזל השיורי באמצעות פיפטה אוטומטית מתכווננת לפני העברת כל דגימה לצינור מיקרופוגה בנפח 1.5 מ"ל.
- צנטריפוגה את צינורות המיקרופוגה במהירות גבוהה (13,000 x גרם) במיקרופוגה ב 4 ° C למשך דקה אחת, ולהשליך את שאריות supernatant.
- הקפיאו במהירות הבזק את הכדוריות על ידי טבילת כל צינור מיקרופוגה אטום לחנקן נוזלי. זה יעזור ליזה יעילה של התאים עבור מיצוי RNA.
- מוסיפים TRIzol (1 מ"ל) לכל גלולה קפואה, ומהומוגניים את המתלה על ידי פיפטינג (לא מערבלים). יש לאחסן בטמפרטורה של -80°C עד לקבלת מוכנות לביצוע מיצוי RNA עבור כל הדגימות.
הערה: ניתן להשהות את הפרוטוקול בשלב זה. - חזור על שלבים 3.1-3.13 עם שלושה עותקים ביולוגיים.
4. בידוד RNA מתרביות ליזוגן לא מושרות ומושרות
קריטי: כל השלבים האלה צריכים להתבצע בסביבה נטולת RNase28. יש לנגב את ספסלי העבודה עם 10% NaClO או משביתים קנייניים של RNase. יש לטפל בלבה עם מעכבי RNase כגון טיפול DEPC, ויש להשתמש במים נטולי נוקלאז בכל התגובות.
- הפשירו את הכדוריות הקפואות שטופלו בטריזול משלב 3.12 על קרח, והוסיפו 400 מיקרוליטר כלורופורם ברמה של ביולוגיה מולקולרית.
- להסעיר את הבקבוקונים היטב על ידי היפוך במשך 10 שניות כדי להשלים את הליזה של כל התאים ( לא מערבולת). לאחר מכן, יש לדגור בטמפרטורת החדר (21°C) למשך 2-5 דקות.
- יש להפריד את השכבה המימית מתערובת TRIzol/כלורופורם באמצעות צנטריפוגה באמצעות מיקרופוגה שולחנית מקוררת בטמפרטורה של 4°C ו-13,000 x g למשך 15 דקות.
- אספו את הפאזה המימית (~ 500 μL, שכבה עליונה) באמצעות פיפטה של 1,000 μL, תוך הקפדה שלא להפריע לשלב הבין-פאזי או האורגני (השכבה התחתונה). מעבירים לצינור מיקרופוגה חדש בנפח 1.5 מ"ל.
- הוסף 450 μL של איזופרופנול ברמה ביולוגית מולקולרית לשלב המימי המופרד, ערבב היטב על ידי היפוך ( לא מערבולת), ודגור בטמפרטורת החדר (21 ° C) במשך 30 דקות.
- לשחזר את RNA על ידי צנטריפוגה באמצעות צנטריפוגה בקירור ב 4 ° C ו 13,000 x גרם במשך 30 דקות.
- יש להשליך את הסופרנאטנט מבלי להפריע לכדורית הרנ"א, ולשטוף את הגלולה פעמיים עם 800 מיקרוליטר של אתנול 70% שהוכן במים נטולי נוקלאז (אין לקפד למעלה ולמטה). להבטיח את היציבות של גלולת RNA על ידי חזרה על שלב הצנטריפוגה במשך 5 דקות לאחר כל שטיפה.
- השליכו את האתנול וייבשו את הכדורית באוויר.
הערה: יש לשאוף את האתנול סביב הגלולה בזהירות באמצעות מיקרוטיפ של 10 μL, ולייבש את הגלולה על ידי היפוך הצינור על נייר ניקוי נקי. גלולת הרנ"א צריכה להפוך לחסרת צבע, והקצוות צריכים להיראות פרועים וגלויים. ייבוש מועט מדי יכול להשאיר שאריות אתנול שיכולות להשפיע על תהליכים במורד הזרם, וייבוש הגלולה יותר מדי יכול להקשות על התרחיף. - יש להשהות מחדש את הרנ"א במים נטולי נוקלאז (50 μL) על ידי דגירה בטמפרטורה של 65°C על שייקר תרמי עם ערבוב לסירוגין (כל 30 שניות) למשך 3-5 דקות בסך הכל.
קריטי: קבוצת הרנ"א 2'- OH מסוגלת לזרז את הפיצול העצמי של גדילי RNA בטמפרטורה גבוהה מעל 65 מעלות צלזיוס ו- pH גבוה. טמפרטורות מתחת ל-65 מעלות צלזיוס יעכבו את ההשעיה של שאריות הדנ"א, ובכך יגבילו את כמות הדנ"א שיש לעכל בשלב מאוחר יותר עם עיכול DNase I. לפיכך, שמירה על הטמפרטורה ב 65 ° C הוא קריטי כדי לקבל את הדגימות הטובות ביותר.
הערה: ניתן להשהות את הפרוטוקול בשלב זה, וניתן לאחסן את הדגימות בטמפרטורה של -80°C.
5. הסרת DNA מזהם מהרנ"א על ידי טיפול DNase
- כדי להסיר דנ"א מזהם מהרנ"א הכולל לפני סינתזת cDNA של הגדיל הראשון, הוסף נפח 0.1 של מאגר DNase 10x ו-1 μL של אנזים DNase ל-10 מיקרוגרם של RNA כולל. מערבבים את הצינור בעדינות ודגרים בטמפרטורה של 37°C למשך 30 דקות.
- השעה מחדש את מגיב ההשבתה של DNase, והוסף לפחות 2 μL או נפח של 10% מנפח התגובה הכולל. מערבבים היטב, ודגרים על הדגימות במשך 5 דקות בטמפרטורת החדר (21 מעלות צלזיוס) במהלך הפיזור מחדש של מגיב ההפעלה של DNase.
- גלול את ריאגנטים DNase על ידי צנטריפוגה באמצעות מיקרוצנטריפוגה שולחנית ב 10,000 × גרם במשך 1.5 דקות.
- מעבירים את הסופרנאטנט המכיל את הרנ"א לצינור טרי מבלי להפריע לכדורית.
הערה: בדוק את איכות הרנ"א באמצעות ספקטרופוטומטר UV בקנה מידה 1 μL ומנתח מחשב מבוסס חומצות גרעין מיקרופלואידיות בהתאם להוראות היצרן; RNA כולל מטוהר יכול להיות מאוחסן ב -80 ° C. עבור qRT-PCR, RNA יכול לשמש ישירות בשלב זה. עבור תהליכים רגישים יותר במורד הזרם, כגון ריצוף RNA, הדורשים איכות דגימה מחמירה, יש להגיע ליחס A260/230 של ε 2.0 כדי להמשיך הלאה. - הרכיבו את נפח תמיסת הרנ"א נטולת הדנ"א ל-500 מיקרוליטר באמצעות מים נטולי נוקלאז.
- הוסף 50 μL של 3 M נתרן אצטט ללא nuclease (pH 5.3) ו 495 μL של isopropanol. מערבבים היטב, ודגרים בטמפרטורת החדר במשך 30 דקות.
הערה: שלב זה יזרז את הרנ"א. - לשחזר את RNA על ידי צנטריפוגה ב 13,000 x גרם ו 4 ° C במשך 30 דקות.
- שטפו את גלולת הרנ"א שלוש פעמים עם אתנול קר כקרח 70% על ידי צנטריפוגה של הדגימות בטמפרטורה של 13,000 x גרם ו-4°C במשך 5 דקות לאחר כל שטיפה כדי להסיר את המלחים לחלוטין.
- בדוק את איכות הרנ"א באמצעות ספקטרופוטומטר UV בקנה מידה 1 μL ומנתח מחשב מבוסס חומצות גרעין מיקרופלואידיות בהתאם להוראות היצרן; RNA כולל מטוהר יכול להיות מאוחסן ב -80 ° C.
הערה: מדריך29 שימש להשגת תקני איכות RNA. אם היחס A260/230 הוא <2.0, חזור על שלבים 5.5-5.9.
6. ניתוח איכותי וכמותי של RNA ללא DNase
- לאמת את יעילות הטיפול ב- DNase עבור כל דגימה על ידי ביצוע PCR כמותי באמצעות פריימרים 16S rRNA (טבלה 2) עם 1 מיקרוגרם של RNA כולל, ולאשר כי לא מיוצר מוצר הגברה.
הערה: הפריימרים האידיאליים להערכת זיהום gDNA יהיו פריימרים המתוכננים לחנך בצמתים אינטרון-אקסון או באזורים רגולטוריים בפרוקריוטים או באתרים לא פעילים בשעתוק30,31. - קבע את מספר תקינות הרנ"א (RIN) באמצעות מנתח מחשב מבוסס חומצות גרעין מיקרופלואידיות בהתאם להוראות היצרן.
הערה: יש להשתמש בדוגמאות המציגות RIN ≥ 9 לסינתזה של הגדיל הראשון. יש להשליך דגימות המציגות RIN < 9, ולחזור על שלבי הבידוד (1.1-5.4). - כמת את ריכוז ה-RNA הכולל באמצעות ערכת בדיקת RNA HS ופלואורימטר בהתאם להוראות היצרן.
7. סינתזת cDNA גדיל ראשון
- הכינו תערובת פריימר RNA לכל דגימה על ידי ערבוב של 1 מיקרוגרם של RNA כולל עם 1 μL של הקסמרים אקראיים (50 ng·μL−1) ו-1 μL של תערובת dNTP של 10 mM. לאחר מכן, כוונן את הנפח הכולל ל -10 μL באמצעות מים נטולי נוקלאז.
- יש לדגור על התגובה בטמפרטורה של 65°C למשך 5 דקות, ולהניח על קרח למשך דקה.
- הכן תערובת סינתזת cDNA עבור כל דגימה על ידי הוספת 2 μL של מאגר RT 10x; 4 μL של 25 mM MgCl2; 2 μL של 0.1 M DTT; 1 μL של מעכב RNase (40 U·μL−1); ו- 1 μL של מגיב השעתוק ההפוך (200 U·μL−1) בסדר המצוין.
- הוסף את תערובת סינתזת cDNA לתערובת RNA/פריימר. מערבבים בעדינות, וצנטריפוגות את הדגימות לזמן קצר כדי לאסוף את הרכיבים בתחתית הצינור.
- מקציפים את התערובת על ידי דגירה של הדגימות במשך 10 דקות ב 25 ° C, ואחריו 50 דקות ב 50 ° C. לסיים את התגובות על ידי דגירה ב 85 ° C במשך 5 דקות, ומצנן על קרח.
- הוסף 1 μL של RNase H לכל צינור, ודגר ב 37 ° C במשך 20 דקות כדי להסיר את RNA מן DNA:RNA היברידי.
- לבסוף, דללו את תגובת הסינתזה cDNA לנפח כולל של 80 μL, ואחסנו אותה ב -80 °C עד לשימוש נוסף.
הערה: ניתן להשהות את הפרוטוקול בשלב זה.
8. עקומה סטנדרטית וכמותית (q)-PCR לקביעת רמות הביטוי של גנים סמנים המצביעים על שלבים שונים של שכפול פאגים
- זהה קבוצה של גני מטרה שיכולים לשמש כסמנים לכל שלב של שכפול הפאג המעניין. בענייננו, אלה היו כמפורט בטבלה 2.
- להגביר כל אחד מגני המטרה מהדנ"א הגנומי של התבנית באמצעות פריימרים רלוונטיים ובאמצעות PCR עם תנאי ההגברה הבאים: דנטורציה ראשונית ב 95 ° C למשך 2 דקות; דנטורציה ב 95 ° C במשך 30 שניות; חישול בטמפרטורת החישול האופטימלית בהתאם לפריימרים (58 מעלות צלזיוס שימש כאן) במשך 30 שניות; הארכה ב-72°C למשך דקה אחת; והארכה סופית ב-72°C למשך 5 דקות.
- לטהר כל אמפליקון באמצעות ערכת טיהור PCR, ולשכפל אותם בווקטור שיבוט TA בהתאם להוראות היצרן. אמת את הרצף של כל מוצר משוכפל על ידי ריצוף Sanger.
הערה: ניתן להשהות את הפרוטוקול בשלב זה. - חשב את מספר העותק עבור פלסמידים בודדים באמצעות המשוואה הבאה20:
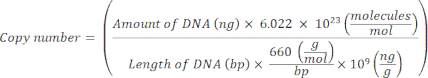
- הכינו תבנית סטנדרטית לכל גן סמן על ידי דילול סדרתי של הדנ"א הפלסמיד מ-109 עותקים/μL ל-10 2 עותקים/μL ב-H2O סטרילי נטול נוקלאז ברמה מולקולרית.
- לבצע PCR כמותי בהתאם להוראות היצרן עבור מערכת qPCR המועדפת עם 1 μL של cDNA (משלב 7.7) עבור כל דגימה משולשת, יחד עם תקני פלסמיד בהתאמה משולש; לבצע את ה-PCR בצלחת של 96 בארות עבור כל מטרה.
- התווה את מספר העתק ה- DNA של יומן הרישום (ציר x) לעומת סף המחזור (ציר y, Ct), והשתמש בפלטפורמה מתאימה כגון Excel או R כדי לבצע חישוב רגרסיה ליניארית כדי להציג את מקדם הקביעה (R2) ומשוואה ליניארית.
הערה: מקדם הקביעה צריך להיות מעל 0.98. - הערך את מספר ההעתקה עבור כל מטרה באמצעות המשוואה הליניארית (y = mx + b) הנגזרת מהרגרסיה הליניארית (שלב 8.7), כאשר y הוא ה- CT המשוער; x הוא מספר העתק ה- DNA של היומן; m הוא שיפוע הקו, המגדיר את השינוי ב-Ct ביחס למספר העתק ה-DNA; ו-b הוא יירוט ציר y המייצג את ה-Ct המשוער עבור עותק דנ"א אחד32.
- עבור כל גן סמן לחשב את היעילות של הגברת PCR (E) באמצעות הפרמטרים מהרגרסיה הליניארית של העקומה הסטנדרטית והמשוואה הבאה, כאשר m הוא השיפוע הנגזר משלב 8.7 ושלב 8.8:
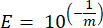
- אמת את כל הפריימרים במונחים של אחוז היעילות שלהם באמצעות המשוואה הבאה:
הערה: היעילות חייבת להיות בטווח של 90%-110%.
- חשב את מספר העותק המוחלט של ה- DNA באמצעות הנוסחה הבאה:
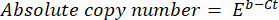
כאשר Ct (שלב 8.8) הוא סף המחזור, b הוא היירוט (שלב 8.8), m הוא השיפוע (שלב 8.8), ו-E הוא היעילות של הגברת PCR (שלב 8.9).
קריטי: כאשר משווים הגברה של שתי מטרות או יותר על ידי q-PCR, יש לחשב את יעילות ה-PCR עבור כל מטרה על מנת להשוות את מספרי העתקי ה-DNA המוחלטים. - במחקר זה, הגנים 16S rRNA, proC ו- rpoD שימשו כבקרות פנימיות כלליות, ו- gyrB שימש כבקרת אינדוקציה33,34,35.
הערה: בעת בחירת בקרות פנימיות מנתוני RNA seq, מומלץ לבחור בקרות פנימיות שאינן משתנות ברמות הביטוי עבור התנאים שנבדקו. שיקול זהיר של בקרות מתאימות חשוב תמיד לפרשנות משמעותית של התוצאות.
תוצאות
בעבודה זו, הספירה הטמפורלית הישירה של ייצור פאגים מתרבית ליזוגן PAO1 LESΦ2 שגדלה בתנאים לא מעוררים שימשה כדי לקבוע את ההשפעה של אינדוקציה ספונטנית של LESΦ2. צפיפות הפאגים הייתה בנקודה הנמוכה ביותר שלה עם ממוצע של ~2.61 x 106 יחידות יוצרות פלאק (PFU)·mL−1 2 שעות לאחר תת-תרבית בתווך טרי במהלך השלב המעריכי המוקדם של הצמיחה, מה שמרמז על כך שליזוגנזה הייתה המצב הדומיננטי. הטיטר LESΦ2 גדל במהירות לממוצע של ~2.4 x 108 PFU·mL−1 תוך 4 שעות והגיע לצפיפות הגבוהה ביותר לאחר 6 שעות (ממוצע של ~5.83 x 109 PFU·mL−1; איור 4).
אינדוקציה ספונטנית מינימלית נצפתה בשלב היומן המוקדם של צמיחת ליזוגן (לאחר שעתיים). עם זאת, הנוכחות המדידה של פאגים במדיום התרבית הייתה תוצאה של אירועים קודמים רבים, כולל: אריזת חומצות גרעין לראשי חלבונים, הרכבת חלבונים לחלקיקי פאגים, וביטוי גנים של פאגים מאוחרים, גנים של פאגים בשלב הביניים וגנים של פאגים מווסתים מוקדמים. היה חשוב לתפוס את התאים הנגועים לפני הופעת אירועי השכפול הקשורים לפאגים; לפיכך, 90 דקות נבחר לתת לתרבות לצמוח לפני האינדוקציה. כדי ללכוד את פרופיל ביטוי הגנים של PAO1, דגימות ליזוגן LESΦ2 מתרבית נקצרו לפני האינדוקציה ואחריה במשך תקופה של 90 דקות, כפי שהוזכר בשלב 3.4. נקודת זמן זו של 90 דקות היא הרבה לפני שרמות גבוהות של אינדוקציה ספונטנית של הפרופאג' התושב מזוהות על ידי בדיקת הפלאק משלב 2.3.2. מכיוון שצפיפות תאי החיידק הייתה נמוכה במהלך הגידול המעריכי המוקדם, נפחי התרבית הוגדלו עד 800 מ"ל כדי להבטיח מספיק חומר למחקרי ביטוי הגנים. הדגימות נאספו מהתרבית הבלתי מושרית ומהתרביות המושרות כל 10 דקות, והרנ"א הופק כדי למפות את פרופיל הביטוי של הסמנים העיקריים לליזוגניה ושכפול ליטי במהלך גדילת החיידקים. סה"כ RNA טוהר ואומת להיעדר DNA גנומי באמצעות בדיקות qPCR המכוונות לגן rRNA 16S (שלב 6.1). הדגימות שהגיעו ל-RIN ≥-9 עברו בקרת איכות והומרו ל-cDNA.
גנום LESΦ2 המבואר נבדק כדי לזהות גנים שהם שחקנים ידועים במחזורי השכפול הליזוגני והליטי של פאגים ממוזגים. גנים מזוהים אלה שימשו לאחר מכן כדי לאמת את qRT-PCR עבור פרופיל הביטוי של גנים מוגבלים במחזור ליזוגן וגנים הקשורים למחזור הליטי מתרביות מושרות ולא מושרות. כימתנו את מספר העתק הדנ"א המוחלט וערכנו מבחן Wilcoxon signed-rank באמצעות R36 כדי להשוות את רמות הביטוי בתרביות לא מושרות ומושרות (איור 5). נצפתה עלייה ניכרת בביטוי הגן cro (סמן מוקדם של שכפול ליטי) מ~2.31 x 109 עותקים בתרביות לא מושרות ל~3.02 x 1011 עותקים 30 דקות לאחר האינדוקציה (Wilcoxon signed-rank test: p < 0.01). באופן דומה, חלבוני O וחלבוני P, שהם סמנים בשלב הביניים של שכפול ליטי (וצפויים להיות מעורבים בשכפול גנום פאגים), הראו גם הם עלייה משמעותית מ~1.74 x 108 ל~1.25 x 10 10 עותקים (Wilcoxon signed-rank test: p < 0.01) ומ~ 6.05 x 102 עד ~5.68 x10 5 עותקים (Wilcoxon signed-rank test: P < 0.01), בהתאמה. לבסוף, הגנים המבניים הקשורים לזנב שימשו כסמנים מאוחרים של מחזור השכפול הליטי. שוב, ראינו עלייה משמעותית בביטוי מ~2.31 x 106 עותקים בתרבויות לא מושרות ל~4.38 x 108 עותקים 30 דקות לאחר האינדוקציה (Wilcoxon signed-rank test: p < 0.01). לפיכך, נתוני RT-PCR הכמותיים אישרו כי ביטוי הגנים של גנים מבוססים היטב לשכפול ליטי עקב אחר המגמה הצפויה, כאשר הסמנים המוקדמים, האמצעיים והמאוחרים הראו ביטוי דיפרנציאלי כפול בסדר החזוי (איור 5). מאחר שהביטוי של הסמנים לשכפול ליטי היה מווסת 30 דקות לאחר ההתאוששות, זה נחשב כנקודת זמן מייצגת מתאימה לחקר הנוף השעתוק של פאגים ממוזגים פעילים והמארחים החיידקיים שלהם במהלך המחזור הליטי.
ראינו ביטוי מסוים של גנים ליטיים בתנאים לא מושרים, מה שאישר כי אינדוקציה ספונטנית כלשהי מתרחשת תמיד, אפילו בתרבויות אופטימליות שבהן מספרי הליזוגן מיוצגים עם היחס הגבוה ביותר של CFU ל- PFU משוחרר בשלב היומן המוקדם. משמעות הדבר היא שתמיד תהיה רמה מסוימת של "רעש" בנתוני התמלול, מה שמחזק את החשיבות של בקרות שהוכנו בקפידה, כולל תרבויות מושרות ולא מושרות. הבחירה המתאימה של גני הבקרה הפנימיים כדי לקבוע את השינויים בביטוי מסתמכת על בחינה מדוקדקת של נתוני השעתוק כדי לזהות גנים המתבטאים באותה רמה הן בדגימות הלא מושרות והן בדגימות המושרות. התוצאות הראשוניות שלנו מצביעות על כך ש- rpoD היה גן הבקרה האמין ביותר שנבדק והיה לו הביטוי היציב ביותר (~ 1.71 x 10 5 עותקים לפני הזירוז ו~ 3.33 x 105 עותקים 30 דקות לאחר הזירוז; מבחן Wilcoxon signed-rank: p = 0.3594) בהשוואה לגנים 16S rRNA או proC (איור 5). השתנות הביטוי של הבקרות הפנימיות הובילה למדידת המספרים המוחלטים של התמלילים. בחינה עתידית של נתוני התמלול תתמוך בבחירת בקרות פנימיות מתאימות לאימות נוסף.
הגן cI שימש בתרגיל פרופיל הגנים שלנו, מכיוון שהוא סמן מוכר היטב של ליזוגניה. בהשוואה לסמנים לשכפול ליטי, הביטוי של הגן cI היה יציב יחסית (איור 5), אולם מספר ההעתקים של הגן הזה היה גבוה באופן מרגיע בתרביות שלא נוצרו בהשוואה לסמנים לשכפול ליטי. נתונים אלה תואמים את מספרי ה-PFU הנמוכים באותן דגימות, ובכך מאשרים כי ביטוי מדכא גבוה היה קשור לרמות נמוכות יותר של ייצור פאגים. הנתונים המדווחים כאן מראים כי הביטוי של תעתיק cI עבור פאג מסוים זה אינו מופחת באופן משמעותי לאחר אינדוקציה, כפי שניתן לראות בפאגים Stx11,17. פעילות המדכא נשלטת בדרך כלל הן ברמת השעתוק והן ברמת הפוסט-תרגום, כך שניתן לשעתק את הגן המדכא, אך החלבון המתקבל נתון מיד למחשוף עצמי. ניסויים נוספים נדרשים כדי לאמת בקרות תמלול ופוסט-תרגום. יתר על כן, מהעקומה הסטנדרטית שלנו, מגבלת הזיהוי המינימלית של qPCR נראית ~ 102 עותקים.
יחד, הממצאים שלנו ממבחני פלאק ו-qRT-PCR מאמתים את האסטרטגיה שלנו להכנת תרבית ודגימות RNA כדי ליצור קלט מבוקר היטב לניסויי RNA-Seq. התרבויות הלא מושרות בשלב המעריכי המוקדם הציגו רמות נמוכות של אינדוקציה ספונטנית וביטוי גנים ליטי, דבר המצביע על הדומיננטיות של הליזוגניה. לעומת זאת, התרביות שבודדו 30 דקות לאחר האינדוקציה הראו עלייה משמעותית בביטוי גנים של סמן המעידים על דומיננטיות של שכפול ליטי.
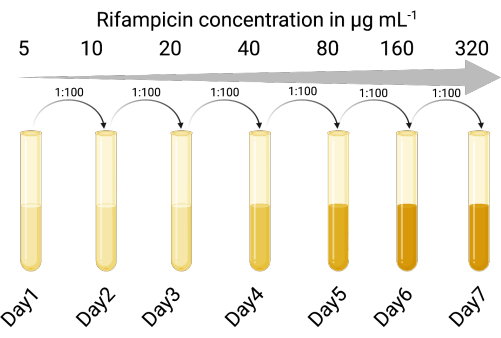
איור 1: הפרוטוקול ליצירת מארח מחוון עמיד לריפמפיצין (נוצר באמצעות BioRender.com). לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: התכנון הניסיוני לספירת PFU ו-CFU של ליזוגן מאותה דגימה. (נוצר באמצעות BioRender.com) אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
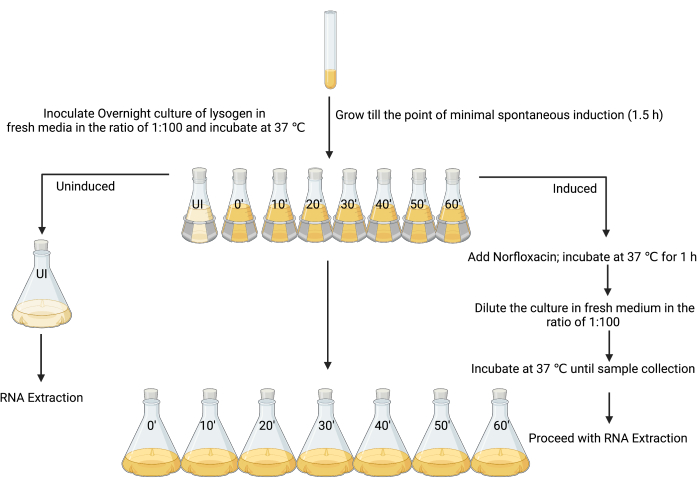
איור 3: התכנון הניסויי לדגימת תרביות מושרות ולא מושרות לבידוד רנ"א. (נוצר באמצעות BioRender.com) לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
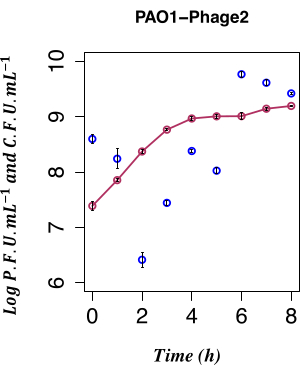
איור 4: ספירה זמנית של אינדוקציה ספונטנית. ספירה טמפורלית של ייצור ספונטני של LES prophage באמצעות PFU מליסוגן PAO1 Φ2 עם CFU, n = 8 (שני העתקים ביולוגיים וארבעה טכניים); קווי השגיאה מייצגים את סטיית התקן. הנקודות האדומות הכהות מציינות את CFU·mL−1 ב-LB; הנקודות הכחולות הכהות מציינות את PFU·mL−1 ב-LB. השחרור הספונטני של הפאג הזיהומי φ2 על ידי הליזוגנים הוא ברמה הנמוכה ביותר הניתנת למדידה בשעתיים לאחר החיסון. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 5: מספר העתק מוחלט של גני סמן המטרה. מספר ההעתקים המוחלט של גנים של סמן פאגים מאשר את דפוסי הביטוי החזויים, הנגזרים באמצעות RT-qPCR, של גנים הצפויים למלא תפקידים חשובים במחזורים ליזוגניים וליטיים. הנקודות מייצגות גם שלושה העתקים ביולוגיים וגם שלושה שכפולים טכניים (n = 9). (א) התיבה האדומה מייצגת את הסמן הליזוגני, cI; (B) ירוק מייצג את הסמן הליטי המוקדם, cro; (C,D) כחול מייצג את הסמנים הליטיים האמצעיים, גנים לשכפול DNA; (E) מגנטה מייצגת את הסמן הליטי המאוחר, גנים מבניים של זנב; (F-H) אפור מייצג את הסמנים המארחים ששימשו כבקרות פנימיות, ו-(I) לבן מייצג את gyrase B, ששימש כבקרת אינדוקציה. הקווים האופקיים המלאים מציגים את החציון של ההתפלגות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 1: פריימרים שתוכננו במחקר זה. הרצפים של פריימרים ספציפיים עבור גני הסמן והבקרות הפנימיות המשמשות במחקר זה מסופקים, יחד עם מזהי ההצטרפות המתאימים שלהם ל- NCBI. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 2: יעילות הפריימרים ששימשו במחקר זה חושבה באמצעות עקומת תקן qPCR. אנא לחץ כאן כדי להוריד טבלה זו.
Discussion
יצירתו של מארח אינדיקטור ניתן לבחירה, ששימש בעבר במבחני פלאק כדי לכמת בצורה מדויקת יותר את האינדוקציה הספונטנית של פאג Stx מ- E. coli MC106137,38,39, תוארה כאן עבור P. aeruginosa phage LESΦ2. להתערבות זו יש יתרון נוסף של הפחתת שלבי עיבוד הדגימה והזמן, ובכך מאפשרת הערכה בו זמנית של שיעורי אינדוקציה ספונטניים בתנאי תרבית מרובים. קיים סיכון ליצירת מוטציות אחרות במהלך יצירת וריאנטים עמידים לריפמפיצין40; עם זאת, בעבודה זו, הזן המפותח שימש רק כמארח אינדיקטור לספירת רבדים מתרבויות מעניינות ולא נכלל בניתוח התמלול. כל עוד זן האינדיקטור הניתן לבחירה נותר רגיש באותה מידה להדבקה על ידי הפאג המעניין, אין חשש לגבי מוטציות נרכשות אחרות. עם זאת, לא זוהו הבדלים בפרופילי הפולימורפיזם של אורך מקטע ההגבלה על ידי ניתוח אלקטרופורזה של ג'ל שדה דופק (PFGE) של PAO1WT ו- PAO1RIF (הנתונים אינם מוצגים).
בעת בחירת תאים מארחים, נדיר למצוא זן אינדיקטור שאינו מכיל כבר פרופגים. לדוגמה, PAO1 מכיל את הפרופאג' Pf4. בקרות הניסוי במחקר זה תוכננו כך שיהיו מסוגלות לבחון ישירות את ביטוי הגנים של פאגים ספציפיים (במקרה זה, LES prophage 2) ואת ההשפעות שיש לפאג' זה על ביטוי גנים חיידקיים. בהשוואה בין תעתיקים מ-PAO1 הנושאים את LES prophage 2 וחסרים את LES prophage 2 (הן lysogen והן non-lysogen נושאים את Pf4 האנדוגני), המשמשים כבקרות פנימיות כדי לשלול את ההשפעה של Pf4 על המארח. בנוסף, הוכח כי Pf4 בדרך כלל אינו גורם לליזה בתא המארחשלו 41 ולכן אינו מסוגל לבלבל את התוצאות של ניסויים אלה.
ידוע היטב כי בקרת איכות זהירה היא חיונית בהכנת הדגימות להפקת נתוני אומיקס משמעותיים42. עם זאת, כפי שתואר קודם לכן11, אפיון זהיר של פעילות פרופג'ים בהכנת תרביות ליזוגן למחקרים כאלה מבוצע רק לעתים רחוקות. כאן, אנו מפרטים את הפרוטוקולים השיטתיים שלנו להכנת מערך תרביות מבוקר היטב וממוטב למחקרי שעתוק כדי לחקור טוב יותר את יחסי הגומלין בין חיידקים ופאגים ממוזגים. הסינכרוניות של האוכלוסייה נשלטה על ידי הבאת התרבית דרך לפחות ארבע הכפלות לפני שטיפלו בה עם האנטיביוטיקה המושרה נורפלקסצין. על ידי קביעת MIC של norfloxacin עבור הזן במחקר, אנו יכולים להבטיח כי הריכוז של הגורם המשרה היה בדיוק מעל MIC עבור טיפול "אינדוקציה". התאים המטופלים דוללו ביחס של 1:10 כדי להוריד את ריכוז הנורפלקסצין מתחת למיקרופון לאחר טיפול של שעה אחת על מנת לאפשר לתאים להתאושש ולהשלים את תהליך שכפול הפאגים, המסתיים בליזה של התא ובשחרור צאצאי פאגים זיהומיים. התאים נכנסים למחזור השכפול הליטי רק לאחר גירוי האינדוקציה לאחר שריכוז הנורפלקסצין הובא מתחת למיקרופון במהלך תקופת ההחלמה. במקרה זה, מעבר מעל 1 מיקרוגרם·מ"ל−1 norfloxacin פירושו כי התרופה לא יכול להיות מדולל ביעילות מתחת למיקרופון, כמו MIC עבור norfloxacin עבור PAO1 הוא 0.19 מיקרוגרם ·mL−1. רמת דילול השראת חייבת להיות מאוזנת עם הצורך בהתאוששות ליזוגן ושמירה על צפיפות התרבית לקצירת הרנ"א. הנתונים הנדונים כאן מראים כי ניתן לסנכרן תרביות כדי ליצור דגימות שבהן הליזוגניות שולטת, ובכך להפחית את הרעש מהשראה ספונטנית ולאפשר זיהוי של שינויים אמיתיים המונעים על ידי ליזוגניות בביטוי גנים. מכיוון שהמצב הליזוגני שולט בשלב האקספוננציאלי המוקדם של הצמיחה כאשר צפיפות התא החיידקית נמוכה, אנו מציעים להרחיב את התרביות כדי לקצור מספיק RNA למחקרי ביטוי גנים עתידיים כגון RNA-Seq.
השימוש בנורפלקסצין כגורם מעורר לאלץ תרביות להיכנס למחזור הליטי מדווח היטב43,44; עם זאת, זה ישפיע גם על ביטוי של גנים חיידקיים אחרים בתהליך45,46. כדי למתן זאת, ספריות רנ"א מתרביות בר ביקורתיות שגדלו באותם תנאים מעוררים ולא מעוררים צריכות להיכלל בניסויי RNA-Seq. השימוש בבקרות פנימיות ובגנים של סמנים מרכזיים כדי לאמת את שלבי שכפול הפאגים על ידי qRT-PCR חיוני גם להשוואות מדויקות. פרופיל RT-PCR כמותי אינו יכול להתפרש על ידי השוואת המספרים המוחלטים של תעתיקים עבור כל גן בנקודות זמן שונות; צורת הפרופיל היא החשובה. ראשית, רק אזור קטן אחד בתעתיק של גן כלשהו נדגם, כך שלא ידוע אם מדובר ביסוד קצר מועד או בעל חיים ארוכים יותר27. אין ספק, מיפוי RNA-Seq של תעתיקים מראה כי צפיפות נתוני המיפוי משתנה באופן משמעותי לאורך הגן. שנית, זוהי צורת פרופיל ביטוי הגנים שיש לפרש עבור גן סמן הקשור למחזור הליטי או לאורח החיים הליזוגני או אפילו לנתק ממעגלי ויסות הפאגים11. אינדוקציה ספונטנית היא בעיה אמיתית בתרבות הליזוגן ותמיד תגרום לביטוי של גנים הקשורים למחזור הליטי. עם זאת, פרופיל מראה כי הגנים הקשורים למחזור השכפול הליטי מדוכאים בביטוי שלהם לפני האינדוקציה (לפחות שני קפלי לוג) ובפוסט-אינדוקציה מווסתת כלפי מעלה.
ניתוחי השעתוק שנערכו בעבר של אינטראקציות פאגים Stx עם E. coli תומכים בהבנה מעמיקה של גני הפאגים המעורבים בשמירה על ליזוגניות והפעלת המחזור הליטי11,17. נכון לעכשיו, הפאגים LES של P. aeruginosa כבר מבוארים, אבל תפקודי הגן העיקריים שלהם פחות מובנים. מחקרי שעתוק יאפשרו ביאור מחדש של פרופג'ים של LES וישפרו את הבנתנו את הגנים המעורבים במחזור הליזוגני והליטי. קישור רצף גנים לתפקוד מהווה אתגר גדול בחקר פרופג'ים חדשים, מה שמדגיש עוד יותר את הצורך במחקרים נוספים כדי לאשר את תפקודי גן הפאגים לייצור כלי ביאור טובים יותר47. היישום וההתאמה הרחבים יותר של הפרוטוקולים ואמצעי בקרת האיכות הנוספים המפורטים במאמר וידאו זה יכולים לסייע בחשיפת פונקציות פרופג'ים שונות, ובכך לשפר את צינורות הביאור ולשנות את הבנתנו את הפאגים והביולוגיה של חיידקים.
Materials
| Name | Company | Catalog Number | Comments |
| PAO1 | 6 | ||
| LESB58 | 6 | ||
| LES phages | Induced and purified from LESB58 using Norfloxacin. | This study | |
| Lysogeny Broth (LB) | Merck | 1.10285.500 | |
| LB Agar | Merck | 1.10283.500 | |
| Agar Agar | Fisher | A/1080/53 | |
| Top Agar | 0.4 g Agar Agar+2.5 g LB Broth in 100 mL water; autoclave and use. | - | |
| Rifampicin | Sigma (Stock: 50 mg/mL in Methanol- Mix well and use 0.22µm filter to sterilize and store it in -20°C until use) | R3501 | |
| Glacial Acetic Acid | Fisher 1% (v/v) in water | 10060000 | |
| Norfloxacin | Sigma (Stock: 25 mg/mL of 1% Glacial Acetic Acid-Mix well and use 0.22µm filter to sterilize and store it in -20°C until use;To avoid freeze thaw cycles, store as small aliquotes) | N9890 | |
| Phenol saturated with citrate buffer pH 4.3 | Sigma | P-4682 | |
| Molecular Biology grade Ethanol | Fisher | 16695992 | |
| TRIzol | Invitrogen | 12044977 | |
| Chloroform | Fisher | 11398187 | |
| Isopropanol | Fisher | 17150576 | |
| Nuclease-free H2O | Invitrogen | 10526945 | |
| 10X TURBO DNase | Ambion | AM1907 | |
| Qubit RNA HS, BR Kit | Invitrogen | Q10210 | |
| Agilent RNA 6000 Nano Kit | Agilent | 5067-1511 | |
| SuperScriptIII first strand synthesis kit | Invitrogen | 18080051 | |
| PCR Reagents | Bioline Mytaq Red 2X | BIO-25043 | |
| qPCR Reagents | Sensifast SYBR Hi Rox | BIO-92020 | |
| PCR purification kit | Isolate II PCR and Gel Kit | BIO-52060 | |
| TA cloning kit | TA Cloning Kit, with pCR 2.1 Vector, without competent cells | K202040 | |
| StepOne Real Time PCR system | Thermo Fisher Scientific | 4376600 |
References
- Lin, D. M., Koskella, B., Lin, H. C. Phage therapy: An alternative to antibiotics in the age of multi-drug resistance. World Journal of Gastrointestinal Pharmacology and Therapeutics. 8 (3), 162-173 (2017).
- Jiang, W., Marraffini, L. A. CRISPR-Cas: New tools for genetic manipulations from bacterial immunity systems. Annual Review of Microbiology. 69 (1), 209-228 (2015).
- Santos, S. B., Azeredo, J. Bacteriophage-based biotechnological applications. Viruses. 11 (8), 737(2019).
- Rodríguez-Rubio, L., Jofre, J., Muniesa, M. Is genetic mobilization considered when using bacteriophages in antimicrobial therapy. Antibiotics. 6 (4), 32(2017).
- Hatfull, G. F. Dark Matter of the biosphere: The amazing world of bacteriophage diversity. Journal of Virology. 89 (16), 8107-8110 (2015).
- Yukgehnaish, K., et al. PhageLeads: Rapid assessment of phage therapeutic suitability using an ensemble Machine Learning approach. Viruses. 14 (2), 342(2022).
- Seemann, T. Prokka: Rapid prokaryotic genome annotation. Bioinformatics. 30 (14), 2068-2069 (2014).
- Arndt, D., et al. PHASTER: A better, faster version of the PHAST phage search tool. Nucleic Acids Research. 44, W16-W21 (2016).
- Banerjee, S., et al. FINDER: An automated software package to annotate eukaryotic genes from RNA-Seq data and associated protein sequences. BMC Bioinformatics. 22 (1), 205(2021).
- Jumper, J., et al. Highly accurate protein structure prediction with AlphaFold. Nature. 596 (7873), 583-589 (2021).
- Veses-Garcia, M., et al. Transcriptomic analysis of Shiga-toxigenic bacteriophage carriage reveals a profound regulatory effect on acid resistance in Escherichia coli. Applied and Environmental Microbiology. 81 (23), 8118-8125 (2015).
- Owen, S. V., et al. A window into lysogeny: revealing temperate phage biology with transcriptomics. Microbial Genomics. 6 (2), e000330(2020).
- Davies, E. V., Winstanley, C., Fothergill, J. L., James, C. E. The role of temperate bacteriophages in bacterial infection. FEMS Microbiology Letters. 363 (5), 015(2016).
- Livny, J., Friedman, D. I. Characterizing spontaneous induction of Stx encoding phages using a selectable reporter system. Molecular Microbiology. 51 (6), 1691-1704 (2004).
- Fogg, P. C. M., et al. Identification of multiple integration sites for Stx-phage Φ24B in the Escherichia coli genome, description of a novel integrase and evidence for a functional anti-repressor. Microbiology. 153 (12), 4098-4110 (2007).
- James, C. E., et al. Differential infection properties of three inducible prophages from an epidemic strain of Pseudomonas aeruginosa. BMC Microbiology. 12, 216(2012).
- Riley, L. M., et al. Identification of genes expressed in cultures of E. coli lysogens carrying the Shiga toxin-encoding prophage Φ24B. BMC Microbiology. 12 (1), 42(2012).
- Stover, C. K., et al. Complete genome sequence of Pseudomonas aeruginosa PAO1, an opportunistic pathogen. Nature. 406 (6799), 959-964 (2000).
- Winstanley, C., et al. Newly introduced genomic prophage islands are critical determinants of in vivo competitiveness in the Liverpool Epidemic Strain of Pseudomonas aeruginosa. Genome Research. 19 (1), 12-23 (2009).
- Davies, E. V., et al. Temperate phages enhance pathogen fitness in chronic lung infection. The ISME Journal. 10 (10), 2553-2555 (2016).
- Allison, H. E. Stx-phages: drivers and mediators of the evolution of STEC and STEC-like pathogens. Future Microbiology. 2 (2), 165-174 (2007).
- Allison, H. E., et al. Immunity profiles of wild-type and recombinant Shiga-like toxin-encoding bacteriophages and characterization of novel double lysogens. Infection and Immunity. 71 (6), 3409-3418 (2003).
- Mori, N., et al. A peptide based on homologous sequences of the β-barrel assembly machinery component BamD potentiates antibiotic susceptibility of Pseudomonas aeruginosa. Journal of Antimicrobial Chemotherapy. 67 (9), 2173-2181 (2012).
- Chojnacki, M., et al. A novel, broad-spectrum antimicrobial combination for the treatment of Pseudomonas aeruginosa corneal infections. Antimicrobial Agents and Chemotherapy. 63 (10), e00777(2019).
- Miles, A. A., Misra, S. S., Irwin, J. O. The estimation of the bactericidal power of the blood. Epidemiology & Infection. 38 (6), 732-749 (1938).
- Srikumar, S., et al. RNA-seq brings new insights to the intra-macrophage transcriptome of Salmonella Typhimurium. PLoS Pathogens. 11 (11), e1005262(2015).
- Kröger, C., et al. The transcriptional landscape and small RNAs of Salmonella enterica serovar Typhimurium. Proceedings of the National Academy of Sciences of the United States of America. 109 (20), E1277-E1286 (2012).
- Green, M. R., Sambrook, J. How to win the battle with RNase. Cold Spring Harbor Protocols. (2), (2019).
- Koetsier, G. A practical guide to analyzing nucleic acid concentration and purity with microvolume spectrophotometers. New England BioLabs Inc. , Available from: https://www.neb.com/-/media/nebus/files/application-notes/technote_mvs_analysis_of_nucleic_acid_concentration_and_purity.pdf?rev=c24cea043416420d84fb6bf7b554dbbb (2019).
- Saunders, N. A., Lee, M. A. Real-Time PCR: Advanced Technologies and Applications. , Caister Academic Press. Norfolk, UK. (2013).
- Bustin, S. A. A-Z of Quantitative PCR. , International University Line. La Jolla, CA. (2004).
- Ruijter, J. M., et al. Efficiency correction is required for accurate quantitative PCR analysis and reporting. Clinical Chemistry. 67 (6), 829-842 (2021).
- Fothergill, J. L., Neill, D. R., Loman, N., Winstanley, C., Kadioglu, A. Pseudomonas aeruginosa adaptation in the nasopharyngeal reservoir leads to migration and persistence in the lungs. Nature Communications. 5 (1), 4780(2014).
- Huang, J., et al. Temperature-dependent expression of phzM and its regulatory genes lasI and ptsP in rhizosphere isolate Pseudomonas sp. strain M18. Applied and Environmental Microbiology. 75 (20), 6568-6580 (2009).
- Savli, H., et al. Expression stability of six housekeeping genes: a proposal for resistance gene quantification studies of Pseudomonas aeruginosa by real-time quantitative RT-PCR. Journal of Medical Microbiology. 52 (5), 403-408 (2003).
- Kassambara, A. rstatix: Pipe-Friendly Framework for Basic Statistical Tests. , Available from: https://CRAN.R-project.org/package=rstatix (2022).
- McDonald, J. E., et al. High-throughput method for rapid induction of prophages from lysogens and its application in the study of Shiga toxin-encoding Escherichia coli strains. Applied and Environmental Microbiology. 76 (7), 2360-2365 (2010).
- Smith, D. L., et al. Short-tailed Stx phages exploit the conserved YaeT protein to disseminate Shiga toxin genes among Enterobacteria. Journal of Bacteriology. 189 (20), 7223-7233 (2007).
- James, C. E., et al. Lytic and lysogenic infection of diverse Escherichia coli and Shigella strains with a verocytotoxigenic bacteriophage. Applied and Environmental Microbiology. 67 (9), 4335-4337 (2001).
- Rees, V. E., et al. Characterization of hypermutator Pseudomonas aeruginosa isolates from patients with cystic fibrosis in Australia. Antimicrobial Agents and Chemotherapy. 63 (4), e02538(2019).
- Li, Y., et al. Excisionase in Pf filamentous prophage controls lysis-lysogeny decision-making in Pseudomonas aeruginosa. Molecular Microbiology. 111 (2), 495-513 (2019).
- Van Kampen, A. H. C., Moerland, P. D. Taking bioinformatics to systems medicine. Systems Medicine. 1386, 17-41 (2016).
- Matsushiro, A., Sato, K., Miyamoto, H., Yamamura, T., Honda, T. Induction of prophages of enterohemorrhagic Escherichia coli O157:H7 with norfloxacin. Journal of Bacteriology. 181 (7), 2257-2260 (1999).
- James, C. E., et al. Lytic activity by temperate phages of Pseudomonas aeruginosa in long-term cystic fibrosis chronic lung infections. The ISME Journal. 9 (6), 1391-1398 (2015).
- Shaw, K. J., et al. Comparison of the changes in global gene expression of Escherichia coli induced by four bactericidal agents. Microbial Physiology. 5 (2), 105-122 (2003).
- Long, H., et al. Antibiotic treatment enhances the genome-wide mutation rate of target cells. Proceedings of the National Academy of Sciences of the United States of America. 113 (18), E2498-E2505 (2016).
- González-Tortuero, E., et al. VIGA: A sensitive, precise and automatic de novo VIral Genome Annotator. bioRxiv. , (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved