Method Article
Ilıman Bakteriyofajların Lizojenleri Üzerindeki Etkisini Transkriptomik Yoluyla Anlamak
Özet
Bu protokol, kehanetlerin konakçıları üzerindeki etkisinin ortaya çıkmasını sağlar. Bakteri kültürleri, lizojenik durumu en iyi destekleyen ve spontan indüksiyonu sınırlayan koşullar kullanılarak senkronize edilir. RT-qPCR, kehanet kısıtlı genleri ve faj kontrolünden ayrılmamış genleri, litik replikasyon döngüsü sırasında eksprese edilenlerden kesin olarak ayırır.
Özet
Ilıman fajlar, bakteri genomlarının çoğunda kehanetler olarak entegre olarak bulunur. Bazı kehanetler kriptiktir ve bakteri kromozomunda sabittir, ancak diğerleri aktiftir ve kendiliğinden veya indükleyici faktörlere maruz bırakılarak replikatif bir forma tetiklenebilir. Kehanetler genellikle konakçı hücrelerine toksin üretimi veya diğer virülansla ilişkili özellikler kazandırma yeteneği ile ilişkilidir. Daha yeni çalışmalar, konakçılarının fizyolojisini değiştirmede çok daha büyük bir rol oynayabileceklerini göstermiştir. Burada açıklanan teknik, fırsatçı bakteri Pseudomonas aeruginosa'da kehanetlerin gen ekspresyonunu nasıl etkilediğini araştırmamızı sağlamıştır.
Bu çalışmada, vahşi tip P. aeruginosa suşu PAO1'in büyümesi, Liverpool Epidemik Suşu (LES) LESB58'den farklı kehanet kombinasyonları taşıyan izojenik lizojenlerinkiyle karşılaştırıldı. Bir lizojen kültüründe, bakteri hücrelerinin bir kısmı, faj parçacıklarının montajı ile ilişkili olanlar gibi, geç faj genlerinin hücre başına yüksek düzeyde ekspresyon ile litik bakteriyofaj replikasyonunu (spontan indüksiyon) destekleyecektir, böylece lizojen kısıtlı gen ekspresyonu ile ilişkili düşük seviyeli gen ekspresyonunu maskeleyecektir. Spontan indüksiyonun etkisi, bu nedenle, bir lizojen popülasyonunda kehanet gen ekspresyonunu gizleyebilir.
Erken üstel büyüme fazında minimal olan spontan indüksiyonu tanımlamak için büyüme profili oluşturma deneyleri kullanıldı. Bu çalışma, erken üstel büyüme aşamasında örnek kültürlerin nasıl hazırlanacağını ve düşük hücre sayılarına rağmen yeterli kontrollerin nasıl kurulacağını bildirmektedir. Bu protokoller, çeşitli koşullar altında vahşi tip ve lizojenik bakterilerin güvenilir ve tekrarlanabilir bir şekilde karşılaştırılmasını sağlar, böylece kehanet genomlarının transkriptomik profillemesini geliştirir ve daha önce tanınmayan kehanet işlevlerinin tanımlanmasına yardımcı olur.
Giriş
Son zamanlarda, antimikrobiyal dirençle mücadele için faj tedavisi1 ve CRISPR-Cas tabanlı gen düzenleme2, bakteriyofaj araştırmalarına olan ilgiyi yeniden artırdı. Yine, biyoteknolojideki gelişmeler, bakteri ve fajlar arasındaki etkileşimlerin daha derinlemesine araştırılmasını sağlamıştır3. Bununla birlikte, fajın terapötik kullanımı ("faj tedavisi"), virülans ve direnç genlerini yatay olarak aktarma kapasitesine sahip mobil genetik elemanlar olarak hareket eden fajlarla ilgili endişeler nedeniyle engellenmektedir4. "Karanlık maddenin"5 (bilinmeyen işlevlere sahip genler) genişliği hem rahatsız edici hem de caziptir. Karanlık madde, faj biyolojisi anlayışımızda bir boşluk ve moleküler araçlar ve potansiyel yeni terapötikler için büyük ölçüde kullanılmayan bir kaynak olarak kabul edilir6. Geliştirilmiş gen açıklama 7,8,9 ve yeni peptit katlama algoritmaları10 ile birlikte yüksek verimli dizileme tekniklerinin geliştirilmesi, faj genlerinin tespitini, tanımını ve işlevsel tahminini iyileştirmektedir. Bununla birlikte, bilim, çoğu fajın gen fonksiyonlarını kültürde veya gerçek dünyada doğrulamaktan hala uzaktır.
RNA dizilimi (RNA-Seq), faj enfeksiyonu sırasında gen ekspresyonunu küresel olarak haritalayabilir ve litik ve lizojenik döngülerde yer alan hem faj hem de bakteriyel elementlerin anlaşılmasını önemli ölçüde geliştirmiştir11,12. Lizojenik süreçler sırasında, ılıman faj genomları, kehanetler haline gelmek üzere bakteri DNA'sına entegre edilir13. Küresel gen ekspresyonu profilleme deneyleri, ılıman faj genomlarında kodlanan, ancak yalnızca lizojenik durum11 sırasında ifade edilen kehanet kısıtlı genleri tanımlamak için kullanılabilir. Bu tür genler, faj yapısal proteinlerini kodlamaz ve herhangi bir faj enfeksiyonu sürecine dahil değildir. RNA-Seq, ya bir işlev kazancı indükleyerek ya da mevcut bakteri genlerini düzenleyerek, bakteri konakçısının biyolojisini etkileme olasılığı daha yüksek olan genleri tanımlamak için kullanılabilir, böylece genellikle bakterilerin değişen ortamlara uyum sağlamasını sağlar. Bu nedenle, kehanetlerin bir dizi bakteri fonksiyonunu kontrol eden mikrobiyal kukla ustaları olarak hareket etme yeteneği incelenebilir.
Kehanet kısıtlı gen ekspresyonunun etkili analizinin önünde iki büyük engel vardır. İlk olarak, duyarlı ana bilgisayarların mevcudiyeti önemli bir konudur. Tanım olarak, kehanetler zaten spesifik konakçı genomlarına dahil edilmiştir, bu nedenle kehanetin varlığında ve yokluğunda küresel gen ekspresyonunu karşılaştırmak için duyarlı bir vahşi tip konakçı bulmak zordur. Bu, ya başka bir duyarlı konakçının de novo enfeksiyonu ya da konakçı genomunun geri kalanını bozmadan orijinal vahşi tip izolattan kehanetin silinmesi yoluyla başarılabilir. İkinci engel, lizojenik popülasyonların heterojen doğasında yatmaktadır. Bazı kehanetler, mutasyon veya rekombinasyon yoluyla "kriptik" hale gelir, yani bakteri genomunun belirli bir yerinde sabitlenirler. Bununla birlikte, diğer kehanetler "aktiftir" ve kendiliğinden veya indükleyici faktörlere maruz kaldıktan sonra replikatif, litik bir döngüye indüklenebilir. Birçok lizojenik kültürde, spontan indüksiyon hızı, bakteri hücrelerinin bir kısmının her zaman litik faj replikasyonuna uğradığı anlamına gelir14,15,16. Bu popülasyonlarda geç faj genlerinin yüksek düzeyde ekspresyonu, lizojen kısıtlı gen ekspresyonu ile ilişkili düşük seviyeli gen ekspresyonunu maskelemektedir11,17. Spontan kehanet indüksiyonu geçiren lizojenlerin oranı, büyüme durumuna, büyüme koşullarına veya diğer tetikleyicilere göre değişebilir. Bu nedenle, kehanetlerin lizojen üzerindeki etkilerini incelemek için, büyüme koşullarını lizojenik durumu destekleyecek şekilde optimize ederek spontan kehanet indüksiyon olayları mümkün olduğunca en aza indirilmelidir.
Bu çalışma, Pseudomonas aeruginosa'nın Liverpool Salgın Suşundan (LES) bir dizi birlikte yaşama kehanetinin etkisini araştırmak için yapılan hazırlık çalışmalarını bildirmektedir. Aktif kehanetler indüklendi ve LES'den izole edildi ve model P. aeruginosa konak suşu, PAO116,18,19'u enfekte etmek için kullanıldı. Yabani tip P. aeruginosa suşunun tüm genomları, PAO1 ve lizojeni PAO1Φ2, vahşi tip suşun kimliğini sağlamak ve lizojenin izojenik olduğunu doğrulamak için (30x kapsama derinliğinde) dizilendi. LES, kistik fibrozis hastalarında artmış morbidite ve mortalite ile ilişkilendirilmiştir ve LES fajlarının 19 kistik fibrozis akciğer ortamına adaptasyona yardımcı olduğu öne sürülmüştür16,19,20. Bu kehanetlerin konakçılarının biyolojisini etkilediğine dair güçlü kanıtlara rağmen20,21, gen fonksiyonlarının çoğu henüz karakterize edilmemiştir ve spesifik etkileşim mekanizmaları tam olarak anlaşılamamıştır. Bir transkriptomik yaklaşım, kontrollü bir konakçı arka planında kehanet geni fonksiyonlarını ampirik olarak ortaya çıkarabilir. Spontan indüksiyon ekspresyon profillerini etkileyebileceğinden, bu makalede lizojenik durumu desteklemek için büyüme koşullarının nasıl optimize edileceği açıklanmaktadır. Kültürlerin bu tür senkronizasyonu, PAO1'de LES faj replikasyonunun önemli aşamalarıyla ilişkili anahtar genetik belirteçlerin ekspresyon seviyelerini ölçmek için gerçek zamanlı PCR ile doğrulanabilir. Aynı yaklaşım daha önce Escherichia coli11,17,21,22'de motiliteyi, asit direncini ve antimikrobiyal direnci etkileyen Shiga-toksijenik fajların kehanet kısıtlı işlevlerini tanımlamak için kullanılmıştır.
Protokol
1. Seçilebilir bir gösterge ana bilgisayarı oluşturun (Şekil 1)
NOT: Faj kültürü lizatları, orijinal bakteri konakçısından kirletici hücreler içerebilir. Antibiyotiğe dirençli bir indikatör suşuna sahip olmak, indikatör suşu ile kehanetin orijinal bakteri konakçısı arasındaki ayrıma izin verir. Seçilebilir bir indikatör suşunun kullanılması, faj amplifikasyon adımlarını takiben lizojen hücrelerinden fajı çıkarmak için santrifüjleme veya filtrasyon adımları gerektirmeden enfektif faj partiküllerinin doğru sayımını sağlar. Seçilebilir gösterge konak suşu, birden fazla koşulun aynı anda denenebilmesi için faj sayımı için gereken süreyi ve adım sayısını da azaltır.
- İlgilenilen ılıman faj tarafından litik ve lizojenik enfeksiyona duyarlı uygun bir indikatör konakçı suşu tanımlayın. P. aeruginosa laboratuvar suşu PAO118,20 kullanılmıştır ve üç LES fajına (LESΦ2, LESΦ3 ve LESΦ4) duyarlıdır.
- Uygun bir seçici ajan seçin (burada rifampisin kullanılmıştır) ve gösterge konakçı için minimum inhibitör konsantrasyonu (MIC) belirlemek için bir et suyu seyreltme testi gerçekleştirin (16 μg·mL-1, PAO1 için MIC'dir)23,24.
- İndikatör konakçı kültürlerini, MIC'nin altından başlayarak (bu durumda 5 μg·mL-1), 18-24 saat boyunca, çalkalama ile ve 37 ° C'de, lizojen et suyunda (LB) seçici ajanın artan konsantrasyonlarına sırayla maruz bırakın.
- En yüksek konsantrasyonda 1:100 oranında (aşıdan ortaya) büyüyen kültürü, MIC yeterince arttırılana kadar seçici ajanın iki kat artan konsantrasyonlarına (her seferinde 18-24 saat) aktarın. PAO1, 300 μg·mL−1 rifampisinde rifampisine dirençli bir suş (PAO1-Rif R) haline geldi.
2. Spontan indüksiyonun zamansal doğrudan sayımı (Şekil 2)
- Tek bir koloniyi 5 mL LB içinde aşılayarak hem lizojenin (örneğin, LES fajlarını barındıran P. aeruginosa PAO1 lizojeni) hem de gösterge konakçının (PAO1-RifR) gece boyunca başlangıç kültürlerini kurun ve 37 ° C'de 180 rpm'de (18-24 saat) çalkalayarak inkübe edin.
- Gece kültürlerini 100 mL LB içinde 1:100 oranında aşılayarak taze lizojen ve indikatör konakçı kültürleri oluşturun ve 37 ° C'de çalkalama (180 rpm) ile inkübe edin.
- OD600'ü ve Miles Misra tekniğini kullanarak canlı sayımıölçerek lizojen büyümesini izleyin 25. Bunu yapmak için, 8 saat boyunca aşılama noktasından her saat başı her lizojen kültüründen 1 mL numune alın.
- Numuneyi aldıktan hemen sonra, ilgili ortamın 900 μL'sine 100 μL numune ekleyerek numuneyi seri olarak seyreltin. Maksimum hızda iyice girdaplayın, her seyreltmede ucu atın ve seyreltme serisine 10−1'den 10−9'a kadar devam edin.
- Gerekli seyreltmelerin 10 μL'sini bir LB agar plakasına üç kopya halinde tespit edin, kurumasını bekleyin ve 37 °C'de 18-24 saat inkübe edin.
- Canlı bakteri hücrelerinin sayısını hesaplamak için, kolayca sayılabilen kolonilerle bir seyreltme bulun. Her noktadaki koloni sayısını sayın ve ardından aşağıdaki formülü kullanın:

NOT: Lizojen kültürü büyüdükçe, aktif faj parçacıkları spontan indüksiyonla üretilecektir. Enfektif fajların üretimi, lizojen popülasyonunun transkriptomunun artık litik faj replikasyon sinyalinden ve karşılık gelen konakçı hücre yanıtından litik replikasyon döngüsü ile ilişkili gen ekspresyonu ile kontamine olduğu anlamına gelir. Bu nedenle, veri setinde mümkün olduğunca fazla arka plan transkripsiyon gürültüsünü (litik faj transkriptomu tarafından üretilen) sınırlamak için lizojenik hücrelerin serbest enfektif faj partiküllerine oranının en yüksek olduğu büyüme aşamasını belirlemek önemlidir.
- Her temporal numunedeki enfektif faj partiküllerini numaralandırmak için, 100 μL orta üstel faz indikatör konakçısı (OD600: 0.4-0.5; bu durumda, PAO1-Rif R) varlığında LB'de (üst agar) 5 mL steril %0.4 bakteriyolojik agar aşılayın (bu durumda, PAO1-RifR) uygun bir seçici ajan varlığında (bu durumda 50 μg·mL−1 rifampisin, PAO1 konağının MIC'si sadece 16 μg·mL−1; Malzeme Tablosuna bakınız, satır 8 ve satır 9)
- Aşılanmış üst agar tabakasına aynı seri seyreltmeden 10 μL (bkz. adım 2.2.2) yerleştirin ve 37 °C'de 18-24 saat inkübe etmeden önce kurumasını bekleyin.
- Enfektif faj partiküllerini hesaplamak için, kolayca sayılabilen plaklarla bir seyreltme bulun. Her noktadaki plak sayısını sayın.

- Daha sonraki deneysel adımlar için CFU (koloni oluşturma birimi) başına spontan indüksiyonun minimum olduğu süreyi/koşulu bulun.
3. RNA ekstraksiyonu için indüklenmemiş ve indüklenmiş lizojen kültürlerinin hazırlanması (Şekil 3)
- Tek bir lizojen kolonisini 5 mL LB içinde aşılayarak taze bir gece kültürü oluşturun ve 37 ° C'de 18-24 saat çalkalayarak (180 rpm) inkübe edin.
- Sekiz adet 250 mL'lik şişede 1:100 oranında 80 mL LB içinde gece kültürünü alt kültürleyin.
- İlk şişeyi "indüklenmemiş" ve diğerlerini "indüklenmiş" olarak etiketleyin ve her bir numunenin hasat edilmesi gereken zaman noktaları (yani, "indüklenmiş t = 0", "indüklenmiş t = 10 dk", "indüklenmiş t = 20 dk", vb.; Şekil 3).
- 90 dakikalık inkübasyondan sonra, OD600 0.1-0.2 arasında olduğunda veya minimal spontan indüksiyon sırasında (tartışmaya bakın), indüklenmemiş şişeye 4 μL %1 buzlu asetik asit (v/h) ekleyin (Şekil 3).
NOT: Bu çalışmada indükleyici ajan, çözücü olarak %1 buzlu asetik asit kullanılarak yapıldığından, kontrol adımı olarak tek başına aynı miktarda çözücü ilave edilmiştir. Farklı indükleyicilerin hazırlanmasına bağlı olarak alternatif kontroller düşünülebilir. - İndüklenmemiş şişeden 80 mL kültürü 720 mL steril LB'ye ekleyin ve hemen durdurma çözeltisini ekleyin (buz gibi soğuk% 5 [v / h] fenol, pH 4.3,% 95 [v / h] etanol) kültür hacminin% 20'si (160 mL) olan bir hacim kullanarak ve RNA transkriptlerini stabilize etmek için en az 30 dakika ve 2 saatten fazla olmamak üzere buz üzerinde inkübe edin12, 26,27. Bu, indüklenmemiş numunedir.
- Kalan kültürleri yedi adet 250 mL'lik şişede (Şekil 3) uygun bir indükleyici ajanın MIC ile indükleyin (bu durumda, 25 mg·mL−1 norfloksasin, %1 buzlu asetik asit [w/v] içinde hazırlanır, 1 μg·mL−1 nihai konsantrasyonda kullanılır), iyice karıştırın ve 37 °C'de ve 180 rpm'de 1 saat çalkalayarak inkübe edin.
NOT: Bu adım, lizojen kültürünü daha koordineli bir litik replikasyon durumuna zorlayacaktır. Kültürdeki çoğu hücre, enfektif faj parçacıklarının litik üretimine girmeye başlayacaktır. - İndüklenen şişeden 720 mL steril LB'ye 80 mL kültür ekleyerek hücrelerin iyileşmesine izin verin, bu da indükleyici ajanı etkili bir şekilde seyreltir. Adım 3.5'te belirtildiği gibi bir durdurma çözeltisi ekleyerek her bir şişeden her 10 dakikada bir 0 ila 1 saat arasında bakteri hücrelerini toplayın.
NOT: Durdurma çözeltisi, RNA'yı 2 saate kadar stabilize eder. Bununla birlikte, numune stabilitesini artırmak için sonraki tüm adımları 4 °C'de gerçekleştirin. - RNA bozulmasını önlemek için işlemden sonra 2 saati geçmeyecek şekilde, mümkün olan en kısa sürede 4 °C'de 15 dakika boyunca 10.000 x g'da santrifüjleme ile hasat edin.
- Süpernatanı atın ve her numuneyi 1,5 mL'lik bir mikrofüj tüpüne aktarmadan önce ayarlanabilir bir otomatik pipet kullanarak kalan sıvıdaki bakteri peletlerini nazikçe yeniden süspanse edin.
- Mikrofüj tüplerini yüksek hızda (13.000 x g) bir mikrofüjde 4 °C'de 1 dakika santrifüjleyin ve kalan süpernatanı atın.
- Her bir kapalı mikrofüj tüpünü sıvı nitrojene daldırarak peletleri hızlı dondurun. Bu, RNA ekstraksiyonu için hücrelerin verimli bir şekilde parçalanmasına yardımcı olacaktır.
- Her donmuş pelete TRIzol (1 mL) ekleyin ve süspansiyonu pipetleyerek homojenize edin (girdap yapmayın). Tüm numuneler için RNA ekstraksiyonu yapmaya hazır olana kadar −80 °C'de saklayın.
NOT: Protokol bu noktada duraklatılabilir. - 3.1–3.13 arasındaki adımları üç biyolojik kopya ile tekrarlayın.
4. İndüklenmemiş ve indüklenmiş lizojen kültürlerinden RNA'nın izolasyonu
KRİTİK : Tüm bu adımlar RNaz içermeyen bir ortamda gerçekleştirilmelidir28. Çalışma tezgahları %10 NaClO veya tescilli RNase inaktivatörleri ile silinmelidir. Laboratuar gereçleri, DEPC tedavisi gibi RNaz inhibitörleri ile muamele edilmeli ve tüm reaksiyonlarda nükleaz içermeyen su kullanılmalıdır.
- Adım 3.12'deki donmuş TRIzol ile muamele edilmiş peletleri buz üzerinde çözün ve 400 μL moleküler biyoloji sınıfı kloroform ekleyin.
- Tüm hücrelerin parçalanmasını tamamlamak için şişeleri 10 saniye ters çevirerek iyice çalkalayın (girdap yapmayın ). Daha sonra oda sıcaklığında (21 °C) 2-5 dakika inkübe edin.
- Sulu tabakayı, 15 dakika boyunca 4 ° C'de ve 13.000 x g'da soğutulmuş bir masa üstü mikrofüj kullanarak santrifüjleme yoluyla TRIzol/kloroform karışımından ayırın.
- Sulu fazı (~ 500 μL, üst katman) 1.000 μL'lik bir pipet kullanarak toplayın, ara fazı veya organik fazı (alt katman) bozmamaya dikkat edin. Yeni bir 1,5 mL mikrofüj tüpüne aktarın.
- Ayrılan sulu faza 450 μL moleküler biyoloji dereceli izopropanol ekleyin, ters çevirerek iyice karıştırın (girdap yapmayın ) ve oda sıcaklığında (21 °C) 30 dakika inkübe edin.
- RNA'yı 4 °C'de ve 13.000 x g'da 30 dakika boyunca soğutulmuş bir santrifüj kullanarak santrifüjleyerek geri kazanın.
- RNA peletini bozmadan süpernatanı atın ve peleti nükleaz içermeyen suyla hazırlanmış 800 μL %70 etanol ile iki kez yıkayın (yukarı ve aşağı pipetlemeyin). Her yıkamadan sonra santrifüj adımını 5 dakika tekrarlayarak RNA peletinin stabilitesini sağlayın.
- Etanolü atın ve peleti havayla kurutun.
NOT: 10 μL'lik bir mikro uç kullanarak peletin etrafındaki etanolü dikkatlice aspire edin ve tüpü temiz kurutma kağıdına ters çevirerek peleti kurutun. RNA peleti renksiz hale gelmeli ve kenarlar fırfırlı ve görünür görünmelidir. Çok az kurutma, sonraki prosesleri etkileyebilecek kalıntı etanol bırakabilir ve peletin çok fazla kurutulması, yeniden süspansiyonu zorlaştırabilir. - RNA'yı nükleaz içermeyen suda (50 μL) 65 °C'de aralıklı karıştırma ile bir termo-çalkalayıcı üzerinde (her 30 saniyede bir) toplam 3-5 dakika inkübe ederek yeniden süspanse edin.
KRİTİK : RNA'nın 2'- OH grubu, 65 °C'nin üzerindeki yüksek bir sıcaklıkta ve yüksek bir pH'da RNA ipliklerinin otobölünmesini katalize edebilir. 65 ° C'nin altındaki sıcaklıklar, artık DNA'nın yeniden süspansiyonunu geciktirir, böylece DNaz I sindirimi ile daha sonraki bir aşamada sindirilmesi gereken DNA miktarını sınırlar. Bu nedenle, sıcaklığı 65 °C'de tutmak, en iyi numuneleri elde etmek için çok önemlidir.
NOT: Protokol bu noktada duraklatılabilir ve numuneler −80 °C'de saklanabilir.
5. Kirletici DNA'nın DNaz tedavisi ile RNA'dan uzaklaştırılması
- Birinci iplikçik cDNA sentezinden önce kirletici DNA'yı toplam RNA'dan çıkarmak için, 10 μg toplam RNA'ya 0.1 hacim 10x DNaz tamponu ve 1 μL DNaz enzimi ekleyin. Tüpü yavaşça karıştırın ve 37 °C'de 30 dakika inkübe edin.
- DNaz inaktivasyon reaktifini yeniden süspanse edin ve toplam reaksiyon hacminin minimum 2 μL veya %10'luk bir hacmini ekleyin. İyice karıştırın ve DNase inaktivasyon reaktifinin yeniden dağılması sırasında numuneleri oda sıcaklığında (21 ° C) 5 dakika inkübe edin.
- DNase reaktiflerini 1.5 dakika boyunca 10.000 × g'da masa üstü bir mikrosantrifüj kullanarak santrifüjleme yoluyla peletleyin.
- RNA'yı içeren süpernatanı, peleti bozmadan taze bir tüpe aktarın.
NOT: Üreticinin talimatlarına göre 1 μL ölçekli UV spektrofotometresi ve mikroakışkan bazlı nükleik asit bilgisayar analizörü kullanarak RNA'nın kalitesini kontrol edin; saflaştırılmış toplam RNA −80 °C'de saklanabilir. qRT-PCR için, RNA doğrudan bu noktada kullanılabilir. Sıkı numune kalitesi gerektiren RNA dizilimi gibi daha hassas aşağı akış süreçleri için, daha fazla ilerlemek için ε2.0'ın A 260/230 oranına ulaşılmalıdır. - DNA'sız RNA çözeltisinin hacmini, nükleaz içermeyen su kullanarak 500 μL'ye yükseltin.
- 50 μL nükleaz içermeyen 3 M sodyum asetat (pH 5.3) ve 495 μL izopropanol ekleyin. İyice karıştırın ve oda sıcaklığında 30 dakika inkübe edin.
NOT: Bu adım RNA'yı çökeltecektir. - RNA'yı 13.000 x g ve 4 °C'de 30 dakika santrifüjleyerek geri kazanın.
- Tuzları tamamen çıkarmak için her yıkamadan sonra numuneleri 13.000 x g ve 4 °C'de 5 dakika santrifüjleyerek RNA peletini buz gibi %70 etanol ile üç kez yıkayın.
- Üreticinin talimatlarına göre 1 μL ölçekli UV spektrofotometresi ve mikroakışkan bazlı nükleik asit bilgisayar analizörü kullanarak RNA'nın kalitesini kontrol edin; saflaştırılmış toplam RNA −80 °C'de saklanabilir.
NOT: Kılavuz29 , RNA kalite standartlarını elde etmek için kullanılmıştır. A260/230 oranı <2,0 ise 5,5-5,9 arasındaki adımları tekrarlayın.
6. DNaz içermeyen RNA'nın kalitatif ve kantitatif analizi
- 1 μg toplam RNA ile 16S rRNA primerleri (Tablo 2) kullanarak kantitatif bir PCR gerçekleştirerek her numune için DNaz tedavisinin verimliliğini doğrulayın ve hiçbir amplifikasyon ürününün üretilmediğini onaylayın.
NOT: gDNA kontaminasyonunu değerlendirmek için ideal primerler, prokaryotlarda veya transkripsiyonel olarak aktif olmayan bölgelerde intron-ekzon bağlantılarında veya düzenleyici bölgelerde tavlamak üzere tasarlanmış primerler olacaktır30,31. - Üreticinin talimatlarına göre mikroakışkan bazlı bir nükleik asit bilgisayar analizörü kullanarak RNA bütünlük numarasını (RIN) belirleyin.
NOT: Birinci iplikçik sentezi için RIN ≥ 9 gösteren numuneler kullanılmalıdır. RIN < 9 gösteren numuneler atılmalı ve izolasyon adımları (1.1-5.4) tekrarlanmalıdır. - Üreticinin talimatlarına göre HS RNA test kiti ve bir florimetre kullanarak toplam RNA konsantrasyonunu ölçün.
7. Birinci iplikli cDNA sentezi
- 1 μg toplam RNA'yı 1 μL rastgele heksamerler (50 ng·μL−1) ve 1 μL 10 mM dNTP karışımı ile karıştırarak her numune için bir RNA primer karışımı hazırlayın. Ardından, nükleaz içermeyen su kullanarak toplam hacmi 10 μL'ye ayarlayın.
- Reaksiyonu 65 °C'de 5 dakika inkübe edin ve 1 dakika buz üzerine koyun.
- 2 μL 10x RT tamponu ekleyerek her numune için bir cDNA sentez karışımı hazırlayın; 4 μL 25 mM MgCl2; 2 μL 0,1 M DTT; 1 μL RNaz inhibitörü (40 U·μL−1); ve belirtilen sırayla 1 μL ters transkripsiyon reaktifi (200 U·μL−1).
- cDNA sentez karışımını RNA/primer karışımına ekleyin. Yavaşça karıştırın ve tüpün altındaki bileşenleri toplamak için numuneleri kısaca santrifüjleyin.
- Numuneleri 25 °C'de 10 dakika, ardından 50 °C'de 50 dakika inkübe ederek karışımı hazırlayın. 85 °C'de 5 dakika inkübe ederek reaksiyonları sonlandırın ve buz üzerinde soğutun.
- Her tüpe 1 μL RNase H ekleyin ve RNA'yı DNA:RNA hibridinden çıkarmak için 37 °C'de 20 dakika inkübe edin.
- Son olarak, cDNA sentez reaksiyonunu toplam 80 μL hacme seyreltin ve daha fazla kullanıma kadar −80 °C'de saklayın.
NOT: Protokol bu noktada duraklatılabilir.
8. Faj replikasyonunun farklı aşamalarını gösteren işaretleyici genlerin ekspresyon seviyelerini belirlemek için standart eğri ve kantitatif (q)-PCR
- İlgilenilen fajın replikasyonunun her aşaması için belirteç görevi görebilecek bir dizi hedef gen tanımlayın. Bizim durumumuzda, bunlar Tablo 2'de detaylandırıldığı gibiydi.
- İlgili primerleri kullanarak ve aşağıdaki amplifikasyon koşullarıyla PCR kullanarak şablon genomik DNA'dan hedef genlerin her birini amplifiye edin: 2 dakika boyunca 95 ° C'de ilk denatürasyon; 30 saniye boyunca 95 ° C'de denatürasyon; primerlere bağlı olarak optimum tavlama sıcaklığında (burada 58 °C kullanılmıştır) 30 s tavlama; 72°C'de 1 dakika uzatma; ve son uzatma 72 °C'de 5 dakika.
- Her amplikonu bir PCR saflaştırma kiti kullanarak saflaştırın ve bunları üreticinin talimatlarına göre bir TA klonlama vektöründe klonlayın. Klonlanan her ürünün sırasını Sanger dizilimi ile doğrulayın.
NOT: Protokol bu noktada duraklatılabilir. - Aşağıdaki denklem20'yi kullanarak tek tek plazmitler için kopya sayısını hesaplayın:
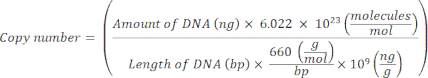
- Plazmit DNA'yı moleküler dereceli nükleaz içermeyen steril H 2 O içinde 109 kopya / μL'den 102 kopya / μL'ye seri olarak seyrelterek her bir işaretleyici gen için standart bir şablon hazırlayın.
- Tercih edilen qPCR sistemi için üreticinin talimatlarına göre, her numune için 1 μL cDNA (adım 7.7'den itibaren) ile kantitatif PCR'yi üç kopya halinde ilgili plazmid standartlarıyla birlikte üç kopya halinde gerçekleştirin; PCR'yi her hedef için 96 oyuklu bir plakada gerçekleştirin.
- Log DNA kopya numarasını (x ekseni) döngü eşiğine (y ekseni, Ct) göre çizin ve belirleme katsayısını (R 2) ve doğrusal bir denklemi görüntülemek üzere doğrusal bir regresyon hesaplaması gerçekleştirmek için Excel veya R gibi uygun bir platform kullanın.
NOT: Belirleme katsayısı 0,98'in üzerinde olmalıdır. - Doğrusal regresyondan (adım 8.7) türetilen doğrusal denklemi (y = mx + b) kullanarak her hedef için kopya sayısını tahmin edin, burada y tahmini Ct'dir; x , günlük DNA kopya numarasıdır; m , DNA kopya sayısına göre Ct'deki değişimi tanımlayan çizginin eğimidir; ve b , bir DNA kopyası32 için tahmini Ct'yi temsil eden y ekseni kesişimidir.
- Her bir işaretleyici gen için, standart eğrinin doğrusal regresyonundan elde edilen parametreleri ve aşağıdaki denklemi kullanarak PCR amplifikasyonunun (E) verimliliğini hesaplayın, burada m , adım 8.7 ve adım 8.8'den türetilen eğimdir:
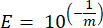
- Aşağıdaki denklemi kullanarak tüm primerleri verimlilik yüzdeleri açısından doğrulayın:
NOT: Verimlilik %90-%110 aralığında olmalıdır.
- Aşağıdaki formülü kullanarak DNA'nın mutlak kopya sayısını hesaplayın:
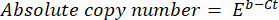
burada Ct (adım 8.8) döngü eşiği, b kesişme noktası (adım 8.8), m eğim (adım 8.8) ve E PCR amplifikasyonunun verimliliğidir (adım 8.9).
KRİTİK : İki veya daha fazla hedefin amplifikasyonunu q-PCR ile karşılaştırırken, mutlak DNA kopya sayılarını karşılaştırmak için her hedef için PCR etkinliği hesaplanmalıdır. - Bu çalışmada genel internal kontrol olarak 16S rRNA, proC ve rpoD genleri, indüksiyon kontrolü olarak gyrB kullanılmıştır33,34,35.
NOT: RNA sıralama verilerinden dahili kontroller seçerken, test edilen koşullar için ifade seviyelerinde değişmeyen dahili kontrollerin seçilmesi en iyisidir. Sonuçların anlamlı bir şekilde yorumlanması için uygun kontrollerin dikkatli bir şekilde değerlendirilmesi her zaman önemlidir.
Sonuçlar
Bu çalışmada, spontan LESΦ2 indüksiyonunun etkisini belirlemek için, indükleyici olmayan koşullar altında yetiştirilen bir PAO1 LESΦ2 lizojen kültüründen faj üretiminin doğrudan zamansal sayımı kullanıldı. Faj yoğunluğu, büyümenin erken üstel fazı sırasında taze ortamda alt kültürden sonra ortalama ~2.61 x 106 plak oluşturan birim (PFU) · mL−1 2 saat ile en düşük noktasındaydı, bu da lizojeninin baskın durum olduğunu düşündürdü. LESΦ2 titresi 4 saat içinde hızla ~2.4 x 108 PFU·mL−1 ortalamasına yükseldi ve 6 saat sonra en yüksek yoğunluğa ulaştı (ortalama ~5.83 x 109 PFU·mL−1; Şekil 4).
Lizojen büyümesinin erken log fazında (2 saat sonra) minimal spontan indüksiyon gözlendi. Bununla birlikte, kültür ortamındaki fajların ölçülebilir varlığı, aşağıdakiler de dahil olmak üzere birçok önceki olayın sonucuydu: nükleik asitlerin protein kafalarına paketlenmesi, proteinlerin faj parçacıklarına birleştirilmesi ve geç faj genlerinin ekspresyonu, orta evre faj genleri ve erken düzenleyici faj genleri. Fajla ilişkili replikasyon olaylarının ekspresyonundan önce enfekte olmuş hücreleri yakalamak önemliydi; Bu nedenle, indüksiyondan önce kültürün büyümesine izin vermek için 90 dakika seçildi. PAO1'in gen ekspresyon profilini yakalamak için, bir kültürden LESΦ2 lizojen örnekleri, adım 3.4'te belirtildiği gibi, 90 dakikalık bir süre boyunca indüksiyon öncesi ve indüksiyon sonrası hasat edildi. Bu 90 dakikalık zaman noktası, 2.3.2 adımındaki plak tahlili ile yerleşik kehanetin yüksek seviyelerde spontan indüksiyonunun tespit edilmesinden çok öncedir. Erken üstel büyüme sırasında bakteri hücre yoğunluğu düşük olduğundan, gen ekspresyonu çalışmaları için yeterli materyal sağlamak için kültür hacimleri 800 mL'ye kadar ölçeklendirildi. Örnekler, indüklenmemiş kültürden ve indüklenmiş kültürlerden her 10 dakikada bir toplandı ve bakteri büyümesi sırasında lizojeni ve litik replikasyon için anahtar belirteçlerin ekspresyon profilini haritalamak için RNA ekstrakte edildi. Toplam RNA, 16S rRNA genini hedefleyen qPCR testleri kullanılarak genomik DNA'nın yokluğu için saflaştırıldı ve doğrulandı (adım 6.1). RIN ≥ 9'a ulaşan numuneler kalite kontrolünden geçti ve cDNA'ya dönüştürüldü.
Açıklamalı LESΦ2 genomu, ılıman fajların lizojenik ve litik replikasyon döngülerinde iyi bilinen oyuncular olan genleri tanımlamak için incelendi. Bu tanımlanan genler daha sonra, indüklenmiş ve indüklenmemiş kültürlerden lizojen döngüsü kısıtlı ve litik döngü ile ilişkili genlerin ekspresyon profili için qRT-PCR'yi doğrulamak için kullanıldı. Mutlak DNA kopya sayısını ölçtük ve indüklenmemiş ve indüklenmiş kültürlerdeki ekspresyon seviyelerini karşılaştırmak için R36 kullanarak bir Wilcoxon işaretli sıra testi gerçekleştirdik (Şekil 5). İndüklenmemiş kültürlerde ~ 2.31 x 109 kopyadan indüksiyondan 30 dakika sonra ~ 3.02 x 1011 kopyaya kadar cro geninin ekspresyonunda (litik replikasyonun erken bir belirteci) belirgin bir artış gözlendi (Wilcoxon işaretli sıra testi: p < 0.01) gözlendi. Benzer şekilde, litik replikasyonun orta aşama belirteçleri olan (ve faj genom replikasyonunda yer aldığı tahmin edilen) O proteinleri ve P proteinleri de ~1.74 x 108'den ~1.25 x 10 10 kopyaya (Wilcoxon işaretli sıra testi: p < 0.01) ve ~ 6.05 x 102'den ~5.68 x10 5 kopyaya (Wilcoxon imzalı sıra testi: p < 0.01), sırasıyla. Son olarak, kuyrukla ilişkili yapısal genler, litik replikasyon döngüsünün geç belirteçleri olarak kullanıldı. Yine, indüklenmemiş kültürlerde ~2.31 x 106 kopyadan indüksiyondan 30 dakika sonra ~4.38 x 108 kopyaya ekspresyonda önemli bir artış gözlemledik (Wilcoxon işaretli sıra testi: p < 0.01). Bu nedenle, kantitatif RT-PCR verileri, litik replikasyon için iyi kurulmuş belirteç genlerinin gen ekspresyonunun beklenen eğilimi takip ettiğini ve erken, orta ve geç belirteçlerin tahmin edilen sırayla çok katlı diferansiyel ekspresyon gösterdiğini doğruladı (Şekil 5). Litik replikasyon belirteçlerinin ekspresyonu iyileşmeden 30 dakika sonra yukarı regüle edildiğinden, bu, litik döngü sırasında aktif ılıman fajların ve bakteri konakçılarının transkriptomik manzarasını incelemek için uygun bir temsili zaman noktası olarak kabul edilir.
İndüklenmemiş koşullarda litik genlerin bir miktar ekspresyonunu gözlemledik, bu da lizojen sayılarının erken log fazında salınan PFU'ya en yüksek CFU oranıyla temsil edildiği optimize edilmiş kültürlerde bile her zaman bazı spontan indüksiyonların meydana geldiğini doğruladı. Bu, transkriptomik verilerde her zaman bir miktar "gürültü" olacağı anlamına gelir, bu da indüklenmiş ve indüklenmemiş kültürler de dahil olmak üzere dikkatlice hazırlanmış kontrollerin önemini pekiştirir. Ekspresyondaki kıvrım değişikliklerini belirlemek için iç kontrol genlerinin uygun seçimi, hem indüklenmemiş hem de indüklenmiş örneklerde aynı seviyede eksprese edilen genleri tanımlamak için transkriptomik verilerin dikkatlice incelenmesine dayanır. Ön sonuçlarımız, rpoD'nin test edilen en güvenilir kontrol geni olduğunu ve en kararlı ekspresyona sahip olduğunu göstermektedir (indüksiyondan önce ~ 1.71 x 10 5 kopya ve indüksiyondan 30 dakika sonra ~ 3.33 x 105 kopya; Wilcoxon işaretli sıra testi: p = 0.3594) 16S rRNA veya proC genleri ile karşılaştırılmıştır (Şekil 5). İç kontrollerin ifadesinin değişkenliği, mutlak transkript sayılarının ölçülmesine yol açmıştır. Transkriptomik verilerin gelecekte incelenmesi, daha fazla doğrulama için uygun iç kontrollerin seçimini destekleyecektir.
cI geni, lizojeninin iyi bilinen bir belirteci olduğu için gen profilleme egzersizimizde kullanılmıştır. Litik replikasyon belirteçleri ile karşılaştırıldığında, cI geninin ekspresyonu nispeten kararlıydı (Şekil 5), ancak bu genin kopya sayısı, indüklenmemiş kültürlerde litik replikasyon belirteçlerine kıyasla güven verici derecede yüksekti. Bu veriler, aynı örneklerdeki düşük PFU sayıları ile uyumludur, bu nedenle yüksek baskılayıcı ekspresyonunun daha düşük faj üretimi seviyeleri ile ilişkili olduğunu doğrulamaktadır. Burada bildirilen veriler, bu özel faj için cI transkriptinin ekspresyonunun, Stx fajlarında görüldüğü gibi, indüksiyon sonrası önemli ölçüde aşağı regüle edilmediğini göstermektedir11,17. Baskılayıcı aktivitesi normalde hem transkripsiyonel hem de translasyon sonrası seviyelerde kontrol edilir, bu nedenle baskılayıcı gen kopyalanabilir, ancak ortaya çıkan protein hemen otobölünmeye tabi tutulur. Transkripsiyonel ve translasyon sonrası kontrolleri doğrulamak için daha fazla deney gereklidir. Ayrıca, standart eğrimizden, qPCR'nin minimum tespit limiti ~102 kopya gibi görünmektedir.
Plak ve qRT-PCR testlerinden elde ettiğimiz bulgular birlikte, RNA-Seq deneyleri için iyi kontrol edilen bir girdi oluşturmak için kültür ve RNA numunesi hazırlama stratejimizi doğrulamaktadır. Erken üstel fazdaki indüklenmemiş kültürler, düşük seviyelerde spontan indüksiyon ve litik gen ekspresyonu sergiledi, bu da lizojeninin baskınlığını düşündürdü. Buna karşılık, indüksiyondan 30 dakika sonra izole edilen kültürler, litik replikasyonun baskınlığını gösteren işaretleyici genlerin ekspresyonunda önemli artışlar gösterdi.
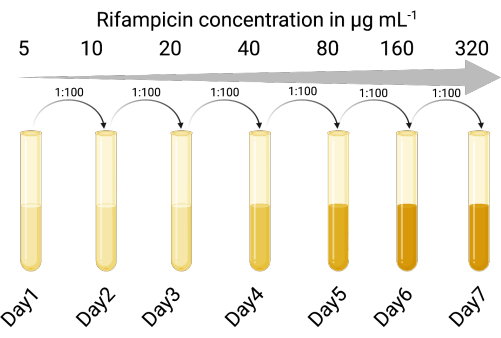
Şekil 1: Rifampisine dirençli gösterge ana bilgisayarını oluşturma protokolü (BioRender.com ile oluşturuldu). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Aynı numuneden bir lizojenin PFU ve CFU'sunu numaralandırmak için deneysel tasarım. (BioRender.com ile oluşturuldu) Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
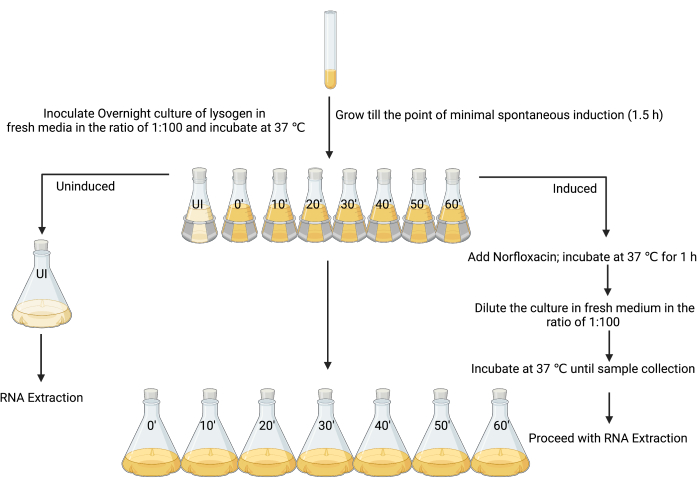
Şekil 3: RNA izolasyonu için indüklenmiş ve indüklenmemiş kültürlerden numune almak için deneysel tasarım. (BioRender.com ile oluşturuldu) Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
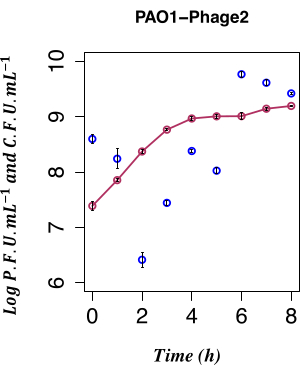
Şekil 4: Spontan indüksiyonun zamansal numaralandırılması. Eşzamanlı CFU ile PAO1 Φ2 lizojenden PFU kullanılarak spontan LES kehanet üretiminin zamansal sayımı, n = 8 (iki biyolojik ve dört teknik kopya); Hata çubukları standart sapmayı temsil eder. Koyu kırmızı noktalar LB'deki CFU·mL−1'i gösterir; koyu mavi noktalar LB cinsinden PFU·mL−1'i gösterir. Lizojenler tarafından φ2 enfektif fajın spontan salınımı, aşılamadan 2 saat sonra ölçülebilir en düşük seviyededir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Hedef belirteç genlerinin mutlak kopya sayısı. Faj işaretleyici genlerinin mutlak kopya sayısı, lizojeni ve litik döngülerde önemli roller oynaması beklenen genlerin RT-qPCR kullanılarak türetilen tahmin edilen ekspresyon modellerini doğrular. Noktalar hem üç biyolojik hem de üç teknik kopyayı temsil eder (n = 9). (Bir) Kırmızı kutu, lizojeni belirteci cI'yi temsil eder; (B) yeşil, erken litik işaretleyici cro'yu temsil eder; (C,D) mavi, orta litik belirteçleri, DNA replikasyon genlerini temsil eder; (E) macenta, geç litik markörü, kuyruk yapısal genlerini temsil eder; (F-H) gri, dahili kontrol olarak kullanılan konakçı belirteçlerini temsil eder ve (I) beyaz, indüksiyon kontrolü olarak kullanılan DNA giraz B'yi temsil eder. Düz yatay çizgiler dağılımın medyanını gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tablo 1: Bu çalışmada tasarlanan primerler. Bu çalışmada kullanılan marker genler ve iç kontroller için spesifik primerlerin dizileri, karşılık gelen NCBI erişim kimlikleri ile birlikte sağlanmıştır. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 2: Bu çalışmada kullanılan primerlerin etkinliği qPCR standart eğrisi kullanılarak hesaplanmıştır. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tartışmalar
E. coli MC106137,38,39'dan Stx fajının spontan indüksiyonunu daha doğru bir şekilde ölçmek için daha önce plak tahlillerinde kullanılan seçilebilir bir gösterge konağın oluşturulması, burada P. aeruginosa faj LESΦ2 için açıklanmıştır. Bu müdahale, numune işleme adımlarını ve süresini azaltma, böylece çoklu kültür koşullarında spontan indüksiyon oranlarının eşzamanlı olarak değerlendirilmesini sağlama avantajına sahiptir. Rifampisine dirençli varyantların(40) oluşturulması sırasında başka mutasyonlar üretme riski vardır; Bununla birlikte, bu çalışmada, evrimleşmiş suş yalnızca ilgilenilen kültürlerden alınan plakların sayımı için bir gösterge konakçı olarak kullanıldı ve transkriptomik analize dahil edilmedi. Seçilebilir indikatör suş, ilgilenilen faj tarafından enfeksiyona eşit derecede duyarlı kaldığı sürece, diğer edinilmiş mutasyonlar hakkında endişe yoktur. Bununla birlikte, PAO1WT ve PAO1RIF'in nabız alanı jel elektroforezi (PFGE) analizi ile kısıtlama fragmanı uzunluk polimorfizm profillerinde herhangi bir fark tespit edilmemiştir (veriler gösterilmemiştir).
Konakçı hücreleri seçerken, halihazırda kehanetleri barındırmayan bir gösterge suşu bulmak nadirdir. Bir örnek olarak, PAO1, ipliksi kehanet Pf4'ü barındırır. Bu çalışma için deneysel kontroller, spesifik fajların gen ekspresyonunu (bu durumda, LES prophage 2) ve bu fajın bakteriyel gen ekspresyonu üzerindeki etkilerini doğrudan inceleyebilmek için tasarlanmıştır. PAO1'den alınan transkriptlerin karşılaştırılmasında, LES kehaneti 2'yi taşıyan ve LES kehaneti 2'den yoksun (hem lizojen hem de lizojen olmayan, endojen Pf4'ü taşır), Pf4'ün konakçı üzerindeki etkisini dışlamak için dahili kontroller görevi görür. Ek olarak, Pf4'ün genellikle konakçı hücresinde41 lizise neden olmadığı ve bu nedenle bu deneylerin sonuçlarını karıştıramadığı gösterilmiştir.
Anlamlı omik veriler üretmek için numune hazırlamada dikkatli kalite kontrolünün çok önemli olduğu iyi bilinmektedir42. Bununla birlikte, daha önce tarif edildiği gibi,11, bu tür çalışmalar için lizojen kültürlerinin hazırlanmasında kehanet aktivitesinin dikkatli karakterizasyonu nadiren gerçekleştirilir. Burada, bakteriler ve ılıman fajlar arasındaki etkileşimleri daha iyi keşfetmek için transkriptomik çalışmalar için iyi kontrol edilen ve optimize edilmiş bir kültür seti hazırlamaya yönelik sistematik protokollerimizi detaylandırıyoruz. Popülasyonun eşzamanlılığı, indükleyici antibiyotik norfloksasin ile tedavi edilmeden önce kültürün en az dört katına çıkarılmasıyla kontrol edildi. Çalışmadaki suş için norfloksasin MİK'sini belirleyerek, indükleyici ajanın konsantrasyonunun "indüksiyon" tedavisi için MİK'nin hemen üzerinde olmasını sağlayabiliriz. Tedavi edilen hücreler daha sonra, hücrelerin faj replikasyon sürecini iyileştirmesine ve tamamlamasına izin vermek için 1 saatlik tedaviden sonra norfloksasin konsantrasyonunu MIC'nin altına düşürmek için 1:10 oranında seyreltildi, bu da hücrenin parçalanması ve enfektif faj soyunun serbest bırakılmasıyla sonuçlandı. Hücreler, indüksiyon uyaranını takiben litik replikasyon döngüsüne ancak iyileşme süresi boyunca norfloksasin konsantrasyonu MIC'nin altına getirildikten sonra girer. Bu durumda, 1 μg·mL−1 norfloksasinin üzerine çıkmak, PAO1 için norfloksasin için MIC 0.19 μg·mL−1 olduğundan, ilacın MIC'nin altında etkili bir şekilde seyreltilemeyeceği anlamına gelir. İndükleyici seyreltme seviyesi, lizojen geri kazanımı ihtiyacı ve RNA'nın toplanması için kültür yoğunluğunun korunması ile dengelenmelidir. Burada tartışılan veriler, lizojeninin baskın olduğu örnekler oluşturmak için kültürleri senkronize etmenin mümkün olduğunu, böylece spontan indüksiyondan kaynaklanan gürültüyü azaltmanın ve gen ekspresyonunda gerçek lizojeni kaynaklı değişikliklerin saptanmasını sağlamanın mümkün olduğunu göstermektedir. Lizojenik durum, bakteri hücre yoğunluğu düşük olduğunda büyümenin erken üstel fazında baskın olduğundan, RNA-Seq gibi sonraki gen ekspresyonu çalışmaları için yeterli RNA'yı toplamak için kültürlerin ölçeklendirilmesini öneriyoruz.
Kültürleri litik döngüye zorlamak için indükleyici bir ajan olarak norfloksasin kullanımı iyi bildirilmiştir43,44; Bununla birlikte, bu aynı zamanda süreçteki diğer bakteri genlerinin ekspresyonunu da etkileyecektir45,46. Bunu hafifletmek için, aynı indükleyici ve indükleyici olmayan koşullar altında yetiştirilen kontrol yabani tip kültürlerden elde edilen RNA kütüphaneleri, RNA-Seq deneylerine dahil edilmelidir. qRT-PCR ile faj replikasyonunun aşamalarını doğrulamak için dahili kontrollerin ve anahtar işaretleyici genlerin kullanılması da doğru karşılaştırmalar için çok önemlidir. Kantitatif RT-PCR profillemesi, çeşitli zaman noktalarında her gen için mutlak transkript sayılarının karşılaştırılmasıyla yorumlanamaz; Önemli olan profilin şeklidir. İlk olarak, herhangi bir gen için transkriptte sadece küçük bir bölge örneklenmiştir, bu nedenle kısa ömürlü mü yoksa daha uzun ömürlü bir element mi olduğu bilinmemektedir27. Kesinlikle, transkriptlerin RNA-Seq haritalaması, haritalama verilerinin yoğunluğunun bir genin uzunluğu boyunca önemli ölçüde değiştiğini göstermektedir. İkincisi, litik döngü veya lizojenik yaşam tarzı ile ilişkili veya hatta faj düzenleyici devrelerden ayrılmış bir belirteç gen için yorumlanması gereken gen ekspresyon profilinin şeklidir11. Spontan indüksiyon, lizojen kültüründe gerçek bir sorundur ve her zaman litik döngü ile ilişkili genlerin ekspresyonu ile sonuçlanacaktır. Bununla birlikte, profilleme, litik replikasyon döngüsü ile ilişkili genlerin, indüksiyon öncesi (en az iki log kıvrımı) ve indüksiyon sonrası yukarı regüle edilmelerinde bastırıldığını göstermektedir.
E. coli ile Stx faj etkileşimlerinin daha önce yapılan transkriptomik analizleri, lizojeninin korunmasında ve litik siklusun11,17 tetiklenmesinde rol oynayan faj genlerinin tam olarak anlaşılmasını desteklemektedir. Şu anda, P. aeruginosa'nın LES fajları açıklanmıştır, ancak anahtar gen işlevleri daha az anlaşılmıştır. Transkriptomik çalışmalar, LES kehanetlerinin yeniden açıklanmasını sağlayacak ve lizojeni ve litik döngüde yer alan genler hakkındaki anlayışımızı geliştirecektir. Gen dizisini işleve bağlamak, yeni kehanetlerin incelenmesinde büyük bir zorluğu temsil eder ve bu da daha iyi açıklama araçlarının üretimi için faj gen işlevlerini doğrulamak için daha fazla çalışmaya duyulan ihtiyacı daha da vurgular47. Bu video makalesinde ayrıntıları verilen protokollerin ve ekstra kalite kontrol önlemlerinin daha geniş bir şekilde uygulanması ve uyarlanması, çeşitli kehanet işlevlerinin ortaya çıkarılmasına ve böylece açıklama boru hatlarının iyileştirilmesine ve faj ve bakteri biyolojisi anlayışımızın dönüştürülmesine yardımcı olabilir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| PAO1 | 6 | ||
| LESB58 | 6 | ||
| LES phages | Induced and purified from LESB58 using Norfloxacin. | This study | |
| Lysogeny Broth (LB) | Merck | 1.10285.500 | |
| LB Agar | Merck | 1.10283.500 | |
| Agar Agar | Fisher | A/1080/53 | |
| Top Agar | 0.4 g Agar Agar+2.5 g LB Broth in 100 mL water; autoclave and use. | - | |
| Rifampicin | Sigma (Stock: 50 mg/mL in Methanol- Mix well and use 0.22µm filter to sterilize and store it in -20°C until use) | R3501 | |
| Glacial Acetic Acid | Fisher 1% (v/v) in water | 10060000 | |
| Norfloxacin | Sigma (Stock: 25 mg/mL of 1% Glacial Acetic Acid-Mix well and use 0.22µm filter to sterilize and store it in -20°C until use;To avoid freeze thaw cycles, store as small aliquotes) | N9890 | |
| Phenol saturated with citrate buffer pH 4.3 | Sigma | P-4682 | |
| Molecular Biology grade Ethanol | Fisher | 16695992 | |
| TRIzol | Invitrogen | 12044977 | |
| Chloroform | Fisher | 11398187 | |
| Isopropanol | Fisher | 17150576 | |
| Nuclease-free H2O | Invitrogen | 10526945 | |
| 10X TURBO DNase | Ambion | AM1907 | |
| Qubit RNA HS, BR Kit | Invitrogen | Q10210 | |
| Agilent RNA 6000 Nano Kit | Agilent | 5067-1511 | |
| SuperScriptIII first strand synthesis kit | Invitrogen | 18080051 | |
| PCR Reagents | Bioline Mytaq Red 2X | BIO-25043 | |
| qPCR Reagents | Sensifast SYBR Hi Rox | BIO-92020 | |
| PCR purification kit | Isolate II PCR and Gel Kit | BIO-52060 | |
| TA cloning kit | TA Cloning Kit, with pCR 2.1 Vector, without competent cells | K202040 | |
| StepOne Real Time PCR system | Thermo Fisher Scientific | 4376600 |
Referanslar
- Lin, D. M., Koskella, B., Lin, H. C. Phage therapy: An alternative to antibiotics in the age of multi-drug resistance. World Journal of Gastrointestinal Pharmacology and Therapeutics. 8 (3), 162-173 (2017).
- Jiang, W., Marraffini, L. A. CRISPR-Cas: New tools for genetic manipulations from bacterial immunity systems. Annual Review of Microbiology. 69 (1), 209-228 (2015).
- Santos, S. B., Azeredo, J. Bacteriophage-based biotechnological applications. Viruses. 11 (8), 737 (2019).
- Rodríguez-Rubio, L., Jofre, J., Muniesa, M. Is genetic mobilization considered when using bacteriophages in antimicrobial therapy. Antibiotics. 6 (4), 32 (2017).
- Hatfull, G. F. Dark Matter of the biosphere: The amazing world of bacteriophage diversity. Journal of Virology. 89 (16), 8107-8110 (2015).
- Yukgehnaish, K., et al. PhageLeads: Rapid assessment of phage therapeutic suitability using an ensemble Machine Learning approach. Viruses. 14 (2), 342 (2022).
- Seemann, T. Prokka: Rapid prokaryotic genome annotation. Bioinformatics. 30 (14), 2068-2069 (2014).
- Arndt, D., et al. PHASTER: A better, faster version of the PHAST phage search tool. Nucleic Acids Research. 44, W16-W21 (2016).
- Banerjee, S., et al. FINDER: An automated software package to annotate eukaryotic genes from RNA-Seq data and associated protein sequences. BMC Bioinformatics. 22 (1), 205 (2021).
- Jumper, J., et al. Highly accurate protein structure prediction with AlphaFold. Nature. 596 (7873), 583-589 (2021).
- Veses-Garcia, M., et al. Transcriptomic analysis of Shiga-toxigenic bacteriophage carriage reveals a profound regulatory effect on acid resistance in Escherichia coli. Applied and Environmental Microbiology. 81 (23), 8118-8125 (2015).
- Owen, S. V., et al. A window into lysogeny: revealing temperate phage biology with transcriptomics. Microbial Genomics. 6 (2), e000330 (2020).
- Davies, E. V., Winstanley, C., Fothergill, J. L., James, C. E. The role of temperate bacteriophages in bacterial infection. FEMS Microbiology Letters. 363 (5), 015 (2016).
- Livny, J., Friedman, D. I. Characterizing spontaneous induction of Stx encoding phages using a selectable reporter system. Molecular Microbiology. 51 (6), 1691-1704 (2004).
- Fogg, P. C. M., et al. Identification of multiple integration sites for Stx-phage Φ24B in the Escherichia coli genome, description of a novel integrase and evidence for a functional anti-repressor. Microbiology. 153 (12), 4098-4110 (2007).
- James, C. E., et al. Differential infection properties of three inducible prophages from an epidemic strain of Pseudomonas aeruginosa. BMC Microbiology. 12, 216 (2012).
- Riley, L. M., et al. Identification of genes expressed in cultures of E. coli lysogens carrying the Shiga toxin-encoding prophage Φ24B. BMC Microbiology. 12 (1), 42 (2012).
- Stover, C. K., et al. Complete genome sequence of Pseudomonas aeruginosa PAO1, an opportunistic pathogen. Nature. 406 (6799), 959-964 (2000).
- Winstanley, C., et al. Newly introduced genomic prophage islands are critical determinants of in vivo competitiveness in the Liverpool Epidemic Strain of Pseudomonas aeruginosa. Genome Research. 19 (1), 12-23 (2009).
- Davies, E. V., et al. Temperate phages enhance pathogen fitness in chronic lung infection. The ISME Journal. 10 (10), 2553-2555 (2016).
- Allison, H. E. Stx-phages: drivers and mediators of the evolution of STEC and STEC-like pathogens. Future Microbiology. 2 (2), 165-174 (2007).
- Allison, H. E., et al. Immunity profiles of wild-type and recombinant Shiga-like toxin-encoding bacteriophages and characterization of novel double lysogens. Infection and Immunity. 71 (6), 3409-3418 (2003).
- Mori, N., et al. A peptide based on homologous sequences of the β-barrel assembly machinery component BamD potentiates antibiotic susceptibility of Pseudomonas aeruginosa. Journal of Antimicrobial Chemotherapy. 67 (9), 2173-2181 (2012).
- Chojnacki, M., et al. A novel, broad-spectrum antimicrobial combination for the treatment of Pseudomonas aeruginosa corneal infections. Antimicrobial Agents and Chemotherapy. 63 (10), e00777 (2019).
- Miles, A. A., Misra, S. S., Irwin, J. O. The estimation of the bactericidal power of the blood. Epidemiology & Infection. 38 (6), 732-749 (1938).
- Srikumar, S., et al. RNA-seq brings new insights to the intra-macrophage transcriptome of Salmonella Typhimurium. PLoS Pathogens. 11 (11), e1005262 (2015).
- Kröger, C., et al. The transcriptional landscape and small RNAs of Salmonella enterica serovar Typhimurium. Proceedings of the National Academy of Sciences of the United States of America. 109 (20), E1277-E1286 (2012).
- Green, M. R., Sambrook, J. How to win the battle with RNase. Cold Spring Harbor Protocols. (2), (2019).
- A practical guide to analyzing nucleic acid concentration and purity with microvolume spectrophotometers. New England BioLabs Inc Available from: https://www.neb.com/-/media/nebus/files/application-notes/technote_mvs_analysis_of_nucleic_acid_concentration_and_purity.pdf?rev=c24cea043416420d84fb6bf7b554dbbb (2019)
- Saunders, N. A., Lee, M. A. . Real-Time PCR: Advanced Technologies and Applications. , (2013).
- Bustin, S. A. . A-Z of Quantitative PCR. , (2004).
- Ruijter, J. M., et al. Efficiency correction is required for accurate quantitative PCR analysis and reporting. Clinical Chemistry. 67 (6), 829-842 (2021).
- Fothergill, J. L., Neill, D. R., Loman, N., Winstanley, C., Kadioglu, A. Pseudomonas aeruginosa adaptation in the nasopharyngeal reservoir leads to migration and persistence in the lungs. Nature Communications. 5 (1), 4780 (2014).
- Huang, J., et al. Temperature-dependent expression of phzM and its regulatory genes lasI and ptsP in rhizosphere isolate Pseudomonas sp. strain M18. Applied and Environmental Microbiology. 75 (20), 6568-6580 (2009).
- Savli, H., et al. Expression stability of six housekeeping genes: a proposal for resistance gene quantification studies of Pseudomonas aeruginosa by real-time quantitative RT-PCR. Journal of Medical Microbiology. 52 (5), 403-408 (2003).
- . rstatix: Pipe-Friendly Framework for Basic Statistical Tests Available from: https://CRAN.R-project.org/package=rstatix (2022)
- McDonald, J. E., et al. High-throughput method for rapid induction of prophages from lysogens and its application in the study of Shiga toxin-encoding Escherichia coli strains. Applied and Environmental Microbiology. 76 (7), 2360-2365 (2010).
- Smith, D. L., et al. Short-tailed Stx phages exploit the conserved YaeT protein to disseminate Shiga toxin genes among Enterobacteria. Journal of Bacteriology. 189 (20), 7223-7233 (2007).
- James, C. E., et al. Lytic and lysogenic infection of diverse Escherichia coli and Shigella strains with a verocytotoxigenic bacteriophage. Applied and Environmental Microbiology. 67 (9), 4335-4337 (2001).
- Rees, V. E., et al. Characterization of hypermutator Pseudomonas aeruginosa isolates from patients with cystic fibrosis in Australia. Antimicrobial Agents and Chemotherapy. 63 (4), e02538 (2019).
- Li, Y., et al. Excisionase in Pf filamentous prophage controls lysis-lysogeny decision-making in Pseudomonas aeruginosa. Molecular Microbiology. 111 (2), 495-513 (2019).
- Van Kampen, A. H. C., Moerland, P. D. Taking bioinformatics to systems medicine. Systems Medicine. 1386, 17-41 (2016).
- Matsushiro, A., Sato, K., Miyamoto, H., Yamamura, T., Honda, T. Induction of prophages of enterohemorrhagic Escherichia coli O157:H7 with norfloxacin. Journal of Bacteriology. 181 (7), 2257-2260 (1999).
- James, C. E., et al. Lytic activity by temperate phages of Pseudomonas aeruginosa in long-term cystic fibrosis chronic lung infections. The ISME Journal. 9 (6), 1391-1398 (2015).
- Shaw, K. J., et al. Comparison of the changes in global gene expression of Escherichia coli induced by four bactericidal agents. Microbial Physiology. 5 (2), 105-122 (2003).
- Long, H., et al. Antibiotic treatment enhances the genome-wide mutation rate of target cells. Proceedings of the National Academy of Sciences of the United States of America. 113 (18), E2498-E2505 (2016).
- González-Tortuero, E., et al. VIGA: A sensitive, precise and automatic de novo VIral Genome Annotator. bioRxiv. , (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır