Method Article
Понимание влияния умеренных бактериофагов на их лизогены с помощью транскриптомики
В этой статье
Резюме
Этот протокол позволяет выявить влияние профагов на их хозяев. Бактериальные культуры синхронизируются с использованием условий, которые наилучшим образом поддерживают лизогенное состояние, ограничивая спонтанную индукцию. ОТ-кПЦР однозначно отличает гены, ограниченные профагами, и гены, не связанные с контролем фагов, от генов, экспрессируемых во время цикла литической репликации.
Аннотация
Фаги умеренного пояса интегрированы в качестве профагов в большинство бактериальных геномов. Некоторые профаги являются криптическими и фиксируются в бактериальной хромосоме, но другие активны и могут быть запущены в репликативную форму либо спонтанно, либо под воздействием индуцирующих факторов. Профаги обычно ассоциируются со способностью придавать клетке-хозяину продукцию токсина или другие признаки, связанные с вирулентностью. Более поздние исследования показали, что они могут играть гораздо большую роль в изменении физиологии своих хозяев. Описанная здесь методика позволила нам исследовать, как профаги влияют на экспрессию генов у условно-патогенной бактерии Pseudomonas aeruginosa.
В этой работе сравнивали рост штамма P. aeruginosa дикого типа PAO1 с ростом изогенных лизогенов, несущих различные комбинации профагов из Ливерпульского эпидемического штамма (LES) LESB58. В культуре лизогена часть бактериальных клеток будет поддерживать репликацию литического бактериофага (спонтанную индукцию) с высоким уровнем экспрессии на клетку поздних фаговых генов, например, связанных со сборкой фаговых частиц, тем самым маскируя низкоуровневую экспрессию генов, связанную с экспрессией генов, ограниченных лизогеном. Таким образом, влияние спонтанной индукции может затенять экспрессию генов профага в популяции лизогена.
Эксперименты по профилированию роста были использованы для выявления спонтанной индукции, которая была минимальной в ранней фазе экспоненциального роста. В этом исследовании рассказывается о том, как подготовить образцы культур во время ранней фазы экспоненциального роста и как установить адекватный контроль, несмотря на низкое количество клеток. Эти протоколы обеспечивают надежное и воспроизводимое сравнение бактерий дикого типа и лизогенных бактерий в различных условиях, тем самым улучшая транскриптомное профилирование геномов профагов и помогая идентифицировать ранее нераспознанные функции профагов.
Введение
В последнее время фаговая терапия для борьбы с устойчивостью к противомикробным препаратам1 и редактирование генов на основе CRISPR-Cas2 вызвали новый интерес к исследованиям бактериофагов. Опять же, достижения в области биотехнологии позволили глубже изучить взаимодействие между бактериями ифагами. Тем не менее, терапевтическое использование фагов («фаговая терапия») затруднено опасениями по поводу того, что фаги действуют как мобильные генетические элементы, обладающие способностью переносить гены вирулентности и резистентности горизонтально. Масштабы «темной материи»5 (гены с неизвестными функциями) одновременно и тревожны, и заманчивы. Темная материя считается пробелом в нашем понимании биологии фагов и в значительной степени неиспользованным ресурсом для молекулярных инструментов и потенциальных новыхтерапевтических средств. Разработка высокопроизводительных методов секвенирования, наряду с улучшенной аннотацией генов 7,8,9 и новыми алгоритмами сворачивания пептидов10, улучшает обнаружение, описание и функциональное предсказание фаговых генов. Тем не менее, наука все еще далека от подтверждения функций генов большинства фагов в культуре или в реальном мире.
Секвенирование РНК (RNA-Seq) может глобально картировать экспрессию генов во время фаговой инфекции и значительно улучшило понимание как фаговых, так и бактериальных элементов, участвующих в литических и лизогенных циклах11,12. Во время лизогенных процессов геномы умеренных фагов интегрируются в бактериальную ДНК, становясь профагами13. Глобальные эксперименты по профилированию экспрессии генов могут быть использованы для идентификации генов, ограниченных профагами, которые кодируются в геномах фагов умеренного пояса, но экспрессируются только в лизогенном состоянии11. Такие гены не кодируют фаговые структурные белки и не участвуют ни в каких процессах фаговой инфекции. RNA-Seq может быть использован для идентификации тех генов, которые с большей вероятностью влияют на биологию бактерии-хозяина, либо индуцируя усиление функции, либо регулируя существующие бактериальные гены, что часто позволяет бактериям адаптироваться к изменяющимся условиям окружающей среды. Таким образом, способность профагов действовать как микробные кукловоды, контролирующие ряд бактериальных функций, может быть изучена.
Существует два основных препятствия для эффективного анализа экспрессии генов, ограниченных профагами. Во-первых, ключевым вопросом является наличие восприимчивых хостов. По определению, профаги уже включены в свой специфический геном хозяина, поэтому трудно найти восприимчивого хозяина дикого типа, чтобы сравнить глобальную экспрессию генов в присутствии и отсутствии профага. Это может быть достигнуто либо путем de novo инфицирования другого восприимчивого хозяина, либо путем удаления профага из исходного изолята дикого типа, не нарушая остальную часть генома хозяина. Второй барьер заключается в гетерогенной природе лизогенных популяций. Некоторые профаги деградируют в результате мутации или рекомбинации, становясь «криптическими», что означает, что они фиксируются в определенном месте бактериального генома. Тем не менее, другие профаги являются «активными» и могут быть введены в репликативный, литический цикл спонтанно или после воздействия индуцирующих факторов. Во многих лизогенных культурах скорость спонтанной индукции означает, что часть бактериальных клеток всегда подвергается репликации литических фагов14,15,16. Высокий уровень экспрессии поздних фаговых генов в этих популяциях маскирует низкоуровневую экспрессию генов, связанную с экспрессией генов, ограниченных лизогеном11,17. Доля лизогенов, подвергающихся спонтанной индукции профага, может варьироваться в зависимости от состояния роста, условий роста или других триггеров. Таким образом, для изучения влияния профагов на лизоген спонтанные события индукции профагов должны быть сведены к минимуму, насколько это возможно, путем оптимизации условий роста в пользу лизогенного состояния.
В данном исследовании сообщается о подготовительной работе, проведенной для изучения влияния набора сожительствующих профагов из ливерпульского эпидемического штамма (LES) синегнойной палочки. Активные профаги индуцировали и выделяли из LES и использовали для инфицирования модельного штамма хозяина P. aeruginosa, PAO116,18,19. Были секвенированы полные геномы штамма P. aeruginosa дикого типа, PAO1, и его лизогена, PAO1Φ2, были секвенированы (на глубине 30-кратного покрытия), чтобы обеспечить идентичность штамма дикого типа и подтвердить, что лизоген изогенен. НПС ассоциировался с повышенной заболеваемостью и смертностью у пациентов с муковисцидозом, а фаги LES 19 помогали адаптироваться к легочной среде муковисцидоза16,19,20. Несмотря на убедительные доказательства того, что эти профаги влияют на биологию своего хозяина20,21, большинство их генных функций еще предстоит охарактеризовать, а конкретные механизмы взаимодействия плохо изучены. Транскриптомный подход может эмпирически раскрыть функции гена-профага на фоне контролируемого хозяина. Поскольку спонтанная индукция может влиять на профили экспрессии, в этой статье описывается, как оптимизировать условия роста в пользу лизогенного состояния. Такая синхронизация культур может быть подтверждена с помощью ПЦР в реальном времени для количественной оценки уровней экспрессии ключевых генетических маркеров, которые связаны с критическими стадиями репликации фагов LES в PAO1. Тот же подход был использован ранее для выявления профаг-ограниченных функций шига-токсигенных фагов, которые влияют на подвижность, кислотоустойчивость и устойчивость к противомикробным препаратам у Escherichia coli11,17,21,22.
протокол
1. Создайте выбираемый узел сети индикаторов (рисунок 1)
ПРИМЕЧАНИЕ: Лизаты фаговых культур могут содержать загрязняющие клетки исходного бактериального хозяина. Наличие резистентного к антибиотикам индикаторного штамма позволяет отличить индикаторный штамм от исходного бактериального хозяина профага. Использование выбираемого индикаторного штамма позволяет точно перечислить инфекционные фаговые частицы, не требуя центрифугирования или фильтрации для удаления фага из лизогенных клеток после этапов амплификации фагов. Выбираемый штамм хозяина-индикатора также сокращает время и количество шагов для перечисления фагов, что позволяет одновременно тестировать несколько условий.
- Определить подходящий штамм-индикаторный хозяин, восприимчивый к литическому и лизогенному инфицированию интересующим нас фагом умеренного пояса. Был использован лабораторный штамм P. aeruginosa PAO118,20, чувствительный к трем фагам LES (LESΦ2, LESΦ3 и LESΦ4).
- Выберите подходящий селективный агент (здесь использовали рифампицин) и проведите анализ разведения бульона для определения минимальной ингибирующей концентрации (MIC) для хозяина-индикатора (16 мкг·мл−1 является МПК для PAO1)23,24.
- Последовательно подвергают культуры-индикаторные хозяева возрастающим концентрациям селективного агента в лизогении бульоне (ЛБ), начиная с МПК (в данном случае 5 мкг·мл−1), в течение 18–24 ч при встряхивании и при 37 °С.
- Культуру, растущую в самой высокой концентрации в соотношении 1:100 (посев к среде), переносят в двукратно повышенные концентрации селективного агента (18–24 ч каждый раз) до тех пор, пока МПК не будет достаточно увеличен. PAO1 стал резистентным к рифампицину штаммом (PAO1-RifR) при концентрации рифампицина 300 мкг·мл−1 .
2. Временное прямое перечисление спонтанной индукции (рис. 2)
- Устанавливают на ночь закваски как лизогена (например, лизоген P. aeruginosa PAO1, содержащий фаги LES), так и индикаторного хозяина (PAO1-RifR), инокулируя одну колонию в 5 мл LB, и инкубируют при 37 °C при встряхивании при 180 об/мин (18–24 ч).
- Установите свежие лизогенные и индикаторные культуры-хозяева, инокулируя культуры на ночь в 100 мл LB в соотношении 1:100 и инкубируйте при 37 °C при встряхивании (180 об/мин).
- Контролируйте рост лизогена, измеряя OD600 и количество жизнеспособных веществ с помощью метода Майлза Мисра25. Для этого отбирают по 1 мл пробы от каждой лизогенной культуры каждый час от точки посева в течение 8 ч.
- Последовательно разбавляйте образец сразу после отбора, добавляя 100 мкл образца в 900 мкл соответствующей среды. Хорошо встряхните на максимальной скорости, отбрасывайте наконечник при каждом разведении, и продолжайте серию разбавлений от 10−1 до 10−9.
- Нанесите 10 мкл необходимых разведений в трех экземплярах на агаровую пластину LB, дайте высохнуть и инкубируйте при 37 °C в течение 18–24 ч.
- Чтобы рассчитать количество жизнеспособных бактериальных клеток, найдите разведение с легко подсчитываемыми колониями. Подсчитайте количество колоний в каждом пятне, а затем используйте следующую формулу:

ПРИМЕЧАНИЕ: По мере роста культуры лизогена активные фаговые частицы будут производиться путем спонтанной индукции. Производство инфекционных фагов означает, что транскриптом лизогенной популяции теперь контаминирован экспрессией генов, связанных с циклом литической репликации, из сигнала репликации литического фага и соответствующего ответа клетки-хозяина. Таким образом, важно определить стадию роста, на которой соотношение лизогенных клеток к свободным инфекционным фаговым частицам является наиболее высоким, чтобы ограничить как можно больше фонового транскрипционного шума (генерируемого литическим транскриптомом фага) в наборе данных.
- Для подсчета инфекционных фаговых частиц в каждом временном образце инокуляцию 5 мл стерильного 0,4%-ного бактериологического агара в LB (верхний агар) 100 мкл среднеэкспоненциального фазового индикаторного хозяина (OD600: 0,4–0,5; в данном случае PAO1-RifR) в присутствии соответствующего селективного агента (в данном случае 50 мкг·мл−1 рифампицина, так как МПК хозяина PAO1 составляет всего 16 мкг·мл−1; см. Таблицу материалов, ряд 8 и ряд 9)
- Нанесите 10 мкл того же серийного разведения (см. шаг 2.2.2) на верхний слой инокулированного агара и дайте высохнуть перед инкубацией при 37 °C в течение 18–24 ч.
- Чтобы рассчитать инфекционные фаговые частицы, найдите разведение с легко подсчитываемыми бляшками. Подсчитайте количество бляшек в каждом пятне.

- Найдите время/условие, при котором спонтанная индукция на КОЕ (колониеобразующую единицу) минимальна для дальнейших экспериментальных шагов.
3. Подготовка неиндуцированных и индуцированных лизогенных культур к экстракции РНК (рис. 3)
- Создайте свежую культуру на ночь, инокулируя одну колонию лизогена в 5 мл LB, и инкубируйте при 37 °C при встряхивании (180 об/мин) в течение 18–24 ч.
- Субкультура: ночная культура в 80 мл LB в соотношении 1:100 в восьми колбах по 250 мл.
- Обозначьте первую колбу как «неиндуцированную», а остальные как «индуцированную», вместе с временными моментами, когда каждая проба должна быть собрана (например, «индуцированная t = 0», «индуцированная t = 10 мин», «индуцированная t = 20 мин» и т. д.; Рисунок 3).
- После 90 мин инкубации, когда OD600 составляет 0,1–0,2, или во время минимальной спонтанной индукции (см. обсуждение), добавьте 4 мкл 1% ледяной уксусной кислоты (v/v) в неиндуцированную колбу (рис. 3).
ПРИМЕЧАНИЕ: Поскольку индуцирующий агент в этой работе был изготовлен с использованием 1% ледяной уксусной кислоты в качестве растворителя, такое же количество растворителя было добавлено только в качестве контрольного этапа. В зависимости от приготовления различных индукторов могут быть рассмотрены альтернативные методы контроля. - Добавьте 80 мл культуры из неиндуцированной колбы в 720 мл стерильного ЛБ и немедленно добавьте стоп-раствор (ледяной 5% [v/v] фенол, pH 4,3, 95% [v/v] этанол), используя объем, который составляет 20% объема культуры (160 мл), и инкубируйте на льду не менее 30 мин и не более 2 ч для стабилизации транскриптов РНК12, 26,27. Это неиндуцированная выборка.
- Остальные культуры индуцируют в семи колбах по 250 мл (рисунок 3) с МПК соответствующего индуктора (в данном случае 25 мг·мл−1 норфлоксацина, приготовленного в 1%-ной ледяной уксусной кислоте [w/v], используют при конечной концентрации 1 мкг·мл−1), хорошо перемешать и инкубировать при 37 °C и при встряхивании при 180 об/мин в течение 1 ч.
ПРИМЕЧАНИЕ: Этот шаг приведет культуру лизогена в более скоординированное состояние литической репликации. Большинство клеток в культуре начинают подвергаться литической продукции инфекционных фаговых частиц. - Дайте клеткам восстановиться, добавив 80 мл культуры из индуцированной колбы к 720 мл стерильного LB, который эффективно разбавляет индуцирующий агент. Собирайте бактериальные клетки из каждой колбы каждые 10 мин с 0 до 1 ч, добавляя стоп-раствор, как указано в шаге 3.5.
ПРИМЕЧАНИЕ: Стоп-раствор стабилизирует РНК до 2 ч. Однако для повышения стабильности образца выполняют все дальнейшие действия при 4 °С. - Сбор урожая центрифугированием при 10 000 x g в течение 15 мин при 4 °C как можно скорее, не более 2 ч после обработки, чтобы избежать деградации РНК.
- Выбросьте надосадочную жидкость и осторожно ресуспендируйте бактериальные гранулы в остаточной жидкости с помощью регулируемой автоматической пипетки, прежде чем переносить каждый образец в пробирку с микрофугой объемом 1,5 мл.
- Центрифугируют пробирки с микрофугой на высокой скорости (13 000 x g) в микрофуге при 4 °C в течение 1 мин и выбрасывают остаточную надосадочную жидкость.
- Мгновенно заморозьте гранулы, погрузив каждую герметичную пробирку микрофуги в жидкий азот. Это будет способствовать эффективному лизису клеток для экстракции РНК.
- Добавьте ТРИзол (1 мл) в каждую замороженную гранулу и гомогенизируйте суспензию путем пипетирования (не встряхивайте). Хранить при температуре −80 °C до тех пор, пока не будет готова к экстракции РНК для всех образцов.
ПРИМЕЧАНИЕ: На этом этапе протокол можно приостановить. - Повторите шаги 3.1–3.13 с тремя биологическими репликатами.
4. Выделение РНК из неиндуцированных и индуцированных лизогенных культур
КРИТИЧЕСКИЙ: Все эти шаги должны выполняться в среде, свободной от РНКазы28. Рабочие места должны быть протерты 10% NaClO или запатентованными инактиваторами РНКазы. Лабораторная посуда должна быть обработана ингибиторами РНКазы, такими как обработка DEPC, и во всех реакциях должна использоваться вода, не содержащая нуклеаз.
- Разморозьте замороженные гранулы, обработанные TRIzol, начиная с шага 3.12, на льду и добавьте 400 мкл хлороформа молекулярно-биологического качества.
- Хорошо перемешайте флаконы путем инверсии в течение 10 с, чтобы завершить лизис всех клеток ( не вихрить). Затем инкубируют при комнатной температуре (21 °C) в течение 2–5 мин.
- Отделите водный слой от смеси TRIzol и хлороформа центрифугированием с использованием охлаждаемой настольной микрофуги при 4 °C и 13 000 x g в течение 15 минут.
- Соберите водную фазу (~ 500 мкл, верхний слой) с помощью пипетки объемом 1 000 мкл, стараясь не нарушить интерфазную или органическую фазу (нижний слой). Переложите в новую пробирку с микрофугой объемом 1,5 мл.
- К отделенной водной фазе добавить 450 мкл изопропанола молекулярно-биологического качества, хорошо перемешать путем инверсии ( не взбивать) и инкубировать при комнатной температуре (21 °C) в течение 30 мин.
- Извлечение РНК центрифугированием с использованием охлаждаемой центрифуги при 4 °C и 13 000 x g в течение 30 мин.
- Выбросьте надосадочную жидкость, не повредив гранулу РНК, и дважды промойте гранулу 800 мкл 70% этанола, приготовленного на воде, не содержащей нуклеаз (не пипетки вверх и вниз). Обеспечьте стабильность гранулы РНК, повторяя этап центрифугирования в течение 5 минут после каждой промывки.
- Выбросьте этанол и высушите гранулы на воздухе.
ПРИМЕЧАНИЕ: Осторожно аспирируйте этанол вокруг гранулы с помощью микронаконечника на 10 мкл и высушите гранулу, перевернув пробирку на чистую промокательную бумагу. Гранула РНК должна стать бесцветной, а края должны казаться взъерошенными и видимыми. Слишком малая сушка может привести к образованию остаточного этанола, который может повлиять на последующие процессы, а слишком сильная сушка гранул может затруднить повторную суспензию. - Ресуспендировать РНК в безнуклеазной воде (50 мкл) путем инкубации при 65 °C на термошейкере с прерывистым перемешиванием (каждые 30 с) в общей сложности 3–5 мин.
КРИТИЧЕСКИЙ: Группа РНК 2'-OH способна катализировать авторасщепление цепей РНК при высокой температуре выше 65 °C и высоком pH. Температура ниже 65 °C замедляет ресуспендирование остаточной ДНК, тем самым ограничивая количество ДНК, которое должно быть переварено на более поздней стадии при расщеплении ДНКазы I. Следовательно, поддержание температуры на уровне 65 °C имеет решающее значение для получения наилучших образцов.
ПРИМЕЧАНИЕ: На этом этапе протокол можно приостановить, и образцы можно хранить при температуре −80 °C.
5. Удаление контаминирующей ДНК с РНК путем обработки ДНКазой
- Чтобы удалить загрязняющую ДНК из общей РНК перед синтезом кДНК первой цепи, добавьте 0,1 объема 10-кратного ДНКазного буфера и 1 мкл фермента ДНКазы к 10 мкг общей РНК. Осторожно перемешайте пробирку и инкубируйте при температуре 37 °C в течение 30 минут.
- Ресуспендируйте реагент для инактивации ДНКазы и добавьте минимум 2 мкл или 10% объема от общего объема реакции. Хорошо перемешайте и инкубируйте образцы в течение 5 мин при комнатной температуре (21 °C) во время редиспергирования реагента для инактивации ДНКазы.
- Гранулируют реагенты ДНКазы центрифугированием с помощью настольной микроцентрифуги при 10 000 × г в течение 1,5 мин.
- Переложите надосадочную жидкость, содержащую РНК, в свежую пробирку, не повредив гранулу.
ПРИМЕЧАНИЕ: Проверьте качество РНК с помощью УФ-спектрофотометра в масштабе 1 мкл и микрофлюидного компьютерного анализатора нуклеиновых кислот в соответствии с инструкциями производителя; очищенную общую РНК можно хранить при температуре −80 °C. Для кОТ-ПЦР РНК может быть использована непосредственно на этом этапе. Для более чувствительных последующих процессов, таких как секвенирование РНК, которые требуют строгого качества образцов, необходимо достичь соотношения A260/230 ε 2,0. - Доведите объем раствора РНК без ДНК до 500 мкл, используя безнуклеазную воду.
- Добавьте 50 мкл безнуклеазного 3 М ацетата натрия (рН 5,3) и 495 мкл изопропанола. Хорошо перемешать и выдержать при комнатной температуре 30 мин.
ПРИМЕЧАНИЕ: На этом этапе происходит осаждение РНК. - Извлекают РНК центрифугированием при 13 000 x g и 4 °C в течение 30 мин.
- Трижды промойте гранулы РНК ледяным 70% этанолом, центрифугируя образцы при 13 000 x g и 4 °C в течение 5 минут после каждой промывки для полного удаления солей.
- Проверяют качество РНК с помощью УФ-спектрофотометра в масштабе 1 мкл и микрофлюидного компьютерного анализатора нуклеиновых кислот в соответствии с инструкциями производителя; очищенную общую РНК можно хранить при температуре −80 °C.
ПРИМЕЧАНИЕ: Руководство29 использовалось для достижения стандартов качества РНК. Если соотношение A260/230 равно <2,0, то повторите шаги 5,5–5,9.
6. Качественный и количественный анализ РНК, не содержащей ДНКазы
- Проверьте эффективность обработки ДНКазой для каждого образца путем проведения количественной ПЦР с использованием праймеров 16S рРНК (таблица 2) с 1 мкг общей РНК и убедитесь, что продукт амплификации не производится.
Примечание: Идеальными праймерами для оценки контаминации гДНК являются праймеры, предназначенные для отжига в интрон-экзонных переходах или регуляторных областях у прокариот или в транскрипционно неактивных сайтах30,31. - Определите число целостности РНК (RIN) с помощью микрофлюидного компьютерного анализатора нуклеиновых кислот в соответствии с инструкциями производителя.
ПРИМЕЧАНИЕ: Для синтеза первой нити следует использовать образцы с RIN ≥ 9. Образцы, показывающие RIN < 9, следует отбросить, а этапы изоляции (1.1–5.4) следует повторить. - Количественно определите общую концентрацию РНК с помощью набора для анализа РНК HS и флуориметра в соответствии с инструкциями производителя.
7. Синтез кДНК первой цепи
- Приготовьте смесь РНК-праймеров для каждого образца, смешав 1 мкг общей РНК с 1 мкл случайных гексамеров (50 нг·мкл−1) и 1 мкл смеси dNTP 10 мМ. Затем отрегулируйте общий объем до 10 мкл, используя воду, не содержащую нуклеаз.
- Инкубируйте реакцию при 65 °C в течение 5 минут и поместите на лед на 1 минуту.
- Приготовьте смесь для синтеза кДНК для каждого образца, добавив 2 мкл 10-кратного RT-буфера; 4 мкл 25 мМ MgCl2; 2 мкл 0,1 М DTT; 1 мкл ингибитора РНКазы (40 Ед·мкл−1); и 1 мкл реагента обратной транскрипции (200 U·мкл−1) в указанном порядке.
- Добавьте смесь синтеза кДНК в смесь РНК/праймера. Аккуратно перемешайте и кратковременно центрифугируйте образцы, чтобы собрать компоненты на дне пробирки.
- Загрунтуйте смесь, инкубируя образцы в течение 10 минут при 25 °C, а затем 50 минут при 50 °C. Прекратите реакции, инкубируя при 85 °C в течение 5 мин и охладив на льду.
- Добавьте 1 мкл РНКазы H в каждую пробирку и инкубируйте при 37 °C в течение 20 минут, чтобы удалить РНК из гибрида ДНК:РНК.
- Наконец, разбавьте реакцию синтеза кДНК до общего объема 80 мкл и храните ее при температуре −80 °C до дальнейшего использования.
ПРИМЕЧАНИЕ: На этом этапе протокол можно приостановить.
8. Стандартная кривая и количественная (q)-ПЦР для определения уровней экспрессии генов-маркеров, указывающих на разные стадии репликации фагов
- Определите набор генов-мишеней, которые могут выступать в качестве маркеров для каждой стадии репликации интересующего фага. В нашем случае они были описаны в таблице 2.
- Амплифицировать каждый из генов-мишеней из матричной геномной ДНК с использованием соответствующих праймеров и с помощью ПЦР со следующими условиями амплификации: начальная денатурация при 95 °C в течение 2 мин; денатурация при 95 °С в течение 30 с; отжиг при оптимальной температуре отжига в зависимости от грунтовки (здесь использовалась 58 °С) в течение 30 с; удлинение при 72°С в течение 1 мин; и окончательное удлинение при 72 °C в течение 5 мин.
- Очистите каждый ампликон с помощью набора для очистки ПЦР и клонируйте их в вектор клонирования ТА в соответствии с инструкциями производителя. Проверка последовательности каждого клонированного продукта с помощью секвенирования по Сэнгеру.
ПРИМЕЧАНИЕ: На этом этапе протокол можно приостановить. - Вычислите число копий для отдельных плазмид, используя следующее уравнение20:
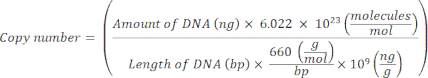
- Подготовьте стандартный шаблон для каждого гена-маркера путем последовательного разведения плазмидной ДНК от 109 копий/мкл до 10 2 копий/мкл в молекулярном беснуклеазном стерильном H2 O.
- Проводить количественную ПЦР в соответствии с инструкциями производителя для предпочтительной системы кПЦР с 1 мкл кДНК (начиная с шага 7.7) для каждого образца в трех экземплярах вместе с соответствующими стандартами плазмид в трех экземплярах; проводят ПЦР в 96-луночном планшете для каждой мишени.
- Постройте график зависимости логарифмического числа копий ДНК (ось x) от порога цикла (ось y, Ct) и используйте соответствующую платформу, такую как Excel или R, для выполнения вычисления линейной регрессии, чтобы отобразить коэффициент детерминации (R2) и линейное уравнение.
ПРИМЕЧАНИЕ: Коэффициент детерминации должен быть выше 0,98. - Оцените количество копий для каждой цели с помощью линейного уравнения (y = mx + b), полученного из линейной регрессии (шаг 8.7), где y — расчетное Ct; x — логарифмическая копия ДНК; m – наклон линии, определяющий изменение Ct по отношению к числу копий ДНК; и b — точка пересечения по оси Y, представляющая собой расчетное значение Ct для одной копии ДНК32.
- Для каждого гена-маркера рассчитайте эффективность ПЦР-амплификации (E), используя параметры линейной регрессии стандартной кривой и следующее уравнение, где m — наклон, полученный из шагов 8.7 и 8.8:
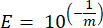
- Проверьте все праймеры с точки зрения их процентной эффективности, используя следующее уравнение:
ПРИМЕЧАНИЕ: КПД должен быть в пределах 90%–110%.
- Рассчитайте абсолютное число копий ДНК по следующей формуле:
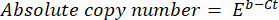
где Ct (шаг 8.8) – порог цикла, b – пересечение (шаг 8.8), m – наклон (шаг 8.8), E – эффективность амплификации ПЦР (шаг 8.9).
КРИТИЧЕСКИЙ: При сравнении амплификации двух или более мишеней методом q-ПЦР эффективность ПЦР должна быть рассчитана для каждой мишени, чтобы сравнить абсолютное число копий ДНК. - В этом исследовании гены 16S рРНК, proC и rpoD использовались в качестве общего внутреннего контроля, а gyrB использовался в качестве индукционного контроля33,34,35.
ПРИМЕЧАНИЕ: При выборе внутреннего контроля на основе данных секвенирования РНК лучше всего выбирать внутренние элементы управления, которые не изменяются в уровнях экспрессии для тестируемых условий. Тщательное рассмотрение надлежащих средств контроля всегда важно для осмысленной интерпретации результатов.
Результаты
В данной работе для определения влияния спонтанной индукции LESΦ2 был использован прямой временной подсчет продукции фагов из культуры лизогена PAO1 LESΦ2, выращенной в неиндуцирующих условиях. Плотность фагов была в самой низкой точке со средним значением ~2,61 x 106 бляшеобразующих единиц (БОЕ)·мл−1 2 ч после субкультуры в свежей среде во время ранней экспоненциальной фазы роста, что позволяет предположить, что лизогения была доминирующим состоянием. Титр LESΦ2 быстро увеличивался до среднего значения ~2,4 x 108 PFU·mL−1 в течение 4 ч и достигал максимальной плотности через 6 ч (среднее ~5,83 x 109 PFU·mL−1; Рисунок 4).
Минимальная спонтанная индукция наблюдалась во время ранней логарифмической фазы роста лизогена (через 2 ч). Тем не менее, измеримое присутствие фагов в питательной среде было результатом многих предшествующих событий, в том числе следующих: упаковка нуклеиновых кислот в белковые головки, сборка белков в фаговые частицы и экспрессия поздних фаговых генов, фаговых генов средней стадии и ранних регуляторных фаговых генов. Важно было поймать инфицированные клетки до того, как проявятся события фаг-ассоциированной репликации; Таким образом, было выбрано 90 минут, чтобы дать культуре вырасти до индукции. Для получения профиля экспрессии генов PAO1, образцы лизогена LESΦ2 из культуры собирали до и после индукции в течение 90-минутного периода, как указано в шаге 3.4. Этот 90-минутный промежуток времени задолго до того, как высокие уровни спонтанной индукции резидентного профага будут обнаружены с помощью анализа бляшек, начиная с шага 2.3.2. Поскольку плотность бактериальных клеток была низкой во время раннего экспоненциального роста, объемы культивирования были увеличены до 800 мл, чтобы обеспечить достаточный материал для исследований экспрессии генов. Образцы отбирали из неиндуцированной культуры и индуцированных культур каждые 10 мин, и выделяли РНК для картирования профиля экспрессии ключевых маркеров лизогении и литической репликации во время роста бактерий. Общую РНК очищали и валидировали на отсутствие геномной ДНК с помощью кПЦР-анализов, нацеленных на ген 16S рРНК (шаг 6.1). Образцы, достигшие RIN ≥ 9, прошли контроль качества и были преобразованы в кДНК.
Аннотированный геном LESΦ2 был исследован для выявления генов, которые являются известными игроками в лизогенных и литических циклах репликации фагов умеренного пояса. Затем эти идентифицированные гены были использованы для валидации кОТ-ПЦР для профилирования экспрессии генов, ограниченных лизогенным циклом и связанных с литическим циклом, из индуцированных и неиндуцированных культур. Мы количественно оценили абсолютное число копий ДНК и провели критерий знакового ранга Вилкоксона с использованием R36 для сравнения уровней экспрессии в неиндуцированных и индуцированных культурах (рис. 5). Наблюдалось заметное увеличение экспрессии гена cro (ранний маркер литической репликации) с ~2,31 x 109 копий в неиндуцированных культурах до ~3,02 x 1011 копий через 30 мин после индукции (критерий знакового ранга Вилкоксона: p < 0,01). Аналогичным образом, О-белки и Р-белки, которые являются маркерами промежуточной стадии литической репликации (и, по прогнозам, участвуют в репликации фагового генома), также показали значительное повышение регуляции от ~1,74 x 108 до ~1,25 x 10 10 копий (критерий знакового ранга Вилкоксона: p < 0,01) и от ~ 6,05 x 102 до ~5,68 x10 5 копий (критерий знакового ранга Уилкоксона: p < 0,01) соответственно. Наконец, структурные гены, ассоциированные с хвостом, были использованы в качестве поздних маркеров цикла литической репликации. Опять же, мы наблюдали значительное увеличение экспрессии с ~2,31 x 106 копий в неиндуцированных культурах до ~4,38 x 108 копий через 30 минут после индукции (критерий знакового ранга Уилкоксона: p < 0,01). Таким образом, количественные данные ОТ-ПЦР подтвердили, что экспрессия генов хорошо известных маркерных генов для литической репликации следовала ожидаемой тенденции, при этом ранние, средние и поздние маркеры показали многократную дифференциальную экспрессию в прогнозируемом порядке (рис. 5). Поскольку экспрессия маркеров литической репликации повышалась через 30 минут после восстановления, это считается подходящим репрезентативным моментом времени для изучения транскриптомного ландшафта активных фагов умеренного пояса и их бактериальных хозяев во время литического цикла.
Мы наблюдали некоторую экспрессию литических генов в неиндуцированных условиях, подтверждая, что некоторая спонтанная индукция происходит всегда, даже в оптимизированных культурах, в которых лизогенное число представлено с наибольшим отношением КОЕ к высвобожденному ПФЕ в ранней логарифмической фазе. Это означает, что в транскриптомных данных всегда будет присутствовать некоторый уровень «шума», что подчеркивает важность тщательно подготовленного контроля, включая индуцированные и неиндуцированные культуры. Надлежащий выбор генов внутреннего контроля для определения складчатых изменений экспрессии основан на тщательном изучении данных транскриптомики для выявления генов, экспрессирующихся на одном и том же уровне как в неиндуцированных, так и в индуцированных образцах. Наши предварительные результаты свидетельствуют о том, что rpoD был наиболее надежным контрольным геном и имел наиболее стабильную экспрессию (~1,71 x 10 5 копий до индукции и ~3,33 x 105 копий через 30 мин после индукции; Критерий знакового ранга Вилкоксона: p = 0,3594) по сравнению с генами 16S рРНК или proC (рис. 5). Вариативность экспрессии внутреннего контроля привела к измерению абсолютных чисел транскриптов. Будущая экспертиза данных транскриптомики будет способствовать выбору надлежащих средств внутреннего контроля для дальнейшей валидации.
Ген cI был использован в нашем исследовании генного профилирования, поскольку он является хорошо известным маркером лизогении. По сравнению с маркерами литической репликации, экспрессия гена cI была относительно стабильной (рис. 5), но число копий этого гена было обнадеживающе высоким в неиндуцированных культурах по сравнению с маркерами литической репликации. Эти данные согласуются с низкими показателями ПФУ в тех же образцах, что подтверждает, что высокая экспрессия репрессоров была связана с более низкими уровнями продукции фагов. Данные, представленные здесь, показывают, что экспрессия транскрипта cI для этого конкретного фага существенно не снижается после индукции, как это видно на фагах Stx11,17. Репрессорная активность обычно контролируется как на транскрипционном, так и на посттрансляционном уровнях, поэтому ген-репрессор может быть транскрибирован, но полученный белок немедленно подвергается авторасщеплению. Необходимы дальнейшие эксперименты для валидации транскрипционного и посттрансляционного контроля. Более того, из нашей стандартной кривой следует, что минимальный предел обнаружения кПЦР составляет ~102 копии.
В совокупности наши результаты анализа бляшек и ОТ-ПЦР подтверждают правильность нашей стратегии подготовки образцов культуры и РНК для получения хорошо контролируемых входных данных для экспериментов RNA-Seq. Неиндуцированные культуры в раннеэкспоненциальной фазе демонстрировали низкие уровни спонтанной индукции и экспрессии литических генов, что свидетельствует о доминировании лизогении. Напротив, культуры, выделенные через 30 мин после индукции, показали значительное увеличение экспрессии генов-маркеров, что указывает на доминирование литической репликации.
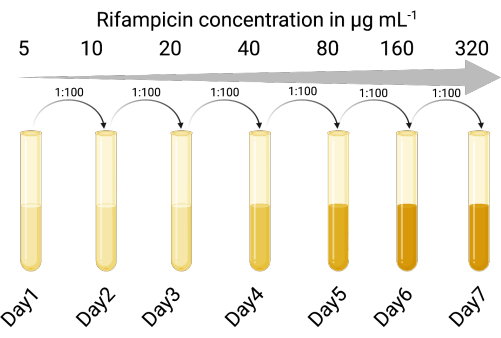
Рисунок 1: Протокол создания хоста индикатора, резистентного к рифампицину (Created with BioRender.com)). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Схема эксперимента для подсчета ПФУ и КОЕ лизогена из одного и того же образца. (Создано с помощью BioRender.com) Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
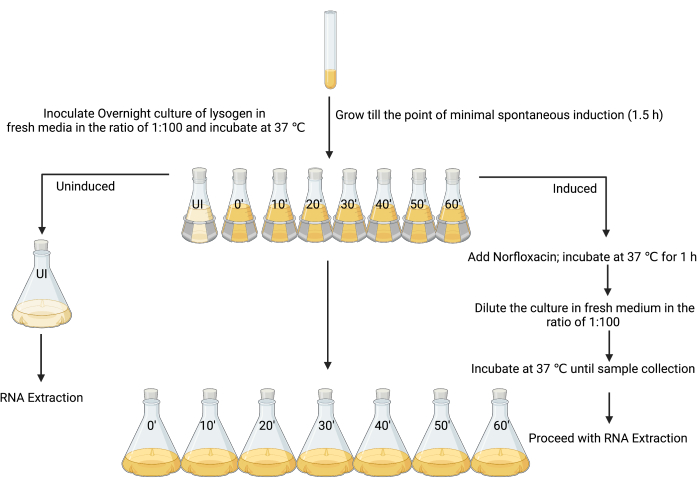
Рисунок 3: Дизайн эксперимента по отбору индуцированных и неиндуцированных культур для выделения РНК. (Создано с помощью BioRender.com) Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
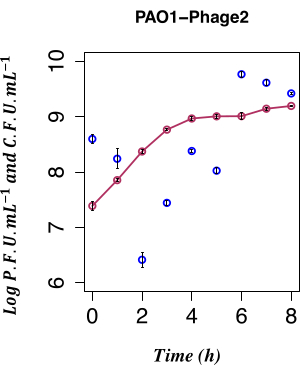
Рисунок 4: Временное перечисление спонтанной индукции. Временное перечисление спонтанной продукции LES-профага с использованием ПФУ из лизогена PAO1 Φ2 с одновременным КОЕ, n = 8 (два биологических и четыре технических репликата); Столбцы погрешности представляют собой стандартное отклонение. Темно-красные точки обозначают КОЕ·мл−1 в фунтах; темно-синие точки обозначают PFU·mL−1 в фунтах. Спонтанное высвобождение инфицирующего фага φ2 лизогенами находится на самом низком измеримом уровне через 2 ч после инокуляции. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 5: Абсолютное число копий генов-маркеров-мишеней. Абсолютное число копий генов-маркеров фагов подтверждает предсказанные паттерны экспрессии, полученные с помощью ОТ-кПЦР, генов, которые, как ожидается, будут играть важную роль в лизогении и литических циклах. Точки представляют собой как три биологические, так и три технические реплики (n = 9). (А) Красным прямоугольником показан маркер лизогении, cI; (B) зеленым цветом обозначен ранний литический маркер, cro; (C,D) синим цветом обозначены среднелитические маркеры, гены репликации ДНК; (E) пурпурный представляет собой позднелитический маркер, структурные гены хвоста; (F–H) серым цветом обозначены маркеры хозяина, которые использовались в качестве внутреннего контроля, а белым цветом (I) — ДНК-гираза B, которая использовалась в качестве индукционного контроля. Сплошные горизонтальные линии показывают медиану распределения. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Таблица 1: Грунтовки, разработанные в данном исследовании. Приведены последовательности специфических праймеров для маркерных генов и внутреннего контроля, использованных в этом исследовании, а также соответствующие идентификаторы образцов NCBI. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 2: Эффективность праймеров, использованных в данном исследовании, рассчитана с использованием стандартной кривой кПЦР. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Обсуждение
Создание селективного хозяина-индикатора, ранее использовавшегося в бляшечных анализах для более точной количественной оценки спонтанной индукции фага Stx из E. coli MC1061 37,38,39, было описано здесь для фага P. aeruginosa LESΦ2. Это вмешательство имеет дополнительное преимущество, заключающееся в сокращении этапов и времени обработки образцов, что позволяет одновременно оценивать частоту спонтанной индукции в различных условиях культивирования. Существует риск генерации других мутаций при создании резистентных к рифампицину вариантов40; Однако в этой работе эволюционировавший штамм использовался только в качестве индикаторного хозяина для подсчета бляшек из интересующих культур и не был включен в транскриптомный анализ. До тех пор, пока селекционируемый индикаторный штамм остается одинаково восприимчивым к заражению интересующим нас фагом, нет никаких опасений по поводу других приобретенных мутаций. Тем не менее, при анализе с помощью гель-электрофореза (ПФГЭ) PAO1WT иPAO1 RIF (данные не показаны) не выявлено различий в профилях полиморфизма длины рестрикционных фрагментов (данные не показаны).
При выборе клеток-хозяев редко можно встретить штамм-индикатор, который еще не содержит профагов. В качестве примера можно привести PAO1, содержащий нитевидный профаг Pf4. Экспериментальные контрольные группы для этого исследования были разработаны таким образом, чтобы иметь возможность непосредственно изучить экспрессию генов специфических фагов (в данном случае LES prophage 2) и влияние, которое этот фаг оказывает на экспрессию бактериальных генов. При сравнении транскриптов из PAO1, несущих LES-профаг 2 и лишенных LES-профага 2 (как лизоген, так и нелизоген несут эндогенный Pf4), которые служат внутренним контролем для исключения влияния Pf4 на хозяина. Кроме того, было продемонстрировано, что Pf4 обычно не вызывает лизиса в клетке-хозяине41 и, следовательно, не способен исказить результаты этих экспериментов.
Хорошо известно, что тщательный контроль качества имеет решающее значение при подготовке образцов для получения значимых омиксных данных42. Однако,как было описано ранее11, тщательная характеристика активности профагов при подготовке лизогеновых культур для таких исследований проводится редко. В этой статье мы подробно опишем наши систематические протоколы подготовки хорошо контролируемого и оптимизированного набора культур для транскриптомных исследований, чтобы лучше изучить взаимодействие между бактериями и фагами умеренного пояса. Синхронность популяции контролировали путем введения культуры по крайней мере через четыре удвоения перед лечением индуцирующим антибиотиком норфлоксацином. Определив МПК норфлоксацина для штамма в исследовании, мы смогли гарантировать, что концентрация индуцирующего агента была чуть выше МПК для «индукционной» терапии. Затем обработанные клетки разбавляли 1:10, чтобы снизить концентрацию норфлоксацина ниже МПК после 1 ч лечения, чтобы позволить клеткам восстановиться и завершить процесс репликации фагов, заканчивающийся лизисом клетки и высвобождением инфицированного фагового потомства. Клетки вступают в цикл литической репликации после индукционного стимула только после того, как концентрация норфлоксацина снижается ниже МПК в течение восстановительного периода. В этом случае превышение 1 мкг·мл− 1 норфлоксацина означает, что препарат не может быть эффективно разбавлен ниже МПК, так как МПК для норфлоксацина для PAO1 составляет 0,19 мкг·мл−1. Уровень разведения индуктора должен быть сбалансирован с необходимостью восстановления лизогена и сохранением плотности культуры для сбора РНК. Данные, обсуждаемые здесь, показывают, что можно синхронизировать культуры для создания образцов, в которых доминирует лизогения, тем самым уменьшая шум от спонтанной индукции и позволяя обнаруживать истинные изменения в экспрессии генов, вызванные лизогением. Поскольку лизогенное состояние преобладает в раннеэкспоненциальной фазе роста, когда плотность бактериальных клеток низкая, мы предлагаем масштабировать культуры, чтобы собрать достаточное количество РНК для последующих исследований экспрессии генов, таких как RNA-Seq.
Хорошо известно об использовании норфлоксацина в качестве индуцирующего агента для принудительного включения культур в литический цикл43,44; Однако это также повлияет на экспрессию других бактериальных генов в процессе45,46. Чтобы смягчить это, библиотеки РНК из контрольных культур дикого типа, выращенных в тех же индуцирующих и неиндуцирующих условиях, должны быть включены в эксперименты RNA-Seq. Использование внутреннего контроля и ключевых маркерных генов для валидации стадий репликации фагов с помощью ОТ-ПЦР также имеет решающее значение для точных сравнений. Количественное профилирование ОТ-ПЦР не может быть интерпретировано путем сравнения абсолютных чисел транскриптов для каждого гена в различные моменты времени; Важна форма профиля. Во-первых, был отобран только один небольшой участок в транскрипте для любого гена,поэтому неизвестно, является ли он короткоживущим или долгоживущим элементом. Конечно, RNA-Seq картирование транскриптов показывает, что плотность данных картирования значительно изменяется в зависимости от длины гена. Во-вторых, именно форма профиля экспрессии гена должна быть интерпретирована для гена-маркера, связанного с литическим циклом или лизогенным образом жизни или даже отделенного от регуляторных цепей фагов11. Спонтанная индукция является реальной проблемой в культуре лизогена, и она всегда будет приводить к экспрессии генов, связанных с литическим циклом. Тем не менее, профилирование показывает, что гены, связанные с циклом литической репликации, подавляются в своей экспрессии до индукции (по крайней мере, две логарифмические складки) и регулируются после индукции.
Проведенные ранее транскриптомные анализы взаимодействия фагов Stx с E. coli подтверждают глубокое понимание фаговых генов, участвующих в поддержании лизогении и запуске литического цикла11,17. В настоящее время фаги LES P. aeruginosa аннотированы, но их ключевые функции генов менее изучены. Транскриптомные исследования позволят повторно аннотировать профаги LES и улучшить наше понимание генов, участвующих в лизогении и литическом цикле. Связывание последовательности генов с функцией представляет собой серьезную проблему при изучении новых профагов, что еще больше подчеркивает необходимость проведения дополнительных исследований для подтверждения функций фаговых генов для создания более совершенных инструментов аннотирования47. Более широкое применение и адаптация протоколов и дополнительных мер контроля качества, подробно описанных в этой видеостатье, может помочь в раскрытии различных функций профагов и, таким образом, в улучшении конвейеров аннотаций и преобразовании нашего понимания биологии фагов и бактерий.
Материалы
| Name | Company | Catalog Number | Comments |
| PAO1 | 6 | ||
| LESB58 | 6 | ||
| LES phages | Induced and purified from LESB58 using Norfloxacin. | This study | |
| Lysogeny Broth (LB) | Merck | 1.10285.500 | |
| LB Agar | Merck | 1.10283.500 | |
| Agar Agar | Fisher | A/1080/53 | |
| Top Agar | 0.4 g Agar Agar+2.5 g LB Broth in 100 mL water; autoclave and use. | - | |
| Rifampicin | Sigma (Stock: 50 mg/mL in Methanol- Mix well and use 0.22µm filter to sterilize and store it in -20°C until use) | R3501 | |
| Glacial Acetic Acid | Fisher 1% (v/v) in water | 10060000 | |
| Norfloxacin | Sigma (Stock: 25 mg/mL of 1% Glacial Acetic Acid-Mix well and use 0.22µm filter to sterilize and store it in -20°C until use;To avoid freeze thaw cycles, store as small aliquotes) | N9890 | |
| Phenol saturated with citrate buffer pH 4.3 | Sigma | P-4682 | |
| Molecular Biology grade Ethanol | Fisher | 16695992 | |
| TRIzol | Invitrogen | 12044977 | |
| Chloroform | Fisher | 11398187 | |
| Isopropanol | Fisher | 17150576 | |
| Nuclease-free H2O | Invitrogen | 10526945 | |
| 10X TURBO DNase | Ambion | AM1907 | |
| Qubit RNA HS, BR Kit | Invitrogen | Q10210 | |
| Agilent RNA 6000 Nano Kit | Agilent | 5067-1511 | |
| SuperScriptIII first strand synthesis kit | Invitrogen | 18080051 | |
| PCR Reagents | Bioline Mytaq Red 2X | BIO-25043 | |
| qPCR Reagents | Sensifast SYBR Hi Rox | BIO-92020 | |
| PCR purification kit | Isolate II PCR and Gel Kit | BIO-52060 | |
| TA cloning kit | TA Cloning Kit, with pCR 2.1 Vector, without competent cells | K202040 | |
| StepOne Real Time PCR system | Thermo Fisher Scientific | 4376600 |
Ссылки
- Lin, D. M., Koskella, B., Lin, H. C. Phage therapy: An alternative to antibiotics in the age of multi-drug resistance. World Journal of Gastrointestinal Pharmacology and Therapeutics. 8 (3), 162-173 (2017).
- Jiang, W., Marraffini, L. A. CRISPR-Cas: New tools for genetic manipulations from bacterial immunity systems. Annual Review of Microbiology. 69 (1), 209-228 (2015).
- Santos, S. B., Azeredo, J. Bacteriophage-based biotechnological applications. Viruses. 11 (8), 737(2019).
- Rodríguez-Rubio, L., Jofre, J., Muniesa, M. Is genetic mobilization considered when using bacteriophages in antimicrobial therapy. Antibiotics. 6 (4), 32(2017).
- Hatfull, G. F. Dark Matter of the biosphere: The amazing world of bacteriophage diversity. Journal of Virology. 89 (16), 8107-8110 (2015).
- Yukgehnaish, K., et al. PhageLeads: Rapid assessment of phage therapeutic suitability using an ensemble Machine Learning approach. Viruses. 14 (2), 342(2022).
- Seemann, T. Prokka: Rapid prokaryotic genome annotation. Bioinformatics. 30 (14), 2068-2069 (2014).
- Arndt, D., et al. PHASTER: A better, faster version of the PHAST phage search tool. Nucleic Acids Research. 44, W16-W21 (2016).
- Banerjee, S., et al. FINDER: An automated software package to annotate eukaryotic genes from RNA-Seq data and associated protein sequences. BMC Bioinformatics. 22 (1), 205(2021).
- Jumper, J., et al. Highly accurate protein structure prediction with AlphaFold. Nature. 596 (7873), 583-589 (2021).
- Veses-Garcia, M., et al. Transcriptomic analysis of Shiga-toxigenic bacteriophage carriage reveals a profound regulatory effect on acid resistance in Escherichia coli. Applied and Environmental Microbiology. 81 (23), 8118-8125 (2015).
- Owen, S. V., et al. A window into lysogeny: revealing temperate phage biology with transcriptomics. Microbial Genomics. 6 (2), e000330(2020).
- Davies, E. V., Winstanley, C., Fothergill, J. L., James, C. E. The role of temperate bacteriophages in bacterial infection. FEMS Microbiology Letters. 363 (5), 015(2016).
- Livny, J., Friedman, D. I. Characterizing spontaneous induction of Stx encoding phages using a selectable reporter system. Molecular Microbiology. 51 (6), 1691-1704 (2004).
- Fogg, P. C. M., et al. Identification of multiple integration sites for Stx-phage Φ24B in the Escherichia coli genome, description of a novel integrase and evidence for a functional anti-repressor. Microbiology. 153 (12), 4098-4110 (2007).
- James, C. E., et al. Differential infection properties of three inducible prophages from an epidemic strain of Pseudomonas aeruginosa. BMC Microbiology. 12, 216(2012).
- Riley, L. M., et al. Identification of genes expressed in cultures of E. coli lysogens carrying the Shiga toxin-encoding prophage Φ24B. BMC Microbiology. 12 (1), 42(2012).
- Stover, C. K., et al. Complete genome sequence of Pseudomonas aeruginosa PAO1, an opportunistic pathogen. Nature. 406 (6799), 959-964 (2000).
- Winstanley, C., et al. Newly introduced genomic prophage islands are critical determinants of in vivo competitiveness in the Liverpool Epidemic Strain of Pseudomonas aeruginosa. Genome Research. 19 (1), 12-23 (2009).
- Davies, E. V., et al. Temperate phages enhance pathogen fitness in chronic lung infection. The ISME Journal. 10 (10), 2553-2555 (2016).
- Allison, H. E. Stx-phages: drivers and mediators of the evolution of STEC and STEC-like pathogens. Future Microbiology. 2 (2), 165-174 (2007).
- Allison, H. E., et al. Immunity profiles of wild-type and recombinant Shiga-like toxin-encoding bacteriophages and characterization of novel double lysogens. Infection and Immunity. 71 (6), 3409-3418 (2003).
- Mori, N., et al. A peptide based on homologous sequences of the β-barrel assembly machinery component BamD potentiates antibiotic susceptibility of Pseudomonas aeruginosa. Journal of Antimicrobial Chemotherapy. 67 (9), 2173-2181 (2012).
- Chojnacki, M., et al. A novel, broad-spectrum antimicrobial combination for the treatment of Pseudomonas aeruginosa corneal infections. Antimicrobial Agents and Chemotherapy. 63 (10), e00777(2019).
- Miles, A. A., Misra, S. S., Irwin, J. O. The estimation of the bactericidal power of the blood. Epidemiology & Infection. 38 (6), 732-749 (1938).
- Srikumar, S., et al. RNA-seq brings new insights to the intra-macrophage transcriptome of Salmonella Typhimurium. PLoS Pathogens. 11 (11), e1005262(2015).
- Kröger, C., et al. The transcriptional landscape and small RNAs of Salmonella enterica serovar Typhimurium. Proceedings of the National Academy of Sciences of the United States of America. 109 (20), E1277-E1286 (2012).
- Green, M. R., Sambrook, J. How to win the battle with RNase. Cold Spring Harbor Protocols. (2), (2019).
- Koetsier, G. A practical guide to analyzing nucleic acid concentration and purity with microvolume spectrophotometers. New England BioLabs Inc. , Available from: https://www.neb.com/-/media/nebus/files/application-notes/technote_mvs_analysis_of_nucleic_acid_concentration_and_purity.pdf?rev=c24cea043416420d84fb6bf7b554dbbb (2019).
- Saunders, N. A., Lee, M. A. Real-Time PCR: Advanced Technologies and Applications. , Caister Academic Press. Norfolk, UK. (2013).
- Bustin, S. A. A-Z of Quantitative PCR. , International University Line. La Jolla, CA. (2004).
- Ruijter, J. M., et al. Efficiency correction is required for accurate quantitative PCR analysis and reporting. Clinical Chemistry. 67 (6), 829-842 (2021).
- Fothergill, J. L., Neill, D. R., Loman, N., Winstanley, C., Kadioglu, A. Pseudomonas aeruginosa adaptation in the nasopharyngeal reservoir leads to migration and persistence in the lungs. Nature Communications. 5 (1), 4780(2014).
- Huang, J., et al. Temperature-dependent expression of phzM and its regulatory genes lasI and ptsP in rhizosphere isolate Pseudomonas sp. strain M18. Applied and Environmental Microbiology. 75 (20), 6568-6580 (2009).
- Savli, H., et al. Expression stability of six housekeeping genes: a proposal for resistance gene quantification studies of Pseudomonas aeruginosa by real-time quantitative RT-PCR. Journal of Medical Microbiology. 52 (5), 403-408 (2003).
- Kassambara, A. rstatix: Pipe-Friendly Framework for Basic Statistical Tests. , Available from: https://CRAN.R-project.org/package=rstatix (2022).
- McDonald, J. E., et al. High-throughput method for rapid induction of prophages from lysogens and its application in the study of Shiga toxin-encoding Escherichia coli strains. Applied and Environmental Microbiology. 76 (7), 2360-2365 (2010).
- Smith, D. L., et al. Short-tailed Stx phages exploit the conserved YaeT protein to disseminate Shiga toxin genes among Enterobacteria. Journal of Bacteriology. 189 (20), 7223-7233 (2007).
- James, C. E., et al. Lytic and lysogenic infection of diverse Escherichia coli and Shigella strains with a verocytotoxigenic bacteriophage. Applied and Environmental Microbiology. 67 (9), 4335-4337 (2001).
- Rees, V. E., et al. Characterization of hypermutator Pseudomonas aeruginosa isolates from patients with cystic fibrosis in Australia. Antimicrobial Agents and Chemotherapy. 63 (4), e02538(2019).
- Li, Y., et al. Excisionase in Pf filamentous prophage controls lysis-lysogeny decision-making in Pseudomonas aeruginosa. Molecular Microbiology. 111 (2), 495-513 (2019).
- Van Kampen, A. H. C., Moerland, P. D. Taking bioinformatics to systems medicine. Systems Medicine. 1386, 17-41 (2016).
- Matsushiro, A., Sato, K., Miyamoto, H., Yamamura, T., Honda, T. Induction of prophages of enterohemorrhagic Escherichia coli O157:H7 with norfloxacin. Journal of Bacteriology. 181 (7), 2257-2260 (1999).
- James, C. E., et al. Lytic activity by temperate phages of Pseudomonas aeruginosa in long-term cystic fibrosis chronic lung infections. The ISME Journal. 9 (6), 1391-1398 (2015).
- Shaw, K. J., et al. Comparison of the changes in global gene expression of Escherichia coli induced by four bactericidal agents. Microbial Physiology. 5 (2), 105-122 (2003).
- Long, H., et al. Antibiotic treatment enhances the genome-wide mutation rate of target cells. Proceedings of the National Academy of Sciences of the United States of America. 113 (18), E2498-E2505 (2016).
- González-Tortuero, E., et al. VIGA: A sensitive, precise and automatic de novo VIral Genome Annotator. bioRxiv. , (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены