Method Article
トランスクリプトミクスによる温帯バクテリオファージの溶解原体への影響の理解
要約
このプロトコルにより、宿主に対するプロファージの影響を明らかにすることができます。細菌培養は、溶解原性状態を最もよくサポートする条件を使用して同期され、自発的な誘導が制限されます。RT-qPCRは、増殖抑制遺伝子およびファージ制御から切り離された遺伝子を、溶解性複製サイクル中に発現する遺伝子と明確に区別します。
要約
温帯性ファージは、細菌ゲノムの大部分にプロファージとして組み込まれていることがわかっています。一部のプロファージは不可解で細菌の染色体に固定されていますが、他のプロファージは活性であり、自発的に、または誘導因子への曝露によって複製形態に引き起こされる可能性があります。プロファージは一般に、宿主細胞に毒素産生やその他の病原性関連形質を付与する能力と関連しています。最近の研究では、宿主の生理機能を変化させる上で、はるかに大きな役割を果たすことができることが示されています。今回紹介した手法により、プロファージが日和見細菌 である緑膿菌の遺伝子発現にどのような影響を与えるかを調べることができました。
この研究では、野生型の 緑膿菌 PAO1株の増殖を、リバプール流行株(LES)LESB58のプロファージの異なる組み合わせを運ぶ同原性溶解原の増殖と比較しました。溶解原体培養では、細菌細胞の一部が溶解性バクテリオファージ複製(自発的誘導)をサポートし、ファージ粒子の組み立てに関連するものなど、後期ファージ遺伝子の細胞あたりの高レベルの発現をサポートし、溶解原体制限遺伝子発現に関連する低レベルの遺伝子発現をマスクします。したがって、自発的誘導の影響により、ライソゲン集団全体の増殖遺伝子発現が不明瞭になる可能性があります。
成長プロファイリング実験は、指数関数的成長の初期には最小限であった自発的誘導を特定するために使用されました。この研究では、指数関数的増殖の初期にサンプル培養を調製する方法と、細胞数が少ないにもかかわらず適切なコントロールを設定する方法を報告しています。これらのプロトコルは、さまざまな条件下での野生型細菌と溶解原性細菌の信頼性と再現性のある比較を保証し、プロファージゲノムのトランスクリプトームプロファイリングを改善し、これまで認識されていなかったプロファージ機能の同定を支援します。
概要
近年、薬剤耐性1やCRISPR-Casを用いた遺伝子編集2に取り組むファージセラピーが、バクテリオファージ研究に新たな関心を寄せています。繰り返しになりますが、バイオテクノロジーの進歩により、バクテリアとファージの相互作用をより深く調べることが可能になりました3。しかし、ファージの治療的使用(「ファージ療法」)は、病原性および耐性遺伝子を水平方向に伝達する能力を持つ移動性遺伝要素として作用するファージに関する懸念によって妨げられている4。「暗黒物質」5(機能不明の遺伝子)の広がりは、厄介であると同時に魅力的でもあります。暗黒物質は、ファージ生物学の理解におけるギャップであり、分子ツールや潜在的な新規治療法のほとんど未開発のリソースであると考えられています6。改良された遺伝子アノテーション7,8,9および新しいペプチドフォールディングアルゴリズム10とともに、ハイスループット配列決定技術の開発は、ファージ遺伝子の検出、記述、および機能予測を改善している。しかし、科学は、培養や現実の世界におけるほとんどのファージの遺伝子機能を検証するには、まだほど遠い状態です。
RNAシーケンシング(RNA-Seq)は、ファージ感染中の遺伝子発現をグローバルにマッピングすることができ、溶解サイクルと溶解サイクルに関与するファージと細菌の両方の要素の理解を大幅に向上させました11,12。溶解過程において、温帯性ファージゲノムは細菌DNAに組み込まれ、プロファージとなる13。グローバルな遺伝子発現プロファイリング実験は、温帯ファージゲノムにコードされているが、溶解原性状態の間にのみ発現するプロファージ制限遺伝子を同定するために用いることができる11。このような遺伝子は、ファージ構造タンパク質をコードしておらず、ファージ感染プロセスに関与していません。RNA-Seqは、機能獲得を誘導したり、既存の細菌遺伝子を制御したりすることで、細菌宿主の生物学に影響を与える可能性が高い遺伝子を特定するために使用でき、多くの場合、細菌が変化する環境に適応できるようにします。したがって、プロファージが微生物の操り人形として行動し、さまざまな細菌機能を制御する能力を研究することができます。
プロファージ制限遺伝子発現の効果的な解析には、2つの大きな障壁があります。まず、影響を受けやすいホストの可用性が重要な問題です。定義上、プロファージはすでに特定の宿主ゲノムに組み込まれているため、プロファージの存在下と非存在下で全体的な遺伝子発現を比較するために感受性野生型宿主を見つけることは困難です。これは、宿主ゲノムの残りの部分を破壊することなく、別の感受性宿主のde novo感染または元の野生型分離株からのプロファージの欠失のいずれかによって達成できます。第2の障壁は、溶解原性集団の不均一性にあります。一部のプロファージは、突然変異や組換えによって分解され、細菌ゲノムの特定の場所に固定される「隠れた」状態になります。しかし、他のプロファージは「活性」であり、自発的に、または誘導因子への曝露後に、複製性の溶解サイクルに誘導される可能性があります。多くの溶解原性培養では、自発的誘導の速度は、細菌細胞の一部が常に溶解性ファージ複製を受けていることを意味します14,15,16。これらの集団における後期ファージ遺伝子の高レベルの発現は、リソゲン制限遺伝子発現に関連する低レベルの遺伝子発現を覆い隠す11,17。自発的な増殖誘導を受けるリソゲンの割合は、増殖状態、増殖条件、またはその他のトリガーによって変化し得る。したがって、プロファージが溶解原体に及ぼす影響を研究するには、溶解原性状態に有利なように増殖条件を最適化することにより、自発的なプロファージ誘導イベントを可能な限り最小限に抑える必要があります。
この研究は、緑膿菌のリバプール流行株(LES)からの一連の同生プロファージの影響を調査するために行われた準備作業を報告します。活性プロファージを誘導し、LESから単離し、モデル緑膿菌宿主株PAO116,18,19に感染させた。野生型緑膿菌株PAO1とその溶解原体PAO1Φ2の全ゲノムを(30倍の深さで)配列決定し、野生型株の同一性を確保し、溶解原が同質であることを確認しました。LESは、嚢胞性線維症患者の罹患率および死亡率の増加と関連しており、LESファージ19は、嚢胞性線維症の肺環境への適応を助けることが示唆されている16,19,20。これらのプロファージが宿主の生物学に影響を与えるという強力な証拠にもかかわらず20,21、それらの遺伝子機能の大部分は未だに特徴付けられておらず、相互作用の具体的なメカニズムは十分に理解されていません。トランスクリプトミクスのアプローチは、制御された宿主バックグラウンドにおけるプロファージ遺伝子の機能を経験的に明らかにすることができます。自発的誘導は発現プロファイルに影響を与える可能性があるため、本稿では、溶解原性状態を優先するように増殖条件を最適化する方法について説明します。このような培養の同期は、PAO1におけるLESファージ複製の重要な段階に関連する主要な遺伝子マーカーの発現レベルを定量化するために、リアルタイムPCRによって検証することができます。同じアプローチは、大腸菌11,17,21,22の運動性、耐酸性、および抗菌性耐性に影響を与える志賀毒素原性ファージのプロファージ制限機能を同定するために以前に使用されていました。
プロトコル
1. 選択可能なインジケータホストを作成します(図1)
注:ファージ培養ライセートには、元の細菌宿主由来の汚染細胞が含まれている可能性があります。抗生物質耐性の指標株を持つことで、指標株とプロファージの元の細菌宿主とを区別することができます。選択可能な指示薬株を使用すると、ファージ増幅ステップに続いてリソゲン細胞からファージを除去するための遠心分離またはろ過ステップを必要とせずに、感染性ファージ粒子の正確な計数が可能になります。また、選択可能なインジケータホスト株は、ファージの列挙の時間とステップ数を減らし、複数の条件を同時に試すことができます。
- 目的の温帯ファージによる溶解性および溶解原性感染の影響を受けやすい適切な指標宿主株を特定します。緑膿菌のラボ株PAO118,20を使用し、3つのLESファージ(LESΦ2、LESΦ3、およびLESΦ4)に感受性があります。
- 適切な選択剤(ここではリファンピシンを使用)を選択し、培養液希釈アッセイを実施して、指示薬宿主の最小発育阻害濃度(MIC)を決定します(16 μg·mL-1はPAO1のMICです)23,24。
- 指示薬宿主培養物を、MIC未満(この場合は5μg·mL-1)から開始し、振とうを伴いながら、37°Cで、18〜24時間、リソジェニーブロス(LB)中の選択的薬剤の濃度の上昇に順次さらします。
- MICが十分に増加するまで、1:100の比率(接種物と培地)で最高濃度で増殖した培養物を、選択剤の2倍に増加した濃度(毎回18〜24時間)に移します。PAO1は、300 μg·mL-1リファンピシンでリファンピシン耐性株(PAO1-RifR)となった。
2. 自発的帰納の時間的直接列挙(図2)
- 5 mLのLBに単一のコロニーを接種することにより、ライソゲン(例:LESファージを有する 緑膿菌 PAO1リソゲン)と指標宿主(PAO1-RifR)の両方の一晩スターター培養をセットアップし、180 rpm(18〜24時間)で振とうしながら37°Cでインキュベートします。
- 100 mL の LB に 1:100 の割合で一晩培養を接種し、新鮮なライソゲンおよび指標宿主培養をセットアップし、37 °C で振とう(180 rpm)しながらインキュベートします。
- OD600 と Miles Misra 法25 を使用して生存数を測定することにより、リゾゲンの成長を監視します。これを行うには、接種時点から8時間ごとに各リゾゲン培養物から1 mLのサンプルを採取します。
- 採取後すぐに、100 μLのサンプルを各培地の900 μLに添加して段階希釈します。最高速度でよくボルテックスし、希釈ごとにチップを捨て、希釈系列を10-1から10-9まで続けます。
- 必要な希釈液10 μLを3回に分けてLB寒天プレートにスポットし、乾燥させ、37°Cで18〜24時間インキュベートします。
- 生菌細胞の数を計算するには、簡単に数えられるコロニーを持つ希釈液を見つけます。各スポットのコロニーの数を数え、次の式を使用します。

注:ライソゲン培養物が増殖するにつれて、活性バクテリオファージ粒子が自発的誘導によって生成されます。感染性ファージの産生は、溶解性ファージ集団のトランスクリプトームが、溶解性ファージ複製シグナルおよび対応する宿主細胞応答からの溶解性複製サイクル関連遺伝子発現で汚染されることを意味します。したがって、データセット内のバックグラウンド転写ノイズ(溶解性ファージトランスクリプトームによって生成される)を可能な限り制限するために、遊離感染性ファージ粒子に対する溶解原性細胞の割合が最も高い増殖段階を特定することが重要です。
- 各側頭サンプル中の感染性ファージ粒子を列挙するには、適切な選択剤(PAO1宿主のMICがわずか16μg·mL-1であるため、この場合50μg·mL-1リファンピシン)の存在下で、LB(上部寒天培地)中の滅菌0.4%細菌寒天培地5 mLを100 μLの中指数位相指示宿主(OD600:0.4–0.5;この場合はPAO1-RifR)を接種します。 行 8 と行 9)
- 同じ段階希釈液(ステップ2.2.2を参照)10 μLを接種した上部寒天層にスポットし、乾燥させてから37°Cで18〜24時間インキュベートします。
- 感染性ファージ粒子を計算するには、簡単に数えられるプラークを含む希釈液を見つけます。各スポットのプラークの数を数えます。

- CFU(コロニー形成単位)ごとの自発的誘導が、さらなる実験ステップで最小になる時間/条件を見つけます。
3. RNA抽出のための非誘導および誘導ライソゲン培養の調製(図3)
- 5 mLのLBにリゾゲンの単一コロニーを接種して新鮮な一晩培養を行い、37°Cで振とう(180 rpm)で18〜24時間インキュベートします。
- 8つの250 mLフラスコで80 mLのLBで1:100の比率で一晩培養します。
- 最初のフラスコに「非誘導」、他のフラスコに「誘導」のラベルを付け、各サンプルを回収する時点(つまり、「誘導t = 0」、「誘導t = 10分」、「誘導t = 20分」など)を付けます。 図3)。
- 90分間のインキュベーション後、OD600 が0.1〜0.2の間、または自発誘導が最小の場合(説明を参照)、4 μLの1%氷酢酸(v/v)を非誘導フラスコに加えます(図3)。
注:本作業における誘起剤は、溶媒として1%氷酢酸を用いて作製したので、同量の溶媒を単独で添加し、対照工程とした。代替的なコントロールは、異なるインデューサーの調製に応じて考慮され得る。 - 誘導されていないフラスコから80mLの培養物を720mLの滅菌LBに加え、直ちに培養液(氷冷5%[v/v]フェノール、pH 4.3、95%[v/v]エタノール)を培養容量の20%(160mL)を用いて添加し、最低30分以上2時間以内で氷上でインキュベートしてRNA転写物を安定化させる12。26,27。これは誘導されていないサンプルです。
- 適切な誘導剤(この場合、25 mg·mL-1ノルフロキサシン、1%氷酢酸[w/v]で調製、最終濃度1 μg·mL-1で使用)のMICで7つの250 mLフラスコ(図3)に残りの培養を誘導し、よく混合し、37°Cで180rpmで1時間振とうしながらインキュベートします。
注:このステップでは、溶解原培養液をより調整された溶解性複製状態に強制します。培養中のほとんどの細胞は、感染性ファージ粒子の溶解産生を受け始めます。 - 誘導フラスコから80 mLの培養液を720 mLの滅菌LBに添加して細胞を回復させ、誘導剤を効果的に希釈します。ステップ3.5で述べたように、停止溶液を添加することにより、時間0から1時間まで10分ごとに各フラスコから細菌細胞を採取します。
注:停止溶液は、RNAを最大2時間安定化させます。ただし、サンプルの安定性を高めるには、以降のすべてのステップを4°Cで行ってください。 - RNAの分解を避けるため、処理後2時間を超えないように、できるだけ早く10,000 x g で4°Cで15分間遠心分離して回収してください。
- 上清を廃棄し、各サンプルを1.5 mLのマイクロチューブに移す前に、調整可能な自動ピペットを使用して残留液中に細菌ペレットを静かに再懸濁します。
- 4°Cのマイクロチューブで高速(13,000× g)で1分間遠心分離し、残った上清を廃棄します。
- 密封された各マイクロチューブを液体窒素に浸して、ペレットを瞬間凍結します。これは、RNA抽出のための細胞の効率的な溶解を助けます。
- 各凍結ペレットにTRIzol(1 mL)を添加し、ピペッティングで懸濁液をホモジナイズします(ボルテックスしないでください)。すべてのサンプルのRNA抽出を行う準備ができるまで、-80°Cで保存します。
注: この時点でプロトコルを一時停止できます。 - ステップ 3.1 から 3.13 を 3 回の生物学的複製で繰り返します。
4. 非誘導および誘導ライソゲン培養からのRNAの単離
重要:これらの手順はすべて、RNaseフリー環境で実行する必要があります28。ワークベンチは、10%NaClOまたは独自のRNase不活性化剤で拭き取る必要があります。実験器具はDEPC処理などのRNase阻害剤で処理し、すべての反応にヌクレアーゼフリーの水を使用する必要があります。
- ステップ3.12で凍結したTRIzol処理ペレットを氷上で解凍し、400 μLの分子生物学グレードのクロロホルムを加えます。
- バイアルを10秒間反転させてよく攪拌し、すべての細胞の溶解を完了します(ボルテックス しないでください )。その後、室温(21°C)で2〜5分間インキュベートします。
- 冷蔵卓上型マイクロフュージを使用して、4°C、13,000 x g で15分間遠心分離することにより、TRIzol/クロロホルム混合物から水層を分離します。
- 1,000 μLのピペットを使用して、中間相または有機相(最下層)を乱さないように注意しながら、水相(~500μL、最上層)を回収します。新しい1.5 mLマイクロチューブに移します。
- 分離した水相に450 μLの分子生物学グレードのイソプロパノールを加え、反転させてよく混合し(ボルテックス しないでください )、室温(21°C)で30分間インキュベートします。
- 冷蔵遠心分離機を用いて、4°C、13,000 x g で30分間遠心分離することにより、RNAを回収します。
- RNAペレットを乱さずに上清を廃棄し、ヌクレアーゼフリー水で調製した70%エタノール800μLでペレットを2回洗浄します(ピペットで上下にピペットしないでください)。各洗浄後に遠心分離ステップを5分間繰り返すことにより、RNAペレットの安定性を確保します。
- エタノールを捨て、ペレットを風乾します。
注:10 μLのマイクロチップを使用してペレットの周囲にエタノールを注意深く吸引し、清潔な吸い取り紙の上でチューブを反転させてペレットを乾燥させます。RNAペレットは無色に変わり、エッジはフリル状で見えるはずです。乾燥が少なすぎると、下流工程に影響を与える可能性のある残留エタノールが残る可能性があり、ペレットの乾燥が多すぎると再懸濁が困難になる可能性があります。 - RNAをヌクレアーゼフリー水(50 μL)に再懸濁し、サーモシェーカー上で65°C、間欠混合(30秒ごと)しながら合計3〜5分間インキュベートします。
CRITICAL:RNAの2'-OH基は、65°Cを超える高温および高pHでRNA鎖のオート切断を触媒することができます。65°C以下の温度では、残留DNAの再懸濁が遅れるため、DNase I消化後の段階で消化しなければならないDNAの量が制限されます。したがって、最良のサンプルを得るためには、温度を65°Cに保つことが重要です。
注:この時点でプロトコルを一時停止し、サンプルを-80°Cで保存できます。
5. DNase処理によるRNAからの汚染DNAの除去
- 第一鎖cDNA合成前に全RNAから汚染DNAを除去するには、0.1容量の10x DNaseバッファーと1 μLのDNase酵素を10 μgのトータルRNAに加えます。チューブを穏やかに混合し、37°Cで30分間インキュベートします。
- DNase不活化試薬を再懸濁し、最低2 μLまたは総反応容量の10%の容量を添加します。よく混合し、DNase不活化試薬の再分散中にサンプルを室温(21°C)で5分間インキュベートします。
- 卓上型微量遠心分離機を用いて、10,000 × g で1.5分間遠心分離することにより、DNase試薬をペレット化します。
- RNAを含む上清をペレットを乱すことなく新しいチューブに移します。
注:製造元の指示に従って、1 μLスケールのUV分光光度計とマイクロ流体ベースの核酸コンピューター分析装置を使用してRNAの品質を確認します。精製されたトータルRNAは−80°Cで保存できます。 qRT-PCRの場合、この時点でRNAを直接使用できます。RNAシーケンシングなど、厳格なサンプル品質を必要とする、より感度の高いダウンストリームプロセスでは、A260/230 比のε 2.0に達する必要があります。 - ヌクレアーゼフリー水を使用して、DNAフリーRNA溶液の容量を500 μLに構成します。
- ヌクレアーゼフリーの3 M酢酸ナトリウム(pH 5.3)50 μLとイソプロパノール495 μLを加えます。よく混合し、室温で30分間インキュベートします。
注:このステップでは、RNAが沈殿します。 - 13,000 x g 、4°Cで30分間遠心分離してRNAを回収します。
- RNAペレットを氷冷した70%エタノールで3回洗浄し、各洗浄後にサンプルを13,000 x g 、4°Cで5分間遠心分離し、塩を完全に除去します。
- メーカーの指示に従って、1 μLスケールのUV分光光度計とマイクロ流体ベースの核酸コンピューター分析装置を使用してRNAの品質を確認します。精製されたトータルRNAは−80°Cで保存できます。
注:ガイド29 は、RNA品質基準を達成するために使用されました。A260/230 の比率が<2.0の場合は、手順5.5〜5.9を繰り返します。
6. DNaseフリーRNAの定性・定量解析
- 1 μgのトータルRNAで16S rRNAプライマー(表2)を用いて定量PCRを行い、各サンプルのDNase処理の効率を検証し、増幅産物が産生されないことを確認します。
注:gDNAコンタミネーションを評価するための理想的なプライマーは、原核生物のイントロン-エクソン接合部または調節領域、または転写的に不活性な部位でアニーリングするように設計されたプライマーです30,31。 - 製造元の指示に従って、マイクロ流体ベースの核酸コンピューター分析装置を使用して RNA 完全性数 (RIN) を決定します。
注 : RIN ≥ 9 を示すサンプルは、1 本鎖合成に使用する必要があります。RIN<9を示すサンプルは破棄し、分離手順(1.1〜5.4)を繰り返す必要があります。 - HS RNAアッセイキットと蛍光度計を使用して、メーカーの指示に従って総RNA濃度を定量します。
7. 第一鎖cDNA合成
- 1 μgのトータルRNAと1 μLのランダム六量体(50 ng·μL-1)および10 mM dNTPミックス1 μLを混合して、各サンプルのRNAプライマー混合物を調製します。次に、ヌクレアーゼフリー水を使用して総容量を10μLに調整します。
- 反応液を65°Cで5分間インキュベートし、氷上に1分間置きます。
- 2 μL の 10x RT バッファーを添加して、各サンプルの cDNA 合成ミックスを調製します。4μLの25mM MgCl2;2 μL の 0.1 M DTT;1μLのRNase阻害剤(40U·μL−1);1μLの逆転写試薬(200U·μL-1)を示された順序で。
- cDNA合成ミックスをRNA/プライマー混合物に加えます。穏やかに混合し、サンプルを短時間遠心分離して、チューブの底にある成分を回収します。
- サンプルを25°Cで10分間インキュベートし、続いて50°Cで50分間インキュベートして、混合物をプライミングします。 85°Cで5分間インキュベートして反応を終了し、氷上で冷却します。
- 各チューブにRNase H 1 μLを添加し、37°Cで20分間インキュベートして、DNA:RNAハイブリッドからRNAを除去します。
- 最後に、cDNA合成反応液を総容量80 μLに希釈し、さらに使用するまで-80°Cで保存します。
注: この時点でプロトコルを一時停止できます。
8.バクテリオファージ複製の異なる段階を示すマーカー遺伝子の発現レベルを決定するための標準曲線と量的(q)-PCR
- 目的のファージの複製の各段階のマーカーとして作用し得る標的遺伝子のセットを同定する。我々の場合、これらは 表2に詳述されているとおりである。
- 関連するプライマーを使用し、以下の増幅条件でPCRを使用して、テンプレートゲノムDNAから標的遺伝子のそれぞれを増幅します:95°Cで2分間の初期変性。95°Cで30秒間変性。プライマーに応じた最適なアニーリング温度(ここでは58°Cを使用)で30秒間アニーリングします。72°Cで1分間伸長。72°Cで5分間伸長します。
- PCR精製キットを使用して各アンプリコンを精製し、メーカーの指示に従ってTAクローニングベクターでクローニングします。サンガーシーケンシングにより、各クローニング産物の配列を確認します。
注: この時点でプロトコルを一時停止できます。 - 個々のプラスミドのコピー数は、以下の式20を使用して計算します。
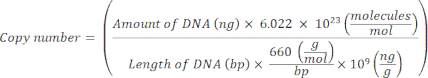
- プラスミドDNAを分子グレードヌクレアーゼフリーの滅菌H2Oで109コピー/μLから102コピー/μLに段階希釈することにより、各マーカー遺伝子の標準テンプレートを調製します。
- 各サンプルに 1 μL の cDNA(ステップ 7.7 から)を 3 つずつ、それぞれのプラスミド標準を 3 つに分けて、優先 qPCR システムに関するメーカーの指示に従って定量 PCR を実施します。各ターゲットの96ウェルプレートでPCRを実施します。
- Log DNAコピー数(x軸)とサイクル閾値(y軸、Ct)をプロットし、ExcelやRなどの適切なプラットフォームを使用して線形回帰計算を実行し、決定係数(R2)と線形方程式を表示します。
注:決定係数は0.98以上である必要があります。 - 線形回帰(ステップ8.7)から導出された線形方程式(y = mx + b)を使用して、各ターゲットのコピー数を推定します(yは推定Ctです)。xは対数DNAコピー数です。mは線の傾きであり、DNAコピー数に対するCtの変化を定義します。bは、1つのDNAコピー32について推定されたCtを表すy軸切片である。
- 各マーカー遺伝子について、検量線の線形回帰のパラメータと次の式(mはステップ8.7およびステップ8.8から導出された傾き)を使用して、PCR増幅の効率(E)を計算します。
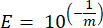
- 次の式を使用して、効率率の観点からすべてのプライマーを検証します。
注意: 効率は90%〜110%の範囲である必要があります。
- DNAの絶対コピー数は、次の式を使用して計算します。
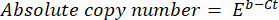
ここで、 Ct (ステップ8.8)はサイクル閾値、 b はインターセプト(ステップ8.8)、 m はスロープ(ステップ8.8)、 E はPCR増幅の効率(ステップ8.9)です。
CRITICAL:q-PCRによる2つ以上のターゲットの増幅を比較する場合、DNAコピーの絶対数を比較するために、ターゲットごとにPCR効率を計算する必要があります。 - 本研究では、16S rRNA、proC、およびrpoD遺伝子を一般的な内部コントロールとして使用し、gyrBを誘導コントロールとして使用しました33,34,35。
注:RNA seqデータから内部コントロールを選択する場合は、試験した条件で発現レベルが変化しない内部コントロールを選択するのが最善です。適切なコントロールを慎重に検討することは、結果を有意義に解釈するために常に重要です。
結果
この研究では、非誘導条件下で増殖したPAO1 LESΦ2リゾゲン培養物からのファージ産生の直接時間的列挙を使用して、自発的なLESΦ2誘導の影響を決定しました。ファージ密度は最低点で、増殖の初期の指数関数的な段階の新鮮培地での継代培養後、平均は~2.61 x 106プラーク形成単位(PFU)·mL-1 2時間であり、リソジェニーが支配的な状態であったことを示唆しています。LESΦ2力価は、4時間以内に平均~2.4 x 108 PFU·mL−1まで急激に上昇し、6時間後には最高密度に達しました(平均:~5.83 x 109 PFU·mL−1;図4)。
最小限の自発的誘導は、リゾゲン増殖の初期の対数期(2時間後)に観察されました。.しかし、培地中のファージの存在が測定可能であったのは、核酸のタンパク質ヘッドへのパッケージング、ファージ粒子へのタンパク質の組み立て、後期ファージ遺伝子、中期ファージ遺伝子、および初期調節ファージ遺伝子の発現など、多くの先行イベントの結果でした。ファージ関連複製イベントの発現前に感染細胞を捕捉することが重要でした。したがって、誘導前に培養を成長させるために90分が選択されました。PAO1の遺伝子発現プロファイルを捕捉するために、ステップ3.4で述べたように、培養物からLESΦ2リソゲンサンプルを90分間にわたって導入前および誘導後に回収しました。この 90 分間の時点は、常在菌の高レベルの自発的誘導がステップ 2.3.2 のプラーク アッセイによって検出されるかなり前の時点です。初期の指数関数的増殖では細菌細胞密度が低かったため、遺伝子発現研究のための十分な材料を確保するために、培養量を800 mLにスケールアップしました。サンプルは、10分ごとに非誘導培養および誘導培養から収集され、RNAを抽出して、細菌増殖中の溶解および溶解性複製の主要なマーカーの発現プロファイルをマッピングしました。 16S rRNA遺伝子を標的とするqPCRアッセイを用いて、トータルRNAを精製し、ゲノムDNAが存在しないことを検証しました(ステップ6.1)。RIN ≥ 9に到達したサンプルは品質管理に合格し、cDNAに変換されました。
アノテーションされたLESΦ2ゲノムを調べて、温帯ファージの溶解原性および溶解性複製サイクルでよく知られているプレーヤーである遺伝子を特定しました。次に、これらの同定された遺伝子を使用して、誘導培養および非誘導培養からの溶解原サイクル制限遺伝子および溶解サイクル関連遺伝子の発現プロファイリングのためのqRT-PCRを検証しました。DNAコピーの絶対数を定量化し、R36を用いてWilcoxon符号ランク試験を実施して、非誘導培養と誘導培養の発現レベルを比較しました(図5)。cro遺伝子(溶解性複製の初期マーカー)の発現が、誘導されていない培養では~2.31 x 109コピーから、誘導後30分で~3.02 x 1011コピー(Wilcoxon符号ランク検定:p < 0.01)に顕著に増加しました。同様に、溶解性複製の中間段階マーカーである(ファージゲノム複製に関与すると予測されている)Oタンパク質とPタンパク質も、~1.74 x 108から~1.25 x 10 10コピー(Wilcoxon符号ランク検定:p < 0.01)および~6.05 x 102から~5.68 x10 5コピー(Wilcoxon符号ランク検定: p < 0.01)をそれぞれ参照してください。最後に、尾部に関連する構造遺伝子を溶解性複製サイクルの後期マーカーとして使用しました。ここでも、誘導されていない培養では~2.31 x 106コピーから、誘導後30分で~4.38 x 108コピーに発現が有意に増加しました(Wilcoxon符号順位検定:p < 0.01)。このように、定量的なRT-PCRデータにより、溶解性複製のための確立されたマーカー遺伝子の遺伝子発現は、予測された順序で多倍の差異的発現を示すなど、予想された傾向に従うことが確認されました(図5)。溶解性複製のマーカーの発現は回復後30分でアップレギュレーションされたため、これは溶解サイクル中の活性温帯ファージとその細菌宿主のトランスクリプトームランドスケープを研究するための適切な代表的な時点であると考えられています。
非誘導条件下で溶解性遺伝子の発現を観察し、初期の対数期にCFUと放出されたPFUの比率が最も高い最適化された培養でも、何らかの自発的誘導が常に起こることを確認しました。これは、トランスクリプトミクスデータには常にある程度の「ノイズ」が存在することを意味し、誘導培養と非誘導培養を含む、慎重に準備されたコントロールの重要性を裏付けています。発現の倍数変化を決定するための内部対照遺伝子の適切な選択は、トランスクリプトミクスデータを注意深く調べて、非誘導サンプルと誘導サンプルの両方で同じレベルで発現している遺伝子を特定することに依存しています。我々の予備的な結果は、rpoDが試験された最も信頼性の高いコントロール遺伝子であり、最も安定した発現を有することを示唆している(誘導前~1.71 x 10 5コピー、誘導後30分で~3.33 x 105コピー;Wilcoxonの符号順位検定:p = 0.3594)を16S rRNAまたはproC遺伝子と比較しました(図5)。内部統制の発現のばらつきは、転写産物の絶対数の測定につながりました。トランスクリプトミクスデータの今後の調査は、さらなる検証のための適切な内部統制の選択をサポートします。
cI遺伝子は、ライソジェニーのマーカーとしてよく知られているため、遺伝子プロファイリングの演習で使用されました。溶解性複製のマーカーと比較して、cI遺伝子の発現は比較的安定していましたが(図5)、この遺伝子のコピー数は、溶解性複製のマーカーと比較して、非誘導培養で安心できるほど高かった。これらのデータは、同じサンプル中のPFU値の低さと一致しており、リプレッサーの発現が高いほどファージ産生のレベルが低いことが確認されています。ここで報告されたデータは、Stxファージに見られるように、この特定のファージのcI転写産物の発現が誘導後に有意にダウンレギュレーションされていないことを示しています11,17。リプレッサー活性は通常、転写レベルと翻訳後レベルの両方で制御されているため、リプレッサー遺伝子は転写できますが、結果として得られるタンパク質はすぐに自己切断されます。転写および翻訳後コントロールを検証するには、さらなる実験が必要です。さらに、検量線から、qPCRの最小検出限界は~102コピーであるように思われます。
プラークアッセイとqRT-PCRアッセイから得られた知見は、RNA-Seq実験のための適切に制御されたインプットを生成するための培養およびRNAサンプル調製に関する当社の戦略を実証するものです。初期の指数関数的段階の非誘導培養物は、自発的誘導および溶解性遺伝子発現のレベルが低く、溶解性が優勢であることを示唆しています。対照的に、誘導後30分で単離された培養物では、溶解性複製の優性を示すマーカー遺伝子の発現が有意に増加しました。
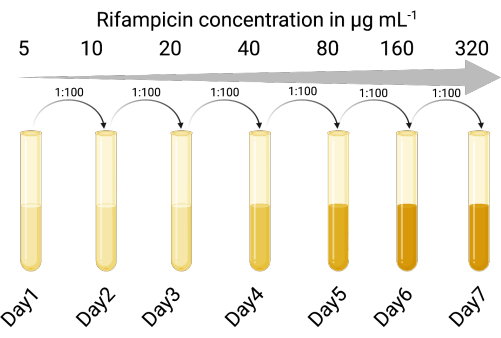
図1:リファンピシン耐性インジケーターホストを作成するためのプロトコル(BioRender.com で作成)。 この図の拡大版をご覧になるには、ここをクリックしてください。

図2:同じサンプルからリゾゲンのPFUとCFUを列挙するための実験計画。 (BioRender.com で作成)この図の拡大版をご覧になるには、ここをクリックしてください。
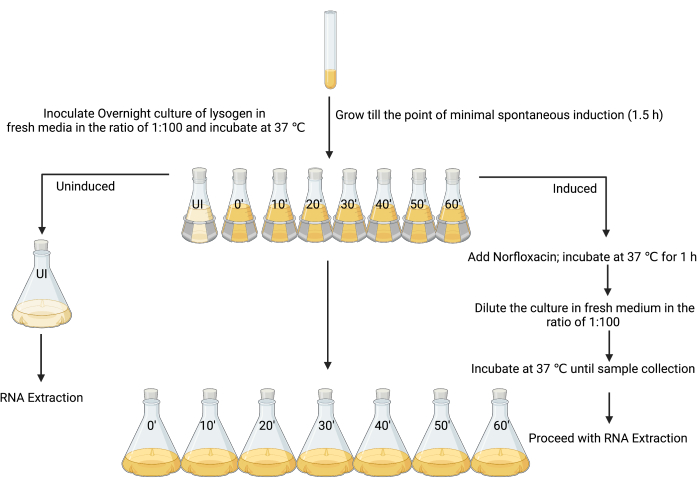
図3:RNA単離のための誘導培養と非誘導培養のサンプリングの実験計画。 (BioRender.com で作成) この図の拡大版をご覧になるには、ここをクリックしてください。
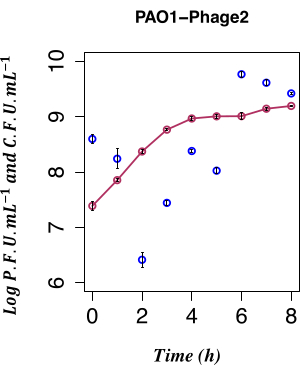
図4:自発的帰納の時間的列挙。PAO1 Φ2 リゾゲンからの PFU と同時 CFU、n = 8 (2 つの生物学的複製と 4 つの技術的複製);誤差範囲は標準偏差を表します。暗赤色の点は、LBのCFU・mL−1 を示します。濃い青色の点はLBのPFU・mL−1 を示す。ライソゲンによるφ2感染性ファージの自然放出は、接種後2時間で測定可能な最低レベルです。. この図の拡大版をご覧になるには、ここをクリックしてください。

図5:標的マーカー遺伝子の絶対コピー数。ファージマーカー遺伝子の絶対コピー数は、RT-qPCRを用いて、溶解および溶解サイクルにおいて重要な役割を果たすと予想される遺伝子の予測発現パターンを裏付けています。ドットは、3 つの生物学的反復と 3 つの技術的反復の両方を表します (n = 9)。(ア)赤いボックスは、リソジェニーマーカーcIを表します。(B)緑色は、初期の溶解マーカーであるcroを表す。(C、D)青は中間溶解性マーカー、DNA複製遺伝子を表す。(e)マゼンタは、後期溶解マーカー、尾部構造遺伝子を表す;(F–H)灰色は内部コントロールとして用いた宿主マーカー、(I)白色は誘導コントロール用としたDNAジャイレースB。横実線は分布の中央値を示します。この図の拡大版をご覧になるには、ここをクリックしてください。
表1:この研究で設計されたプライマー。 本研究で用いたマーカー遺伝子および内部コントロールの特異的プライマーの配列を、対応するNCBIアクセッションIDとともに提供します。 この表をダウンロードするには、ここをクリックしてください。
表2:この研究で使用したプライマーの効率は、qPCR標準曲線を使用して計算されました。この表をダウンロードするには、ここをクリックしてください。
ディスカッション
緑膿菌MC106137,38,39からのStxファージの自発的誘導をより正確に定量化するためにプラークアッセイで以前に使用された選択可能な指標宿主の作成は、緑膿菌ファージLESΦ2についてここに記載されています。この介入には、サンプル処理のステップと時間が短縮され、複数の培養条件での自発的な誘導率の同時評価が可能になるという利点もあります。リファンピシン耐性変異体の作成中に他の変異を生じさせるリスクがある40。ただし、この研究では、進化した株は、目的の培養物からのプラークを列挙するための指標宿主としてのみ使用され、トランスクリプトーム分析には含まれていませんでした。選択可能な指標株が目的のファージによる感染に対して等しく感受性である限り、他の後天性変異についての懸念はありません。それにもかかわらず、PAO1WTおよびPAO1RIFのパルスフィールドゲル電気泳動(PFGE)分析では、制限フラグメント長多型プロファイルに差は検出されませんでした(データは示していません)。
宿主細胞を選択する際、まだ増殖物を保有していない指標株を見つけることはまれです。その好例として、PAO1は糸状のプロファージPf4を保有しています。この研究の実験的コントロールは、特定のファージ(この場合はLESプロファージ2)の遺伝子発現と、このファージが細菌の遺伝子発現に及ぼす影響を直接調べることができるように設計されています。LESプロファージ2を保有するPAO1とLESプロファージ2を欠損するPAO1(リゾゲンと非リソゲンの両方が内因性Pf4を保有)の比較では、宿主に対するPf4の影響を排除するための内部コントロールとして機能します。さらに、Pf4は通常、その宿主細胞41 において溶解を引き起こさず、したがって、これらの実験の結果を混乱させることができないことが実証されている。
有意義なオミクスデータを生成するためのサンプル調製において、慎重な品質管理が重要であることは十分に確立されている42。しかしながら、前述したように11、そのような研究のためのリゾゲン培養物の調製におけるプロファージ活性の慎重な特性評価はめったに行われない。ここでは、細菌と温帯ファージの相互作用をよりよく探索するために、トランスクリプトーム研究のために適切に制御され最適化された培養セットを調製するための体系的なプロトコルについて詳しく説明します。個体群の同期性は、抗生物質ノルフロキサシンを誘発して処理する前に、少なくとも4回の倍増によって培養物を持ち込むことによって制御されました。研究中の菌株のノルフロキサシンのMICを決定することにより、誘導剤の濃度が「誘導」治療のMICをわずかに上回っていることを確認できます。処理された細胞は、細胞が回復し、バクテリオファージ複製プロセスを完了し、細胞の溶解と感染性バクテリオファージ子孫の放出で終わるようにするために、1時間の処理後にMICの下でノルフロキサシン濃度を下げるために1:10を希釈しました。細胞はnorfloxacinの集中が回復期間の間にMICの下に持って来られた後だけ誘導の刺激に続く溶解性の複製周期に入ります。この場合、1 μg·mL-1ノルフロキサシンを超えることは、PAO1のノルフロキサシンのMICが0.19 μg·mL-1であるため、薬物がMICの下で効果的に希釈できなかったことを意味します。インデューサーの希釈レベルは、リゾゲン回収の必要性とRNAを回収するための培養密度の保持とのバランスをとる必要があります。ここで取り上げたデータは、培養を同期させてライソジェニーが優勢なサンプルを作製することで、自然誘導によるノイズを低減し、ライソジェニーによる遺伝子発現の真の変化を検出できることを実証しています。細菌細胞密度が低い指数関数的増殖初期では溶解原性状態が優勢であるため、RNA-Seqなどのその後の遺伝子発現研究に十分なRNAを収穫するために培養をスケールアップすることをお勧めします。
培養物を溶解サイクルに強制するための誘導剤としてのノルフロキサシンの使用は、よく報告されています43,44。しかし、これはプロセスにおける他の細菌遺伝子の発現にも影響を与えるであろう45,46。これを軽減するには、同じ誘導条件と非誘導条件で増殖させた対照野生型培養由来のRNAライブラリーをRNA-Seq実験に含める必要があります。qRT-PCRによるファージ複製の段階を検証するための内部コントロールとキーマーカー遺伝子の使用も、正確な比較のために重要です。定量的RT-PCRプロファイリングは、さまざまな時点での各遺伝子の転写産物の絶対数を比較することによって解釈することはできません。重要なのはプロファイルの形状です。第一に、どの遺伝子の転写産物でも1つの小さな領域しかサンプリングされていないため、それが短命な要素なのか、より長い寿命の要素なのかは不明です27。確かに、転写産物のRNA-Seqマッピングは、マッピングデータの密度が遺伝子の長さにわたって大きく変化することを示しています。第二に、溶解周期または溶解原性ライフスタイルに関連するマーカー遺伝子について解釈されるべき、あるいはファージ調節回路から切り離されたマーカー遺伝子について解釈されるべきであるのは、遺伝子発現プロファイルの形状である11。自然誘導は、ライソゲン培養における真の問題であり、常に溶解周期関連遺伝子の発現をもたらします。しかし、プロファイリングは、溶解性複製サイクルに関連する遺伝子が、その発現前誘導(少なくとも2つの対数フォールド)で抑制され、誘導後にアップレギュレーションされることを示しています。
Stxファージと大腸菌との相互作用のトランスクリプトーム解析は、溶解性の維持と溶解サイクルの引き金となるファージ遺伝子の完全な理解を裏付けている11,17。現在、緑膿菌のLESファージにアノテーションが付けられているが、その重要な遺伝子機能はあまりよくわかっていない。トランスクリプトーム研究により、LESプロファージの再アノテーションが可能になり、溶解と溶解サイクルに関与する遺伝子の理解が深まります。遺伝子配列を機能に結びつけることは、新規プロファージの研究における大きな課題であり、より良いアノテーションツールを製造するために、ファージ遺伝子の機能を確認するためのさらなる研究の必要性をさらに強調している47。このビデオ記事で詳述されているプロトコルのより広範な適用と適応、および追加の品質管理手段は、さまざまなプロファージ機能を明らかにするのに役立ち、したがって、アノテーションパイプラインを改善し、ファージと細菌の生物学の理解を変革する可能性があります。
資料
| Name | Company | Catalog Number | Comments |
| PAO1 | 6 | ||
| LESB58 | 6 | ||
| LES phages | Induced and purified from LESB58 using Norfloxacin. | This study | |
| Lysogeny Broth (LB) | Merck | 1.10285.500 | |
| LB Agar | Merck | 1.10283.500 | |
| Agar Agar | Fisher | A/1080/53 | |
| Top Agar | 0.4 g Agar Agar+2.5 g LB Broth in 100 mL water; autoclave and use. | - | |
| Rifampicin | Sigma (Stock: 50 mg/mL in Methanol- Mix well and use 0.22µm filter to sterilize and store it in -20°C until use) | R3501 | |
| Glacial Acetic Acid | Fisher 1% (v/v) in water | 10060000 | |
| Norfloxacin | Sigma (Stock: 25 mg/mL of 1% Glacial Acetic Acid-Mix well and use 0.22µm filter to sterilize and store it in -20°C until use;To avoid freeze thaw cycles, store as small aliquotes) | N9890 | |
| Phenol saturated with citrate buffer pH 4.3 | Sigma | P-4682 | |
| Molecular Biology grade Ethanol | Fisher | 16695992 | |
| TRIzol | Invitrogen | 12044977 | |
| Chloroform | Fisher | 11398187 | |
| Isopropanol | Fisher | 17150576 | |
| Nuclease-free H2O | Invitrogen | 10526945 | |
| 10X TURBO DNase | Ambion | AM1907 | |
| Qubit RNA HS, BR Kit | Invitrogen | Q10210 | |
| Agilent RNA 6000 Nano Kit | Agilent | 5067-1511 | |
| SuperScriptIII first strand synthesis kit | Invitrogen | 18080051 | |
| PCR Reagents | Bioline Mytaq Red 2X | BIO-25043 | |
| qPCR Reagents | Sensifast SYBR Hi Rox | BIO-92020 | |
| PCR purification kit | Isolate II PCR and Gel Kit | BIO-52060 | |
| TA cloning kit | TA Cloning Kit, with pCR 2.1 Vector, without competent cells | K202040 | |
| StepOne Real Time PCR system | Thermo Fisher Scientific | 4376600 |
参考文献
- Lin, D. M., Koskella, B., Lin, H. C. Phage therapy: An alternative to antibiotics in the age of multi-drug resistance. World Journal of Gastrointestinal Pharmacology and Therapeutics. 8 (3), 162-173 (2017).
- Jiang, W., Marraffini, L. A. CRISPR-Cas: New tools for genetic manipulations from bacterial immunity systems. Annual Review of Microbiology. 69 (1), 209-228 (2015).
- Santos, S. B., Azeredo, J. Bacteriophage-based biotechnological applications. Viruses. 11 (8), 737 (2019).
- Rodríguez-Rubio, L., Jofre, J., Muniesa, M. Is genetic mobilization considered when using bacteriophages in antimicrobial therapy. Antibiotics. 6 (4), 32 (2017).
- Hatfull, G. F. Dark Matter of the biosphere: The amazing world of bacteriophage diversity. Journal of Virology. 89 (16), 8107-8110 (2015).
- Yukgehnaish, K., et al. PhageLeads: Rapid assessment of phage therapeutic suitability using an ensemble Machine Learning approach. Viruses. 14 (2), 342 (2022).
- Seemann, T. Prokka: Rapid prokaryotic genome annotation. Bioinformatics. 30 (14), 2068-2069 (2014).
- Arndt, D., et al. PHASTER: A better, faster version of the PHAST phage search tool. Nucleic Acids Research. 44, W16-W21 (2016).
- Banerjee, S., et al. FINDER: An automated software package to annotate eukaryotic genes from RNA-Seq data and associated protein sequences. BMC Bioinformatics. 22 (1), 205 (2021).
- Jumper, J., et al. Highly accurate protein structure prediction with AlphaFold. Nature. 596 (7873), 583-589 (2021).
- Veses-Garcia, M., et al. Transcriptomic analysis of Shiga-toxigenic bacteriophage carriage reveals a profound regulatory effect on acid resistance in Escherichia coli. Applied and Environmental Microbiology. 81 (23), 8118-8125 (2015).
- Owen, S. V., et al. A window into lysogeny: revealing temperate phage biology with transcriptomics. Microbial Genomics. 6 (2), e000330 (2020).
- Davies, E. V., Winstanley, C., Fothergill, J. L., James, C. E. The role of temperate bacteriophages in bacterial infection. FEMS Microbiology Letters. 363 (5), 015 (2016).
- Livny, J., Friedman, D. I. Characterizing spontaneous induction of Stx encoding phages using a selectable reporter system. Molecular Microbiology. 51 (6), 1691-1704 (2004).
- Fogg, P. C. M., et al. Identification of multiple integration sites for Stx-phage Φ24B in the Escherichia coli genome, description of a novel integrase and evidence for a functional anti-repressor. Microbiology. 153 (12), 4098-4110 (2007).
- James, C. E., et al. Differential infection properties of three inducible prophages from an epidemic strain of Pseudomonas aeruginosa. BMC Microbiology. 12, 216 (2012).
- Riley, L. M., et al. Identification of genes expressed in cultures of E. coli lysogens carrying the Shiga toxin-encoding prophage Φ24B. BMC Microbiology. 12 (1), 42 (2012).
- Stover, C. K., et al. Complete genome sequence of Pseudomonas aeruginosa PAO1, an opportunistic pathogen. Nature. 406 (6799), 959-964 (2000).
- Winstanley, C., et al. Newly introduced genomic prophage islands are critical determinants of in vivo competitiveness in the Liverpool Epidemic Strain of Pseudomonas aeruginosa. Genome Research. 19 (1), 12-23 (2009).
- Davies, E. V., et al. Temperate phages enhance pathogen fitness in chronic lung infection. The ISME Journal. 10 (10), 2553-2555 (2016).
- Allison, H. E. Stx-phages: drivers and mediators of the evolution of STEC and STEC-like pathogens. Future Microbiology. 2 (2), 165-174 (2007).
- Allison, H. E., et al. Immunity profiles of wild-type and recombinant Shiga-like toxin-encoding bacteriophages and characterization of novel double lysogens. Infection and Immunity. 71 (6), 3409-3418 (2003).
- Mori, N., et al. A peptide based on homologous sequences of the β-barrel assembly machinery component BamD potentiates antibiotic susceptibility of Pseudomonas aeruginosa. Journal of Antimicrobial Chemotherapy. 67 (9), 2173-2181 (2012).
- Chojnacki, M., et al. A novel, broad-spectrum antimicrobial combination for the treatment of Pseudomonas aeruginosa corneal infections. Antimicrobial Agents and Chemotherapy. 63 (10), e00777 (2019).
- Miles, A. A., Misra, S. S., Irwin, J. O. The estimation of the bactericidal power of the blood. Epidemiology & Infection. 38 (6), 732-749 (1938).
- Srikumar, S., et al. RNA-seq brings new insights to the intra-macrophage transcriptome of Salmonella Typhimurium. PLoS Pathogens. 11 (11), e1005262 (2015).
- Kröger, C., et al. The transcriptional landscape and small RNAs of Salmonella enterica serovar Typhimurium. Proceedings of the National Academy of Sciences of the United States of America. 109 (20), E1277-E1286 (2012).
- Green, M. R., Sambrook, J. How to win the battle with RNase. Cold Spring Harbor Protocols. (2), (2019).
- A practical guide to analyzing nucleic acid concentration and purity with microvolume spectrophotometers. New England BioLabs Inc Available from: https://www.neb.com/-/media/nebus/files/application-notes/technote_mvs_analysis_of_nucleic_acid_concentration_and_purity.pdf?rev=c24cea043416420d84fb6bf7b554dbbb (2019)
- Saunders, N. A., Lee, M. A. . Real-Time PCR: Advanced Technologies and Applications. , (2013).
- Bustin, S. A. . A-Z of Quantitative PCR. , (2004).
- Ruijter, J. M., et al. Efficiency correction is required for accurate quantitative PCR analysis and reporting. Clinical Chemistry. 67 (6), 829-842 (2021).
- Fothergill, J. L., Neill, D. R., Loman, N., Winstanley, C., Kadioglu, A. Pseudomonas aeruginosa adaptation in the nasopharyngeal reservoir leads to migration and persistence in the lungs. Nature Communications. 5 (1), 4780 (2014).
- Huang, J., et al. Temperature-dependent expression of phzM and its regulatory genes lasI and ptsP in rhizosphere isolate Pseudomonas sp. strain M18. Applied and Environmental Microbiology. 75 (20), 6568-6580 (2009).
- Savli, H., et al. Expression stability of six housekeeping genes: a proposal for resistance gene quantification studies of Pseudomonas aeruginosa by real-time quantitative RT-PCR. Journal of Medical Microbiology. 52 (5), 403-408 (2003).
- . rstatix: Pipe-Friendly Framework for Basic Statistical Tests Available from: https://CRAN.R-project.org/package=rstatix (2022)
- McDonald, J. E., et al. High-throughput method for rapid induction of prophages from lysogens and its application in the study of Shiga toxin-encoding Escherichia coli strains. Applied and Environmental Microbiology. 76 (7), 2360-2365 (2010).
- Smith, D. L., et al. Short-tailed Stx phages exploit the conserved YaeT protein to disseminate Shiga toxin genes among Enterobacteria. Journal of Bacteriology. 189 (20), 7223-7233 (2007).
- James, C. E., et al. Lytic and lysogenic infection of diverse Escherichia coli and Shigella strains with a verocytotoxigenic bacteriophage. Applied and Environmental Microbiology. 67 (9), 4335-4337 (2001).
- Rees, V. E., et al. Characterization of hypermutator Pseudomonas aeruginosa isolates from patients with cystic fibrosis in Australia. Antimicrobial Agents and Chemotherapy. 63 (4), e02538 (2019).
- Li, Y., et al. Excisionase in Pf filamentous prophage controls lysis-lysogeny decision-making in Pseudomonas aeruginosa. Molecular Microbiology. 111 (2), 495-513 (2019).
- Van Kampen, A. H. C., Moerland, P. D. Taking bioinformatics to systems medicine. Systems Medicine. 1386, 17-41 (2016).
- Matsushiro, A., Sato, K., Miyamoto, H., Yamamura, T., Honda, T. Induction of prophages of enterohemorrhagic Escherichia coli O157:H7 with norfloxacin. Journal of Bacteriology. 181 (7), 2257-2260 (1999).
- James, C. E., et al. Lytic activity by temperate phages of Pseudomonas aeruginosa in long-term cystic fibrosis chronic lung infections. The ISME Journal. 9 (6), 1391-1398 (2015).
- Shaw, K. J., et al. Comparison of the changes in global gene expression of Escherichia coli induced by four bactericidal agents. Microbial Physiology. 5 (2), 105-122 (2003).
- Long, H., et al. Antibiotic treatment enhances the genome-wide mutation rate of target cells. Proceedings of the National Academy of Sciences of the United States of America. 113 (18), E2498-E2505 (2016).
- González-Tortuero, E., et al. VIGA: A sensitive, precise and automatic de novo VIral Genome Annotator. bioRxiv. , (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved