Method Article
Comprendre l’impact des bactériophages tempérés sur leurs lysogènes grâce à la transcriptomique
Dans cet article
Résumé
Ce protocole permet de révéler l’impact des prophages sur leurs hôtes. Les cultures bactériennes sont synchronisées en utilisant les conditions qui soutiennent le mieux l’état lysogénique, limitant ainsi l’induction spontanée. La RT-qPCR distingue sans équivoque les gènes restreints aux prophages et ceux qui ne sont pas couplés au contrôle des phages de ceux qui sont exprimés pendant le cycle de réplication lytique.
Résumé
Les phages tempérés se trouvent intégrés sous forme de prophages dans la majorité des génomes bactériens. Certains prophages sont cryptiques et fixés dans le chromosome bactérien, mais d’autres sont actifs et peuvent être déclenchés sous une forme réplicative soit spontanément, soit par exposition à des facteurs inducteurs. Les prophages sont généralement associés à la capacité de conférer la production de toxines ou d’autres traits associés à la virulence à leur cellule hôte. Des études plus récentes ont montré qu’ils peuvent jouer un rôle beaucoup plus important dans la modification de la physiologie de leurs hôtes. La technique décrite ici nous a permis d’étudier comment les prophages affectent l’expression des gènes chez la bactérie opportuniste Pseudomonas aeruginosa.
Dans ce travail, la croissance de la souche PAO1 de P. aeruginosa de type sauvage a été comparée à celle de lysogènes isogéniques porteurs de différentes combinaisons de prophages de la souche épidémique de Liverpool (LES) LESB58. Dans une culture de lysogène, une proportion de cellules bactériennes soutiendra la réplication des bactériophages lytiques (induction spontanée) avec un niveau élevé d’expression par cellule des gènes tardifs des phages, tels que ceux associés à l’assemblage des particules de phages, masquant ainsi l’expression génique de faible niveau associée à l’expression des gènes restreints aux lysogènes. L’impact de l’induction spontanée peut donc masquer l’expression du gène du prophage dans une population de lysogènes.
Des expériences de profilage de croissance ont été utilisées pour identifier l’induction spontanée, qui était minime au début de la phase de croissance exponentielle. Cette étude explique comment préparer des cultures d’échantillons au début de la phase de croissance exponentielle et comment mettre en place des contrôles adéquats malgré un faible nombre de cellules. Ces protocoles assurent la comparaison fiable et reproductible des bactéries de type sauvage et lysogéniques dans diverses conditions, améliorant ainsi le profilage transcriptomique des génomes de prophages et aidant à l’identification de fonctions de prophages jusqu’alors inconnues.
Introduction
Récemment, la phagothérapie pour lutter contre la résistance aux antimicrobiens1 et l’édition génomique basée sur CRISPR-Cas2 ont suscité un regain d’intérêt pour la recherche sur les bactériophages. Là encore, les progrès de la biotechnologie ont permis d’étudier plus en profondeur les interactions entre les bactéries et les phages3. Cependant, l’utilisation thérapeutique des phages (« phagothérapie ») est entravée par les préoccupations concernant les phages agissant comme des éléments génétiques mobiles ayant la capacité de transférer horizontalement les gènes de virulence et de résistance4. L’étendue de la « matière noire »5 (gènes aux fonctions inconnues) est à la fois troublante et séduisante. La matière noire est considérée comme une lacune dans notre compréhension de la biologie des phages et une ressource largement inexploitée pour les outils moléculaires et les nouvelles thérapies potentielles6. Le développement de techniques de séquençage à haut débit, ainsi que l’amélioration de l’annotation des gènes 7,8,9 et de nouveaux algorithmes de repliement peptidique10, améliorent la détection, la description et la prédiction fonctionnelle des gènes des phages. Cependant, la science est encore loin de valider les fonctions génétiques de la plupart des phages en culture ou dans le monde réel.
Le séquençage de l’ARN (RNA-Seq) permet de cartographier globalement l’expression des gènes au cours de l’infection par les phages et a considérablement amélioré la compréhension des phages et des éléments bactériens impliqués dans les cycles lytiques et lysogéniques11,12. Au cours des processus lysogéniques, les génomes des phages tempérés sont intégrés à l’ADN bactérien pour devenir des prophages13. Des expériences de profilage global de l’expression génique peuvent être utilisées pour identifier les gènes restreints aux prophages qui sont codés sur les génomes des phages tempérés mais qui ne sont exprimés qu’à l’état lysogénique11. Ces gènes ne codent pas pour les protéines structurales des phages et ne sont impliqués dans aucun processus d’infection par les phages. Le séquençage de l’ARN peut être utilisé pour identifier les gènes les plus susceptibles d’influencer la biologie de l’hôte bactérien, soit en induisant un gain de fonction, soit en régulant les gènes bactériens existants, permettant ainsi souvent aux bactéries de s’adapter à des environnements changeants. Par conséquent, la capacité des prophages à agir comme des marionnettistes microbiens, contrôlant une gamme de fonctions bactériennes, pourrait être étudiée.
Il existe deux obstacles majeurs à l’analyse efficace de l’expression des gènes restreints aux prophages. Tout d’abord, la disponibilité d’hôtes sensibles est une question clé. Par définition, les prophages sont déjà incorporés dans le génome spécifique de leur hôte, il est donc difficile de trouver un hôte de type sauvage susceptible de comparer l’expression globale du gène en présence et en absence du prophage. Cela peut être réalisé soit par l’infection de novo d’un autre hôte sensible, soit par la suppression du prophage de l’isolat de type sauvage d’origine, sans perturber le reste du génome de l’hôte. Le deuxième obstacle réside dans la nature hétérogène des populations lysogéniques. Certains prophages se dégradent par mutation ou recombinaison pour devenir « cryptiques », c’est-à-dire qu’ils sont fixés à un endroit spécifique du génome bactérien. Cependant, d’autres prophages sont « actifs » et peuvent être induits dans un cycle lytique réplicatif spontanément ou après exposition à des facteurs inducteurs. Dans de nombreuses cultures lysogéniques, le taux d’induction spontanée signifie qu’une partie des cellules bactériennes subissent toujours une réplication lytique des phages14,15,16. Un niveau élevé d’expression des gènes tardifs des phages dans ces populations masque l’expression génique de faible niveau associée à l’expression génique restreinte aux lysogènes11,17. La proportion de lysogènes subissant une induction spontanée de prophage peut varier en fonction de l’état de croissance, des conditions de croissance ou d’autres déclencheurs. Par conséquent, pour étudier les impacts des prophages sur le lysogène, les événements spontanés d’induction des prophages doivent être minimisés autant que possible en optimisant les conditions de croissance pour favoriser l’état lysogène.
Cette étude rend compte des travaux préparatoires effectués pour étudier l’influence d’un ensemble de prophages cohabitants de la souche épidémique de Liverpool (LES) de Pseudomonas aeruginosa. Des prophages actifs ont été induits et isolés à partir de LES et utilisés pour infecter la souche hôte modèle de P. aeruginosa, PAO116,18,19. Les génomes entiers de la souche sauvage de P. aeruginosa, PAO1, et de son lysogène, PAO1Φ2, ont été séquencés (à une profondeur de couverture de 30x) pour assurer l’identité de la souche de type sauvage et confirmer que le lysogène était isogène. Le LES a été associé à une augmentation de la morbidité et de la mortalité chez les patients atteints de fibrose kystique, et il a été suggéré que les phages LES 19 aident à l’adaptation à l’environnement pulmonaire de la fibrose kystique16,19,20. Malgré des preuves solides que ces prophages affectent la biologie de leur hôte20,21, la majorité de leurs fonctions génétiques n’ont pas encore été caractérisées et les mécanismes spécifiques d’interaction sont mal compris. Une approche transcriptomique permet de découvrir empiriquement les fonctions des gènes prophages dans un contexte hôte contrôlé. Étant donné que l’induction spontanée peut affecter les profils d’expression, cet article décrit comment optimiser les conditions de croissance pour favoriser l’état lysogène. Une telle synchronisation des cultures peut être validée par PCR en temps réel pour quantifier les niveaux d’expression des marqueurs génétiques clés associés aux étapes cruciales de la réplication des phages LES dans PAO1. La même approche a déjà été utilisée pour identifier les fonctions restreintes aux prophages des phages shiga-toxinogènes qui affectent la motilité, la résistance à l’acide et la résistance aux antimicrobiens chez Escherichia coli11,17,21,22.
Protocole
1. Création d’un hôte d’indicateur sélectionnable (Figure 1)
REMARQUE : Les lysats de culture de phages peuvent contenir des cellules contaminantes de l’hôte bactérien d’origine. Le fait d’avoir une souche indicatrice résistante aux antibiotiques permet de faire la distinction entre la souche indicatrice et l’hôte bactérien d’origine du prophage. L’utilisation d’une souche indicatrice sélectionnable permet le dénombrement précis des particules de phages infectieuses sans nécessiter d’étapes de centrifugation ou de filtration pour éliminer le phage des cellules lysogènes après les étapes d’amplification des phages. La souche de l’hôte indicateur sélectionnable réduit également le temps et le nombre d’étapes pour le dénombrement des phages, de sorte que plusieurs conditions peuvent être testées simultanément.
- Identifier une souche hôte indicatrice appropriée susceptible d’être infectée lytique et lysogénique par le phage tempéré d’intérêt. La souche de laboratoire PAO118,20 de P. aeruginosa a été utilisée et est sensible aux trois phages LES (LESΦ2, LESΦ3 et LESΦ4).
- Choisir un agent sélectif approprié (la rifampicine a été utilisée ici) et effectuer un essai de dilution de bouillon pour déterminer la concentration minimale inhibitrice (CMI) pour l’hôte indicateur (16 μg·mL−1 est la CMI pour PAO1)23,24.
- Exposer séquentiellement les cultures hôtes indicatrices à des concentrations croissantes de l’agent sélectif dans le bouillon de lysogénie (LB), en commençant en dessous de la CMI (dans ce cas 5 μg·mL−1), pendant 18 à 24 h, avec agitation, et à 37 °C.
- Transférer la culture en croissance à la concentration la plus élevée dans un rapport de 1 :100 (inoculum à milieu) dans des concentrations deux fois plus élevées de l’agent sélectif (18 à 24 h à chaque fois) jusqu’à ce que la CMI ait été suffisamment augmentée. La PAO1 est devenue une souche résistante à la rifampicine (PAO1-RifR) à 300 μg·mL−1 de rifampicine.
2. Dénombrement temporel direct de l’induction spontanée (Figure 2)
- Mettre en place des cultures de démarrage pendant la nuit du lysogène (p. ex., P . aeruginosa PAO1 lysogène hébergeant des phages LES) et de l’hôte indicateur (PAO1-RifR) en inoculant une seule colonie dans 5 mL de LB, et incuber à 37 °C avec agitation à 180 tr/min (18 à 24 h).
- Mettre en place des cultures hôtes de lysogène frais et d’indicateurs en inoculant les cultures pendant la nuit dans 100 mL de LB dans un rapport de 1 :100, et incuber à 37 °C en agitant (180 tr/min).
- Surveillez la croissance des lysogènes en mesurant la DO600 et le nombre viable à l’aide de la technique de Miles Misra25. Pour ce faire, prélever un échantillon de 1 ml de chaque culture de lysogène toutes les heures à partir du point d’inoculation pendant 8 h.
- Diluer l’échantillon en série immédiatement après le prélèvement en ajoutant 100 μL de l’échantillon dans 900 μL du milieu respectif. Bien vortex à la vitesse maximale, jeter la pointe à chaque dilution et continuer la série de dilution de 10−1 à 10−9.
- Placer 10 μL des dilutions requises en trois exemplaires sur une plaque de gélose LB, laisser sécher et incuber à 37 °C pendant 18 à 24 h.
- Pour calculer le nombre de cellules bactériennes viables, trouvez une dilution avec des colonies facilement dénombrables. Comptez le nombre de colonies dans chaque endroit, puis utilisez la formule suivante :

REMARQUE : Au fur et à mesure que la culture de lysogène se développe, des particules de phages actives seront produites par induction spontanée. La production de phages infectieux signifie que le transcriptome de la population de lysogènes est maintenant contaminé par l’expression génique associée au cycle de réplication lytique à partir du signal de réplication des phages lytiques et de la réponse correspondante de la cellule hôte. Il est donc important d’identifier le stade de croissance auquel la proportion de cellules lysogéniques par rapport aux particules de phages infectieuses libres est la plus élevée afin de limiter autant que possible le bruit de transcription de fond (généré par le transcriptome du phage lytique) dans l’ensemble de données.
- Pour dénombrer les particules de phages infectieuses dans chaque échantillon temporal, inoculer 5 mL de gélose bactériologique stérile à 0,4 % dans de la gélose LB (gélose supérieure) avec 100 μL d’hôte indicateur de phase exponentielle moyenne (OD600 : 0,4–0,5 ; dans ce cas, PAO1-RifR) en présence d’un agent sélectif approprié (50 μg·mL−1 rifampicine dans ce cas, car la CMI de l’hôte PAO1 n’est que de 16 μg·mL−1 ; voir Tableau des matériaux, rangée 8 et rangée 9)
- Déposer 10 μL de la même dilution en série (voir étape 2.2.2) sur la couche supérieure de gélose inoculée et laisser sécher avant d’incuber à 37 °C pendant 18 à 24 h.
- Pour calculer les particules de phages infectieuses, trouvez une dilution avec des plaques facilement dénombrables. Comptez le nombre de plaques à chaque endroit.

- Trouvez le temps/la condition pour lesquels l’induction spontanée par UFC (unité formant colonie) est minimale pour les étapes expérimentales ultérieures.
3. Préparation de cultures de lysogène non induites et induites pour l’extraction de l’ARN (Figure 3)
- Mettre en place une culture fraîche pendant la nuit en inoculant une seule colonie de lysogène dans 5 mL de LB et incuber à 37 °C avec agitation (180 tr/min) pendant 18 à 24 h.
- Sous-culture : la culture de nuit dans 80 mL de LB à un rapport de 1 :100 dans huit flacons de 250 mL.
- Étiqueter la première fiole comme « non induite » et les autres comme « induite », ainsi que les moments où chaque échantillon doit être prélevé (c.-à-d. « t induit = 0 », « t induit = 10 min », « t induit = 20 min », etc. Graphique 3).
- Après 90 minutes d’incubation, lorsque la DO600 se situe entre 0,1 et 0,2, ou au moment de l’induction spontanée minimale (voir la discussion), ajouter 4 μL d’acide acétique glacial (v/v) à 1 % dans la fiole non induite (Figure 3).
NOTA : Comme l’agent inducteur dans ce travail a été fabriqué en utilisant de l’acide acétique glacial à 1 % comme solvant, la même quantité de solvant a été ajoutée seule comme étape de contrôle. D’autres moyens de lutte peuvent être envisagés en fonction de la préparation des différents inducteurs. - Ajouter la culture de 80 mL de la fiole non induite à 720 mL de LB stérile, et ajouter immédiatement la solution d’arrêt (phénol glacé à 5 % [v/v], pH 4,3, éthanol à 95 % [v/v]) en utilisant un volume correspondant à 20 % du volume de culture (160 ml), et incuber sur glace pendant au moins 30 min et pas plus de 2 h pour stabiliser les transcrits de l’ARN12, 26 et 27. Il s’agit de l’échantillon non induit.
- Induire les cultures restantes dans sept flacons de 250 mL (figure 3) avec la CMI d’un agent inducteur approprié (dans ce cas, 25 mg·mL−1 norfloxacine, préparée dans de l’acide acétique glacial à 1 % [p/v], utilisée à une concentration finale de 1 μg·mL−1), bien mélanger et incuber à 37 °C et en agitant à 180 tr/min pendant 1 h.
REMARQUE : Cette étape forcera la culture de lysogène dans un état plus coordonné de réplication lytique. La plupart des cellules de la culture commenceront à subir une production lytique de particules de phages infectieuses. - Permettre aux cellules de se rétablir en ajoutant 80 mL de culture de la fiole induite à 720 mL de LB stérile, ce qui dilue efficacement l’agent inducteur. Prélever les cellules bactériennes de chaque fiole toutes les 10 minutes à partir du temps 0 jusqu’à 1 h en ajoutant une solution d’arrêt, comme mentionné à l’étape 3.5.
REMARQUE : La solution d’arrêt stabilise l’ARN jusqu’à 2 h. Cependant, pour améliorer la stabilité de l’échantillon, effectuez toutes les étapes suivantes à 4 °C. - Récolte par centrifugation à 10 000 x g pendant 15 min à 4 °C dès que possible, sans dépasser 2 h après le traitement pour éviter la dégradation de l’ARN.
- Jetez le surnageant et remettez délicatement les pastilles bactériennes en suspension dans le liquide résiduel à l’aide d’une pipette automatique réglable avant de transférer chaque échantillon dans un tube de microfuge de 1,5 ml.
- Centrifuger les tubes du microfuge à grande vitesse (13 000 x g) dans un microfuge à 4 °C pendant 1 min, et jeter le surnageant résiduel.
- Congelez les granulés en plongeant chaque tube de microfuge scellé dans de l’azote liquide. Cela facilitera la lyse efficace des cellules pour l’extraction de l’ARN.
- Ajouter TRIzol (1 ml) à chaque pastille congelée et homogénéiser la suspension par pipetage (ne pas vortex). Conserver à −80 °C jusqu’au moment d’effectuer l’extraction de l’ARN pour tous les échantillons.
REMARQUE : Le protocole peut être mis en pause à ce stade. - Répétez les étapes 3.1 à 3.13 avec trois répétitions biologiques.
4. Isolement de l’ARN à partir de cultures de lysogène non induites et induites
CRITIQUE : Toutes ces étapes doivent être effectuées dans un environnement exempt de RNase28. Les établis doivent être essuyés avec 10% de NaClO ou des inactivateurs de RNase propriétaires. Le matériel de laboratoire doit être traité avec des inhibiteurs de la RNase tels que le traitement DEPC, et de l’eau exempte de nucléase doit être utilisée dans toutes les réactions.
- Décongelez les granulés congelés traités au TRIzol de l’étape 3.12 sur de la glace et ajoutez 400 μL de chloroforme de qualité biologie moléculaire.
- Bien agiter les flacons par inversion pendant 10 s pour terminer la lyse de toutes les cellules ( ne pas vortex). Ensuite, incubez à température ambiante (21 °C) pendant 2 à 5 minutes.
- Séparer la couche aqueuse du mélange TRIzol/chloroforme par centrifugation à l’aide d’un microfuge de table réfrigéré à 4 °C et 13 000 x g pendant 15 min.
- Prélever la phase aqueuse (~ 500 μL, couche supérieure) à l’aide d’une pipette de 1 000 μL en prenant soin de ne pas perturber l’interphase ou la phase organique (couche inférieure). Transférer dans un nouveau tube microfuge de 1,5 mL.
- Ajouter 450 μL d’isopropanol de qualité biologie moléculaire à la phase aqueuse séparée, bien mélanger par inversion ( ne pas vortex) et incuber à température ambiante (21 °C) pendant 30 min.
- Récupérer l’ARN par centrifugation à l’aide d’une centrifugeuse réfrigérée à 4 °C et 13 000 x g pendant 30 min.
- Jeter le surnageant sans perturber la pastille d’ARN et laver la pastille deux fois avec 800 μL d’éthanol à 70 % préparée avec de l’eau sans nucléase (ne pas pipeter de haut en bas). Assurez-vous de la stabilité de la pastille d’ARN en répétant l’étape de centrifugation pendant 5 min après chaque lavage.
- Jetez l’éthanol et séchez le granulé à l’air libre.
REMARQUE : Aspirez soigneusement l’éthanol autour de la pastille à l’aide d’un micro-embout de 10 μL et séchez la pastille en retournant le tube sur du papier buvard propre. La pastille d’ARN doit devenir incolore et les bords doivent apparaître ébouriffés et visibles. Un séchage trop faible peut laisser de l’éthanol résiduel qui peut avoir un impact sur les processus en aval, et un séchage excessif du granulé peut rendre la remise en suspension difficile. - Remettre l’ARN en suspension dans de l’eau sans nucléase (50 μL) en incubant à 65 °C sur un thermo-agitateur avec mélange intermittent (toutes les 30 s) pendant un total de 3 à 5 min.
CRITIQUE : Le groupe 2'- OH de l’ARN est capable de catalyser l’autoclivage des brins d’ARN à une température élevée supérieure à 65 °C et à un pH élevé. Des températures inférieures à 65 °C retarderont la remise en suspension de l’ADN résiduel, limitant ainsi la quantité d’ADN qui doit être digérée à un stade ultérieur de la digestion de la DNase I. Par conséquent, il est essentiel de maintenir la température à 65 °C pour obtenir les meilleurs échantillons.
REMARQUE : Le protocole peut être mis en pause à ce stade et les échantillons peuvent être stockés à −80 °C.
5. Élimination de l’ADN contaminant de l’ARN par traitement DNase
- Pour éliminer l’ADN contaminant de l’ARN total avant la synthèse de l’ADNc du premier brin, ajoutez un volume de 0,1 volume de tampon 10x DNase et 1 μL d’enzyme DNase à 10 μg d’ARN total. Mélangez délicatement le tube et incubez à 37 °C pendant 30 min.
- Remettre en suspension le réactif d’inactivation de la DNase et ajouter au moins 2 μL ou 10 % du volume total de la réaction. Bien mélanger et incuber les échantillons pendant 5 min à température ambiante (21 °C) pendant la redispersion du réactif d’inactivation de la DNase.
- Granulé les réactifs DNase par centrifugation à l’aide d’une microcentrifugeuse de table à 10 000 × g pendant 1,5 min.
- Transférez le surnageant contenant l’ARN dans un tube neuf sans perturber la pastille.
REMARQUE : Vérifier la qualité de l’ARN à l’aide d’un spectrophotomètre UV à l’échelle de 1 μL et d’un analyseur informatique d’acide nucléique microfluidique conformément aux instructions du fabricant ; l’ARN total purifié peut être stocké à −80 °C. Pour le qRT-PCR, L’ARN pourrait être utilisé directement à ce stade. Pour les processus en aval plus sensibles, tels que le séquençage de l’ARN, qui nécessitent une qualité d’échantillon stricte, un rapport A260/230 de ε 2,0 doit être atteint pour aller plus loin. - Compléter le volume de la solution d’ARN sans ADN à 500 μL en utilisant de l’eau sans nucléase.
- Ajouter 50 μL d’acétate de sodium 3M sans nucléase (pH 5,3) et 495 μL d’isopropanol. Bien mélanger, et incuber à température ambiante pendant 30 min.
REMARQUE : Cette étape précipitera l’ARN. - Récupérer l’ARN par centrifugation à 13 000 x g et 4 °C pendant 30 min.
- Lavez la pastille d’ARN trois fois avec de l’éthanol à 70 % glacé en centrifugeant les échantillons à 13 000 x g et à 4 °C pendant 5 minutes après chaque lavage pour éliminer complètement les sels.
- Vérifier la qualité de l’ARN à l’aide d’un spectrophotomètre UV à l’échelle de 1 μL et d’un analyseur informatique d’acide nucléique à base microfluidique, conformément aux instructions du fabricant ; l’ARN total purifié peut être stocké à −80 °C.
REMARQUE : Le guide29 a été utilisé pour atteindre les normes de qualité de l’ARN. Si le rapport A260/230 est de <2,0, répétez les étapes 5.5 à 5.9.
6. Analyse qualitative et quantitative de l’ARN sans DNase
- Valider l’efficacité du traitement par DNase pour chaque échantillon en effectuant une PCR quantitative à l’aide d’amorces d’ARNr 16S (tableau 2) avec 1 μg d’ARN total, et confirmer qu’aucun produit d’amplification n’est produit.
NOTE : Les amorces idéales pour évaluer la contamination par l’ADNg seraient les amorces conçues pour recuire au niveau des jonctions intron-exon ou des régions régulatrices chez les procaryotes ou sur les sites transcriptionnellement inactifs30,31. - Déterminer le numéro d’intégrité de l’ARN (RIN) à l’aide d’un analyseur informatique d’acide nucléique à base microfluidique, conformément aux instructions du fabricant.
REMARQUE : Les échantillons présentant un RIN ≥ 9 doivent être utilisés pour la synthèse du premier brin. Les échantillons présentant un RIN < 9 doivent être éliminés et les étapes d’isolement (1.1 à 5.4) doivent être répétées. - Quantifier la concentration totale d’ARN à l’aide de la trousse de dosage de l’ARN HS et d’un fluorimètre selon les instructions du fabricant.
7. Synthèse de l’ADNc premier brin
- Préparer un mélange d’amorces d’ARN pour chaque échantillon en mélangeant 1 μg d’ARN total avec 1 μL d’hexamères aléatoires (50 ng·μL−1) et 1 μL de mélange dNTP de 10 mM. Ensuite, ajustez le volume total à 10 μL en utilisant de l’eau sans nucléase.
- Incuber la réaction à 65 °C pendant 5 min et placer sur de la glace pendant 1 min.
- Préparer un mélange de synthèse d’ADNc pour chaque échantillon en ajoutant 2 μL de tampon 10x RT ; 4 μL de 25 mM MgCl2 ; 2 μL de 0,1 M de TNT ; 1 μL d’inhibiteur de la RNase (40 U·μL−1) ; et 1 μL du réactif de transcription inverse (200 U·μL−1) dans l’ordre indiqué.
- Ajouter le mélange de synthèse d’ADNc au mélange ARN/amorce. Mélangez délicatement et centrifugez brièvement les échantillons pour recueillir les composants au fond du tube.
- Amorcez le mélange en incubant les échantillons pendant 10 min à 25 °C, puis 50 min à 50 °C. Terminez les réactions en incubant à 85 °C pendant 5 minutes et laissez refroidir sur de la glace.
- Ajouter 1 μL de RNase H dans chaque tube et incuber à 37 °C pendant 20 min pour éliminer l’ARN de l’hybride ADN :ARN.
- Enfin, diluez la réaction de synthèse de l’ADNc à un volume total de 80 μL et conservez-la à −80 °C jusqu’à une nouvelle utilisation.
REMARQUE : Le protocole peut être mis en pause à ce stade.
8. Courbe standard et PCR quantitative (q)-PCR pour déterminer les niveaux d’expression des gènes marqueurs qui indiquent les différents stades de la réplication des phages
- Identifiez un ensemble de gènes cibles qui peuvent servir de marqueurs pour chaque étape de la réplication du phage d’intérêt. Dans notre cas, il s’agit de ce qui est détaillé dans le tableau 2.
- Amplifier chacun des gènes cibles à partir de l’ADN génomique matrice à l’aide d’amorces appropriées et en utilisant la PCR avec les conditions d’amplification suivantes : dénaturation initiale à 95 °C pendant 2 min ; dénaturation à 95 °C pendant 30 s ; recuit à la température de recuit optimale en fonction des apprêts (58 °C a été utilisé ici) pendant 30 s ; extension à 72°C pendant 1 min ; et extension finale à 72 °C pendant 5 min.
- Purifiez chaque amplicon à l’aide d’un kit de purification PCR et clonez-les dans un vecteur de clonage TA selon les instructions du fabricant. Vérifier la séquence de chaque produit cloné par séquençage de Sanger.
REMARQUE : Le protocole peut être mis en pause à ce stade. - Calculez le nombre de copies pour les plasmides individuels à l’aide de l’équation20 suivante :
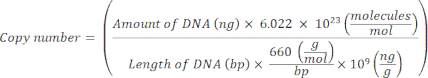
- Préparer un modèle standard pour chaque gène marqueur en diluant en série l’ADN plasmidique de 109 copies/μL à 10 2 copies/μL dans du H2 O stérile sans nucléase de qualité moléculaire.
- Effectuer une PCR quantitative selon les instructions du fabricant pour le système qPCR préféré avec 1 μL d’ADNc (à partir de l’étape 7.7) pour chaque échantillon en trois exemplaires, ainsi que les étalons plasmidiques respectifs en trois exemplaires ; effectuer la PCR dans une plaque de 96 puits pour chaque cible.
- Tracez le nombre de copies d’ADN logarithmique (axe des abscisses) par rapport au seuil de cycle (axe des ordonnées, Ct) et utilisez une plate-forme appropriée telle qu’Excel ou R pour effectuer un calcul de régression linéaire afin d’afficher le coefficient de détermination (R2) et une équation linéaire.
REMARQUE : Le coefficient de détermination doit être supérieur à 0,98. - Estimez le nombre de copies pour chaque cible à l’aide de l’équation linéaire (y = mx + b) dérivée de la régression linéaire (étape 8.7), où y est le Ct estimé ; x est le nombre logarithmique de copie d’ADN ; m est la pente de la droite, qui définit la variation de la Ct par rapport au nombre de copies d’ADN ; et b est l’ordonnée à l’origine de l’axe des ordonnées qui représente le Ct estimé pour une copie d’ADN32.
- Pour chaque gène marqueur, calculer l’efficacité de l’amplification de la PCR (E) en utilisant les paramètres de la régression linéaire de la courbe standard et l’équation suivante, où m est la pente dérivée des étapes 8.7 et 8.8 :
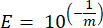
- Validez toutes les amorces en termes d’efficacité en pourcentage à l’aide de l’équation suivante :
REMARQUE : L’efficacité doit être comprise entre 90 % et 110 %.
- Calculez le nombre absolu de copies de l’ADN à l’aide de la formule suivante :
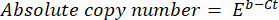
où Ct (étape 8.8) est le seuil de cycle, b est l’ordonnée à l’origine (étape 8.8), m est la pente (étape 8.8) et E est l’efficacité de l’amplification par PCR (étape 8.9).
CRITIQUE : Lors de la comparaison de l’amplification de deux cibles ou plus par q-PCR, l’efficacité de la PCR doit être calculée pour chaque cible afin de comparer le nombre absolu de copies d’ADN. - Dans cette étude, les gènes 16S de l’ARNr, du proC et du rpoD ont été utilisés comme contrôles internes généraux, et gyrB a été utilisé comme contrôle d’induction33,34,35.
REMARQUE : Lorsque vous choisissez des contrôles internes à partir des données de séquençage de l’ARN, il est préférable de sélectionner des contrôles internes dont les niveaux d’expression ne changent pas pour les conditions testées. Il est toujours important d’examiner attentivement les mesures de contrôle appropriées pour une interprétation significative des résultats.
Résultats
Dans ce travail, le dénombrement temporel direct de la production de phages à partir d’une culture de lysogène PAO1 LESΦ2 cultivée dans des conditions non inductrices a été utilisé pour déterminer l’impact de l’induction spontanée de LESΦ2. La densité de phages était à son point le plus bas avec une moyenne de ~2,61 x 106 unités formant des plaques (PFU)·mL−1 2 h après la sous-culture en milieu frais au début de la phase exponentielle de croissance, ce qui suggère que la lysogénie était l’état dominant. Le titre LESΦ2 a rapidement augmenté pour atteindre une moyenne de ~2,4 x 108 PFU·mL−1 en 4 h et a atteint la densité la plus élevée après 6 h (moyenne de ~5,83 x 109 PFU·mL−1 ; Graphique 4).
Une induction spontanée minimale a été observée au cours de la phase logarithmique précoce de la croissance du lysogène (après 2 h). Cependant, la présence mesurable de phages dans le milieu de culture était le résultat de nombreux événements antérieurs, y compris les suivants : l’emballage des acides nucléiques dans les têtes de protéines, l’assemblage des protéines en particules de phages et l’expression des gènes de phages tardifs, de gènes de phages de stade intermédiaire et de gènes de phages de régulation précoce. Il était important de détecter les cellules infectées avant l’expression des événements de réplication associés aux phages ; Par conséquent, 90 min a été choisi pour permettre à la culture de se développer avant l’induction. Pour capturer le profil d’expression génique de PAO1, des échantillons de lysogène LESΦ2 provenant d’une culture ont été prélevés avant et après l’induction sur une période de 90 minutes, comme mentionné à l’étape 3.4. Ce délai de 90 minutes est bien avant que des niveaux élevés d’induction spontanée du prophage résident ne soient détectés par le test de plaque de l’étape 2.3.2. Étant donné que la densité de cellules bactériennes était faible au début de la croissance exponentielle, les volumes de culture ont été augmentés à 800 ml afin d’assurer un matériel suffisant pour les études d’expression génique. Les échantillons ont été prélevés à partir de la culture non induite et des cultures induites toutes les 10 minutes, et l’ARN a été extrait pour cartographier le profil d’expression des marqueurs clés de la lysogénie et de la réplication lytique au cours de la croissance bactérienne. L’ARN total a été purifié et validé pour l’absence d’ADN génomique à l’aide de tests qPCR ciblant le gène de l’ARNr 16S (étape 6.1). Les échantillons atteignant un RIN ≥ 9 ont passé le contrôle de qualité et ont été convertis en ADNc.
Le génome annoté de LESΦ2 a été examiné afin d’identifier des gènes bien connus dans les cycles de réplication lysogénique et lytique des phages tempérés. Ces gènes identifiés ont ensuite été utilisés pour valider la qRT-PCR pour le profilage d’expression des gènes restreints au cycle lysogène et associés au cycle lytique à partir de cultures induites et non induites. Nous avons quantifié le nombre absolu de copies d’ADN et effectué un test de Wilcoxon à l’aide de R36 pour comparer les niveaux d’expression dans les cultures non induites et induites (Figure 5). Une augmentation marquée de l’expression du gène cro (un marqueur précoce de la réplication lytique) de ~2,31 x 109 copies dans des cultures non induites à ~3,02 x10 11 copies 30 min après l’induction (test de Wilcoxon à rang signé : p < 0,01) a été observée. De même, les protéines O et les protéines P, qui sont des marqueurs de stade intermédiaire de la réplication lytique (et dont on prédit qu’elles sont impliquées dans la réplication du génome des phages), ont également montré une régulation positive significative de ~1,74 x 108 à ~1,25 x 10 10 copies (test de Wilcoxon à rang signé : p < 0,01) et de ~ 6,05 x 102 à ~5,68 x10 5 copies (test de Wilcoxon à rang signé : p < 0,01), respectivement. Enfin, les gènes structuraux associés à la queue ont été utilisés comme marqueurs tardifs du cycle de réplication lytique. Encore une fois, nous avons observé une augmentation significative de l’expression de ~2,31 x 106 copies dans des cultures non induites à ~4,38 x 108 copies 30 min après l’induction (test de Wilcoxon à rang signé : p < 0,01). Ainsi, les données quantitatives de RT-PCR ont confirmé que l’expression génique des gènes marqueurs bien établis pour la réplication lytique suivait la tendance attendue, les marqueurs précoces, moyens et tardifs montrant une expression différentielle multiple dans l’ordre prédit (Figure 5). Étant donné que l’expression des marqueurs de la réplication lytique a été régulée à la hausse 30 minutes après la récupération, il s’agit d’un point temporel représentatif approprié pour l’étude du paysage transcriptomique des phages tempérés actifs et de leurs hôtes bactériens au cours du cycle lytique.
Nous avons observé une certaine expression de gènes lytiques dans des conditions non induites, confirmant qu’une certaine induction spontanée se produit toujours, même dans les cultures optimisées dans lesquelles le nombre de lysogènes est représenté avec le rapport le plus élevé d’UFC par rapport à l’UFP libérée dans la phase logarithmique précoce. Cela signifie qu’il y aura toujours un certain niveau de « bruit » dans les données transcriptomiques, ce qui renforce l’importance des contrôles soigneusement préparés, y compris les cultures induites et non induites. Le choix approprié des gènes de contrôle interne pour déterminer les changements de pli dans l’expression repose sur un examen minutieux des données transcriptomiques pour identifier les gènes qui sont exprimés au même niveau dans les échantillons non induits et induits. Nos résultats préliminaires suggèrent que rpoD était le gène de contrôle le plus fiable testé et avait l’expression la plus stable (~1,71 x10 5 copies avant induction et ~3,33 x 105 copies 30 min après l’induction ; Test de Wilcoxon à rang signé : p = 0,3594) par rapport aux gènes de l’ARNr 16S ou du proC (Figure 5). La variabilité de l’expression des contrôles internes a conduit à la mesure du nombre absolu de transcriptions. L’examen futur des données transcriptomiques appuiera le choix de contrôles internes appropriés pour une validation ultérieure.
Le gène cI a été utilisé dans notre exercice de profilage génétique, car il s’agit d’un marqueur bien reconnu de la lysogénie. Par rapport aux marqueurs de la réplication lytique, l’expression du gène cI était relativement stable (Figure 5), mais le nombre de copies de ce gène était rassurant dans les cultures non induites par rapport à celles des marqueurs de la réplication lytique. Ces données sont en accord avec les faibles nombres de PFU dans les mêmes échantillons, confirmant ainsi qu’une expression élevée des répresseurs était associée à des niveaux plus faibles de production de phages. Les données rapportées ici démontrent que l’expression du transcrit cI pour ce phage particulier n’est pas significativement régulée à la baisse après l’induction, comme on le voit dans les phages Stx11,17. L’activité répressive est normalement contrôlée à la fois au niveau transcriptionnel et post-traductionnel, de sorte que le gène répresseur peut être transcrit, mais la protéine résultante est immédiatement soumise à un autoclivage. D’autres expérimentations sont nécessaires pour valider les contrôles transcriptionnels et post-traductionnels. De plus, d’après notre courbe standard, la limite minimale de détection de la qPCR semble être de ~102 copies.
Ensemble, les résultats obtenus à partir des tests de plaque et de qRT-PCR valident notre stratégie de culture et de préparation d’échantillons d’ARN afin de générer une entrée bien contrôlée pour les expériences de séquençage de l’ARN. Les cultures non induites de la phase exponentielle précoce ont montré de faibles niveaux d’induction spontanée et d’expression des gènes lytiques, suggérant la dominance de la lysogénie. En revanche, les cultures isolées 30 min après l’induction ont montré des augmentations significatives de l’expression des gènes marqueurs qui indiquent la dominance de la réplication lytique.
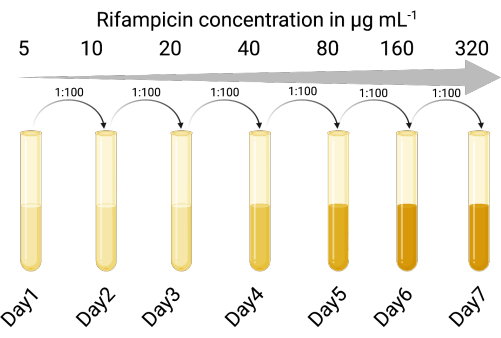
Figure 1 : Protocole de création de l’hôte indicateur résistant à la rifampicine (créé avec BioRender.com). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Plan expérimental pour le dénombrement de l’UFP et de l’UFC d’un lysogène provenant du même échantillon. (Créé avec BioRender.com) Veuillez cliquer ici pour voir une version agrandie de cette figure.
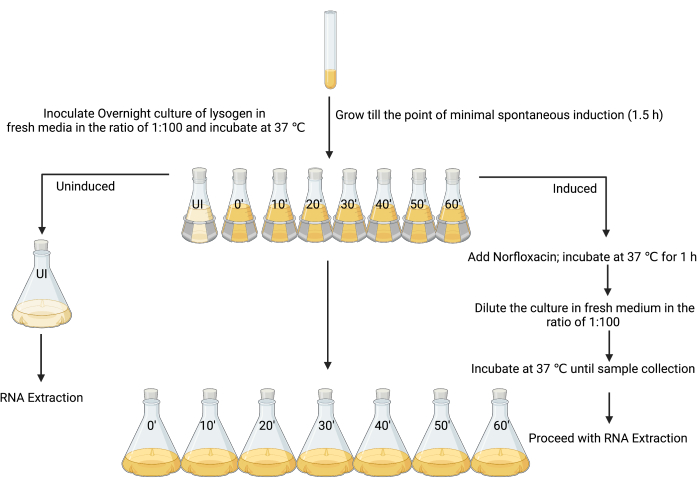
Figure 3 : Plan expérimental pour l’échantillonnage de cultures induites et non induites pour l’isolement de l’ARN. (Créé avec BioRender.com) Veuillez cliquer ici pour voir une version agrandie de cette figure.
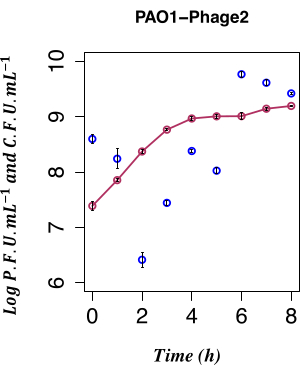
Figure 4 : Dénombrement temporel de l’induction spontanée. Dénombrement temporel de la production spontanée de prophages LES à l’aide de l’UFP du lysogène PAO1 Φ2 avec l’UFC concomitante, n = 8 (deux répétitions biologiques et quatre répétitions techniques) ; Les barres d’erreur représentent l’écart-type. Les points rouge foncé indiquent le CFU·mL−1 en LB ; les points bleu foncé indiquent le PFU·mL−1 en LB. La libération spontanée du phage infectieux φ2 par les lysogènes est au niveau mesurable le plus bas 2 h après l’inoculation. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Nombre absolu de copies des gènes marqueurs cibles. Le nombre absolu de copies des gènes marqueurs de phages confirme les profils d’expression prédits, obtenus à l’aide de la RT-qPCR, des gènes susceptibles de jouer un rôle important dans la lysogénie et les cycles lytiques. Les points représentent à la fois trois répétitions biologiques et trois répétitions techniques (n = 9). (UNE) La case rouge représente le marqueur de lysogénie, cI ; (B) le vert représente le marqueur lytique précoce, cro ; (C,D) le bleu représente les marqueurs lytiques moyens, les gènes de réplication de l’ADN ; (E) le magenta représente le marqueur lytique tardif, les gènes structuraux de la queue ; (F-H) le gris représente les marqueurs de l’hôte qui ont été utilisés comme témoins internes, et (I) le blanc représente l’ADN gyrase B, qui a été utilisé comme témoin d’induction. Les lignes horizontales pleines indiquent la médiane de la distribution. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Amorces conçues dans le cadre de cette étude. Les séquences d’amorces spécifiques pour les gènes marqueurs et les contrôles internes utilisés dans cette étude sont fournies, ainsi que leurs identifiants d’accession NCBI correspondants. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 2 : Efficacité des amorces utilisées dans cette étude calculée à l’aide de la courbe standard qPCR. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
La création d’un hôte indicateur sélectionnable, précédemment utilisé dans les tests de plaque pour quantifier plus précisément l’induction spontanée du phage Stx à partir de E. coli MC1061 37,38,39, a été décrite ici pour le phage LESΦ2 de P. aeruginosa. Cette intervention a l’avantage supplémentaire de réduire les étapes et le temps de traitement de l’échantillon, permettant ainsi l’évaluation simultanée des taux d’induction spontanée dans plusieurs conditions de culture. Il existe un risque de générer d’autres mutations lors de la création de variants résistants à la rifampicine40 ; Cependant, dans ce travail, la souche évoluée n’a été utilisée que comme hôte indicateur pour le dénombrement des plaques provenant de cultures d’intérêt et n’a pas été incluse dans l’analyse transcriptomique. Tant que la souche indicatrice sélectionnable reste également sensible à l’infection par le phage d’intérêt, il n’y a pas lieu de s’inquiéter des autres mutations acquises. Néanmoins, aucune différence dans les profils de polymorphisme de longueur des fragments de restriction n’a été détectée par l’analyse par électrophorèse sur gel en champ pulsé (PFGE) de PAO1WT et PAO1RIF (données non présentées).
Lors du choix des cellules hôtes, il est rare de trouver une souche indicatrice qui n’héberge pas déjà des prophages. À titre d’exemple, PAO1 héberge le prophage filamenteux Pf4. Les témoins expérimentaux de cette étude ont été conçus pour être en mesure d’examiner directement l’expression génique de phages spécifiques (dans ce cas, le prophage LES 2) et les effets de ce phage sur l’expression des gènes bactériens. Dans la comparaison des transcrits de PAO1 porteurs du prophage LES 2 et dépourvus du prophage LES 2 (les lysogènes et les non-lysogènes portent le Pf4 endogène), qui servent de contrôles internes pour exclure l’impact de Pf4 sur l’hôte. De plus, il a été démontré que Pf4 ne provoque généralement pas de lyse dans sa cellule hôte41 et n’est donc pas capable de confondre les résultats de ces expériences.
Il est bien établi qu’un contrôle minutieux de la qualité est crucial dans la préparation des échantillons pour produire des données omiques significatives42. Cependant, comme nous l’avons déjà décrit11, la caractérisation minutieuse de l’activité des prophages dans la préparation de cultures de lysogène pour de telles études est rarement effectuée. Ici, nous détaillons nos protocoles systématiques pour la préparation d’un ensemble de cultures bien contrôlées et optimisées pour les études transcriptomiques afin de mieux explorer les interactions entre les bactéries et les phages tempérés. La synchronicité de la population a été contrôlée en faisant passer la culture par au moins quatre doublements avant de la traiter avec l’antibiotique inducteur norfloxacine. En déterminant la CMI de la norfloxacine pour la souche de l’étude, nous avons pu nous assurer que la concentration de l’agent inducteur était juste au-dessus de la CMI pour le traitement « d’induction ». Les cellules traitées ont ensuite été diluées à 1 :10 pour abaisser la concentration de norfloxacine en dessous de la CMI après le traitement de 1 h afin de permettre aux cellules de récupérer et de compléter le processus de réplication des phages, se terminant par la lyse de la cellule et la libération de la progéniture des phages infectieux. Les cellules n’entrent dans le cycle de réplication lytique après le stimulus d’induction qu’une fois que la concentration de norfloxacine a été amenée en dessous de la CMI pendant la période de récupération. Dans ce cas, dépasser 1 μg·mL−1 norfloxacine signifie que le médicament ne pourrait pas être dilué efficacement en dessous de la CMI, car la CMI de la norfloxacine pour la PAO1 est de 0,19 μg·mL−1. Le niveau de dilution de l’inducteur doit être équilibré avec la nécessité de récupérer le lysogène et de conserver la densité de culture pour la récolte de l’ARN. Les données discutées ici démontrent qu’il est possible de synchroniser les cultures pour créer des échantillons dans lesquels la lysogénie domine, réduisant ainsi le bruit de l’induction spontanée et permettant la détection de véritables changements induits par la lysogénie dans l’expression des gènes. Étant donné que l’état lysogénique est prédominant dans la phase de croissance exponentielle précoce lorsque la densité cellulaire bactérienne est faible, nous suggérons de mettre à l’échelle les cultures afin de récolter suffisamment d’ARN pour les études ultérieures d’expression génique telles que le séquençage de l’ARN.
L’utilisation de la norfloxacine comme agent inducteur pour forcer les cultures à entrer dans le cycle lytique est bien rapportée43,44 ; Cependant, cela affectera également l’expression d’autres gènes bactériens dans le processus45,46. Pour atténuer ce phénomène, des banques d’ARN provenant de cultures de type sauvage de contrôle cultivées dans les mêmes conditions inductrices et non inductrices doivent être incluses dans les expériences de séquençage de l’ARN. L’utilisation de contrôles internes et de gènes marqueurs clés pour valider les étapes de la réplication des phages par qRT-PCR est également cruciale pour des comparaisons précises. Le profilage quantitatif par RT-PCR ne peut pas être interprété en comparant le nombre absolu de transcrits pour chaque gène à différents moments ; C’est la forme du profil qui compte. Tout d’abord, une seule petite région dans le transcrit d’un gène a été échantillonnée, de sorte qu’on ne sait pas s’il s’agit d’un élément à courte ou à plus longue durée de vie27. Certes, la cartographie RNA-Seq des transcrits montre que la densité des données de cartographie varie considérablement sur la longueur d’un gène. Deuxièmement, c’est la forme du profil d’expression génique qui doit être interprétée pour un gène marqueur associé au cycle lytique ou au mode de vie lysogénique ou même découplé des circuits de régulation des phages11. L’induction spontanée est un réel problème dans la culture des lysogènes et se traduira toujours par l’expression de gènes associés au cycle lytique. Cependant, le profilage montre que les gènes associés au cycle de réplication lytique sont supprimés dans leur expression avant l’induction (au moins deux plis logarithmiques) et régulés à la hausse après l’induction.
Les analyses transcriptomiques précédemment effectuées sur les interactions des phages Stx avec E. coli permettent une compréhension approfondie des gènes des phages impliqués dans le maintien de la lysogénie et le déclenchement du cycle lytique11,17. À l’heure actuelle, les phages LES de P. aeruginosa ont été annotés, mais leurs fonctions génétiques clés sont moins bien comprises. Les études transcriptomiques permettront de réannoter les prophages LES et d’améliorer notre compréhension des gènes impliqués dans la lysogénie et le cycle lytique. Relier la séquence des gènes à la fonction représente un défi majeur dans l’étude de nouveaux prophages, ce qui souligne la nécessité de poursuivre les études pour confirmer les fonctions des gènes des phages afin de produire de meilleurs outils d’annotation47. L’application et l’adaptation plus larges des protocoles et des mesures de contrôle de la qualité supplémentaires détaillées dans cet article vidéo pourraient aider à dévoiler diverses fonctions des prophages et, par conséquent, à améliorer les pipelines d’annotation et à transformer notre compréhension de la biologie des phages et des bactéries.
matériels
| Name | Company | Catalog Number | Comments |
| PAO1 | 6 | ||
| LESB58 | 6 | ||
| LES phages | Induced and purified from LESB58 using Norfloxacin. | This study | |
| Lysogeny Broth (LB) | Merck | 1.10285.500 | |
| LB Agar | Merck | 1.10283.500 | |
| Agar Agar | Fisher | A/1080/53 | |
| Top Agar | 0.4 g Agar Agar+2.5 g LB Broth in 100 mL water; autoclave and use. | - | |
| Rifampicin | Sigma (Stock: 50 mg/mL in Methanol- Mix well and use 0.22µm filter to sterilize and store it in -20°C until use) | R3501 | |
| Glacial Acetic Acid | Fisher 1% (v/v) in water | 10060000 | |
| Norfloxacin | Sigma (Stock: 25 mg/mL of 1% Glacial Acetic Acid-Mix well and use 0.22µm filter to sterilize and store it in -20°C until use;To avoid freeze thaw cycles, store as small aliquotes) | N9890 | |
| Phenol saturated with citrate buffer pH 4.3 | Sigma | P-4682 | |
| Molecular Biology grade Ethanol | Fisher | 16695992 | |
| TRIzol | Invitrogen | 12044977 | |
| Chloroform | Fisher | 11398187 | |
| Isopropanol | Fisher | 17150576 | |
| Nuclease-free H2O | Invitrogen | 10526945 | |
| 10X TURBO DNase | Ambion | AM1907 | |
| Qubit RNA HS, BR Kit | Invitrogen | Q10210 | |
| Agilent RNA 6000 Nano Kit | Agilent | 5067-1511 | |
| SuperScriptIII first strand synthesis kit | Invitrogen | 18080051 | |
| PCR Reagents | Bioline Mytaq Red 2X | BIO-25043 | |
| qPCR Reagents | Sensifast SYBR Hi Rox | BIO-92020 | |
| PCR purification kit | Isolate II PCR and Gel Kit | BIO-52060 | |
| TA cloning kit | TA Cloning Kit, with pCR 2.1 Vector, without competent cells | K202040 | |
| StepOne Real Time PCR system | Thermo Fisher Scientific | 4376600 |
Références
- Lin, D. M., Koskella, B., Lin, H. C. Phage therapy: An alternative to antibiotics in the age of multi-drug resistance. World Journal of Gastrointestinal Pharmacology and Therapeutics. 8 (3), 162-173 (2017).
- Jiang, W., Marraffini, L. A. CRISPR-Cas: New tools for genetic manipulations from bacterial immunity systems. Annual Review of Microbiology. 69 (1), 209-228 (2015).
- Santos, S. B., Azeredo, J. Bacteriophage-based biotechnological applications. Viruses. 11 (8), 737(2019).
- Rodríguez-Rubio, L., Jofre, J., Muniesa, M. Is genetic mobilization considered when using bacteriophages in antimicrobial therapy. Antibiotics. 6 (4), 32(2017).
- Hatfull, G. F. Dark Matter of the biosphere: The amazing world of bacteriophage diversity. Journal of Virology. 89 (16), 8107-8110 (2015).
- Yukgehnaish, K., et al. PhageLeads: Rapid assessment of phage therapeutic suitability using an ensemble Machine Learning approach. Viruses. 14 (2), 342(2022).
- Seemann, T. Prokka: Rapid prokaryotic genome annotation. Bioinformatics. 30 (14), 2068-2069 (2014).
- Arndt, D., et al. PHASTER: A better, faster version of the PHAST phage search tool. Nucleic Acids Research. 44, W16-W21 (2016).
- Banerjee, S., et al. FINDER: An automated software package to annotate eukaryotic genes from RNA-Seq data and associated protein sequences. BMC Bioinformatics. 22 (1), 205(2021).
- Jumper, J., et al. Highly accurate protein structure prediction with AlphaFold. Nature. 596 (7873), 583-589 (2021).
- Veses-Garcia, M., et al. Transcriptomic analysis of Shiga-toxigenic bacteriophage carriage reveals a profound regulatory effect on acid resistance in Escherichia coli. Applied and Environmental Microbiology. 81 (23), 8118-8125 (2015).
- Owen, S. V., et al. A window into lysogeny: revealing temperate phage biology with transcriptomics. Microbial Genomics. 6 (2), e000330(2020).
- Davies, E. V., Winstanley, C., Fothergill, J. L., James, C. E. The role of temperate bacteriophages in bacterial infection. FEMS Microbiology Letters. 363 (5), 015(2016).
- Livny, J., Friedman, D. I. Characterizing spontaneous induction of Stx encoding phages using a selectable reporter system. Molecular Microbiology. 51 (6), 1691-1704 (2004).
- Fogg, P. C. M., et al. Identification of multiple integration sites for Stx-phage Φ24B in the Escherichia coli genome, description of a novel integrase and evidence for a functional anti-repressor. Microbiology. 153 (12), 4098-4110 (2007).
- James, C. E., et al. Differential infection properties of three inducible prophages from an epidemic strain of Pseudomonas aeruginosa. BMC Microbiology. 12, 216(2012).
- Riley, L. M., et al. Identification of genes expressed in cultures of E. coli lysogens carrying the Shiga toxin-encoding prophage Φ24B. BMC Microbiology. 12 (1), 42(2012).
- Stover, C. K., et al. Complete genome sequence of Pseudomonas aeruginosa PAO1, an opportunistic pathogen. Nature. 406 (6799), 959-964 (2000).
- Winstanley, C., et al. Newly introduced genomic prophage islands are critical determinants of in vivo competitiveness in the Liverpool Epidemic Strain of Pseudomonas aeruginosa. Genome Research. 19 (1), 12-23 (2009).
- Davies, E. V., et al. Temperate phages enhance pathogen fitness in chronic lung infection. The ISME Journal. 10 (10), 2553-2555 (2016).
- Allison, H. E. Stx-phages: drivers and mediators of the evolution of STEC and STEC-like pathogens. Future Microbiology. 2 (2), 165-174 (2007).
- Allison, H. E., et al. Immunity profiles of wild-type and recombinant Shiga-like toxin-encoding bacteriophages and characterization of novel double lysogens. Infection and Immunity. 71 (6), 3409-3418 (2003).
- Mori, N., et al. A peptide based on homologous sequences of the β-barrel assembly machinery component BamD potentiates antibiotic susceptibility of Pseudomonas aeruginosa. Journal of Antimicrobial Chemotherapy. 67 (9), 2173-2181 (2012).
- Chojnacki, M., et al. A novel, broad-spectrum antimicrobial combination for the treatment of Pseudomonas aeruginosa corneal infections. Antimicrobial Agents and Chemotherapy. 63 (10), e00777(2019).
- Miles, A. A., Misra, S. S., Irwin, J. O. The estimation of the bactericidal power of the blood. Epidemiology & Infection. 38 (6), 732-749 (1938).
- Srikumar, S., et al. RNA-seq brings new insights to the intra-macrophage transcriptome of Salmonella Typhimurium. PLoS Pathogens. 11 (11), e1005262(2015).
- Kröger, C., et al. The transcriptional landscape and small RNAs of Salmonella enterica serovar Typhimurium. Proceedings of the National Academy of Sciences of the United States of America. 109 (20), E1277-E1286 (2012).
- Green, M. R., Sambrook, J. How to win the battle with RNase. Cold Spring Harbor Protocols. (2), (2019).
- Koetsier, G. A practical guide to analyzing nucleic acid concentration and purity with microvolume spectrophotometers. New England BioLabs Inc. , Available from: https://www.neb.com/-/media/nebus/files/application-notes/technote_mvs_analysis_of_nucleic_acid_concentration_and_purity.pdf?rev=c24cea043416420d84fb6bf7b554dbbb (2019).
- Saunders, N. A., Lee, M. A. Real-Time PCR: Advanced Technologies and Applications. , Caister Academic Press. Norfolk, UK. (2013).
- Bustin, S. A. A-Z of Quantitative PCR. , International University Line. La Jolla, CA. (2004).
- Ruijter, J. M., et al. Efficiency correction is required for accurate quantitative PCR analysis and reporting. Clinical Chemistry. 67 (6), 829-842 (2021).
- Fothergill, J. L., Neill, D. R., Loman, N., Winstanley, C., Kadioglu, A. Pseudomonas aeruginosa adaptation in the nasopharyngeal reservoir leads to migration and persistence in the lungs. Nature Communications. 5 (1), 4780(2014).
- Huang, J., et al. Temperature-dependent expression of phzM and its regulatory genes lasI and ptsP in rhizosphere isolate Pseudomonas sp. strain M18. Applied and Environmental Microbiology. 75 (20), 6568-6580 (2009).
- Savli, H., et al. Expression stability of six housekeeping genes: a proposal for resistance gene quantification studies of Pseudomonas aeruginosa by real-time quantitative RT-PCR. Journal of Medical Microbiology. 52 (5), 403-408 (2003).
- Kassambara, A. rstatix: Pipe-Friendly Framework for Basic Statistical Tests. , Available from: https://CRAN.R-project.org/package=rstatix (2022).
- McDonald, J. E., et al. High-throughput method for rapid induction of prophages from lysogens and its application in the study of Shiga toxin-encoding Escherichia coli strains. Applied and Environmental Microbiology. 76 (7), 2360-2365 (2010).
- Smith, D. L., et al. Short-tailed Stx phages exploit the conserved YaeT protein to disseminate Shiga toxin genes among Enterobacteria. Journal of Bacteriology. 189 (20), 7223-7233 (2007).
- James, C. E., et al. Lytic and lysogenic infection of diverse Escherichia coli and Shigella strains with a verocytotoxigenic bacteriophage. Applied and Environmental Microbiology. 67 (9), 4335-4337 (2001).
- Rees, V. E., et al. Characterization of hypermutator Pseudomonas aeruginosa isolates from patients with cystic fibrosis in Australia. Antimicrobial Agents and Chemotherapy. 63 (4), e02538(2019).
- Li, Y., et al. Excisionase in Pf filamentous prophage controls lysis-lysogeny decision-making in Pseudomonas aeruginosa. Molecular Microbiology. 111 (2), 495-513 (2019).
- Van Kampen, A. H. C., Moerland, P. D. Taking bioinformatics to systems medicine. Systems Medicine. 1386, 17-41 (2016).
- Matsushiro, A., Sato, K., Miyamoto, H., Yamamura, T., Honda, T. Induction of prophages of enterohemorrhagic Escherichia coli O157:H7 with norfloxacin. Journal of Bacteriology. 181 (7), 2257-2260 (1999).
- James, C. E., et al. Lytic activity by temperate phages of Pseudomonas aeruginosa in long-term cystic fibrosis chronic lung infections. The ISME Journal. 9 (6), 1391-1398 (2015).
- Shaw, K. J., et al. Comparison of the changes in global gene expression of Escherichia coli induced by four bactericidal agents. Microbial Physiology. 5 (2), 105-122 (2003).
- Long, H., et al. Antibiotic treatment enhances the genome-wide mutation rate of target cells. Proceedings of the National Academy of Sciences of the United States of America. 113 (18), E2498-E2505 (2016).
- González-Tortuero, E., et al. VIGA: A sensitive, precise and automatic de novo VIral Genome Annotator. bioRxiv. , (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon