Method Article
Den Einfluss von Bakteriophagen in gemäßigten Breiten auf ihre Lysogene durch Transkriptomik verstehen
In diesem Artikel
Zusammenfassung
Dieses Protokoll ermöglicht es, die Auswirkungen von Prophagen auf ihre Wirte aufzudecken. Die Bakterienkulturen werden unter Bedingungen synchronisiert, die den lysogenen Zustand am besten unterstützen und die spontane Induktion begrenzen. Die RT-qPCR unterscheidet eindeutig zwischen Prophagen-restriktiven Genen und solchen, die von der Phagenkontrolle abgekoppelt sind, von solchen, die während des lytischen Replikationszyklus exprimiert werden.
Zusammenfassung
Phagen der gemäßigten Breiten sind als Prophagen in die meisten bakteriellen Genome integriert. Einige Prophagen sind kryptisch und im bakteriellen Chromosom fixiert, andere sind jedoch aktiv und können entweder spontan oder durch die Exposition gegenüber induzierenden Faktoren in eine replikative Form getriggert werden. Prophagen werden häufig mit der Fähigkeit in Verbindung gebracht, ihrer Wirtszelle Toxinproduktion oder andere virulenzassoziierte Eigenschaften zu verleihen. Neuere Studien haben gezeigt, dass sie eine viel größere Rolle bei der Veränderung der Physiologie ihrer Wirte spielen können. Mit der hier beschriebenen Technik konnten wir untersuchen, wie Prophagen die Genexpression im opportunistischen Bakterium Pseudomonas aeruginosa beeinflussen.
In dieser Arbeit wurde das Wachstum des Wildtyp-P. aeruginosa-Stammes PAO1 mit dem von isogenen Lysogenen verglichen, die verschiedene Kombinationen von Prophagen aus dem Liverpool Epidemic (LES) LESB58 tragen. In einer Lysogenkultur unterstützt ein Teil der Bakterienzellen die lytische Bakteriophagenreplikation (spontane Induktion) mit einer hohen Expression von späten Phagengenen pro Zelle, wie sie mit der Assemblierung von Phagenpartikeln verbunden sind, und maskiert so die mit der Lysogen-eingeschränkten Genexpression verbundene Genexpression auf niedrigem Niveau. Die Auswirkungen der spontanen Induktion können daher die Expression von Prophagen-Genen in einer Lysogenpopulation verschleiern.
Wachstumsprofiling-Experimente wurden verwendet, um eine spontane Induktion zu identifizieren, die während der frühen exponentiellen Wachstumsphase minimal war. In dieser Studie wird berichtet, wie Probenkulturen während der frühen exponentiellen Wachstumsphase präpariert werden können und wie trotz geringer Zellzahlen adäquate Kontrollen eingerichtet werden können. Diese Protokolle gewährleisten den zuverlässigen und reproduzierbaren Vergleich von Wildtyp- und lysogenen Bakterien unter verschiedenen Bedingungen, wodurch das transkriptomische Profiling von Prophagengenomen verbessert und die Identifizierung bisher unbekannter Prophagenfunktionen unterstützt wird.
Einleitung
In jüngster Zeit haben die Phagentherapie zur Bekämpfung der antimikrobiellen Resistenz1 und die CRISPR-Cas-basierte Geneditierung2 das Interesse an der Bakteriophagenforschung wieder geweckt. Auch hier haben Fortschritte in der Biotechnologie eine tiefere Untersuchung der Wechselwirkungen zwischen Bakterien und Phagen ermöglicht3. Der therapeutische Einsatz von Phagen ("Phagentherapie") wird jedoch durch Bedenken behindert, dass Phagen als mobile genetische Elemente fungieren und in der Lage sind, Virulenz- und Resistenzgene horizontal zu übertragen4. Die Ausdehnung der "Dunklen Materie"5 (Gene mit unbekannten Funktionen) ist sowohl beunruhigend als auch verlockend. Dunkle Materie gilt als eine Lücke in unserem Verständnis der Phagenbiologie und als weitgehend ungenutzte Ressource für molekulare Werkzeuge und potenzielle neuartige Therapeutika6. Die Entwicklung von Hochdurchsatz-Sequenzierungstechniken, zusammen mit verbesserter Genannotation 7,8,9 und neuen Peptidfaltungsalgorithmen10, verbessert die Detektion, Beschreibung und funktionelle Vorhersage von Phagengenen. Die Wissenschaft ist jedoch noch weit davon entfernt, die Genfunktionen der meisten Phagen in Kultur oder in der realen Welt zu validieren.
Die RNA-Sequenzierung (RNA-Seq) kann die Genexpression während einer Phageninfektion global abbilden und hat das Verständnis sowohl der Phagen- als auch der bakteriellen Elemente, die an lytischen und lysogenen Zyklen beteiligt sind, erheblich verbessert11,12. Während lysogener Prozesse werden gemäßigte Phagengenome in bakterielle DNA integriert, um zu Prophagen zu werden13. Globale Genexpressions-Profiling-Experimente können verwendet werden, um Prophagen-restriktive Gene zu identifizieren, die auf gemäßigten Phagengenomen kodiert, aber nur während des lysogenen Zustands exprimiert werden11. Solche Gene kodieren keine Phagen-Strukturproteine und sind nicht an Phageninfektionsprozessen beteiligt. RNA-Seq kann verwendet werden, um diejenigen Gene zu identifizieren, die mit größerer Wahrscheinlichkeit die Biologie des bakteriellen Wirts beeinflussen, entweder indem sie einen Funktionsgewinn induzieren oder die vorhandenen bakteriellen Gene regulieren, wodurch sich die Bakterien oft an veränderte Umgebungen anpassen können. Daher konnte die Fähigkeit von Prophagen untersucht werden, als mikrobielle Puppenspieler zu fungieren, die eine Reihe von bakteriellen Funktionen steuern.
Es gibt zwei Haupthindernisse für die effektive Analyse der Prophagen-restriktiven Genexpression. Erstens ist die Verfügbarkeit von anfälligen Wirten ein zentrales Thema. Per Definition sind Prophagen bereits in ihr spezifisches Wirtsgenom eingebaut, so dass es schwierig ist, einen empfänglichen Wildtyp-Wirt zu finden, um die globale Genexpression in An- und Abwesenheit des Prophagen zu vergleichen. Dies kann entweder durch die De-novo-Infektion eines anderen empfänglichen Wirts oder durch die Deletion des Prophagen aus dem ursprünglichen Wildtyp-Isolat erreicht werden, ohne den Rest des Wirtsgenoms zu stören. Das zweite Hindernis liegt in der heterogenen Natur der lysogenen Populationen. Einige Prophagen werden durch Mutation oder Rekombination abgebaut, um "kryptisch" zu werden, was bedeutet, dass sie an einer bestimmten Stelle des bakteriellen Genoms fixiert sind. Andere Prophagen sind jedoch "aktiv" und können spontan oder nach Exposition gegenüber induzierenden Faktoren in einen replikativen, lytischen Zyklus induziert werden. In vielen lysogenen Kulturen führt die Geschwindigkeit der spontanen Induktion dazu, dass ein Teil der Bakterienzellen immer eine lytische Phagenreplikation durchläuft14,15,16. Eine hohe Expression von späten Phagengenen in diesen Populationen maskiert die niedrige Genexpression, die mit der Lysogen-restriktiven Genexpression assoziiert ist11,17. Der Anteil der Lysogene, die eine spontane Prophageninduktion durchlaufen, kann mit dem Wachstumszustand, den Wachstumsbedingungen oder anderen Auslösern variieren. Um die Auswirkungen von Prophagen auf das Lysogen zu untersuchen, müssen daher spontane Prophageninduktionsereignisse so weit wie möglich minimiert werden, indem die Wachstumsbedingungen optimiert werden, um den lysogenen Zustand zu begünstigen.
Diese Studie berichtet über die Vorarbeiten, die durchgeführt wurden, um den Einfluss einer Reihe von kohabitierenden Prophagen aus dem Liverpool Epidemic Strain (LES) von Pseudomonas aeruginosa zu untersuchen. Aktive Prophagen wurden induziert und aus LES isoliert und zur Infektion des Modell-P. aeruginosa-Wirtsstamms, PAO116,18,19, verwendet. Die gesamten Genome des Wildtyp-P. aeruginosa-Stammes, PAO1, und seines Lysogens, PAO1Φ2, wurden sequenziert (in einer Tiefe von 30-facher Abdeckung), um die Identität des Wildtyp-Stammes sicherzustellen und zu bestätigen, dass das Lysogen isogen ist. Der LES wurde mit einer erhöhten Morbidität und Mortalität bei Mukoviszidose-Patienten in Verbindung gebracht, und es wurde vermutet, dass LES-Phagen 19 die Anpassung an die Mukoviszidose-Lungenumgebung unterstützen16,19,20. Trotz starker Hinweise darauf, dass diese Prophagen die Biologie ihres Wirts beeinflussen20,21, müssen die meisten ihrer Genfunktionen noch charakterisiert werden, und die spezifischen Mechanismen der Interaktion sind nur unzureichend verstanden. Ein Transkriptomik-Ansatz kann die Funktionen des Prophagen-Gens in einem kontrollierten Wirtshintergrund empirisch aufdecken. Da die spontane Induktion die Expressionsprofile beeinflussen kann, wird in diesem Artikel beschrieben, wie die Wachstumsbedingungen optimiert werden können, um den lysogenen Zustand zu begünstigen. Eine solche Synchronisierung von Kulturen kann durch Real-Time-PCR validiert werden, um die Expressionsniveaus wichtiger genetischer Marker zu quantifizieren, die mit entscheidenden Stadien der LES-Phagenreplikation in PAO1 assoziiert sind. Derselbe Ansatz wurde bereits verwendet, um die prophageneingeschränkten Funktionen von Shiga-toxigenen Phagen zu identifizieren, die die Motilität, Säureresistenz und antimikrobielle Resistenz in Escherichia coli11,17,21,22 beeinflussen.
Protokoll
1. Erstellen eines auswählbaren Indikatorhosts (Abbildung 1)
HINWEIS: Phagenkulturlysate können kontaminierende Zellen des ursprünglichen bakteriellen Wirts enthalten. Ein antibiotikaresistenter Indikatorstamm ermöglicht die Unterscheidung zwischen dem Indikatorstamm und dem ursprünglichen bakteriellen Wirt des Prophagen. Die Verwendung eines wählbaren Indikatorstamms ermöglicht die genaue Zählung der infektiösen Phagenpartikel, ohne dass Zentrifugations- oder Filtrationsschritte erforderlich sind, um den Phagen nach den Phagenamplifikationsschritten aus den Lysogenzellen zu entfernen. Der wählbare Indikator-Wirtsstamm reduziert auch die Zeit und die Anzahl der Schritte für die Phagenzählung, so dass mehrere Bedingungen gleichzeitig getestet werden können.
- Identifizierung eines geeigneten Indikator-Wirtsstamms, der für lytische und lysogene Infektionen durch den interessierenden gemäßigten Phagen empfänglich ist. Es wurde der P. aeruginosa-Laborstamm PAO118,20 verwendet, der für die drei LES-Phagen (LESΦ2, LESΦ3 und LESΦ4) empfänglich ist.
- Wählen Sie ein geeignetes selektives Mittel (hier wurde Rifampicin verwendet) und führen Sie einen Bouillonverdünnungsassay durch, um die minimale Hemmkonzentration (MHK) für den Indikatorwirt zu bestimmen (16 μg·mL−1 ist das MHK für PAO1)23,24.
- Die Wirtskulturen des Indikators werden nacheinander steigenden Konzentrationen des selektiven Wirkstoffs in Lysogenesebrühe (LB) ausgesetzt, beginnend unterhalb des MHK (in diesem Fall 5 μg·mL−1), für 18–24 Stunden, mit Schütteln und bei 37 °C.
- Die Kultur, die in der höchsten Konzentration im Verhältnis 1:100 (Inokulum zu Medium) wächst, wird in zweifach erhöhte Konzentrationen des selektiven Mittels überführt (jeweils 18–24 h), bis die MHK ausreichend erhöht ist. PAO1 wurde bei 300 μg·mL−1 Rifampicin zu einem Rifampicin-resistenten Stamm (PAO1-Rif R).
2. Zeitliche direkte Zählung der Spontaninduktion (Abbildung 2)
- Über Nacht werden Starterkulturen sowohl des Lysogens (z. B. P. aeruginosa PAO1-Lysogen, das LES-Phagen beherbergt) als auch des Indikatorwirts (PAO1-RifR) eingerichtet, indem eine einzelne Kolonie in 5 ml LB inokuliert und bei 37 °C mit Schütteln bei 180 U/min (18–24 h) inkubiert wird.
- Richten Sie frische Lysogen- und Indikatorwirtskulturen ein, indem Sie die Übernachtkulturen in 100 ml LB in einem Verhältnis von 1:100 inokulieren und bei 37 °C unter Schütteln (180 U/min) inkubieren.
- Überwachen Sie das Lysogenwachstum, indem Sie den OD600 und die Lebensfähigkeit mit der Miles-Misra-Technik25 messen. Zu diesem Zweck wird ab dem Zeitpunkt der Inokulation 8 h lang stündlich eine 1-ml-Probe aus jeder Lysogenkultur entnommen.
- Verdünnen Sie die Probe unmittelbar nach der Entnahme seriell durch Zugabe von 100 μl der Probe zu 900 μl des jeweiligen Mediums. Vortex-Brunnen mit maximaler Geschwindigkeit, verwerfen Sie die Spitze bei jeder Verdünnung und setzen Sie die Verdünnungsreihe von 10−1 bis 10−9 fort.
- 10 μl der erforderlichen Verdünnungen in dreifacher Ausführung auf eine LB-Agarplatte geben, trocknen lassen und bei 37 °C 18–24 h inkubieren.
- Um die Anzahl lebensfähiger Bakterienzellen zu berechnen, suchen Sie eine Verdünnung mit leicht zählbaren Kolonien. Zählen Sie die Anzahl der Kolonien an jeder Stelle, und verwenden Sie dann die folgende Formel:

HINWEIS: Wenn die Lysogenkultur wächst, werden aktive Phagenpartikel durch spontane Induktion produziert. Die Produktion infektiöser Phagen bedeutet, dass das Transkriptom der Lysogenpopulation nun mit der lytischen Replikationszyklus-assoziierten Genexpression aus dem lytischen Phagenreplikationssignal und der entsprechenden Wirtszellantwort kontaminiert ist. Es ist daher wichtig, das Wachstumsstadium zu identifizieren, in dem der Anteil lysogener Zellen an freien infektiösen Phagenpartikeln am höchsten ist, um so viel Hintergrund-Transkriptionsrauschen (erzeugt durch das lytische Phagen-Transkriptom) im Datensatz zu begrenzen.
- Um die infektiösen Phagenpartikel in jeder temporalen Probe zu zählen, werden 5 ml steriler 0,4%iger bakteriologischer Agar in LB (Top-Agar) mit 100 μl Indikatorwirt der mittleren exponentiellen Phase (OD600: 0,4–0,5; in diesem Fall PAO1-RifR) in Gegenwart eines geeigneten selektiven Wirkstoffs (in diesem Fall 50 μg·mL−1 Rifampicin) inokuliert, da die MHK des PAO1-Wirts nur 16 μg·mL−1 beträgt; siehe Materialtabelle, Reihe 8 und Reihe 9)
- 10 μl derselben seriellen Verdünnung (siehe Schritt 2.2.2) auf die inokulierte obere Agarschicht geben und trocknen lassen, bevor sie 18–24 Stunden lang bei 37 °C inkubiert werden.
- Um die infektiösen Phagenpartikel zu berechnen, finden Sie eine Verdünnung mit leicht abzählbaren Plaques. Zählen Sie die Anzahl der Tafeln an jeder Stelle.

- Ermitteln Sie die Zeit/Bedingung, für die die spontane Induktion pro KBE (koloniebildende Einheit) für die weiteren Versuchsschritte minimal ist.
3. Herstellung von induzierten und induzierten Lysogenkulturen für die RNA-Extraktion (Abbildung 3)
- Richten Sie eine frische Kultur über Nacht ein, indem Sie eine einzelne Kolonie des Lysogens in 5 ml LB inokulieren und bei 37 °C unter Schütteln (180 U/min) für 18–24 Stunden inkubieren.
- Subkultur der Übernachtkultur in 80 ml LB in einem Verhältnis von 1:100 in acht 250-ml-Kolben.
- Kennzeichnen Sie den ersten Kolben als "nicht induziert" und die anderen als "induziert", zusammen mit den Zeitpunkten, zu denen jede Probe entnommen werden soll (d. h. "induziert t = 0", "induziert t = 10 min", "induziert t = 20 min" usw.; Abbildung 3).
- Nach 90 Minuten Inkubation, wenn der OD600 zwischen 0,1 und 0,2 liegt, oder zum Zeitpunkt der minimalen spontanen Induktion (siehe Diskussion), werden 4 μl 1%ige Eisessigsäure (v/v) in den nicht induzierten Kolben gegeben (Abbildung 3).
ANMERKUNG: Da das Induktionsmittel in dieser Arbeit unter Verwendung von 1%iger Eisessigsäure als Lösungsmittel hergestellt wurde, wurde die gleiche Menge Lösungsmittel allein als Kontrollschritt zugegeben. Alternative Kontrollen können je nach Herstellung der verschiedenen Induktoren in Betracht gezogen werden. - Man gibt die 80-ml-Kultur aus dem nicht induzierten Kolben zu 720 ml sterilem LB und fügt sofort die Stopplösung (eiskaltes 5%iges [v/v]-Phenol, pH-Wert 4,3, 95-%iges [v/v]-Ethanol) unter Verwendung eines Volumens hinzu, das 20 % des Kulturvolumens (160 ml) beträgt, und inkubiert auf Eis für mindestens 30 Minuten und nicht länger als 2 Stunden, um die RNA-Transkriptezu stabilisieren 12, 26,27. Dies ist die nicht induzierte Probe.
- Die übrigen Kulturen werden in sieben 250-ml-Kolben (Abbildung 3) mit dem MHK eines geeigneten Induktionsmittels (in diesem Fall 25 mg·ml−1 Norfloxacin, hergestellt in 1%iger Eisessigsäure [w/v], verwendet in einer Endkonzentration von 1 μg·ml−1) induziert, gut gemischt und bei 37 °C und unter Schütteln bei 180 U/min für 1 h inkubiert.
ANMERKUNG: Dieser Schritt zwingt die Lysogenkultur in einen besser koordinierten Zustand der lytischen Replikation. Die meisten Zellen in der Kultur beginnen mit der lytischen Produktion von infektiösen Phagenpartikeln. - Lassen Sie die Zellen sich erholen, indem Sie 80 ml Kultur aus dem induzierten Kolben zu 720 ml sterilem LB hinzufügen, wodurch das induzierende Mittel effektiv verdünnt wird. Die Bakterienzellen werden alle 10 Minuten von 0 bis 1 h aus jedem Kolben entnommen, indem eine Stopplösung zugegeben wird, wie in Schritt 3.5 beschrieben.
HINWEIS: Die Stopplösung stabilisiert die RNA für bis zu 2 Stunden. Um jedoch die Probenstabilität zu erhöhen, führen Sie alle weiteren Schritte bei 4 °C durch. - Ernte durch Zentrifugation bei 10.000 x g für 15 Minuten bei 4 °C so bald wie möglich, nicht länger als 2 Stunden nach der Behandlung, um einen RNA-Abbau zu vermeiden.
- Verwerfen Sie den Überstand und resuspendieren Sie die Bakterienpellets vorsichtig mit einer einstellbaren automatischen Pipette in der Restflüssigkeit, bevor Sie jede Probe in ein 1,5-ml-Mikrofugenröhrchen überführen.
- Die Mikrofugenröhrchen werden bei hoher Geschwindigkeit (13.000 x g) in einer Mikrofuge bei 4 °C für 1 min zentrifugiert und der restliche Überstand entsorgt.
- Gefrieren Sie die Pellets schockgefrieren, indem Sie jedes versiegelte Mikrofugenröhrchen in flüssigen Stickstoff tauchen. Dies wird die effiziente Lyse der Zellen für die RNA-Extraktion unterstützen.
- Geben Sie TRIzol (1 ml) zu jedem gefrorenen Pellet und homogenisieren Sie die Suspension durch Pipettieren (nicht vortexen). Bei −80 °C lagern, bis die RNA-Extraktion für alle Proben durchgeführt werden kann.
HINWEIS: Das Protokoll kann an dieser Stelle pausiert werden. - Wiederholen Sie die Schritte 3.1 bis 3.13 mit drei biologischen Replikaten.
4. Isolierung von RNA aus nicht-induzierten und induzierten Lysogenkulturen
KRITISCH: Alle diese Schritte sollten in einer RNase-freien Umgebung durchgeführt werden28. Die Werkbänke sollten mit 10% NaClO oder proprietären RNase-Inaktivatoren abgewischt werden. Die Laborgeräte sollten mit RNase-Inhibitoren wie der DEPC-Behandlung behandelt werden, und bei allen Reaktionen sollte nukleasefreies Wasser verwendet werden.
- Die gefrorenen TRIzol-behandelten Pellets aus Schritt 3.12 auf Eis auftauen und 400 μl molekularbiologisches Chloroform hinzufügen.
- Rühren Sie die Fläschchen 10 s lang gut um, um die Lyse aller Zellen abzuschließen ( kein Wirbel). Anschließend bei Raumtemperatur (21 °C) 2–5 Minuten inkubieren.
- Trennen Sie die wässrige Schicht von der TRIzol/Chloroform-Mischung durch Zentrifugation mit einer gekühlten Tischmikrofuge bei 4 °C und 13.000 x g für 15 min.
- Sammeln Sie die wässrige Phase (~ 500 μl, obere Schicht) mit einer 1.000-μl-Pipette, wobei darauf zu achten ist, dass die Interphase oder die organische Phase (untere Schicht) nicht gestört wird. In ein neues 1,5-ml-Mikrofugenröhrchen umfüllen.
- 450 μl Isopropanol in molekularbiologischer Qualität in die abgetrennte wässrige Phase geben, durch Inversion gut mischen ( nicht vortexen) und bei Raumtemperatur (21 °C) 30 Minuten lang inkubieren.
- Die RNA wird durch Zentrifugation in einer gekühlten Zentrifuge bei 4 °C und 13.000 x g für 30 min zurückgewonnen.
- Verwerfen Sie den Überstand, ohne das RNA-Pellet zu stören, und waschen Sie das Pellet zweimal mit 800 μl 70 %igem Ethanol, das mit nukleasefreiem Wasser zubereitet wurde (nicht auf- und abpipettieren). Stellen Sie die Stabilität des RNA-Pellets sicher, indem Sie den Zentrifugationsschritt nach jedem Waschen 5 Minuten lang wiederholen.
- Entsorgen Sie das Ethanol und trocknen Sie das Pellet an der Luft.
HINWEIS: Saugen Sie das Ethanol vorsichtig mit einer 10-μl-Mikrospitze um das Pellet herum an und trocknen Sie das Pellet, indem Sie das Röhrchen auf sauberem Löschpapier umdrehen. Das RNA-Pellet sollte farblos werden und die Ränder sollten gekräuselt und sichtbar erscheinen. Eine zu geringe Trocknung kann Ethanolreste hinterlassen, die sich auf nachgelagerte Prozesse auswirken können, und eine zu starke Trocknung des Pellets kann die Resuspension erschweren. - Resuspendieren Sie die RNA in nukleasefreiem Wasser (50 μl), indem Sie bei 65 °C auf einem Thermoschüttler mit intermittierendem Mischen (alle 30 s) für insgesamt 3–5 Minuten inkubieren.
KRITISCH: Die 2'-OH-Gruppe der RNA ist in der Lage, die Autospaltung von RNA-Strängen bei einer hohen Temperatur über 65 °C und einem hohen pH-Wert zu katalysieren. Temperaturen unter 65 °C verzögern die Resuspension der Rest-DNA und begrenzen so die Menge an DNA, die zu einem späteren Zeitpunkt mit dem DNase-I-Verdau verdaut werden muss. Daher ist es wichtig, die Temperatur bei 65 °C zu halten, um die besten Proben zu erhalten.
HINWEIS: Das Protokoll kann an dieser Stelle pausiert werden, und die Proben können bei −80 °C gelagert werden.
5. Entfernung kontaminierender DNA aus der RNA durch DNase-Behandlung
- Um kontaminierende DNA aus der Gesamt-RNA vor der cDNA-Synthese des ersten Strangs zu entfernen, fügen Sie 10 μg Gesamt-RNA 0,1 Volumen 10x DNase-Puffer und 1 μL DNase-Enzym hinzu. Das Röhrchen vorsichtig mischen und bei 37 °C 30 Minuten lang inkubieren.
- Resuspendieren Sie das DNase-Inaktivierungsreagenz und fügen Sie mindestens 2 μl oder 10 Vol.-% des gesamten Reaktionsvolumens hinzu. Mischen Sie gut und inkubieren Sie die Proben 5 Minuten lang bei Raumtemperatur (21 °C) während der Redispergierung des DNase-Inaktivierungsreagenzes.
- Pelletieren Sie die DNase-Reagenzien durch Zentrifugation mit einer Tischmikrozentrifuge bei 10.000 × g für 1,5 Minuten.
- Den Überstand, der die RNA enthält, in ein frisches Röhrchen überführen, ohne das Pellet zu stören.
HINWEIS: Überprüfen Sie die Qualität der RNA mit einem UV-Spektrophotometer im 1-μl-Maßstab und einem mikrofluidischen Nukleinsäure-Computeranalysator gemäß den Anweisungen des Herstellers. gereinigte Gesamt-RNA kann bei −80 °C gelagert werden. Für qRT-PCR könnte RNA direkt an dieser Stelle eingesetzt werden. Für empfindlichere nachgelagerte Prozesse, wie z. B. die RNA-Sequenzierung, die eine strenge Probenqualität erfordern, muss einA-260/230-Verhältnis von ε 2,0 erreicht werden, um fortzufahren. - Das Volumen der DNA-freien RNA-Lösung wird mit nukleasefreiem Wasser auf 500 μl aufgefüllt.
- Fügen Sie 50 μl nukleasefreies 3 M Natriumacetat (pH 5,3) und 495 μl Isopropanol hinzu. Gut mischen und 30 Minuten bei Raumtemperatur inkubieren.
HINWEIS: In diesem Schritt wird die RNA ausgefällt. - Die RNA wird durch Zentrifugation bei 13.000 x g und 4 °C für 30 min gewonnen.
- Waschen Sie das RNA-Pellet dreimal mit eiskaltem 70%igem Ethanol, indem Sie die Proben nach jedem Waschen 5 Minuten lang bei 13.000 x g und 4 °C zentrifugieren, um die Salze vollständig zu entfernen.
- Überprüfen Sie die Qualität der RNA mit einem UV-Spektrophotometer im 1-μl-Maßstab und einem mikrofluidischen Nukleinsäure-Computeranalysator gemäß den Anweisungen des Herstellers. gereinigte Gesamt-RNA kann bei −80 °C gelagert werden.
ANMERKUNG: Die Führung29 wurde verwendet, um die RNA-Qualitätsstandards zu erreichen. Wenn das Verhältnis A260/230 <2,0 beträgt, wiederholen Sie die Schritte 5,5 bis 5,9.
6. Qualitative und quantitative Analyse der DNase-freien RNA
- Validieren Sie die Wirksamkeit der DNase-Behandlung für jede Probe, indem Sie eine quantitative PCR mit 16S rRNA-Primern (Tabelle 2) mit 1 μg Gesamt-RNA durchführen und bestätigen, dass kein Amplifikationsprodukt produziert wird.
ANMERKUNG: Die idealen Primer zur Beurteilung der gDNA-Kontamination wären Primer, die so konzipiert sind, dass sie an Intron-Exon-Verbindungen oder regulatorischen Regionen in Prokaryoten oder an transkriptionell inaktiven Stellen annealisieren30,31. - Bestimmen Sie die RNA-Integritätszahl (RIN) mit einem mikrofluidischen Nukleinsäure-Computeranalysator gemäß den Anweisungen des Herstellers.
HINWEIS: Für die Erststrangsynthese sollten Proben verwendet werden, die einen RIN ≥ 9 aufweisen. Proben, die eine RIN < 9 aufweisen, sollten verworfen werden, und die Isolationsschritte (1.1–5.4) sollten wiederholt werden. - Quantifizieren Sie die Gesamt-RNA-Konzentration mit dem HS-RNA-Assay-Kit und einem Fluorimeter gemäß den Anweisungen des Herstellers.
7. Erststrang-cDNA-Synthese
- Bereiten Sie für jede Probe eine RNA-Primermischung vor, indem Sie 1 μg Gesamt-RNA mit 1 μl zufälligen Hexameren (50 ng·μL−1) und 1 μl 10 mM dNTP-Mischung mischen. Stellen Sie dann das Gesamtvolumen mit nukleasefreiem Wasser auf 10 μl ein.
- Die Reaktion wird bei 65 °C 5 min lang inkubiert und 1 min lang auf Eis gelegt.
- Bereiten Sie für jede Probe eine cDNA-Synthesemischung vor, indem Sie 2 μl 10x RT-Puffer hinzufügen. 4 μl 25 mM MgCl2; 2 μl mit 0,1 M DVB-T; 1 μl RNase-Inhibitor (40 U·μL−1); und 1 μl des reversen Transkriptionsreagenzes (200 U·μL−1) in der angegebenen Reihenfolge.
- Die cDNA-Synthesemischung wird zur RNA/Primer-Mischung gegeben. Mischen Sie vorsichtig und zentrifugieren Sie die Proben kurz, um die Komponenten am Boden des Röhrchens zu sammeln.
- Die Mischung wird vorbereitet, indem die Proben 10 Minuten lang bei 25 °C und anschließend 50 Minuten bei 50 °C inkubiert werden. Die Reaktionen werden durch Inkubation bei 85 °C für 5 Minuten beendet und auf Eis gekühlt.
- Geben Sie 1 μl RNase H in jedes Röhrchen und inkubieren Sie bei 37 °C für 20 Minuten, um die RNA aus dem DNA:RNA-Hybrid zu entfernen.
- Zum Schluss wird die cDNA-Synthesereaktion auf ein Gesamtvolumen von 80 μl verdünnt und bis zur weiteren Verwendung bei −80 °C gelagert.
HINWEIS: Das Protokoll kann an dieser Stelle pausiert werden.
8. Standardkurve und quantitative (q)-PCR zur Bestimmung der Expressionsniveaus von Markergenen, die auf verschiedene Stadien der Phagenreplikation hinweisen
- Identifizieren Sie eine Reihe von Zielgenen, die als Marker für jedes Stadium der Replikation des interessierenden Phagen fungieren können. In unserem Fall waren diese wie in Tabelle 2 aufgeführt.
- Amplifikation jedes der Zielgene aus der genomischen DNA des Templates unter Verwendung relevanter Primer und unter Verwendung von PCR mit den folgenden Amplifikationsbedingungen: anfängliche Denaturierung bei 95 °C für 2 min; Denaturierung bei 95 °C für 30 s; Glühen bei optimaler Glühtemperatur je nach Primer (hier wurde 58 °C verwendet) für 30 s; Verlängerung bei 72°C für 1 min; und abschließende Verlängerung bei 72 °C für 5 min.
- Reinigen Sie jedes Amplikon mit einem PCR-Aufreinigungskit und klonen Sie es gemäß den Anweisungen des Herstellers in einen TA-Klonierungsvektor. Überprüfen Sie die Reihenfolge jedes geklonten Produkts durch Sanger-Sequenzierung.
HINWEIS: Das Protokoll kann an dieser Stelle pausiert werden. - Berechnen Sie die Kopienzahl für einzelne Plasmide mit der folgenden Gleichung20:
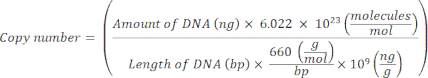
- Bereiten Sie ein Standard-Template für jedes Markergen vor, indem Sie die Plasmid-DNA seriell von 109 Kopien/μl auf 102 Kopien/μl in molekularem Nuklease-freiem sterilemH2Overdünnen.
- Führen Sie eine quantitative PCR gemäß den Anweisungen des Herstellers für das bevorzugte qPCR-System mit 1 μl cDNA (aus Schritt 7.7) für jede Probe in dreifacher Ausführung zusammen mit den jeweiligen Plasmidstandards in dreifacher Ausführung durch. Führen Sie die PCR in einer 96-Well-Platte für jedes Ziel durch.
- Stellen Sie die Log-DNA-Kopienzahl (x-Achse) im Vergleich zum Zyklusschwellenwert (y-Achse, Ct) dar und verwenden Sie eine geeignete Plattform wie Excel oder R, um eine lineare Regressionsberechnung durchzuführen, um den Bestimmtheitskoeffizienten (R2) und eine lineare Gleichung anzuzeigen.
HINWEIS: Das Bestimmtheitsmaß sollte über 0,98 liegen. - Schätzen Sie die Kopienzahl für jedes Ziel anhand der linearen Gleichung (y = mx + b), die aus der linearen Regression (Schritt 8.7) abgeleitet wurde, wobei y der geschätzte Ct-Wert ist. x ist die logarithmische DNA-Kopiennummer; m ist die Steigung der Linie, die die Änderung des Ct-Werts in Bezug auf die DNA-Kopienzahl definiert; und b ist der y-Achsenabschnitt, der die geschätzte Ct-Rate für eine DNA-Kopie32 darstellt.
- Berechnen Sie für jedes Markergen die Effizienz der PCR-Amplifikation (E) unter Verwendung der Parameter aus der linearen Regression der Standardkurve und der folgenden Gleichung, wobei m die aus Schritt 8.7 und Schritt 8.8 abgeleitete Steigung ist:
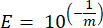
- Validieren Sie alle Primer hinsichtlich ihres prozentualen Wirkungsgrads anhand der folgenden Gleichung:
HINWEIS: Der Wirkungsgrad muss im Bereich von 90 % bis 110 % liegen.
- Berechnen Sie die absolute Kopienzahl der DNA mit der folgenden Formel:
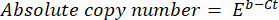
wobei Ct (Schritt 8.8) die Zyklusschwelle, b der Achsenabschnitt (Schritt 8.8), m die Steigung (Schritt 8.8) und E die Effizienz der PCR-Amplifikation (Schritt 8.9) ist.
KRITISCH: Beim Vergleich der Amplifikation von zwei oder mehr Targets mittels q-PCR muss die PCR-Effizienz für jedes Target berechnet werden, um die absoluten DNA-Kopienzahlen zu vergleichen. - In dieser Studie wurden die 16S rRNA-, proC- und rpoD-Gene als allgemeine interne Kontrollen und gyrB als Induktionskontrolle verwendet33,34,35.
HINWEIS: Bei der Auswahl interner Kontrollen aus den RNA-Sequenzierungsdaten ist es am besten, interne Kontrollen auszuwählen, deren Expressionsniveaus sich unter den getesteten Bedingungen nicht ändern. Für die sinnvolle Interpretation der Ergebnisse ist immer die sorgfältige Abwägung geeigneter Kontrollen wichtig.
Ergebnisse
In dieser Arbeit wurde die direkte zeitliche Zählung der Phagenproduktion aus einer PAO1 LESΦ2-Lysogenkultur, die unter nicht-induzierenden Bedingungen gezüchtet wurde, verwendet, um den Einfluss der spontanen LESΦ2-Induktion zu bestimmen. Die Phagendichte war mit einem Mittelwert von ~2,61 x 106 Plaque-bildenden Einheiten (PFU)·ml−1 2 h nach Subkultur in frischem Medium während der frühen exponentiellen Wachstumsphase am niedrigsten, was darauf hindeutet, dass die Lysogenese der dominante Zustand war. Der LESΦ2-Titer stieg innerhalb von 4 h rasch auf einen Mittelwert von ~2,4 x 108 PFU·mL− 1 an und erreichte nach 6 h die höchste Dichte (Mittelwert von ~5,83 x 109 PFU·mL−1; Abbildung 4).
Eine minimale spontane Induktion wurde während der frühen logarithmischen Phase des Lysogenwachstums (nach 2 h) beobachtet. Das messbare Vorhandensein von Phagen im Kulturmedium war jedoch das Ergebnis vieler früherer Ereignisse, einschließlich der folgenden: der Verpackung von Nukleinsäuren in Proteinköpfen, der Assemblierung von Proteinen in Phagenpartikeln und der Expression von späten Phagengenen, Phagengenen im mittleren Stadium und frühen regulatorischen Phagengenen. Es war wichtig, die infizierten Zellen vor der Expression der Phagen-assoziierten Replikationsereignisse abzufangen; Daher wurde 90 Minuten gewählt, um die Kultur vor der Induktion wachsen zu lassen. Um das Genexpressionsprofil des PAO1 zu erfassen, wurden LESΦ2-Lysogenproben aus einer Kultur vor und nach der Induktion über einen Zeitraum von 90 Minuten geerntet, wie in Schritt 3.4 erwähnt. Dieser 90-minütige Zeitpunkt liegt lange bevor mit dem Plaque-Assay aus Schritt 2.3.2 ein hohes Maß an spontaner Induktion des residenten Prophagen nachgewiesen wird. Da die bakterielle Zelldichte während des frühen exponentiellen Wachstums gering war, wurden die Kulturvolumina auf bis zu 800 ml skaliert, um ausreichend Material für die Genexpressionsstudien zu gewährleisten. Die Proben wurden alle 10 Minuten aus der induzierten Kultur und den induzierten Kulturen entnommen und RNA extrahiert, um das Expressionsprofil der Schlüsselmarker für die Lysogenese und lytische Replikation während des Bakterienwachstums abzubilden. Die Gesamt-RNA wurde gereinigt und mit qPCR-Assays, die auf das 16S rRNA-Gen abzielen, auf das Fehlen genomischer DNA validiert (Schritt 6.1). Die Proben, die eine RIN ≥ 9 erreichten, bestanden die Qualitätskontrolle und wurden in cDNA umgewandelt.
Das annotierte LESΦ2-Genom wurde untersucht, um Gene zu identifizieren, die bekannte Akteure in den lysogenen und lytischen Replikationszyklen von Phagen der gemäßigten Zonen sind. Diese identifizierten Gene wurden dann verwendet, um die qRT-PCR für die Erstellung von Expressionsprofilen der lysogenzykluseingeschränkten und lytischen zyklusassoziierten Gene aus induzierten und nicht-induzierten Kulturen zu validieren. Wir quantifizierten die absolute DNA-Kopienzahl und führten einen Wilcoxon-Signed-Rank-Test mit R36 durch, um die Expressionsniveaus in nicht induzierten und induzierten Kulturen zu vergleichen (Abbildung 5). Es wurde ein deutlicher Anstieg der Expression des cro-Gens (ein früher Marker der lytischen Replikation) von ~2,31 x 109 Kopien in nicht induzierten Kulturen auf ~3,02 x 10 11 Kopien 30 Minuten nach der Induktion beobachtet (Wilcoxon-Vorzeichen-Rang-Test: p < 0,01). In ähnlicher Weise zeigten O-Proteine und P-Proteine, die Marker im mittleren Stadium der lytischen Replikation sind (und von denen angenommen wird, dass sie an der Replikation des Phagengenoms beteiligt sind), ebenfalls eine signifikante Hochregulierung von ~1,74 x 108 auf ~1,25 x 10 10 Kopien (Wilcoxon-Signed-Rank-Test: p < 0,01) und von ~ 6,05 x 102 bis ~5,68 x10 5 Kopien (Wilcoxon-Signed-Rank-Test: p < 0,01). Schließlich wurden die Schwanz-assoziierten Strukturgene als späte Marker des lytischen Replikationszyklus verwendet. Auch hier beobachteten wir einen signifikanten Anstieg der Expression von ~2,31 x 106 Kopien in nicht induzierten Kulturen auf ~4,38 x 108 Kopien 30 Minuten nach der Induktion (Wilcoxon-Vorzeichen-Rang-Test: p < 0,01). Somit bestätigten die quantitativen RT-PCR-Daten, dass die Genexpression von gut etablierten Markergenen für die lytische Replikation dem erwarteten Trend folgte, wobei die frühen, mittleren und späten Marker eine mehrfache differentielle Expression in der vorhergesagten Reihenfolge zeigten (Abbildung 5). Da die Expression der Marker für die lytische Replikation 30 Minuten nach der Genesung hochreguliert war, wird dies als ein geeigneter repräsentativer Zeitpunkt für die Untersuchung der transkriptomischen Landschaft aktiver gemäßigter Phagen und ihrer bakteriellen Wirte während des lytischen Zyklus angesehen.
Wir beobachteten eine gewisse Expression lytischer Gene unter nicht-induzierten Bedingungen, was bestätigt, dass eine spontane Induktion immer auftritt, selbst in optimierten Kulturen, in denen die Lysogenzahlen mit dem höchsten Verhältnis von KBE zu freigesetzter PFU in der frühen logarithmischen Phase dargestellt sind. Dies bedeutet, dass es immer ein gewisses Maß an "Rauschen" in den Transkriptomik-Daten geben wird, was die Bedeutung sorgfältig vorbereiteter Kontrollen, einschließlich induzierter und nicht induzierter Kulturen, unterstreicht. Die geeignete Auswahl der internen Kontrollgene zur Bestimmung der Faltenänderungen in der Expression beruht auf einer sorgfältigen Untersuchung der Transkriptomik-Daten, um Gene zu identifizieren, die sowohl in den nicht induzierten als auch in den induzierten Proben auf dem gleichen Niveau exprimiert werden. Unsere vorläufigen Ergebnisse deuten darauf hin, dass rpoD das zuverlässigste getestete Kontrollgen war und die stabilste Expression aufwies (~1,71 x 105 Kopien vor der Induktion und ~3,33 x 105 Kopien 30 Minuten nach der Induktion; Wilcoxon-Vorzeichen-Rang-Test: p = 0,3594) im Vergleich zu den 16S-rRNA - oder proC-Genen (Abbildung 5). Die Variabilität der Ausprägung der internen Kontrollen führte zur Messung der absoluten Anzahl der Transkripte. Zukünftige Untersuchungen der Transkriptomik-Daten werden die Auswahl geeigneter interner Kontrollen für die weitere Validierung unterstützen.
Das cI-Gen wurde in unserer Genprofilierungsübung verwendet, da es ein anerkannter Marker für die Lysogenese ist. Im Vergleich zu den Markern für die lytische Replikation war die Expression des cI-Gens relativ stabil (Abbildung 5), aber die Kopienzahl dieses Gens war in den nicht induzierten Kulturen im Vergleich zu denen der Marker für die lytische Replikation beruhigend hoch. Diese Daten stimmen mit den niedrigen PFU-Zahlen in denselben Proben überein und bestätigen damit, dass eine hohe Repressorexpression mit einer geringeren Phagenproduktion verbunden war. Die hier berichteten Daten zeigen, dass die Expression des cI-Transkripts für diesen speziellen Phagen nach der Induktion nicht signifikant herunterreguliert ist, wie dies bei den Stx-Phagen der Fall war11,17. Die Repressoraktivität wird normalerweise sowohl auf transkriptioneller als auch auf posttranslationaler Ebene kontrolliert, so dass das Repressor-Gen transkribiert werden kann, aber das resultierende Protein sofort einer Autospaltung unterzogen wird. Weitere Experimente sind erforderlich, um transkriptionelle und posttranslationale Kontrollen zu validieren. Darüber hinaus scheint die minimale Nachweisgrenze der qPCR nach unserer Standardkurve ~102 Kopien zu betragen.
Zusammen validieren unsere Ergebnisse aus Plaque- und qRT-PCR-Assays unsere Strategie für die Kultur- und RNA-Probenvorbereitung, um einen gut kontrollierten Input für RNA-Seq-Experimente zu generieren. Die nicht induzierten Kulturen in der frühen exponentiellen Phase zeigten ein geringes Maß an spontaner Induktion und lytischer Genexpression, was auf die Dominanz der Lysogenese hindeutet. Im Gegensatz dazu zeigten die Kulturen, die 30 Minuten nach der Induktion isoliert wurden, einen signifikanten Anstieg der Expression von Markergenen, die auf die Dominanz der lytischen Replikation hinweisen.
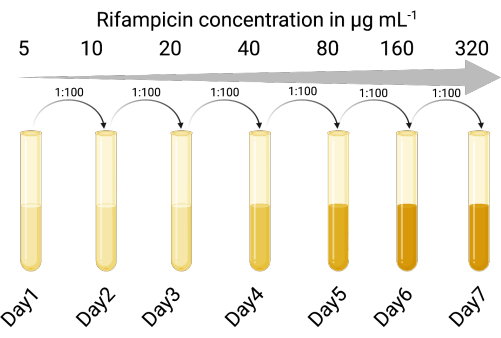
Abbildung 1: Das Protokoll zur Erstellung des Rifampicin-resistenten Indikatorhosts (Erstellt mit BioRender.com). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Das experimentelle Design zur Zählung der PFU und KBE eines Lysogens aus derselben Probe. (Erstellt mit BioRender.com) Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
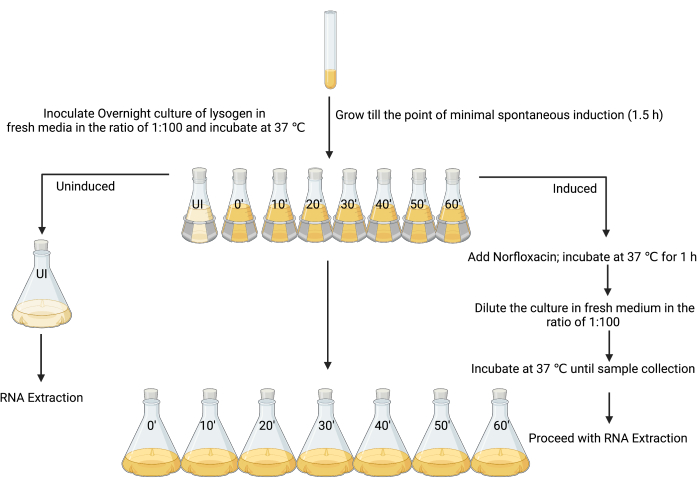
Abbildung 3: Das experimentelle Design für die Probenahme von induzierten und nicht-induzierten Kulturen für die RNA-Isolierung. (Erstellt mit BioRender.com) Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
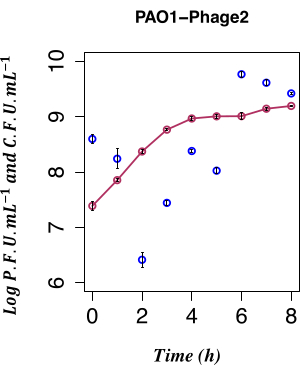
Abbildung 4: Zeitliche Aufzählung der spontanen Induktion. Zeitliche Zählung der spontanen LES-Prophagenproduktion unter Verwendung der PFU aus dem PAO1 Φ2-Lysogen mit der gleichzeitigen KBE, n = 8 (zwei biologische und vier technische Replikate); Die Fehlerbalken stellen die Standardabweichung dar. Die dunkelroten Punkte zeigen die KBE·ml−1 in LB an; Die dunkelblauen Punkte zeigen die PFU·mL−1 in LB an. Die spontane Freisetzung des infektiösen Phagen φ2 durch die Lysogene ist 2 h nach der Inokulation auf dem niedrigsten messbaren Niveau. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Absolute Kopienzahl der Zielmarkergene. Die absolute Kopienzahl der Phagenmarkergene bestätigt die vorhergesagten Expressionsmuster von Genen, von denen erwartet wird, dass sie eine wichtige Rolle in der Lysogenese und in lytischen Zyklen spielen. Die Punkte stellen sowohl drei biologische als auch drei technische Replikate dar (n = 9). (A) Das rote Kästchen stellt den Lysogenestie-Marker cI dar; (B) Grün steht für den frühen lytischen Marker cro; (C,D) Blau steht für die mittleren lytischen Marker, DNA-Replikationsgene; (E) Magenta repräsentiert den späten lytischen Marker, die strukturellen Gene des Schwanzes; (F–H) Grau steht für die Wirtsmarker, die als interne Kontrollen verwendet wurden, und (I) Weiß steht für die DNA-Gyrase B, die als Induktionskontrolle verwendet wurde. Die durchgezogenen horizontalen Linien zeigen den Median der Verteilung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Tabelle 1: In dieser Studie entworfene Primer. Die Sequenzen spezifischer Primer für die in dieser Studie verwendeten Markergene und internen Kontrollen werden zusammen mit den entsprechenden NCBI-Zugangs-IDs bereitgestellt. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 2: Die Effizienz der in dieser Studie verwendeten Primer wurde anhand der qPCR-Standardkurve berechnet. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Die Schaffung eines selektierbaren Indikatorwirts, der zuvor in Plaque-Assays verwendet wurde, um die spontane Induktion von Stx-Phagen aus E. coli MC106137,38,39 genauer zu quantifizieren, wurde hier für den P. aeruginosa-Phagen LESΦ2 beschrieben. Diese Intervention hat den zusätzlichen Vorteil, dass die Probenverarbeitungsschritte und die Probenzeit reduziert werden, wodurch die gleichzeitige Bewertung der spontanen Induktionsraten unter mehreren Kulturbedingungen ermöglicht wird. Es besteht die Gefahr, dass bei der Bildung von Rifampicin-resistenten Varianten weitere Mutationen entstehen40; In dieser Arbeit wurde der entwickelte Stamm jedoch nur als Indikatorwirt für die Zählung von Plaques aus interessierenden Kulturen verwendet und nicht in die transkriptomische Analyse einbezogen. Solange der selektierbare Indikatorstamm gleichermaßen anfällig für eine Infektion durch den interessierenden Phagen bleibt, gibt es keine Bedenken hinsichtlich anderer erworbener Mutationen. Nichtsdestotrotz wurden bei der Pulsfeld-Gelelektrophorese-Analyse (PFGE) von PAO1WT und PAO1RIF keine Unterschiede in den Restriktionsfragmentlängen-Polymorphismusprofilen festgestellt (Daten nicht gezeigt).
Bei der Auswahl der Wirtszellen ist es selten, einen Indikatorstamm zu finden, der nicht bereits Prophagen beherbergt. Ein typisches Beispiel dafür ist PAO1, das den filamentösen Prophagen Pf4 beherbergt. Die experimentellen Kontrollen für diese Studie wurden so konzipiert, dass sie die Genexpression bestimmter Phagen (in diesem Fall LES Prophage 2) und die Auswirkungen dieses Phagen auf die bakterielle Genexpression direkt untersuchen können. Im Vergleich von Transkripten von PAO1, die den LES Prophage 2 tragen und denen der LES Prophage 2 fehlt (sowohl Lysogen als auch Nicht-Lysogen tragen das endogene Pf4), die als interne Kontrollen dienen, um den Einfluss von Pf4 auf den Wirt auszuschließen. Darüber hinaus wurde gezeigt, dass Pf4 normalerweise keine Lyse in seiner Wirtszelle41 verursacht und daher nicht in der Lage ist, die Ergebnisse dieser Experimente zu verfälschen.
Es ist allgemein bekannt, dass eine sorgfältige Qualitätskontrolle bei der Probenvorbereitung entscheidend ist, um aussagekräftige Omics-Daten zu erzeugen42. Wie bereits11 beschrieben, wird die sorgfältige Charakterisierung der Prophagenaktivität bei der Herstellung von Lysogenkulturen für solche Studien jedoch nur selten durchgeführt. Hier beschreiben wir unsere systematischen Protokolle zur Vorbereitung eines gut kontrollierten und optimierten Satzes von Kulturen für transkriptomische Studien, um die Wechselwirkungen zwischen Bakterien und gemäßigten Phagen besser zu untersuchen. Die Synchronizität der Population wurde kontrolliert, indem die Kultur durch mindestens vier Verdopplungen gebracht wurde, bevor sie mit dem induzierenden Antibiotikum Norfloxacin behandelt wurde. Durch die Bestimmung des MHK von Norfloxacin für den Stamm in der Studie konnten wir sicherstellen, dass die Konzentration des auslösenden Mittels knapp über dem MHK für die "Induktions"-Behandlung lag. Die behandelten Zellen wurden dann um 1:10 verdünnt, um die Norfloxacinkonzentration nach der 1-stündigen Behandlung unter das MHK zu senken, damit sich die Zellen erholen und den Phagenreplikationsprozess abschließen konnten, der mit der Lyse der Zelle und der Freisetzung infektiöser Phagennachkommen endete. Die Zellen treten nach dem Induktionsreiz erst dann in den lytischen Replikationszyklus ein, wenn die Konzentration von Norfloxacin während der Erholungsphase unter den MHK gesenkt wurde. In diesem Fall bedeutet ein Überschreiten von 1 μg·ml−1 Norfloxacin, dass das Arzneimittel unterhalb des MHK nicht wirksam verdünnt werden kann, da das MHK für Norfloxacin für PAO1 0,19 μg·mL−1 beträgt. Der Grad der Induktorverdünnung muss mit der Notwendigkeit der Lysogenrückgewinnung und der Beibehaltung der Kulturdichte für die RNA-Ernte in Einklang gebracht werden. Die hier diskutierten Daten zeigen, dass es möglich ist, Kulturen zu synchronisieren, um Proben zu erzeugen, in denen die Lysogenese dominiert, wodurch das Rauschen der spontanen Induktion reduziert und der Nachweis echter lysogenesebedingter Veränderungen in der Genexpression ermöglicht wird. Da der lysogene Zustand in der frühen exponentiellen Phase des Wachstums vorherrscht, wenn die bakterielle Zelldichte gering ist, schlagen wir vor, die Kulturen zu skalieren, um genügend RNA für nachfolgende Genexpressionsstudien wie RNA-Seq zu ernten.
Die Verwendung von Norfloxacin als Induktionsmittel, um Kulturen in den lytischen Zyklus zu zwingen, ist gut berichtet43,44; Dies wirkt sich jedoch auch auf die Expression anderer bakterieller Gene aus45,46. Um dies zu mildern, sollten RNA-Bibliotheken aus Kontroll-Wildtyp-Kulturen, die unter den gleichen induzierenden und nicht-induzierenden Bedingungen gezüchtet wurden, in RNA-Seq-Experimente einbezogen werden. Die Verwendung interner Kontrollen und wichtiger Markergene zur Validierung der Stadien der Phagenreplikation mittels qRT-PCR ist ebenfalls entscheidend für genaue Vergleiche. Quantitatives RT-PCR-Profiling kann nicht interpretiert werden, indem die absolute Anzahl der Transkripte für jedes Gen zu verschiedenen Zeitpunkten verglichen wird. Auf die Form des Profils kommt es an. Erstens wurde nur eine kleine Region im Transkript für ein Gen beprobt, so dass unbekannt ist, ob es sich um ein kurzlebiges oder längerlebiges Element handelt27. Sicherlich zeigt die RNA-Seq-Kartierung von Transkripten, dass die Dichte der Mapping-Daten über die Länge eines Gens signifikant variiert. Zweitens ist es die Form des Genexpressionsprofils, die für ein Markergen interpretiert werden sollte, das mit dem lytischen Zyklus oder der lysogenen Lebensweise assoziiert oder sogar von den Phagen-Regelkreisen entkoppelt ist11. Spontane Induktion ist ein echtes Problem in der Lysogenkultur und führt immer zur Expression von Genen, die mit dem lytischen Zyklus assoziiert sind. Das Profiling zeigt jedoch, dass die Gene, die mit dem lytischen Replikationszyklus assoziiert sind, in ihrer Expression vor der Induktion (mindestens zwei logarithmische Faltungen) unterdrückt und nach der Induktion hochreguliert sind.
Die zuvor durchgeführten transkriptomischen Analysen von Stx-Phageninteraktionen mit E. coli unterstützen ein gründliches Verständnis der Phagengene, die an der Aufrechterhaltung der Lysogenese und der Auslösung des lytischen Zyklus beteiligt sind11,17. Derzeit sind die LES-Phagen von P. aeruginosa annotiert, aber ihre wichtigsten Genfunktionen sind weniger gut verstanden. Transkriptomische Studien werden die Re-Annotation der LES-Prophagen ermöglichen und unser Verständnis der Gene verbessern, die an der Lysogenese und dem lytischen Zyklus beteiligt sind. Die Verknüpfung von Gensequenz und Funktion stellt eine große Herausforderung bei der Untersuchung neuartiger Prophagen dar, was die Notwendigkeit weiterer Studien zur Bestätigung der Phagengenfunktionen für die Herstellung besserer Annotationswerkzeuge unterstreicht47. Die breitere Anwendung und Anpassung der Protokolle und zusätzlichen Qualitätskontrollmaßnahmen, die in diesem Videoartikel beschrieben werden, könnte dazu beitragen, verschiedene Prophagenfunktionen zu enthüllen und damit die Annotationspipelines zu verbessern und unser Verständnis der Phagen- und Bakterienbiologie zu verändern.
Materialien
| Name | Company | Catalog Number | Comments |
| PAO1 | 6 | ||
| LESB58 | 6 | ||
| LES phages | Induced and purified from LESB58 using Norfloxacin. | This study | |
| Lysogeny Broth (LB) | Merck | 1.10285.500 | |
| LB Agar | Merck | 1.10283.500 | |
| Agar Agar | Fisher | A/1080/53 | |
| Top Agar | 0.4 g Agar Agar+2.5 g LB Broth in 100 mL water; autoclave and use. | - | |
| Rifampicin | Sigma (Stock: 50 mg/mL in Methanol- Mix well and use 0.22µm filter to sterilize and store it in -20°C until use) | R3501 | |
| Glacial Acetic Acid | Fisher 1% (v/v) in water | 10060000 | |
| Norfloxacin | Sigma (Stock: 25 mg/mL of 1% Glacial Acetic Acid-Mix well and use 0.22µm filter to sterilize and store it in -20°C until use;To avoid freeze thaw cycles, store as small aliquotes) | N9890 | |
| Phenol saturated with citrate buffer pH 4.3 | Sigma | P-4682 | |
| Molecular Biology grade Ethanol | Fisher | 16695992 | |
| TRIzol | Invitrogen | 12044977 | |
| Chloroform | Fisher | 11398187 | |
| Isopropanol | Fisher | 17150576 | |
| Nuclease-free H2O | Invitrogen | 10526945 | |
| 10X TURBO DNase | Ambion | AM1907 | |
| Qubit RNA HS, BR Kit | Invitrogen | Q10210 | |
| Agilent RNA 6000 Nano Kit | Agilent | 5067-1511 | |
| SuperScriptIII first strand synthesis kit | Invitrogen | 18080051 | |
| PCR Reagents | Bioline Mytaq Red 2X | BIO-25043 | |
| qPCR Reagents | Sensifast SYBR Hi Rox | BIO-92020 | |
| PCR purification kit | Isolate II PCR and Gel Kit | BIO-52060 | |
| TA cloning kit | TA Cloning Kit, with pCR 2.1 Vector, without competent cells | K202040 | |
| StepOne Real Time PCR system | Thermo Fisher Scientific | 4376600 |
Referenzen
- Lin, D. M., Koskella, B., Lin, H. C. Phage therapy: An alternative to antibiotics in the age of multi-drug resistance. World Journal of Gastrointestinal Pharmacology and Therapeutics. 8 (3), 162-173 (2017).
- Jiang, W., Marraffini, L. A. CRISPR-Cas: New tools for genetic manipulations from bacterial immunity systems. Annual Review of Microbiology. 69 (1), 209-228 (2015).
- Santos, S. B., Azeredo, J. Bacteriophage-based biotechnological applications. Viruses. 11 (8), 737(2019).
- Rodríguez-Rubio, L., Jofre, J., Muniesa, M. Is genetic mobilization considered when using bacteriophages in antimicrobial therapy. Antibiotics. 6 (4), 32(2017).
- Hatfull, G. F. Dark Matter of the biosphere: The amazing world of bacteriophage diversity. Journal of Virology. 89 (16), 8107-8110 (2015).
- Yukgehnaish, K., et al. PhageLeads: Rapid assessment of phage therapeutic suitability using an ensemble Machine Learning approach. Viruses. 14 (2), 342(2022).
- Seemann, T. Prokka: Rapid prokaryotic genome annotation. Bioinformatics. 30 (14), 2068-2069 (2014).
- Arndt, D., et al. PHASTER: A better, faster version of the PHAST phage search tool. Nucleic Acids Research. 44, W16-W21 (2016).
- Banerjee, S., et al. FINDER: An automated software package to annotate eukaryotic genes from RNA-Seq data and associated protein sequences. BMC Bioinformatics. 22 (1), 205(2021).
- Jumper, J., et al. Highly accurate protein structure prediction with AlphaFold. Nature. 596 (7873), 583-589 (2021).
- Veses-Garcia, M., et al. Transcriptomic analysis of Shiga-toxigenic bacteriophage carriage reveals a profound regulatory effect on acid resistance in Escherichia coli. Applied and Environmental Microbiology. 81 (23), 8118-8125 (2015).
- Owen, S. V., et al. A window into lysogeny: revealing temperate phage biology with transcriptomics. Microbial Genomics. 6 (2), e000330(2020).
- Davies, E. V., Winstanley, C., Fothergill, J. L., James, C. E. The role of temperate bacteriophages in bacterial infection. FEMS Microbiology Letters. 363 (5), 015(2016).
- Livny, J., Friedman, D. I. Characterizing spontaneous induction of Stx encoding phages using a selectable reporter system. Molecular Microbiology. 51 (6), 1691-1704 (2004).
- Fogg, P. C. M., et al. Identification of multiple integration sites for Stx-phage Φ24B in the Escherichia coli genome, description of a novel integrase and evidence for a functional anti-repressor. Microbiology. 153 (12), 4098-4110 (2007).
- James, C. E., et al. Differential infection properties of three inducible prophages from an epidemic strain of Pseudomonas aeruginosa. BMC Microbiology. 12, 216(2012).
- Riley, L. M., et al. Identification of genes expressed in cultures of E. coli lysogens carrying the Shiga toxin-encoding prophage Φ24B. BMC Microbiology. 12 (1), 42(2012).
- Stover, C. K., et al. Complete genome sequence of Pseudomonas aeruginosa PAO1, an opportunistic pathogen. Nature. 406 (6799), 959-964 (2000).
- Winstanley, C., et al. Newly introduced genomic prophage islands are critical determinants of in vivo competitiveness in the Liverpool Epidemic Strain of Pseudomonas aeruginosa. Genome Research. 19 (1), 12-23 (2009).
- Davies, E. V., et al. Temperate phages enhance pathogen fitness in chronic lung infection. The ISME Journal. 10 (10), 2553-2555 (2016).
- Allison, H. E. Stx-phages: drivers and mediators of the evolution of STEC and STEC-like pathogens. Future Microbiology. 2 (2), 165-174 (2007).
- Allison, H. E., et al. Immunity profiles of wild-type and recombinant Shiga-like toxin-encoding bacteriophages and characterization of novel double lysogens. Infection and Immunity. 71 (6), 3409-3418 (2003).
- Mori, N., et al. A peptide based on homologous sequences of the β-barrel assembly machinery component BamD potentiates antibiotic susceptibility of Pseudomonas aeruginosa. Journal of Antimicrobial Chemotherapy. 67 (9), 2173-2181 (2012).
- Chojnacki, M., et al. A novel, broad-spectrum antimicrobial combination for the treatment of Pseudomonas aeruginosa corneal infections. Antimicrobial Agents and Chemotherapy. 63 (10), e00777(2019).
- Miles, A. A., Misra, S. S., Irwin, J. O. The estimation of the bactericidal power of the blood. Epidemiology & Infection. 38 (6), 732-749 (1938).
- Srikumar, S., et al. RNA-seq brings new insights to the intra-macrophage transcriptome of Salmonella Typhimurium. PLoS Pathogens. 11 (11), e1005262(2015).
- Kröger, C., et al. The transcriptional landscape and small RNAs of Salmonella enterica serovar Typhimurium. Proceedings of the National Academy of Sciences of the United States of America. 109 (20), E1277-E1286 (2012).
- Green, M. R., Sambrook, J. How to win the battle with RNase. Cold Spring Harbor Protocols. (2), (2019).
- Koetsier, G. A practical guide to analyzing nucleic acid concentration and purity with microvolume spectrophotometers. New England BioLabs Inc. , Available from: https://www.neb.com/-/media/nebus/files/application-notes/technote_mvs_analysis_of_nucleic_acid_concentration_and_purity.pdf?rev=c24cea043416420d84fb6bf7b554dbbb (2019).
- Saunders, N. A., Lee, M. A. Real-Time PCR: Advanced Technologies and Applications. , Caister Academic Press. Norfolk, UK. (2013).
- Bustin, S. A. A-Z of Quantitative PCR. , International University Line. La Jolla, CA. (2004).
- Ruijter, J. M., et al. Efficiency correction is required for accurate quantitative PCR analysis and reporting. Clinical Chemistry. 67 (6), 829-842 (2021).
- Fothergill, J. L., Neill, D. R., Loman, N., Winstanley, C., Kadioglu, A. Pseudomonas aeruginosa adaptation in the nasopharyngeal reservoir leads to migration and persistence in the lungs. Nature Communications. 5 (1), 4780(2014).
- Huang, J., et al. Temperature-dependent expression of phzM and its regulatory genes lasI and ptsP in rhizosphere isolate Pseudomonas sp. strain M18. Applied and Environmental Microbiology. 75 (20), 6568-6580 (2009).
- Savli, H., et al. Expression stability of six housekeeping genes: a proposal for resistance gene quantification studies of Pseudomonas aeruginosa by real-time quantitative RT-PCR. Journal of Medical Microbiology. 52 (5), 403-408 (2003).
- Kassambara, A. rstatix: Pipe-Friendly Framework for Basic Statistical Tests. , Available from: https://CRAN.R-project.org/package=rstatix (2022).
- McDonald, J. E., et al. High-throughput method for rapid induction of prophages from lysogens and its application in the study of Shiga toxin-encoding Escherichia coli strains. Applied and Environmental Microbiology. 76 (7), 2360-2365 (2010).
- Smith, D. L., et al. Short-tailed Stx phages exploit the conserved YaeT protein to disseminate Shiga toxin genes among Enterobacteria. Journal of Bacteriology. 189 (20), 7223-7233 (2007).
- James, C. E., et al. Lytic and lysogenic infection of diverse Escherichia coli and Shigella strains with a verocytotoxigenic bacteriophage. Applied and Environmental Microbiology. 67 (9), 4335-4337 (2001).
- Rees, V. E., et al. Characterization of hypermutator Pseudomonas aeruginosa isolates from patients with cystic fibrosis in Australia. Antimicrobial Agents and Chemotherapy. 63 (4), e02538(2019).
- Li, Y., et al. Excisionase in Pf filamentous prophage controls lysis-lysogeny decision-making in Pseudomonas aeruginosa. Molecular Microbiology. 111 (2), 495-513 (2019).
- Van Kampen, A. H. C., Moerland, P. D. Taking bioinformatics to systems medicine. Systems Medicine. 1386, 17-41 (2016).
- Matsushiro, A., Sato, K., Miyamoto, H., Yamamura, T., Honda, T. Induction of prophages of enterohemorrhagic Escherichia coli O157:H7 with norfloxacin. Journal of Bacteriology. 181 (7), 2257-2260 (1999).
- James, C. E., et al. Lytic activity by temperate phages of Pseudomonas aeruginosa in long-term cystic fibrosis chronic lung infections. The ISME Journal. 9 (6), 1391-1398 (2015).
- Shaw, K. J., et al. Comparison of the changes in global gene expression of Escherichia coli induced by four bactericidal agents. Microbial Physiology. 5 (2), 105-122 (2003).
- Long, H., et al. Antibiotic treatment enhances the genome-wide mutation rate of target cells. Proceedings of the National Academy of Sciences of the United States of America. 113 (18), E2498-E2505 (2016).
- González-Tortuero, E., et al. VIGA: A sensitive, precise and automatic de novo VIral Genome Annotator. bioRxiv. , (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten