Method Article
توصيف التئام الجروح الظهارية في الجسم الحي باستخدام الكائن الحي النموذجي Cnidarian Clytia hemisphaerica
In This Article
Summary
تصف هذه الورقة طريقة لإنشاء جروح في ظهارة Clytia hemisphaerica medusa الحية وصورة التئام الجروح بدقة عالية في الجسم الحي. بالإضافة إلى ذلك ، يتم تقديم تقنية لإدخال الأصباغ والأدوية لاضطراب عمليات الإشارات في الخلايا الظهارية والمصفوفة خارج الخلية أثناء التئام الجروح.
Abstract
جميع الأعضاء الحيوانية، من الجلد إلى العينين إلى الأمعاء، مغطاة بصفائح من الخلايا الطلائية تسمح لها بالحفاظ على الاتزان الداخلي مع حمايتها من العدوى. لذلك ، ليس من المستغرب أن تكون القدرة على إصلاح الجروح الظهارية أمرا بالغ الأهمية لجميع metazoans. يتضمن التئام الجروح الظهارية في الفقاريات عمليات متداخلة ، بما في ذلك الاستجابات الالتهابية ، والأوعية الدموية ، وإعادة الظهارة. يتضمن تنظيم هذه العمليات تفاعلات معقدة بين الخلايا الظهارية والخلايا المجاورة والمصفوفة خارج الخلية (ECM) ؛ يحتوي ECM على بروتينات هيكلية وبروتينات تنظيمية وجزيئات صغيرة نشطة. هذا التعقيد ، إلى جانب حقيقة أن معظم الحيوانات لديها أنسجة معتمة و ECMs يتعذر الوصول إليها ، يجعل من الصعب دراسة التئام الجروح في الحيوانات الحية. لذلك يتم تنفيذ الكثير من العمل على التئام الجروح الظهارية في أنظمة زراعة الأنسجة ، مع نوع خلية ظهارية واحدة مطلية كطبقة أحادية على مصفوفة اصطناعية. توفر Clytia hemisphaerica (Clytia ) مكملا فريدا ومثيرا لهذه الدراسات ، مما يسمح بدراسة التئام الجروح الظهارية في سليم مع ECM أصيل. ظهارة الأديم الظاهر في Clytia هي طبقة واحدة من الخلايا الظهارية الحرشفية الكبيرة ، مما يسمح بالتصوير عالي الدقة باستخدام الفحص المجهري لتباين التداخل التفاضلي (DIC) في الحيوانات الحية. إن غياب الخلايا الليفية المهاجرة أو الأوعية الدموية أو الاستجابات الالتهابية يجعل من الممكن تشريح الأحداث الحرجة في إعادة الظهارة في الجسم الحي. يمكن تحليل شفاء أنواع مختلفة من الجروح ، بما في ذلك الجروح الدقيقة أحادية الخلية ، والجروح الظهارية الصغيرة والكبيرة ، والجروح التي تلحق الضرر بالغشاء القاعدي. يمكن ملاحظة تكوين الصفيحة ، وتقلص سلسلة المحفظة ، وتمدد الخلايا ، وهجرة الخلايا الجماعية في هذا النظام. علاوة على ذلك ، يمكن إدخال العوامل الدوائية عبر ECM لتعديل تفاعلات cell: ECM والعمليات الخلوية في الجسم الحي. يوضح هذا العمل طرقا لإنشاء الجروح في Clytia الحية ، والتقاط أفلام الشفاء ، والتحقيق في آليات الشفاء عن طريق الحقن الدقيق للكواشف في ECM.
Introduction
تغطي صفائح الخلايا الظهارية السطح الخارجي لجميع metazoans ، وتبطن الأعضاء الداخلية ، وتقسم جسم الحيوان إلى مقصورات منفصلة. تفصل الظهارة أيضا الجسم الداخلي عن البيئة الخارجية وتحميه من التلف والعدوى. ومن ثم ، كان ظهور الطبقات الظهارية جزءا أساسيا من تطور الحيوانات متعددة الخلايا ، وتظهر الطبقات الظهارية في جميع الحيوانات من الفقاريات إلى معظم metazoansالقاعدية 1. ظهارة بعض الأعضاء هي طبقة واحدة أحادية ، كما هو الحال في الأكياس الهوائية الرئوية والأوعية الدموية والأمعاء2 ، وكذلك في بشرة اللافقاريات مثل planaria و cnidarians3. في الأنسجة الأخرى ، مثل الجلد4 والقرنية5 من الفقاريات ، تكون الظهارة طبقية ، مما يعني وجود طبقات متعددة من الخلايا الظهارية2. في جميع الحالات ، يتم لصق الطبقة الظهارية القاعدية على الغشاء القاعدي ، وهي ورقة بروتينية تشكل منطقة متخصصة من المصفوفة خارج الخلية (ECM)6،7،8.
يجب إصلاح الخروقات في الظهارة بسرعة لإعادة إنشاء ورقة ظهارية مستمرة. يحدث تلف الظهارة أثناء العمليات الطبيعية ، مثل تساقط الخلايا الظهارية في الأمعاء ،9،10 ونتيجة للالتهاب أو الصدمة الجسدية. عند تلف خلية ظهارية واحدة ، يجب إما إصلاح نفسها أو التخلص منها للسماح للخلايا المحيطة بالالتصاق ببعضها البعض وإغلاق الثقب11,12. في الجروح الأكبر من حجم خلية واحدة ، يجب أن تتحرك الخلايا الظهارية للوصول إلى بعضها البعض وإصلاح الورقة13. يمكن تحقيق ذلك عن طريق انتشار الخلايا إذا كانت الفجوات صغيرة أو قد تتطلب هجرة الخلايا الظهارية من هوامش الجرح لسد فجوة الجرح. وتسمى هذه العملية الأخيرة إعادة الظهارة14,15. في الأنسجة الجنينية ، تنتشر الخلايا الظهارية وتهاجر لإغلاق الجروح أو يتم سحبها عبر الفجوة عن طريق تقلص كابلات الأكتوميوسين التي تتشكل بين الخلايا عند هامش الجرح ، في آلية تشبه سلسلة المحفظة16. في العديد من الأنسجة البالغة ، تتضمن إعادة الظهارة هجرة صفائح الخلايا المتماسكة ، حيث تحافظ الخلايا على تقاطعاتها مع الخلايا المجاورة14،17،18. في الأنسجة الأخرى ، يتم تفكيك الخلية: اتصالات الخلايا وتتصرف الخلايا الظهارية مثل خلايا اللحمة المتوسطة ، وتتحرك بطريقة منسقة ولكن مستقلة في منطقة الجرح أثناء إعادة الظهارة14،19،20،21.
يتم تنظيم حركات الخلايا الظهارية من خلال التفاعلات المعقدة بين الخلايا المهاجرة وبين الخلايا و ECM. في حين أن هناك كمية هائلة من الأدبيات التجريبية التي تتناول آليات تنشيط الجروح للخلايا الظهارية والهجرة اللاحقة ، لا يزال هناك الكثير الذي يتعين اكتشافه. على سبيل المثال ، لم يتم تحديد الإشارة الأولية التي تنشط الخلايا الظهارية للهجرة استجابة للجرح بشكل قاطع 22 ، كما أنه ليس من المفهوم تماما كيف يتم إعادة نشر الأكتين لإنشاء صفائح الصفيحة على جانب الخلايا الظهارية الأقرب إلى الجرح 22،23،24،25،26،27. تتطلب هجرة الخلايا الجماعية مشاركة المعلومات من الخلايا الموجودة في الجرح مع الخلايا البعيدة عن الجرح ، ولا يزال مسار الاتصال غير واضح28. خلية:تقاطعات الخلايا والخلية: يجب تفكيك مرفقات ECM وإصلاحها حيث تعيد الخلايا الموجودة في الورقة ترتيب نفسها ، لكن تنظيم هذه العملية غير مفهومبشكل جيد 14,29. إن إحراز تقدم في هذه الأسئلة وغيرها من الأسئلة ذات الصلة ليس مهما فقط كمشكلة بيولوجية أساسية ولكن أيضا بسبب الأهمية السريرية للشفاء الصحيح للجروح. الأمراض التي تضر بقدرة الخلايا الظهارية على الهجرة بشكل صحيح تؤدي إلى جروح مزمنة. مثال على ذلك هو المرض الوراثي انحلال البشرة الفقاعي ، حيث يتم تحور الجينات المشاركة في ارتباط الخلايا الظهارية ب ECM ، مما يؤدي إلى جلد هش يتقشر ويتقرح. كما تتعرض إعادة الظهارة للخطر في أنسجة الشيخوخة الطبيعية30,31. لذلك فإن الفهم الأفضل ضروري لتطوير التدخلات لتحسين نتائج التئام الجروح.
تمت دراسة هجرة الخلايا الظهارية في التئام الجروح باستخدام كل من النهج في المختبر والكائنات الحية النموذجية. أجريت غالبية الدراسات حول التئام الجروح وآليات هجرة الخلايا في زراعة الأنسجة ، حيث تزرع الطبقات الأحادية من نوع واحد من الخلايا الظهارية على ركيزة تحل محل ECM. يتم خدش الطبقة الأحادية للخلية أو زراعتها باستخدام الإستنسل لإنشاء فجوات بأشكال وأحجام محددة ثم يتم ملاحظتها32،33،34. يسمح النموذج في المختبر بتصور مثالي لسلوك الخلية ، فضلا عن فرصة تغيير صفات الركيزة ، وتعريض الخلايا للأدوية والعوامل اللاأحيائية والحيوية ، ونقل الخلايا بتركيبات تعبر عن أو تقمع جينات مختلفة ذات أهمية. ومع ذلك ، قد يفشل هذا النهج الاختزالي في التقاط بعض المعلمات المهمة التي ينطوي عليها سلوك الخلية الظهارية في سياق في الجسم الحي ، بما في ذلك الاتصال بين أنواع الخلايا المختلفة وأحداث الإشارات التي تحدث في ECM11. توفر النماذج في الجسم الحي السياق الأصلي للجرح ، مع أنواع متعددة من الخلايا ، ومسارات إشارات متداخلة ، و ECM35 معقد. أحد هذه النماذج لدراسات التئام الجروح هو الفأر19 ، حيث سمحت التطورات الحديثة للباحثين بمراقبة خلايا البشرة أثناء التئام الجروح كاملة السماكة في الحيوانات الحية36. ومع ذلك ، فإن الفأر والأنظمة الأخرى في الجسم الحي تمثل تحديات لدراسة إعادة الظهارة. أولا ، يتم موازنة الميزة الكبيرة لمراقبة سلوك الخلية في سياق طبيعي من خلال تعقيد الأحداث المتداخلة زمنيا التي تحدث أثناء التئام جروح الفقاريات ، بما في ذلك تخثر الدم ، وتجنيد الخلايا المناعية والالتهابات ، وتجنيد الخلايا الليفية ، وإزالة تمايز الخلايا ، وإعادة الأوعية الدموية ، وإعادة تشكيل ECM. علاوة على ذلك ، فإن الأنسجة المعتمة تجعل التصوير صعبا. لقد تغلبت أنظمة يرقة ذبابة الفاكهة والبشرةالزرد 37،38 على بعض هذه الصعوبات بسبب بساطتها النسبية39.
قدم مختبرنا مؤخرا نموذجا جديدا لدراسة التئام الجروح الظهارية: شكل ميدوسا (قنديل البحر) من الهيدروزوان cnidarian Clytia hemisphaerica (Clytia) 40. Clytia هو كائن نموذجي ناشئ مع جينوم41 متسلسل بالكامل ومشروح ، ونسخة RNAseq أحادية الخلية42 ، وبروتوكولات معمول بها لتعديل الجينوم (الطفرات والجينات المحورة)43،44،45. Cnidarians هي واحدة من أقدم السلالات الموجودة التي لديها طبقات ظهارية ، لذا فإن فهم التئام الجروح cnidarian يوفر نظرة ثاقبة لمسارات الأجداد التي ضمنت السلامة الظهارية. بالنسبة لتلك المسارات التي تم الحفاظ عليها في جميع أنحاء شجرة الحياة ، تقدم Clytia نظاما جديدا مثيرا لدراسة ديناميكيات الخلايا الظهارية والتنظيم الوظيفي لالتئام الجروح في الجسم الحي.
الظهارة التي تغطي السطح العلوي ل Clytia medusa (exumbrella) هي طبقة أحادية من الخلايا الظهارية الحرشفية الشفافة التي يبلغ عرضها حوالي 50 ميكرومتر وسمكها 1-2 ميكرومتر (الشكل 1). وهي متصلة ب ECM يسمى mesoglea - "هلام" قنديل البحر. يشبه mesoglea تركيبيا ECM الموجود في الحيواناتالأخرى 46،47،48 بما في ذلك الفقاريات ، وله غشاء قاعدي 40 ، وهو شفاف تماما. يمكن خدش الطبقة الظهارية في Clytia medusa أو جرحها بسهولة (انظر أدناه). تسمح بساطة وشفافية الظهارة و ECM بتصوير عالي الدقة للخلايا وحركاتها أثناء الشفاء. في الآونة الأخيرة ، وصف كامران وآخرون التئام الجروح الصغيرة في ظهارة Clytia بالتفصيل40. وقد ثبت أن الشفاء في Clytia يحدث من خلال زحف الخلايا القائم على lamellipodia ، وانتشار الخلايا ، وهجرة الخلايا الجماعية ، بالإضافة إلى إغلاق سلسلة المحفظة التي هي أكثر نموذجية للأنظمة الجنينية (على الرغم من رؤيتها سابقا في الهياكل الحيوانية البالغة مثل القرنية49). التئام الجروح Clytia سريع للغاية ، كما شوهد في الأنظمة الأخرى التي تفتقر إلى الاستجابة الالتهابية40,50. يعتمد الشفاء في Clytia exumbrella كليا على حركات الخلايا الظهارية الموجودة - لا تتكاثر أي خلايا أو تهاجر عبر ECM إلى موقع الجرح (الفيلم التكميلي 1). تشير كل هذه النتائج إلى أن Clytia هو نظام نموذجي مفيد لدراسة التئام الجروح الظهارية. في الواقع ، أدت سهولة تصوير الخلايا الظهارية في Clytia أثناء التئام الجروح إلى اكتشاف أن lamellipodia الخلايا الظهارية تمتد وتنتشر على مناطق ECM المكشوفة طالما أن هناك غشاء قاعدي سليم. في حالة تلف الغشاء القاعدي ، يتحول الشفاء الظهاري إلى آلية سلسلة محفظة40. كان هذا أول عرض للآلية الكامنة وراء قرار الإغلاق عن طريق الزحف القائم على الصفيحة مقابل إغلاق سلسلة المحفظة ، مما يسلط الضوء على أهمية تفاعلات خلية معينة: ECM في الشفاء ومراقبة الخلايا في سياقها الطبيعي.
أدناه ، يتم وصف البروتوكولات لإنشاء وتصوير الجروح الدقيقة أحادية الخلية ، والجروح الصغيرة التي تغلق بشكل أساسي عن طريق انتشار الخلية ، والجروح الكبيرة التي تتطلب هجرة الخلايا الجماعية لإغلاقها. علاوة على ذلك ، يتم وصف بروتوكول لإدخال جزيئات صغيرة في ECM والخلايا الظهارية ، مما يسمح بالاضطرابات التجريبية للمسارات التنظيمية المفترضة لالتئام الجروح.
Protocol
1. تربية الحيوان
- الحفاظ على مستعمرات Clytia polypp على شرائح المجهر و medusae في مياه البحر الاصطناعية (ASW) عند 18 درجة مئوية في نظام الزرد ، مع خزانات الزرد 2 لتر لمستعمرات الاورام الحميدة وخزانات الكريزل الزائفة 5 لتر حسب الطلب ل medusae (الشكل التكميلي 1)51. يتكون ASW من 4٪ محيط فوري في منزوع الأيونات (DI) H2O.
- إطعام الحيوانات يوميا مع الأرتيميا 2-3 أيام كما هو موضح51.
ملاحظة: يكون تصوير التئام الجروح أسهل إذا لم يتم إطعام الحيوانات مؤخرا ، حيث يوجد قدر أقل من الحطام المنطلق من القناة الهضمية في مجال الرؤية. - اجمع ميدوساي الصغيرة من مستعمرات الاورام الحميدة المنشأة حسب الحاجة عن طريق وضع المستعمرات في دورق سعة 2 لتر مملوء ب 1 لتر من ASW طوال الليل. استخدم أنثى medusae البالغة من العمر 2-3 أسابيع لجميع تجارب التئام الجروح. تم وصف انتشار Clytia بالتفصيل في مكان آخر51.
2. الجرح
- إحداث جروح دقيقة داخل الخلايا وفيما بينها (20-500 ميكرومتر2)
- قم بإنشاء ماصة نقل معدلة عن طريق قطع الطرف بالمقص لعمل فتحة أكبر (قطرها 0.5-0.7 سم).
ملاحظة: يجب أن تكون الفتحة الموجودة في الماصة واسعة بما يكفي لتجنب أي ضرر للحيوان. - باستخدام ماصة النقل المعدلة ، ضع ميدوسا على شريحة منخفضة مع توجيه مظلة ميدوسا لأعلى ، مع ما يكفي من ASW لتغطية الحيوان.
- ضع غطاء على الحيوان والصورة على الفور (انظر أدناه للحصول على وصف للتصوير). يضغط غطاء الغطاء على mesoglea ، ويخلق ارتداد الأنسجة المضغوطة قوة تدفع الخلايا بعيدا قليلاعن بعضها البعض 52. يظهر هذا على الفور كفجوات بين كل خلية وتلف داخل بعض الخلايا (الشكل 1B و B والشكل 2 والشكل 3A-C).
- قم بإنشاء ماصة نقل معدلة عن طريق قطع الطرف بالمقص لعمل فتحة أكبر (قطرها 0.5-0.7 سم).
- خلق جروح ظهارية صغيرة (0.02-0.125 مم2)
- باستخدام ماصة نقل معدلة (على النحو الوارد أعلاه) ، ضع ميدوسا على شريحة منخفضة مع توجيه مظلة ميدوسا لأعلى.
- باستخدام طرف ماصة سعة 200 ميكرولتر ، خدش سطح ميدوسا برفق. يمكن أن يؤدي الخدش اللطيف أيضا إلى حدوث تمزقات في الغشاء القاعدي ، والتي تظهر بسهولة22. تغطية الحيوان مع غطاء للتصوير. بدلا من ذلك ، يكون وضع غطاء الغطاء كافيا في بعض الأحيان لإنشاء جروح ظهارية صغيرة حتى بدون خدش (الشكل 1C و C والشكل 2 والشكل 3A-C).
ملاحظة: لا تضغط لأسفل عند خدش سطح ميدوسا ، لأن هذا يضر ب ECM ويخلق سطحا غير منتظم - يصعب التركيز على الخلايا الظهارية المهاجرة على سطح غير منتظم.
- خلق جروح ظهارية كبيرة (0.5-0.9 مم2)
- اصنع إبرة حقن مجهرية باستخدام مجتذب ماصة دقيقة وأنبوب شعري زجاجي (الخطوة 5.2). ضع إبرة الحقن المجهري الفارغة في حامل حاقن دقيق مثبت على معالج دقيق. قطع طرف الإبرة بحيث تكون الفتحة حوالي 20-40 ميكرومتر.
ملاحظة: يمكن تخزين الإبر المقطوعة للجروح الظهارية الكبيرة وإعادة استخدامها لزيادة الاتساق بين التجارب. - اضبط ضغط الانتظار على الحاقن الدقيق على الصفر ، واضبط ضغط الإخراج على 20 رطل لكل بوصة مربعة تقريبا. اضبط الحاقن الدقيق لتوصيل نبضة هواء 2 ثانية.
ملاحظة: قد يلزم تعديل ضغط الإخراج بناء على قطر فتحة الإبرة (على سبيل المثال ، ستستخدم الأطراف الأصغر ضغطا أعلى ، بينما تستخدم الأطراف الأكبر ضغطا أقل). - ضع ميدوسا مع مواجهة المظلة لأعلى على شريحة منخفضة على مرحلة نطاق التشريح ، مع ما يكفي من ASW لتغطية الحيوان. باستخدام المعالج الدقيق ، اضبط طرف إبرة الحقن المجهري بحيث يكون فوق الماء مباشرة. للقيام بذلك ، اغمس الطرف بعناية في الماء (قد يدخل الماء إلى طرف الماصة) ، ثم اسحبه بحيث يكون قريبا من السطح الظهاري لميدوسا.
ملاحظة: يجب وضع الطرف فوق ربع واحد من ميدوسا. تقسم القنوات الشعاعية لميدوسا جرس ميدوسا إلى أربعة أرباع متميزة. سيؤدي استهداف الربع إلى تصوير أنظف ، حيث يتم استبعاد الغدد التناسلية والقنوات الشعاعية من منطقة الجرح. - نبض الهواء عن طريق الضغط على ابدأ على الحاقن. كرر النبض في نفس المكان مرتين إلى أربع مرات ، اعتمادا على عرض الحافة. تتطلب النصائح الأكبر نبضات أقل.
ملاحظة: يجب أن تكون المسافة البادئة في الماء / ميدوسا الناتجة عن نبض الهواء مرئية. - قم بتغطية الحيوان المصاب بغطاء لتصوير الجروح الكبيرة (الشكل 1D ، D ').
- اتبع الخطوات أدناه (القسم 3) لتصوير التئام الجروح الظهارية.
- اصنع إبرة حقن مجهرية باستخدام مجتذب ماصة دقيقة وأنبوب شعري زجاجي (الخطوة 5.2). ضع إبرة الحقن المجهري الفارغة في حامل حاقن دقيق مثبت على معالج دقيق. قطع طرف الإبرة بحيث تكون الفتحة حوالي 20-40 ميكرومتر.
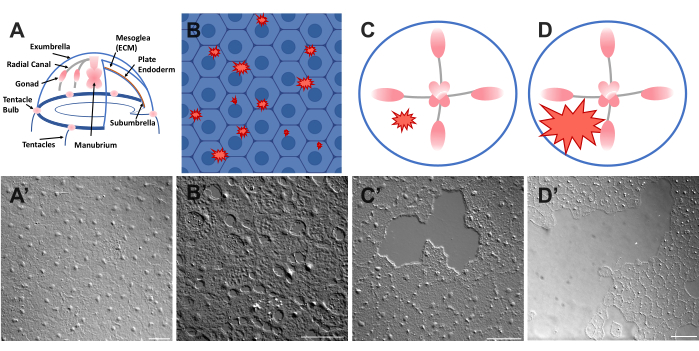
الشكل 1: الطبقة الظهارية الخارجية السليمة والمصابة في Clytia medusa. (أ) رسم كاريكاتوري لجسم كليتيا ميدوسا. (أ') ظهارة ميدوسا exumbrella سليمة ينظر إليها من فوق. (ب ) رسم كاريكاتوري للجروح الدقيقة أحادية الخلية (أشكال خشنة حمراء) مع خلايا طلائية باللون الأزرق. (ب') الجروح الدقيقة أحادية الخلية. (ج) رسم كاريكاتوري لجرح ظهاري صغير (شكل خشن أحمر). (ج') جرح ظهاري صغير. (د) رسم كاريكاتوري لجرح ظهاري كبير (شكل خشن أحمر). (د') جرح ظهاري كبير. تم الحصول على جميع الصور باستخدام الفحص المجهري DIC. أشرطة المقياس في (A'-C'): 50 ميكرومتر. شريط المقياس في (D'): 100 ميكرومتر. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
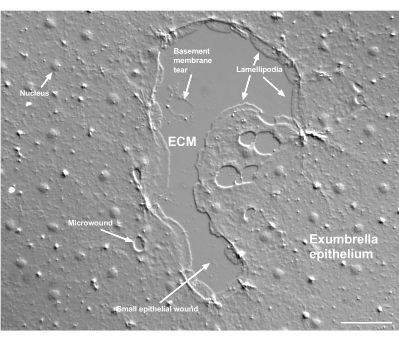
الشكل 2: جروح متعددة الأحجام وغشاء قاعدي تالف. يظهر جرح ظهاري صغير نموذجي ، مع ملصقات تشير إلى الصفيحة التي تتكون من الخلايا الهامشية. بالإضافة إلى ذلك ، يتم رؤية الجروح الدقيقة داخل الخلايا الظهارية وفيما بينها. لاحظ تمزق الغشاء القاعدي الصغير في الجزء العلوي من الجرح. يظهر الفيلم 4 شفاء هذا الجرح . شريط المقياس: 50 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
3. تصوير التئام الجروح الظهارية
- تأكد من محاذاة المجهر لإضاءة كولر53 وأنه قد تم إعداده بشكل صحيح للفحص المجهري54 لتباين التداخل التفاضلي (DIC). الخلايا الظهارية غير مرئية تقريبا مع البصريات القياسية (الشكل 3D ، E).
- اضبط التركيز على المظلة. على الرغم من أن هذه طبقة رقيقة ، يجب أن تكون الخلايا السداسية واضحة.
ملاحظة: يتم فصل exumbrella و subumbrella بواسطة mesoglea سميكة تدعمها ألياف عمودية. توجد الخلايا الفرعية في نفس المستوى البؤري مثل القنوات الشعاعية. إذا ركزت في البداية على طبقة المظلة الفرعية ، فاضبط التركيز ببطء من خلال الألياف المتوسطة والعمودية حتى العثور على المظلة الخارجية. - حدد الجرح يدويا للصورة. للجروح الكبيرة ، استخدم هدف 10x. بالنسبة للجروح الصغيرة والجروح أحادية الخلية ، استخدم هدف 20x.
- ابدأ تشغيل برنامج يجمع الصور كفيلم في الوقت الفعلي أو يجمع سلسلة من الصور على فترات منتظمة. راقب التقدم للتأكد من أن منطقة الجرح لا تنجرف خارج مجال الرؤية وأن الخلايا ذات الاهتمام تظل في بؤرة التركيز.
- الجروح أحادية الخلية تغلق في غضون دقيقة. لذلك ، صور إغلاقها بفيلم.
- لالتقاط تفاصيل ديناميكيات الخلايا للجروح الصغيرة ، اجمع الصور كل 10 ثوان تقريبا. يستغرق إغلاق الجروح الصغيرة من 20 إلى 50 دقيقة حسب الحجم.
- لا تصور الشرائح غير المختومة لأكثر من 45 دقيقة ، لأن تبخر الماء من الشريحة بمرور الوقت يؤدي إلى موت الحيوانات وتمزق الخلايا.
- لمراقبة أطول ، أغلق حول غطاء الغطاء بالفازلين لتقليل التبخر.
ملاحظة: قد تنبض بعض ميدوسا على الشريحة ، مما يتداخل مع التصوير. في هذه الحالة ، تعمل الحيوانات المتصاعدة في تخفيف 1:10 بنسبة 1٪ إيثيل 3-أمينوبنزوات ميثان سلفونات (Tricaine) ، معدلة على الرقم الهيدروجيني 7.5 ، في ASW كمخدر فعال وليس له تأثير واضح على الشفاء في إطار زمني 1 ساعة. ومع ذلك ، فإن الحيوانات تموت إذا تركت لعدة ساعات في Tricaine.

الشكل 3: تكوين جرح صغير في ظهارة المظلة. (أ) خدش لطيف للمظلة الخارجية بطرف ماصة 200 ميكرولتر لإنشاء جرح ظهاري صغير. (ب) يكون وضع غطاء الغطاء كافيا أحيانا لإحداث جروح طلائية صغيرة. (ج) ميدوسا مثبتة على شريحة منخفض. (د ) صورة الجرح الظهاري الصغير بدون بصريات مدينة دبي للإنترنت و (ه) مع بصريات مدينة دبي للإنترنت. قضبان المقياس: 50 ميكرومتر يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
4. التحليل
- تحضير ملفات الصور
ملاحظة: لمعالجة ملفات الصور ، استخدم FIJI / ImageJ مع المكونات الإضافية BioFormat المحدثة.- اضبط المقياس على نسبة البكسل الصحيحة لكل ميكرون قبل تسجيل مكدس الصور ؛ تحليل > تعيين المقياس. هذا ضروري لاستخراج قياسات الحجم الفعلي في تحليلات المصب.
- في كثير من الأحيان ، ينجرف الحيوان قليلا على شريحة المجهر. لذلك ، للتخلص من الانجراف في الأفلام ، قم بتسجيل الصور باستخدام محاذاة المكدس الخطي المكون الإضافي FIJI مع SIFT. الإضافات > التسجيل > محاذاة المكدس الخطي مع SIFT.
- احفظ المكدس المسجل كملف .avi. ملف > حفظ باسم > AVI ... في النافذة المنبثقة ، اضبط معدل الإطارات (يتم ضبط الأشكال المتحركة هنا على 10 إطارات في الثانية) وانقر فوق موافق. استخدم هذا الإخراج لإجراء تحليل التئام الجروح.
- تحليل منطقة الجرح
- باستخدام أداة lasso في FIJI / ImageJ ، حدد الجرح عن طريق تتبع حواف الخلية. قم بقياس منطقة الجرح التي تم تحديدها للتو باستخدام Command + M أو CTRL + M.
- كرر قياس منطقة الجرح كل 10 إطارات. يمكن بعد ذلك رسم القياسات من FIJI / ImageJ باستخدام المنشور 9 (الشكل 4).
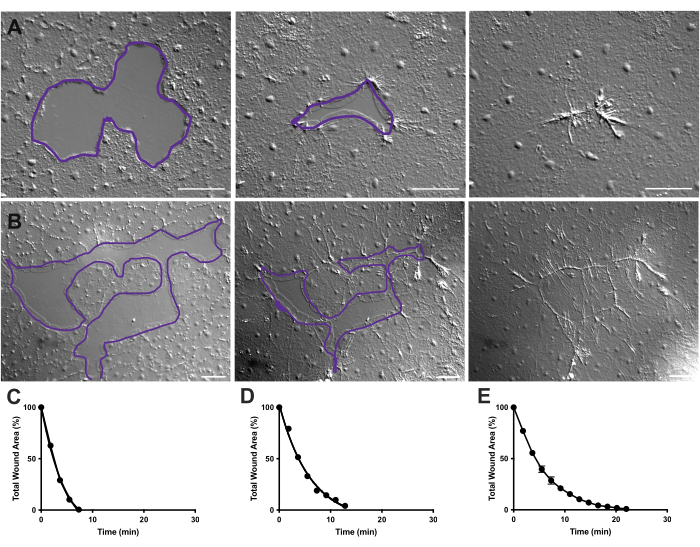
الشكل 4: تحليل منطقة الجرح في الجروح الطلائية الصغيرة. (أ ) مثال على التئام جرح ظهاري صغير خلال ١٠ دقائق. (ب) مثال على التئام جروح طلائية مختلفة خلال ٢١ دقيقة. الخطوط العريضة الأرجوانية في A و B قابلة للمقارنة مع قياسات مناطق الجرح باستخدام أداة lasso في FIJI / ImageJ. (ج) التقليل الطبيعي لمنطقة الجرح بمرور الوقت في (أ). (د) الاختزال الطبيعي لمنطقة الجرح بمرور الوقت في الخيار (ب). ه: متوسط تقليص مساحة الجرح بمرور الوقت ل 14 جرحا صغيرا. ن = 14. تتمحور أشرطة الخطأ حول متوسط ± SEM. قضبان المقياس: 50 ميكرومتر يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
5. حقن Mesogleal
- إنشاء طبق الحقن
- تحضير بوليديميثيل سيلوكسان (PDMS) عن طريق الجمع بين قاعدة PDMS وعامل المعالجة ، بنسبة 10 أجزاء أساسية إلى 1 جزء عامل معالجة بالوزن. يقلب بقوة لخلط القاعدة وعامل المعالجة بالكامل.
- لإزالة الفقاعات ، ضع الخليط في غرفة مفرغة لمدة 15 دقيقة. صب الخليط في طبق بتري 60 مم مع أغطية أنابيب الطرد المركزي الدقيقة لتثبيت القالب في مكانه. ضع القالب على الفور على أغطية الأنابيب بزاوية 45 درجة والشريط في مكانه. يتكون القالب من ثلاث شرائح زجاجية مكدسة وملتصقة ببعضها البعض لإنشاء حواف في طبق الحقن النهائي.
- ضع الطبق والعفن والمزيج بالكامل في فرن على حرارة 60 درجة مئوية لمدة 2 ساعة لعلاج المطاط الصناعي. قم بإزالة القالب للحصول على طبق حقن مكتمل.
- سحب ماصة دقيقة
- باستخدام مجتذب قطب كهربائي دقيق ، صمم برنامج سحب. استخدم برنامجا من خطوة واحدة بسرعة عالية. الحرارة هي تقريبا نتيجة اختبار RAMP الزجاجية55,56. تحقق من الماصات الدقيقة الناتجة للحصول على تناقص تدريجي طويل متسق.
ملاحظة: استخدم الشعيرات الدموية البورسليكات الزجاجية ذات الجدران الرقيقة بقطر خارجي 1.0 مم وقطر داخلي 0.75 مم وطول 10 سم.
- باستخدام مجتذب قطب كهربائي دقيق ، صمم برنامج سحب. استخدم برنامجا من خطوة واحدة بسرعة عالية. الحرارة هي تقريبا نتيجة اختبار RAMP الزجاجية55,56. تحقق من الماصات الدقيقة الناتجة للحصول على تناقص تدريجي طويل متسق.
- حقن الأصباغ والمخدرات
- اصنع إبرة حقن مجهرية (على النحو الوارد أعلاه).
- ردم إبرة الحقن المجهري باستخدام طرف ماصة طويل مع حجم زائد من الصبغة أو الدواء للحقن في ميدوسا.
ملاحظة: بالنسبة ل Clytia ، يجب الاحتفاظ بثنائي ميثيل سلفوكسيد (DMSO) عند تخفيف <1: 100 مع ASW ، حيث أن تركيزات DMSO الأعلى تعيق التئام الجروح. في حالة حقن محلول واضح ، يمكن إضافة محلول Fast Green FCF (تخفيف 1: 100 من 0.1٪ Fast Green FCF في ASW) لتصور السائل المحقون. - باستخدام ماصة نقل معدلة على النحو الوارد أعلاه ، ضع ميدوسا مع توجيه المظلة الفرعية لأعلى في طبق حقن PDMS مع ما يكفي من ASW لتغطية الحيوان (الشكل 5C). ضع الطبق على مرحلة نطاق التشريح.
ملاحظة: الحد من ASW الزائد يمنع ميدوسا من السباحة في الطبق ويسمح بحقن أكثر نجاحا. - ركز على طرف إبرة الحقن المجهري وقم بدفعها في الماء بالقرب من ميدوسا. باستخدام المعالج الدقيق ، اضغط على الإبرة في الطبق حتى تنحني وتنكسر. فتحة الطرف هذه حوالي 10-20 ميكرومتر.
ملاحظة: يمكن استخدام هذه الإبرة بشكل متكرر لنفس حقن الصبغة / الدواء في ذلك اليوم. يوصى باستخدام طرف جديد كل يوم وللأصباغ / الأدوية المنفصلة. - باستخدام micromanipulator ، أدخل طرف الإبرة من خلال المظلة الفرعية في mesoglea دون ثقب exumbrella.
ملاحظة: سيكون تجعيد / طي الظهارة ملحوظا. بمجرد إدخال الإبرة في ميدوسا ، يتوقف التجعيد / الطي. - على الحاقن الدقيق ، اضبط ضغط الانتظار على الصفر وضغط الطرد على ≤20 رطل لكل بوصة مربعة. حقن في واحد أو اثنين من الربعين ، وملء كل بقعة من الصبغة أو المخدرات ما يقرب من 1/4 من مساحة هذا الربع.
ملاحظة: اعتمادا على حجم ميدوسا ، تكون الأحجام الأكبر أو الأصغر مناسبة في أماكن الحقن المفردة. يؤدي الإفراط في ملء ميدوسا إلى أضرار جسيمة للظهارة وحتى موت الحيوان. - اعتمادا على الصبغة أو الدواء الذي يتم حقنه ، يتم وضع الحيوانات في دورق من ASW الطازج للسماح بنشر الصبغة أو الدواء وحضانته.
- للتصوير ، قم بتركيب ميدوسا على شريحة منخفضة باستخدام ماصة نقل معدلة ، ووضع الحيوان بحيث تكون المظلة الخارجية متجهة لأعلى (الشكل 5). يمكن إصابة الحيوانات في هذه المرحلة لاختبار تأثير الكاشف المحقون.
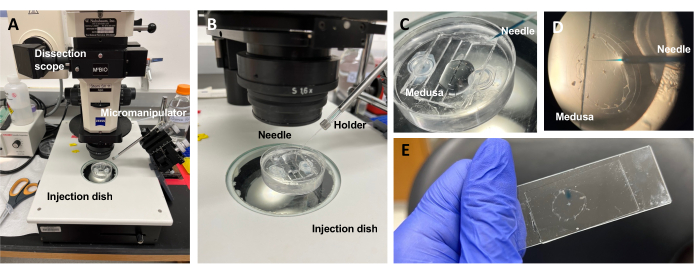
الشكل 5: إعداد الحقن لإدخال الأصباغ أو الأدوية إلى ECM. (أ) إعداد الحقن. (ب) لقطة مقربة لإعداد الحقن تظهر اتجاه إبرة الحقن المجهري (زاوية 45 درجة تقريبا بالنسبة للحيوان في الطبق). (ج) لقطة مقربة لطبق حقن السيليكون مع ميدوسا في كمية صغيرة من ASW للحقن. (د) إبرة حقن مجهرية محملة ب FCF الأخضر السريع تدخل إلى mesoglea من medusa من خلال المظلة الفرعية. (ه) الحقن اللاحق ل FCF الأخضر السريع في ميدوسا مركبة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
باتباع البروتوكولات المذكورة أعلاه ، تم تصوير الجروح الدقيقة أحادية الخلية والجروح الصغيرة والجروح الكبيرة. تم حفظ مكدسات مسجلة من ملفات الصور كملفات .avi.
في الفيلم 1 ، يمكن رؤية الجروح الدقيقة تغلق بين الخلايا وداخلها (الشكل 1 والشكل 2). لوحظت الصفيحة الصغيرة أثناء الإغلاق ، تليها الانكماش والشفاء. يتم استبعاد الحطام وإطلاقه في الماء. اكتمال الشفاء في دقيقة واحدة أو أقل.
في الفيلم 2 و 3 ، تلتئم الجروح الصغيرة ذات الأشكال المختلفة من خلال تكوين الصفيحة ، وتمديد ملامسات الصفيحة ، وانتشار الخلايا على هامش الجرح ، كما هو موضح سابقا40 (الشكل 1 والشكل 2). لا تشارك الخلايا الموجودة في الطبقات خلف الخلايا الهامشية في التئام الجروح بهذا الحجم ولا توجد هجرة جماعية للخلايا. يتبع الإغلاق السريع والتدريجي للفجوات الظهارية تقلص الأنسجة على طول خط الجرحالمشكل حديثا 40. يظهر المعدل الطبيعي للشفاء من هذين الجرحين ، معبرا عنه كنسبة مئوية من المساحة الأصلية بمرور الوقت ، (الشكل 4C ، D). في حين أن هناك بعض التباين في ديناميكيات إغلاق الجرح ، فإن متوسط النسبة المئوية لإغلاق المنطقة بمرور الوقت ل 14 جرحا بأشكال مختلفة تتراوح من 0.02-0.125 مم2 يسمح بإنشاء منحنى متوسط لالتئام الجروح في الحيوانات غير المعالجة (الشكل 4E).
يمكن رؤية الأضرار التي لحقت الغشاء القاعدي بوضوح عند حدوثه (الشكل 2). في الفيلم 4 ، تنتشر الخلايا الموجودة على هامش جرح صغير يوجد فيه تلف في الغشاء القاعدي حول المنطقة المتضررة ، ويكتمل إغلاق الفجوة بتقلص سلسلة المحفظة.
إذا كانت الأنسجة مجففة أو تالفة للغاية بحيث لا يمكن إصلاحها ، يمكن أن تتوقف حركات الخلايا ، أو يمكن أن تنفجر ورقة الخلايا بأكملها (الفيلم 5 والفيلم 6). يحدث هذا عادة بعد فترات طويلة من التصوير (45 دقيقة أو أكثر). إذا حدث انفجار الخلية في وقت مبكر من التصوير ، يتم التخلص من العينة.
كما هو موضح في الفيلم 7 ، تلتئم الجروح الكبيرة على عدة مراحل. أولا ، تصبح حافة الجرح ناعمة ومنتظمة بسبب الانقباضات على الهامش ، كما ورد سابقا57. بعد ذلك ، ينظر إلى الصفيحة على أنها تتشكل من الخلايا الموجودة على هامش الجرح ، مع تحرك الصفيحة للأمام لزيادة ملامسة الصفيحة المجاورة. يظهر تتبع النوى في الخلايا عند هامش الجرح وعدة طبقات خلف الخلايا الهامشية أن الفجوات الكبيرة تغلق بهجرة الخلايا الجماعية40. لا تنفصل الخلايا أبدا ولكنها تتحرك معا كورقة.
يمكن أن يكون إدخال الأصباغ والعوامل الدوائية أداة قوية لتشريح الآليات البيولوجية. يتم استبعاد العديد من المواد من Clytia (غير معروضة) ، على الأرجح بسبب طبقة المخاط التي تغطي سطح الحيوان. ومع ذلك ، يمكن استخدام الحقن المجهري لإدخال الجزيئات مباشرة في ECM ، مما يعطل هيكل ECM أو يزعج الأنشطة التنظيمية في ECM. بالإضافة إلى ذلك ، فإن الأصباغ والجزيئات الأخرى قادرة على دخول الخلايا الظهارية من الجانب القاعدي. على سبيل المثال ، يوضح الشكل 6 التلوين النووي باستخدام Hoechst ، وتلطيخ الغشاء باستخدام FM1-43 ، وتثبيط تكوين الصفيحة بواسطة السيتوكلاسين B بعد حقن هذه الكواشف الدقيقة في ECM. يسمح إدخال هذه الجزيئات إلى ECM والخلايا الظهارية قبل الجرح بإجراء تجارب تختبر تأثير الأدوات الدوائية على عملية الشفاء.
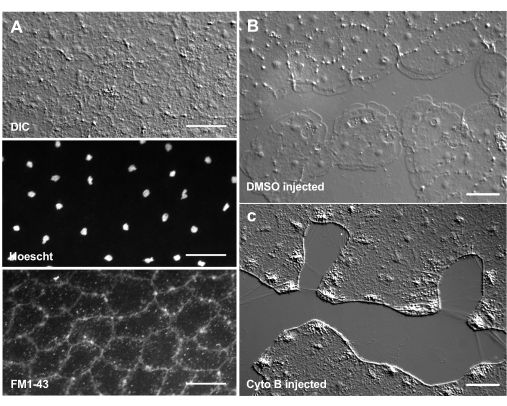
الشكل 6: الخلايا الطلائية للميدوسا بعد الحقن المجهري للأصباغ أو العوامل الدوائية. (أ) الخلايا الظهارية الموضحة في اللوحة العلوية بعد 5 دقائق من الحقن مع 20 ميكرومتر Hoechst (النوى) و 50 ميكرومتر FM1-43 (الأغشية). (ب، ج) التئام الجروح بعد الحقن مع التحكم في 1: 1000 DMSO (B) أو 100 μM Cytochalasin B (C). تم إجراء الجروح بعد 15 دقيقة من الحقن. تم التقاط الصور بعد 5 دقائق من الإصابة. يتم تثبيط تشكيل الصفيحة بواسطة السيتوكلاسين ب. يعتقد أن "الألياف" الظاهرة التي غالبا ما تظهر بين الخلايا في منطقة الجرح ناتجة عن شد يمتد الغشاء القاعدي - فهي لا تلطخ بالقضيب (غير معروض). قضبان المقياس: 50 ميكرومتر. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
الفيلم 1: فيلم الفاصل الزمني لشفاء الجرح الدقيق أحادي الخلية. الوقت المنقضي: 20 ثانية. معدل الإطارات: 10 إطارات في الثانية. شريط المقياس: 50 ميكرومتر. الرجاء الضغط هنا لتنزيل هذا الفيلم.
الفيلم 2: فيلم الفاصل الزمني لشفاء جروح ظهارية صغيرة. الوقت المنقضي: 9 دقائق و 54 ثانية. معدل الإطارات: 10 إطارات في الثانية. شريط المقياس: 50 ميكرومتر. الرجاء الضغط هنا لتنزيل هذا الفيلم.
الفيلم 3: فيلم الفاصل الزمني لشفاء جروح ظهارية صغيرة. هذا الجرح أكبر وأكثر انتظاما من الجرح في الفيلم 2. الوقت المنقضي: 20 دقيقة و 54 ثانية. معدل الإطارات: 10 إطارات في الثانية. شريط المقياس: 50 ميكرومتر. الرجاء الضغط هنا لتنزيل هذا الفيلم.
الفيلم 4: فيلم الفاصل الزمني لجرح صغير وشفاء جرح دقيق مع تمزق الغشاء القاعدي. تنتشر Lamellipodia حول تمزق الغشاء القاعدي ، على الرغم من أنها يمكن أن تتقدم على بقية ECM. بمجرد إحاطة منطقة الجرح مع تلف الغشاء القاعدي ، يسحب تقلص سلسلة المحفظة الخلايا فوق المنطقة. الوقت المنقضي: 19 دقيقة و 4 ثوان. معدل الإطارات: 10 إطارات في الثانية. شريط المقياس: 50 ميكرومتر. الرجاء الضغط هنا لتنزيل هذا الفيلم.
الفيلم 5: خلايا تموت في جرح ظهاري صغير. من المحتمل أن يكون موت الخلايا بسبب جفاف الحيوان. الوقت المنقضي: 4 دقائق و 24 ثانية. معدل الإطارات: 10 إطارات في الثانية. شريط المقياس: 100 ميكرومتر. الرجاء الضغط هنا لتنزيل هذا الفيلم.
الفيلم 6: جرح ظهاري صغير يفشل في إكمال الشفاء. الوقت المنقضي: 42 دقيقة و 32 ثانية. معدل الإطارات: 10 إطارات في الثانية. شريط المقياس: 50 ميكرومتر. الرجاء الضغط هنا لتنزيل هذا الفيلم.
الفيلم 7: التئام الجروح الظهارية الكبيرة. الوقت المنقضي: 25 دقيقة و 29 ثانية. معدل الإطارات: 10 إطارات في الثانية. شريط المقياس: 100 ميكرومتر. الرجاء الضغط هنا لتنزيل هذا الفيلم.
الشكل التكميلي 1: مخططات أبعاد خزان Clytia. التصور 3D من الدبابات Clytia حسب الطلب. (أ) منظر أمامي وخلفي. (ب) منظر جانبي. القطع في القطعة الموضحة باللون الأخضر مغطاة بشبكة من النايلون. يدخل الماء الخزان مباشرة فوق الشبكة ، ويكتسح الشبكة ويخلق تيارا دائريا. يخرج الماء من النظام من خلال الفتحة الموجودة في القطعة النهائية الموضحة باللون الأزرق. الرجاء الضغط هنا لتنزيل هذا الملف.
الفيلم التكميلي 1: مصفوفة خارج الخلية اللاخلوية في Clytia. Z-كومة من Clytia التي اتخذت باستخدام المجهر متحد البؤر. يركز المكدس في البداية على المظلة الخارجية ثم يقوم بمسح كل 10 ميكرومتر من خلال ECM إلى الأديم الباطن الصفيحة والمظلة الفرعية. تظهر الصور التي تستخدم DIC (يسار) وتلطيخ Hoechst النووي (يمين) نقص الخلايا في ECM. شريط المقياس: 100 ميكرومتر. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
هنا ، يتم تقديم المنهجية لتصوير الجروح في الجسم الحي في Clytia ، وهو كائن نموذجي لافقاري جديد نسبيا40،43،58. هناك العديد من العوامل التي تجعل هذا النظام أداة بحث فريدة وقوية ، متميزة عن النماذج الأخرى المستخدمة لدراسة التئام الجروح وإعادة الظهارة. أولا ، يتم توصيل ظهارة أحادية الطبقة ب ECM شفاف ، وبالتالي تشبه مقايسات زراعة الأنسجة في المختبر (الشكل 1 ، الشكل 2 ، الشكل 3 ، الشكل 4). كما هو الحال في المقايسات المختبرية ، يمكن تصوير الخلايا بدقة عالية. ومع ذلك ، على عكس زراعة الأنسجة ، هناك بيئة خلوية أصيلة و ECM ، بحيث يمكن رؤية التئام الجروح في سياق أحداث الإشارات المعقدة التي تحدث في حي مصاب. ثانيا ، تفتقر Clytia إلى الاستجابات الالتهابية ، والخلايا الليفية المهاجرة ، والأوعية الدموية ، والدم. وهذا يسمح بدراسة عملية إعادة الظهارة في الجسم الحي في غياب الأحداث المتداخلة التي تحدث في الحيوانات البالغة الأكثر تعقيدا أثناء التئام الجروح59. ثالثا ، ECM غير خلوي (الفيلم التكميلي 1) وكبير ، مما يتيح سهولة الوصول إليه باستخدام إبرة الحقن المجهري (الشكل 5 والشكل 6). باستخدام هذا النهج ، يمكن للباحثين اختبار تأثير الكواشف الدوائية التي تزعج بنية ECM أو الإشارات على التئام الجروح في الجسم الحي. يمكن أيضا إدخال الكواشف في الخلايا الظهارية ، ويمكن تقييم آثارها على التئام الجروح في الجسم الحي. رابعا ، هناك بروتوكولات موجودة لإنشاء المسوخ والحيوانات المعدلة وراثيا في نظام Clytia42،43،44،45. لذلك يمكن ملاحظة التئام الجروح في الجسم الحي في الحيوانات ذات التعبير المتزايد / المنخفض للجينات ذات الأهمية.
هناك العديد من الخطوات الحاسمة في هذه التقنية. أولا ، كما هو موضح في الشكل 3 ، من الضروري استخدام مجهر تم تكوينه بشكل صحيح للفحص المجهري DIC لأن الخلايا الظهارية المسطحة والشفافة غير مرئية تقريبا باستخدام المجهر الضوئي القياسي. من المهم أيضا تطوير مهارة جرح الحيوانات بلطف حتى تتلف الظهارة دون التلاعب بوحدة التحكم في المحتوى. لمسة لطيفة مماثلة ضرورية لحقن المواد الدقيقة في ECM ، لأن الأضرار الجسيمة التي لحقت بالحيوان أثناء الحقن قد تعرض للخطر التحليل اللاحق لالتئام الجروح. في حين أن هناك منحنى تعليمي لهذه التقنيات ، حتى الطلاب المبتدئين قد أتقنوها بسرعة في مختبر Malamy. في الواقع ، تم استخدام هذه البروتوكولات لإثبات هجرة الخلايا في الدورات المعملية الجامعية في جامعة شيكاغو.
للحصول على التصوير الأمثل ، من المهم ألا يتحرك الحيوان ولا تنجرف منطقة الجرح المختارة خارج مجال الرؤية. إذا كانت الحيوانات تنبض ، فإن العلاج باستخدام Tricaine كما هو موضح فعال للغاية. للانجراف ، غالبا ما يكون من الضروري إعادة وضع العينة يدويا. يمكن حذف هذه الحركات من الفيلم النهائي باستخدام وظيفة التسجيل في FIJI / ImageJ.
يتمثل أحد قيود هذا النظام في أنه لا يمكن إنشاء جروح متطابقة ، حيث تختلف الجروح في الشكل والحجم باستخدام الطرق الموضحة هنا. لذلك ، قد يكون من الصعب تحديد المعدل الدقيق لإغلاق الجرح أو هجرة الخلايا. تلتصق العلامات الموضعية مثل حبيبات الكربون ب ECM المكشوف في جريح ويمكن استخدامها لقياس معدل هجرة الخلايا الجماعية في الجروح الكبيرة (غير معروض). بالنسبة لتحليل إغلاق الجرح الصغير ، حتى مع اختلاف حجم الجرح وشكله ، هناك نطاق محدود من معدلات الإغلاق بين الجروح بهذا الحجم (الشكل 4). لذلك من الممكن الكشف الكمي عن آثار الكواشف الدوائية التعزيزية أو القمعية.
بينما يصف هذا العمل توصيف التئام الجروح باستخدام الفحص المجهري DIC فقط ، يمكن استخدام نفس الأساليب لتصوير الشفاء باستخدام الفحص المجهري الفلوري أو المجهري متحد البؤر. للمساعدة في ذلك ، توجد بروتوكولات لتوليد محورة وراثيا يتم فيها تمييز البروتينات الخلوية وخارج الخلية المختلفة بالفلورسنت. سيكون التصوير المتزامن مع مدينة دبي للإنترنت والتألق ، جنبا إلى جنب مع اضطراب التئام الجروح باستخدام العوامل الدوائية أو الخطوط الطافرة ، نهجا قويا لفهم الآليات التي تكمن وراء عملية التئام الجروح في الظهارة.
Disclosures
لا شيء للكشف عنه.
Acknowledgements
يتم دعم E.E.L.L. بمنحة من مؤسسة العلوم الوطنية PRFB 2011010. نود أن نشكر Tsuyoshi Momose و Evelyn Houliston لمساعدتنا في إنشاء مستعمرات Clytia الخاصة بنا ، وجان بابتيست رينييه لجمع صور التئام الجروح الدقيقة ، وهاري كيريازيس لبناء خزانات الكريزل الزائفة ، وإليزابيث بالدو للحفاظ على موطن Clytia. تم إنشاء الشكل 1B باستخدام BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 20500 ACE EKE Microscope Fiber Optic Light Source | Kramer Scientific Corporation | ||
| AxioCam 506 mono | ZEISS | 426557-0000-000-MA285 | |
| Capillary tubes | World Precision Instruments | TW1004 | |
| Cytochalasin B | Abcam | ab143482 | |
| Depression slides | Amscope | BS-C12 | |
| DMR with DIC options and fluorescence halogen lamp | Leica | ||
| Ethyl 3-aminobenzoate methanesulfonate | Sigma Aldrich | E10521-10G | |
| Fast Green FCF | Thermo Scientific | A16520-06 | |
| FM1-43 | Biotium | 70022 | Excitation/Emission: 480/598 nm |
| Hoechst 33342 | Thermo Scientific | 62249 | Excitation/Emission: 361/497 nm |
| imageJ | NIH | ||
| Microloader tips (0.5-10 μL /2-20 μL) | Eppendorf | 930001007 | |
| Micromanipulator | World Precision Instruments | 3301R / M3301L | |
| Microscope Cover Glass (22X40-1.5) | Fisherbrand | 12-544-BP | |
| Petri Dish (60 mm x 15 mm) | Fisherbrand | FB085713A | |
| PicoNozzle v2 | World Precision Instruments | 5430-ALL | |
| Pipette puller | Sutter Instrument Co | P-97 | |
| Pneumatic PicoPump | World Precision Instruments | PV820 | |
| Polycarbonate vacuum, desiccator | Bel-art | F42025-0000 | |
| Prism 9 | GraphPad | ||
| STEMI Sv11 Dissection scope | ZEISS | STEMI SV11 | |
| SYLGARD 184 | Dow Silicones | 1024001 | |
| Transfer pipettes | Fisherbrand | 13-711-7M | |
| Z-Hab mini system | Pentair | ||
| ZEN Microscopy software | Zeiss |
References
- Tyler, S. Epithelium-the primary building block for metazoan complexity. Integrative and Comparative Biology. 43 (1), 55-63 (2003).
- Kurn, H., Daly, D. T. Histology, Epithelial Cell. StatPearls. , (2022).
- Schempp, C., Emde, M., Wölfle, U. Dermatology in the Darwin anniversary. Part 1: Evolution of the integument. Journal of the German Society of Dermatology. 7 (9), 750-757 (2009).
- Lopez-Ojeda, W., Pandey, A., Alhajj, M., Oakley, A. M. Anatomy, Skin (Integument). StatPearls. , (2022).
- Bukowiecki, A., Hos, D., Cursiefen, C., Eming, S. A. Wound-healing studies in cornea and skin: parallels, differences and opportunities. International Journal of Molecular Sciences. 18 (6), 1257 (2017).
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. Journal of Cell Science. 123 (24), 4195-4200 (2010).
- Hynes, R. O. The evolution of metazoan extracellular matrix. The Journal of Cell Biology. 196 (6), 671-679 (2012).
- Fidler, A. L., et al. Collagen IV and basement membrane at the evolutionary dawn of metazoan tissues. eLife. 6, 24176 (2017).
- Bullen, T. F., et al. Characterization of epithelial cell shedding from human small intestine. Laboratory Investigation; a Journal of Technical Methods and Pathology. 86 (10), 1052-1063 (2006).
- Watson, A. J. M., et al. Epithelial barrier function in vivo is sustained despite gaps in epithelial layers. Gastroenterology. 129 (3), 902-912 (2005).
- Sonnemann, K. J., Bement, W. M. Wound repair: toward understanding and integration of single-cell and multicellular wound responses. Annual Review of Cell and Developmental Biology. 27, 237-263 (2011).
- Abreu-Blanco, M. T., Verboon, J. M., Parkhurst, S. M. Single cell wound repair. BioArchitecture. 1 (3), 114-121 (2011).
- Fenteany, G., Janmey, P. A., Stossel, T. P. Signaling pathways and cell mechanics involved in wound closure by epithelial cell sheets. Current Biology. 10 (14), 831-838 (2000).
- Pastar, I., et al. Epithelialization in wound healing: a comprehensive review. Advances in Wound Care. 3 (7), 445-464 (2014).
- Rousselle, P., Braye, F., Dayan, G. Re-epithelialization of adult skin wounds: Cellular mechanisms and therapeutic strategies. Advanced Drug Delivery Reviews. 146, 344-365 (2019).
- Bement, W. M., Forscher, P., Mooseker, M. S. A novel cytoskeletal structure involved in purse string wound closure and cell polarity maintenance. The Journal of Cell Biology. 121 (3), 565-578 (1993).
- Vedula, S. R. K., Ravasio, A., Lim, C. T., Ladoux, B. Collective Cell migration: a mechanistic perspective. Physiology. 28 (6), 370-379 (2013).
- Li, L., He, Y., Zhao, M., Jiang, J. Collective cell migration: Implications for wound healing and cancer invasion. Burns & Trauma. 1 (1), 21-26 (2015).
- Bornes, L., Windoffer, R., Leube, R. E., Morgner, J., van Rheenen, J. Scratch-induced partial skin wounds re-epithelialize by sheets of independently migrating keratinocytes. Life Science Alliance. 4 (1), 202000765 (2021).
- Theveneau, E., Mayor, R. Collective cell migration of epithelial and mesenchymal cells. Cellular and Molecular Life Sciences. 70 (19), 3481-3492 (2013).
- Haensel, D., Dai, X. Epithelial-to-mesenchymal transition in cutaneous wound healing: where we are and where we are heading. Developmental Dynamics. 247 (3), 473-480 (2018).
- Cordeiro, J. V., Jacinto, A. The role of transcription-independent damage signals in the initiation of epithelial wound healing. Nature Reviews. Molecular Cell Biology. 14 (4), 249-262 (2013).
- Abreu-Blanco, M. T., Watts, J. J., Verboon, J. M., Parkhurst, S. M. Cytoskeleton responses in wound repair. Cellular and Molecular Life Sciences. 69 (15), 2469-2483 (2012).
- Klarlund, J. K., Block, E. R. Free edges in epithelia as cues for motility. Cell Adhesion & Migration. 5 (2), 106-110 (2011).
- Enyedi, B., Niethammer, P. Mechanisms of epithelial wound detection. Trends in Cell Biology. 25 (7), 398-407 (2015).
- Niethammer, P. The early wound signals. Current Opinion in Genetics & Development. 40, 17-22 (2016).
- Jacinto, A., Martinez-Arias, A., Martin, P. Mechanisms of epithelial fusion and repair. Nature Cell Biology. 3 (5), 117-123 (2001).
- Mayor, R., Etienne-Manneville, S. The front and rear of collective cell migration. Nature reviews. Molecular Cell Biology. 17 (2), 97-109 (2016).
- Gupta, S., Yap, A. S. How adherens junctions move cells during collective migration. Faculty Reviews. 10, 56 (2021).
- Blair, M. J., Jones, J. D., Woessner, A. E., Quinn, K. P. Skin structure-function relationships and the wound healing response to intrinsic aging. Advances in Wound Care. 9 (3), 127-143 (2020).
- Falanga, V., et al. Chronic wounds. Nature Reviews. Disease Primers. 8 (1), 50 (2022).
- Liang, C. -. C., Park, A. Y., Guan, J. -. L. In vitro scratch assay: a convenient and inexpensive method for analysis of cell migration in vitro. Nature Protocols. 2 (2), 329-333 (2007).
- Jonkman, J. E. N., et al. An introduction to the wound healing assay using live-cell microscopy. Cell Adhesion & Migration. 8 (5), 440-451 (2014).
- Poujade, M., et al. Collective migration of an epithelial monolayer in response to a model wound. Proceedings of the National Academy of Sciences. 104 (41), 15988-15993 (2007).
- Masson-Meyers, D. S., et al. Experimental models and methods for cutaneous wound healing assessment. International Journal of Experimental Pathology. 101 (1-2), 21-37 (2020).
- Park, S., et al. Tissue-scale coordination of cellular behaviour promotes epidermal wound repair in live mice. Nature Cell Biology. 19 (2), 155-163 (2017).
- Tsai, C. -. R., Wang, Y., Galko, M. J. Crawling wounded: molecular genetic insights into wound healing from Drosophila larvae. The International Journal of Developmental Biology. 62 (6-7-8), 479-489 (2018).
- Richardson, R., et al. Adult zebrafish as a model system for cutaneous wound-healing research. The Journal of Investigative Dermatology. 133 (6), 1655-1665 (2013).
- Erickson, J. R., Echeverri, K. Learning from regeneration research organisms: The circuitous road to scar free wound healing. Developmental Biology. 433 (2), 144-154 (2018).
- Kamran, Z., et al. In vivo imaging of epithelial wound healing in the cnidarian Clytia hemisphaerica demonstrates early evolution of purse string and cell crawling closure mechanisms. BMC Developmental Biology. 17 (1), 17 (2017).
- Chari, T., et al. Whole-animal multiplexed single-cell RNA-seq reveals transcriptional shifts across Clytia medusa cell types. Science Advances. 7 (48), (2021).
- Weissbourd, B., et al. A genetically tractable jellyfish model for systems and evolutionary neuroscience. Cell. 184 (24), 5854-5868 (2021).
- Momose, T., et al. High doses of CRISPR/Cas9 ribonucleoprotein efficiently induce gene knockout with low mosaicism in the hydrozoan Clytia hemisphaerica through microhomology-mediated deletion. Scientific Reports. 8 (1), 11734 (2018).
- Houliston, E., Leclère, L., Munro, C., Copley, R. R., Momose, T. Past, present and future of Clytia hemisphaerica as a laboratory jellyfish. Current Topics in Developmental Biology. 147, 121-151 (2022).
- Schmid, V., et al. The extracellular matrix (mesoglea) of hydrozoan jellyfish and its ability to support cell adhesion and spreading. Hydrobiologia. 216 (1), 3-10 (1991).
- Day, R. M., Lenhoff, H. M. Hydra mesoglea: a model for investigating epithelial cell-basement membrane interactions. Science. 211 (4479), 291-294 (1981).
- Zhang, X., et al. The collagens of hydra provide insight into the evolution of metazoan extracellular matrices. The Journal of Biological Chemistry. 282 (9), 6792-6802 (2007).
- Danjo, Y., Gipson, I. K. Actin 'purse string' filaments are anchored by E-cadherin-mediated adherens junctions at the leading edge of the epithelial wound, providing coordinated cell movement. Journal of Cell Science. 111 (22), 3323-3332 (1998).
- Arenas Gómez, C. M., Sabin, K. Z., Echeverri, K. Wound healing across the animal kingdom: Crosstalk between the immune system and the extracellular matrix. Developmental Dynamics. 249 (7), 834-846 (2020).
- Lechable, M., et al. An improved whole life cycle culture protocol for the hydrozoan genetic model Clytia hemisphaerica. Biology Open. 9 (11), (2020).
- Casares, L., et al. Hydraulic fracture during epithelial stretching. Nature Materials. 14 (3), 343-351 (2015).
- Wayne, R. Chapter 4 - Bright-Field Microscopy. Light and Video Microscopy (Third Edition). , 95-116 (2019).
- Murphy, D. B., Davidson, M. W. . Fundamentals of Light Microscopy and Electronic Imaging: Second Edition. , (2012).
- . Micropipette Techniques for Electrophysiology Available from: https://www.sutter.com/micropipette/cookbook.html (2022)
- Brown, A. L., Johnson, B. E., Goodman, M. B. Making patch-pipettes and sharp electrodes with a programmable puller). Journal of Visualized Experiments. (20), e939 (2008).
- Klarlund, J. K. Dual modes of motility at the leading edge of migrating epithelial cell sheets. Proceedings of the National Academy of Sciences. 109 (39), 15799-15804 (2012).
- Houliston, E., Momose, T., Manuel, M. Clytia hemisphaerica: a jellyfish cousin joins the laboratory. Trends in Genetics. 26 (4), 159-167 (2010).
- Rodrigues, M., Kosaric, N., Bonham, C. A., Gurtner, G. C. Wound healing: a cellular perspective. Physiological Reviews. 99 (1), 665-706 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved