Method Article
Cnidarian 모델 유기체 Clytia hemisphaerica를 사용한 생체 내 상피 상처 치유 특성화
요약
본 논문은 생체 내에서 고해상도로 상처 치유를 위해 살아있는 Clytia hemisphaerica medusa의 상피에 상처를 만드는 방법을 설명 한다. 또한, 상처 치유 동안 상피 세포 및 세포 외 기질의 신호 전달 과정을 교란시키기 위해 염료 및 약물을 도입하는 기술이 제시됩니다.
초록
피부에서 눈, 내장에 이르기까지 모든 동물의 장기는 상피 세포 시트로 덮여있어 항상성을 유지하면서 감염으로부터 보호 할 수 있습니다. 따라서 상피 상처를 복구하는 능력이 모든 후생 동물에게 중요하다는 것은 놀라운 일이 아닙니다. 척추동물의 상피 상처 치유는 염증 반응, 혈관 형성 및 재상피화를 포함한 중첩 과정을 포함합니다. 이러한 과정의 조절은 상피 세포, 이웃 세포 및 세포외 기질(ECM) 사이의 복잡한 상호작용을 포함합니다. ECM에는 구조 단백질, 조절 단백질 및 활성 소분자가 포함되어 있습니다. 이러한 복잡성은 대부분의 동물이 불투명한 조직과 접근하기 어려운 ECM을 가지고 있다는 사실과 함께 살아있는 동물에서 상처 치유를 연구하기 어렵게 만듭니다. 따라서 상피 상처 치유에 대한 많은 연구가 조직 배양 시스템에서 수행되며, 단일 상피 세포 유형은 인공 매트릭스에 단층으로 도금됩니다. Clytia hemisphaerica (Clytia)는 이러한 연구에 독특하고 흥미로운 보완 기능을 제공하여 진정한 ECM을 가진 온전한 동물에서 상피 상처 치유를 연구할 수 있도록 합니다. Clytia의 외배엽 상피는 큰 편평 상피 세포의 단일 층으로, 살아있는 동물에서 DIC(Differential Interfering Contrast) 현미경을 사용하여 고해상도 이미징을 가능하게 합니다. 이동 섬유아세포, 혈관구조 또는 염증 반응이 없기 때문에 생체 내 재상피화에서 중요한 사건을 해부할 수 있습니다. 단세포 미세상처, 크고 작은 상피 상처, 기저막을 손상시키는 상처 등 다양한 유형의 상처의 치유를 분석할 수 있습니다. 라멜리포디아 형성, 지갑 끈 수축, 세포 스트레칭 및 집단 세포 이동이 모두 이 시스템에서 관찰될 수 있습니다. 또한 ECM을 통해 약리학적 제제를 도입하여 생체 내에서 세포:ECM 상호 작용 및 세포 과정을 수정할 수 있습니다. 이 작업은 살아있는 Clytia에서 상처를 만들고, 치유 영화를 캡처하고, ECM에 시약을 미세 주입하여 치유 메커니즘을 조사하는 방법을 보여줍니다.
서문
상피 세포 시트는 모든 후생 동물의 외부 표면을 덮고 내부 장기를 정렬하며 동물의 몸을 별개의 구획으로 나눕니다. 상피는 또한 내부 신체를 외부 환경과 분리하고 손상과 감염으로부터 보호합니다. 따라서 상피층의 출현은 다세포 동물의 진화에 필수적인 부분이었으며, 상피층은 척추동물에서 가장 기초적인 후생동물에 이르기까지 모든 동물에서 볼 수 있다1. 일부 장기의 상피는 폐 공기 주머니, 혈관, 장2과 같은 단일 단층이며, 플라나리아와 자포동물과 같은 무척추동물의 표피에서도 존재한다3. 척추동물의 피부(skin)4와 각막(cornea)5과 같은 다른 조직에서는 상피가 층화되어 있는데, 이는 여러 개의 상피세포층(epithelial cell layer)2이 존재한다는 것을 의미한다. 모든 경우에, 가장 기저 상피층은 세포외 기질 (ECM)의 특수 영역을 형성하는 단백질 시트 인 기저막에 부착됩니다.6,7,8.
연속적인 상피 시트를 재현하기 위해 상피의 균열을 신속하게 복구해야 합니다. 상피 손상은 장에서 상피 세포가 흘러 나오는 것과 같은 자연적 과정에서 발생하며,9,10 염증이나 신체적 외상의 결과로 발생합니다. 단일 상피 세포가 손상되면, 주변 세포가 서로 부착되어 구멍(11, 12)을 닫을 수 있도록 스스로 복구하거나 제거해야 한다. 단일 세포의 크기보다 큰 상처에서, 상피 세포는 서로 도달하고 시트13을 복구하기 위해 이동해야 한다. 이것은 갭이 작거나 상처 갭을 닫기 위해 상처의 가장자리에서 상피 세포의 이동을 필요로 할 수 있는 경우 세포 확산에 의해 달성될 수 있습니다. 이 후자의 과정을 재상피화(re-epithelialization)라고 한다14,15. 배아 조직에서, 상피 세포는 상처를 닫기 위해 퍼지고 이동하거나, 지갑 끈과 유사한 메커니즘으로 상처 가장자리에서 세포 사이에 형성되는 악토미오신 케이블의 수축에 의해 틈을 가로질러 당겨집니다(16). 많은 성인 조직에서, 재상피화는 세포가 이웃 세포와의 접합을 유지하는 간섭성 세포 시트의 이동을 수반한다14,17,18. 다른 조직에서는 세포:세포 연결이 해체되고 상피 세포는 중간엽 세포처럼 행동하여 재상피화 동안 조정되지만 독립적인 방식으로 상처 부위로 이동합니다 14,19,20,21.
상피 세포 이동은 이동하는 세포 사이, 세포와 ECM 사이의 복잡한 상호 작용에 의해 조절됩니다. 상피 세포의 상처 활성화 및 후속 이동 메커니즘을 다루는 엄청난 양의 실험 문헌이 있지만 아직 밝혀야 할 것이 많이 남아 있습니다. 예를 들어, 상처에 반응하여 상피 세포를 활성화시켜 이동하는 초기 신호는 확실하게 확인되지 않았으며(22), 상처에 가장 가까운 상피 세포 측면에 라멜리포디아를 생성하기 위해 액틴이 어떻게 재배치되는지도 완전히 이해되지 않았다 22,23,24,25,26,27. 집단 세포 이동은 상처 원위 세포와 공유하기 위해 상처 세포의 정보를 필요로 하며, 의사소통 경로는 여전히 불분명하다28. 셀:셀 접합부와 셀:ECM 부착물은 시트 내의 셀이 스스로 재배열됨에 따라 분해 및 개질되어야 하지만, 이 과정의 조절은 잘 이해되지 않고 있다14,29. 이러한 질문과 기타 관련 질문에 대한 진전은 근본적인 생물학적 문제로서 중요할 뿐만 아니라 올바른 상처 치유의 임상적 중요성 때문에 중요합니다. 상피 세포가 올바르게 이동하는 능력을 손상시키는 질병은 만성 상처를 초래합니다. 예를 들어 유전 질환인 수포성 표피박리증이 있는데, 여기서 ECM에 상피 세포가 부착되는 데 관여하는 유전자가 돌연변이되어 피부가 벗겨지고 물집이 생기는 연약한 피부가 됩니다. 재상피화는 또한 자연적으로 노화된 조직에서 손상된다30,31. 따라서 상처 치유 결과를 개선하기 위한 중재를 개발하려면 더 나은 이해가 필수적입니다.
상처 치유에서 상피 세포 이동은 시험관 내 접근법과 모델 유기체를 모두 사용하여 연구되었습니다. 상처 치유 및 세포 이동 메커니즘에 대한 대부분의 연구는 단일 상피 세포 유형의 단층이 ECM을 대체하는 기질에서 성장되는 조직 배양에서 수행되었습니다. 세포 단층은 특정 모양과 크기의 틈을 만들기 위해 스텐실로 긁히거나 성장한 다음 관찰됩니다32,33,34. 시험관 내 모델은 세포 행동의 이상적인 시각화뿐만 아니라 기질의 품질을 변화시키고, 세포를 약물과 비생물적 및 생물학적 요인에 노출시키고, 다양한 관심 유전자를 발현하거나 억제하는 구조로 세포를 형질감염시킬 수 있는 기회를 제공합니다. 그러나, 이러한 환원주의적 접근법은 ECM11에서 발생하는 다양한 세포 유형 및 신호 전달 이벤트 간의 통신을 포함하여 생체 내 맥락에서 상피 세포 거동과 관련된 중요한 매개변수 중 일부를 포착하지 못할 수 있습니다. 생체 내 모델은 여러 세포 유형, 겹치는 신호 전달 경로 및 복잡한 ECM35와 함께 상처의 진정한 맥락을 제공합니다. 상처 치유 연구를 위한 그러한 모델 중 하나는 마우스(19)이며, 최근의 발전으로 연구자들은 살아있는 동물(36)에서 전층 상처를 치유하는 동안 표피 세포를 관찰할 수 있게 되었다. 그러나 마우스 및 기타 생체 내 시스템은 재상피화를 연구하는 데 어려움을 겪고 있습니다. 첫째, 자연적 맥락에서 세포 거동을 관찰하는 것의 가장 큰 이점은 혈액 응고, 면역 세포 및 염증의 모집, 섬유아세포의 모집, 세포 역분화, 재혈관화 및 ECM의 리모델링을 포함하여 척추동물 상처 치유 동안 발생하는 시간적으로 겹치는 사건의 복잡성과 균형을 이룹니다. 또한 불투명한 조직은 이미징을 어렵게 만듭니다. 초파리 유충과 제브라피쉬 표피 시스템(Zebrafish epidermamis system)37,38은 상대적으로 단순하기 때문에 이러한 어려움 중 일부를 극복했다(39).
우리 연구실은 최근 상피 상처 치유를 연구하기위한 새로운 모델을 도입했습니다 : hydrozoan cnidarian Clytia hemisphaerica (Clytia) 40의 메두사 (해파리) 형태. Clytia는 완전히 시퀀싱되고 주석이 달린 게놈41, 단일 세포 RNAseq 전사체 42 및 게놈 변형(돌연변이 유발 및 형질전환 발생)43,44,45을 위한 프로토콜을 갖춘 신흥 모델 유기체입니다. Cnidarians는 상피층을 가진 현존하는 가장 오래된 혈통 중 하나이므로 자포 상처 치유를 이해하면 상피 무결성을 보장하는 조상 경로에 대한 통찰력을 얻을 수 있습니다. 생명 나무 전체에 걸쳐 보존된 경로를 위해 Clytia는 상피 세포 역학과 생체 내 상처 치유의 기능적 조절을 연구하는 흥미롭고 새로운 시스템을 제공합니다.
Clytia medusa(exumbrella)의 윗면을 덮고 있는 상피는 너비가 약 50μm, 두께가 1-2μm인 투명한 편평 상피 세포의 단층입니다(그림 1). 그들은 해파리의 "젤리"인 mesoglea라고 불리는 ECM에 붙어 있습니다. 메조글레아는 척추동물을 포함한 다른 동물(46,47,48)에서 발견되는 ECM과 조성적으로 유사하고, 기저 막(40)을 가지며, 완전히 투명하다. Clytia medusa의 상피층은 쉽게 긁히거나 상처를 입을 수 있습니다 (아래 참조). 상피와 ECM의 단순성과 투명성은 치유 중 세포와 세포의 움직임에 대한 고해상도 이미징을 가능하게 합니다. 최근에, Kamran et al. Clytia 상피의 작은 상처 치유를 자세히 설명했습니다40. Clytia의 치유는 lamellipodia 기반 세포 크롤링, 세포 확산 및 집단 세포 이동뿐만 아니라 배아 시스템에서 더 전형적인 지갑 끈 폐쇄를 통해 발생한다는 것이 입증되었습니다(이전에는 각막과 같은 성인 동물 구조에서 볼 수 있었지만49). Clytia 상처 치유는 염증 반응40,50이없는 다른 시스템에서 볼 수 있듯이 매우 빠릅니다. Clytia exumbrella의 치유는 기존 상피 세포의 움직임에 전적으로 의존하며, 세포가 증식하거나 ECM을 통해 상처 부위로 이동하지 않습니다(보충 동영상 1). 이러한 모든 발견은 Clytia가 상피 상처 치유를 연구하는 데 유용한 모델 시스템임을 시사합니다. 실제로, 상처 치유 동안 Clytia의 상피 세포를 쉽게 이미징할 수 있었기 때문에 상피 세포 라멜리포디아가 손상되지 않은 기저막이 있는 한 노출된 ECM 영역에 걸쳐 확장되고 퍼진다는 발견이 이루어졌습니다. 기저막이 손상되면, 상피 치유는 지갑 끈 기구(40)로 전환된다. 이것은 lamellipodia 기반 크롤링 대 지갑 끈 폐쇄로 폐쇄하기로 한 결정의 기본 메커니즘에 대한 첫 번째 시연으로, 치유에서 특정 세포:ECM 상호 작용의 중요성과 자연적인 맥락에서 세포를 관찰하는 것의 중요성을 강조했습니다.
아래에서는 단일 세포 미세 상처, 주로 세포 확산에 의해 닫히는 작은 상처 및 닫히기 위해 집단 세포 이동이 필요한 큰 상처를 만들고 이미징하기 위한 프로토콜에 대해 설명합니다. 또한, ECM 및 상피 세포에 소분자를 도입하여 상처 치유의 추정 조절 경로의 실험적 섭동을 허용하는 프로토콜이 설명되어 있습니다.
프로토콜
1. 동물 문화
- 현미경 슬라이드의 Clytia 폴립 콜로니와 제브라피쉬 시스템의 인공 해수(ASW)에서 18°C의 메두사를 유지하고, 폴립 콜로니를 위한 2L 제브라피쉬 탱크와 메두사를 위한 맞춤형 5L 유사 크라이젤 탱크를 사용합니다(보충 그림 1)51. ASW는 탈이온화된(DI)H2O에서 4% Instant Ocean으로 구성됩니다.
- 설명 된 바와 같이 2-3 일 된 아르테미아로 매일 동물에게 먹이십시오51.
참고: 상처 치유 영상은 장에서 시야로 방출되는 파편이 적기 때문에 동물에게 최근에 먹이를 주지 않은 경우 더 쉽습니다. - 밤새 1L의 ASW로 채워진 2L 비커에 콜로니를 넣어 필요에 따라 확립된 폴립 콜로니에서 아기 메두사를 수집합니다. 모든 상처 치유 실험에 2-3주 된 암컷 메두사를 사용하십시오. 클리티아의 번식은 다른 곳에서도 상세히 기술되어 있다51.
2. 상처
- 세포 내 및 세포 사이에 미세 상처 생성(20-500 μm2)
- 더 큰 구멍(직경 0.5-0.7cm)을 만들기 위해 가위로 팁을 절단하여 수정된 이송 피펫을 만듭니다.
알림: 피펫의 구멍은 동물이 손상되지 않도록 충분히 넓어야 합니다. - 수정된 이송 피펫을 사용하여 메두사 엑스우솔브렐러가 위를 향하도록 하여 메두사를 움푹 들어간 슬라이드에 놓고 동물을 덮을 만큼만 ASW를 사용합니다.
- 즉시 동물과 이미지 위에 커버슬립을 놓습니다(이미징에 대한 설명은 아래 참조). 커버슬립은 중엽을 압박하고, 압축된 조직의 반동은 세포를 약간 밀어내는 힘을 생성한다52. 이것은 즉시 각 세포 사이의 간격과 일부 세포 내의 손상으로 나타납니다(그림 1B, B', 그림 2 및 그림 3A-C).
- 더 큰 구멍(직경 0.5-0.7cm)을 만들기 위해 가위로 팁을 절단하여 수정된 이송 피펫을 만듭니다.
- 작은 상피 상처 만들기 (0.02-0.125 mm2)
- 수정된 이송 피펫(위와 같이)을 사용하여 메두사 엑스우솔이 위를 향하도록 하여 메두사를 함몰 슬라이드에 놓습니다.
- 200μL 피펫 팁을 사용하여 메두사 표면을 부드럽게 긁습니다. 부드럽게 긁으면 기저막에 찢어짐이 생길 수 있는데, 이는 쉽게 알 수 있다22. 이미징을 위해 커버 슬립으로 동물을 덮으십시오. 또는 커버슬립을 배치하는 것만으로도 긁히지 않아도 작은 상피 상처를 만들 수 있습니다(그림 1C, C', 그림 2 및 그림 3A-C).
참고: 메두사 표면을 긁을 때 아래로 누르지 마십시오., ECM을 손상시키고 불규칙한 표면을 생성하므로 — 불규칙한 표면에서 이동하는 상피 세포는 초점을 유지하기가 더 어렵습니다.
- 큰 상피 상처 만들기 (0.5-0.9 mm2)
- 마이크로 피펫 풀러와 유리 모세관을 사용하여 미세 주입 바늘을 만듭니다 (5.2 단계). 빈 미세주입 바늘을 미세 조작기에 부착된 미세 주입기 홀더에 넣습니다. 개구부가 약 20-40 μm가되도록 바늘 끝을 자릅니다.
참고: 큰 상피 상처용 절단 바늘은 보관 및 재사용하여 실험 간의 일관성을 높일 수 있습니다. - 마이크로 인젝터의 유지 압력을 0으로 설정하고 배출 압력을 약 20PSI로 설정합니다. 2초의 공기 펄스를 전달하도록 마이크로 인젝터를 설정합니다.
알림: 배출 압력은 바늘 개구부의 직경에 따라 조정해야 할 수 있습니다(즉, 작은 팁은 더 높은 압력을 사용하고 큰 팁은 더 낮은 압력을 사용함). - 동물을 덮을 수 있을 만큼의 ASW를 사용하여 해부 스코프 단계의 함몰 슬라이드에 exumbrella가 위를 향하도록 메두사를 놓습니다. 미세 매니퓰레이터를 사용하여 미세 주입 바늘 끝이 물 바로 위에 오도록 조정합니다. 이렇게하려면 팁을 물에 조심스럽게 담근 다음 (물이 피펫 팁에 들어갈 수 있음) 메두사의 상피 표면에 가깝도록 집어 넣습니다.
알림: 팁은 메두사의 한 사분면 위에 위치해야 합니다. 메두사의 방사형 운하는 메두사 종을 4개의 별개의 사분면으로 나눕니다. 사분면을 표적으로 삼으면 생식선과 요골관이 상처 부위에서 제외되기 때문에 더 깨끗한 이미징을 얻을 수 있습니다. - 인젝터의 시작을 눌러 공기를 펄스합니다. 팁의 너비에 따라 같은 지점에서 펄스를 2-4회 반복합니다. 팁이 클수록 더 적은 펄스가 필요합니다.
알림: 공기의 맥박으로 인한 물/메두사의 움푹 들어간 곳이 보여야 합니다. - 큰 상처를 이미징하기 위해 부상당한 동물을 커버 슬립으로 덮습니다 (그림 1D, D ').
- 이미징 상피 상처 치유를 위해 아래 단계(섹션 3)를 따르십시오.
- 마이크로 피펫 풀러와 유리 모세관을 사용하여 미세 주입 바늘을 만듭니다 (5.2 단계). 빈 미세주입 바늘을 미세 조작기에 부착된 미세 주입기 홀더에 넣습니다. 개구부가 약 20-40 μm가되도록 바늘 끝을 자릅니다.
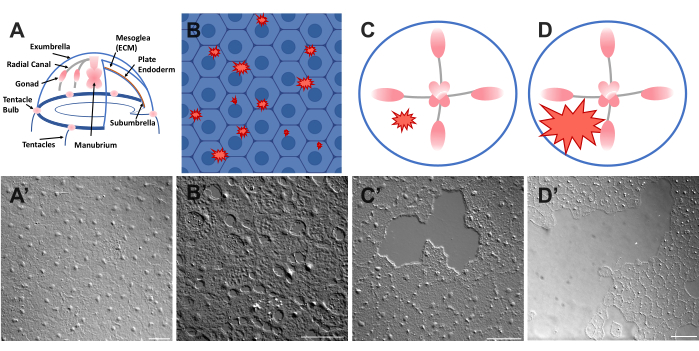
그림 1: Clytia medusa의 손상되지 않고 상처 입은 우산 상피층. (A) Clytia medusa 몸체의 만화 그래픽. (ᅡ') 위에서 본 온전한 메두사 exumbrella 상피. (B) 파란색의 상피 세포가 있는 단세포 미세 상처(빨간색 들쭉날쭉한 모양)의 만화. (비') 단세포 미세 상처. (C) 작은 상피 상처 (빨간색 들쭉날쭉 한 모양)의 만화. (씨') 작은 상피 상처. (D) 큰 상피 상처 (빨간색 들쭉날쭉 한 모양)의 만화. (디') 큰 상피 상처. 이미지는 모두 DIC 현미경을 사용하여 얻었습니다. 스케일 바 (A'-C'): 50 μm. 스케일 바 (D'): 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
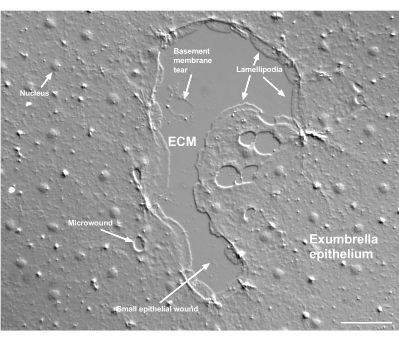
그림 2: 여러 크기의 상처와 손상된 기저막. 전형적인 작은 우산 상피 상처가 나타나며, 가장자리 세포에서 형성되는 lamellipodia를 나타내는 레이블이 있습니다. 또한 상피 세포 내부와 상피 세포 사이의 미세 상처가 보입니다. 상처의 윗부분에 작은 기저막이 찢어지는 것을 주목하십시오. 영화 4 는 이 상처의 치유를 보여줍니다. 스케일 바: 50μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 이미징 상피 상처 치유
- 현미경이 Köhler 조명53에 맞게 정렬되었고 DIC(Differential Interfering Contrast) 현미경54에 맞게 올바르게 설정되었는지 확인하십시오. 상피 세포는 표준 광학 장치에서는 거의 보이지 않습니다(그림 3D,E).
- exumbrella에 초점을 맞춥니다. 이것은 얇은 층이지만 육각형 세포는 깨끗해야합니다.
참고 : exumbrella와 subumbrella는 수직 섬유에 의해지지되는 두꺼운 mesoglea에 의해 분리됩니다. subumbrellar 세포는 요골 운하와 동일한 초점면에 있습니다. 처음에 subumbrellar 레이어에 초점을 맞춘 경우, exumbrella를 찾을 때까지 mesoglea 및 수직 섬유를 통해 천천히 초점을 조정하십시오. - 이미지에 상처를 수동으로 식별합니다. 큰 상처의 경우 10x 대물렌즈를 사용하십시오. 작은 상처와 단세포 상처의 경우 20x 대물렌즈를 사용하십시오.
- 이미지를 실시간으로 동영상으로 수집하거나 정기적으로 일련의 이미지를 수집하는 프로그램을 시작합니다. 진행 상황을 모니터링하여 상처 부위가 시야를 벗어나지 않고 관심 세포에 초점이 맞춰져 있는지 확인합니다.
- 단세포 상처는 1 분 안에 닫힙니다. 따라서 영화로 폐쇄를 이미지화하십시오.
- 작은 상처에 대한 세포 역학의 세부 정보를 캡처하려면 약 10초마다 이미지를 수집합니다. 작은 상처의 봉합은 크기에 따라 20-50 분이 걸립니다.
- 시간이 지남에 따라 슬라이드에서 물이 증발하면 동물이 죽고 세포가 파열되므로 밀봉되지 않은 슬라이드를 45분 이상 이미지화하지 마십시오.
- 더 오래 관찰하려면 증발을 줄이기 위해 바셀린으로 커버슬립 주위를 밀봉하십시오.
알림: 일부 메두사는 슬라이드에서 맥박을 일으켜 이미징을 방해할 수 있습니다. 이 경우 ASW에 pH 7.5로 조정된 1% 에틸 3-아미노벤조에이트 메탄설포네이트(트리카인)의 1:10 희석액에 동물을 장착하면 효과적인 마취제 역할을 하며 1시간 동안 치유에 명백한 효과가 없습니다. 그러나 Tricaine에서 몇 시간 동안 방치하면 동물이 죽습니다.

그림 3 : exumbrellar 상피에 작은 상처 만들기. (A) 200μL 피펫 팁으로 우산을 부드럽게 긁어 작은 상피 상처를 만듭니다. (B) 커버슬립을 놓는 것만으로도 때때로 작은 상피 상처를 만들기에 충분합니다. (C) 메두사는 움푹 들어간 미끄럼틀에 장착되었습니다. (D) DIC 광학이 없는 작은 상피 상처 이미지 및 (E) DIC 광학이 있는 이미지. 스케일 바: 50 μm 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 분석
- 이미지 파일 준비
참고: 이미지 파일을 처리하려면 업데이트된 BioFormat 플러그인과 함께 FIJI/ImageJ를 사용하십시오.- 이미지 스택을 등록하기 전에 미크론당 올바른 픽셀 비율로 배율을 설정합니다. 스케일> 분석합니다. 이는 다운스트림 분석에서 실제 크기 측정값을 추출하는 데 필요합니다.
- 종종 동물은 현미경 슬라이드에서 약간 표류합니다. 따라서 동영상에서 드리프트를 제거하려면 SIFT와 함께 FIJI 플러그인 선형 스택 정렬을 사용하여 이미지를 등록합니다. 플러그인 > SIFT와의 선형 스택 정렬> 등록.
- 등록된 스택을 .avi 파일로 저장합니다. 파일 > AVI> 다른 이름으로 저장... 팝업에서 프레임 속도를 설정하고(여기서는 애니메이션 그림이 10fps로 설정됨) 확인을 클릭합니다. 이 출력을 사용하여 상처 치유 분석을 수행할 수 있습니다.
- 상처 부위 분석
- FIJI/ImageJ의 올가미 도구를 사용하여 세포 가장자리를 추적하여 상처의 윤곽을 그립니다. 방금 윤곽 선이 표시된 상처 부위를 Command+M 또는 Ctrl+M으로 측정합니다.
- 10프레임마다 상처 부위 측정을 반복합니다. 그런 다음 Prism 9를 사용하여 FIJI/ImageJ의 측정값을 플로팅할 수 있습니다(그림 4).
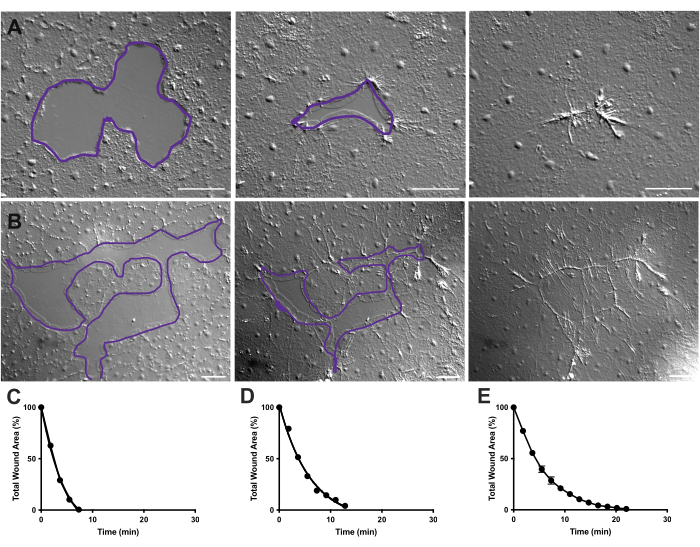
그림 4: 작은 상피 상처의 상처 부위 분석. (A) 10분에 걸친 작은 상피 상처 치유의 예. (B) 21분에 걸친 상피 상처 치유의 예. A, B의 보라색 윤곽선은 FIJI/ImageJ의 올가미 도구를 사용하여 상처 부위를 측정한 것과 비슷합니다. (C) A에서 시간 경과에 따른 상처 부위의 정규화된 감소. (D) B에서 시간 경과에 따른 상처 부위의 정규화된 감소. (E) 14개의 작은 상처에 대한 시간 경과에 따른 상처 면적의 평균 감소. n = 14입니다. 평균 SEM을 중심으로 한 오차 막대±. 스케일 바: 50 μm 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
5. 중폭 주사
- 사출 접시 만들기
- PDMS 베이스와 경화제를 염기 10부 대 경화제 1중량부의 비율로 혼합하여 폴리디메틸실록산(PDMS)을 준비합니다. 베이스와 경화제가 완전히 섞이도록 세게 저어줍니다.
- 기포를 제거하려면 혼합물을 진공 챔버에 15분 동안 넣습니다. 혼합물을 미세 원심분리기 튜브 캡이 있는 60mm 페트리 접시에 부어 금형을 제자리에 고정합니다. 즉시 금형을 튜브 캡에 45° 비스듬히 놓고 테이프를 제자리에 붙입니다. 금형은 최종 사출 접시에 융기를 만들기 위해 함께 접착된 3개의 적층된 오프셋 유리 슬라이드입니다.
- 전체 접시, 몰드 및 혼합물을 60°C의 오븐에 2시간 동안 넣어 엘라스토머를 경화시킵니다. 완성된 사출 접시의 몰드를 제거합니다.
- 마이크로피펫 풀링
- 미세 전극 풀러를 사용하여 풀링 프로그램을 설계합니다. 빠른 속도의 원스텝 프로그램을 사용하십시오. 열은 대략 유리 RAMP 테스트 결과55,56입니다. 결과 마이크로피펫에서 길고 일관된 테이퍼를 확인합니다.
알림: 외경 1.0mm, 내경 0.75mm, 길이 10cm의 얇은 벽 유리 붕규산 모세관을 사용하십시오.
- 미세 전극 풀러를 사용하여 풀링 프로그램을 설계합니다. 빠른 속도의 원스텝 프로그램을 사용하십시오. 열은 대략 유리 RAMP 테스트 결과55,56입니다. 결과 마이크로피펫에서 길고 일관된 테이퍼를 확인합니다.
- 염료 및 약물 주입
- 미세 주입 바늘을 만드십시오 (위와 같이).
- 긴 피펫 팁을 사용하여 메두사에 주입하기 위해 과도한 양의 염료 또는 약물로 미세 주입 바늘을 다시 채웁니다.
알림: Clytia의 경우 DMSO 농도가 높을수록 상처 치유를 방해하므로 디메틸 설폭사이드(DMSO)를 ASW로 <1:100 희석하여 보관해야 합니다. 맑은 용액을 주입하는 경우 Fast Green FCF 용액(ASW에서 0.1% Fast Green FCF를 1:100 희석)을 추가하여 주입된 액체를 시각화할 수 있습니다. - 위와 같이 수정된 이송 피펫을 사용하여 우산이 위를 향하도록 메두사를 동물을 덮을 만큼의 ASW가 있는 PDMS 주입 접시에 놓습니다(그림 5C). 접시를 해부 범위의 무대에 놓습니다.
알림: 과도한 ASW를 제한하면 메두사가 접시에서 헤엄치는 것을 방지하고 더 성공적인 주사를 할 수 있습니다. - 미세 주입 바늘 끝에 초점을 맞추고 메두사 근처의 물로 전진시킵니다. 미세 매니퓰레이터를 사용하여 바늘이 구부러지고 부러질 때까지 접시에 바늘을 누르십시오. 이 팁 개구부는 약 10-20 μm입니다.
참고: 이 바늘은 그날 동일한 염료/약물 주사에 반복적으로 사용할 수 있습니다. 매일 신선한 팁을 사용하고 별도의 염료/약물을 사용하는 것이 좋습니다. - 미세 매니퓰레이터를 사용하여 우산을 뚫지 않고 서브 우산을 통해 바늘 끝을 mesoglea에 삽입하십시오.
참고: 상피의 주름/접힘이 눈에 띕니다. 바늘이 메두사에 삽입되면 주름/접힘이 멈춥니다. - 마이크로 인젝터에서 유지 압력을 0으로 설정하고 배출 압력을 ≤20PSI로 설정합니다. 하나 또는 두 개의 사분면에 주입하여 각 사분면 면적의 약 1/4에 해당하는 염료 또는 약물 반점을 채웁니다.
알림: 메두사의 크기에 따라 단일 주사 부위에 더 크거나 작은 부피가 적합합니다. 메두사를 과도하게 채우면 상피에 극심한 손상이 발생하고 심지어 동물이 사망합니다. - 주입되는 염료 또는 약물에 따라 동물을 신선한 ASW 비커에 넣어 염료 또는 약물 확산 및 배양을 허용합니다.
- 이미징을 위해 수정된 이송 피펫을 사용하여 메두사를 함몰 슬라이드에 장착하고 exumbrella가 위를 향하도록 동물을 배치합니다(그림 5). 주입 된 시약의 효과를 테스트하기 위해이 단계에서 동물을 상처 입힐 수 있습니다.
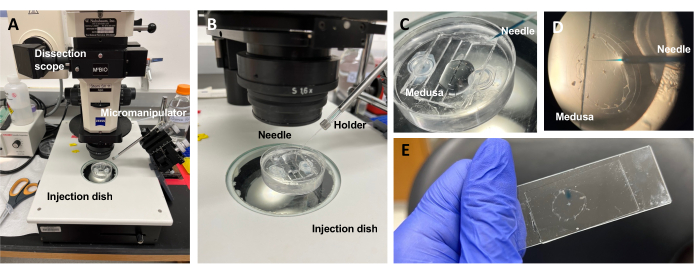
그림 5: ECM에 염료 또는 약물을 도입하기 위한 주입 설정. (A) 주입 설정. (B) 미세 주사 바늘 방향을 보여주는 주사 설정의 클로즈업(접시에 있는 동물에 대해 약 45° 각도). (C) 주사를 위해 소량의 ASW에 메두사를 넣은 실리콘 주입 접시의 클로즈업. (D) Fast Green FCF가 장전된 미세 주사 바늘이 우산을 통해 메두사의 중형으로 들어갑니다. (E) 장착된 메두사에 Fast Green FCF 사후 주입. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
위의 프로토콜에 따라 단세포 미세상처, 작은 상처 및 큰 상처를 영상화했습니다. 등록된 이미지 파일 스택은 .avi 파일로 저장되었습니다.
동영상 1에서 미세 상처는 세포 사이와 세포 내에서 닫히는 것을 볼 수 있습니다(그림 1 및 그림 2). 작은 lamellipodia는 폐쇄 중에 관찰되고 수축과 치유가 뒤 따른다. 파편은 배제되어 물 속으로 방출됩니다. 치유는 1 분 이내에 완료됩니다.
동영상 2 및 3에서, 상이한 형태의 작은 상처는 앞서 설명한 바와 같이, 라멜리포디아의 형성, 라멜리포디아 접촉의 확장, 그리고 상처 가장자리에서의 세포의 확산을 통해 치유된다(도40)(도 1 및 도 2). 변연 세포 뒤의 계층에 있는 세포는 이 크기의 상처 치유에 참여하지 않으며 집단 세포 이동도 없습니다. 상피 간극의 신속하고 점진적인 폐쇄는 새로 형성된 상처 솔기(40)를 따라 조직 수축이 뒤따른다. 시간 경과에 따른 원래 면적의 백분율로 표시되는 이 두 상처의 정규화된 치유 속도가 표시됩니다(그림 4C,D). 상처 봉합 역학에는 약간의 변동이 있지만, 0.02-0.125mm2 범위의 다양한 모양의 14개 상처에 대해 시간 경과에 따른 평균 면적 봉합 비율을 계산하면 처리되지 않은 동물의 상처 치유를 위한 평균 곡선을 설정할 수 있습니다(그림 4E).
기저막의 손상은 발생할 때 명확하게 볼 수 있습니다(그림 2). 동영상 4에서는 기저막 손상이 있는 작은 상처의 가장자리에 있는 세포가 손상 부위 주위로 퍼지고, 지갑 끈 수축으로 틈새 봉합이 완료됩니다.
조직이 탈수되거나 너무 손상되어 복구할 수 없는 경우 세포 이동이 멈추거나 전체 세포 시트가 파열될 수 있습니다(동영상 5 및 동영상 6). 이것은 일반적으로 장기간의 이미징(45분 이상) 후에 발생합니다. 이미징 초기에 세포 파열이 발생하면 샘플이 폐기됩니다.
영화 7에서 볼 수 있듯이 큰 상처는 여러 단계로 치유됩니다. 첫째, 상처의 가장자리는 이전에 보고된 바와 같이 가장자리의 수축으로 인해 매끄럽고 규칙적이 됩니다(57). 그런 다음 lamellipodia가 상처 가장자리의 세포에서 형성되는 것으로 보이며, lamellipodia는 인접한 lamellipodia와의 접촉을 최대화하기 위해 앞으로 이동합니다. 상처 가장자리와 가장자리 세포 뒤의 여러 계층에서 세포의 핵을 추적하면 집단 세포 이동에 의해 큰 간격이 닫히는 것을 알 수 있습니다40. 셀은 분리되지 않고 시트로 함께 움직입니다.
염료 및 약리학 적 제제의 도입은 생물학적 메커니즘을 해부하는 강력한 도구가 될 수 있습니다. 많은 물질이 Clytia(표시되지 않음)에서 제외되는데, 이는 아마도 동물의 표면을 코팅하는 점액층 때문일 것입니다. 그러나 미세주입은 분자를 ECM에 직접 도입하여 ECM 구조를 방해하거나 ECM의 조절 활동을 교란시키는 데 사용할 수 있습니다. 또한, 염료 및 다른 분자는 기저부에서 상피 세포로 들어갈 수 있습니다. 예를 들어, 그림 6 은 Hoechst를 사용한 핵 염색, FM1-43을 사용한 막 염색 및 이러한 시약을 ECM에 미세 주입한 후 cytochalasin B에 의한 lamellipodia 형성 억제를 보여줍니다. 상처를 입기 전에 ECM과 상피 세포에 이러한 분자를 도입하면 치유 과정에 대한 약리학 적 도구의 효과를 테스트하는 실험이 가능합니다.
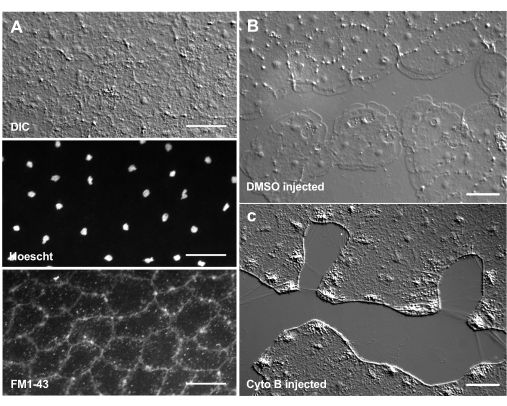
그림 6: 염료 또는 약리학적 제제의 미세주입 후 메두사의 상피 세포. (A) 20 μM Hoechst(핵) 및 50 μM FM1-43(막)을 주입한 후 5분 후 상단 패널에 표시된 상피 세포. (나,씨) 1:1,000 DMSO 대조군(B) 또는 100μM 사이토칼라신 B(C) 주사 후 상처 치유. 주사 후 15분 후에 상처를 만들었습니다. 이미지는 부상 후 5분 후에 촬영되었습니다. lamellipodia의 형성은 cytochalasin B에 의해 억제됩니다. 상처 부위의 세포 사이에서 종종 볼 수 있는 명백한 "섬유"는 기저막을 늘리는 장력의 결과로 여겨지며, 팔로이딘으로 염색되지 않습니다(표시되지 않음). 스케일 바: 50 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
동영상 1: 단세포 미세상처 치유의 타임랩스 동영상. 경과 시간: 20초 프레임 속도: 10fps. 스케일 바: 50 μm. 이 영화를 다운로드하려면 여기를 클릭하십시오.
영화 2: 작은 상피 상처 치유의 타임랩스 동영상. 경과 시간: 9분 54초 프레임 속도: 10fps. 스케일 바: 50 μm. 이 영화를 다운로드하려면 여기를 클릭하십시오.
동영상 3: 작은 상피 상처 치유의 타임랩스 동영상. 이 상처는 영화 2의 상처보다 더 크고 불규칙한 모양입니다. 경과 시간: 20분 54초 프레임 속도: 10fps. 스케일 바: 50 μm. 이 영화를 다운로드하려면 여기를 클릭하십시오.
동영상 4: 작은 상처와 기저막 파열로 치유되는 미세 상처의 타임랩스 동영상. Lamellipodia는 ECM의 나머지 부분을 통해 전진할 수 있지만 기저막 파열 주위로 퍼집니다. 기저막 손상이 있는 상처 부위가 둘러싸이면 지갑 끈 수축이 세포를 해당 부위 위로 끌어당깁니다. 경과 시간: 19분 4초 프레임 속도: 10fps. 스케일 바: 50 μm. 이 영화를 다운로드하려면 여기를 클릭하십시오.
영화 5: 작은 상피 상처로 죽어가는 세포. 세포 사멸은 동물의 탈수로 인한 것일 수 있습니다. 경과 시간: 4분 24초 프레임 속도: 10fps. 스케일 바: 100 μm. 이 영화를 다운로드하려면 여기를 클릭하십시오.
영화 6: 작은 상피 상처가 치유를 완료하지 못합니다. 경과 시간: 42분 32초 프레임 속도: 10fps. 스케일 바: 50 μm. 이 영화를 다운로드하려면 여기를 클릭하십시오.
영화 7: 큰 상피 상처 치유. 경과 시간: 25분 29초 프레임 속도: 10fps. 스케일 바: 100 μm. 이 영화를 다운로드하려면 여기를 클릭하십시오.
보충 그림 1: Clytia 탱크 치수 회로도. 맞춤형 Clytia 탱크의 3D 시각화. (A) 앞면과 뒷면 모습. (B) 측면도. 녹색으로 표시된 조각의 컷아웃은 나일론 메쉬로 덮여 있습니다. 물은 메쉬 바로 위에 탱크로 들어가 메쉬를 스윕하고 원형 전류를 생성합니다. 물은 파란색으로 표시된 끝 부분의 구멍을 통해 시스템에서 빠져 나옵니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 동영상 1: Clytia의 무세포 세포외 기질. 공초점 현미경을 사용하여 촬영한 Clytia의 Z 스택. 스택은 처음에 exumbrella에 초점을 맞춘 다음 ECM을 통해 10μm마다 플레이트 내배엽 및 subumbrella로 스캔합니다. DIC(왼쪽)와 Hoechst 핵 염색(오른쪽)을 사용한 이미지는 ECM에 세포가 없음을 보여줍니다. 스케일 바: 100 μm. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
여기서, 방법론은 비교적 새로운 무척추 동물 모델 유기체 인 Clytia에서 생체 내 상처를 이미징하기 위해 제시됩니다40,43,58. 이 시스템을 상처 치유 및 재상피화를 연구하는 데 사용되는 다른 모델과 구별되는 독특하고 강력한 연구 도구로 만드는 몇 가지 요인이 있습니다. 첫째, 단층 상피는 투명한 ECM에 부착되어 시험관 내 조직 배양 분석과 유사합니다(그림 1, 그림 2, 그림 3, 그림 4). in vitro 분석에서와 같이 세포를 고해상도로 이미지화할 수 있습니다. 그러나 조직 배양과 달리 진정한 세포 환경과 ECM이 있어 상처 치유는 살아있는 부상당한 동물에서 발생하는 복잡한 신호 전달 사건의 맥락에서 볼 수 있습니다. 둘째, Clytia는 염증 반응, 이동 섬유아세포, 혈관 구조 및 혈액이 부족합니다. 이것은 상처 치유 동안 더 복잡한 성인 동물에서 발생하는 중복되는 사건이 없는 상태에서 생체 내에서 재상피화 과정을 연구할 수 있게 한다59. 셋째, ECM은 무세포(Supplemental Movie 1)이고 크기가 커서 미세 주사 바늘로 쉽게 접근할 수 있습니다(그림 5 및 그림 6). 이 접근법을 사용하여 연구자들은 생체 내 상처 치유에 대한 ECM 구조 또는 신호 전달을 교란시키는 약리학 적 시약의 효과를 테스트 할 수 있습니다. 시약은 또한 상피 세포에 도입될 수 있고, 생체내 상처 치유에 대한 이들의 효과를 평가할 수 있다. 넷째, Clytia 시스템42,43,44,45에서 돌연변이 및 형질 전환 동물을 생성하기위한 프로토콜이 존재합니다. 따라서 관심 유전자의 발현이 증가/감소한 동물에서 생체 내 상처 치유를 관찰할 수 있습니다.
이 기술에는 몇 가지 중요한 단계가 있습니다. 먼저, 도 3에 나타난 바와 같이, 표준 광학 현미경으로는 거의 보이지 않는 평평하고 투명한 상피 세포로서 DIC 현미경에 맞게 올바르게 구성된 현미경을 사용할 필요가 있다. ECM을 훼손하지 않고 상피가 손상되도록 동물을 부드럽게 상처를 입히는 기술을 개발하는 것도 중요합니다. ECM에 물질을 미세 주입하는 경우에도 유사하게 부드러운 터치가 필요한데, 주사 중 동물에 대한 광범위한 손상이 상처 치유에 대한 후속 분석을 손상시킬 수 있기 때문입니다. 이러한 기술에 대한 학습 곡선이 있지만 초보자도 Malamy 연구실에서 빠르게 마스터했습니다. 실제로 이러한 프로토콜은 시카고 대학의 학부 실험실 과정에서 세포 이동을 입증하는 데 사용되었습니다.
최적의 이미징을 위해서는 동물이 움직이지 않고 선택한 상처 부위가 시야에서 벗어나지 않는 것이 중요합니다. 동물이 맥박을 뛰는 경우, 설명 된대로 Tricaine으로 치료하는 것이 매우 효과적입니다. 드리프트의 경우 샘플을 수동으로 재배치해야 하는 경우가 많습니다. 이러한 움직임은 FIJI/ImageJ의 등록 기능을 사용하여 최종 동영상에서 제거할 수 있습니다.
이 시스템의 한계는 여기에 설명된 방법을 사용하여 상처의 모양과 크기가 모두 다르기 때문에 동일한 상처를 만들 수 없다는 것입니다. 따라서 상처 봉합 또는 세포 이동의 정확한 속도를 정량화하는 것은 어려울 수 있습니다. 탄소 입자와 같은 위치 마커는 상처 입은 동물에서 노출된 ECM에 달라붙고, 큰 상처에서 집단 세포 이동 속도를 측정하기 위해 사용될 수 있다 (도시되지 않음). 작은 상처 봉합 분석의 경우 상처 크기와 모양이 가변적이더라도 이 크기의 상처 중 봉합 속도 범위가 제한적입니다(그림 4). 따라서 촉진 또는 억제 약리학 적 시약의 효과를 정량적으로 검출 할 수 있습니다.
이 연구는 DIC 현미경만을 사용하여 상처 치유의 특성을 설명하지만, 형광 또는 컨포칼 현미경을 사용하여 치유를 이미지화하는 데에도 동일한 접근 방식을 사용할 수 있습니다. 이를 돕기 위해 다양한 세포 및 세포외 단백질이 형광 표지된 형질전환 동물을 생성하기 위한 프로토콜이 마련되어 있습니다. 약리학적 제제 또는 돌연변이 계통을 사용한 상처 치유의 교란과 결합된 DIC 및 형광을 사용한 동시 이미징은 상피의 상처 치유 과정의 기초가 되는 메커니즘을 이해하는 강력한 접근 방식이 될 것입니다.
공개
공개 할 것이 없습니다.
감사의 말
E.E.L.L. 국립 과학 재단 PRFB 2011010의 보조금으로 지원됩니다. 클리티아 식민지 건설에 도움을 준 Tsuyoshi Momose와 Evelyn Houliston, 미세 상처 치유 이미지 수집에 도움을 준 Jean-Baptiste Reynier, 유사 크라이젤 탱크 건설에 대해 Harry Kyriazes, Clytia 서식지를 유지해 준 Elizabeth Baldo에게 감사드립니다. 그림 1B는 BioRender.com 로 만들어졌습니다.
자료
| Name | Company | Catalog Number | Comments |
| 20500 ACE EKE Microscope Fiber Optic Light Source | Kramer Scientific Corporation | ||
| AxioCam 506 mono | ZEISS | 426557-0000-000-MA285 | |
| Capillary tubes | World Precision Instruments | TW1004 | |
| Cytochalasin B | Abcam | ab143482 | |
| Depression slides | Amscope | BS-C12 | |
| DMR with DIC options and fluorescence halogen lamp | Leica | ||
| Ethyl 3-aminobenzoate methanesulfonate | Sigma Aldrich | E10521-10G | |
| Fast Green FCF | Thermo Scientific | A16520-06 | |
| FM1-43 | Biotium | 70022 | Excitation/Emission: 480/598 nm |
| Hoechst 33342 | Thermo Scientific | 62249 | Excitation/Emission: 361/497 nm |
| imageJ | NIH | ||
| Microloader tips (0.5-10 μL /2-20 μL) | Eppendorf | 930001007 | |
| Micromanipulator | World Precision Instruments | 3301R / M3301L | |
| Microscope Cover Glass (22X40-1.5) | Fisherbrand | 12-544-BP | |
| Petri Dish (60 mm x 15 mm) | Fisherbrand | FB085713A | |
| PicoNozzle v2 | World Precision Instruments | 5430-ALL | |
| Pipette puller | Sutter Instrument Co | P-97 | |
| Pneumatic PicoPump | World Precision Instruments | PV820 | |
| Polycarbonate vacuum, desiccator | Bel-art | F42025-0000 | |
| Prism 9 | GraphPad | ||
| STEMI Sv11 Dissection scope | ZEISS | STEMI SV11 | |
| SYLGARD 184 | Dow Silicones | 1024001 | |
| Transfer pipettes | Fisherbrand | 13-711-7M | |
| Z-Hab mini system | Pentair | ||
| ZEN Microscopy software | Zeiss |
참고문헌
- Tyler, S. Epithelium-the primary building block for metazoan complexity. Integrative and Comparative Biology. 43 (1), 55-63 (2003).
- Kurn, H., Daly, D. T. Histology, Epithelial Cell. StatPearls. , (2022).
- Schempp, C., Emde, M., Wölfle, U. Dermatology in the Darwin anniversary. Part 1: Evolution of the integument. Journal of the German Society of Dermatology. 7 (9), 750-757 (2009).
- Lopez-Ojeda, W., Pandey, A., Alhajj, M., Oakley, A. M. Anatomy, Skin (Integument). StatPearls. , (2022).
- Bukowiecki, A., Hos, D., Cursiefen, C., Eming, S. A. Wound-healing studies in cornea and skin: parallels, differences and opportunities. International Journal of Molecular Sciences. 18 (6), 1257(2017).
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. Journal of Cell Science. 123 (24), 4195-4200 (2010).
- Hynes, R. O. The evolution of metazoan extracellular matrix. The Journal of Cell Biology. 196 (6), 671-679 (2012).
- Fidler, A. L., et al. Collagen IV and basement membrane at the evolutionary dawn of metazoan tissues. eLife. 6, 24176(2017).
- Bullen, T. F., et al. Characterization of epithelial cell shedding from human small intestine. Laboratory Investigation; a Journal of Technical Methods and Pathology. 86 (10), 1052-1063 (2006).
- Watson, A. J. M., et al. Epithelial barrier function in vivo is sustained despite gaps in epithelial layers. Gastroenterology. 129 (3), 902-912 (2005).
- Sonnemann, K. J., Bement, W. M. Wound repair: toward understanding and integration of single-cell and multicellular wound responses. Annual Review of Cell and Developmental Biology. 27, 237-263 (2011).
- Abreu-Blanco, M. T., Verboon, J. M., Parkhurst, S. M. Single cell wound repair. BioArchitecture. 1 (3), 114-121 (2011).
- Fenteany, G., Janmey, P. A., Stossel, T. P. Signaling pathways and cell mechanics involved in wound closure by epithelial cell sheets. Current Biology. 10 (14), 831-838 (2000).
- Pastar, I., et al. Epithelialization in wound healing: a comprehensive review. Advances in Wound Care. 3 (7), 445-464 (2014).
- Rousselle, P., Braye, F., Dayan, G. Re-epithelialization of adult skin wounds: Cellular mechanisms and therapeutic strategies. Advanced Drug Delivery Reviews. 146, 344-365 (2019).
- Bement, W. M., Forscher, P., Mooseker, M. S. A novel cytoskeletal structure involved in purse string wound closure and cell polarity maintenance. The Journal of Cell Biology. 121 (3), 565-578 (1993).
- Vedula, S. R. K., Ravasio, A., Lim, C. T., Ladoux, B. Collective Cell migration: a mechanistic perspective. Physiology. 28 (6), 370-379 (2013).
- Li, L., He, Y., Zhao, M., Jiang, J. Collective cell migration: Implications for wound healing and cancer invasion. Burns & Trauma. 1 (1), 21-26 (2015).
- Bornes, L., Windoffer, R., Leube, R. E., Morgner, J., van Rheenen, J. Scratch-induced partial skin wounds re-epithelialize by sheets of independently migrating keratinocytes. Life Science Alliance. 4 (1), 202000765(2021).
- Theveneau, E., Mayor, R. Collective cell migration of epithelial and mesenchymal cells. Cellular and Molecular Life Sciences. 70 (19), 3481-3492 (2013).
- Haensel, D., Dai, X. Epithelial-to-mesenchymal transition in cutaneous wound healing: where we are and where we are heading. Developmental Dynamics. 247 (3), 473-480 (2018).
- Cordeiro, J. V., Jacinto, A. The role of transcription-independent damage signals in the initiation of epithelial wound healing. Nature Reviews. Molecular Cell Biology. 14 (4), 249-262 (2013).
- Abreu-Blanco, M. T., Watts, J. J., Verboon, J. M., Parkhurst, S. M. Cytoskeleton responses in wound repair. Cellular and Molecular Life Sciences. 69 (15), 2469-2483 (2012).
- Klarlund, J. K., Block, E. R. Free edges in epithelia as cues for motility. Cell Adhesion & Migration. 5 (2), 106-110 (2011).
- Enyedi, B., Niethammer, P. Mechanisms of epithelial wound detection. Trends in Cell Biology. 25 (7), 398-407 (2015).
- Niethammer, P. The early wound signals. Current Opinion in Genetics & Development. 40, 17-22 (2016).
- Jacinto, A., Martinez-Arias, A., Martin, P. Mechanisms of epithelial fusion and repair. Nature Cell Biology. 3 (5), 117-123 (2001).
- Mayor, R., Etienne-Manneville, S. The front and rear of collective cell migration. Nature reviews. Molecular Cell Biology. 17 (2), 97-109 (2016).
- Gupta, S., Yap, A. S. How adherens junctions move cells during collective migration. Faculty Reviews. 10, 56(2021).
- Blair, M. J., Jones, J. D., Woessner, A. E., Quinn, K. P. Skin structure-function relationships and the wound healing response to intrinsic aging. Advances in Wound Care. 9 (3), 127-143 (2020).
- Falanga, V., et al. Chronic wounds. Nature Reviews. Disease Primers. 8 (1), 50(2022).
- Liang, C. -C., Park, A. Y., Guan, J. -L. In vitro scratch assay: a convenient and inexpensive method for analysis of cell migration in vitro. Nature Protocols. 2 (2), 329-333 (2007).
- Jonkman, J. E. N., et al. An introduction to the wound healing assay using live-cell microscopy. Cell Adhesion & Migration. 8 (5), 440-451 (2014).
- Poujade, M., et al. Collective migration of an epithelial monolayer in response to a model wound. Proceedings of the National Academy of Sciences. 104 (41), 15988-15993 (2007).
- Masson-Meyers, D. S., et al. Experimental models and methods for cutaneous wound healing assessment. International Journal of Experimental Pathology. 101 (1-2), 21-37 (2020).
- Park, S., et al. Tissue-scale coordination of cellular behaviour promotes epidermal wound repair in live mice. Nature Cell Biology. 19 (2), 155-163 (2017).
- Tsai, C. -R., Wang, Y., Galko, M. J. Crawling wounded: molecular genetic insights into wound healing from Drosophila larvae. The International Journal of Developmental Biology. 62 (6-7-8), 479-489 (2018).
- Richardson, R., et al. Adult zebrafish as a model system for cutaneous wound-healing research. The Journal of Investigative Dermatology. 133 (6), 1655-1665 (2013).
- Erickson, J. R., Echeverri, K. Learning from regeneration research organisms: The circuitous road to scar free wound healing. Developmental Biology. 433 (2), 144-154 (2018).
- Kamran, Z., et al. In vivo imaging of epithelial wound healing in the cnidarian Clytia hemisphaerica demonstrates early evolution of purse string and cell crawling closure mechanisms. BMC Developmental Biology. 17 (1), 17(2017).
- Home. MARIMBA. , Available from: http://marimba.obs-vlfr.fr/home (2023).
- Chari, T., et al. Whole-animal multiplexed single-cell RNA-seq reveals transcriptional shifts across Clytia medusa cell types. Science Advances. 7 (48), (2021).
- Weissbourd, B., et al. A genetically tractable jellyfish model for systems and evolutionary neuroscience. Cell. 184 (24), 5854-5868 (2021).
- Momose, T., et al. High doses of CRISPR/Cas9 ribonucleoprotein efficiently induce gene knockout with low mosaicism in the hydrozoan Clytia hemisphaerica through microhomology-mediated deletion. Scientific Reports. 8 (1), 11734(2018).
- Houliston, E., Leclère, L., Munro, C., Copley, R. R., Momose, T. Past, present and future of Clytia hemisphaerica as a laboratory jellyfish. Current Topics in Developmental Biology. 147, 121-151 (2022).
- Schmid, V., et al. The extracellular matrix (mesoglea) of hydrozoan jellyfish and its ability to support cell adhesion and spreading. Hydrobiologia. 216 (1), 3-10 (1991).
- Day, R. M., Lenhoff, H. M. Hydra mesoglea: a model for investigating epithelial cell-basement membrane interactions. Science. 211 (4479), 291-294 (1981).
- Zhang, X., et al. The collagens of hydra provide insight into the evolution of metazoan extracellular matrices. The Journal of Biological Chemistry. 282 (9), 6792-6802 (2007).
- Danjo, Y., Gipson, I. K. Actin 'purse string' filaments are anchored by E-cadherin-mediated adherens junctions at the leading edge of the epithelial wound, providing coordinated cell movement. Journal of Cell Science. 111 (22), 3323-3332 (1998).
- Arenas Gómez, C. M., Sabin, K. Z., Echeverri, K. Wound healing across the animal kingdom: Crosstalk between the immune system and the extracellular matrix. Developmental Dynamics. 249 (7), 834-846 (2020).
- Lechable, M., et al. An improved whole life cycle culture protocol for the hydrozoan genetic model Clytia hemisphaerica. Biology Open. 9 (11), (2020).
- Casares, L., et al. Hydraulic fracture during epithelial stretching. Nature Materials. 14 (3), 343-351 (2015).
- Wayne, R. Chapter 4 - Bright-Field Microscopy. Light and Video Microscopy (Third Edition). , 95-116 (2019).
- Murphy, D. B., Davidson, M. W. Fundamentals of Light Microscopy and Electronic Imaging: Second Edition. , John Wiley and Sons. (2012).
- Micropipette Techniques for Electrophysiology. , Available from: https://www.sutter.com/micropipette/cookbook.html (2022).
- Brown, A. L., Johnson, B. E., Goodman, M. B. Making patch-pipettes and sharp electrodes with a programmable puller). Journal of Visualized Experiments. (20), e939(2008).
- Klarlund, J. K. Dual modes of motility at the leading edge of migrating epithelial cell sheets. Proceedings of the National Academy of Sciences. 109 (39), 15799-15804 (2012).
- Houliston, E., Momose, T., Manuel, M. Clytia hemisphaerica: a jellyfish cousin joins the laboratory. Trends in Genetics. 26 (4), 159-167 (2010).
- Rodrigues, M., Kosaric, N., Bonham, C. A., Gurtner, G. C. Wound healing: a cellular perspective. Physiological Reviews. 99 (1), 665-706 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유