Method Article
使用刺胞动物模式生物Clytia hemisphaerica表征体内上皮伤口愈合
摘要
本文描述了一种在活 的Clytia hemisphaerica medusa 的上皮中创建伤口的方法,并在 体内以高分辨率图像伤口愈合。此外,还提出了一种在伤口愈合过程中引入染料和药物来扰乱上皮细胞和细胞外基质中的信号传导过程的技术。
摘要
所有动物器官,从皮肤到眼睛再到肠道,都覆盖着上皮细胞片,使它们能够维持体内平衡,同时保护它们免受感染。因此,修复上皮伤口的能力对所有后生动物都至关重要也就不足为奇了。脊椎动物的上皮伤口愈合涉及重叠过程,包括炎症反应、血管形成和再上皮化。这些过程的调节涉及上皮细胞、邻近细胞和细胞外基质(ECM)之间的复杂相互作用;ECM 包含结构蛋白、调节蛋白和活性小分子。这种复杂性,加上大多数动物具有不透明的组织和难以接近的ECM的事实,使得在活体动物中难以研究伤口愈合。因此,许多关于上皮伤口愈合的工作是在组织培养系统中进行的,将单个上皮细胞类型作为单层接种在人工基质上。 Clytia hemisphaerica (Clytia)为这些研究提供了独特而令人兴奋的补充,允许在具有真实ECM的完整动物中研究上皮伤口愈合。Clytia 的外胚层上皮是单层大的鳞状上皮细胞,允许在活体动物中使用差分干扰对比 (DIC) 显微镜进行高分辨率成像。由于没有迁移性成纤维细胞、脉管系统或炎症反应,因此可以解剖 体内再上皮化的关键事件。可以分析各种类型的伤口的愈合,包括单细胞微伤口,大小上皮伤口以及损坏基底膜的伤口。板状伪足的形成、钱包收缩、细胞拉伸和细胞集体迁移都可以在这个系统中观察到。此外,可以通过ECM 引入 药理学试剂来改变 体内的细胞:ECM相互作用和细胞过程。这项工作展示了在活Clytia中制造伤口的方法,捕捉愈合电影,并通过将试剂微注射到ECM中来探索愈合机制。
引言
上皮细胞片覆盖所有后生动物的外表面,排列内部器官,并将动物身体分成离散的隔室。上皮还将内部身体与外部环境分开,并保护其免受损害和感染。因此,上皮层的出现是多细胞动物进化的重要组成部分,从脊椎动物到最基础的后生动物的所有动物都可以看到上皮层1。某些器官的上皮是单层的,例如肺气囊,血管和肠道2,以及无脊椎动物(如涡虫和刺胞动物3)的表皮中。在其他组织中,例如脊椎动物的皮肤4和角膜5,上皮是分层的,这意味着有多个上皮细胞层2。在所有情况下,最基底的上皮层附着在基底膜上,基底膜是形成细胞外基质(ECM)特殊区域的蛋白质片6,7,8。
必须迅速修复上皮的破损,以重建连续的上皮片。上皮损伤发生在自然过程中,例如肠道中上皮细胞的脱落,9,10以及炎症或身体创伤的结果。当单个上皮细胞受损时,它必须自我修复或消除,以使周围的细胞相互附着并关闭孔11,12。在大于单个细胞大小的伤口中,上皮细胞必须移动以相互接触并修复薄片13。如果间隙很小或可能需要上皮细胞从伤口边缘迁移以闭合伤口间隙,则可以通过细胞扩散来实现;后一个过程称为再上皮化14,15。在胚胎组织中,上皮细胞扩散并迁移到闭合伤口,或者通过伤口边缘细胞之间形成的肌动肌收缩素电缆的收缩穿过间隙,其机制类似于钱包串16。在许多成人组织中,再上皮化涉及相干细胞片的迁移,其中细胞与相邻细胞保持连接14,17,18。在其他组织中,细胞:细胞连接被拆除,上皮细胞的行为更像间充质细胞,在再上皮化过程中以协调但独立的方式移动到伤口区域14,19,20,21。
上皮细胞运动受迁移细胞之间以及细胞与ECM之间的复杂相互作用的调节。虽然有大量的实验文献涉及上皮细胞伤化和随后迁移的机制,但仍有许多有待发现。例如,激活上皮细胞迁移以响应伤口的初始信号尚未明确鉴定22,也没有完全理解肌动蛋白如何重新部署以在最靠近伤口的上皮细胞一侧产生板状伪足22,23,24,25,26,27.集体细胞迁移需要来自伤口细胞的信息与伤口远端的细胞共享,并且通信途径仍然不清楚28。细胞:细胞连接和细胞:ECM附件必须拆卸和重组,因为片中的细胞重新排列自身,但对这一过程的调节知之甚少14,29。在这些和其他相关问题上取得进展不仅作为一个基本的生物学问题很重要,而且还因为正确的伤口愈合的临床意义。损害上皮细胞正确迁移能力的疾病会导致慢性伤口;一个例子是遗传性疾病大疱性表皮松解症,其中参与上皮细胞附着在ECM上的基因发生突变,导致皮肤脆弱,剥落和起水泡。再上皮化在自然老化组织中也受到损害30,31。因此,更好的理解对于开发改善伤口愈合结果的干预措施至关重要。
伤口愈合中的上皮细胞迁移已使用体外方法和模式生物进行了研究。大多数关于伤口愈合和细胞迁移机制的研究都是在组织培养中进行的,其中单个上皮细胞类型的单层生长在替代ECM的基质上。将细胞单层划伤或用模板生长以产生特定形状和大小的间隙,然后观察32,33,34。体外模型允许细胞行为的理想可视化,以及改变底物质量的机会,将细胞暴露于药物和非生物和生物因子中,以及用表达或抑制各种目标基因的构建体转染细胞。然而,这种还原论方法可能无法捕获体内环境中上皮细胞行为所涉及的一些重要参数,包括各种细胞类型之间的通信和ECM11中发生的信号事件。体内模型提供了伤口的真实背景,具有多种细胞类型、重叠的信号通路和复杂的 ECM35。伤口愈合研究的一个这样的模型是小鼠19,其中最近的进展使研究人员能够在活体动物36的全层伤口愈合过程中观察表皮细胞。然而,小鼠和其他体内系统对研究再上皮化提出了挑战。首先,在自然环境中观察细胞行为的巨大优势与脊椎动物伤口愈合过程中发生的时间重叠事件的复杂性相平衡,包括血液凝固、免疫细胞募集和炎症、成纤维细胞募集以及细胞去分化、血运重建和 ECM 重塑。此外,不透明的组织使成像变得困难。果蝇幼虫和斑马鱼表皮系统37,38已经克服了其中一些困难,因为它们相对简单39。
我们的实验室最近推出了一种研究上皮伤口愈合的新模型:水生动物刺胞动物Clytia hemisphaerica(Clytia)的美杜莎(水母)形式40。Clytia 是一种新兴的模式生物,具有完全测序和注释的基因组41、单细胞 RNAseq 转录组42 和基因组修饰(诱变和转基因)方案 43,44,45。刺胞动物是现存最古老的具有上皮层的谱系之一,因此了解刺胞动物伤口愈合有助于深入了解确保上皮完整性的祖先途径。对于那些在整个生命之树中一直保存的途径,Clytia 提供了一个令人兴奋的新系统来研究上皮细胞动力学和体内伤口愈合的功能调节。
覆盖美杜莎(外伞)上表面的上皮是单层透明的鳞状上皮细胞,宽约50μm,厚1-2μm(图1)。它们附着在称为中胚层的ECM上 - 水母的"水母"。中胚层在成分上类似于在其他动物46,47,48(包括脊椎动物)中发现的ECM,具有基底膜40,并且完全透明。Clytia medusa的上皮层很容易被划伤或受伤(见下文)。上皮和ECM的简单性和透明度允许在愈合过程中对细胞及其运动进行高分辨率成像。最近,Kamran等人详细描述了Clytia上皮中小伤口的愈合40。研究表明,Clytia 的愈合是通过基于板状伪底的细胞爬行、细胞扩散和集体细胞迁移以及更典型的胚胎系统钱包串闭合来实现的(尽管以前在角膜49 等成年动物结构中见过)。Clytia 伤口愈合非常快,正如在其他缺乏炎症反应的系统中所看到的那样40,50.Clytia exumbrella的愈合完全取决于现有上皮细胞的运动 - 没有细胞增殖或通过ECM迁移到伤口部位(补充电影1)。所有这些发现都表明,Clytia是研究上皮伤口愈合的有用模型系统。事实上,在伤口愈合过程中对Clytia中上皮细胞进行成像的容易性导致发现,只要有完整的基底膜,上皮细胞板状伪足就会延伸并扩散到暴露的ECM区域;如果基底膜受损,上皮愈合切换到钱包串机制40。这是首次证明了通过基于板状伪足的爬行与钱包线闭合决定关闭的机制,强调了特定细胞:ECM相互作用在愈合和观察细胞自然环境中的重要性。
下面描述了用于创建和成像单细胞微伤口、主要通过细胞扩散闭合的小伤口以及需要集体细胞迁移才能闭合的大伤口的协议。此外,描述了将小分子引入ECM和上皮细胞的方案,允许对伤口愈合的假定调节途径进行实验扰动。
研究方案
1. 动物养殖
- 在斑马鱼系统中,在显微镜载玻片上保持Clytia 息肉菌落和人工海水(ASW)中的水母细胞菌落,使用2 L斑马鱼罐用于息肉菌落,为水母科定制5 L伪kreisel水箱(补充图1)51。ASW由4%的去离子(DI)H2O速溶海洋组成。
- 每天用2-3天大的卤虫喂养动物,如所述51。
注意:如果动物最近没有喂食,伤口愈合成像更容易,因为从肠道释放到视野中的碎片较少。 - 根据需要从已建立的息肉菌落中收集婴儿水母,将菌落放入装有 1 L ASW 的 2 L 烧杯中过夜。使用2-3周龄的女性水母进行所有伤口愈合实验。Clytia的繁殖已在别处详细描述51。
2. 伤人
- 在细胞内和细胞之间产生微伤口(20-500μm2)
- 通过用剪刀剪开吸头以形成更大的开口(直径0.5-0.7厘米)来创建改进的转移移液器。
注意:移液器中的开口应足够宽,以避免对动物造成任何伤害。 - 使用改进的转移移液管,将美杜莎放在凹陷滑轨上,美杜莎伞朝上,用刚好足够的ASW覆盖动物。
- 立即将盖玻片放在动物和图像上(有关成像的说明,请参见下文)。盖玻片压缩中胚层,压缩组织的反弹产生一种力,将细胞稍微推开52。这立即表现为每个细胞之间的间隙和某些细胞内的损伤(图1B,B',图2和图3A-C)。
- 通过用剪刀剪开吸头以形成更大的开口(直径0.5-0.7厘米)来创建改进的转移移液器。
- 产生小的上皮伤口(0.02-0.125毫米2)
- 使用改进的移液管(如上所述),将美杜莎放在凹陷滑轨上,美杜莎伞朝上。
- 使用 200 μL 移液器吸头,轻轻刮擦美杜莎表面。轻柔的刮擦也会在基底膜上产生裂口,这是显而易见的22。用盖玻片覆盖动物进行成像。或者,即使没有刮擦,盖玻片的位置有时也足以产生小的上皮伤口(图1C,C',图2和图3A-C)。
注意:抓挠美杜莎表面时不要按下,因为这会损坏ECM并产生不规则的表面 - 在不规则表面上迁移的上皮细胞更难保持焦点。
- 造成大的上皮伤口(0.5-0.9毫米2)
- 使用微量移液器拉拔器和玻璃毛细管制作显微注射针(步骤5.2)。将空的显微注射针放入固定在显微操纵器的显微注射器支架中。切针尖,使开口约为20-40μm。
注意:用于大上皮伤口的切割针可以存储和重复使用,以提高实验之间的一致性。 - 将微量注射器上的保持压力设置为零,并将喷射压力设置为大约 20 PSI。设置显微注射器以提供 2 秒的空气脉冲。
注意:喷射压力可能需要根据针口的直径进行调整(即,较小的尖端将使用较高的压力,而较大的尖端将使用较低的压力)。 - 将美杜莎与伞朝上放在解剖镜的凹陷滑梯上,用刚好足够的反潜战覆盖动物。使用显微操纵器,调整显微注射针尖,使其刚好在水面上方。为此,请小心地将吸头浸入水中(水可能会进入移液器吸头),然后将其缩回,使其靠近美杜莎的上皮表面。
注意:尖端应位于美杜莎的一个象限上。美杜莎的放射管将美杜莎钟分为四个不同的象限。靶向象限将导致更清晰的成像,因为性腺和桡骨管被排除在伤口区域之外。 - 通过按下喷油器上的启动来脉冲空气。在同一点重复脉冲两到四次,具体取决于尖端的宽度。吸头越大,脉冲越少。
注意:水/美杜莎中由空气脉冲引起的压痕应该是可见的。 - 用盖玻片覆盖受伤的动物,用于成像大伤口(图1D,D')。
- 请按照以下步骤(第 3 节)对上皮伤口愈合进行成像。
- 使用微量移液器拉拔器和玻璃毛细管制作显微注射针(步骤5.2)。将空的显微注射针放入固定在显微操纵器的显微注射器支架中。切针尖,使开口约为20-40μm。
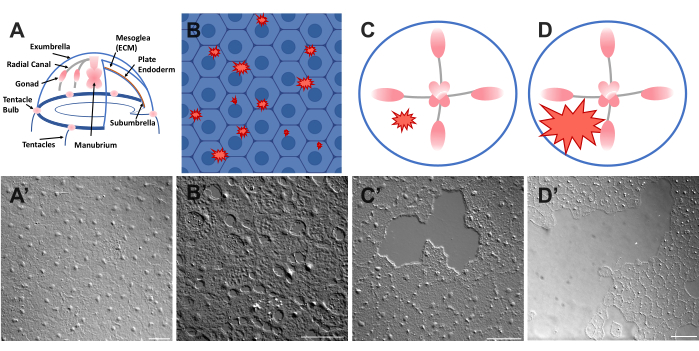
图1:Clytia medusa中完整和受伤的伞状上皮层。(A)Clytia Medusa身体的卡通图形。(A')从上面看完整的美杜莎伞上皮。(B)带有蓝色上皮细胞的单细胞微伤口(红色锯齿状)的卡通。(二) 单细胞微伤口。(C)小上皮伤口(红色锯齿状)的卡通。(C') 小上皮伤口。(D)大上皮伤口(红色锯齿状)的卡通。(D') 大上皮伤口。图像均使用DIC显微镜获得。比例尺 (A'-C'):50 μm。比例尺 (D'): 100 μm. 请点击此处查看此图的大图。
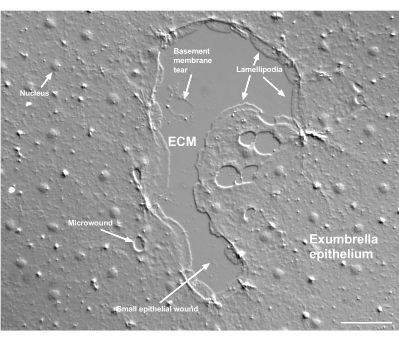
图 2:多种尺寸的伤口和受损的基底膜。 图中显示了典型的小的伞状上皮伤口,标签表明由边缘细胞形成的板状伪足。此外,还可见上皮细胞内和之间的微伤口。注意伤口上部的小基底膜撕裂。 电影4 显示了这个伤口的愈合。比例尺:50 μm。 请点击此处查看此图的大图。
3. 影像学上皮伤口愈合
- 确保显微镜已针对科勒照明53对准,并且已正确设置为微分干涉对比(DIC)显微镜54。上皮细胞在标准光学器件中几乎不可见(图3D,E)。
- 将焦点调整到伞形。虽然这是一层薄薄的,但六角形细胞应该是透明的。
注意:伞和副伞由由垂直纤维支撑的厚中胚层隔开。伞下细胞与桡管位于同一焦平面上。如果最初聚焦在伞下层,则通过中胚层和垂直纤维缓慢调整焦点,直到找到伞下层。 - 手动识别伤口以进行成像。对于大伤口,请使用10倍物镜。对于较小的伤口和单细胞伤口,请使用20倍物镜。
- 启动一个程序,该程序将图像实时收集为电影或定期收集一系列图像。监测进展,以确保伤口区域不会偏离视野,并且感兴趣的细胞保持聚焦。
- 单细胞伤口在一分钟内闭合;因此,用电影来想象他们的结尾。
- 为了捕获小伤口的细胞动力学细节,大约每10秒收集一次图像。小伤口的闭合需要20-50分钟,具体取决于大小。
- 不要对未密封的载玻片成像超过45分钟,因为随着时间的推移,载玻片中的水分蒸发会导致动物死亡和细胞破裂。
- 为了进行更长时间的观察,用凡士林密封盖玻片周围以减少蒸发。
注意:某些美杜莎可能会在载玻片上脉冲,这会干扰成像。在这种情况下,将动物安装在 ASW 中调节至 pH 7.5 的 1% 3-氨基苯甲酸乙酯(Tricaine)的 1:10 稀释液中可作为有效的麻醉剂,并且在 1 小时内对愈合没有明显影响。然而,如果在特里卡因中放置几个小时,这些动物会死亡。

图 3:在伞外上皮上形成一个小伤口。(A) 用 200 μL 移液器吸头轻轻刮擦伞,以形成小的上皮伤口。 (B) 放置盖玻片有时足以形成小的上皮伤口。 (C) 美杜莎安装在凹陷滑梯上。 (D ) 没有DIC光学元件的小上皮伤口图像和 (E) 有DIC光学元件。比例尺: 50 μm 请点击此处查看此图的大图。
4. 分析
- 准备图像文件
注意:要处理图像文件,请使用FIJI/ImageJ和更新的BioFormat插件。- 在注册图像堆栈之前,将比例设置为正确的每微米像素比例; 分析>设置比例。这对于在下游分析中提取实际尺寸测量值是必需的。
- 通常,动物在显微镜载玻片上略微漂移;因此,为了消除电影中的漂移,请使用FIJI插件线性堆栈对齐和SIFT注册图像。 插件>使用 SIFT 注册>线性堆栈对齐。
- 将注册的堆栈另存为.avi文件。 文件>另存为> AVI... 在弹出窗口中,设置帧速率(此处的动画图形设置为 10 fps),然后单击 确定。使用此输出执行伤口愈合分析。
- 伤口面积分析
- 使用FIJI/ImageJ中的套索工具,通过描摹细胞边缘来勾勒伤口。测量刚刚用 Command +M 或 CTRL+M 勾勒出的伤口区域。
- 每10帧重复一次伤口面积测量。然后可以使用棱镜9绘制来自FIJI/ImageJ的测量值(图4)。
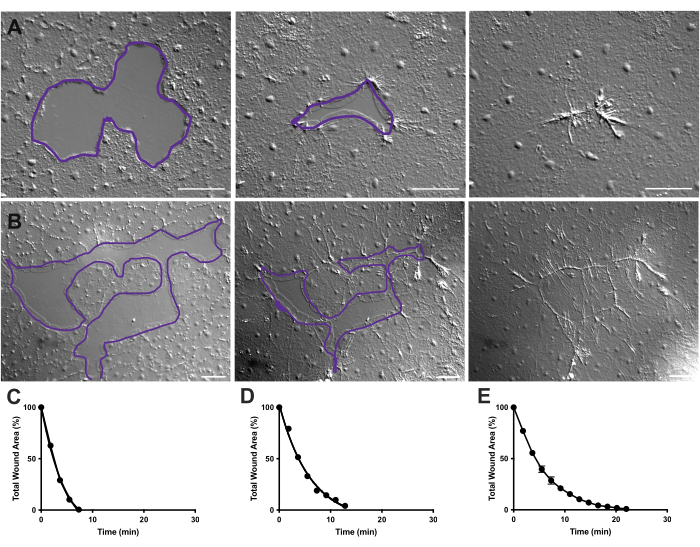
图4:小上皮伤口的伤口面积分析。(A)小上皮伤口在10分钟内愈合的例子。 (B)不同的上皮伤口在21分钟内愈合的例子。A,B中的紫色轮廓与FIJI/ImageJ中使用套索工具测量伤口区域相当。(C)随着时间的推移,A中伤口面积的正常化减少。(D)B中伤口面积随时间的标准化减少。(E)14个小伤口随着时间的推移平均减少伤口面积。n = 14。误差线以平均± SEM 为中心。 比例尺: 50 μm 请点击此处查看此图的大图。
5. 中胚层注射
- 制作注射皿
- 通过将PDMS碱和固化剂以10份碱与1份固化剂重量的比例制备聚二甲基硅氧烷(PDMS)。剧烈搅拌,使基碱和固化剂充分混合。
- 要去除气泡,请将混合物放入真空室中15分钟。将混合物倒入带有微量离心管盖的60mm培养皿中,以将模具固定到位。立即将模具以 45° 倾斜度放在管帽上,并用胶带固定到位。模具是三个堆叠的胶印载玻片,粘在一起,在最终的注射皿中形成脊。
- 将整个培养皿,模具和混合物放入60°C的烤箱中2小时以固化弹性体。取出模具以获得完成的注射盘。
- 微量移液器拉拔
- 使用微电极拉拔器,设计一个拉拔程序。使用高速的一步程序。所述热量约为玻璃RAMP测试结果55,56。检查所得微量移液器是否具有长一致的锥度。
注意:使用外径为 1.0 毫米、内径为 0.75 毫米、长度为 10 厘米的薄壁玻璃硼硅酸盐毛细管。
- 使用微电极拉拔器,设计一个拉拔程序。使用高速的一步程序。所述热量约为玻璃RAMP测试结果55,56。检查所得微量移液器是否具有长一致的锥度。
- 注射染料和药物
- 制作显微注射针(如上所述)。
- 使用长移液器尖端回填显微注射针头,将过量的染料或药物注射到美杜莎中。
注意:对于Clytia, 二甲基亚砜(DMSO)应用ASW保持在<1:100稀释度,因为较高的DMSO浓度会阻碍伤口愈合。如果注入澄清溶液,可以添加固绿FCF溶液(ASW中0.1%固绿FCF的1:100稀释)以可视化注入的液体。 - 使用如上所述的改进的转移移液管,将水母与副伞朝上放入PDMS注射盘中,其ASW刚好足以覆盖动物(图5C)。将培养皿放在解剖镜的舞台上。
注意:限制过量的ASW可以防止美杜莎在培养皿中游泳,并允许更成功的注射。 - 专注于显微注射针尖,并将其推进到美杜莎附近的水中。使用显微操纵器将针头压入培养皿中,直到其弯曲并断裂。该尖端开口约为10-20μm。
注意:此针头可重复用于当天的相同染料/药物注射。建议每天使用新鲜的吸头,并用于单独的染料/药物。 - 使用显微操纵器,将针尖通过副伞插入中胚层,而无需刺穿伞。
注意:上皮的折痕/折叠将很明显。一旦将针插入美杜莎,折痕/折叠就会停止。 - 在微量注射器上,将保压压力设置为零,将喷射压力设置为 ≤20 PSI。注射到一个或两个象限中,在每个象限中填充大约该象限面积的 1/4 的染料或药物点。
注意:根据美杜莎的大小,较大或较小的体积适合单次注射点。过度填充美杜莎会导致上皮极度受损,甚至动物死亡。 - 根据注射的染料或药物,将动物放入新鲜ASW烧杯中,以允许染料或药物扩散和孵育。
- 为了成像,使用改进的移液管将美杜莎安装到凹陷载玻片上,将动物定位,使伞朝上(图5)。在这个阶段可以伤害动物以测试注射试剂的效果。
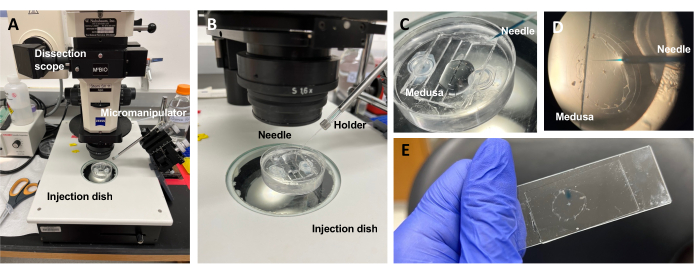
图 5:用于将染料或药物引入 ECM 的进样设置。(A) 注射设置。( B) 注射装置的特写,显示显微注射针的方向(相对于培养皿中的动物约45°角)。 (C) 硅胶注射盘与美杜莎在少量ASW注射中的特写。 (D) 装有快速绿色FCF的显微注射针通过亚伞进入美杜莎的中胚层。 (E) 在安装的美杜莎中注射后快速绿色FCF。 请点击此处查看此图的大图。
结果
按照上述方案,对单细胞微伤口、小伤口和大伤口进行成像。已注册的图像文件堆栈已另存为.avi文件。
在视频1中,可以看到细胞之间和细胞内的微伤口闭合(图1 和 图2)。在闭合过程中观察到小板状伪足,然后收缩和愈合。碎片被排除并释放到水中。愈合在一分钟或更短的时间内完成。
在电影2和3中,不同形状的小伤口通过板状伪足的形成,层状接触的延伸和伤口边缘细胞的扩散而愈合,如前所述40 (图1 和 图2)。边缘细胞后面的细胞不参与这种大小的伤口的愈合,也没有集体细胞迁移。上皮间隙的快速和渐进闭合之后是沿着新形成的伤口接缝40的组织收缩。显示了这两个伤口的标准化愈合率,表示为随着时间的推移原始区域的百分比(图4C,D)。虽然伤口闭合的动力学存在一些变化,但平均14个不同形状的伤口的闭合百分比,范围从0.02-0.125 mm2 ,可以建立未经治疗的动物伤口愈合的平均曲线(图4E)。
基底膜的损伤在发生时可以清楚地看到(图2)。在 电影4中,小伤口边缘的细胞在损伤区域周围扩散,并且间隙闭合通过钱包线收缩完成。
如果组织脱水或受损太严重而无法修复,细胞运动可能会停止,或者整个细胞片可能会破裂(视频5 和 视频6)。这通常发生在长时间成像(45分钟或更长时间)后。如果在成像早期发生细胞破裂,则丢弃样品。
如 电影7所示,大伤口分几个阶段愈合。首先,由于边缘收缩,伤口边缘变得光滑和规则,如先前报道的那样57。然后,可以看到板状伪足从伤口边缘的细胞形成,板状伪足向前移动以最大限度地与相邻的板状足接触。对伤口边缘和边缘细胞后面几层细胞中的细胞核的跟踪表明,大间隙通过集体细胞迁移关闭40。细胞永远不会分离,而是作为一张纸一起移动。
染料和药理学试剂的引入可以成为剖析生物机制的有力工具。许多物质被排除在Clytia之外(未显示),可能是因为粘液层覆盖在动物表面。然而,显微注射可用于将分子直接引入ECM,破坏ECM结构或扰乱ECM中的调节活动。此外,染料和其他分子能够从基底侧进入上皮细胞。例如, 图6 显示了用Hoechst进行核染色,用FM1-43进行膜染色,以及将这些试剂显微注射到ECM后细胞松弛素B对板状伪足形成的抑制。在受伤前将这些分子引入ECM和上皮细胞允许测试药理学工具对愈合过程影响的实验。
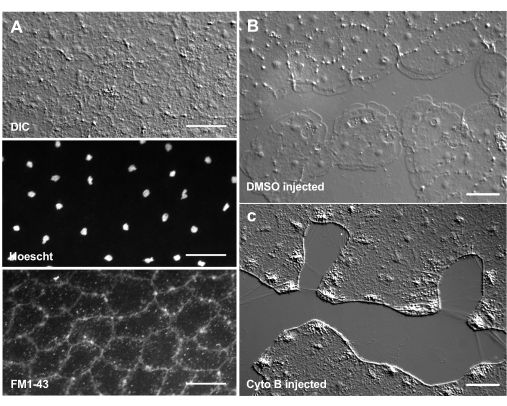
图6:显微注射染料或药理剂后美杜莎的上皮细胞。(A) 用20μM Hoechst(细胞核)和50μM FM1-43(膜)注射后5分钟在顶部图中显示的上皮细胞。(乙,丙) 注射后伤口愈合与1:1,000 DMSO对照 (B) 或100μM细胞松弛素B (C)。注射后15分钟伤口。图像在受伤后5分钟拍摄。板状伪足的形成被细胞松弛素B抑制。伤口区域细胞之间经常看到的明显"纤维"被认为是张力拉伸基底膜的结果 - 它们不会用鬼笔环肽染色(未显示)。比例尺:50 μm。 请点击此处查看此图的大图。
电影1:单细胞微伤口愈合的延时电影。经过时间:20 秒。帧速率:10 帧/秒。比例尺:50 μm。 请点击这里下载此影片。
电影2:一个小上皮伤口愈合的延时电影。经过的时间:9分54秒。帧速率:10 帧/秒。比例尺:50 μm。 请点击这里下载此影片。
电影3:一个小上皮伤口愈合的延时电影。这个伤口比电影2中的伤口更大,形状更不规则。经过的时间:20分54秒。帧速率:10 帧/秒。比例尺:50 μm。 请点击这里下载此影片。
电影4:延时电影,一个小伤口和一个微伤口愈合与地下室膜撕裂。 板状伪足在基底膜撕裂周围扩散,尽管它们可以在ECM的其余部分推进。一旦有基底膜损伤的伤口区域被包围,钱包线收缩将细胞拉过该区域。经过时间:19 分 4 秒。帧速率:10 帧/秒。比例尺:50 μm。 请点击这里下载此影片。
电影5:细胞在一个小的上皮伤口中死亡。 细胞死亡可能是由于动物脱水。经过时间:4分24秒。帧速率:10 帧/秒。比例尺:100 μm。 请点击这里下载此影片。
电影6:一个小的上皮伤口无法完全愈合。 经过时间:42分32秒。帧速率:10 帧/秒。比例尺:50 μm。 请点击这里下载此影片。
电影7:大上皮伤口愈合。 经过时间:25 分 29 秒。帧速率:10 帧/秒。比例尺:100 μm。 请点击这里下载此影片。
补充图1:Clytia储罐尺寸示意图。 定制Clytia坦克的3D可视化。 (A) 正面和背面视图。 (B) 侧视图。绿色作品中的切口覆盖着尼龙网布。水直接通过网格进入水箱,扫过网格并产生圆形电流。水通过蓝色所示的端件上的孔排出系统。请点击此处下载此文件。
补充电影1:Clytia中的无细胞细胞外基质。 使用共聚焦显微镜拍摄的Clytia的Z堆栈。堆栈最初聚焦在外伞上,然后每 10 μm 通过 ECM 扫描一次到板内胚层和亚伞。使用DIC(左)和Hoechst核染色(右)的图像表明ECM中缺乏细胞。比例尺:100 μm。 请点击这里下载此文件。
讨论
在这里,介绍了在Clytia(一种相对较新的无脊椎动物模式生物40,43,58)体内伤口成像的方法。有几个因素使该系统成为独特而强大的研究工具,不同于用于研究伤口愈合和再上皮化的其他模型。首先,单层上皮附着在透明的ECM上,因此类似于体外组织培养测定(图1,图2,图3,图4)。 与体外测定一样,细胞可以以高分辨率成像。然而,与组织培养不同,存在真实的细胞环境和ECM,因此可以在活体受伤动物中发生的复杂信号事件的背景下查看伤口愈合。其次,Clytia 缺乏炎症反应、迁移性成纤维细胞、脉管系统和血液。这允许在体内研究再上皮化过程,而伤口愈合期间没有更复杂的成年动物中发生的重叠事件59。第三,ECM是无细胞的(补充电影1)并且很大,可以用显微注射针轻松访问(图5和图6)。使用这种方法,研究人员可以测试扰乱ECM结构或信号传导的药理学试剂对体内伤口愈合的影响。试剂也可以引入上皮细胞,并且可以评估它们对体内伤口愈合的影响。第四,存在在Clytia系统中产生突变体和转基因动物的协议42,43,44,45。因此,可以在目标基因表达增加/减少的动物中观察到体内伤口愈合。
该技术有几个关键步骤。首先,如图 3所示,有必要使用正确配置用于DIC显微镜的显微镜,因为标准光学显微镜几乎看不到扁平透明的上皮细胞。同样重要的是发展轻轻缠绕动物的技能,以便在不刨ECM的情况下损坏上皮。将材料微注射到ECM中需要同样温和的触摸,因为在注射过程中对动物的广泛损害可能会影响随后的伤口愈合分析。虽然这些技术有一个学习曲线,但即使是初学者也可以在Malamy实验室中快速掌握它们。事实上,这些协议已被用于证明芝加哥大学本科实验室课程中的细胞迁移。
为了获得最佳成像,重要的是动物不要移动,并且选择的伤口区域不会漂移出视野。如果动物出现脉动,如上所述用三卡因治疗非常有效。对于漂移,通常需要手动重新定位样品。这些移动可以使用FIJI/ImageJ中的配准功能从最终电影中消除。
该系统的一个限制是不可能产生相同的伤口,因为使用此处描述的方法伤口的形状和大小各不相同。因此,很难定量伤口闭合或细胞迁移的确切速率。位置标记物(如碳粒)粘附在受伤动物暴露的ECM上,可用于测量大伤口中的集体细胞迁移速率(未显示)。对于小伤口闭合分析,即使伤口大小和形状不同,这种大小的伤口的闭合率范围也有限(图4)。因此,可以定量检测促动机或抑制性药理试剂的效果。
虽然这项工作描述了仅使用DIC显微镜对伤口愈合的表征,但相同的方法可用于使用荧光或共聚焦显微镜对愈合进行成像。为了帮助实现这一目标,已经制定了生成转基因动物的方案,其中各种细胞和细胞外蛋白被荧光标记。DIC和荧光的同步成像,结合使用药物或突变系对伤口愈合的扰动,将是理解上皮伤口愈合过程基础机制的有力方法。
披露声明
没什么可透露的。
致谢
E.E.L.L.得到了美国国家科学基金会PRFB 2011010的资助。我们要感谢Tsuyoshi Momose和Evelyn Houliston帮助我们建立Clytia殖民地,感谢Jean-Baptiste Reynier收集微伤口愈合图像,Harry Kyriazes建造伪kreisel坦克,以及Elizabeth Baldo维护Clytia栖息地。图 1B 是用 BioRender.com 创建的。
材料
| Name | Company | Catalog Number | Comments |
| 20500 ACE EKE Microscope Fiber Optic Light Source | Kramer Scientific Corporation | ||
| AxioCam 506 mono | ZEISS | 426557-0000-000-MA285 | |
| Capillary tubes | World Precision Instruments | TW1004 | |
| Cytochalasin B | Abcam | ab143482 | |
| Depression slides | Amscope | BS-C12 | |
| DMR with DIC options and fluorescence halogen lamp | Leica | ||
| Ethyl 3-aminobenzoate methanesulfonate | Sigma Aldrich | E10521-10G | |
| Fast Green FCF | Thermo Scientific | A16520-06 | |
| FM1-43 | Biotium | 70022 | Excitation/Emission: 480/598 nm |
| Hoechst 33342 | Thermo Scientific | 62249 | Excitation/Emission: 361/497 nm |
| imageJ | NIH | ||
| Microloader tips (0.5-10 μL /2-20 μL) | Eppendorf | 930001007 | |
| Micromanipulator | World Precision Instruments | 3301R / M3301L | |
| Microscope Cover Glass (22X40-1.5) | Fisherbrand | 12-544-BP | |
| Petri Dish (60 mm x 15 mm) | Fisherbrand | FB085713A | |
| PicoNozzle v2 | World Precision Instruments | 5430-ALL | |
| Pipette puller | Sutter Instrument Co | P-97 | |
| Pneumatic PicoPump | World Precision Instruments | PV820 | |
| Polycarbonate vacuum, desiccator | Bel-art | F42025-0000 | |
| Prism 9 | GraphPad | ||
| STEMI Sv11 Dissection scope | ZEISS | STEMI SV11 | |
| SYLGARD 184 | Dow Silicones | 1024001 | |
| Transfer pipettes | Fisherbrand | 13-711-7M | |
| Z-Hab mini system | Pentair | ||
| ZEN Microscopy software | Zeiss |
参考文献
- Tyler, S. Epithelium-the primary building block for metazoan complexity. Integrative and Comparative Biology. 43 (1), 55-63 (2003).
- Kurn, H., Daly, D. T. Histology, Epithelial Cell. StatPearls. , (2022).
- Schempp, C., Emde, M., Wölfle, U. Dermatology in the Darwin anniversary. Part 1: Evolution of the integument. Journal of the German Society of Dermatology. 7 (9), 750-757 (2009).
- Lopez-Ojeda, W., Pandey, A., Alhajj, M., Oakley, A. M. Anatomy, Skin (Integument). StatPearls. , (2022).
- Bukowiecki, A., Hos, D., Cursiefen, C., Eming, S. A. Wound-healing studies in cornea and skin: parallels, differences and opportunities. International Journal of Molecular Sciences. 18 (6), 1257(2017).
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. Journal of Cell Science. 123 (24), 4195-4200 (2010).
- Hynes, R. O. The evolution of metazoan extracellular matrix. The Journal of Cell Biology. 196 (6), 671-679 (2012).
- Fidler, A. L., et al. Collagen IV and basement membrane at the evolutionary dawn of metazoan tissues. eLife. 6, 24176(2017).
- Bullen, T. F., et al. Characterization of epithelial cell shedding from human small intestine. Laboratory Investigation; a Journal of Technical Methods and Pathology. 86 (10), 1052-1063 (2006).
- Watson, A. J. M., et al. Epithelial barrier function in vivo is sustained despite gaps in epithelial layers. Gastroenterology. 129 (3), 902-912 (2005).
- Sonnemann, K. J., Bement, W. M. Wound repair: toward understanding and integration of single-cell and multicellular wound responses. Annual Review of Cell and Developmental Biology. 27, 237-263 (2011).
- Abreu-Blanco, M. T., Verboon, J. M., Parkhurst, S. M. Single cell wound repair. BioArchitecture. 1 (3), 114-121 (2011).
- Fenteany, G., Janmey, P. A., Stossel, T. P. Signaling pathways and cell mechanics involved in wound closure by epithelial cell sheets. Current Biology. 10 (14), 831-838 (2000).
- Pastar, I., et al. Epithelialization in wound healing: a comprehensive review. Advances in Wound Care. 3 (7), 445-464 (2014).
- Rousselle, P., Braye, F., Dayan, G. Re-epithelialization of adult skin wounds: Cellular mechanisms and therapeutic strategies. Advanced Drug Delivery Reviews. 146, 344-365 (2019).
- Bement, W. M., Forscher, P., Mooseker, M. S. A novel cytoskeletal structure involved in purse string wound closure and cell polarity maintenance. The Journal of Cell Biology. 121 (3), 565-578 (1993).
- Vedula, S. R. K., Ravasio, A., Lim, C. T., Ladoux, B. Collective Cell migration: a mechanistic perspective. Physiology. 28 (6), 370-379 (2013).
- Li, L., He, Y., Zhao, M., Jiang, J. Collective cell migration: Implications for wound healing and cancer invasion. Burns & Trauma. 1 (1), 21-26 (2015).
- Bornes, L., Windoffer, R., Leube, R. E., Morgner, J., van Rheenen, J. Scratch-induced partial skin wounds re-epithelialize by sheets of independently migrating keratinocytes. Life Science Alliance. 4 (1), 202000765(2021).
- Theveneau, E., Mayor, R. Collective cell migration of epithelial and mesenchymal cells. Cellular and Molecular Life Sciences. 70 (19), 3481-3492 (2013).
- Haensel, D., Dai, X. Epithelial-to-mesenchymal transition in cutaneous wound healing: where we are and where we are heading. Developmental Dynamics. 247 (3), 473-480 (2018).
- Cordeiro, J. V., Jacinto, A. The role of transcription-independent damage signals in the initiation of epithelial wound healing. Nature Reviews. Molecular Cell Biology. 14 (4), 249-262 (2013).
- Abreu-Blanco, M. T., Watts, J. J., Verboon, J. M., Parkhurst, S. M. Cytoskeleton responses in wound repair. Cellular and Molecular Life Sciences. 69 (15), 2469-2483 (2012).
- Klarlund, J. K., Block, E. R. Free edges in epithelia as cues for motility. Cell Adhesion & Migration. 5 (2), 106-110 (2011).
- Enyedi, B., Niethammer, P. Mechanisms of epithelial wound detection. Trends in Cell Biology. 25 (7), 398-407 (2015).
- Niethammer, P. The early wound signals. Current Opinion in Genetics & Development. 40, 17-22 (2016).
- Jacinto, A., Martinez-Arias, A., Martin, P. Mechanisms of epithelial fusion and repair. Nature Cell Biology. 3 (5), 117-123 (2001).
- Mayor, R., Etienne-Manneville, S. The front and rear of collective cell migration. Nature reviews. Molecular Cell Biology. 17 (2), 97-109 (2016).
- Gupta, S., Yap, A. S. How adherens junctions move cells during collective migration. Faculty Reviews. 10, 56(2021).
- Blair, M. J., Jones, J. D., Woessner, A. E., Quinn, K. P. Skin structure-function relationships and the wound healing response to intrinsic aging. Advances in Wound Care. 9 (3), 127-143 (2020).
- Falanga, V., et al. Chronic wounds. Nature Reviews. Disease Primers. 8 (1), 50(2022).
- Liang, C. -C., Park, A. Y., Guan, J. -L. In vitro scratch assay: a convenient and inexpensive method for analysis of cell migration in vitro. Nature Protocols. 2 (2), 329-333 (2007).
- Jonkman, J. E. N., et al. An introduction to the wound healing assay using live-cell microscopy. Cell Adhesion & Migration. 8 (5), 440-451 (2014).
- Poujade, M., et al. Collective migration of an epithelial monolayer in response to a model wound. Proceedings of the National Academy of Sciences. 104 (41), 15988-15993 (2007).
- Masson-Meyers, D. S., et al. Experimental models and methods for cutaneous wound healing assessment. International Journal of Experimental Pathology. 101 (1-2), 21-37 (2020).
- Park, S., et al. Tissue-scale coordination of cellular behaviour promotes epidermal wound repair in live mice. Nature Cell Biology. 19 (2), 155-163 (2017).
- Tsai, C. -R., Wang, Y., Galko, M. J. Crawling wounded: molecular genetic insights into wound healing from Drosophila larvae. The International Journal of Developmental Biology. 62 (6-7-8), 479-489 (2018).
- Richardson, R., et al. Adult zebrafish as a model system for cutaneous wound-healing research. The Journal of Investigative Dermatology. 133 (6), 1655-1665 (2013).
- Erickson, J. R., Echeverri, K. Learning from regeneration research organisms: The circuitous road to scar free wound healing. Developmental Biology. 433 (2), 144-154 (2018).
- Kamran, Z., et al. In vivo imaging of epithelial wound healing in the cnidarian Clytia hemisphaerica demonstrates early evolution of purse string and cell crawling closure mechanisms. BMC Developmental Biology. 17 (1), 17(2017).
- Home. MARIMBA. , Available from: http://marimba.obs-vlfr.fr/home (2023).
- Chari, T., et al. Whole-animal multiplexed single-cell RNA-seq reveals transcriptional shifts across Clytia medusa cell types. Science Advances. 7 (48), (2021).
- Weissbourd, B., et al. A genetically tractable jellyfish model for systems and evolutionary neuroscience. Cell. 184 (24), 5854-5868 (2021).
- Momose, T., et al. High doses of CRISPR/Cas9 ribonucleoprotein efficiently induce gene knockout with low mosaicism in the hydrozoan Clytia hemisphaerica through microhomology-mediated deletion. Scientific Reports. 8 (1), 11734(2018).
- Houliston, E., Leclère, L., Munro, C., Copley, R. R., Momose, T. Past, present and future of Clytia hemisphaerica as a laboratory jellyfish. Current Topics in Developmental Biology. 147, 121-151 (2022).
- Schmid, V., et al. The extracellular matrix (mesoglea) of hydrozoan jellyfish and its ability to support cell adhesion and spreading. Hydrobiologia. 216 (1), 3-10 (1991).
- Day, R. M., Lenhoff, H. M. Hydra mesoglea: a model for investigating epithelial cell-basement membrane interactions. Science. 211 (4479), 291-294 (1981).
- Zhang, X., et al. The collagens of hydra provide insight into the evolution of metazoan extracellular matrices. The Journal of Biological Chemistry. 282 (9), 6792-6802 (2007).
- Danjo, Y., Gipson, I. K. Actin 'purse string' filaments are anchored by E-cadherin-mediated adherens junctions at the leading edge of the epithelial wound, providing coordinated cell movement. Journal of Cell Science. 111 (22), 3323-3332 (1998).
- Arenas Gómez, C. M., Sabin, K. Z., Echeverri, K. Wound healing across the animal kingdom: Crosstalk between the immune system and the extracellular matrix. Developmental Dynamics. 249 (7), 834-846 (2020).
- Lechable, M., et al. An improved whole life cycle culture protocol for the hydrozoan genetic model Clytia hemisphaerica. Biology Open. 9 (11), (2020).
- Casares, L., et al. Hydraulic fracture during epithelial stretching. Nature Materials. 14 (3), 343-351 (2015).
- Wayne, R. Chapter 4 - Bright-Field Microscopy. Light and Video Microscopy (Third Edition). , 95-116 (2019).
- Murphy, D. B., Davidson, M. W. Fundamentals of Light Microscopy and Electronic Imaging: Second Edition. , John Wiley and Sons. (2012).
- Micropipette Techniques for Electrophysiology. , Available from: https://www.sutter.com/micropipette/cookbook.html (2022).
- Brown, A. L., Johnson, B. E., Goodman, M. B. Making patch-pipettes and sharp electrodes with a programmable puller). Journal of Visualized Experiments. (20), e939(2008).
- Klarlund, J. K. Dual modes of motility at the leading edge of migrating epithelial cell sheets. Proceedings of the National Academy of Sciences. 109 (39), 15799-15804 (2012).
- Houliston, E., Momose, T., Manuel, M. Clytia hemisphaerica: a jellyfish cousin joins the laboratory. Trends in Genetics. 26 (4), 159-167 (2010).
- Rodrigues, M., Kosaric, N., Bonham, C. A., Gurtner, G. C. Wound healing: a cellular perspective. Physiological Reviews. 99 (1), 665-706 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。