Method Article
Caracterización de la cicatrización de heridas epiteliales in vivo utilizando el organismo modelo cnidario Clytia hemisphaerica
En este artículo
Resumen
Este artículo describe un método para crear heridas en el epitelio de una Clytia hemisphaerica medusa viva e imágenes de cicatrización de heridas a alta resolución in vivo. Además, se presenta una técnica para introducir colorantes y fármacos para perturbar los procesos de señalización en las células epiteliales y la matriz extracelular durante la cicatrización de heridas.
Resumen
Todos los órganos animales, desde la piel hasta los ojos y los intestinos, están cubiertos con láminas de células epiteliales que les permiten mantener la homeostasis mientras los protegen de la infección. Por lo tanto, no es sorprendente que la capacidad de reparar heridas epiteliales sea crítica para todos los metazoos. La cicatrización de heridas epiteliales en vertebrados implica procesos superpuestos, incluidas las respuestas inflamatorias, la vascularización y la reepitelización. La regulación de estos procesos implica interacciones complejas entre las células epiteliales, las células vecinas y la matriz extracelular (ECM); la ECM contiene proteínas estructurales, proteínas reguladoras y moléculas pequeñas activas. Esta complejidad, junto con el hecho de que la mayoría de los animales tienen tejidos opacos y ECM inaccesibles, hace que la cicatrización de heridas sea difícil de estudiar en animales vivos. Por lo tanto, gran parte del trabajo en la cicatrización de heridas epiteliales se realiza en sistemas de cultivo de tejidos, con un solo tipo de célula epitelial plateada como una monocapa en una matriz artificial. Clytia hemisphaerica (Clytia) proporciona un complemento único y emocionante a estos estudios, permitiendo estudiar la cicatrización de heridas epiteliales en un animal intacto con una ECM auténtica. El epitelio ectodérmico de Clytia es una sola capa de grandes células epiteliales escamosas, lo que permite obtener imágenes de alta resolución utilizando microscopía de contraste diferencial interferente (DIC) en animales vivos. La ausencia de fibroblastos migratorios, vasculatura o respuestas inflamatorias permite diseccionar los eventos críticos en la reepitelización in vivo. Se puede analizar la curación de varios tipos de heridas, incluidas microheridas unicelulares, heridas epiteliales pequeñas y grandes y heridas que dañan la membrana basal. La formación de lamelipodios, la contracción de la cuerda de la bolsa, el estiramiento celular y la migración celular colectiva se pueden observar en este sistema. Además, se pueden introducir agentes farmacológicos a través de la ECM para modificar las interacciones célula:ECM y los procesos celulares in vivo. Este trabajo muestra métodos para crear heridas en Clytia vivo, capturar películas de curación y sondear mecanismos de curación mediante la microinyección de reactivos en la ECM.
Introducción
Las láminas de células epiteliales cubren la superficie externa de todos los metazoos, alinean los órganos internos y dividen el cuerpo animal en compartimentos discretos. El epitelio también separa el cuerpo interno del ambiente externo y lo protege del daño y la infección. Por lo tanto, el advenimiento de las capas epiteliales fue una parte esencial de la evolución de los animales multicelulares, y las capas epiteliales se ven en todos los animales, desde los vertebrados hasta los metazoos más basales1. El epitelio de algunos órganos es una sola monocapa, como en los sacos de aire pulmonares, los vasos sanguíneos y el intestino2, así como en la epidermis de invertebrados como planaria y cnidarios3. En otros tejidos, como la piel4 y la córnea5 de los vertebrados, el epitelio está estratificado, lo que significa que hay múltiples capas de células epiteliales2. En todos los casos, la capa epitelial más basal está fijada a la membrana basal, una lámina de proteínas que forma una región especializada de la matriz extracelular (MEC)6,7,8.
Las brechas en el epitelio deben repararse rápidamente para recrear una lámina epitelial continua. El daño al epitelio ocurre durante procesos naturales, como el desprendimiento de células epiteliales en el intestino,9,10 y como resultado de una inflamación o trauma físico. Cuando una sola célula epitelial está dañada, debe repararse a sí misma o eliminarse para permitir que las células circundantes se unan entre sí y cierren el orificio11,12. En heridas más grandes que el tamaño de una sola célula, las células epiteliales deben moverse para alcanzarse entre sí y reparar la lámina13. Esto puede lograrse mediante la diseminación celular si las brechas son pequeñas o pueden requerir la migración de células epiteliales desde los márgenes de una herida para cerrar la brecha de la herida; Este último proceso se denomina reepitelización14,15. En los tejidos embrionarios, las células epiteliales se diseminan y migran para cerrar heridas o son arrastradas a través del espacio por la contracción de los cables de actomiosina que se forman entre las células en el margen de la herida, en un mecanismo que se asemeja a una cuerda de monedero16. En muchos tejidos adultos, la reepitelización implica la migración de láminas celulares coherentes, donde las células mantienen sus uniones con las células vecinas14,17,18. En otros tejidos, las conexiones célula-célula se desmantelan y las células epiteliales se comportan más como células mesenquimales, moviéndose de manera coordinada pero independiente hacia la región de la herida durante la reepitelización 14,19,20,21.
Los movimientos de las células epiteliales están regulados por interacciones complejas entre las células migratorias y entre las células y la ECM. Si bien existe una enorme cantidad de literatura experimental que aborda los mecanismos de activación de heridas de las células epiteliales y la posterior migración, aún queda mucho por descubrir. Por ejemplo, la señal inicial que activa las células epiteliales para migrar en respuesta a una herida no ha sido identificada definitivamente 22, ni se entiende completamente cómo se redistribuye la actina para crear lamelipodos en el lado de las células epiteliales más cercano a la herida 22,23,24,25,26,27. La migración celular colectiva requiere que la información de las células en la herida sea compartida con las células distales a la herida, y la vía de comunicación aún no está clara28. Las uniones célula:celda y celda:ECM deben desmontarse y reformarse a medida que las células de la lámina se reorganizan, pero la regulación de este proceso es poco conocida14,29. Avanzar en estas y otras preguntas relacionadas no solo es importante como problema biológico fundamental, sino también por la importancia clínica de la correcta cicatrización de heridas. Las enfermedades que comprometen la capacidad de las células epiteliales para migrar correctamente resultan en heridas crónicas; un ejemplo es la enfermedad genética epidermólisis ampollosa, donde los genes implicados en la unión de las células epiteliales a la ECM están mutados, dando lugar a una piel frágil que se despega y ampolla. La reepitelización también está comprometida en los tejidos naturalmente envejecidos30,31. Por lo tanto, una mejor comprensión es esencial para desarrollar intervenciones que mejoren los resultados de cicatrización de heridas.
La migración de células epiteliales en la cicatrización de heridas se ha estudiado utilizando enfoques in vitro y organismos modelo. La mayoría de los estudios de cicatrización de heridas y mecanismos de migración celular se han llevado a cabo en cultivo de tejidos, donde se cultivan monocapas de un solo tipo de célula epitelial sobre un sustrato que sustituye a la ECM. Las monocapas celulares se rayan o se cultivan con plantillas para crear huecos de formas y tamaños específicos y luego se observan32,33,34. El modelo in vitro permite una visualización ideal del comportamiento celular, así como la oportunidad de cambiar las cualidades del sustrato, exponer las células a fármacos y factores abióticos y bióticos, y transfectar células con construcciones que expresan o suprimen varios genes de interés. Sin embargo, este enfoque reduccionista puede no capturar algunos de los parámetros importantes involucrados en el comportamiento de las células epiteliales en un contexto in vivo, incluida la comunicación entre varios tipos de células y los eventos de señalización que ocurren en la ECM11. Los modelos in vivo proporcionan el contexto auténtico de una herida, con múltiples tipos de células, vías de señalización superpuestas y una ECMcompleja 35. Uno de estos modelos para estudios de cicatrización de heridas es el ratón19, en el que los avances recientes han permitido a los investigadores observar las células epidérmicas durante la cicatrización de heridas de espesor total en animales vivos36. Sin embargo, el ratón y otros sistemas in vivo presentan desafíos para estudiar la reepitelización. En primer lugar, la gran ventaja de observar el comportamiento celular en un contexto natural se equilibra con la complejidad de los eventos temporalmente superpuestos que ocurren durante la cicatrización de heridas de vertebrados, incluida la coagulación de la sangre, el reclutamiento de células inmunes y la inflamación, el reclutamiento de fibroblastos y la desdiferenciación celular, la revascularización y la remodelación de la ECM. Además, los tejidos opacos dificultan la obtención de imágenes. Los sistemas de epidermis de larva de Drosophila y pez cebra 37,38 han superado algunas de estas dificultades debido a su relativa simplicidad 39.
Nuestro laboratorio introdujo recientemente un nuevo modelo para estudiar la cicatrización de heridas epiteliales: la forma medusa (medusa) del cnidario hidrozoario Clytia hemisphaerica (Clytia)40. Clytia es un organismo modelo emergente con un genoma41 completamente secuenciado y anotado, un transcriptoma RNAseq unicelular42 y protocolos establecidos para la modificación del genoma (mutagénesis y transgénesis)43,44,45. Los cnidarios son uno de los linajes existentes más antiguos que tienen capas epiteliales, por lo que comprender la curación de heridas cnidarias proporciona información sobre las vías ancestrales que aseguraron la integridad epitelial. Para aquellas vías que se han conservado a lo largo del árbol de la vida, Clytia ofrece un nuevo y emocionante sistema para estudiar la dinámica de las células epiteliales y la regulación funcional de la cicatrización de heridas in vivo.
El epitelio que cubre la superficie superior de la Clytia medusa (exumbrella) es una monocapa de células epiteliales escamosas transparentes que miden aproximadamente 50 μm de ancho por 1-2 μm de espesor (Figura 1). Están unidos a una ECM llamada mesoglea, la "gelatina" de la medusa. La mesoglea es composicionalmente similar a la ECM encontrada en otros animales 46,47,48 incluyendo vertebrados, tiene una membrana basal 40, y es completamente transparente. La capa epitelial en la Clytia medusa puede ser fácilmente rayada o herida (ver más abajo). La simplicidad y transparencia del epitelio y la ECM permiten obtener imágenes de alta resolución de las células y sus movimientos durante la curación. Recientemente, Kamran et al. caracterizaron la cicatrización de pequeñas heridas en el epitelio de Clytia en detalle40. Se demostró que la curación en Clytia ocurre a través del rastreo celular basado en lamelipodios, la propagación celular y la migración celular colectiva, así como el cierre de la cuerda de la bolsa que es más típico de los sistemas embrionarios (aunque se vio anteriormente en estructuras de animales adultos como la córnea49). La cicatrización de heridas de Clytia es extremadamente rápida, como se ha visto en otros sistemas que carecen de una respuesta inflamatoria40,50. La curación en el exumbrella de Clytia depende completamente de los movimientos de las células epiteliales existentes: ninguna célula prolifera o migra a través de la ECM al sitio de la herida (Película suplementaria 1). Todos estos hallazgos sugieren que Clytia es un sistema modelo útil para estudiar la cicatrización de heridas epiteliales. De hecho, la facilidad de obtener imágenes de las células epiteliales en Clytia durante la cicatrización de heridas llevó al descubrimiento de que los lamellipodia de células epiteliales se extienden y se extienden sobre áreas de ECM expuestas siempre que haya una membrana basal intacta; Si la membrana basal está dañada, la curación epitelial cambia a un mecanismo de cuerda de monedero40. Esta fue la primera demostración de un mecanismo subyacente a la decisión de cerrar por rastreo basado en lamellipodia versus cierre de cuerda de bolsa, destacando la importancia de las interacciones específicas célula: ECM en la curación y de la observación de las células en su contexto natural.
A continuación, se describen los protocolos para crear e imágenes de microheridas unicelulares, heridas pequeñas que se cierran principalmente por propagación celular y heridas grandes que requieren migración celular colectiva para cerrarse. Además, se describe un protocolo para la introducción de moléculas pequeñas en la ECM y las células epiteliales, lo que permite perturbaciones experimentales de las vías reguladoras putativas de la cicatrización de heridas.
Protocolo
1. Cultivo animal
- Mantener colonias de pólipos de Clytia en portaobjetos de microscopio y medusas en agua de mar artificial (ASW) a 18 °C en un sistema de pez cebra, con tanques de pez cebra de 2 L para colonias de pólipos y tanques de pseudo-kreisel de 5 L hechos a medida para medusas (Figura suplementaria 1)51. ASW consiste en un 4% de océano instantáneo en desionizado (DI)H2O.
- Alimentar a los animales diariamente con artemia de 2-3 días de edad como se describe51.
NOTA: Las imágenes de curación de heridas son más fáciles si los animales no han sido alimentados recientemente, ya que hay menos desechos liberados del intestino al campo de visión. - Recoja medusas bebé de las colonias de pólipos establecidas según sea necesario colocando colonias en un vaso de precipitados de 2 L lleno de 1 L de ASW durante la noche. Use medusas femeninas de 2-3 semanas de edad para todos los experimentos de curación de heridas. La propagación de Clytia se ha descrito en detalle en otra parte51.
2. Herido
- Creación de microheridas dentro y entre las células (20-500 μm2)
- Cree una pipeta de transferencia modificada cortando la punta con tijeras para hacer una abertura más grande (0.5-0.7 cm de diámetro).
NOTA: La abertura de la pipeta debe ser lo suficientemente ancha para evitar daños al animal. - Usando la pipeta de transferencia modificada, coloque la medusa en un portaobjetos de depresión con el exumbrel de medusa hacia arriba, con el ASW suficiente para cubrir al animal.
- Coloque un cubreobjetos sobre el animal y la imagen inmediatamente (consulte a continuación la descripción de las imágenes). El cubreobjetos comprime la mesoglea, y el rebote del tejido comprimido crea una fuerza que separa ligeramente las células52. Esto aparece inmediatamente como espacios entre cada célula y daño dentro de algunas células (Figura 1B, B', Figura 2 y Figura 3A-C).
- Cree una pipeta de transferencia modificada cortando la punta con tijeras para hacer una abertura más grande (0.5-0.7 cm de diámetro).
- Creación de pequeñas heridas epiteliales (0,02-0,125 mm2)
- Usando una pipeta de transferencia modificada (como la anterior), coloque la medusa en un portaobjetos de depresión con el exumbrel de medusa hacia arriba.
- Con una punta de pipeta de 200 μL, rasque suavemente la superficie de la medusa. El rascado suave también puede crear rasgaduras en la membrana basal, que son fácilmente evidentes22. Cubra al animal con un cubreobjetos para obtener imágenes. Alternativamente, la colocación del cubreobjetos a veces es suficiente para crear pequeñas heridas epiteliales incluso sin rascarse (Figura 1C, C', Figura 2 y Figura 3A-C).
NOTA: No presione hacia abajo al rascar la superficie de la medusa, ya que esto daña la ECM y crea una superficie irregular: las células epiteliales que migran sobre una superficie irregular son más difíciles de mantener enfocadas.
- Creación de grandes heridas epiteliales (0,5-0,9 mm2)
- Hacer una aguja de microinyección con un extractor de micropipetas y un tubo capilar de vidrio (paso 5.2). Coloque la aguja de microinyección vacía en un soporte para microinyectores fijado a un micromanipulador. Corte la punta de la aguja para que la abertura sea de aproximadamente 20-40 μm.
NOTA: Las agujas cortadas para heridas epiteliales grandes se pueden almacenar y reutilizar para aumentar la consistencia entre los experimentos. - Ajuste la presión de retención en el microinyector a cero y establezca la presión de expulsión en aproximadamente 20 PSI. Ajuste el microinyector para que entregue un pulso de aire de 2 s.
NOTA: Es posible que sea necesario ajustar la presión de expulsión en función del diámetro de la abertura de la aguja (es decir, las puntas más pequeñas usarán una presión más alta, mientras que las puntas más grandes usarán una presión más baja). - Coloque la medusa con el exumbrel hacia arriba en un tobogán de depresión en el escenario de un endoscopio de disección, con el ASW suficiente para cubrir al animal. Usando el micromanipulador, ajuste la punta de la aguja de microinyección para que esté justo por encima del agua. Para hacer esto, sumerja cuidadosamente la punta en agua (el agua puede entrar en la punta de la pipeta), luego retírela para que esté cerca de la superficie epitelial de la medusa.
NOTA: La punta debe colocarse sobre un cuadrante de la medusa. Los canales radiales de la medusa dividen la campana de la medusa en cuatro cuadrantes distintos. Apuntar a un cuadrante dará como resultado imágenes más limpias, ya que las gónadas y los canales radiales se excluyen del área de la herida. - Pulse el aire presionando el botón de arranque en el inyector. Repita el pulso en el mismo lugar de dos a cuatro veces, dependiendo del ancho de la punta. Las puntas más grandes requieren menos pulsos.
NOTA: Una hendidura en el agua / medusa causada por el pulso del aire debe ser visible. - Cubra al animal herido con un cubreobjetos para obtener imágenes de heridas grandes (Figura 1D, D').
- Siga los pasos a continuación (sección 3) para obtener imágenes de la cicatrización de la herida epitelial.
- Hacer una aguja de microinyección con un extractor de micropipetas y un tubo capilar de vidrio (paso 5.2). Coloque la aguja de microinyección vacía en un soporte para microinyectores fijado a un micromanipulador. Corte la punta de la aguja para que la abertura sea de aproximadamente 20-40 μm.
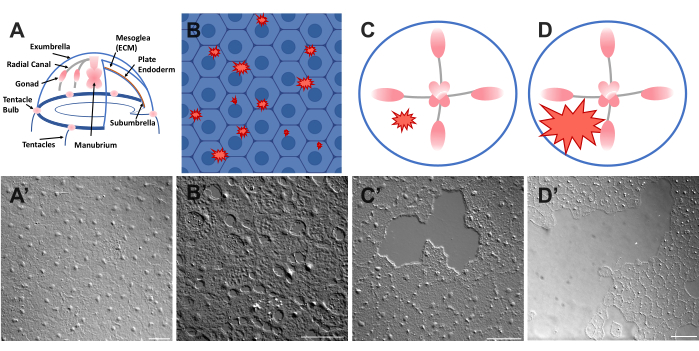
Figura 1: Capa epitelial de exumbrella intacta y herida en Clytia medusa. (A) Gráfico de dibujos animados del cuerpo de Clytia medusa. (A') Epitelio intacto de medusa exumbrella visto desde arriba. (B) Caricatura de microheridas unicelulares (formas dentadas rojas) con células epiteliales en azul. (B') Microheridas unicelulares. (C) Caricatura de una pequeña herida epitelial (forma dentada roja). (C') Pequeña herida epitelial. (D) Caricatura de una gran herida epitelial (forma dentada roja). (D') Herida epitelial grande. Todas las imágenes se obtuvieron mediante microscopía DIC. Barras de escala en (A'-C'): 50 μm. Barra de escala en (D'): 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
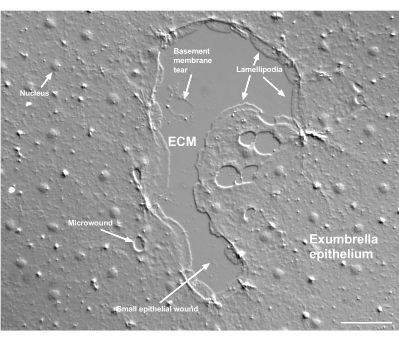
Figura 2: Heridas de múltiples tamaños y una membrana basal dañada. Se muestra una pequeña herida epitelial típica de exumbrella, con etiquetas que indican lamellipodia que se forman a partir de células marginales. Además, se observan microheridas dentro y entre las células epiteliales. Tenga en cuenta el pequeño desgarro de la membrana basal en la parte superior de la herida. La película 4 muestra la curación de esta herida. Barra de escala: 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
3. Obtención de imágenes de la cicatrización de heridas epiteliales
- Asegúrese de que el microscopio se ha alineado para la iluminación de Köhler53 y que se ha configurado correctamente para la microscopía de contraste diferencial de interferencia (DIC)54. Las células epiteliales son casi invisibles con la óptica estándar (Figura 3D, E).
- Ajusta el enfoque al exumbrella. Aunque esta es una capa delgada, las celdas hexagonales deben ser claras.
NOTA: El exumbrella y el subumbrella están separados por una mesoglea gruesa que está soportada por fibras verticales. Las células subparaguas están en el mismo plano focal que los canales radiales. Si inicialmente se enfoca en la capa subumbrelar, ajuste el enfoque lentamente a través de la mesoglea y las fibras verticales hasta encontrar el exumbrella. - Identifique manualmente una herida en la imagen. Para heridas grandes, use un objetivo 10x. Para heridas más pequeñas y heridas unicelulares, use un objetivo de 20x.
- Inicie un programa que recopile imágenes como una película en tiempo real o que recopile una serie de imágenes a intervalos regulares. Supervise el progreso para asegurarse de que el área de la herida no se desvíe del campo de visión y que las células de interés permanezcan enfocadas.
- Las heridas unicelulares se cierran en un minuto; Por lo tanto, imagina su cierre con una película.
- Para capturar detalles de la dinámica celular de heridas pequeñas, recopile imágenes aproximadamente cada 10 s. El cierre de heridas pequeñas toma 20-50 minutos dependiendo del tamaño.
- No tome imágenes de los portaobjetos sin sellar durante más de 45 minutos, ya que la evaporación del agua del tobogán con el tiempo conduce a la muerte del animal y la ruptura de las células.
- Para una observación más prolongada, selle alrededor del cubreobjetos con vaselina para reducir la evaporación.
NOTA: Algunas medusa pueden pulsar en el portaobjetos, lo que interfiere con las imágenes. En este caso, los animales montados en una dilución 1:10 de metanosulfonato de etilo 3-aminobenzoato al 1% (Tricaine), ajustado a pH 7.5, en ASW sirve como un anestésico efectivo y no tiene ningún efecto aparente sobre la curación en un marco de tiempo de 1 h. Sin embargo, los animales morirán si se dejan durante varias horas en Tricaine.

Figura 3: Creación de una pequeña herida en el epitelio exparante. (A) Rascado suave del exumbrel con una punta de pipeta de 200 μL para crear una pequeña herida epitelial. (B) La colocación del cubreobjetos es a veces suficiente para crear pequeñas heridas epiteliales. (C) Medusa montada en un portaobjetos de depresión. (D ) Imagen de herida epitelial pequeña sin óptica DIC y (E) con óptica DIC. Barras de escala: 50 μm Haga clic aquí para ver una versión más grande de esta figura.
4. Análisis
- Preparación de archivos de imagen
NOTA: Para procesar los archivos de imagen, utilice FIJI/ImageJ con plugins BioFormat actualizados.- Establezca la escala en la proporción correcta de píxeles por micra antes de registrar la pila de imágenes; Analizar > establecer escala. Esto es necesario para extraer mediciones de tamaño reales en análisis posteriores.
- A menudo, el animal se desplaza ligeramente en el portaobjetos del microscopio; por lo tanto, para eliminar la deriva en las películas, registre las imágenes utilizando la alineación de pila lineal del complemento FIJI con SIFT. Plugins > Registro > Alineación de Pila Lineal con SIFT.
- Guarde la pila registrada como un archivo .avi. Archivo > Guardar como > AVI... En la ventana emergente, establezca la velocidad de fotogramas (las figuras animadas en este documento se establecen en 10 fps) y haga clic en Aceptar. Utilice esta salida para realizar el análisis de cicatrización de heridas.
- Análisis del área de la herida
- Con la herramienta de lazo de FIJI/ImageJ, delinee la herida trazando los bordes de la celda. Mida el área de la herida que se acaba de delinear con Comando+M o CTRL+M.
- Repita la medición del área de la herida cada 10 cuadros. Las mediciones de FIJI/ImageJ se pueden trazar utilizando el prisma 9 (Figura 4).
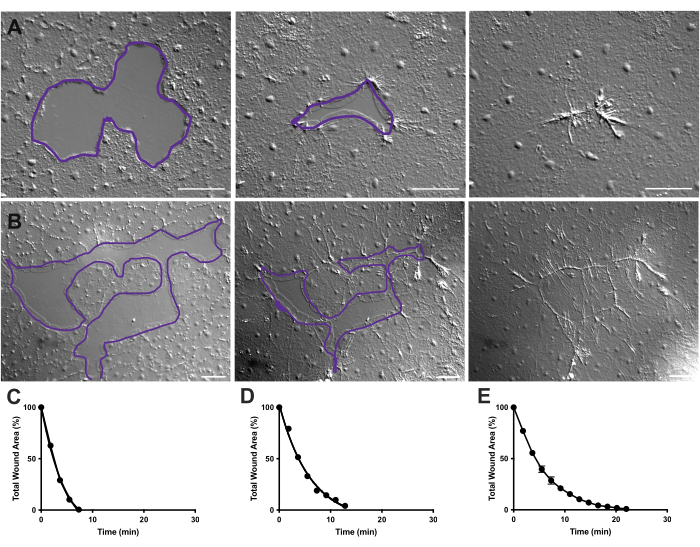
Figura 4: Análisis del área de la herida en pequeñas heridas epiteliales. (A ) Ejemplo de una pequeña herida epitelial que cicatriza más de 10 min. (B) Ejemplo de una herida epitelial diferente que cicatriza durante 21 min. Los contornos púrpuras en A, B son comparables a las mediciones de áreas de heridas utilizando la herramienta de lazo en FIJI / ImageJ. (C) Reducción normalizada del área de la herida con el tiempo en A. (D) Reducción normalizada del área de la herida con el tiempo en B. (E) Reducción promedio del área de la herida a lo largo del tiempo para 14 heridas pequeñas. n = 14. Barras de error centradas en la media ± SEM. Barras de escala: 50 μm Haga clic aquí para ver una versión más grande de esta figura.
5. Inyecciones mesogleal
- Creación de un plato de inyección
- Prepare el polidimetilsiloxano (PDMS) combinando una base PDMS y un agente de curado, en una proporción de 10 partes de base a 1 parte de agente de curado en peso. Revuelva vigorosamente para mezclar completamente la base y el agente de curado.
- Para eliminar las burbujas, coloque la mezcla en una cámara de vacío durante 15 minutos. Vierta la mezcla en una placa de Petri de 60 mm con tapas de tubo de microcentrífuga para mantener el molde en su lugar. Coloque inmediatamente el molde en las tapas de los tubos con una inclinación de 45° y coloque cinta adhesiva en su lugar. El molde son tres diapositivas de vidrio apiladas y desplazadas pegadas para crear crestas en el plato de inyección final.
- Coloque todo el plato, el molde y la mezcla en un horno a 60 °C durante 2 h para curar el elastómero. Retire el molde para un plato de inyección completo.
- Extracción de micropipetas
- Usando un extractor de microelectrodos, diseñe un programa de extracción. Use un programa de un solo paso con alta velocidad. El calor es aproximadamente el resultado de la prueba de rampa de vidrio55,56. Compruebe las micropipetas resultantes para detectar estrechas largas y consistentes.
NOTA: Utilice capilares de borosilicato de vidrio de pared delgada con un diámetro exterior de 1,0 mm, un diámetro interior de 0,75 mm y una longitud de 10 cm.
- Usando un extractor de microelectrodos, diseñe un programa de extracción. Use un programa de un solo paso con alta velocidad. El calor es aproximadamente el resultado de la prueba de rampa de vidrio55,56. Compruebe las micropipetas resultantes para detectar estrechas largas y consistentes.
- Inyección de colorantes y drogas
- Haga una aguja de microinyección (como la anterior).
- Rellene la aguja de microinyección con una punta de pipeta larga con un exceso de volumen de tinte o medicamento para inyección en la medusa.
NOTA: Para Clytia, el dimetilsulfóxido (DMSO) debe mantenerse en una dilución de <1:100 con ASW, ya que las concentraciones más altas de DMSO impiden la cicatrización de heridas. Si se inyecta una solución transparente, se puede agregar una solución Fast Green FCF (dilución 1:100 de Fast Green FCF al 0,1% en ASW) para visualizar el líquido inyectado. - Usando una pipeta de transferencia modificada como la anterior, coloque una medusa con el subparaguas hacia arriba en un plato de inyección PDMS con suficiente ASW para cubrir al animal (Figura 5C). Coloque el plato en el escenario de un endoscopio de disección.
NOTA: Limitar el exceso de ASW evita que la medusa nade en el plato y permite inyecciones más exitosas. - Concéntrese en la punta de la aguja de microinyección y avance hacia el agua cerca de la medusa. Con el micromanipulador, presione la aguja en el plato hasta que se doble y se rompa. Esta abertura de la punta es de aproximadamente 10-20 μm.
NOTA: Esta aguja se puede usar repetidamente para las mismas inyecciones de tinte/drogas ese día. Se recomienda usar una punta fresca cada día y para tintes / medicamentos separados. - Usando el micromanipulador, inserte la punta de la aguja a través del subparaguas en la mesoglea sin perforar el exumbrella.
NOTA: Se notará un pliegue/plegamiento del epitelio. Una vez que la aguja se inserta en la medusa, el pliegue cesa. - En el microinyector, ajuste la presión de retención a cero y la presión de expulsión a ≤20 PSI. Inyecte en uno o dos cuadrantes, llenando cada uno con una mancha de tinte o droga aproximadamente 1/4 del área de ese cuadrante.
NOTA: Dependiendo del tamaño de la medusa, los volúmenes más grandes o más pequeños son apropiados en puntos de inyección individuales. El llenado excesivo de la medusa resulta en un daño extremo al epitelio e incluso la muerte del animal. - Dependiendo del tinte o droga que se inyecte, los animales se colocan en un vaso de precipitados de ASW fresco para permitir la difusión e incubación del tinte o la droga.
- Para obtener imágenes, monte la medusa en un portaobjetos de depresión usando una pipeta de transferencia modificada, colocando al animal de modo que el exumbrella esté hacia arriba (Figura 5). Los animales pueden ser heridos en esta etapa para probar el efecto de un reactivo inyectado.
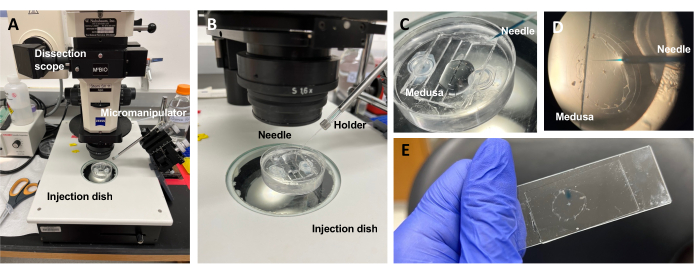
Figura 5: Configuración de la inyección para introducir colorantes o fármacos en la ECM. (A) Configuración de inyección. (B) Primer plano de la configuración de inyección que muestre la orientación de la aguja de microinyección (ángulo de aproximadamente 45° con respecto al animal en el plato). (C) Primer plano del plato de inyección de silicona con la medusa en una pequeña cantidad de ASW para inyección. (D) Una aguja de microinyección cargada con Fast Green FCF que entra en la mesoglea de la medusa a través del subparaguas. (E) Post-inyección de Fast Green FCF en una medusa montada. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
Siguiendo los protocolos anteriores, se tomaron imágenes de microheridas unicelulares, heridas pequeñas y heridas grandes. Las pilas registradas de archivos de imagen se guardaron como archivos .avi.
En la película 1, se puede ver que las microheridas se cierran entre y dentro de las células (Figura 1 y Figura 2). Se observan pequeños lamellipodia durante el cierre, seguidos de contracción y curación. Los desechos se excluyen y se liberan en el agua. La curación se completa en un minuto o menos.
En las películas 2 y 3, pequeñas heridas de diferentes formas se curan a través de la formación de lamellipodia, la extensión de los contactos lamellipodiales y la propagación de células en el margen de la herida, como se describió anteriormente40 (Figura 1 y Figura 2). Las células en niveles detrás de las células marginales no participan en la curación de heridas de este tamaño ni hay migración celular colectiva. El cierre rápido y progresivo de las brechas epiteliales es seguido por la contracción del tejido a lo largo de la costura de la herida recién formada40. Se muestra la tasa normalizada de cicatrización de estas dos heridas, expresada como porcentaje del área original a lo largo del tiempo (Figura 4C, D). Si bien existe cierta variabilidad en la dinámica del cierre de heridas, promediar el porcentaje de cierre del área a lo largo del tiempo para 14 heridas de varias formas que van desde 0.02-0.125 mm2 permite el establecimiento de una curva promedio para la cicatrización de heridas en animales no tratados (Figura 4E).
El daño a la membrana basal se puede ver claramente cuando ocurre (Figura 2). En la película 4, las células en el margen de una pequeña herida en la que hay daño en la membrana basal se extienden alrededor del área dañada, y el cierre de la brecha se completa con una contracción de la cuerda del bolso.
Si el tejido está deshidratado o demasiado dañado para repararlo, los movimientos celulares pueden detenerse o toda la lámina de células puede estallar (Película 5 y Película 6). Esto generalmente ocurre después de largos períodos de imágenes (45 minutos o más). Si el estallido celular ocurre temprano en la toma de imágenes, la muestra se descarta.
Como se muestra en la película 7, las heridas grandes sanan en varias etapas. En primer lugar, el borde de la herida se vuelve liso y regular debido a las contracciones en el margen, como se informó anteriormente57. Luego, se observa que los lamellipodia se forman a partir de las células en el margen de la herida, con lamellipodia avanzando para maximizar el contacto con lamellipodia adyacente. El seguimiento de los núcleos en las células en el margen de la herida y varios niveles detrás de las células marginales muestra que grandes brechas se cierran por la migración celular colectiva40. Las células nunca se desprenden, sino que se mueven juntas como una hoja.
La introducción de colorantes y agentes farmacológicos puede ser una herramienta poderosa para diseccionar mecanismos biológicos. Muchas sustancias están excluidas de Clytia (no se muestra), probablemente debido a la capa de moco que recubre la superficie del animal. Sin embargo, la microinyección se puede utilizar para introducir moléculas directamente en la ECM, interrumpiendo la estructura de la ECM o perturbando las actividades reguladoras en la ECM. Además, los colorantes y otras moléculas pueden ingresar a las células epiteliales desde el lado basal. Por ejemplo, la Figura 6 muestra tinción nuclear con Hoechst, tinción de membrana con FM1-43 e inhibición de la formación de lamellipodia por citocalasina B después de que estos reactivos se microinyectan en la ECM. La introducción de estas moléculas en la ECM y las células epiteliales antes de la herida permite experimentos que prueban el efecto de las herramientas farmacológicas en el proceso de curación.
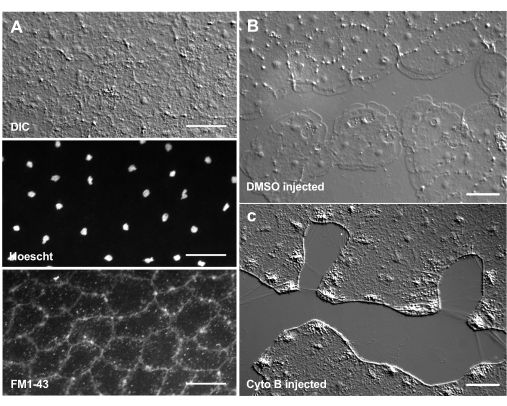
Figura 6: Células epiteliales de la medusa tras microinyección de colorantes o agentes farmacológicos. (A) Células epiteliales mostradas en el panel superior 5 min después de la inyección con 20 μM Hoechst (núcleos) y 50 μM FM1-43 (membranas). (B,C) Cicatrización de heridas después de la inyección con 1:1.000 DMSO control (B) o 100 μM de citocalasina B (C). Las heridas se hicieron 15 minutos después de la inyección. Las imágenes fueron tomadas 5 min después de la herida. La formación de lamellipodia es inhibida por la citocalasina B. Se cree que las "fibras" aparentes que a menudo se ven entre las células en el área de la herida son el resultado de la tensión que estira la membrana basal: no se tiñen con faloidina (no se muestra). Barras de escala: 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
Película 1: Película de lapso de tiempo de curación de microheridas de una sola célula. Tiempo transcurrido: 20 s. Velocidad de fotogramas: 10 fps. Barra de escala: 50 μm. Haga clic aquí para descargar esta película.
Película 2: Película de lapso de tiempo de una pequeña cicatrización de herida epitelial. Tiempo transcurrido: 9 min 54 s. Velocidad de fotogramas: 10 fps. Barra de escala: 50 μm. Haga clic aquí para descargar esta película.
Película 3: Película de lapso de tiempo de una pequeña herida epitelial que cicatriza. Esta herida es más grande y de forma más irregular que la herida en la película 2. Tiempo transcurrido: 20 min 54 s. Velocidad de fotogramas: 10 fps. Barra de escala: 50 μm. Haga clic aquí para descargar esta película.
Película 4: Película de lapso de tiempo de una pequeña herida y una cicatrización de microherida con un desgarro de la membrana basal. Los lamellipodia se extienden alrededor del desgarro de la membrana basal, aunque pueden avanzar sobre el resto de la ECM. Una vez que se rodea la región de la herida con el daño de la membrana basal, una contracción de la cuerda del bolso tira de las células sobre la región. Tiempo transcurrido: 19 min 4 s. Velocidad de fotogramas: 10 fps. Barra de escala: 50 μm. Haga clic aquí para descargar esta película.
Película 5: Células muriendo en una pequeña herida epitelial. La muerte celular es probablemente debido a la deshidratación del animal. Tiempo transcurrido: 4 min 24 s. Velocidad de fotogramas: 10 fps. Barra de escala: 100 μm. Haga clic aquí para descargar esta película.
Película 6: Una pequeña herida epitelial no logra completar la curación. Tiempo transcurrido: 42 min 32 s. Velocidad de fotogramas: 10 fps. Barra de escala: 50 μm. Haga clic aquí para descargar esta película.
Película 7: Cicatrización de heridas epiteliales grandes. Tiempo transcurrido: 25 min 29 s. Velocidad de fotogramas: 10 fps. Barra de escala: 100 μm. Haga clic aquí para descargar esta película.
Figura suplementaria 1: Esquemas de dimensiones del tanque Clytia. Visualización 3D de los tanques Clytia hechos a medida. (A) Vista frontal y trasera. (B) Vista lateral. El recorte en la pieza que se muestra en verde está cubierto con malla de nylon. El agua entra en el tanque directamente sobre la malla, barre sobre la malla y crea una corriente circular. El agua sale del sistema a través del orificio en la pieza final que se muestra en azul. Haga clic aquí para descargar este archivo.
Película suplementaria 1: Matriz extracelular acelular en Clytia. Pila Z de Clytia tomada con microscopía confocal. La pila se enfoca inicialmente en el exumbrella y luego escanea cada 10 μm a través de la ECM hasta el endodermo y el subparaguas de la placa. Las imágenes que usan DIC (izquierda) y tinción nuclear de Hoechst (derecha) demuestran la falta de células en la ECM. Barra de escala: 100 μm. Haga clic aquí para descargar este archivo.
Discusión
Aquí, se presenta la metodología para obtener imágenes de heridas in vivo en Clytia, un organismo modelo de invertebrados relativamente nuevo40,43,58. Hay varios factores que hacen de este sistema una herramienta de investigación única y poderosa, distinta de otros modelos utilizados para estudiar la cicatrización de heridas y la reepitelización. Primero, el epitelio monocapa se une a una ECM transparente, por lo tanto, se asemeja a los ensayos de cultivo de tejidos in vitro (Figura 1, Figura 2, Figura 3, Figura 4). Al igual que en los ensayos in vitro, las células se pueden visualizar en alta resolución. Sin embargo, a diferencia del cultivo de tejidos, existe un entorno celular auténtico y ECM, por lo que la cicatrización de heridas se puede ver en el contexto de los complejos eventos de señalización que ocurren en un animal vivo lesionado. En segundo lugar, Clytia carece de respuestas inflamatorias, fibroblastos migratorios, vasculatura y sangre. Esto permite que el proceso de reepitelización sea estudiado in vivo en ausencia de los eventos superpuestos que ocurren en animales adultos más complejos durante la cicatrización de heridas59. En tercer lugar, el ECM es acelular (Película suplementaria 1) y grande, lo que permite un fácil acceso con una aguja de microinyección (Figura 5 y Figura 6). Usando este enfoque, los investigadores pueden probar el efecto de los reactivos farmacológicos que perturban la estructura o señalización de la ECM en la cicatrización de heridas in vivo. Los reactivos también se pueden introducir en las células epiteliales, y se pueden evaluar sus efectos sobre la cicatrización de heridas in vivo. En cuarto lugar, existen protocolos para la creación de mutantes y animales transgénicos en el sistema Clytia42,43,44,45. Por lo tanto, la cicatrización de heridas in vivo se puede observar en animales con expresión aumentada/disminuida de genes de interés.
Hay varios pasos críticos en esta técnica. Primero, como se muestra en la Figura 3, es necesario usar un microscopio que esté configurado correctamente para la microscopía DIC ya que las células epiteliales planas y transparentes son casi invisibles con la microscopía óptica estándar. También es importante desarrollar la habilidad de herir a los animales suavemente para que el epitelio se dañe sin arrancar la ECM. Un toque igualmente suave es necesario para microinyectar materiales en la ECM, ya que el daño extenso al animal durante la inyección podría comprometer un análisis posterior de la cicatrización de heridas. Si bien hay una curva de aprendizaje para estas técnicas, incluso los estudiantes principiantes las han dominado rápidamente en el laboratorio de Malamy. De hecho, estos protocolos se han utilizado para demostrar la migración celular en cursos de laboratorio de pregrado en la Universidad de Chicago.
Para obtener imágenes óptimas, es importante que el animal no se mueva y que el área de la herida elegida no se desvíe del campo de visión. Si los animales están pulsando, el tratamiento con tricaína como se describe es muy eficaz. Para la deriva, a menudo es necesario reposicionar manualmente la muestra. Estos movimientos se pueden eliminar de la película final utilizando la función de registro en FIJI/ImageJ.
Una limitación con este sistema es que no es posible crear heridas idénticas, ya que las heridas varían tanto en forma como en tamaño utilizando los métodos descritos aquí. Por lo tanto, puede ser difícil cuantificar la tasa exacta de cierre de heridas o migración celular. Los marcadores posicionales, como los granos de carbono, se adhieren a la ECM expuesta en un animal herido y se pueden usar para medir la tasa de migración celular colectiva en heridas grandes (no se muestra). Para el análisis de cierre de heridas pequeñas, incluso con tamaño y forma variables de la herida, existe un rango limitado de tasas de cierre entre las heridas de este tamaño (Figura 4). Por lo tanto, es posible detectar cuantitativamente los efectos de los reactivos farmacológicos propositivos o represivos.
Si bien este trabajo describe la caracterización de la cicatrización de heridas utilizando solo microscopía DIC, se pueden usar los mismos enfoques para la curación de imágenes utilizando microscopía fluorescente o confocal. Para ayudar en esto, existen protocolos para generar animales transgénicos en los que varias proteínas celulares y extracelulares están marcadas con fluorescencia. Las imágenes concurrentes con CID y fluorescencia, combinadas con la perturbación de la cicatrización de heridas utilizando agentes farmacológicos o líneas mutantes, serán un enfoque poderoso para comprender los mecanismos que subyacen al proceso de cicatrización de heridas en el epitelio.
Divulgaciones
Nada que revelar.
Agradecimientos
E.E.L.L. cuenta con el apoyo de una subvención de la National Science Foundation PRFB 2011010. Nos gustaría agradecer a Tsuyoshi Momose y Evelyn Houliston por ayudarnos a establecer nuestras colonias de Clytia, a Jean-Baptiste Reynier por la recopilación de las imágenes de curación de microheridas, a Harry Kyriazes por la construcción de los tanques pseudo-kreisel y a Elizabeth Baldo por mantener el hábitat de Clytia. La Figura 1B fue creada con BioRender.com.
Materiales
| Name | Company | Catalog Number | Comments |
| 20500 ACE EKE Microscope Fiber Optic Light Source | Kramer Scientific Corporation | ||
| AxioCam 506 mono | ZEISS | 426557-0000-000-MA285 | |
| Capillary tubes | World Precision Instruments | TW1004 | |
| Cytochalasin B | Abcam | ab143482 | |
| Depression slides | Amscope | BS-C12 | |
| DMR with DIC options and fluorescence halogen lamp | Leica | ||
| Ethyl 3-aminobenzoate methanesulfonate | Sigma Aldrich | E10521-10G | |
| Fast Green FCF | Thermo Scientific | A16520-06 | |
| FM1-43 | Biotium | 70022 | Excitation/Emission: 480/598 nm |
| Hoechst 33342 | Thermo Scientific | 62249 | Excitation/Emission: 361/497 nm |
| imageJ | NIH | ||
| Microloader tips (0.5-10 μL /2-20 μL) | Eppendorf | 930001007 | |
| Micromanipulator | World Precision Instruments | 3301R / M3301L | |
| Microscope Cover Glass (22X40-1.5) | Fisherbrand | 12-544-BP | |
| Petri Dish (60 mm x 15 mm) | Fisherbrand | FB085713A | |
| PicoNozzle v2 | World Precision Instruments | 5430-ALL | |
| Pipette puller | Sutter Instrument Co | P-97 | |
| Pneumatic PicoPump | World Precision Instruments | PV820 | |
| Polycarbonate vacuum, desiccator | Bel-art | F42025-0000 | |
| Prism 9 | GraphPad | ||
| STEMI Sv11 Dissection scope | ZEISS | STEMI SV11 | |
| SYLGARD 184 | Dow Silicones | 1024001 | |
| Transfer pipettes | Fisherbrand | 13-711-7M | |
| Z-Hab mini system | Pentair | ||
| ZEN Microscopy software | Zeiss |
Referencias
- Tyler, S. Epithelium-the primary building block for metazoan complexity. Integrative and Comparative Biology. 43 (1), 55-63 (2003).
- Kurn, H., Daly, D. T. Histology, Epithelial Cell. StatPearls. , (2022).
- Schempp, C., Emde, M., Wölfle, U. Dermatology in the Darwin anniversary. Part 1: Evolution of the integument. Journal of the German Society of Dermatology. 7 (9), 750-757 (2009).
- Lopez-Ojeda, W., Pandey, A., Alhajj, M., Oakley, A. M. Anatomy, Skin (Integument). StatPearls. , (2022).
- Bukowiecki, A., Hos, D., Cursiefen, C., Eming, S. A. Wound-healing studies in cornea and skin: parallels, differences and opportunities. International Journal of Molecular Sciences. 18 (6), 1257(2017).
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. Journal of Cell Science. 123 (24), 4195-4200 (2010).
- Hynes, R. O. The evolution of metazoan extracellular matrix. The Journal of Cell Biology. 196 (6), 671-679 (2012).
- Fidler, A. L., et al. Collagen IV and basement membrane at the evolutionary dawn of metazoan tissues. eLife. 6, 24176(2017).
- Bullen, T. F., et al. Characterization of epithelial cell shedding from human small intestine. Laboratory Investigation; a Journal of Technical Methods and Pathology. 86 (10), 1052-1063 (2006).
- Watson, A. J. M., et al. Epithelial barrier function in vivo is sustained despite gaps in epithelial layers. Gastroenterology. 129 (3), 902-912 (2005).
- Sonnemann, K. J., Bement, W. M. Wound repair: toward understanding and integration of single-cell and multicellular wound responses. Annual Review of Cell and Developmental Biology. 27, 237-263 (2011).
- Abreu-Blanco, M. T., Verboon, J. M., Parkhurst, S. M. Single cell wound repair. BioArchitecture. 1 (3), 114-121 (2011).
- Fenteany, G., Janmey, P. A., Stossel, T. P. Signaling pathways and cell mechanics involved in wound closure by epithelial cell sheets. Current Biology. 10 (14), 831-838 (2000).
- Pastar, I., et al. Epithelialization in wound healing: a comprehensive review. Advances in Wound Care. 3 (7), 445-464 (2014).
- Rousselle, P., Braye, F., Dayan, G. Re-epithelialization of adult skin wounds: Cellular mechanisms and therapeutic strategies. Advanced Drug Delivery Reviews. 146, 344-365 (2019).
- Bement, W. M., Forscher, P., Mooseker, M. S. A novel cytoskeletal structure involved in purse string wound closure and cell polarity maintenance. The Journal of Cell Biology. 121 (3), 565-578 (1993).
- Vedula, S. R. K., Ravasio, A., Lim, C. T., Ladoux, B. Collective Cell migration: a mechanistic perspective. Physiology. 28 (6), 370-379 (2013).
- Li, L., He, Y., Zhao, M., Jiang, J. Collective cell migration: Implications for wound healing and cancer invasion. Burns & Trauma. 1 (1), 21-26 (2015).
- Bornes, L., Windoffer, R., Leube, R. E., Morgner, J., van Rheenen, J. Scratch-induced partial skin wounds re-epithelialize by sheets of independently migrating keratinocytes. Life Science Alliance. 4 (1), 202000765(2021).
- Theveneau, E., Mayor, R. Collective cell migration of epithelial and mesenchymal cells. Cellular and Molecular Life Sciences. 70 (19), 3481-3492 (2013).
- Haensel, D., Dai, X. Epithelial-to-mesenchymal transition in cutaneous wound healing: where we are and where we are heading. Developmental Dynamics. 247 (3), 473-480 (2018).
- Cordeiro, J. V., Jacinto, A. The role of transcription-independent damage signals in the initiation of epithelial wound healing. Nature Reviews. Molecular Cell Biology. 14 (4), 249-262 (2013).
- Abreu-Blanco, M. T., Watts, J. J., Verboon, J. M., Parkhurst, S. M. Cytoskeleton responses in wound repair. Cellular and Molecular Life Sciences. 69 (15), 2469-2483 (2012).
- Klarlund, J. K., Block, E. R. Free edges in epithelia as cues for motility. Cell Adhesion & Migration. 5 (2), 106-110 (2011).
- Enyedi, B., Niethammer, P. Mechanisms of epithelial wound detection. Trends in Cell Biology. 25 (7), 398-407 (2015).
- Niethammer, P. The early wound signals. Current Opinion in Genetics & Development. 40, 17-22 (2016).
- Jacinto, A., Martinez-Arias, A., Martin, P. Mechanisms of epithelial fusion and repair. Nature Cell Biology. 3 (5), 117-123 (2001).
- Mayor, R., Etienne-Manneville, S. The front and rear of collective cell migration. Nature reviews. Molecular Cell Biology. 17 (2), 97-109 (2016).
- Gupta, S., Yap, A. S. How adherens junctions move cells during collective migration. Faculty Reviews. 10, 56(2021).
- Blair, M. J., Jones, J. D., Woessner, A. E., Quinn, K. P. Skin structure-function relationships and the wound healing response to intrinsic aging. Advances in Wound Care. 9 (3), 127-143 (2020).
- Falanga, V., et al. Chronic wounds. Nature Reviews. Disease Primers. 8 (1), 50(2022).
- Liang, C. -C., Park, A. Y., Guan, J. -L. In vitro scratch assay: a convenient and inexpensive method for analysis of cell migration in vitro. Nature Protocols. 2 (2), 329-333 (2007).
- Jonkman, J. E. N., et al. An introduction to the wound healing assay using live-cell microscopy. Cell Adhesion & Migration. 8 (5), 440-451 (2014).
- Poujade, M., et al. Collective migration of an epithelial monolayer in response to a model wound. Proceedings of the National Academy of Sciences. 104 (41), 15988-15993 (2007).
- Masson-Meyers, D. S., et al. Experimental models and methods for cutaneous wound healing assessment. International Journal of Experimental Pathology. 101 (1-2), 21-37 (2020).
- Park, S., et al. Tissue-scale coordination of cellular behaviour promotes epidermal wound repair in live mice. Nature Cell Biology. 19 (2), 155-163 (2017).
- Tsai, C. -R., Wang, Y., Galko, M. J. Crawling wounded: molecular genetic insights into wound healing from Drosophila larvae. The International Journal of Developmental Biology. 62 (6-7-8), 479-489 (2018).
- Richardson, R., et al. Adult zebrafish as a model system for cutaneous wound-healing research. The Journal of Investigative Dermatology. 133 (6), 1655-1665 (2013).
- Erickson, J. R., Echeverri, K. Learning from regeneration research organisms: The circuitous road to scar free wound healing. Developmental Biology. 433 (2), 144-154 (2018).
- Kamran, Z., et al. In vivo imaging of epithelial wound healing in the cnidarian Clytia hemisphaerica demonstrates early evolution of purse string and cell crawling closure mechanisms. BMC Developmental Biology. 17 (1), 17(2017).
- Home. MARIMBA. , Available from: http://marimba.obs-vlfr.fr/home (2023).
- Chari, T., et al. Whole-animal multiplexed single-cell RNA-seq reveals transcriptional shifts across Clytia medusa cell types. Science Advances. 7 (48), (2021).
- Weissbourd, B., et al. A genetically tractable jellyfish model for systems and evolutionary neuroscience. Cell. 184 (24), 5854-5868 (2021).
- Momose, T., et al. High doses of CRISPR/Cas9 ribonucleoprotein efficiently induce gene knockout with low mosaicism in the hydrozoan Clytia hemisphaerica through microhomology-mediated deletion. Scientific Reports. 8 (1), 11734(2018).
- Houliston, E., Leclère, L., Munro, C., Copley, R. R., Momose, T. Past, present and future of Clytia hemisphaerica as a laboratory jellyfish. Current Topics in Developmental Biology. 147, 121-151 (2022).
- Schmid, V., et al. The extracellular matrix (mesoglea) of hydrozoan jellyfish and its ability to support cell adhesion and spreading. Hydrobiologia. 216 (1), 3-10 (1991).
- Day, R. M., Lenhoff, H. M. Hydra mesoglea: a model for investigating epithelial cell-basement membrane interactions. Science. 211 (4479), 291-294 (1981).
- Zhang, X., et al. The collagens of hydra provide insight into the evolution of metazoan extracellular matrices. The Journal of Biological Chemistry. 282 (9), 6792-6802 (2007).
- Danjo, Y., Gipson, I. K. Actin 'purse string' filaments are anchored by E-cadherin-mediated adherens junctions at the leading edge of the epithelial wound, providing coordinated cell movement. Journal of Cell Science. 111 (22), 3323-3332 (1998).
- Arenas Gómez, C. M., Sabin, K. Z., Echeverri, K. Wound healing across the animal kingdom: Crosstalk between the immune system and the extracellular matrix. Developmental Dynamics. 249 (7), 834-846 (2020).
- Lechable, M., et al. An improved whole life cycle culture protocol for the hydrozoan genetic model Clytia hemisphaerica. Biology Open. 9 (11), (2020).
- Casares, L., et al. Hydraulic fracture during epithelial stretching. Nature Materials. 14 (3), 343-351 (2015).
- Wayne, R. Chapter 4 - Bright-Field Microscopy. Light and Video Microscopy (Third Edition). , 95-116 (2019).
- Murphy, D. B., Davidson, M. W. Fundamentals of Light Microscopy and Electronic Imaging: Second Edition. , John Wiley and Sons. (2012).
- Micropipette Techniques for Electrophysiology. , Available from: https://www.sutter.com/micropipette/cookbook.html (2022).
- Brown, A. L., Johnson, B. E., Goodman, M. B. Making patch-pipettes and sharp electrodes with a programmable puller). Journal of Visualized Experiments. (20), e939(2008).
- Klarlund, J. K. Dual modes of motility at the leading edge of migrating epithelial cell sheets. Proceedings of the National Academy of Sciences. 109 (39), 15799-15804 (2012).
- Houliston, E., Momose, T., Manuel, M. Clytia hemisphaerica: a jellyfish cousin joins the laboratory. Trends in Genetics. 26 (4), 159-167 (2010).
- Rodrigues, M., Kosaric, N., Bonham, C. A., Gurtner, G. C. Wound healing: a cellular perspective. Physiological Reviews. 99 (1), 665-706 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados