Method Article
في الجسم الحي تصوير الدماغ بالكامل ليرقات الزرد باستخدام المجهر الفلوري ثلاثي الأبعاد
In This Article
Summary
يظهر هنا بروتوكول لتصوير الدماغ بالكامل في الجسم الحي ليرقات الزرد باستخدام المجهر الفلوري ثلاثي الأبعاد. يتضمن الإجراء التجريبي إعداد العينات والحصول على الصور والتصور.
Abstract
كحيوان نموذجي للفقاريات ، تستخدم اليرقات الزرد على نطاق واسع في علم الأعصاب وتوفر فرصة فريدة لمراقبة نشاط الدماغ بالكامل بدقة خلوية. هنا ، نقدم بروتوكولا محسنا لإجراء تصوير كامل للدماغ لسمك الزرد اليرقي باستخدام الفحص المجهري الفلوري ثلاثي الأبعاد ، بما في ذلك تحضير العينات وتجميدها ، وتضمين العينات ، والحصول على الصور ، والتصور بعد التصوير. يتيح البروتوكول الحالي التصوير في الجسم الحي للبنية والنشاط العصبي لدماغ الزرد اليرقية بدقة خلوية لأكثر من 1 ساعة باستخدام الفحص المجهري متحد البؤر والفحص المجهري الفلوري المصمم خصيصا. كما تمت مناقشة الخطوات الحاسمة في البروتوكول ، بما في ذلك تركيب العينات وتحديد مواقعها ، ومنع تكوين الفقاعات والغبار في هلام الأغاروز ، وتجنب الحركة في الصور الناتجة عن التصلب غير الكامل لهلام الأغاروز وشلل الأسماك. تم التحقق من صحة البروتوكول وتأكيده في إعدادات متعددة. يمكن تكييف هذا البروتوكول بسهولة لتصوير الأعضاء الأخرى لسمك الزرد اليرقات.
Introduction
تم اعتماد الزرد (Danio rerio) على نطاق واسع كحيوان فقاري نموذجي في علم الأعصاب ، نظرا لشفافيته البصرية في مرحلة اليرقات ، وتطوره السريع ، وتكلفة صيانته المنخفضة ، وتوافر الأدوات الوراثية المتنوعة1،2،3،4. على وجه الخصوص ، توفر الشفافية البصرية لليرقات جنبا إلى جنب مع مراسلي الفلورسنت المشفرين وراثيا للأحداث البيولوجية5،6،7،8،9 فرصة فريدة لتصوير كل من النشاط العصبي والبنية على مستوى الدماغ بالكامل10،11،12،13،14. ومع ذلك ، حتى مع وجود مجهر يدعم الدقة الخلوية ، فإن الصور المكتسبة لا تحتفظ بالضرورة بالمعلومات على مستوى الخلية الواحدة. قد تتدهور جودة الصورة البصرية بسبب الانحراف الناتج عن هلام الأغاروز المستخدم لتركيب العينات ، وقد يتم تركيب الأسماك بزاوية ، وبالتالي لا يتم احتواء مناطق الاهتمام بالكامل في مجال رؤية المجهر ، وقد تتحرك الأسماك أثناء التسجيل ، مما يتسبب في حدوث آثار متحركة في الصور أو إعاقة استخراج الإشارة الدقيقة من الصور.
وبالتالي ، هناك حاجة إلى بروتوكول فعال وقابل للتكرار للحصول على بيانات صورة عالية الجودة بأقل قدر من الضوضاء والحركة. لسوء الحظ ، فإن البروتوكولات المتاحة للجمهور لتصوير دماغ كامل من يرقات الزرد في الجسم الحي15،16،17،18،19 تصف الإجراء بإيجاز فقط ، تاركة أجزاء كبيرة من التفاصيل ، مثل تصلب الأغاروز ، وتقنيات التركيب الدقيقة ، وتحديد موضع العينة باستخدام الملقط ، حتى كل تجريبي. بالإضافة إلى ذلك ، يمكن أن تؤدي التناقضات في تركيز الأغاروز وطرق التثبيت10،11،14،15،16،17،18،19 إلى تحديات ناشئة عن حركة الأسماك أثناء عملية التصوير.
هنا ، يتم توفير بروتوكول مفصل لتصوير الدماغ بالكامل لليرقات الزرد باستخدام المجهر الفلوري ثلاثي الأبعاد. يقدم الشكل 1 نظرة عامة رسومية للبروتوكول: تحضير العينة وتجميدها ، وتضمين العينات ، والحصول على الصور ، والتصور بعد التصوير. يتم عرض التصوير الهيكلي والوظيفي لدماغ يرقات الزرد في الجسم الحي باستخدام مجهر تجاري متحد البؤر ومجهر مضان مصمم خصيصا. يمكن تصميم هذا البروتوكول من قبل الممارسين لتصوير الدماغ مع بعض المحفزات الحسية أو السياقات السلوكية اعتمادا على الاحتياجات التجريبية والتصميم.
Protocol
تمت الموافقة على جميع تجارب الزرد من قبل اللجنة المؤسسية لرعاية واستخدام الحيوانات (IACUC) التابعة ل KAIST (KA2021-125). ما مجموعه 12 من أسماك الزرد البالغة مع التعبير العصبي الشامل لمؤشر الكالسيوم GCaMP7a [Tg(huc:GAL4); تم استخدام Tg (UAS: GCaMP7a)] على خلفية كاسبر [mitfa (w2 / w2) ؛ mpv17 (a9 / a9)] للتكاثر. تألفت هذه المجموعة من ثماني إناث وأربعة ذكور ، تتراوح أعمارهم بين 3 و 12 شهرا. تم إجراء تجارب التصوير على يرقات الزرد في 3-4 أيام بعد الإخصاب (d.p.f.) ، وهي مرحلة لا يمكن خلالها تحديد جنسها.
1. تحضير عينة الزرد
- جمع الأجنة بعد تربية الأسماك البالغة من الخط المعدل وراثيا المطلوب ، مثل Tg (huc: GAL4) ؛ Tg (UAS: GCaMP7a) 20،21،22 ، في طبق بتري مملوء بماء البيض (انظر جدول المواد). ضع الأجنة في حاضنة عند 28 درجة مئوية وارفعها إلى 3-4 d.p.f. اليرقات23،24،25.
- إذا لم تكن خلفية الزرد ألبينو ، لمنع تكوين التصبغ ، انقل الأجنة في 24 ساعة بعد الإخصاب (h.p.f.) إلى طبق بتري مملوء بماء البيض الذي يحتوي على 200 ميكرومتر من 1-فينيل 2-ثيوريا (PTU ؛ انظر جدول المواد)25,26. كل 24 ساعة ، انقل السمك إلى طبق جديد بماء بيض طازج يحتوي على 200 ميكرومتر من وحدة PTU.
ملاحظة: يتم الحفاظ على الزرد في ظل الظروف القياسية عند 28 درجة مئوية ودورة الضوء 14:10 ساعة: الظلام. من المعروف أن علاج PTU يؤثر على سلوك ووظيفة الغدة الدرقية ليرقات الزرد27,28. لذلك ، من المهم استخدام PTU بحذر والتحكم بعناية في العوامل المربكة المحتملة في أي تجارب.
- إذا لم تكن خلفية الزرد ألبينو ، لمنع تكوين التصبغ ، انقل الأجنة في 24 ساعة بعد الإخصاب (h.p.f.) إلى طبق بتري مملوء بماء البيض الذي يحتوي على 200 ميكرومتر من 1-فينيل 2-ثيوريا (PTU ؛ انظر جدول المواد)25,26. كل 24 ساعة ، انقل السمك إلى طبق جديد بماء بيض طازج يحتوي على 200 ميكرومتر من وحدة PTU.
- للعثور على العينة التي تعبر عن البروتينات الفلورية ذات الأهمية (على سبيل المثال ، GCaMP7a عموم الخلايا العصبية) ، قم بفحص العينة تحت مجهر مضان epi-fluorescence وحدد عينة ذات تعبير ساطع.
- تحضير 3-4 d.p.f. عينة الزرد المختارة في طبق بتري مملوء بماء البيض (الشكل 2 أ).
ملاحظة: لتسجيل النشاط العصبي التلقائي ، يوصى باستخدام عينات تتراوح أعمارها بين 80-100 h.p.f. ، حيث أن مستوى النشاط التلقائي منخفض قبل 80 h.p.f. وتطور التصبغ ، حتى مع خلفية كاسبر ، قد يؤدي إلى تدهور جودة الصورة بعد 100 h.p.f. - تحضير محلول بروميد بانكورونيوم 0.25 ملغم/مل14،19،29،30،31 بإضافة 1 مل من محلول مخزون 2.5 ملغم/مل (انظر جدول المواد) إلى 10 مل من ماء البيض. قسمة محلول بروميد البانكورونيوم إلى أنابيب طرد مركزي دقيقة سعة 1.5 مل.
- انقل العينة التي تم فرزها مسبقا إلى طبق بتري باستخدام ماصة نقل.
ملاحظة: حاول حمل الحد الأدنى من حجم ماء البيض مع العينة. - نقل 0.1 مل من محلول بروميد البانكورونيوم إلى طبق بتري للشلل.
ملاحظة: بروميد Pancuronium له تأثير مثبط محتمل على النشاط العصبي في يرقات الزرد32. ومن الضروري النظر بعناية في تركيز ومدة التعرض لبروميد البانكورونيوم.
2. 2٪ (بالوزن / المجلد) إعداد هلام الاغاروز
- قم بتشغيل كتلة حرارية واضبط درجة الحرارة المستهدفة على 37 درجة مئوية. انتظر حتى تسخن الوحدة وتتوازن عند درجة الحرارة المحددة.
- قم بإذابة 0.2 جم من مسحوق الأغاروز منخفض الانصهار (انظر جدول المواد) في 10 مل من ماء البيض.
- سخني محلول الأغاروز في الميكروويف واخلطيه بالهز والدوامة حتى يذوب الأغاروز تماما.
- قم بتقسام هلام الأغاروز إلى أنابيب طرد مركزي دقيقة سعة 1.5 مل وتخزين أنابيب الطرد المركزي الدقيقة على كتلة الحرارة (الشكل 2 ب).
ملاحظة: تحقق مما إذا كانت الفقاعات الموجودة في هلام الأغاروز قد اختفت.
3. تركيب العينة وتحديد المواقع
- افحص العينة تحت المجهر المجسم للتحقق من توقف حركة اليرقات وتقييم صحة العينة بصريا عن طريق فحص نبضات قلبها (الشكل 2C). إذا كانت ضربات القلب بطيئة جدا، فتخلص من العينة.
ملاحظة: إذا كانت ضربات قلب الأسماك التي يتم تصويرها بطيئة جدا (على سبيل المثال ، أقل من 60 نبضة في الدقيقة) ، فقد لا يكون من الممكن إجراء تصوير طويل المدى. لتقييم صحة الأسماك ، يمكن فحص معدل ضربات القلب بصريا من خلال مقارنته بالأسماك الأخرى في نفس طبق بتري. سيساعد ذلك في ضمان أن الأسماك التي يتم تصويرها صحية ومستقرة بما يكفي لإجراء التصوير. - باستخدام ماصة النقل ، ضع يرقية واحدة من الزرد في هلام الأغاروز في أنبوب الطرد المركزي الدقيق سعة 1.5 مل (الشكل 2 د).
ملاحظة: تأكد من التخلص من الماصة بعد نقل العينة. - صب هلام agarose في طبق بتري لجعل معطف 1-2 ملم. نقل العينة في أنابيب الطرد المركزي الدقيقة إلى طبق بتري باستخدام ماصة النقل ، بحيث يتم وضع اليرقة في وسط الطبق.
ملاحظة: إذا كان هناك غبار وفقاعات في هلام الأغاروز ، فقم بإزالتها باستخدام ماصة النقل. - استخدم الملقط لوضع العينة في الاتجاه المطلوب بحيث يكون الرأس والذيل مسطحين (الشكل 2E).
- قم بتدوير العينة باستخدام ملقط بحيث تكون كلتا العينين مستويتين (الشكل 2F).
ملاحظة: يجب إكمال إجراءات المحاذاة (الموضع والدوران) قبل أن يبدأ هلام الأغاروز في التصلب. - بعد المحاذاة ، انتظر حتى يتجمد هلام الأغاروز (الشكل 2G ، H).
ملاحظة: يمكن أن يتراوح وقت الانتظار حتى يتجمد هلام الأغاروز من 5-10 دقائق ، اعتمادا على حجم وحجم الجل. - بعد تصلب هلام الأغاروز ، املأ طبق بتري بماء البيض وضع طبق بتري مع العينة المضمنة في مرحلة المجهر (الشكل 2I).
4. الحصول على الصور
- قم بتشغيل نظام المجهر (على سبيل المثال ، الليزر ، وأجهزة التحكم متحدة البؤر ، والمجهر ، والكمبيوتر ؛ انظر جدول المواد) وتحقق من أن النظام بأكمله يعمل.
- حدد عدسة موضوعية منخفضة التكبير وحدد موقع العينة في مركز مجال الرؤية.
- حدد عدسة موضوعية للغمر بالماء أو غمس الماء مع تكبير مناسب (على سبيل المثال، عدسة غمس الماء ذات فتحة رقمية 16x 0.8 (NA)؛ انظر جدول المواد). قم بإجراء تعديلات دقيقة على مجال الرؤية.
- اضبط معلمات التصوير (على سبيل المثال ، حجم الصورة ، وطاقة الليزر ، ووقت التعرض ، وعدد الإطارات) باستخدام برنامج الحصول على الصور.
ملاحظة: اضبط معلمات التصوير لتحقيق أفضل النتائج الممكنة لتلبية الاحتياجات المحددة (راجع الإعداد للحصول على الصور في قسم النتائج التمثيلية). إذا كانت الصورة مشبعة ، فقم بتقليل طاقة الليزر. - ابحث عن دماغ العينة عن طريق تحريك المرحلة وحدد سمكها باستخدام وضع العرض المباشر في البرنامج عن طريق تغيير المستويات البؤرية يدويا لأعلى ولأسفل. اضبط الحدود الدنيا والعليا لمستوى الصوت.
ملاحظة: تأكد من احتواء الدماغ بأكمله في مجال الرؤية على طول الاتجاهين الجانبي والمحوري. - اضبط حجم خطوة z مع مراعاة الدقة المحورية للمجهر.
ملاحظة: يعتمد الحجم الأمثل z-step لتصوير دماغ يرقات الزرد على طريقة التصوير ودقة المجهر. على سبيل المثال ، تم استخدام حجم خطوة z يبلغ 5 ميكرومتر بالنظر إلى سمك الصفيحة الخفيفة ومتوسط قطر أجسام الخلايا10. - تابع الحصول على الصورة لحقل الرؤية المحدد.
- للتصوير الهيكلي الحجمي ، احصل على صورة 3-D (x ، y ، z) للدماغ بأكمله عن طريق تغيير المستويات البؤرية والحصول على صور 2-D لكل مستوى z بالتتابع.
- للتصوير الوظيفي لطائرة z واحدة ، احصل على صور متسلسلة زمنية (x ، y ، t) للنشاط العصبي للدماغ على عمق معين.
- للتصوير الوظيفي الحجمي ، احصل على صورة 4-D (x ، y ، z ، t) للنشاط العصبي في الدماغ بأكمله عن طريق الحصول على صور 3-D بالتتابع.
ملاحظة: قم بتعيين عدد الإطارات مع مراعاة حجم الذاكرة المتوفرة للكمبيوتر. يوصى بوقت اكتساب أقل من 1 ساعة بسبب مدة تأثير بروميد البانكورونيوم.
- بعد الحصول على الصور ، احفظ النتائج وسجل معلمات التصوير (على سبيل المثال ، حجم البكسل ، وحجم الخطوة z ، ومعدل الإطارات ، وطاقة الليزر) لتحليل الصور.
- تصدير الصور بتنسيق مناسب لعرض البيانات وتحليل الصور.
ملاحظة: يوصى بتصدير الصور بتنسيق ملف صورة (TIF) ذي علامات العلامات. يدعم TIF ضغط الصور بدون فقدان البيانات ومتوافق مع معظم برامج معالجة الصور ولغات البرمجة. بالإضافة إلى ذلك ، يدعم تنسيق TIF تضمين البيانات الوصفية ، مثل معلمات الاستحواذ ودقة الصورة والمعلومات الأخرى ذات الصلة التي يمكن أن تساعد في تفسير البيانات وإمكانية تكرارها.
5. الإعداد للمرئيات باستخدام napari
ملاحظة: napari هو عارض صور متعدد الأبعاد مفتوح المصدر في بيئة Python مع عرض يستند إلى وحدة معالجة الرسومات (GPU)33. يوفر المكون الإضافي للرسوم المتحركة napari إنشاء برمجي للأفلام. يوصى باستخدام فيجي ، وهو برنامج مفتوح المصدر لمعالجة الصور ، لمعالجة الصور للأغراض العامة ، مثل التصفية والتحويل الهندسي (انظر جدول المواد). تتوفر التعليمات البرمجية المصدر المستخدمة للتصور باستخدام napari على GitHub (https://github.com/NICALab/Zebrafish-brain-visualization).
- قم بتثبيت ناباري وناباري للرسوم المتحركة باستخدام النقطة أو كوندا. بعد التثبيت ، قم بإنشاء ملف دفتر ملاحظات jupyter جديد.
ملاحظة: يوصى بالتشغيل باستخدام دفتر jupyter ، وهو أداة تفاعلية ل Python ، عبر برنامج Python النصي. - استيراد ناباري وناباري الرسوم المتحركة.
6. تصور الهياكل باستخدام ناباري
- لتصور الصور وإنشاء أفلام لدماغ الزرد المقدم ، قم بتحميل صورة 3-D (x ، y ، z) وافتح نافذة napari. قم بتوصيل المكون الإضافي للرسوم المتحركة napari (الشكل 3 أ).
- اضبط معلمات مثل حجم voxel وخريطة الألوان وحدود التباين في تحكمات الطبقة.
- اضبط إعدادات العارض (على سبيل المثال ، المنظور والزوايا) في اللوحة.
- لالتقاط الصورة المعروضة، اضغط على زر الالتقاط في معالج الرسوم المتحركة.
- لإنشاء أفلام بحجم الصوت المعروض ، قم بتعديل إعدادات العارض وإضافة إطارات رئيسية (الشكل 3 ب).
- بعد إضافة الإطارات الرئيسية ، قم بتعيين عدد الإطارات (الخطوات) بين الإطارات الرئيسية في معالج الرسوم المتحركة. احفظ الرسوم المتحركة المعروضة.
7. معالجة الصور وتصور النشاط العصبي باستخدام ناباري
ملاحظة: لتصور صور السلاسل الزمنية للنشاط العصبي كصور متراكبة لخلفية ونشاط ثابتين ، يجب تطبيق خوارزمية التحلل على الصور الأولية. استخدم تطبيق MATLAB لخوارزمية تحلل تسمى BEAR24. يتوفر إصدار MATLAB من BEAR على GitHub (https://github.com/NICALab/BEAR).
- لتحليل الخلفية الثابتة والنشاط العصبي ، قم بتطبيق BEAR على صور السلاسل الزمنية الأولية (x ، y ، t أو x ، y ، z ، t). بعد التحلل ، احفظ صور الخلفية والنشاط العصبي كملفات TIF (الشكل 3C).
- قم بتحميل الخلفية وصور النشاط العصبي وافتح نافذة napari. قم بتوصيل المكون الإضافي للرسوم المتحركة napari.
- استخدم خريطة ألوان رمادية لصور الخلفية وخريطة ألوان ساخنة لصور النشاط العصبي (الشكل 3C).
- اضبط معلمات مثل حدود العتامة والتباين في تحكمات الطبقة.
- لإنشاء أفلام للنشاط العصبي ، قم بتعديل إعدادات العارض وإضافة إطارات رئيسية لعرض الرسوم المتحركة.
- بعد إضافة الإطارات الرئيسية ، قم بتعيين عدد الإطارات (الخطوات) بين الإطارات الرئيسية في معالج الرسوم المتحركة. احفظ الرسوم المتحركة المعروضة.
النتائج
هيكل ونشاط الخلايا العصبية لأدمغة الزرد اليرقات التي تعبر عن مؤشر الكالسيوم عموم الخلايا العصبية GCaMP7a (Tg(huc:GAL4); Tg(UAS:GCaMP7a))20,21,22 مع كاسبر (mitfa(w2/w2);mpv17(a9/a9))34 تم تصوير الخلفية عند 3-4 d.p.f. باتباع البروتوكول الموصوف.
بالنسبة للتصوير الهيكلي الحجمي ، تم تصوير العينة باستخدام نظام مجهر متحد البؤر تجاري للمسح النقطي مزود بعدسة موضوعية لغمس الماء 16x 0.8 NA. تم استخدام ليزر إثارة 488 نانومتر لكل من التصوير الهيكلي والوظيفي. كان معدل الإطارات ودقة الصورة وحجم البكسل وحجم الخطوة المحورية 0.25 هرتز و 2048 × 2048 و 0.34 ميكرومتر و 1.225 ميكرومتر على التوالي. استغرق الحصول على الصورة حوالي 1 ساعة و 20 دقيقة. غطى مجال الرؤية الحجمي للصورة المكتسبة مناطق الدماغ في الدماغ الأمامي والدماغ المتوسط والدماغ الخلفي (الشكل 4 أ). كانت أجسام الخلايا العصبية للنخاع المستطيل ، الصفيحة المخيخية ، القفص البصري ، الحبال ، والدماغ الدماغي الظهري في الدماغ الكامل لسمك الزرد اليرقية 4 d.p.f. مرئية بوضوح في صور الفحص المجهري متحد البؤر (الشكل 4 ب). تم إجراء العرض ثلاثي الأبعاد للصور المجهرية متحدة البؤر باستخدام napari27 باتباع البروتوكول المذكور أعلاه (الشكل 4C والفيديو 1).
للتصوير الوظيفي في 2-D ، تم تصوير العينة باستخدام نفس نظام الفحص المجهري متحد البؤر ، المجهز بعدسة موضوعية لغمس الماء 16x 0.8 NA. كان معدل الإطارات ودقة الصورة وحجم البكسل 2 هرتز و 512 × 256 و 1.5 ميكرومتر على التوالي. كانت أجسام الخلايا العصبية مرئية بوضوح في كل من الخلفية والنشاط العصبي المتراكب (الشكل 5 أ ، ب).
بالنسبة للتصوير الوظيفي ثلاثي الأبعاد ، تم استخدام نظام الفحص المجهري ثلاثي الأبعاد18 المصمم خصيصا ، والذي كان قادرا على تصوير النشاط العصبي لدماغ الزرد اليرقية بالكامل في الجسم الحي مع مجال رؤية يبلغ 1040 ميكرومتر × 400 ميكرومتر × 235 ميكرومتر ودقة جانبية ومحورية تبلغ 1.7 ميكرومتر و 5.4 ميكرومتر على التوالي. كان معدل التصوير يصل إلى 4.2 حجم في الثانية. على غرار تقديم بيانات التصوير الهيكلي ، تم استخدام napari لتقديم 3-D لبيانات تصوير الكالسيوم في الدماغ بالكامل (الشكل 5C والفيديو 2).
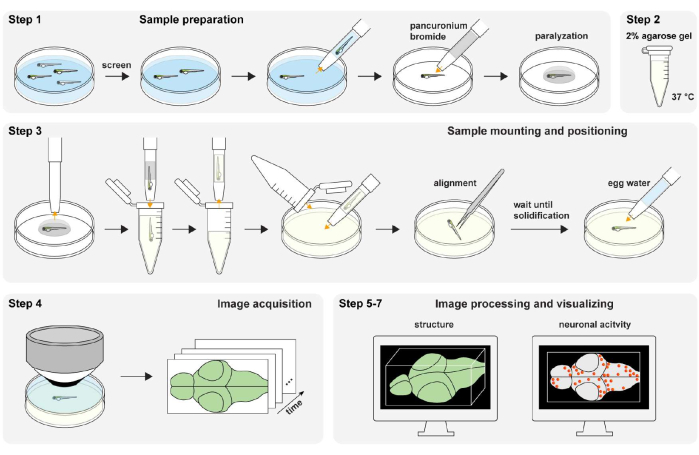
الشكل 1: نظرة عامة على الإجراء التجريبي. تحضير عينة الزرد والشلل (الخطوة 1). إعداد هلام الأغاروز 2٪ (بالوزن / المجلد) (الخطوة 2). تركيب العينة وتحديد موضعها (الخطوة 3). الحصول على الصور (الخطوة 4). معالجة الصور وتصور البنية والنشاط العصبي (الخطوة 5-7). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: إجراء تجريبي لإعداد تصوير الدماغ بالكامل . (أ) عينة من أسماك الزرد التي تم فحصها والتي تعبر عن GCaMP7a للخلايا العصبية في طبق بتري مملوء بماء البيض. (ب) المعدات والمواد اللازمة لتركيب العينات وتحديد مواقعها. (1) كتلة الحرارة عند 37 درجة مئوية ؛ (2) 2٪ (بالوزن / المجلد) هلام الأغاروز ؛ (3) أنبوب طرد مركزي دقيق 1.5 مل ؛ (4) ماء البيض. (5) 0.25 مغ/مل من محلول بروميد البانكورونيوم؛ (6) طبق بتري. (7) ملقط. (8) نقل ماصة. ج: صورة مجهرية مجسمة للعينة المشلولة. يشير السهم الأسود إلى قلب العينة. (د) تنقل العينة الموجودة في أنبوب الطرد المركزي الصغير الذي شدته 1.5 mL باستخدام ماصة. يظهر الجزء الداخلي عرضا مكبرا للمنطقة المحاصرة. (ه) توضع العينة (السهم الأسود) في وسط طبق بتري باستخدام الملقط. (و) محاذاة العينة باستخدام الملقط. (ز) مثال على عينة مضمنة غير محاذية. (ح) مثال على عينة مضمنة محاذاة. (I) توضع العينة على مرحلة المجهر تحت العدسة الموضوعية للحصول على الصور. شريط المقياس: 500 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
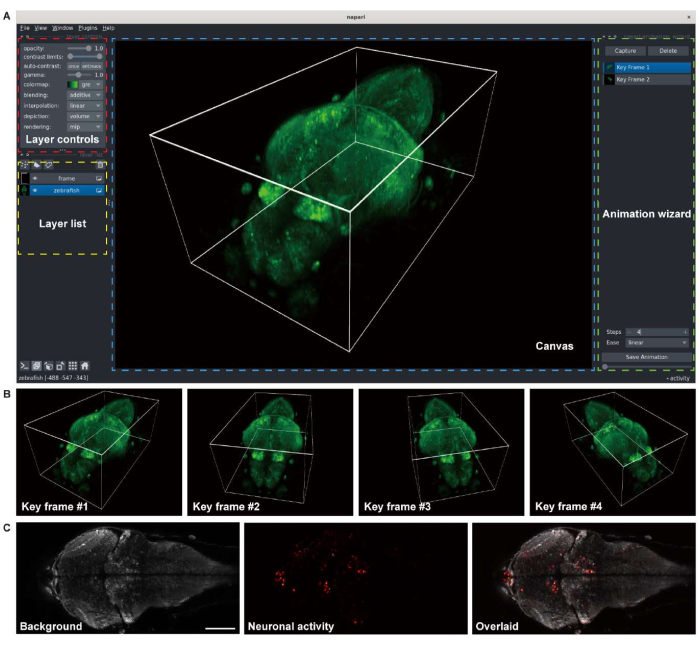
الشكل 3: تصور صور دماغ يرقات الزرد. (أ) التقديم ثلاثي الأبعاد لصورة مجهرية متحدة البؤر ليرقات الزرد (4 d.p.f) تعبر عن GCaMP7a للخلايا العصبية الشاملة. تم استخدام napari ، وهو عارض صور متعدد الأبعاد مفتوح المصدر في بيئة Python ، للعرض. تشتمل نافذة napari على عناصر تحكم طبقة (مربع أحمر) وقائمة طبقات (مربع أصفر) ولوحة قماشية (مربع أزرق) ومعالج رسوم متحركة (مربع أخضر). (B) تتم إضافة إطارات المفاتيح ذات إعدادات عارض متعددة لعرض رسم متحرك. (ج) صورة مجهرية متحدة البؤر لتصوير الفاصل الزمني 2-D للنشاط العصبي في دماغ الزرد اليرقات. تتحلل الصورة إلى الخلفية (يسار) والنشاط العصبي (الوسط) ، ثم تتراكب (يمين). شريط المقياس: 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
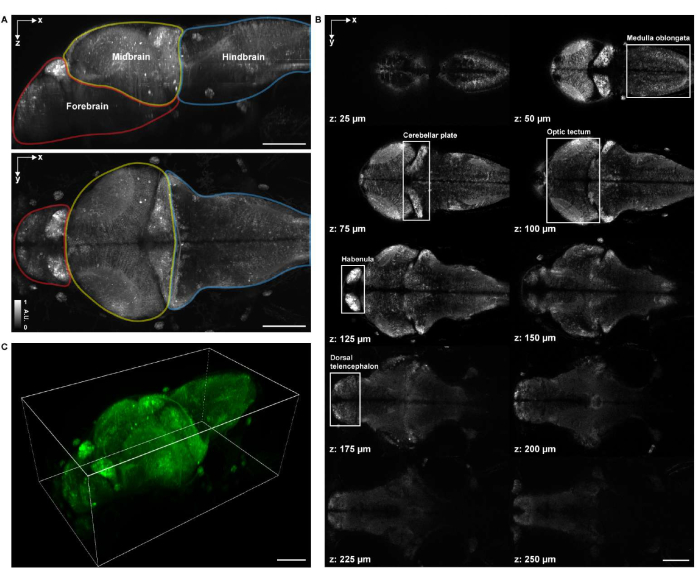
الشكل 4: التركيب التصويري لدماغ يرقات الزرد. (أ) الإسقاط الأقصى للكثافة (MIP) لصورة مجهرية متحدة البؤر ليرقات الزرد (4 d.p.f.) دماغية تعبر عن GCaMP7a للخلايا العصبية الشاملة. أعلى: MIP الجانبي. أسفل: MIP محوري. تحتوي كل حدود على الدماغ الأمامي (الأحمر) والدماغ المتوسط (الأصفر) والدماغ الخلفي (الأزرق). (ب) ما مجموعه 10 شرائح محورية على أعماق متعددة من صورة حجمية للدماغ (عند z = 25 ميكرومتر ، 50 ميكرومتر ، 75 ميكرومتر ، 100 ميكرومتر ، 125 ميكرومتر ، 150 ميكرومتر ، 175 ميكرومتر ، 200 ميكرومتر ، 225 ميكرومتر ، 250 ميكرومتر ، محسوبة لأعلى من أعلى إلى أسفل ؛ z = 0 ميكرومتر تشير إلى السطح العلوي للدماغ). يمثل كل صندوق أبيض منطقة الدماغ (النخاع المستطيل ، الصفيحة المخيخية ، القفص البصري ، الحبال ، والدماغ الدماغي الظهري). ج: الدماغ كله باستخدام الناباري. شريط المقياس: 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
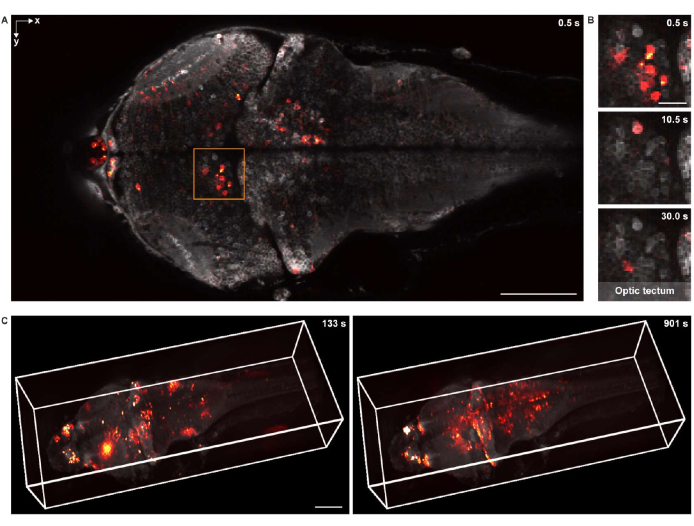
الشكل 5: تصوير النشاط العصبي لدماغ يرقات الزرد. (أ) صورة مجهرية متحدة البؤر للنشاط العصبي في يرقات الزرد (4 d.p.f.) الدماغ معبرا عن GCaMP7a عموم الخلايا العصبية. شريط المقياس: 100 ميكرومتر. (B) منظر موسع للمنطقة المحاصرة في A يوضح النشاط العصبي في القفص البصري في نقاط زمنية متعددة. شريط المقياس: 20 ميكرومتر. (ج) عرض 3-D للنشاط العصبي للدماغ بالكامل في دماغ الزرد اليرقية المكتسبة باستخدام مجهر مصمم خصيصا (يسار: t = 133 s ؛ اليمين: t = 901 s). يتم تثبيت النشاط العصبي على الخلفية الثابتة. شريط المقياس: 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
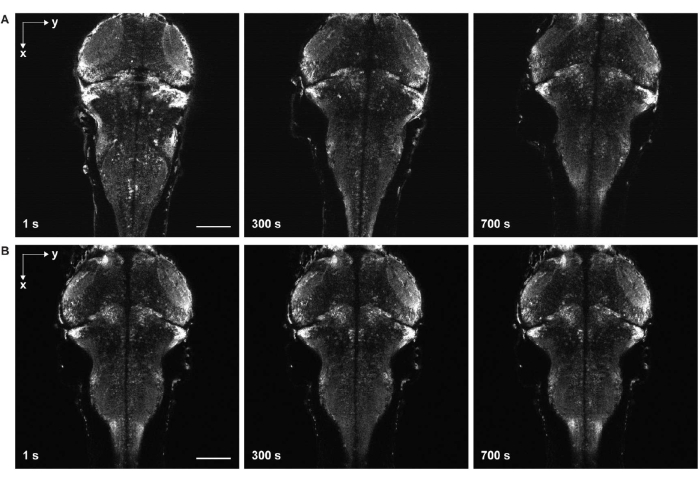
الشكل 6: التصوير بفاصل زمني مع انحراف العينة وبدونه . (أ) تصوير الفاصل الزمني لدماغ يرقات الزرد معبرا عن GCaMP7a للخلايا العصبية الشاملة مع انحراف العينة. تمت إضافة ماء البيض إلى العينة قبل تصلب هلام الأغاروز (الخطوة 3.6-3.7). تحركت الأسماك في الاتجاهين الجانبي والمحوري. ب: التصوير بفاصل زمني لدماغ يرقات الزرد دون انحراف العينة. تمت إضافة ماء البيض إلى العينة بعد تصلب هلام الأغاروز (الخطوة 3.6-3.7). شريط المقياس: 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
فيديو 1: عرض ثلاثي الأبعاد لبنية الدماغ الكاملة ليرقات الزرد (4 d.p.f.) الدماغ الذي يعبر عن GCaMP7a للخلايا العصبية. الرجاء الضغط هنا لتنزيل هذا الفيديو.
فيديو 2: عرض ثلاثي الأبعاد للنشاط العصبي للدماغ بالكامل في يرقات الزرد (4 d.p.f.) الدماغ الذي يعبر عن GCaMP7a للخلايا العصبية. الرجاء الضغط هنا لتنزيل هذا الفيديو.
Discussion
يتيح البروتوكول الحالي تصوير الدماغ بالكامل في الجسم الحي ليرقات الزرد على مدى فترة طويلة (على سبيل المثال ، أطول من 1 ساعة) وتصورات لبيانات التصوير الهيكلية والوظيفية المكتسبة.
الخطوات الأكثر أهمية هي تركيب العينة وتحديد المواقع. أثناء تضمين العينة ، من الضروري منع تكوين الفقاعات وتجنب الغبار في هلام الأغاروز. إذا كان الجل يحتوي على فقاعات هواء وغبار ، فقد تتدهور جودة الصورة بشدة. أثناء وضع العينة باستخدام الملقط ، من المهم التأكد من أن العينة مستوية أفقيا ورأسيا. خلاف ذلك ، قد لا يتم احتواء مناطق الاهتمام في مجال رؤية المجهر. بالإضافة إلى ذلك ، يجب أن يتم هذا الوضع في غضون فترة زمنية قصيرة قبل تصلب هلام الأغاروز لتجنب التسبب في تلف سطحه ، لأن هذا الضرر يضر بجودة الصورة.
التحدي الرئيسي الآخر هو تجنب الحركة في الصور التي تأتي من التصلب غير الكامل لهلام الأغاروز (الشكل 6) وشلل الزرد. عند إضافة ماء البيض إلى العينة قبل التصلب الكامل لهلام الأغورس ، تتحرك الأسماك ببطء أفقيا ومحوريا ، وتظهر على شكل انجراف العينة في صور السلاسل الزمنية (الشكل 6 أ). إذا كانت جرعة المشلولة غير كافية أو انتهت مدة التأثير ، فقد تحاول العينة التحرك ، والتي تظهر على شكل ارتعاش سريع في صور الفاصل الزمني.
على الرغم من أهمية الخطوات المذكورة أعلاه للحصول على صور عالية الجودة بدون قطع أثرية متحركة ، فإن البروتوكولات المتاحة للجمهور15،16،17،18،19 لا تقدم سوى لمحة موجزة عن الإجراء التجريبي ، وتفتقر إلى هذه التفاصيل. على سبيل المثال ، تعاني الصور التي تم الحصول عليها بدون بروتوكولات الشلل11 من عناصر الحركة الكبيرة التي تجعل تحليل الصورة النهائية أمرا صعبا. من خلال دمج المكونات الأساسية ، مثل تصلب هلام الأغاروز وشلل العينات ، يعزز بروتوكولنا بشكل كبير الاتساق في جودة الصور المكتسبة مع تقليل عناصر الحركة.
باختصار ، تم وصف إجراء تجريبي محسن وقابل للتكرار للتصوير في الجسم الحي لدماغ الزرد اليرقات. تم تأكيد صحة وقابلية استنساخ هذا البروتوكول للتصوير في الجسم الحي لنشاط الدماغ وبنيته في إعدادات متعددة14،18،29،30،31. ركز سير العمل الحالي على تصوير الدماغ بالكامل لأسماك الزرد اليرقية ، ولكن يمكن تطبيقه بسهولة على تصوير أعضاء أخرى من يرقات الزرد35،36.
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
تم توفير خطوط الزرد المستخدمة في تصوير الكالسيوم من قبل مركز الزرد لنمذجة الأمراض (ZCDM) ، كوريا. تم دعم هذا البحث من قبل المؤسسة الوطنية للبحوث الكورية (2020R1C1C1009869 ، NRF2021R1A4A102159411 ، RS-2023-00209473).
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tube | SciLab | SL.Tub3513 | To aliquot agarose gel and pancuronium bromide solution |
| 15 mL Falcon tubes | Falcon | 352096 | To prepare agarose gel and pancuronium bromide solution |
| 16× 0.8NA water dipping objective lens | Nikon | CFI75 LWD 16×W | Objective lens for whole-brain imaging |
| 1-phenyl 2-thiourea (PTU) | Sigma-Aldrich | P7629-10G | 200 μM of 1-phenyl 2-thiourea (PTU) |
| 50 mL Falcon tubes | Falcon | 352070 | To prepare egg water |
| Disposable transfer pipette | SciLab | SL.Pip3032 | To transfer zebrafish larvae |
| Egg water | N/A | N/A | 0.6 g sea salt in 10 L deionized water |
| Forceps | Karl Hammacher GmbH | HSO 010-10 | Forceps used for sample positioning |
| Low melting point agarose | Thermo Scientific | R0801 | 2% (wt/vol) agarose gel |
| Napari | Napari | N/A | To visualize microscopy images in 3-D |
| NIS-Elements C | Nikon | N/A | Imaging software for confocal microscope |
| Pancuronium bromide | Sigma-Aldrich | P1918-10MG | 0.25 mg/mL of pancuronium bromide solution |
| Petri dish, 35 mm | SPL Life Sciences | 11035 | Petri dish used for sample embedding |
| Petri dish, 55 mm | SPL Life Sciences | 11050 | To prepare zebrafish larvae after screening |
| Point-scanning confocal microscopy system (C2 Plus) | Nikon | N/A | Confocal microscope for whole-brain imaging |
| Sea salt | Sigma-Aldrich | S9883-500G | Sea salt used for preparing egg water |
References
- Choi, T. -. Y., Choi, T. -. I., Lee, Y. -. R., Choe, S. -. K., Kim, C. -. H. Zebrafish as an animal model for biomedical research. Experimental & Molecular Medicine. 53 (3), 310-317 (2021).
- Ahrens, M. B., et al. Brain-wide neuronal dynamics during motor adaptation in zebrafish. Nature. 485 (7399), 471-477 (2012).
- Panier, T., et al. Fast functional imaging of multiple brain regions in intact zebrafish larvae using selective plane illumination microscopy. Frontiers in Neural Circuits. 7, 65 (2013).
- Bianco, I. H., Kampff, A. R., Engert, F. Prey capture behavior evoked by simple visual stimuli in larval zebrafish. Frontiers in Systems Neuroscience. 5, 101 (2011).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. Journal of Neuroscience. 32 (40), 13819-13840 (2012).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Piatkevich, K. D., et al. A robotic multidimensional directed evolution approach applied to fluorescent voltage reporters. Nature Chemical Biology. 14 (4), 352-360 (2018).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nature Methods. 6 (12), 875-881 (2009).
- Looger, L., et al. Fast and sensitive GCaMP calcium indicators for imaging neural populations. Biorxiv. , (2021).
- Ahrens, M. B., Orger, M. B., Robson, D. N., Li, J. M., Keller, P. J. Whole-brain functional imaging at cellular resolution using light-sheet microscopy. Nature Methods. 10 (5), 413-420 (2013).
- Prevedel, R., et al. Simultaneous whole-animal 3D imaging of neuronal activity using light-field microscopy. Nature Methods. 11 (7), 727-730 (2014).
- Chhetri, R. K., et al. Whole-animal functional and developmental imaging with isotropic spatial resolution. Nature Methods. 12 (12), 1171-1178 (2015).
- Ahrens, M. B., Engert, F. Large-scale imaging in small brains. Current Opinion in Neurobiology. 32, 78-86 (2015).
- Yoon, Y. -. G., et al. Sparse decomposition light-field microscopy for high speed imaging of neuronal activity. Optica. 7 (10), 1457-1468 (2020).
- Randlett, O., et al. Whole-brain activity mapping onto a zebrafish brain atlas. Nature Methods. 12 (11), 1039-1046 (2015).
- Cong, L., et al. Rapid whole brain imaging of neural activity in freely behaving larval zebrafish (Danio rerio). eLife. 6, e28158 (2017).
- Bruzzone, M., et al. Whole brain functional recordings at cellular resolution in zebrafish larvae with 3D scanning multiphoton microscopy. Scientific Reports. 11 (1), 11048 (2021).
- Cho, E. -. S., Han, S., Lee, K. -. H., Kim, C. -. H., Yoon, Y. -. G. 3DM: deep decomposition and deconvolution microscopy for rapid neural activity imaging. Optics Express. 29 (20), 32700-32711 (2021).
- Zhang, Z., et al. Imaging volumetric dynamics at high speed in mouse and zebrafish brain with confocal light field microscopy. NatureBiotechnology. 39 (1), 74-83 (2021).
- Muto, A., Ohkura, M., Abe, G., Nakai, J., Kawakami, K. Real-time visualization of neuronal activity during perception. Current Biology. 23 (4), 307-311 (2013).
- Köster, R. W., Fraser, S. E. Tracing transgene expression in living zebrafish embryos. Developmental Biology. 233 (2), 329-346 (2001).
- Park, H. C., et al. Analysis of upstream elements in the HuC promoter leads to the establishment of transgenic zebrafish with fluorescent neurons. Developmental Biology. 227 (2), 279-293 (2000).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: an introduction. Journal of Visualized Experiments. (69), e4196 (2012).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). 4th edition. , (2000).
- Morsch, M., et al. Triggering cell stress and death using conventional UV laser confocal microscopy. Journal of Visualized Experiments. (120), e54983 (2017).
- Antinucci, P., Hindges, R. A crystal-clear zebrafish for in vivo imaging. Scientific Reports. 6, 29490 (2016).
- Parker, M. O., Brock, A. J., Millington, M. E., Brennan, C. H. Behavioral phenotyping of casper mutant and 1-pheny-2-thiourea treated adult zebrafish. Zebrafish. 10 (4), 466-471 (2013).
- Elsalini, O. A., Rohr, K. B. Phenylthiourea disrupts thyroid function in developing zebrafish. Development Genes and Evolution. 212 (12), 593-598 (2003).
- Han, S., Cho, E. -. S., Park, I., Shin, K., Yoon, Y. -. G. Efficient neural network approximation of robust PCA for automated analysis of calcium imaging data. Medical Image Computing and Computer Assisted Intervention. , 595-604 (2021).
- Shin, C., et al. Three-dimensional fluorescence microscopy through virtual refocusing using a recursive light propagation network. Medical Image Analysis. 82, 102600 (2022).
- Eom, M., et al. Statistically unbiased prediction enables accurate denoising of voltage imaging data. bioRxiv. , (2022).
- Johnston, L., et al. Electrophysiological recording in the brain of intact adult zebrafish. Journal of Visualized Experiments. (81), e51065 (2013).
- Sofroniew, N., et al. napari: a multi-dimensional image viewer for Python. Zenodo. , 3555620 (2022).
- White, R. M., et al. Transparent adult zebrafish as a tool for in vivo transplantation analysis. Cell Stem Cell. 2 (2), 183-189 (2008).
- Mickoleit, M., et al. High-resolution reconstruction of the beating zebrafish heart. Nature Methods. 11 (9), 919-922 (2014).
- Voleti, V., et al. Real-time volumetric microscopy of in vivo dynamics and large-scale samples with SCAPE 2.0. Nature Methods. 16 (10), 1054-1062 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved