Method Article
インビボ 3次元蛍光顕微鏡を用いたゼブラフィッシュ幼生の全脳イメージング
要約
ここでは、3次元蛍光顕微鏡を用いたゼブラフィッシュ仔魚の in vivo 全脳イメージングのプロトコルを紹介します。実験手順には、サンプル調製、画像取得、および視覚化が含まれます。
要約
脊椎動物のモデル動物として、仔魚ゼブラフィッシュは神経科学で広く使用されており、細胞分解能で全脳活動を監視するユニークな機会を提供します。ここでは、サンプルの調製と固定化、サンプルの埋め込み、画像の取得、イメージング後の視覚化など、3次元蛍光顕微鏡を使用してゼブラフィッシュ仔魚の全脳イメージングを行うための最適化されたプロトコルを提供します。現在のプロトコルは、共焦点顕微鏡とカスタム設計の蛍光顕微鏡を使用して、1時間以上にわたって細胞分解能でゼブラフィッシュ仔魚の脳の構造とニューロン活動の in vivo イメージングを可能にします。サンプルの取り付けと位置決め、アガロースゲル内の気泡形成とほこりの防止、アガロースゲルの不完全な固化と魚の麻痺によって引き起こされる画像の動きの回避など、プロトコルの重要なステップについても説明します。プロトコルは、複数の設定で検証および確認されています。このプロトコルは、ゼブラフィッシュの幼虫の他の器官を画像化するために容易に適合させることができる。
概要
ゼブラフィッシュ(Danio rerio)は、幼虫期の光透過性、迅速な発育、低い維持費、および多様な遺伝的ツールの利用可能性により、神経科学のモデル脊椎動物として広く採用されています1,2,3,4。特に、生物学的事象の遺伝的にコードされた蛍光レポーターと組み合わせた幼虫の光透過性5,6,7,8,9は、全脳レベルでニューロン活動と構造の両方を画像化するユニークな機会を提供します10,11,12,13,14.しかし、細胞の解像度をサポートする顕微鏡を使用しても、取得した画像は必ずしも単一細胞レベルで情報を保持するとは限りません。試料の装着に使用したアガロースゲルによる収差により光学画質が低下したり、魚が斜めに装着されたりして、関心領域が顕微鏡の視野内に完全に収まらず、記録中に魚が移動し、画像にモーションアーチファクトが発生したり、画像からの正確な信号抽出が妨げられたりする可能性があります。
したがって、ノイズと動きを最小限に抑えて高品質の画像データを取得するには、効果的で再現性のあるプロトコルが必要です。残念ながら、ゼブラフィッシュ仔魚の全脳をin vivoでイメージングするための公開プロトコル15、16、17、18、19は手順を簡単に説明しているだけで、アガロースの固化、正確な取り付け技術、鉗子を使用したサンプルの位置決めなど、詳細のかなりの部分を各実験者に任せています。さらに、アガロース濃度および固定化方法10、11、14、15、16、17、18、19における不一致は、イメージングプロセス中の魚の動きから生じる課題につながる可能性があります。
ここでは、3次元蛍光顕微鏡を用いたゼブラフィッシュ仔魚の全脳イメージングのための詳細なプロトコルを提供する。 図1 は、サンプル調製と固定化、サンプル埋め込み、画像取得、イメージング後の視覚化など、プロトコルの概要をグラフィカルに示しています。 in vivoでの ゼブラフィッシュ幼生脳の構造的および機能的イメージングは、市販の共焦点顕微鏡とカスタム設計の蛍光顕微鏡を使用して実証されています。このプロトコルは、実験のニーズとデザインに応じて、特定の感覚刺激または行動コンテキストを備えた脳イメージングのために開業医によって調整できます。
プロトコル
すべてのゼブラフィッシュ実験は、KAIST(KA2021-125)の施設動物管理使用委員会(IACUC)によって承認されました。カルシウム指標GCaMP7a[Tg(huc:GAL4)]の全神経細胞発現を有する合計12匹の成体ゼブラフィッシュ;Tg(UAS:GCaMP7a)]をキャスパー[mitfa(w2/w2);mpv17(a9/a9)]バックグラウンドで育種に用いた。このグループは、8人の女性と4人の男性で構成され、年齢は3か月から12か月までさまざまでした。ゼブラフィッシュ仔魚の画像実験は、受精後3〜4日(d.p.f.)に行われました。
1. ゼブラフィッシュサンプル調製
- Tg(huc:GAL4)などの所望のトランスジェニック系統の成魚を繁殖させた後に胚を収集する。Tg(UAS:GCaMP7a)20,21,22、卵水で満たされたペトリ皿(材料の表を参照)。胚を28°Cのインキュベーターに入れ、3〜4 d.p.f.幼虫23、24、25に上げます。
- ゼブラフィッシュの背景がアルビノでない場合、色素沈着の形成を抑制するために、受精後24時間(h.p.f.)で胚を200μMの1-フェニル2-チオ尿素(PTU;材料表を参照)を含む卵水で満たされたペトリ皿に移します25,26。24時間ごとに、200μMのPTUを含む新鮮な卵水で魚を新しい皿に移します。
注:ゼブラフィッシュは、28°Cと14:10時間の明暗サイクルで標準条件下で維持されます。PTU治療は、ゼブラフィッシュの幼虫の行動と甲状腺機能に影響を与えることが知られています27,28。したがって、PTUは注意して使用し、実験では潜在的な交絡因子を注意深く制御することが重要です。
- ゼブラフィッシュの背景がアルビノでない場合、色素沈着の形成を抑制するために、受精後24時間(h.p.f.)で胚を200μMの1-フェニル2-チオ尿素(PTU;材料表を参照)を含む卵水で満たされたペトリ皿に移します25,26。24時間ごとに、200μMのPTUを含む新鮮な卵水で魚を新しい皿に移します。
- 目的の蛍光タンパク質(汎ニューロンGCaMP7aなど)を発現するサンプルを見つけるには、落射蛍光顕微鏡でサンプルをスクリーニングし、明るい発現を持つサンプルを選択します。
- 選択した3〜4 d.p.f.卵水で満たされたペトリ皿でゼブラフィッシュサンプルを準備します(図2A)。
注:自発的な神経活動を記録するには、80 h.p.f.より前の自発的活動のレベルが低く、色素沈着の発達は、キャスパーの背景があっても100 h.p.f.後に画質が低下する可能性があるため、80〜100 h.p.f.の間のサンプルを使用することをお勧めします。 - 10 mLの卵水に1 mLの2.5 mg / mLストック溶液(材料の表を参照)を加えて、0.25 mg / mLの臭化パンクロニウム溶液14,19、29、30、31を準備します。臭化パンクロニウム溶液を1.5 mLの微量遠心チューブに分注します。
- 事前にスクリーニングしたサンプルをトランスファーピペットを使用してペトリ皿に移します。
注意: サンプルと一緒に最小量の卵水を持ち越すようにしてください。 - 0.1 mLの臭化パンクロニウム溶液を麻痺のためにペトリ皿に移します。
注:臭化パンクロニウムは、ゼブラフィッシュの幼虫の神経活動に潜在的な減衰効果があります32。臭化パンクロニウムへの曝露の濃度と期間を慎重に検討することが不可欠です。
2. 2%(wt/vol)アガロースゲル調製
- ヒートブロックの電源を入れ、目標温度を37°Cに設定します。 ユニットが熱くなり、設定温度で平衡化するのを待ちます。
- 0.2 gの低融点アガロース粉末( 材料の表を参照)を10 mLの卵水に溶解します。
- アガロース溶液を電子レンジで加熱し、アガロースが完全に溶解するまで振とうしてボルテックスして混合します。
- アガロースゲルを1.5 mLの微量遠心チューブに分注し、マイクロ遠心チューブをヒートブロックに保管します(図2B)。
注意: アガロースゲルの気泡が消えたかどうかを確認してください。
3. サンプルの取り付けと位置決め
- 実体顕微鏡でサンプルをチェックして、幼虫の動きが止まったことを確認し、心拍をチェックしてサンプルの健康状態を視覚的に評価します(図2C)。ハートビートが遅すぎる場合は、サンプルを破棄します。
注:画像化されている魚の心拍が遅すぎる場合(たとえば、毎分60拍未満)、長期間の画像化を実行できない場合があります。魚の健康状態を評価するために、心拍数は同じペトリ皿内の他の魚と比較することによって視覚的にチェックすることができます。これは、画像化される魚が画像化手順に十分健康で安定していることを確認するのに役立ちます。 - トランスファーピペットを使用して、1匹のゼブラフィッシュを1.5 mLマイクロ遠心チューブ内のアガロースゲルに入れます(図2D)。
注意: サンプルを移した後は、必ずピペットを廃棄してください。 - アガロースゲルをペトリ皿に注ぎ、1〜2 mmのコートを作ります。トランスファーピペットを使用して微量遠心チューブ内のサンプルをペトリ皿に移し、幼虫を皿の中央に置きます。
注意: アガロースゲルにほこりや気泡がある場合は、トランスファーピペットを使用してそれらを取り除きます。 - 鉗子を使用して、頭と尾が平らになるようにサンプルを目的の方向に配置します(図2E)。
- 両目が水平になるように鉗子を使用してサンプルを回転させます(図2F)。
注意: アガロースゲルが固化し始める前に、位置合わせ手順(位置と回転)を完了する必要があります。 - アライメント後、アガロースゲルが固まるまで待ちます(図2G、H)。
注:アガロースゲルが固化するまでの待ち時間は、ゲルの容量とサイズに応じて、5〜10分の範囲です。 - アガロースゲルを固化させた後、シャーレに卵水を入れ、サンプルを埋め込んだシャーレを顕微鏡ステージに置きます(図2I)。
4. 画像取得
- 顕微鏡システム(レーザー、共焦点コントローラー、顕微鏡、コンピューターなど、 材料表を参照)の電源を入れ、システム全体が機能していることを確認します。
- 低倍率の対物レンズを選択し、視野の中央にサンプルを配置します。
- 適切な倍率の水浸または水浸対物レンズを選択します(例:16x 0.8開口数(NA)水浸レンズ; 材料表を参照)。視野を微調整します。
- 画像取得ソフトウェアを使用して、イメージングパラメータ(画像サイズ、レーザー出力、露光時間、フレーム数など)を設定します。
注意: 特定のニーズに対して可能な限り最良の結果が得られるようにイメージングパラメータを設定します(代表的な結果セクションの画像取得のセットアップを参照してください)。画像が飽和している場合は、レーザー出力を下げます。 - ステージを動かしてサンプルの脳を見つけ、焦点面を手動で上下に変更することにより、ソフトウェアのライブビューモードを使用してその厚さを決定します。音量の下限と上限を設定します。
注意: 脳全体が横方向と軸方向の両方に沿って視野に含まれていることを確認してください。 - 顕微鏡の軸方向分解能を考慮してzステップサイズを設定します。
注:ゼブラフィッシュの幼虫の脳をイメージングするのに最適なzステップサイズは、イメージングモダリティと顕微鏡の解像度によって異なります。一例として、ライトシートの厚さとセル本体10の平均直径を考慮して、5μmのzステップサイズを使用した。 - 設定した視野の画像取得を進めます。
- 体積構造イメージングでは、焦点面を変えて各z面の2次元画像を順次取得することで、脳全体の3次元画像(x,y,z)を取得します。
- 単一のz平面の機能イメージングでは、特定の深さでの脳の神経活動の時系列画像(x、y、t)を取得します。
- 体積機能イメージングでは、3次元画像を順次取得することにより、脳全体の神経活動の4次元画像(x,y,z,t)を取得します。
メモ: コンピュータの使用可能なメモリサイズを考慮してフレーム数を設定します。臭化パンクロニウムの効果の持続時間のために、1時間未満の取得時間が推奨される。
- 画像を取得した後、結果を保存し、画像分析のためにイメージングパラメータ(ピクセルサイズ、zステップサイズ、フレームレート、レーザーパワーなど)を記録します。
- データのレンダリングと画像解析に適した形式で画像をエクスポートします。
注: タグ付きイメージ ファイル (TIF) 形式のイメージをエクスポートすることをお勧めします。TIFは可逆画像圧縮をサポートし、ほとんどの画像処理ソフトウェアおよびプログラミング言語と互換性があります。さらに、TIF形式は、取得パラメータ、画像解像度、およびデータの解釈と再現性に役立つその他の関連情報などのメタデータの組み込みをサポートしています。
5. napari を使用したビジュアライゼーションのセットアップ
注:napariは、グラフィックスプロセッシングユニット(GPU)ベースのレンダリング33を備えたPython環境におけるオープンソースの多次元画像ビューアです。ナパリアニメーションプラグインは、プログラムによる映画の作成を提供します。フィルタリングや幾何学的変換などの汎用画像処理には、オープンソースの画像処理プログラムであるFijiを使用することをお勧めします( 材料表を参照)。napari を使用したビジュアライゼーションに使用したソースコードは、GitHub (https://github.com/NICALab/Zebrafish-brain-visualization) で入手できます。
- pipまたはcondaのいずれかを使用してナパリとナパリアニメーションをインストールします。インストール後、新しい jupyter ノートブック ファイルを作成します。
注: Python スクリプトよりも、Python 用の対話型ツールである jupyter ノートブックで実行することをお勧めします。 - ナパリとナパリアニメーションをインポートします。
6. ナパリを使った構造物の可視化
- レンダリングされたゼブラフィッシュの脳の画像を視覚化し、ムービーを作成するには、3-D 画像 (x、y、z) を読み込み、napari ウィンドウを開きます。ナパリアニメーションプラグインを接続します(図3A)。
- ボクセル サイズ、カラーマップ、コントラスト制限などのパラメーターをレイヤー コントロールに設定します。
- キャンバスでビューアの設定(遠近法、角度など)を調整します。
- レンダリング イメージをキャプチャするには、アニメーション ウィザードで キャプチャ ボタンを押します。
- レンダリングされたボリュームのムービーを生成するには、ビューアの設定を変更し、キーフレームを追加します(図3B)。
- キーフレームを追加した後、アニメーションウィザードでキーフレーム間のフレーム数(ステップ)を設定します。レンダリングされたアニメーションを保存します。
7. napariを用いた神経活動の画像処理と可視化
注:神経活動の時系列画像を静的な背景と活動のオーバーレイ画像として視覚化するには、分解アルゴリズムを生の画像に適用する必要があります。BEAR24 と呼ばれる分解アルゴリズムの MATLAB 実装を使用します。BEARのMATLABバージョンはGitHub(https://github.com/NICALab/BEAR)で入手できます。
- 静的な背景とニューロンの活動を分解するには、生の時系列画像(x、y、tまたはx、y、z、t)にBEARを適用します。分解後、背景と神経活動の画像をTIFファイルとして保存します(図3C)。
- 背景画像と神経活動画像を読み込み、napariウィンドウを開きます。ナパリアニメーションプラグインを接続します。
- 背景画像にはグレーのカラーマップを使用し、ニューロン活動画像にはホットカラーマップを使用します(図3C)。
- レイヤーコントロールで不透明度やコントラスト制限などのパラメーターを設定します。
- ニューロン活動のムービーを生成するには、ビューアの設定を変更し、キーフレームを追加してアニメーションをレンダリングします。
- キーフレームを追加した後、アニメーションウィザードでキーフレーム間のフレーム数(ステップ)を設定します。レンダリングされたアニメーションを保存します。
結果
カルシウム指標汎神経細胞GCaMP7a(Tg(huc:GAL4)を発現するゼブラフィッシュ仔魚脳の構造と神経活動;Tg(UAS:GCaMP7a))20,21,22をキャスパー(mitfa(w2/w2);mpv17(a9/a9))34バックグラウンドを用いて、記載されたプロトコルに従って3-4 d.p.f.で撮像した。
体積構造イメージングのために、試料は、16x 0.8NA水浸対物レンズを備えた市販の点走査共焦点顕微鏡システムを使用して画像化されました。488 nm励起レーザーを構造イメージングと機能イメージングの両方に使用しました。フレームレート、画像解像度、ピクセルサイズ、および軸方向ステップサイズは、それぞれ0.25Hz、2048 x 2048、0.34 μm、および1.225 μmでした。画像取得には約1時間20分かかりました。取得した画像の体積視野は、前脳、中脳、後脳の脳領域をカバーしていました(図4A)。4 d.p.f.ゼブラフィッシュ仔魚の全脳の延髄、小脳板、視蓋、手綱、背側終脳の神経細胞体が共焦点顕微鏡画像ではっきりと見えました(図4B)。共焦点顕微鏡画像の3Dレンダリングは、前述のプロトコルに従ってnapari27 を使用して実行されました(図4C および ビデオ1)。
2次元での機能イメージングのために、標本は、16x 0.8NA水浸対物レンズを備えた同じ共焦点顕微鏡システムを使用してイメージングされました。フレームレート、画像解像度、ピクセルサイズは、それぞれ2Hz、512 x 256、および1.5 μmでした。ニューロン細胞体は、バックグラウンドと重ね合わせたニューロン活動の両方ではっきりと見えました(図5A、B)。
3−D機能イメージングのために、カスタム設計の3−顕微鏡システム18 が使用され、これは、1,040μm×400μm×235μmの視野およびそれぞれ1.7μmおよび5.4μmの横方向および軸方向の分解能を有するゼブラフィッシュ幼生脳全体のニューロン活動を in vivo でイメージングすることができた。イメージングレートは最大4.2ボリューム/秒でした。構造イメージングデータのレンダリングと同様に、napariは全脳カルシウムイメージングデータの3Dレンダリングに使用されました(図5C および ビデオ2)。
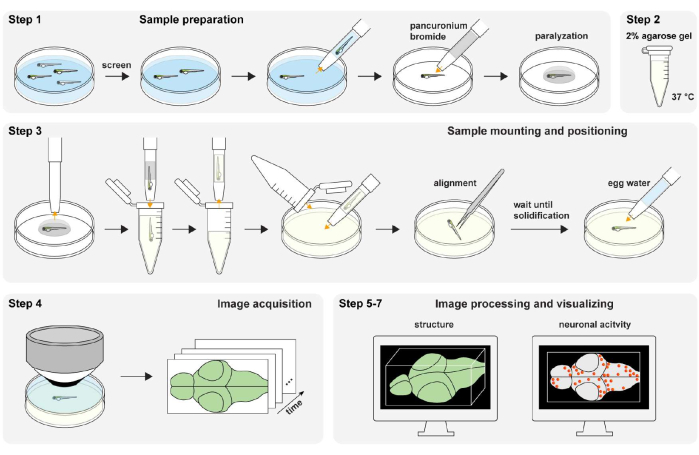
図1:実験手順の概要。 ゼブラフィッシュサンプルの調製と麻痺(ステップ1)。2%(wt/vol)アガロースゲル調製(ステップ2)。サンプルの取り付けと位置決め(ステップ3)。画像取得(ステップ4)。画像処理、構造および神経活動を可視化する(ステップ5−7)。 この図の拡大版を表示するには、ここをクリックしてください。

図2:全脳イメージングを準備するための実験手順 。 (A)卵水を入れたシャーレで汎神経細胞GCaMP7aを発現するゼブラフィッシュ試料をスクリーニングした。(B)試料の取り付けと位置決めに必要な機器と材料。(1)37°Cのヒートブロック。(2)2%(wt / vol)アガロースゲル;(3)1.5 mLマイクロ遠心チューブ;(4)卵水;(5)0.25 mg / mL臭化パンクロニウム溶液;(6)シャーレ;(7)鉗子;(8)トランスファーピペット。(C)麻痺した試料の実体顕微鏡像。黒い矢印はサンプルの心臓部を指しています。(D)1.5 mLマイクロ遠心チューブ内のサンプルをピペットを使用して移します。挿入図は、四角で囲まれた領域の拡大図を示しています。(E)サンプル(黒い矢印)を鉗子を使用してシャーレの中央に置きます。(F)サンプルは鉗子を使用して位置合わせされます。(G)ずれた埋め込みサンプルの例。(H)整列した埋め込みサンプルの例。(i)試料を対物レンズの下の顕微鏡ステージに載せて画像を取得する。スケールバー:500μm。 この図の拡大版を表示するには、ここをクリックしてください。
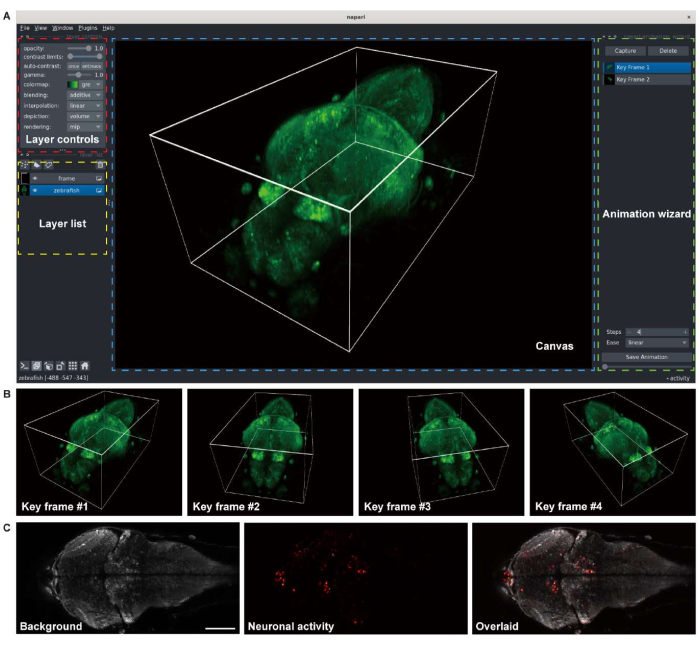
図3:ゼブラフィッシュ仔魚 の脳画像の可視化。 (A)汎神経細胞GCaMP7aを発現するゼブラフィッシュ仔魚(4 d.p.f)脳の共焦点顕微鏡画像の3Dレンダリング。Python環境のオープンソースの多次元画像ビューアであるnapariがレンダリングに使用されました。napari ウィンドウは、レイヤーコントロール(赤いボックス)、レイヤーリスト(黄色のボックス)、キャンバス(青いボックス)、アニメーションウィザード(緑のボックス)で構成されています。(B)アニメーションをレンダリングするために、複数のビューア設定を持つキーフレームが追加されます。(C)ゼブラフィッシュ仔魚脳内の神経活動の2次元タイムラプスイメージングの共焦点顕微鏡画像。画像は背景(左)と神経活動(中央)に分解され、次にオーバーレイされます(右)。スケールバー:100μm。 この図の拡大版を表示するには、ここをクリックしてください。
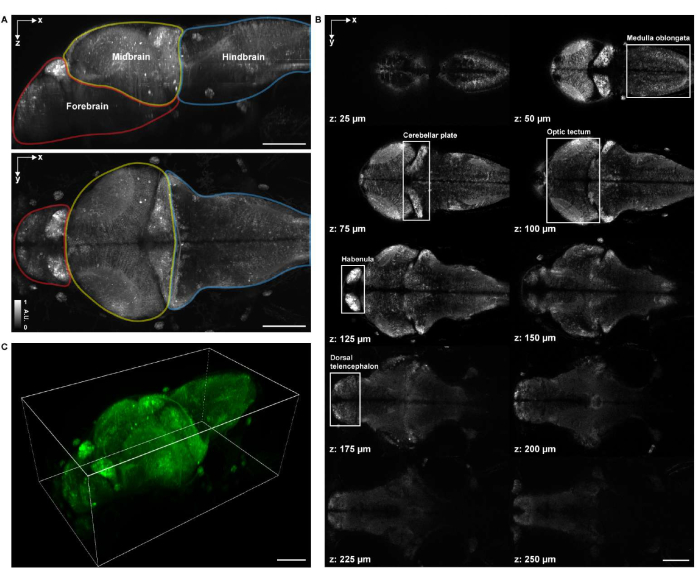
図4:ゼブラフィッシュ仔魚脳のイメージング構造。 (A)汎ニューロンGCaMP7aを発現するゼブラフィッシュ仔魚(4 d.p.f.)脳の共焦点顕微鏡画像の最大強度投影(MIP)。上:横方向のMIP。下:アキシャルMIP。各境界には、前脳 (赤)、中脳 (黄)、および後脳 (青) が含まれます。(B)脳の体積画像から複数の深さで合計10個の軸方向スライス(z = 25 μm、50 μm、75 μm、100 μm、125 μm、150 μm、175 μm、200 μm、225 μm、250 μm、上から下に数え、z = 0 μmは脳の上面を示します)。各白いボックスは、脳の領域(延髄、小脳板、視蓋、手綱、背側終脳)を表しています。(C)ナパリを使用してレンダリングされた全脳。スケールバー:100μm。 この図の拡大版を表示するには、ここをクリックしてください。
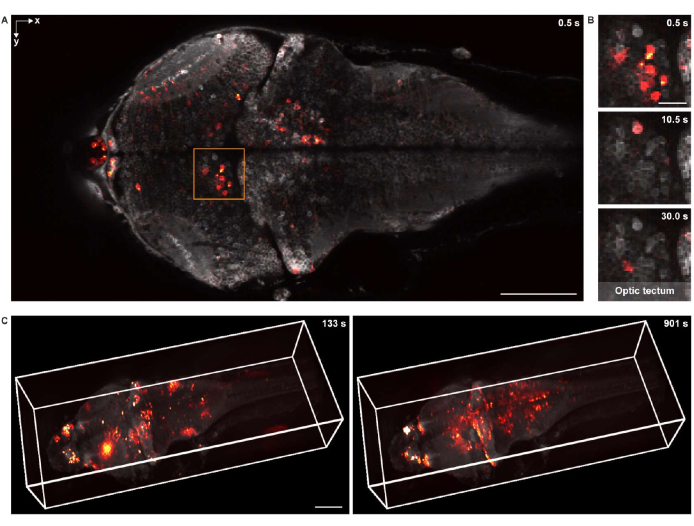
図5:ゼブラフィッシュ仔魚脳の 神経活動のイメージング。 (A)汎ニューロンGCaMP7aを発現するゼブラフィッシュ仔魚(4 d.p.f.)脳における神経活動の共焦点顕微鏡画像。スケールバー:100μm。 (B)複数の時点での視蓋内のニューロン活動を示す A の四角形領域の拡大図。スケールバー:20μm。 (C)カスタム設計の顕微鏡を使用して取得したゼブラフィッシュ仔魚の脳の全脳ニューロン活動の3Dレンダリング(左:t = 133秒、右:t = 901秒)。ニューロン活動は静的な背景に重ね合わされます。スケールバー:100μm。 この図の拡大版を表示するには、ここをクリックしてください。
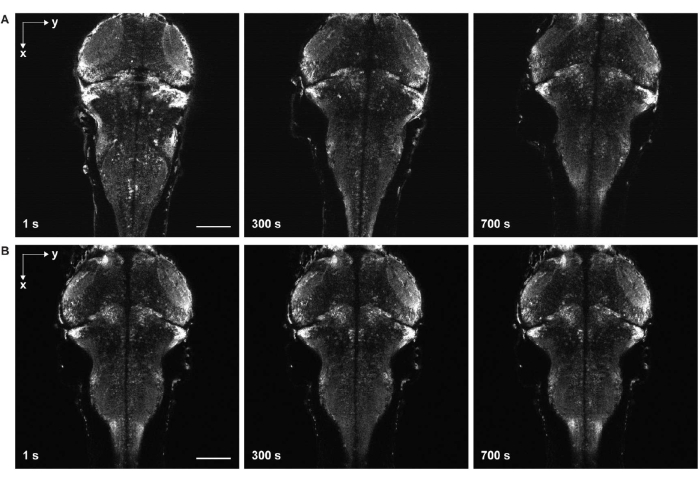
図6:サンプルドリフトありとなしタイムラプスイメージング 。 (A)サンプルドリフトを伴う汎ニューロンGCaMP7aを発現するゼブラフィッシュ仔魚脳のタイムラプスイメージング。アガロースゲルの固化前に卵水を試料に添加した(工程3.6〜3.7)。魚は横方向と軸方向に動いた。(B)サンプルドリフトのないゼブラフィッシュ仔魚脳のタイムラプスイメージング。アガロースゲルの固化後に試料に卵水を添加した(工程3.6-3.7)。スケールバー:100μm。 この図の拡大版を表示するには、ここをクリックしてください。
ビデオ1:汎ニューロンGCaMP7aを発現するゼブラフィッシュ仔魚(4 d.p.f.)脳の全脳構造の3Dレンダリング。このビデオをダウンロードするには、ここをクリックしてください。
ビデオ2:汎ニューロンGCaMP7aを発現するゼブラフィッシュ仔魚(4 d.p.f.)脳における全脳ニューロン活動の3Dレンダリング。このビデオをダウンロードするには、ここをクリックしてください。
ディスカッション
現在のプロトコルは、長期間(例えば、1時間以上)にわたる仔魚の in vivo 全脳イメージングと、取得した構造的および機能的イメージングデータの視覚化を可能にします。
最も重要なステップは、サンプルの取り付けと位置決めです。サンプル包埋中は、気泡の形成を防ぎ、アガロースゲル内のほこりを避けることが重要です。ゲルに気泡やほこりが含まれていると、画質が著しく低下する可能性があります。鉗子を使用してサンプルを配置する際には、サンプルが水平方向と垂直方向の両方で水平であることを確認することが重要です。そうしないと、関心領域が顕微鏡の視野内に含まれない可能性があります。さらに、この位置決めは、アガロースゲルが固化する前の短い時間枠内に行い、そのような損傷が画質を損なうため、表面に損傷を与えないようにする必要があります。
もう一つの大きな課題は、アガロースゲルの不完全な固化(図6)とゼブラフィッシュの麻痺に起因する画像の動きを避けることです。アゴースゲルが完全に固化する前に卵水をサンプルに加えると、魚は横方向と軸方向の両方にゆっくりと移動し、時系列画像にサンプルドリフトとして現れます(図6A)。麻痺薬の投与量が不十分であるか、効果の持続時間が終了すると、サンプルは移動を試みることがあり、これはタイムラプス画像で急速なけいれんとして現れます。
モーションアーチファクトのない高品質の画像を取得するための前述のステップの重要性にもかかわらず、公開されているプロトコル15、16、17、18、19は、実験手順の簡単な概要のみを提供し、これらの詳細を欠いています。例えば、固定化プロトコル11なしで取得された画像は、下流の画像解析を困難にする実質的なモーションアーチファクトに悩まされている。アガロースゲルの固化やサンプルの麻痺などの必須コンポーネントを統合することにより、当社のプロトコルは、モーションアーチファクトを最小限に抑えながら、取得した画像の品質の一貫性を大幅に向上させます。
要約すると、ゼブラフィッシュ仔魚の脳のin vivoイメージングのための最適化された再現可能な実験手順が記載されている。脳活動および構造のインビボイメージングのためのこのプロトコルの有効性および再現性は、複数の設定14、18、29、30、31で確認されている。本ワークフローはゼブラフィッシュ仔魚の全脳イメージングに着目したが、ゼブラフィッシュ仔魚の他の器官イメージングにも容易に適用できる35,36。
開示事項
著者は利益相反を宣言しません。
謝辞
カルシウムイメージングに使用されたゼブラフィッシュ系統は、韓国のゼブラフィッシュ疾病モデリングセンター(ZCDM)によって提供されました。この研究は、韓国国立研究財団(2020R1C1C1009869、NRF2021R1A4A102159411、RS-2023-00209473)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tube | SciLab | SL.Tub3513 | To aliquot agarose gel and pancuronium bromide solution |
| 15 mL Falcon tubes | Falcon | 352096 | To prepare agarose gel and pancuronium bromide solution |
| 16× 0.8NA water dipping objective lens | Nikon | CFI75 LWD 16×W | Objective lens for whole-brain imaging |
| 1-phenyl 2-thiourea (PTU) | Sigma-Aldrich | P7629-10G | 200 μM of 1-phenyl 2-thiourea (PTU) |
| 50 mL Falcon tubes | Falcon | 352070 | To prepare egg water |
| Disposable transfer pipette | SciLab | SL.Pip3032 | To transfer zebrafish larvae |
| Egg water | N/A | N/A | 0.6 g sea salt in 10 L deionized water |
| Forceps | Karl Hammacher GmbH | HSO 010-10 | Forceps used for sample positioning |
| Low melting point agarose | Thermo Scientific | R0801 | 2% (wt/vol) agarose gel |
| Napari | Napari | N/A | To visualize microscopy images in 3-D |
| NIS-Elements C | Nikon | N/A | Imaging software for confocal microscope |
| Pancuronium bromide | Sigma-Aldrich | P1918-10MG | 0.25 mg/mL of pancuronium bromide solution |
| Petri dish, 35 mm | SPL Life Sciences | 11035 | Petri dish used for sample embedding |
| Petri dish, 55 mm | SPL Life Sciences | 11050 | To prepare zebrafish larvae after screening |
| Point-scanning confocal microscopy system (C2 Plus) | Nikon | N/A | Confocal microscope for whole-brain imaging |
| Sea salt | Sigma-Aldrich | S9883-500G | Sea salt used for preparing egg water |
参考文献
- Choi, T. -. Y., Choi, T. -. I., Lee, Y. -. R., Choe, S. -. K., Kim, C. -. H. Zebrafish as an animal model for biomedical research. Experimental & Molecular Medicine. 53 (3), 310-317 (2021).
- Ahrens, M. B., et al. Brain-wide neuronal dynamics during motor adaptation in zebrafish. Nature. 485 (7399), 471-477 (2012).
- Panier, T., et al. Fast functional imaging of multiple brain regions in intact zebrafish larvae using selective plane illumination microscopy. Frontiers in Neural Circuits. 7, 65 (2013).
- Bianco, I. H., Kampff, A. R., Engert, F. Prey capture behavior evoked by simple visual stimuli in larval zebrafish. Frontiers in Systems Neuroscience. 5, 101 (2011).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. Journal of Neuroscience. 32 (40), 13819-13840 (2012).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Piatkevich, K. D., et al. A robotic multidimensional directed evolution approach applied to fluorescent voltage reporters. Nature Chemical Biology. 14 (4), 352-360 (2018).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nature Methods. 6 (12), 875-881 (2009).
- Looger, L., et al. Fast and sensitive GCaMP calcium indicators for imaging neural populations. Biorxiv. , (2021).
- Ahrens, M. B., Orger, M. B., Robson, D. N., Li, J. M., Keller, P. J. Whole-brain functional imaging at cellular resolution using light-sheet microscopy. Nature Methods. 10 (5), 413-420 (2013).
- Prevedel, R., et al. Simultaneous whole-animal 3D imaging of neuronal activity using light-field microscopy. Nature Methods. 11 (7), 727-730 (2014).
- Chhetri, R. K., et al. Whole-animal functional and developmental imaging with isotropic spatial resolution. Nature Methods. 12 (12), 1171-1178 (2015).
- Ahrens, M. B., Engert, F. Large-scale imaging in small brains. Current Opinion in Neurobiology. 32, 78-86 (2015).
- Yoon, Y. -. G., et al. Sparse decomposition light-field microscopy for high speed imaging of neuronal activity. Optica. 7 (10), 1457-1468 (2020).
- Randlett, O., et al. Whole-brain activity mapping onto a zebrafish brain atlas. Nature Methods. 12 (11), 1039-1046 (2015).
- Cong, L., et al. Rapid whole brain imaging of neural activity in freely behaving larval zebrafish (Danio rerio). eLife. 6, e28158 (2017).
- Bruzzone, M., et al. Whole brain functional recordings at cellular resolution in zebrafish larvae with 3D scanning multiphoton microscopy. Scientific Reports. 11 (1), 11048 (2021).
- Cho, E. -. S., Han, S., Lee, K. -. H., Kim, C. -. H., Yoon, Y. -. G. 3DM: deep decomposition and deconvolution microscopy for rapid neural activity imaging. Optics Express. 29 (20), 32700-32711 (2021).
- Zhang, Z., et al. Imaging volumetric dynamics at high speed in mouse and zebrafish brain with confocal light field microscopy. NatureBiotechnology. 39 (1), 74-83 (2021).
- Muto, A., Ohkura, M., Abe, G., Nakai, J., Kawakami, K. Real-time visualization of neuronal activity during perception. Current Biology. 23 (4), 307-311 (2013).
- Köster, R. W., Fraser, S. E. Tracing transgene expression in living zebrafish embryos. Developmental Biology. 233 (2), 329-346 (2001).
- Park, H. C., et al. Analysis of upstream elements in the HuC promoter leads to the establishment of transgenic zebrafish with fluorescent neurons. Developmental Biology. 227 (2), 279-293 (2000).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: an introduction. Journal of Visualized Experiments. (69), e4196 (2012).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). 4th edition. , (2000).
- Morsch, M., et al. Triggering cell stress and death using conventional UV laser confocal microscopy. Journal of Visualized Experiments. (120), e54983 (2017).
- Antinucci, P., Hindges, R. A crystal-clear zebrafish for in vivo imaging. Scientific Reports. 6, 29490 (2016).
- Parker, M. O., Brock, A. J., Millington, M. E., Brennan, C. H. Behavioral phenotyping of casper mutant and 1-pheny-2-thiourea treated adult zebrafish. Zebrafish. 10 (4), 466-471 (2013).
- Elsalini, O. A., Rohr, K. B. Phenylthiourea disrupts thyroid function in developing zebrafish. Development Genes and Evolution. 212 (12), 593-598 (2003).
- Han, S., Cho, E. -. S., Park, I., Shin, K., Yoon, Y. -. G. Efficient neural network approximation of robust PCA for automated analysis of calcium imaging data. Medical Image Computing and Computer Assisted Intervention. , 595-604 (2021).
- Shin, C., et al. Three-dimensional fluorescence microscopy through virtual refocusing using a recursive light propagation network. Medical Image Analysis. 82, 102600 (2022).
- Eom, M., et al. Statistically unbiased prediction enables accurate denoising of voltage imaging data. bioRxiv. , (2022).
- Johnston, L., et al. Electrophysiological recording in the brain of intact adult zebrafish. Journal of Visualized Experiments. (81), e51065 (2013).
- Sofroniew, N., et al. napari: a multi-dimensional image viewer for Python. Zenodo. , 3555620 (2022).
- White, R. M., et al. Transparent adult zebrafish as a tool for in vivo transplantation analysis. Cell Stem Cell. 2 (2), 183-189 (2008).
- Mickoleit, M., et al. High-resolution reconstruction of the beating zebrafish heart. Nature Methods. 11 (9), 919-922 (2014).
- Voleti, V., et al. Real-time volumetric microscopy of in vivo dynamics and large-scale samples with SCAPE 2.0. Nature Methods. 16 (10), 1054-1062 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved