Method Article
생체 내 3차원 형광 현미경을 사용한 제브라피쉬 유충의 전뇌 이미징
요약
여기에 제시된 것은 3차원 형광 현미경을 사용한 유충 제브라피쉬의 생체 내 전뇌 이미징을 위한 프로토콜입니다. 실험 절차에는 샘플 준비, 이미지 획득 및 시각화가 포함됩니다.
초록
척추동물 모델 동물인 제브라피쉬 유충은 신경과학에서 널리 사용되며 세포 분해능에서 전뇌 활동을 모니터링할 수 있는 독특한 기회를 제공합니다. 여기에서는 샘플 준비 및 고정화, 샘플 임베딩, 이미지 획득 및 이미징 후 시각화를 포함하여 3차원 형광 현미경을 사용하여 유충 제브라피쉬의 전뇌 이미징을 수행하기 위한 최적화된 프로토콜을 제공합니다. 현재 프로토콜은 컨포칼 현미경과 맞춤형으로 설계된 형광 현미경을 사용하여 1시간 이상 세포 분해능으로 유충 제브라피쉬 뇌의 구조와 신경 활동을 생체 내 이미징할 수 있습니다. 샘플 장착 및 위치 지정, 아가로스 겔의 기포 형성 및 먼지 방지, 아가로스 겔의 불완전한 응고 및 물고기의 마비로 인한 이미지의 움직임 방지를 포함하여 프로토콜의 중요한 단계도 논의됩니다. 프로토콜은 여러 설정에서 검증 및 확인되었습니다. 이 프로토콜은 애벌레 제브라 피쉬의 다른 기관을 이미징하는 데 쉽게 적용 할 수 있습니다.
서문
제브라피쉬(Danio rerio)는 애벌레 단계의 광학적 투명성, 빠른 발달, 낮은 유지 관리 비용 및 다양한 유전 도구의 가용성으로 인해 신경과학에서 모델 척추동물로 널리 채택되었습니다 1,2,3,4. 특히, 생물학적 사건 5,6,7,8,9의 유전적으로 암호화된 형광 리포터와 결합된 유충의 광학적 투명성은 전뇌 수준(10,11,12,13,14)에서 뉴런 활동과 구조 모두를 이미지화할 수 있는 독특한 기회를 제공한다 . 그러나 세포 해상도를 지원하는 현미경을 사용하더라도 획득한 이미지가 반드시 단일 세포 수준에서 정보를 유지하는 것은 아닙니다. 광학 이미지 품질은 샘플 장착에 사용되는 아가로스 겔에 의해 도입된 수차로 인해 저하될 수 있고, 물고기는 비스듬히 장착될 수 있으며, 따라서 관심 영역은 현미경의 시야 내에 완전히 포함되지 않으며, 물고기는 기록 중에 움직여 이미지에서 모션 아티팩트를 유발하거나 이미지로부터 정확한 신호 추출을 방해할 수 있습니다.
따라서 최소한의 노이즈와 모션으로 고품질 이미지 데이터를 획득하기 위해서는 효과적이고 재현 가능한 프로토콜이 필요합니다. 불행하게도, 생체 내 유충 제브라피쉬의 전체 뇌를 이미징하기 위해 공개적으로 이용 가능한 프로토콜 15,16,17,18,19는 절차를 간략하게 설명할 뿐이며, 아가 로스 응고, 정확한 장착 기술 및 집게를 사용한 샘플 위치 지정과 같은 세부 사항의 상당 부분을 각 실험자에게 맡깁니다. 또한, 아가로스 농도 및 고정화 방법(10,11,14,15,16,17,18,19)의 불일치는 이미징 공정 동안 물고기 이동으로부터 발생하는 문제를 야기할 수 있다.
여기에서는 3차원 형광 현미경을 사용한 유충 제브라피쉬의 전뇌 이미징을 위한 자세한 프로토콜이 제공됩니다. 그림 1 은 프로토콜에 대한 그래픽 개요를 제공합니다: 시료 전처리 및 고정화, 시료 임베딩, 이미지 획득, 이미징 후 시각화. 생체 내에서 유충 제브라피쉬 뇌의 구조적 및 기능적 이미징은 상업용 컨포칼 현미경과 맞춤형으로 설계된 형광 현미경을 사용하여 시연됩니다. 이 프로토콜은 실험 요구 및 설계에 따라 특정 감각 자극 또는 행동 맥락을 가진 뇌 영상을 위해 실무자가 조정할 수 있습니다.
프로토콜
모든 제브라피쉬 실험은 KAIST(KA2021-125)의 IACUC(Institutional Animal Care and Use Committee)의 승인을 받았습니다. 칼슘 지표 GCaMP7a의 범 신경 발현을 가진 총 12마리의 성체 제브라피쉬[Tg(huc:GAL4); 캐스퍼 [mitfa(w2/w2);mpv17(a9/a9)] 배경의 Tg(UAS:GCaMP7a)]를 번식에 사용했습니다. 이 그룹은 8 명의 여성과 4 명의 남성으로 구성되었으며 연령은 3 개월에서 12 개월까지 다양합니다. 영상 실험은 유충 제브라피쉬의 성별을 결정할 수 없는 단계인 수정 후 3-4일(dp)에 수행되었습니다.
1. 제브라피쉬 시료 전처리
- Tg(huc:GAL4)와 같은 원하는 형질전환 계통의 성체 물고기를 번식시킨 후 배아를 수집합니다. Tg(UAS:GCaMP7a)20,21,22, 계란 물로 채워진 페트리 접시에 담습니다(재료 표 참조). 배아를 28°C의 인큐베이터에 넣고 3-4 d.p.f. 유충23,24,25.
- 제브라피쉬 배경이 흰둥이가 아닌 경우 색소 침착을 억제하기 위해 수정 후 24시간(hp)에 배아를 200μM의 1-페닐 2-티오우레아(PTU, 재료 표 참조)25,26가 들어 있는 계란 물로 채워진 페트리 접시에 옮깁니다. 24시간마다 200μM의 PTU가 함유된 신선한 계란수와 함께 생선을 새 접시에 옮깁니다.
알림: 제브라피쉬는 28°C의 표준 조건과 14:10시간의 빛:어둠 주기로 유지됩니다. PTU 치료는 유충 제브라피쉬의 행동과 갑상선 기능에 영향을 미치는 것으로 알려져 있습니다27,28. 따라서 PTU를 주의해서 사용하고 모든 실험에서 잠재적인 교란 요인을 신중하게 제어하는 것이 중요합니다.
- 제브라피쉬 배경이 흰둥이가 아닌 경우 색소 침착을 억제하기 위해 수정 후 24시간(hp)에 배아를 200μM의 1-페닐 2-티오우레아(PTU, 재료 표 참조)25,26가 들어 있는 계란 물로 채워진 페트리 접시에 옮깁니다. 24시간마다 200μM의 PTU가 함유된 신선한 계란수와 함께 생선을 새 접시에 옮깁니다.
- 관심 형광 단백질(예: 범뉴런 GCaMP7a)을 발현하는 시료를 찾으려면 에피 형광 현미경으로 시료를 스크리닝하고 밝은 발현의 시료를 선택합니다.
- 선택한 3-4 dp 제브라피쉬 샘플을 계란 물로 채워진 페트리 접시에 준비합니다(그림 2A).
참고: 자발적인 신경 활동을 기록하려면 80hpf 이전에는 자발적 활동 수준이 낮고 색소 침착이 80hpf 이후에는 이미지 품질을 저하시킬 수 있으므로 80-100hp 사이의 샘플을 사용하는 것이 좋습니다. - 0.25mg/mL 원액(재료 표 참조) 1mL를 계란수14,19,29,30,31mL에 2.5mL의 판쿠로늄 브로마이드 용액 10을 준비합니다. 판쿠로늄 브로마이드 용액을 1.5mL 미세원심분리기 튜브에 분취합니다.
- 이송 피펫을 사용하여 사전 스크리닝된 샘플을 페트리 접시에 옮깁니다.
알림: 샘플과 함께 최소한의 계란 물을 이월하십시오. - 0.1mL의 판쿠로늄 브로마이드 용액을 페트리 접시에 옮겨 마비시킵니다.
참고: Pancuronium bromide는 유충 제브라피쉬32의 신경 활동에 잠재적인 감쇠 효과가 있습니다. 판쿠로늄 브로마이드에 대한 노출의 농도와 기간을 신중하게 고려하는 것이 중요합니다.
2. 2%(wt/vol) 아가로스 겔 제제
- 히트 블록을 켜고 목표 온도를 37°C로 설정합니다. 장치가 가열 및 설정 온도에서 평형을 이룰 때까지 기다리십시오.
- 0.2g의 저융점 아가로스 분말( 재료 표 참조)을 10mL의 달걀 물에 녹입니다.
- 아가로스 용액을 마이크로파로 가열하고 아가로스가 완전히 용해될 때까지 진탕 및 볼텍싱하여 혼합합니다.
- 아가로스 겔을 1.5mL 미세 원심분리 튜브에 분취하고 미세 원심분리 튜브를 열 블록에 보관합니다(그림 2B).
알림: 아가로스 젤의 기포가 사라졌는지 확인하십시오.
3. 샘플 장착 및 위치 지정
- 실체현미경으로 샘플을 확인하여 유충의 움직임이 멈췄는지 확인하고 심장 박동을 확인하여 샘플의 상태를 시각적으로 평가합니다(그림 2C). 심장 박동이 너무 느리면 샘플을 버립니다.
알림: 이미징되는 물고기의 심장 박동이 너무 느리면(예: 분당 60회 미만) 장기 이미징을 수행하지 못할 수 있습니다. 물고기의 건강을 평가하기 위해 심장 박동수는 같은 페트리 접시의 다른 물고기와 비교하여 육안으로 확인할 수 있습니다. 이렇게 하면 이미징되는 물고기가 이미징 절차에 충분히 건강하고 안정적인지 확인하는 데 도움이 됩니다. - 이송 피펫을 사용하여 단일 유충 제브라피쉬를 1.5mL 미세 원심분리기 튜브의 아가로스 겔에 넣습니다(그림 2D).
알림: 샘플을 옮긴 후 피펫을 폐기해야 합니다. - 아가로스 젤을 페트리 접시에 부어 1-2mm 코트를 만듭니다. 이송 피펫을 사용하여 미세 원심 분리기 튜브의 샘플을 페트리 접시로 옮겨 유충이 접시 중앙에 놓이도록합니다.
알림: 아가로스 젤에 먼지와 기포가 있는 경우 이송 피펫을 사용하여 제거하십시오. - 집게를 사용하여 머리와 꼬리가 평평하도록 샘플을 원하는 방향으로 배치합니다(그림 2E).
- 두 눈이 수평이 되도록 집게를 사용하여 샘플을 회전합니다(그림 2F).
참고: 정렬 절차(위치 및 회전)는 아가로스 겔이 응고되기 시작하기 전에 완료되어야 합니다. - 정렬 후 아가로스 겔이 굳을 때까지 기다리십시오(그림 2G,H).
참고: 아가로스 겔이 응고될 때까지 기다리는 시간은 겔의 부피와 크기에 따라 5-10분 범위일 수 있습니다. - 아가로스 겔을 고형화시킨 후, 페트리 접시에 계란수를 채우고 샘플이 내장된 페트리 접시를 현미경 스테이지에 놓습니다(그림 2I).
4. 이미지 획득
- 현미경 시스템(예: 레이저, 컨포칼 컨트롤러, 현미경 및 컴퓨터, 재료 표 참조)을 켜고 전체 시스템이 작동하는지 확인합니다.
- 저배율 대물 렌즈를 선택하고 시야 중앙에서 샘플을 찾습니다.
- 적절한 배율의 침수 또는 침수 대물 렌즈를 선택하십시오(예: 16x 0.8 개구수(NA) 침수 렌즈, 재료 표 참조). 시야를 미세 조정합니다.
- 이미지 수집 소프트웨어를 사용하여 이미징 매개변수(예: 이미지 크기, 레이저 출력, 노출 시간, 프레임 수)를 설정합니다.
알림: 특정 요구 사항에 대해 최상의 결과를 얻을 수 있도록 이미징 매개변수를 설정합니다(대표 결과 섹션의 이미지 획득 설정 참조). 이미지가 포화되면 레이저 출력을 줄이십시오. - 스테이지를 움직여 샘플의 두뇌를 찾고 소프트웨어의 라이브 뷰 모드를 사용하여 초점면을 수동으로 위아래로 변경하여 두께를 결정합니다. 볼륨의 하한과 상한을 설정합니다.
알림: 전체 뇌가 시야에 포함되어 있는지 확인하십시오. - 현미경의 축 해상도를 고려하여 z 단계 크기를 설정합니다.
참고: 유충 제브라피쉬 뇌를 이미징하기 위한 최적의 z-스텝 크기는 이미징 방식과 현미경의 해상도에 따라 다릅니다. 일례로, 광시트의 두께 및 세포체의 평균 직경(10)을 고려하여 5μm의 z-스텝 크기를 사용하였다. - 설정된 화각에 대한 이미지 획득을 진행합니다.
- 체적 구조 이미징의 경우 초점면을 변경하고 각 z면의 2D 이미지를 순차적으로 획득하여 전체 뇌의 3D 이미지(x,y,z)를 획득합니다.
- 단일 z-평면의 기능적 이미징을 위해 특정 깊이에서 뇌의 신경 활동에 대한 시계열 이미지(x,y,t)를 획득합니다.
- 체적 기능 이미징의 경우 3D 이미지를 순차적으로 획득하여 전체 뇌의 신경 활동에 대한 4D 이미지(x,y,z,t)를 획득합니다.
주: 컴퓨터의 사용 가능한 메모리 크기를 고려하여 프레임 수를 설정하십시오. pancuronium bromide의 효과 지속 기간으로 인해 1 시간 미만의 획득 시간이 권장됩니다.
- 이미지를 획득한 후 결과를 저장하고 이미지 분석을 위한 이미징 매개변수(예: 픽셀 크기, z-스텝 크기, 프레임 속도, 레이저 출력)를 기록합니다.
- 데이터 렌더링 및 이미지 분석을 위해 적절한 형식으로 이미지를 내보냅니다.
참고: 태그가 지정된 이미지 파일(TIF) 형식 형식으로 이미지를 내보내는 것이 좋습니다. TIF는 무손실 이미지 압축을 지원하며 대부분의 이미지 처리 소프트웨어 및 프로그래밍 언어와 호환됩니다. 또한 TIF 형식은 획득 매개변수, 이미지 해상도 및 데이터 해석 및 재현성에 도움이 될 수 있는 기타 관련 정보와 같은 메타데이터의 포함을 지원합니다.
5. napari를 사용한 시각화 설정
참고 : napari는 그래픽 처리 장치 (GPU) 기반 렌더링33을 사용하는 Python 환경의 오픈 소스 다차원 이미지 뷰어입니다. napari-animation 플러그인은 프로그래밍 방식으로 영화를 만들 수 있습니다. 필터링 및 기하학적 변환과 같은 범용 이미지 처리에는 오픈 소스 이미지 처리 프로그램인 Fiji를 사용하는 것이 좋습니다( 재료 표 참조). napari를 사용한 시각화에 사용되는 소스 코드는 GitHub(https://github.com/NICALab/Zebrafish-brain-visualization)에서 사용할 수 있습니다.
- pip 또는 conda를 사용하여 napari 및 napari-animation을 설치합니다. 설치 후 새 jupyter Notebook 파일을 만듭니다.
참고: Python용 대화형 도구인 jupyter notebook을 사용하여 실행하는 것이 Python 스크립트보다 권장됩니다. - napari 및 napari-animation을 가져옵니다.
6. 나파리를 이용한 구조 시각화
- 렌더링된 제브라피쉬 브레인의 이미지를 시각화하고 동영상을 만들려면 3차원 이미지(x,y,z)를 로드하고 napari 창을 엽니다. napari-animation 플러그인을 연결합니다(그림 3A).
- 복셀 크기, 컬러맵, 대비 한계와 같은 파라미터를 레이어 컨트롤에서 설정합니다.
- 캔버스에서 뷰어 설정(예: 원근감, 각도)을 조정합니다.
- 렌더링된 이미지를 캡처하려면 애니메이션 마법사에서 캡처 버튼을 누릅니다.
- 렌더링된 볼륨의 동영상을 생성하려면 뷰어 설정을 수정하고 키 프레임을 추가합니다 (그림 3B).
- 키 프레임을 추가한 후 애니메이션 마법사에서 키 프레임 사이의 프레임 수(단계)를 설정합니다. 렌더링된 애니메이션을 저장합니다.
7. napari를 이용한 신경 활동 이미지 처리 및 시각화
참고 : 뉴런 활동의 시계열 이미지를 정적 배경과 활동의 오버레이된 이미지로 시각화하려면, 분해 알고리즘이 원시 이미지에 적용되어야 한다. BEAR24라는 분해 알고리즘의 MATLAB 구현을 사용합니다. BEAR의 MATLAB 버전은 GitHub(https://github.com/NICALab/BEAR)에서 다운로드할 수 있습니다.
- 정적 배경과 뉴런 활동을 분해하려면 원시 시계열 이미지(x,y,t 또는 x,y,z,t)에 BEAR를 적용하십시오. 분해 후 배경 및 신경 활동의 이미지를 TIF 파일로 저장합니다(그림 3C).
- 배경 및 신경 활동 이미지를 로드하고 napari 창을 엽니다. napari-animation 플러그인을 연결합니다.
- 배경 이미지에는 회색 컬러맵을 사용하고 뉴런 활동 이미지에는 핫 컬러맵을 사용합니다(그림 3C).
- 레이어 컨트롤에서 opacity 및 contrast limits와 같은 매개 변수를 설정합니다.
- 뉴런 활동의 동영상을 생성하려면 뷰어 설정을 수정하고 키 프레임을 추가하여 애니메이션을 렌더링합니다.
- 키 프레임을 추가한 후 애니메이션 마법사에서 키 프레임 사이의 프레임 수(단계)를 설정합니다. 렌더링된 애니메이션을 저장합니다.
결과
칼슘 지표 범신경 GCaMP7a(Tg(huc:GAL4))를 발현하는 유충 제브라피쉬 뇌의 구조 및 신경 활동; Tg(UAS:GCaMP7a))20,21,22 캐스퍼(mitfa(w2/w2);mpv17(a9/a9))34 배경은 설명된 프로토콜에 따라 3-4 d.p.f.에서 이미지화되었습니다.
체적 구조 이미징을 위해 16x 0.8NA 침지 대물 렌즈가 장착된 상업용 포인트 스캐닝 컨포칼 현미경 시스템을 사용하여 표본을 이미지화했습니다. 488nm 여기 레이저는 구조 및 기능 이미징 모두에 사용되었습니다. 프레임 속도, 이미지 해상도, 픽셀 크기 및 축 스텝 크기는 각각 0.25Hz, 2048 x 2048, 0.34μm 및 1.225μm였습니다. 이미지 획득에는 약 1시간 20분이 걸렸습니다. 획득된 이미지의 체적 시야는 전뇌, 중뇌 및 후뇌의 뇌 영역을 덮었습니다(그림 4A). 4 d.p.f. 유충 제브라피쉬의 전체 뇌에서 수질 oblongata, 소뇌판, 시신경, habenula 및 등쪽 종뇌의 신경 세포체가 공초점 현미경 이미지에서 명확하게 보였습니다(그림 4B). 컨포칼 현미경 이미지의 3D 렌더링은 앞서 언급한 프로토콜에 따라 napari27 을 사용하여 수행되었습니다(그림 4C 및 비디오 1).
2D의 기능적 이미징을 위해 16x 0.8NA 침지 대물 렌즈가 장착된 동일한 컨포칼 현미경 시스템을 사용하여 표본을 이미지화했습니다. 프레임 속도, 이미지 해상도 및 픽셀 크기는 각각 2Hz, 512 x 256 및 1.5μm였습니다. 뉴런 세포체는 배경과 중첩된 뉴런 활동 모두에서 명확하게 볼 수 있었습니다(그림 5A, B).
3D 기능적 이미징을 위해, 맞춤형으로 설계된 3D 현미경 시스템(18 )이 사용되었으며, 이는 각각 1,040μm × 400μm × 235μm의 시야 및 1.7μm 및 5.4μm의 측면 및 축 해상도로 전체 유충 제브라피쉬 뇌의 신경 활동을 생체 내 이미징할 수 있었습니다. 이미징 속도는 초당 최대 4.2 볼륨이었습니다. 구조적 이미징 데이터를 렌더링하는 것과 유사하게, napari는 전뇌 칼슘 이미징 데이터의 3D 렌더링에 사용되었습니다(그림 5C 및 비디오 2).
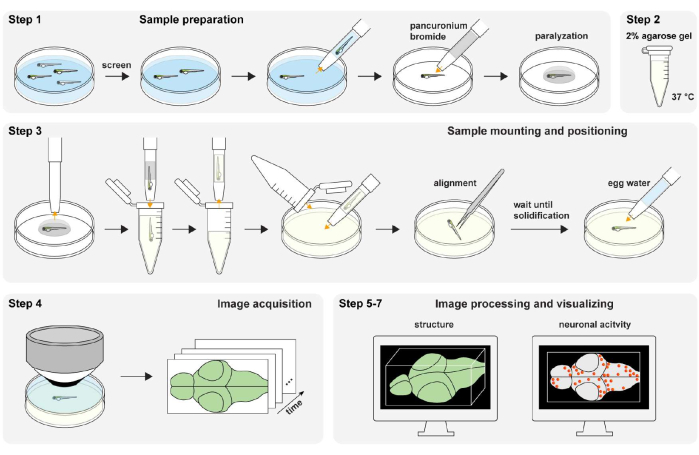
그림 1: 실험 절차의 개요. Zebrafish 샘플 준비 및 마비(1단계). 2 % (wt / vol) 아가로스 겔 제제 (단계 2). 샘플 장착 및 포지셔닝(3단계). 이미지 획득(4단계). 이미지 처리 및 구조 및 신경 활동 시각화 (5-7 단계). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 전뇌 영상을 준비하기 위한 실험 절차 . (A) 계란 물로 채워진 페트리 접시에서 범 뉴런 GCaMP7a를 발현하는 스크리닝된 제브라피쉬 샘플. (B) 샘플 장착 및 위치 지정에 필요한 장비 및 재료. (1) 37°C에서 열 블록; (2) 2 % (wt / vol) 아가로스 겔; (3) 1.5mL 미세원심분리기 튜브; (4) 계란 물; (5) 0.25 mg/mL 판쿠로늄 브로마이드 용액; (6) 페트리 접시; (7) 겸자; (8) 이송 피펫. (C) 마비된 샘플의 실체현미경 이미지. 검은색 화살표는 샘플의 중심을 가리킵니다. (D) 1.5mL 미세원심분리기 튜브의 샘플을 피펫을 사용하여 옮깁니다. 삽입된 화면에는 박스 영역의 확대 보기가 표시됩니다. (E) 집게를 사용하여 샘플(검은색 화살표)을 페트리 접시 중앙에 놓습니다. (F) 집게를 사용하여 샘플을 정렬합니다. (G) 잘못 정렬된 임베디드 샘플의 예. (H) 정렬된 임베디드 샘플의 예. (I) 표본은 이미지 획득을 위해 대물 렌즈 아래의 현미경 스테이지에 배치됩니다. 스케일 바: 500 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
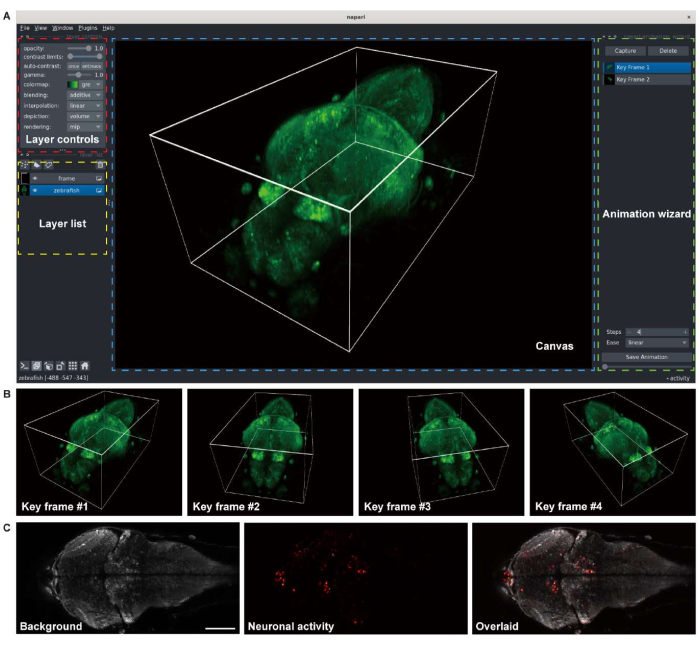
그림 3: 유충 제브라피쉬 뇌 이미지의 시각화. (A) 범뉴런 GCaMP7a를 발현하는 유충 제브라피쉬(4 d.p.f) 뇌의 컨포칼 현미경 이미지의 3D 렌더링. Python 환경의 오픈 소스 다차원 이미지 뷰어인 napari가 렌더링에 사용되었습니다. napari 창은 레이어 컨트롤(빨간색 상자), 레이어 목록(노란색 상자), 캔버스(파란색 상자) 및 애니메이션 마법사(녹색 상자)로 구성됩니다. (B) 애니메이션을 렌더링하기 위해 여러 뷰어 설정이 있는 키 프레임이 추가됩니다. (C) 유충 제브라피쉬 뇌의 신경 활동에 대한 2D 타임랩스 이미징의 컨포칼 현미경 이미지. 이미지는 배경(왼쪽)과 신경 활동(가운데)으로 분해된 다음 겹쳐집니다(오른쪽). 스케일 바: 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
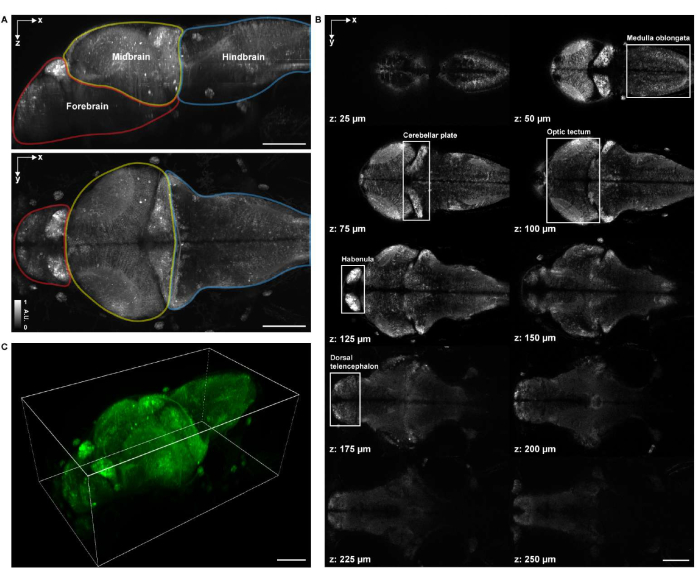
그림 4: 유충 제브라피쉬 뇌의 이미징 구조. (A) 범뉴런 GCaMP7a를 발현하는 유충 제브라피쉬(4 d.p.f.) 뇌의 컨포칼 현미경 이미지의 최대 강도 투영(MIP). 상단: 측면 MIP. 하단 : 축 방향 MIP. 각 경계에는 전뇌(빨간색), 중뇌(노란색) 및 후뇌(파란색)가 포함됩니다. (B) 뇌의 체적 이미지에서 여러 깊이의 총 10개의 축 슬라이스(z = 25μm, 50μm, 75μm, 100μm, 125μm, 150μm, 175μm, 200μm, 225μm, 250μm, 위에서 아래로 위쪽으로 계산됨; z = 0μm는 뇌의 상단 표면을 나타냄). 각 흰색 상자는 뇌의 영역(수질 oblongata, 소뇌판, 시신경, 하베눌라 및 등쪽 종뇌)을 나타냅니다. (C) 나파리를 사용하여 렌더링된 전체 뇌. 스케일 바: 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
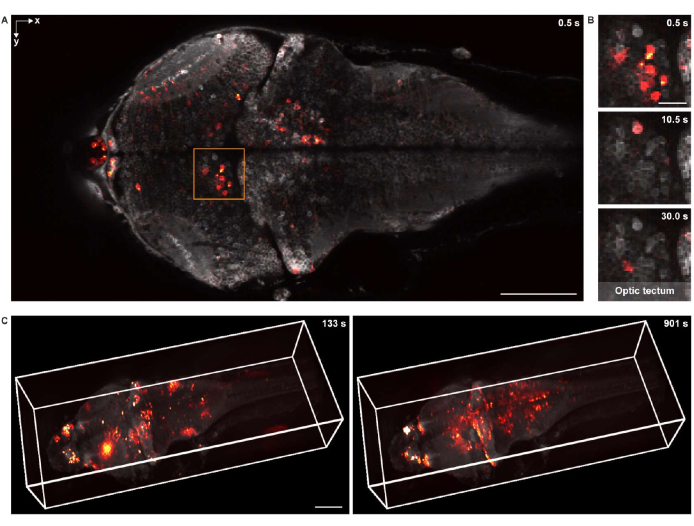
그림 5: 유충 제브라피쉬 뇌의 신경 활동 이미징. (A) 범 뉴런 GCaMP7a를 발현하는 유충 제브라피쉬(4 d.p.f.) 뇌의 뉴런 활동에 대한 컨포칼 현미경 이미지. 스케일 바: 100μm. (B) 여러 시점에서 시신경의 신경 활동을 보여주는 A의 박스형 영역의 확대도. 스케일 바: 20μm. (C) 맞춤형 현미경을 사용하여 획득한 유충 제브라피쉬 뇌의 전뇌 신경 활동의 3D 렌더링(왼쪽: t = 133초, 오른쪽: t = 901초). 뉴런 활동은 정적 배경에 겹쳐집니다. 스케일 바: 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
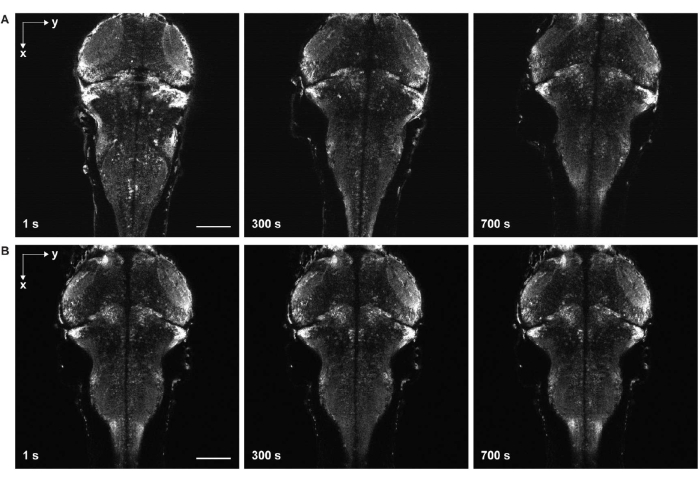
그림 6: 샘플 드리프트가 있거나 없는 타임랩스 이미징. (A) 샘플 드리프트가 있는 범뉴런 GCaMP7a를 발현하는 유충 제브라피쉬 뇌의 타임랩스 이미징. 계란물을 아가로스 겔의 고형화 전에 샘플에 첨가하였다(단계 3.6-3.7). 물고기는 측면 및 축 방향으로 움직였습니다. (B) 샘플 드리프트가 없는 유충 제브라피쉬 뇌의 타임랩스 이미징. 계란물을 아가로스 겔의 고형화 후 샘플에 첨가하였다(단계 3.6-3.7). 스케일 바: 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
비디오 1: 범뉴런 GCaMP7a를 발현하는 유충 제브라피쉬(4d.p.f.) 뇌의 전뇌 구조의 3D 렌더링. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
비디오 2: 범 뉴런 GCaMP7a를 발현하는 유충 제브라피쉬(4 d.p.f.) 뇌에서 전뇌 뉴런 활동의 3D 렌더링. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
토론
현재 프로토콜은 장기간(예: 1시간 이상)에 걸쳐 유충 제브라피쉬의 생체 내 전뇌 이미징과 획득한 구조 및 기능 이미징 데이터의 시각화를 가능하게 합니다.
가장 중요한 단계는 시료 마운팅 및 위치 지정입니다. 시료 포매 중에는 기포 형성을 방지하고 아가로스 겔의 먼지를 방지하는 것이 중요합니다. 젤에 기포와 먼지가 포함되어 있으면 화질이 심각하게 저하될 수 있습니다. 집게를 사용하여 샘플을 배치하는 동안 샘플이 수평 및 수직으로 수평인지 확인하는 것이 중요합니다. 그렇지 않으면 관심 영역이 현미경의 시야 내에 포함되지 않을 수 있습니다. 또한, 이러한 포지셔닝은 아가로스 겔의 고형화 전에 짧은 시간 내에 이루어져야 하며, 이러한 손상은 이미지 품질을 손상시키기 때문에 표면에 손상을 입히는 것을 방지해야 합니다.
또 다른 주요 과제는 아가로스 겔의 불완전한 응고(그림 6)와 제브라피쉬의 마비로 인한 이미지의 움직임을 피하는 것입니다. 아고르스 겔이 완전히 응고되기 전에 계란 물을 샘플에 첨가하면 물고기는 측면 및 축 방향으로 천천히 움직여 시계열 이미지에서 샘플 드리프트로 나타납니다(그림 6A). 마비제의 투여량이 충분하지 않거나 효과의 지속 시간이 끝나면, 검체가 움직이려고 시도할 수 있으며, 이는 타임랩스 영상에서 빠른 경련으로 나타난다.
모션 아티팩트 없이 고품질 이미지를 획득하기 위한 전술한 단계들의 중요성에도 불구하고, 공개적으로 이용가능한 프로토콜들(15,16,17,18,19)은 실험 절차의 간략한 개요만을 제공하며, 이러한 세부사항들은 결여되어 있다. 예를 들어, 고정화 프로토콜(11)이 없는 획득된 이미지들은 다운스트림 이미지 분석을 어렵게 만드는 실질적인 모션 아티팩트들을 겪는다. 아가로스 겔 응고 및 샘플 마비와 같은 필수 구성 요소를 통합함으로써 당사의 프로토콜은 모션 아티팩트를 최소화하면서 획득한 이미지 품질의 일관성을 크게 향상시킵니다.
요약하면, 유충 제브라피쉬 뇌의 생체 내 이미징을 위한 최적화되고 재현 가능한 실험 절차가 설명됩니다. 뇌 활동 및 구조의 생체 내 이미징을 위한 이 프로토콜의 타당성 및 재현성은 다중 설정 14,18,29,30,31에서 확인되었습니다. 현재 작업 흐름은 유충 제브라피쉬의 전뇌 이미징에 초점을 맞추었지만 애벌레 제브라피쉬의 다른 기관 이미징에도 쉽게 적용할 수 있습니다35,36.
공개
저자는 이해 상충을 선언하지 않습니다.
감사의 말
칼슘 이미징에 사용된 제브라피쉬 계통은 한국의 제브라피쉬 질병 모델링 센터(ZCDM)에서 제공했습니다. 본 연구는 한국연구재단(2020R1C1C1009869, NRF2021R1A4A102159411, RS-2023-00209473)의 지원을 받았다.
자료
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tube | SciLab | SL.Tub3513 | To aliquot agarose gel and pancuronium bromide solution |
| 15 mL Falcon tubes | Falcon | 352096 | To prepare agarose gel and pancuronium bromide solution |
| 16× 0.8NA water dipping objective lens | Nikon | CFI75 LWD 16×W | Objective lens for whole-brain imaging |
| 1-phenyl 2-thiourea (PTU) | Sigma-Aldrich | P7629-10G | 200 μM of 1-phenyl 2-thiourea (PTU) |
| 50 mL Falcon tubes | Falcon | 352070 | To prepare egg water |
| Disposable transfer pipette | SciLab | SL.Pip3032 | To transfer zebrafish larvae |
| Egg water | N/A | N/A | 0.6 g sea salt in 10 L deionized water |
| Forceps | Karl Hammacher GmbH | HSO 010-10 | Forceps used for sample positioning |
| Low melting point agarose | Thermo Scientific | R0801 | 2% (wt/vol) agarose gel |
| Napari | Napari | N/A | To visualize microscopy images in 3-D |
| NIS-Elements C | Nikon | N/A | Imaging software for confocal microscope |
| Pancuronium bromide | Sigma-Aldrich | P1918-10MG | 0.25 mg/mL of pancuronium bromide solution |
| Petri dish, 35 mm | SPL Life Sciences | 11035 | Petri dish used for sample embedding |
| Petri dish, 55 mm | SPL Life Sciences | 11050 | To prepare zebrafish larvae after screening |
| Point-scanning confocal microscopy system (C2 Plus) | Nikon | N/A | Confocal microscope for whole-brain imaging |
| Sea salt | Sigma-Aldrich | S9883-500G | Sea salt used for preparing egg water |
참고문헌
- Choi, T. -. Y., Choi, T. -. I., Lee, Y. -. R., Choe, S. -. K., Kim, C. -. H. Zebrafish as an animal model for biomedical research. Experimental & Molecular Medicine. 53 (3), 310-317 (2021).
- Ahrens, M. B., et al. Brain-wide neuronal dynamics during motor adaptation in zebrafish. Nature. 485 (7399), 471-477 (2012).
- Panier, T., et al. Fast functional imaging of multiple brain regions in intact zebrafish larvae using selective plane illumination microscopy. Frontiers in Neural Circuits. 7, 65 (2013).
- Bianco, I. H., Kampff, A. R., Engert, F. Prey capture behavior evoked by simple visual stimuli in larval zebrafish. Frontiers in Systems Neuroscience. 5, 101 (2011).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. Journal of Neuroscience. 32 (40), 13819-13840 (2012).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Piatkevich, K. D., et al. A robotic multidimensional directed evolution approach applied to fluorescent voltage reporters. Nature Chemical Biology. 14 (4), 352-360 (2018).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nature Methods. 6 (12), 875-881 (2009).
- Looger, L., et al. Fast and sensitive GCaMP calcium indicators for imaging neural populations. Biorxiv. , (2021).
- Ahrens, M. B., Orger, M. B., Robson, D. N., Li, J. M., Keller, P. J. Whole-brain functional imaging at cellular resolution using light-sheet microscopy. Nature Methods. 10 (5), 413-420 (2013).
- Prevedel, R., et al. Simultaneous whole-animal 3D imaging of neuronal activity using light-field microscopy. Nature Methods. 11 (7), 727-730 (2014).
- Chhetri, R. K., et al. Whole-animal functional and developmental imaging with isotropic spatial resolution. Nature Methods. 12 (12), 1171-1178 (2015).
- Ahrens, M. B., Engert, F. Large-scale imaging in small brains. Current Opinion in Neurobiology. 32, 78-86 (2015).
- Yoon, Y. -. G., et al. Sparse decomposition light-field microscopy for high speed imaging of neuronal activity. Optica. 7 (10), 1457-1468 (2020).
- Randlett, O., et al. Whole-brain activity mapping onto a zebrafish brain atlas. Nature Methods. 12 (11), 1039-1046 (2015).
- Cong, L., et al. Rapid whole brain imaging of neural activity in freely behaving larval zebrafish (Danio rerio). eLife. 6, e28158 (2017).
- Bruzzone, M., et al. Whole brain functional recordings at cellular resolution in zebrafish larvae with 3D scanning multiphoton microscopy. Scientific Reports. 11 (1), 11048 (2021).
- Cho, E. -. S., Han, S., Lee, K. -. H., Kim, C. -. H., Yoon, Y. -. G. 3DM: deep decomposition and deconvolution microscopy for rapid neural activity imaging. Optics Express. 29 (20), 32700-32711 (2021).
- Zhang, Z., et al. Imaging volumetric dynamics at high speed in mouse and zebrafish brain with confocal light field microscopy. NatureBiotechnology. 39 (1), 74-83 (2021).
- Muto, A., Ohkura, M., Abe, G., Nakai, J., Kawakami, K. Real-time visualization of neuronal activity during perception. Current Biology. 23 (4), 307-311 (2013).
- Köster, R. W., Fraser, S. E. Tracing transgene expression in living zebrafish embryos. Developmental Biology. 233 (2), 329-346 (2001).
- Park, H. C., et al. Analysis of upstream elements in the HuC promoter leads to the establishment of transgenic zebrafish with fluorescent neurons. Developmental Biology. 227 (2), 279-293 (2000).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: an introduction. Journal of Visualized Experiments. (69), e4196 (2012).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). 4th edition. , (2000).
- Morsch, M., et al. Triggering cell stress and death using conventional UV laser confocal microscopy. Journal of Visualized Experiments. (120), e54983 (2017).
- Antinucci, P., Hindges, R. A crystal-clear zebrafish for in vivo imaging. Scientific Reports. 6, 29490 (2016).
- Parker, M. O., Brock, A. J., Millington, M. E., Brennan, C. H. Behavioral phenotyping of casper mutant and 1-pheny-2-thiourea treated adult zebrafish. Zebrafish. 10 (4), 466-471 (2013).
- Elsalini, O. A., Rohr, K. B. Phenylthiourea disrupts thyroid function in developing zebrafish. Development Genes and Evolution. 212 (12), 593-598 (2003).
- Han, S., Cho, E. -. S., Park, I., Shin, K., Yoon, Y. -. G. Efficient neural network approximation of robust PCA for automated analysis of calcium imaging data. Medical Image Computing and Computer Assisted Intervention. , 595-604 (2021).
- Shin, C., et al. Three-dimensional fluorescence microscopy through virtual refocusing using a recursive light propagation network. Medical Image Analysis. 82, 102600 (2022).
- Eom, M., et al. Statistically unbiased prediction enables accurate denoising of voltage imaging data. bioRxiv. , (2022).
- Johnston, L., et al. Electrophysiological recording in the brain of intact adult zebrafish. Journal of Visualized Experiments. (81), e51065 (2013).
- Sofroniew, N., et al. napari: a multi-dimensional image viewer for Python. Zenodo. , 3555620 (2022).
- White, R. M., et al. Transparent adult zebrafish as a tool for in vivo transplantation analysis. Cell Stem Cell. 2 (2), 183-189 (2008).
- Mickoleit, M., et al. High-resolution reconstruction of the beating zebrafish heart. Nature Methods. 11 (9), 919-922 (2014).
- Voleti, V., et al. Real-time volumetric microscopy of in vivo dynamics and large-scale samples with SCAPE 2.0. Nature Methods. 16 (10), 1054-1062 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유