A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
القياس الكمي لانتقائية الميزة البصرية لمنعكس الحركة البصرية في الفئران
In This Article
Summary
هنا ، نصف بروتوكولا قياسيا لقياس المنعكس البصري. فهو يجمع بين تحفيز الأسطوانة الافتراضية وتصوير العين بالفيديو ، وبالتالي يسمح بتقييم دقيق لانتقائية الميزة للسلوك ومرونته التكيفية.
Abstract
المنعكس البصري (OKR) هو حركة عين فطرية أساسية يتم تشغيلها بواسطة الحركة العالمية للبيئة المرئية وتعمل على تثبيت صور الشبكية. نظرا لأهميته وقوته ، فقد تم استخدام OKR لدراسة التعلم البصري الحركي وتقييم الوظائف البصرية للفئران ذات الخلفيات الوراثية المختلفة والأعمار والعلاجات الدوائية. هنا ، نقدم إجراء لتقييم استجابات OKR للفئران الثابتة الرأس بدقة عالية. يمكن أن يستبعد تثبيت الرأس مساهمة التحفيز الدهليزي في حركات العين ، مما يجعل من الممكن قياس حركات العين الناتجة عن الحركة البصرية فقط. يتم استنباط OKR بواسطة نظام أسطوانة افتراضي ، حيث ينجرف صريف عمودي مقدم على ثلاث شاشات كمبيوتر أفقيا بطريقة تذبذبية أو أحادية الاتجاه بسرعة ثابتة. باستخدام نظام الواقع الافتراضي هذا ، يمكننا تغيير المعلمات المرئية بشكل منهجي مثل التردد المكاني ، والتردد الزمني / التذبذب ، والتباين ، والنصوع ، واتجاه الشبكات ، وتحديد منحنيات ضبط انتقائية الميزة المرئية. يضمن تصوير العين بالفيديو بالأشعة تحت الحمراء عالي السرعة قياسا دقيقا لمسار حركات العين. تتم معايرة عيون الفئران الفردية لتوفير فرص لمقارنة OKRs بين من مختلف الأعمار والأجناس والخلفيات الوراثية. تسمح القوة الكمية لهذه التقنية باكتشاف التغييرات في OKR عندما يتكيف هذا السلوك بشكل بلاستيكي بسبب الشيخوخة أو التجربة الحسية أو التعلم الحركي. وبالتالي ، فإنه يجعل هذه التقنية إضافة قيمة إلى ذخيرة الأدوات المستخدمة للتحقيق في مرونة سلوكيات العين.
Introduction
استجابة للمنبهات البصرية في البيئة ، تتحرك أعيننا لتحويل نظرتنا ، أو تثبيت صور الشبكية ، أو تتبع الأهداف المتحركة ، أو محاذاة نقرة العينين مع أهداف تقع على مسافات مختلفة من المراقب ، والتي تعتبر حيوية للرؤية المناسبة 1,2. تم استخدام السلوكيات الحركية للعين على نطاق واسع كنماذج جذابة للتكامل الحسي الحركي لفهم الدوائر العصبية في الصحة والمرض ، على الأقل جزئيا بسبب بساطة النظام الحركي للعين3. يتم التحكم في العين بواسطة ثلاثة أزواج من عضلات العين الخارجية ، وتدور العين في التجويف بشكل أساسي حول ثلاثة محاور مقابلة: الارتفاع والاكتئاب على طول المحور العرضي ، والتقريب والاختطاف على طول المحور الرأسي ، و intorsion و extorsion على طول المحور الأماميالخلفي 1,2. يسمح هذا النظام البسيط للباحثين بتقييم السلوكيات الحركية للفئران بسهولة ودقة في بيئة المختبر.
أحد السلوكيات الحركية الأولية للعين هو المنعكس البصري الحركي (OKR). يتم تشغيل حركة العين اللاإرادية هذه عن طريق الانجرافات البطيئة أو انزلاق الصور على شبكية العين وتعمل على تثبيت صور الشبكية عندما يتحرك رأس أو محيطه 2,4. إن OKR ، كنموذج سلوكي ، مثير للاهتمام للباحثين لعدة أسباب. أولا ، يمكن تحفيزه بشكل موثوق وكمي بدقة 5,6. ثانيا ، إجراءات القياس الكمي لهذا السلوك بسيطة نسبيا وموحدة ويمكن تطبيقها لتقييم الوظائف البصرية لمجموعة كبيرة من7. ثالثا ، هذا السلوك الفطري شديد البلاستيك5،8،9. يمكن تعزيز اتساعها عند حدوث زلات شبكية متكررة لفترة طويلة 5،8،9 ، أو عندما يكون شريكها في العمل منعكس العين الدهليزي (VOR) ، وهي آلية أخرى لتثبيت صور الشبكية الناتجة عن الإدخال الدهليزي2 ، ضعيفا5. تمكن هذه النماذج التجريبية لتقوية OKR الباحثين من الكشف عن أساس الدائرة الكامنة وراء التعلم الحركي للعين.
تم استخدام طريقتين غير جراحيتين بشكل أساسي لتقييم OKR في الدراسات السابقة: (1) تصوير العين بالفيديو جنبا إلى جنب مع طبل مادي7،10،11،12،13 أو (2) التحديد التعسفي لدوران الرأس جنبا إلى جنب مع طبل افتراضي6،14،15،16. على الرغم من أن تطبيقاتها قد حققت اكتشافات مثمرة في فهم الآليات الجزيئية والدوائر للدونة الحركية للعين ، إلا أن لكل من هاتين الطريقتين بعض العيوب التي تحد من قدراتهما في الفحص الكمي لخصائص OKR. أولا ، لا تسمح الطبول المادية ، ذات الأنماط المطبوعة من الخطوط أو النقاط بالأبيض والأسود ، بإجراء تغييرات سهلة وسريعة للأنماط المرئية ، مما يقيد إلى حد كبير قياس اعتماد OKR على ميزات بصرية معينة ، مثل التردد المكاني والاتجاه وتباين حواجز شبكية متحركة 8,17. بدلا من ذلك ، يمكن أن تستفيد اختبارات انتقائية OKR لهذه الميزات المرئية من التحفيز البصري المحوسب ، حيث يمكن تعديل الميزات المرئية بسهولة من تجربة إلى أخرى. بهذه الطريقة ، يمكن للباحثين فحص سلوك OKR بشكل منهجي في مساحة المعلمات المرئية متعددة الأبعاد. علاوة على ذلك ، فإن الطريقة الثانية لفحص OKR تشير فقط إلى عتبات المعلمات المرئية التي تؤدي إلى OKRs يمكن تمييزها ، ولكن ليس سعة حركات العين أو الرأس6،14،15،16. وبالتالي ، فإن الافتقار إلى القوة الكمية يمنع تحليل شكل منحنيات الضبط والميزات المرئية المفضلة ، أو اكتشاف الاختلافات الدقيقة بين الفئران الفردية في الظروف العادية والمرضية. للتغلب على القيود المذكورة أعلاه ، تم الجمع بين تصوير العين بالفيديو والتحفيز البصري الافتراضي المحوسب لفحص سلوك OKR في الدراسات الحديثة5،17،18،19،20. ومع ذلك ، لم تقدم هذه الدراسات المنشورة سابقا تفاصيل فنية كافية أو تعليمات خطوة بخطوة ، وبالتالي لا يزال من الصعب على الباحثين إنشاء اختبار OKR لأبحاثهم الخاصة.
هنا ، نقدم بروتوكولا لتحديد انتقائية الميزة المرئية بدقة لسلوك OKR في ظل الظروف الضوئية أو scotopic مع مزيج من تصوير العين بالفيديو والتحفيز البصري الافتراضي المحوسب. يتم تثبيت رأس الفئران لتجنب حركة العين التي يثيرها التحفيز الدهليزي. يتم استخدام كاميرا عالية السرعة لتسجيل حركات العين من الفئران التي تشاهد حواجز شبكية متحركة مع تغيير المعلمات البصرية. تتم معايرة الحجم المادي لمقل العيون للفئران الفردية لضمان دقة اشتقاق زاوية حركات العين21. تسمح هذه الطريقة الكمية بمقارنة سلوك OKR بين من مختلف الأعمار أو الخلفيات الوراثية ، أو مراقبة تغيره الناجم عن العلاجات الدوائية أو التعلم البصري الحركي.
Protocol
تمت الموافقة على جميع الإجراءات التجريبية التي أجريت في هذه الدراسة من قبل لجنة رعاية المحلية للعلوم البيولوجية ، وفقا للمبادئ التوجيهية التي وضعتها لجنة رعاية بجامعة تورنتو والمجلس الكندي لرعاية.
1. زرع شريط الرأس أعلى الجمجمة
ملاحظة: لتجنب مساهمة سلوك VOR في حركات العين ، يتم تثبيت رأس الماوس أثناء اختبار OKR. لذلك ، يتم زرع شريط الرأس جراحيا أعلى الجمجمة.
- تخدير فأر (أنثى وذكور C57BL / 6 يبلغان من العمر 2-5 أشهر) بمزيج من 4٪ إيزوفلوران (v / v) و O2 في غرفة الغاز. نقل الماوس إلى منصة جراحة مخصصة وتقليل تركيز الأيزوفلوران إلى 1.5٪ -2٪. راقب عمق التخدير عن طريق التحقق من استجابة إصبع القدم ومعدل التنفس طوال الجراحة.
- ضع وسادة تدفئة أسفل جسم للحفاظ على درجة حرارة جسمه. ضع طبقة من مرهم العين المزلق على كلتا العينين لحمايتهما من الجفاف. قم بتغطية العينين بورق الألمنيوم لحمايتهما من الإضاءة الخفيفة.
- حقن كاربروفين تحت الجلد بجرعة 20 ملغ/كغ لتقليل الألم. بعد ترطيب الفراء بمنظف الجلد غلوكونات الكلورهيكسيدين ، احلق الفراء أعلى الجمجمة. تطهير فروة الرأس المكشوفة مع 70 ٪ من الكحول الأيزوبروبيل وكحول الكلورهيكسيدين مرتين.
- حقن بوبيفاكايين (8 ملغ / كغ) تحت الجلد في موقع الشق ، ثم قم بإزالة فروة الرأس (~ 1 سم2) بالمقص لكشف السطح الظهري للجمجمة ، بما في ذلك العظم الجبهي الخلفي والعظم الجداري والعظم بين الجداري.
- ضع عدة قطرات من 1٪ يدوكائين و 1: 100000 إبينفرين على الجمجمة المكشوفة لتقليل الألم والنزيف الموضعي. اكشط الجمجمة باستخدام مكشطة Meyhoefer لإزالة اللفافة وتنظيفه بمحلول ملحي مخزن بالفوسفات (PBS).
ملاحظة: يتم فصل العضلة الصدغية عن الجمجمة لزيادة مساحة السطح لربط قضيب الرأس. - جفف الجمجمة عن طريق نفخ الهواء المضغوط برفق نحو سطح الجمجمة حتى تختفي الرطوبة ويتحول العظم إلى اللون الأبيض. ضع طبقة رقيقة من الغراء الفائق على السطح المكشوف للجمجمة ، بما في ذلك حافة فروة الرأس المقطوعة ، متبوعة بطبقة من راتنج الأكريليك.
ملاحظة: يجب أن يكون سطح الجمجمة خاليا من الدم أو الماء قبل تطبيق superglue. - ضع قضيب رأس من الفولاذ المقاوم للصدأ (انظر الشكل 1 أ) على طول خط الوسط أعلى الجمجمة. ضع المزيد من راتنج الأكريليك ، بدءا من حافة شريط الرأس حتى يتم تضمين قاعدة قضيب الرأس بالكامل في راتنج الأكريليك. ضع راتنج الأكريليك مرتين أو ثلاث مرات لبناء السماكة.
- انتظر لمدة 15 دقيقة حتى يصلب راتنج الأكريليك. حقن تحت الجلد 1 مل من محلول الجرس المرضع. ثم أعد الماوس إلى قفص يوضع على وسادة تدفئة حتى يصبح متحركا بالكامل.
- اسمح للماوس بالتعافي في قفص المنزل لمدة 5 أيام على الأقل بعد الجراحة. بمجرد أن يصبح في حالة جيدة ، ثبت رأسه بشريط الرأس في إعداد OKR لمدة 15-30 دقيقة لتعريفه بتثبيت الرأس والبيئة التجريبية. كرر التعريف مرة واحدة يوميا لمدة 3 أيام على الأقل.
2. إعداد الطبل الافتراضي وتصوير العين بالفيديو
- قم بتركيب ثلاث شاشات بشكل متعامد مع بعضها البعض لتشكيل حاوية مربعة تغطي ~ 270 درجة من السمت و 63 درجة من الارتفاع في الفضاء البصري (الشكل 1B على اليسار).
- باستخدام بطاقة رسومات منفصلة ، ادمج الشاشات الثلاث في شاشة بسيطة لضمان المزامنة عبر جميع الشاشات.
- قم بمعايرة إضاءة الشاشات كما هو موضح أدناه.
- قم بتشغيل الكمبيوتر الذي تتصل به الشاشات وانتظر لمدة 15 دقيقة. الإحماء ضروري للحصول على إضاءة مستقرة.
- قم بتغيير إعداد السطوع على الشاشة بشكل منهجي من 0 إلى 100 بخطوات 25.
- لكل قيمة سطوع ، قم بقياس نصوع الشاشات تحت قيم بكسل مختلفة (0-255 ، خطوات 15) باستخدام مقياس الإضاءة.
- قم بملاءمة العلاقة بين النصوع والسطوع لقيمة البكسل 255 مع الانحدار الخطي وقم بتقدير قيمة السطوع التي تؤدي إلى 160 cd / m2.
- لكل قيمة بيكسل مستخدمة في قياس النصوع (الخطوة 2.3.3)، قم بتقدير النصوع لقيمة السطوع المشتقة في الخطوة 2.3.4 بناء على الانحدار الخطي. استخدم دالة الطاقة lum = A * pixel γ لتناسب العلاقة بين المجموعة الجديدة من قيم النصوع (تحت قيمة السطوع المشتقة في 2.3.4) وقيم البكسل المقابلة لها لاشتقاق عامل جاما γوالمعامل A. سيتم استخدام هذه لتوليد حواجز شبكية جيبية لقيم النصوع المطلوبة.
- اضبط سطوع جميع الشاشات الثلاثة على القيم المشتقة في الخطوة 2.3.4 للتأكد من أن قيم النصوع الخاصة بها هي نفسها لنفس قيمة البكسل.
- قم بإنشاء أسطوانة افتراضية ، والتي تستخدم لتحفيز سلوك OKR ، باستخدام مجموعة أدوات التحفيز البصري ، كما هو موضح أدناه.
- قم بتقديم شبكة جيبية رأسية على الشاشات واضبط الفترة (التباعد بين الخطوط) على طول السمت لضمان أن يكون لإسقاط الشبكة على العين تردد مكاني ثابت (صريف الأسطوانة ؛ الشكل 1B الأوسط واليمين).
- تأكد من تثبيت رأس في وسط العلبة بحيث يرى أن الشبكة لها تردد مكاني ثابت عبر سطح الأسطوانة الافتراضية.
- قم بتعديل معلمات الشبكة المتحركة ، مثل السعة التذبذبية ، والتردد المكاني ، والتردد الزمني / التذبذب ، والاتجاه ، والتباين ، وما إلى ذلك ، في رموز التحفيز البصري. استخدم نوعين من الحركة البصرية: (1) تنحرف الشبكة في اتجاه عقارب الساعة أو عكس اتجاه عقارب الساعة بطريقة تذبذبية تتبع وظيفة جيبية:
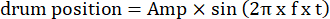
هنا ، Amp هو سعة مسار الأسطوانة ، f هو تردد التذبذب ، و t هو الوقت (سعة التذبذب: 5 ° ؛ التردد المكاني للشبك: 0.04-0.45 CPD ؛ تردد التذبذب: 0.1-0.8 هرتز ، المقابلة لسرعة الذروة للتحفيز من 3.14-25.12 درجة / ثانية [سرعة الأسطوانة = أمبير × 2π × و × كوس (2π × و × ر) ؛ التباين: 80%-100%; متوسط الإنارة: 35-45 شمعة / م2 ؛ (2) تنحرف الشبكة في اتجاه واحد بسرعة ثابتة: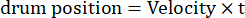
(التردد المكاني: 0.04-0.64 CPD ؛ التردد الزمني: 0.25-1 هرتز ؛ سرعة الأسطوانة = التردد الزمني / التردد المكاني.)
- قم بإعداد تصوير العين بالفيديو كما هو موضح أدناه.
- لتجنب انسداد المجال البصري للحيوان ، ضع مرآة الأشعة تحت الحمراء (IR) 60 درجة من خط الوسط لتشكيل صورة للعين اليمنى.
- ضع كاميرا الأشعة تحت الحمراء على الجانب الأيمن خلف الماوس (الشكل 1C على اليسار) لالتقاط صورة للعين اليمنى.
- قم بتركيب كاميرا الأشعة تحت الحمراء عالية السرعة على ذراع الكاميرا الذي يسمح للكاميرا بالدوران بمقدار ± 10 درجات حول صورة العين اليمنى (الشكل 1C على اليمين).
- استخدم الصمام الثنائي الضوئي المتصل بإحدى الشاشات لتوفير إشارة كهربائية لمزامنة توقيت تصوير العين بالفيديو والتحفيز البصري.
- ضع أربعة صمامات ثنائية باعثة للضوء بالأشعة تحت الحمراء (LEDs) مدعومة بأذرع معقوفة حول العين اليمنى لتوفير إضاءة الأشعة تحت الحمراء للعين.
- ضع اثنين من مصابيح LED للأشعة تحت الحمراء على الكاميرا لتوفير مراجع انعكاس القرنية (CR): أحدهما مثبت فوق الكاميرا (X-CR) ، بينما الآخر على الجانب الأيسر من الكاميرا (Y-CR; الشكل 1 د).
- قم بقياس التكبير البصري لنظام تصوير العين بالفيديو باستخدام شريحة معايرة.
ملاحظة: يتم استخدام CRs المرجعية لإلغاء حركات العين الانتقالية عند حساب زاوية العين بناء على حركات العين الدورانية.
- ثبت رأس في وسط العلبة التي شكلتها الشاشات ، كما هو موضح أدناه.
- ثبت رأس بلوحة الرأس في وسط الحفارة واجعله مواجها للأمام. اضبط إمالة الرأس بحيث يتم تسوية العينين اليسرى واليمنى ، ويتم محاذاة الزوايا الأنفية والزمنية للعينين أفقيا (الشكل 1E).
- حرك رأس أفقيا عن طريق الضبط الخشن الذي يوفره جهاز تثبيت الرأس والتعديل الدقيق الذي توفره مرحلة الترجمة 2D ، وعموديا من خلال جهاز تثبيت الرأس وزوج حامل آخر / آخر ، حتى تظهر العين اليمنى للحيوان في الفيديو المباشر للكاميرا. قبل معايرة وقياس حركات العين ، قم بتراكب صورة العين اليمنى للحيوان المنعكسة بواسطة المرآة الساخنة مع النقطة المحورية لذراع الكاميرا (انظر التفاصيل في الخطوة 3.4 أدناه).
- قم ببناء حاوية مخصصة حول منصة OKR لحجب ضوء الغرفة (الشكل 1F).
3. معايرة حركات العين
ملاحظة: يتم حساب حركات العين الدورانية بناء على حركات التلميذ ونصف قطر مدار حركات الحدقة (Rp ، المسافة من مركز التلميذ إلى مركز مقلة العين). لكل فأر فردي ، يتم قياس نصف القطر هذا تجريبيا21.
- ثبت رأس في وسط العلبة التي شكلتها الشاشات الثلاثة ، كما هو موضح في الخطوة 2.6.1.
- قم بتشغيل الكاميرا واضبط مصابيح LED الأربعة المحيطة بالعين اليمنى لتحقيق إضاءة موحدة بالأشعة تحت الحمراء.
- ضمن التوجيه البصري، اضبط موضع العين اليمنى حتى تظهر في وسط الفيديو، كما هو موضح في الخطوة 2.6.2.
- قم بمحاذاة الصورة الافتراضية للعين اليمنى مع النقطة المحورية لذراع الكاميرا، كما هو موضح أدناه.
- قم بتدوير ذراع الكاميرا يدويا إلى الطرف الأقصى الأيسر (-10 درجة). حرك موضع العين اليمنى للحيوان يدويا على المستوى الأفقي عموديا على المحور البصري مع ضبط دقيق للمرحلة الانتقالية 2D (الشكل 1C ، السهم الأخضر) ، حتى يكون X-CR في المركز الأفقي للصورة.
- قم بتدوير ذراع الكاميرا يدويا إلى الطرف الآخر (+10 درجات). إذا هرب X-CR من مركز الصورة ، فحرك العين اليمنى على طول المحور البصري مع ضبط دقيق حتى يصل X-CR إلى المركز (الشكل 1C ، السهم الأزرق).
- كرر الخطوات من 3.4.1 إلى 3.4.2 عدة مرات حتى يظل X-CR في المركز عندما يتأرجح ذراع الكاميرا إلى اليسار واليمين. إذا تحركت العين اليمنى في منتصف تكرار واحد ، فأعد تشغيل عملية الضبط.
- قم بقياس المسافة الرأسية بين Y-CR وX-CR بعد قفل ذراع الكاميرا في الموضع المركزي. قم بتشغيل مؤشر Y-CR LED وسجل موضعه على الفيديو ، ثم قم بالتبديل إلى X-CR LED وسجل موضعه.
ملاحظة: سيتم استخدام المسافة الرأسية بين Y-CR و X-CR لاشتقاق موضع Y-CR أثناء قياس حركات العين التي يتم فيها تشغيل X-CR LED فقط. - قم بقياس نصف قطر دوران التلميذ Rp ، كما هو موضح أدناه.
- قم بتدوير ذراع الكاميرا إلى الطرف الأيسر (-10 درجة) وسجل مواضع التلميذ (Pp1) و X-CR (PCR1) على الفيديو.
- بعد ذلك ، قم بتدوير ذراع الكاميرا إلى الطرف الأيمن (+10 درجات) وسجل مواضع التلميذ (Pp2) و X-CR (PCR2) على الفيديو. كرر هذه الخطوة عدة مرات.
ملاحظة: يجب أن تظل العين اليمنى للحيوان ثابتة أثناء كل تكرار بحيث يعكس مقدار حركات التلميذ في الفيلم بدقة درجة تأرجح ذراع الكاميرا. - بناء على القيم المسجلة أعلاه ، احسب نصف قطر دوران التلميذ Rp (الشكل 2A) بالصيغة التالية:
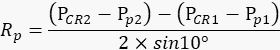
ملاحظة: يتم حساب المسافة بين انعكاس القرنية ومركز التلميذ في المساحة المادية بناء على المسافة بينهما في الفيلم:
PCR - Pp = عدد وحدات البكسل في الفيلم × حجم بكسل شريحة الكاميرا × التكبير
- تطوير العلاقة بين Rp وقطر التلميذ ، كما هو موضح أدناه. يتغير Rp عندما يتوسع التلميذ أو يضيق ؛ تقريبا ، تتناسب قيمته عكسيا مع حجم التلميذ (الشكل 2B أعلى).
- قم بتغيير إضاءة الشاشات بشكل منهجي من 0 إلى 160 شمعة / م2 لتنظيم حجم التلميذ.
- لكل قيمة نصوع ، كرر الخطوة 3.6 8-10 مرات وسجل قطر التلميذ.
- قم بتطبيق الانحدار الخطي على العلاقة بين Rp وقطر التلميذ بناء على القيم المقاسة أعلاه لاشتقاق المنحدر والتقاطع (الشكل 2B السفلي).
ملاحظة: تتم إزالة القيم المتطرفة الناتجة عن حركات العين العرضية قبل التركيب الخطي. بالنسبة للقياسات المتكررة في جلسات متعددة ، يجب إجراء المعايرة مرة واحدة فقط لحيوان واحد ، ما لم تكبر عينه أثناء التجربة.
4. سجل حركات العين من OKR
- قم بإصلاح الماوس في الجهاز باتباع الخطوات 3.1-3.4. تخطي هذه الخطوة إذا حدث التسجيل مباشرة بعد الانتهاء من المعايرة. قفل ذراع الكاميرا في الموضع المركزي.
- قم بإعداد الشاشات ل scotopic OKR كما هو موضح أدناه. تخطي هذه الخطوة ل OKR الضوئية.
- قم بتغطية شاشة كل شاشة بمرشح مخصص ، وهو مصنوع من خمس طبقات من فيلم الكثافة المحايدة (ND) 1.2. تأكد من عدم تسرب الضوء من خلال الفجوة بين المرشح والشاشة.
- أطفئ ضوء الغرفة. تتم الخطوات التالية بمساعدة نظارة الأشعة تحت الحمراء.
- ضع قطرة واحدة من محلول بيلوكاربين (2٪ في محلول ملحي) على العين اليمنى وانتظر 15 دقيقة. تأكد من بقاء القطرة على العين وعدم مسحها بواسطة الماوس. إذا تم مسح المحلول من قبل ، ضع قطرة أخرى من محلول بيلوكاربين. هذا يقلص التلميذ إلى الحجم المناسب لتتبع العين في ظل حالة scotopic.
ملاحظة: في ظل الحالة المنظارية ، يتوسع التلميذ بشكل كبير بحيث تكون حافته مخفية جزئيا خلف الجفن. هذا يؤثر على دقة تقدير مركز التلميذ عن طريق تصوير العين بالفيديو. يؤدي تقليص بؤبؤ العين اليمنى دوائيا إلى تقليل مدخلاته البصرية ، وبالتالي يتم تقديم المحفزات البصرية إلى العين اليسرى. - شطف العين اليمنى بمحلول ملحي لغسل محلول بيلوكاربين جيدا. اسحب الستارة لأسفل لإغلاق العلبة تماما ، مما يمنع الضوء الشارد من التدخل في الرؤية السكوتوبية.
- امنح 5 دقائق للتكيف تماما مع البيئة السكوبية قبل بدء اختبار OKR.
- قم بتشغيل برنامج التحفيز البصري وبرنامج تتبع العين. لقياس OKR الضوئي ، تأكد من تذبذب شبكة الأسطوانة أفقيا مع مسار جيبي ؛ لقياس OKR scotopic ، تأكد من أن شبكة الأسطوانة تنجرف بسرعة ثابتة من اليسار إلى اليمين ، وهو الاتجاه الصدغي الأنفي في إشارة إلى العين اليسرى.
ملاحظة: عندما يتقلص بؤبؤ العين اليمنى ، ولكن ليس العين اليسرى ، بواسطة بيلوكاربين تحت حالة scotopic ، فإن OKR المستنبط من تحفيز الأسطوانة التذبذبية يكون غير متماثل للغاية. وبالتالي ، لقياس OKR scotopic ، يتم تحفيز العين اليسرى أثناء مراقبة حركة العين اليمنى. - يقيس برنامج تتبع العين تلقائيا حجم التلميذ وموضع CR وموضع التلميذ لكل إطار ، ويحسب زاوية موضع العين بناء على الصيغة التالية (الشكل 2C):
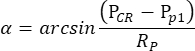
هنا ، P CR هو موضعCR ، Pp هو موضع التلميذ ، و Rp هو نصف قطر دوران التلميذ. يتم حساب المسافة بين انعكاس القرنية ومركز التلميذ في الفضاء المادي بناء على المسافة بينهما في الفيلم:
PCR - Pp = عدد وحدات البكسل في الفيلم × حجم بكسل شريحة الكاميرا × التكبير
يتم اشتقاق Rp من حجم التلميذ المقابل بناء على نموذج الانحدار الخطي في الخطوة 3.7.3 (الشكل 2B السفلي).
5. تحليل حركات العين من OKR مع برنامج تحليل العين
- قم بمعالجة آثار العين باستخدام مرشح متوسط (نافذة المرشح = 0.05 ثانية) لإزالة الضوضاء عالية التردد (الشكل 3 أ الأوسط).
- قم بإزالة الأكياس أو الرأرأة كما هو موضح أدناه.
- تقدير سرعة العين عن طريق حساب مشتق الدرجة الأولى لحركات العين (الشكل 3A أسفل). حدد الأكياس أو الرأرأة من خلال تطبيق عتبة سرعة تبلغ 50 درجة / ثانية (الشكل 3 أ أسفل).
- استبدل الأكياس أو الرأرأة باستقراء مواضع العين أثناء حركات العين السريعة هذه من الجزء قبل الأكياس أو الرأرأة بناء على الانحدار الخطي (الشكل 3 ب).
- احسب سعة حركات العين OKR عن طريق تحويل فورييه السريع (خوارزمية Goertzel) إذا تذبذبت شبكة الأسطوانة (الشكل 3C) ، أو احسب متوسط سرعة حركات العين أثناء التحفيز البصري إذا تحركت شبكة الأسطوانة بسرعة ثابتة في اتجاه واحد (الشكل 3B أسفل).
ملاحظة: تتشابه سعة حركات العين التذبذبية المشتقة من تحويل فورييه مع السعة المشتقة من تركيب مسار العين بوظيفة جيبية (الشكل 3D). - احسب كسب OKR. بالنسبة لحركة الأسطوانة التذبذبية ، يتم تعريف كسب OKR على أنه نسبة سعة حركات العين إلى سعة حركات الأسطوانة (الشكل 3C على اليمين). بالنسبة لحركة الأسطوانة أحادية الاتجاه ، يتم تعريف كسب OKR على أنه نسبة سرعة العين إلى سرعة صريف الأسطوانة (الشكل 3B السفلي).
النتائج
من خلال الإجراء المفصل أعلاه ، قمنا بتقييم اعتماد OKR على العديد من الميزات المرئية. تم اشتقاق أمثلة الآثار الموضحة هنا باستخدام رموز التحليل المتوفرة في ملف الترميز التكميلي 1 ، ويمكن العثور على مثال تتبع الملف الخام في ملف الترميز التكميلي 2. عندما انجرفت شبكة الأسطوانة ...
Discussion
توفر طريقة الفحص السلوكي OKR المعروضة هنا العديد من المزايا. أولا ، يحل التحفيز البصري الذي يتم إنشاؤه بواسطة الكمبيوتر المشكلات الجوهرية للطبول المادية. التعامل مع مسألة أن الطبول المادية لا تدعم الفحص المنهجي للتردد المكاني أو الاتجاه أو ضبط التباين8 ، تسمح الأسطوانة الافتر...
Disclosures
يعلن المؤلفون عدم وجود مصالح متنافسة.
Acknowledgements
نحن ممتنون ل Yingtian He لمشاركة بيانات ضبط الاتجاه. تم دعم هذا العمل بمنح من المؤسسة الكندية للابتكار وصندوق أبحاث أونتاريو (مشروع CFI / ORF رقم 37597) ، NSERC (RGPIN-2019-06479) ، CIHR (Project Grant 437007) ، وجوائز كونوت للباحثين الجدد.
Materials
| Name | Company | Catalog Number | Comments |
| 2D translational stage | Thorlabs | XYT1 | |
| Acrylic resin | Lang Dental | B1356 | For fixing headplate on skull and protecting skull |
| Bupivacaine | STERIMAX | ST-BX223 | Bupivacaine Injection BP 0.5%. Local anesthesia |
| Carprofen | RIMADYL | 8507-14-1 | Analgesia |
| Compressed air | Dust-Off | ||
| Eye ointment | Alcon | Systane | For maintaining moisture of eyes |
| Graphic card | NVIDIA | Geforce GTX 1650 or Quadro P620. | For generating single screen among three monitors |
| Heating pad | Kent Scientific | HTP-1500 | For maintaining body temperature |
| High-speed infrared (IR) camera | Teledyne Dalsa | G3-GM12-M0640 | For recording eye rotation |
| IR LED | Digikey | PDI-E803-ND | For CR reference and the illumination of the eye |
| IR mirror | Edmund optics | 64-471 | For reflecting image of eye |
| Isoflurane | FRESENIUS KABI | CP0406V2 | |
| Labview | National instruments | version 2014 | eye tracking |
| Lactated ringer | BAXTER | JB2324 | Water and energy supply |
| Lidocaine and epinephrine mix | Dentsply Sirona | 82215-1 | XYLOCAINE. Local anesthesia |
| Luminance Meter | Konica Minolta | LS-150 | for calibration of monitors |
| Matlab | MathWorks | version xxx | analysis of eye movements |
| Meyhoefer Curette | World Precision Instruments | 501773 | For scraping skull and removing fascia |
| Microscope calibration slide | Amscope | MR095 | to measure the magnification of video-oculography |
| Monitors | Acer | B247W | Visual stimulation |
| Neutral density filter | Lee filters | 299 | to generate scotopic visual stimulation |
| Nigh vision goggle | Alpha optics | AO-3277 | for scotopic OKR |
| Photodiode | Digikey | TSL254-R-LF-ND | to synchronize visual stimulation and video-oculography |
| Pilocarpine hydrochloride | Sigma-Aldrich | P6503 | |
| Post | Thorlabs | TR1.5 | |
| Post holder | Thorlabs | PH1 | |
| PsychoPy | open source software | version xxx | visual stimulation toolkit |
| Scissor | RWD | S12003-09 | For skin removal |
| Superglue | Krazy Glue | Type: All purpose. For adhering headplate on the skull |
References
- Gerhard, D. Neuroscience. 5th Edition. Yale Journal of Biology and Medicine. , (2013).
- Distler, C., Hoffmann, K. P. . The Oxford Handbook of Eye Movement. , 65-83 (2011).
- Sereno, A. B., Bolding, M. S. . Executive Functions: Eye Movements and Human Neurological Disorders. , (2017).
- Giolli, R. A., Blanks, R. H. I., Lui, F. The accessory optic system: basic organization with an update on connectivity, neurochemistry, and function. Progress in Brain Research. 151, 407-440 (2006).
- Liu, B. H., Huberman, A. D., Scanziani, M. Cortico-fugal output from visual cortex promotes plasticity of innate motor behaviour. Nature. 538 (7625), 383-387 (2016).
- Prusky, G. T., Alam, N. M., Beekman, S., Douglas, R. M. Rapid quantification of adult and developing mouse spatial vision using a virtual optomotor system. Investigative Ophthalmology & Visual Science. 45 (12), 4611-4616 (2004).
- Stahl, J. S., van Alphen, A. M., De Zeeuw, C. I. A comparison of video and magnetic search coil recordings of mouse eye movements. Journal of Neuroscience Methods. 99 (1-2), 101-110 (2000).
- Faulstich, B. M., Onori, K. A., du Lac, S. Comparison of plasticity and development of mouse optokinetic and vestibulo-ocular reflexes suggests differential gain control mechanisms. Vision Research. 44 (28), 3419-3427 (2004).
- Katoh, A., Kitazawa, H., Itohara, S., Nagao, S. Dynamic characteristics and adaptability of mouse vestibulo-ocular and optokinetic response eye movements and the role of the flocculo-olivary system revealed by chemical lesions. Proceedings of the National Academy of Sciences. 95 (13), 7705-7710 (1998).
- Cahill, H., Nathans, J. The optokinetic reflex as a tool for quantitative analyses of nervous system function in mice: application to genetic and drug-induced variation. PLoS One. 3 (4), 2055 (2008).
- Cameron, D. J., et al. The optokinetic response as a quantitative measure of visual acuity in zebrafish. Journal of Visualized Experiments. (80), 50832 (2013).
- de Jeu, M., De Zeeuw, C. I. Video-oculography in mice. Journal of Visualized Experiments. (65), e3971 (2012).
- Kodama, T., du Lac, S. Adaptive acceleration of visually evoked smooth eye movements in mice. The Journal of Neuroscience. 36 (25), 6836-6849 (2016).
- Doering, C. J., et al. Modified Ca(v)1.4 expression in the Cacna1f(nob2) mouse due to alternative splicing of an ETn inserted in exon 2. PLoS One. 3 (7), e2538 (2008).
- Shi, C., et al. Optimization of optomotor response-based visual function assessment in mice. Scientific Reports. 8 (1), 9708 (2018).
- Waldner, D. M., et al. Transgenic expression of Cacna1f rescues vision and retinal morphology in a mouse model of congenital stationary night blindness 2A (CSNB2A). Translational Vision Science & Technology. 9 (11), 19 (2020).
- Tabata, H., Shimizu, N., Wada, Y., Miura, K., Kawano, K. Initiation of the optokinetic response (OKR) in mice. Journal of Vision. 10 (1), 1-17 (2010).
- Al-Khindi, T., et al. The transcription factor Tbx5 regulates direction-selective retinal ganglion cell development and image stabilization. Current Biology. 32 (19), 4286-4298 (2022).
- Harris, S. C., Dunn, F. A. Asymmetric retinal direction tuning predicts optokinetic eye movements across stimulus conditions. eLife. 12, e81780 (2023).
- van Alphen, B., Winkelman, B. H., Frens, M. A. Three-dimensional optokinetic eye movements in the C57BL/6J mouse. Investigative Ophthalmology & Visual Science. 51 (1), 623-630 (2010).
- Stahl, J. S. Calcium channelopathy mutants and their role in ocular motor research. Annals of the New York Academy of Sciences. 956, 64-74 (2002).
- Endo, S., et al. Dual involvement of G-substrate in motor learning revealed by gene deletion. Proceedings of the National Academy of Sciences. 106 (9), 3525-3530 (2009).
- Thomas, B. B., Seiler, M. J., Sadda, S. R., Coffey, P. J., Aramant, R. B. Optokinetic test to evaluate visual acuity of each eye independently. Journal of Neuroscience Methods. 138 (1-2), 7-13 (2004).
- Burroughs, S. L., Kaja, S., Koulen, P. Quantification of deficits in spatial visual function of mouse models for glaucoma. Investigative Ophthalmology & Visual Science. 52 (6), 3654-3659 (2011).
- Wakita, R., et al. Differential regulations of vestibulo-ocular reflex and optokinetic response by β- and α2-adrenergic receptors in the cerebellar flocculus. Scientific Reports. 7 (1), 3944 (2017).
- Dehmelt, F. A., et al. Spherical arena reveals optokinetic response tuning to stimulus location, size, and frequency across entire visual field of larval zebrafish. eLife. 10, e63355 (2021).
- Magnusson, M., Pyykko, I., Jantti, V. Effect of alertness and visual attention on optokinetic nystagmus in humans. American Journal of Otolaryngology. 6 (6), 419-425 (1985).
- Collins, W. E., Schroeder, D. J., Elam, G. W. Effects of D-amphetamine and of secobarbital on optokinetic and rotation-induced nystagmus. Aviation, Space, and Environmental Medicine. 46 (4), 357-364 (1975).
- Reimer, J., et al. Pupil fluctuations track fast switching of cortical states during quiet wakefulness. Neuron. 84 (2), 355-362 (2014).
- Sakatani, T., Isa, T. PC-based high-speed video-oculography for measuring rapid eye movements in mice. Neuroscience Research. 49 (1), 123-131 (2004).
- Sakatani, T., Isa, T. Quantitative analysis of spontaneous saccade-like rapid eye movements in C57BL/6 mice. Neuroscience Research. 58 (3), 324-331 (2007).
- Vinck, M., Batista-Brito, R., Knoblich, U., Cardin, J. A. Arousal and locomotion make distinct contributions to cortical activity patterns and visual encoding. Neuron. 86 (3), 740-754 (2015).
- Bradley, M. M., Miccoli, L., Escrig, M. A., Lang, P. J. The pupil as a measure of emotional arousal and autonomic activation. Psychophysiology. 45 (4), 602-607 (2008).
- Hess, E. H., Polt, J. M. Pupil size as related to interest value of visual stimuli. Science. 132 (3423), 349-350 (1960).
- Di Stasi, L. L., Catena, A., Canas, J. J., Macknik, S. L., Martinez-Conde, S. Saccadic velocity as an arousal index in naturalistic tasks. Neuroscience and Biobehavioral Reviews. 37 (5), 968-975 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved