Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Количественная оценка селективности зрительных признаков оптокинетического рефлекса у мышей
В этой статье
Резюме
Здесь мы опишем стандартный протокол количественной оценки оптокинетического рефлекса. Он сочетает в себе виртуальную стимуляцию барабана и видеоокулографию, что позволяет точно оценить селективность поведения и его адаптивную пластичность.
Аннотация
Оптокинетический рефлекс (OKR) — это важнейшее врожденное движение глаз, которое запускается глобальным движением зрительной среды и служит для стабилизации изображений сетчатки. Благодаря своей важности и надежности, OKR используется для изучения зрительно-моторного обучения и оценки зрительных функций мышей с разным генетическим фоном, возрастом и лекарственным лечением. Здесь мы представляем процедуру оценки OKR-ответов мышей с фиксированной головой с высокой точностью. Фиксация головы может исключить влияние вестибулярной стимуляции на движения глаз, что позволяет измерять движения глаз, вызванные только зрительным движением. OKR вызывается виртуальной барабанной системой, в которой вертикальная решетка, представленная на трех компьютерных мониторах, дрейфует горизонтально колебательно или в одном направлении с постоянной скоростью. С помощью этой системы виртуальной реальности мы можем систематически изменять визуальные параметры, такие как пространственная частота, временная/колебательная частота, контрастность, яркость и направление решеток, а также количественно оценивать кривые настройки селективности визуальных признаков. Высокоскоростная инфракрасная видеоокулография обеспечивает точное измерение траектории движений глаз. Глаза отдельных мышей откалиброваны, чтобы обеспечить возможность сравнения OKR между животными разного возраста, пола и генетического происхождения. Количественная сила этого метода позволяет обнаруживать изменения в OKR, когда это поведение пластически адаптируется из-за старения, сенсорного опыта или моторного обучения; Таким образом, это делает этот метод ценным дополнением к репертуару инструментов, используемых для исследования пластичности поведения глаз.
Введение
В ответ на визуальные раздражители в окружающей среде наши глаза двигаются, чтобы переместить наш взгляд, стабилизировать изображения на сетчатке, отслеживать движущиеся цели или выровнять ямки двух глаз с мишенями, расположенными на разном расстоянии от наблюдателя, что жизненно важно для правильного зрения 1,2. Глазодвигательное поведение широко использовалось в качестве привлекательных моделей сенсомоторной интеграции для понимания нейронных цепей в норме и при болезнях, по крайней мере, отчасти из-за простоты глазодвигательнойсистемы. Управляемый тремя парами экстраокулярных мышц, глаз вращается в глазнице преимущественно вокруг трех соответствующих осей: возвышение и впадина вдоль поперечной оси, приведение и отведение вдоль вертикальной оси и инторсия и разгибание вдоль переднезадней оси 1,2. Такая простая система позволяет исследователям легко и точно оценивать глазодвигательное поведение мышей в лабораторных условиях.
Одним из основных глазодвигательных движений является оптокинетический рефлекс (OKR). Это непроизвольное движение глаз вызывается медленным дрейфом или проскальзыванием изображений на сетчатке и служит для стабилизации изображений сетчатки при движении головы животного или его окружения 2,4. OKR, как поведенческая парадигма, интересен исследователям по нескольким причинам. Во-первых, его можно надежно стимулировать и точно количественно определить 5,6. Во-вторых, процедуры количественной оценки этого поведения относительно просты и стандартизированы и могут быть применены для оценки зрительных функций большой когортыживотных. В-третьих, это врожденное поведение очень пластично 5,8,9. Его амплитуда может быть потенцирована, когда повторяющиеся соскальзывания сетчатки происходят в течение длительного времени 5,8,9, или когда его рабочий партнер вестибулярный глазной рефлекс (VOR), другой механизм стабилизации изображений сетчатки, запускаемый вестибулярным входом2, нарушен5. Эти экспериментальные парадигмы потенцирования OKR дают исследователям возможность раскрыть схемную основу, лежащую в основе глазодвигательного обучения.
В предыдущих исследованиях для оценки OKR в основном использовались два неинвазивных метода: (1) видеоокулография в сочетании с физическим барабаном 7,10,11,12,13 или (2) произвольное определение поворотов головы в сочетании с виртуальным барабаном6,14,15,16. Несмотря на то, что их применение привело к плодотворным открытиям в понимании молекулярных и схемных механизмов глазодвигательной пластичности, каждый из этих двух методов имеет некоторые недостатки, которые ограничивают их возможности в количественном исследовании свойств OKR. Во-первых, физические барабаны, с напечатанными узорами из черно-белых полос или точек, не позволяют легко и быстро менять визуальные паттерны, что в значительной степени ограничивает измерение зависимости OKR от некоторых визуальных признаков, таких как пространственная частота, направление и контрастность движущихся решеток 8,17. Вместо этого тесты селективности OKR к этим визуальным признакам могут быть полезны с помощью компьютеризированной зрительной стимуляции, при которой зрительные признаки могут быть легко изменены от испытания к испытанию. Таким образом, исследователи могут систематически изучать поведение OKR в многомерном пространстве визуальных параметров. Более того, второй метод анализа OKR сообщает только пороговые значения визуальных параметров, которые вызывают различимые OKR, но не амплитуды движений глаз или головы 6,14,15,16. Таким образом, недостаток количественной мощности не позволяет анализировать форму кривых настройки и предпочтительные визуальные признаки, а также обнаруживать тонкие различия между отдельными мышами в нормальных и патологических условиях. Чтобы преодолеть вышеуказанные ограничения, видеоокулография и компьютеризированная виртуальная визуальная стимуляция были объединены для анализа поведения OKR в недавних исследованиях 5,17,18,19,20. Тем не менее, эти ранее опубликованные исследования не предоставили достаточно технических подробностей или пошаговых инструкций, и, следовательно, исследователям по-прежнему сложно установить такой тест OKR для своих собственных исследований.
Здесь мы представляем протокол для точной количественной оценки селективности зрительных признаков поведения OKR в фотопических или скотопических условиях с комбинацией видеоокулографии и компьютеризированной виртуальной визуальной стимуляции. Мышей фиксируют голову, чтобы избежать движения глаз, вызванного вестибулярной стимуляцией. Высокоскоростная камера используется для записи движений глаз мышей, рассматривающих движущиеся решетки с изменяющимися визуальными параметрами. Физический размер глазных яблок отдельных мышей калибруется для обеспечения точности определения угла движения глаз21. Этот количественный метод позволяет сравнивать поведение OKR у животных разного возраста или генетического фона, а также отслеживать его изменение, вызванное фармакологическим лечением или зрительно-моторным обучением.
протокол
Все экспериментальные процедуры, выполненные в этом исследовании, были одобрены Местным комитетом по уходу за животными биологических наук в соответствии с руководящими принципами, установленными Комитетом по уходу за животными Университета Торонто и Канадским советом по уходу за животными.
1. Имплантация перекладины на голову на верхней части черепа
ПРИМЕЧАНИЕ: Чтобы избежать влияния поведения VOR на движения глаз, голова мыши обездвиживается во время теста OKR. Поэтому в верхней части черепа хирургическим путем имплантируется перекладина.
- Обезболить мышь (2-5-месячную самку и самца C57BL/6) смесью 4% изофлурана (v/v) иO2 в газовой камере. Перенесите мышь на индивидуальную хирургическую платформу и уменьшите концентрацию изофлурана до 1,5%-2%. Контролируйте глубину анестезии, проверяя реакцию на защемление пальца ноги и частоту дыхания на протяжении всей операции.
- Подложите под тело животного грелку, чтобы поддерживать температуру его тела. Нанесите слой смазывающей глазной мази на оба глаза, чтобы защитить их от пересыхания. Накройте глаза алюминиевой фольгой, чтобы защитить их от легкого освещения.
- Подкожно вводят карпрофен в дозе 20 мг/кг для уменьшения боли. Намочив мех хлоргексидина глюконатом для чистки кожи, сбрейте шерсть на макушке черепа. Продезинфицируйте открытую кожу головы 70% изопропиловым спиртом и хлоргексидиновым спиртом дважды.
- Введите бупивакаин (8 мг/кг) подкожно в место разреза, затем удалите ножницами кожу головы (~1см2), чтобы обнажить дорсальную поверхность черепа, включая заднюю лобную кость, теменную кость и межтеменную кость.
- Нанесите несколько капель 1% лидокаина и адреналина в соотношении 1:100 000 на открытый череп, чтобы уменьшить местную боль и кровотечение. Соскоблите череп кюреткой Мейхофера, чтобы удалить фасцию, и очистите ее фосфатно-солевым буфером (PBS).
ПРИМЕЧАНИЕ: Височная мышца отделена от черепа, чтобы увеличить площадь поверхности для крепления перекладины на голове. - Высушите череп, осторожно продувая сжатым воздухом поверхность черепа до тех пор, пока влага не исчезнет и кость не станет беловатой. Нанесите тонкий слой суперклея на открытую поверхность черепа, включая край срезанной кожи головы, а затем слой акриловой смолы.
ПРИМЕЧАНИЕ: Поверхность черепа должна быть очищена от крови или воды перед нанесением суперклея. - Поместите перекладину головы из нержавеющей стали (см. рис. 1A) вдоль средней линии на верхнюю часть черепа. Нанесите больше акриловой смолы, начиная от края оголовка до тех пор, пока основание оголовка не будет полностью погружено в акриловую смолу. Нанесите акриловую смолу два или три раза, чтобы нарастить толщину.
- Подождите около 15 минут, пока акриловая смола не затвердеет. Подкожно вводят 1 мл лактатного раствора рингера. Затем верните мышь в клетку, помещенную на грелку, пока животное не станет полностью подвижным.
- Дайте мышке восстановиться в домашней клетке в течение как минимум 5 дней после операции. После того, как животное будет в хорошей форме, зафиксируйте его голову с помощью перекладины на голове в установке OKR на 15-30 минут, чтобы ознакомить его с фиксацией головы и экспериментальной средой. Повторять ознакомление один раз в день в течение не менее 3 дней.
2. Настройка виртуального барабана и видео-окулографии
- Установите три монитора перпендикулярно друг другу, чтобы сформировать квадратный корпус, который охватывает ~270° азимута и 63° возвышения в визуальном пространстве (рис. 1B слева).
- С помощью дискретной видеокарты можно объединить три монитора в простой дисплей, чтобы обеспечить синхронизацию между всеми мониторами.
- Откалибруйте яркость мониторов, как описано ниже.
- Включите компьютер, к которому подключены мониторы, и подождите 15 минут. Прогрев необходим для получения стабильной яркости.
- Систематически изменяйте настройку яркости на мониторе от 0 до 100 с шагом 25.
- Для каждого значения яркости измерьте яркость мониторов при различных значениях пикселей (0-255, шаг 15) с помощью измерителя яркости.
- Сопоставьте зависимость между яркостью и яркостью для значения пикселя 255 с помощью линейной регрессии и оцените значение яркости, которое дает 160 кд/м2.
- Для каждого значения пикселя, используемого при измерении яркости (шаг 2.3.3), оцените яркость для значения яркости, полученного на шаге 2.3.4 на основе линейной регрессии. Используйте степенную функцию lum = A * пиксельныйγ для подгонки соотношения между новым набором значений яркости (под значением яркости, полученным в 2.3.4) и соответствующими им значениями пикселей для получения гамма-фактора γ и коэффициента A. Они будут использоваться для создания синусоидальных решеток с желаемыми значениями яркости.
- Установите яркость всех трех мониторов на значения, полученные на шаге 2.3.4, чтобы убедиться, что их значения яркости одинаковы для одного и того же значения пикселя.
- Сгенерируйте виртуальный барабан, который используется для стимуляции поведения OKR, с помощью набора инструментов визуальной стимуляции, как описано ниже.
- Представьте вертикальную синусоидальную решетку на мониторах и отрегулируйте период (расстояние между полосами) по азимуту, чтобы проекция решетки на глаз имела постоянную пространственную частоту (барабанная решетка; Рисунок 1B в центре и справа).
- Убедитесь, что голова животного закреплена в центре вольера, чтобы оно видело, что решетка имеет постоянную пространственную частоту по всей поверхности виртуального барабана.
- Измените параметры движущейся решетки, такие как амплитуда колебаний, пространственная частота, временная/частота колебаний, направление, контраст и т. д., в кодах визуальной стимуляции. Используйте два типа визуального движения: (1) решетка дрейфует по часовой стрелке или против часовой стрелки в колебательной манере, следуя синусоидальной функции:
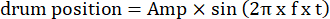
Здесь Amp – амплитуда траектории барабана, f – частота колебаний, t – время (амплитуда колебаний: 5°; пространственная частота решетки: 0,04-0,45 cpd; частота колебаний: 0,1-0,8 Гц, что соответствует пиковой скорости раздражителя 3,14-25,12 °/с [скорость барабана = Amp x 2π x f x cos (2π x f x t); контрастность: 80%-100%; средняя яркость: 35-45 кд/м2; (2) решетка дрейфует в одном направлении с постоянной скоростью: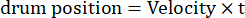
(Пространственная частота: 0,04-0,64 cpd; временная частота: 0,25-1 Гц; скорость барабана = временная частота/пространственная частота.)
- Настройте видеоокуляцию, как описано ниже.
- Чтобы избежать блокировки поля зрения животного, поместите инфракрасное (ИК) зеркало под углом 60° от средней линии, чтобы сформировать изображение правого глаза.
- Поместите ИК-камеру с правой стороны позади мыши (рис. 1C слева), чтобы получить изображение правого глаза.
- Установите высокоскоростную ИК-камеру на кронштейн камеры, который позволяет поворачивать камеру на ± 10° вокруг изображения правого глаза (рис. 1C справа).
- Используйте фотодиод, прикрепленный к одному из мониторов, для подачи электрического сигнала для синхронизации времени видеоокулографии и визуальной стимуляции.
- Разместите четыре ИК-светодиода (LED), поддерживаемые рычагами на гибкой стойке, вокруг правого глаза, чтобы обеспечить ИК-подсветку глаза.
- Разместите два ИК-светодиода на камере, чтобы обеспечить опорные сигналы отражения роговицы (CR): один закреплен над камерой (X-CR), а другой — с левой стороны камеры (Y-CR; Рисунок 1D).
- Измерьте оптическое увеличение видеоокулографической системы с помощью калибровочного предметного стекла.
ПРИМЕЧАНИЕ: Эталонные CR используются для компенсации поступательных движений глаз, когда угол глаза рассчитывается на основе вращательных движений глаз.
- Закрепите голову животного в центре вольера, образованного мониторами, как описано ниже.
- Зафиксируйте голову животного головной пластиной к центру оснастки и сделайте так, чтобы она была обращена вперед. Отрегулируйте наклон головы так, чтобы левый и правый глаза были выровнены, а носовые и височные уголки глаз выровнены по горизонтали (рис. 1E).
- Перемещайте голову животного по горизонтали с помощью грубой регулировки, обеспечиваемой аппаратом фиксации головы, и точной регулировки, обеспечиваемой 2D-трансляционным столиком, и по вертикали с помощью аппарата фиксации головы и пары стойка/держатель столба, пока правый глаз животного не появится в прямом эфире на видео камеры. Перед калибровкой и измерением движений глаз наложите изображение правого глаза животного, отраженное горячим зеркалом, на точку поворота кронштейна камеры (см. подробности на шаге 3.4 ниже).
- Постройте индивидуальный корпус вокруг установки OKR для блокировки освещения в помещении (рис. 1F).
3. Калибровка движений глаз
ПРИМЕЧАНИЕ: Вращательные движения глаз рассчитываются на основе движений зрачка и радиуса орбиты движений зрачка (Rp, расстояние от центра зрачка до центра глазного яблока). Для каждой отдельной мыши этот радиус измеряется экспериментально21.
- Закрепите голову животного в центре вольера, образованного тремя мониторами, как описано в шаге 2.6.1.
- Включите камеру и отрегулируйте четыре светодиода, окружающие правый глаз, чтобы добиться равномерной ИК-подсветки.
- Под визуальным контролем отрегулируйте положение правого глаза до тех пор, пока он не окажется в центре видео, как описано в шаге 2.6.2.
- Совместите виртуальное изображение правого глаза с точкой поворота кронштейна камеры, как описано ниже.
- Вручную поверните кронштейн камеры влево (-10°). Вручную перемещайте положение правого глаза животного в горизонтальной плоскости, перпендикулярной оптической оси, с точной настройкой 2D-трансляционного этапа (рис. 1C, зеленая стрелка), пока X-CR не окажется в горизонтальном центре изображения.
- Вручную поверните кронштейн камеры на другой конец (+10°). Если X-CR убегает от центра изображения, перемещайте правый глаз вдоль оптической оси с точной регулировкой до тех пор, пока X-CR не дойдет до центра (рис. 1C, синяя стрелка).
- Повторите шаги 3.4.1-3.4.2 несколько раз, пока X-CR не останется в центре, когда кронштейн камеры поворачивается влево и вправо. Если правый глаз двигается в середине одного повторения, перезапустите процесс регулировки.
- Измерьте расстояние по вертикали между Y-CR и X-CR после фиксации кронштейна камеры в центральном положении. Включите светодиод Y-CR и запишите его положение на видео, а затем переключитесь на светодиод X-CR и запишите его положение.
ПРИМЕЧАНИЕ: Расстояние по вертикали между Y-CR и X-CR будет использоваться для определения положения Y-CR во время измерения движений глаз, при котором включен только светодиод X-CR. - Измерьте радиус поворота зрачка Rp, как описано ниже.
- Поверните кронштейн камеры влево (-10°) и запишите положения зрачка (Pp1) и X-CR (PCR1) на видео.
- Затем поверните кронштейн камеры вправо (+10°) и запишите положения зрачка (Pp2) и X-CR (PCR2) на видео. Повторите этот шаг несколько раз.
ПРИМЕЧАНИЕ: Правый глаз животного должен оставаться неподвижным во время каждого повторения, чтобы количество движений зрачка в фильме точно отражало степень размаха кронштейна камеры. - Исходя из значений, записанных выше, рассчитайте радиус поворота зрачкаRp (рисунок 2А) по следующей формуле:
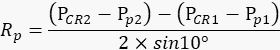
ПРИМЕЧАНИЕ: Расстояние между отражением роговицы и центром зрачка в физическом пространстве вычисляется на основе их расстояния в фильме:
PCR - P p = количество пикселей в фильме x размер пикселя чипа камеры x увеличение
- Разработайте соотношение между Rp и диаметром зрачка, как описано ниже. Rp изменяется при расширении или сужении зрачка; приблизительно, его значение обратно пропорционально размеру зрачка (рис. 2Б вверху).
- Систематически изменяйте яркость мониторов от 0 до 160 кд/м2, чтобы отрегулировать размер зрачка.
- Для каждого значения яркости повторите шаг 3.6 8-10 раз и запишите диаметр зрачка.
- Примените линейную регрессию к соотношению между Rp и диаметром зрачка на основе значений, измеренных выше, чтобы получить наклон и пересечение (рис. 2B внизу).
ПРИМЕЧАНИЕ: Выбросы, вызванные случайными движениями глаз, удаляются перед линейной подгонкой. Для повторяющихся измерений в течение нескольких сеансов калибровка должна быть выполнена только один раз для одного животного, если только его глаз не увеличится во время эксперимента.
4. Записывайте движения глаз OKR
- Закрепите мышь в оснастке, выполнив шаги 3.1-3.4. Пропустите этот шаг, если запись происходит сразу после завершения калибровки. Зафиксируйте кронштейн камеры в центральном положении.
- Настройте мониторы и животное на скотопический OKR, как описано ниже. Пропустите этот шаг для фототопического OKR.
- Покройте экран каждого монитора индивидуальным фильтром, который состоит из пяти слоев пленки нейтральной плотности (ND) 1,2. Убедитесь, что свет не пропускается через зазор между фильтром и монитором.
- Выключите свет в комнате. Следующие шаги выполняются с помощью ИК-очков.
- Нанесите одну каплю раствора пилокарпина (2% в солевом растворе) на правый глаз и подождите 15 минут. Убедитесь, что капля остается на глазу и не смывается мышью. Если раствор вытирается животным, нанесите еще одну каплю раствора пилокарпина. Это уменьшает зрачок до нужного размера для отслеживания взгляда в условиях скотопии.
ПРИМЕЧАНИЕ: В скотопическом состоянии зрачок существенно расширяется так, что его край частично скрыт за веком. Это влияет на точность оценки центра зрачка с помощью видеоокулографии. Фармакологическое сужение зрачка правого глаза уменьшает его зрительный вход, и, таким образом, зрительные стимулы передаются левому глазу. - Промыть правый глаз физиологическим раствором, чтобы тщательно смыть раствор пилокарпина. Опустите шторку, чтобы полностью закрыть корпус, что предотвратит попадание рассеянного света в скотопическое зрение.
- Дайте животному 5 минут, чтобы оно полностью приспособилось к скотопической среде, прежде чем начинать тест OKR.
- Запустите программное обеспечение для визуальной стимуляции и программное обеспечение для отслеживания движений глаз. Для фотопического измерения OKR убедитесь, что решетка барабана колеблется горизонтально с синусоидальной траекторией; для скотопического измерения OKR убедитесь, что решетка барабана дрейфует с постоянной скоростью слева направо, что является височно-носовым направлением по отношению к левому глазу.
ПРИМЕЧАНИЕ: Когда зрачок правого глаза, но не левого, сужается пилокарпином в условиях скотопии, OKR, вызванный осцилляторной стимуляцией барабана, очень асимметричен. Таким образом, для скотопического измерения OKR стимулируется левый глаз, в то время как движение правого глаза контролируется. - Программное обеспечение для отслеживания движения глаз автоматически измеряет размер зрачка, положение CR и положение зрачка для каждого кадра и вычисляет угол положения глаз на основе следующей формулы (рис. 2C):
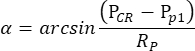
Здесь P CR — положениеCR , Pp — положение зрачка, а Rp — радиус поворота зрачка. Расстояние между отражением роговицы и центром зрачка в физическом пространстве вычисляется на основе их расстояния в фильме:
PCR - P p = количество пикселей в фильме x размер пикселя чипа камеры x увеличение
Rp соответствующего размера зрачка получается на основе модели линейной регрессии на шаге 3.7.3 (рис. 2B внизу).
5. Анализ движений глаз OKR с помощью программного обеспечения для анализа глаз
- Обработайте следы глаз с помощью медианного фильтра (окно фильтра = 0,05 с) для удаления высокочастотного шума (рис. 3А, середина).
- Удалите саккады или нистагм, как описано ниже.
- Оцените скорость движения глаза, вычислив производную первого порядка от движений глаз (рис. 3А внизу). Определите саккады или нистагм, применив порог скорости 50 °/с (рис. 3А внизу).
- Замените саккады или нистагм, экстраполировав положение глаз во время этих быстрых движений глаз из сегмента перед саккадами или нистагмом на основе линейной регрессии (рис. 3B).
- Вычислите амплитуду движений глаз OKR с помощью быстрого преобразования Фурье (алгоритм Герцеля), если барабанная решетка колеблется (рис. 3C), или вычислите среднюю скорость движений глаз во время зрительной стимуляции, если барабанная решетка движется с постоянной скоростью в одном направлении (рис. 3B, внизу).
ПРИМЕЧАНИЕ: Амплитуда колебательных движений глаз, полученная из преобразования Фурье, аналогична амплитуде, полученной при подгонке глазной траектории с синусоидальной функцией (рис. 3D). - Рассчитайте выигрыш OKR. Для колебательного движения барабана усиление OKR определяется как отношение амплитуды движений глаз к амплитуде движений барабана (рис. 3C справа). Для однонаправленного движения барабана усиление OKR определяется как отношение скорости глазка к скорости решетки барабана (рис. 3B внизу).
Результаты
С помощью процедуры, описанной выше, мы оценили зависимость OKR от нескольких визуальных признаков. Примеры трассировок, показанные здесь, были получены с использованием кодов анализа, приведенных в дополнительном файле кодирования 1, а необработанный файл примеров трассировк?...
Обсуждение
Представленный здесь метод поведенческого анализа OKR дает ряд преимуществ. Во-первых, компьютерная визуальная стимуляция решает проблемы, присущие физическим барабанам. Решая проблему, связанную с тем, что физические барабаны не поддерживают систематическое исследование пространств...
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Мы благодарны Yingtian He за то, что он поделился данными настройки направления. Эта работа была поддержана грантами Канадского фонда инноваций и Исследовательского фонда Онтарио (проект CFI/ORF No 37597), NSERC (RGPIN-2019-06479), CIHR (Project Grant 437007) и Connaught New Researcher Awards.
Материалы
| Name | Company | Catalog Number | Comments |
| 2D translational stage | Thorlabs | XYT1 | |
| Acrylic resin | Lang Dental | B1356 | For fixing headplate on skull and protecting skull |
| Bupivacaine | STERIMAX | ST-BX223 | Bupivacaine Injection BP 0.5%. Local anesthesia |
| Carprofen | RIMADYL | 8507-14-1 | Analgesia |
| Compressed air | Dust-Off | ||
| Eye ointment | Alcon | Systane | For maintaining moisture of eyes |
| Graphic card | NVIDIA | Geforce GTX 1650 or Quadro P620. | For generating single screen among three monitors |
| Heating pad | Kent Scientific | HTP-1500 | For maintaining body temperature |
| High-speed infrared (IR) camera | Teledyne Dalsa | G3-GM12-M0640 | For recording eye rotation |
| IR LED | Digikey | PDI-E803-ND | For CR reference and the illumination of the eye |
| IR mirror | Edmund optics | 64-471 | For reflecting image of eye |
| Isoflurane | FRESENIUS KABI | CP0406V2 | |
| Labview | National instruments | version 2014 | eye tracking |
| Lactated ringer | BAXTER | JB2324 | Water and energy supply |
| Lidocaine and epinephrine mix | Dentsply Sirona | 82215-1 | XYLOCAINE. Local anesthesia |
| Luminance Meter | Konica Minolta | LS-150 | for calibration of monitors |
| Matlab | MathWorks | version xxx | analysis of eye movements |
| Meyhoefer Curette | World Precision Instruments | 501773 | For scraping skull and removing fascia |
| Microscope calibration slide | Amscope | MR095 | to measure the magnification of video-oculography |
| Monitors | Acer | B247W | Visual stimulation |
| Neutral density filter | Lee filters | 299 | to generate scotopic visual stimulation |
| Nigh vision goggle | Alpha optics | AO-3277 | for scotopic OKR |
| Photodiode | Digikey | TSL254-R-LF-ND | to synchronize visual stimulation and video-oculography |
| Pilocarpine hydrochloride | Sigma-Aldrich | P6503 | |
| Post | Thorlabs | TR1.5 | |
| Post holder | Thorlabs | PH1 | |
| PsychoPy | open source software | version xxx | visual stimulation toolkit |
| Scissor | RWD | S12003-09 | For skin removal |
| Superglue | Krazy Glue | Type: All purpose. For adhering headplate on the skull |
Ссылки
- Gerhard, D. Neuroscience. 5th Edition. Yale Journal of Biology and Medicine. , (2013).
- Distler, C., Hoffmann, K. P. . The Oxford Handbook of Eye Movement. , 65-83 (2011).
- Sereno, A. B., Bolding, M. S. . Executive Functions: Eye Movements and Human Neurological Disorders. , (2017).
- Giolli, R. A., Blanks, R. H. I., Lui, F. The accessory optic system: basic organization with an update on connectivity, neurochemistry, and function. Progress in Brain Research. 151, 407-440 (2006).
- Liu, B. H., Huberman, A. D., Scanziani, M. Cortico-fugal output from visual cortex promotes plasticity of innate motor behaviour. Nature. 538 (7625), 383-387 (2016).
- Prusky, G. T., Alam, N. M., Beekman, S., Douglas, R. M. Rapid quantification of adult and developing mouse spatial vision using a virtual optomotor system. Investigative Ophthalmology & Visual Science. 45 (12), 4611-4616 (2004).
- Stahl, J. S., van Alphen, A. M., De Zeeuw, C. I. A comparison of video and magnetic search coil recordings of mouse eye movements. Journal of Neuroscience Methods. 99 (1-2), 101-110 (2000).
- Faulstich, B. M., Onori, K. A., du Lac, S. Comparison of plasticity and development of mouse optokinetic and vestibulo-ocular reflexes suggests differential gain control mechanisms. Vision Research. 44 (28), 3419-3427 (2004).
- Katoh, A., Kitazawa, H., Itohara, S., Nagao, S. Dynamic characteristics and adaptability of mouse vestibulo-ocular and optokinetic response eye movements and the role of the flocculo-olivary system revealed by chemical lesions. Proceedings of the National Academy of Sciences. 95 (13), 7705-7710 (1998).
- Cahill, H., Nathans, J. The optokinetic reflex as a tool for quantitative analyses of nervous system function in mice: application to genetic and drug-induced variation. PLoS One. 3 (4), 2055 (2008).
- Cameron, D. J., et al. The optokinetic response as a quantitative measure of visual acuity in zebrafish. Journal of Visualized Experiments. (80), 50832 (2013).
- de Jeu, M., De Zeeuw, C. I. Video-oculography in mice. Journal of Visualized Experiments. (65), e3971 (2012).
- Kodama, T., du Lac, S. Adaptive acceleration of visually evoked smooth eye movements in mice. The Journal of Neuroscience. 36 (25), 6836-6849 (2016).
- Doering, C. J., et al. Modified Ca(v)1.4 expression in the Cacna1f(nob2) mouse due to alternative splicing of an ETn inserted in exon 2. PLoS One. 3 (7), e2538 (2008).
- Shi, C., et al. Optimization of optomotor response-based visual function assessment in mice. Scientific Reports. 8 (1), 9708 (2018).
- Waldner, D. M., et al. Transgenic expression of Cacna1f rescues vision and retinal morphology in a mouse model of congenital stationary night blindness 2A (CSNB2A). Translational Vision Science & Technology. 9 (11), 19 (2020).
- Tabata, H., Shimizu, N., Wada, Y., Miura, K., Kawano, K. Initiation of the optokinetic response (OKR) in mice. Journal of Vision. 10 (1), 1-17 (2010).
- Al-Khindi, T., et al. The transcription factor Tbx5 regulates direction-selective retinal ganglion cell development and image stabilization. Current Biology. 32 (19), 4286-4298 (2022).
- Harris, S. C., Dunn, F. A. Asymmetric retinal direction tuning predicts optokinetic eye movements across stimulus conditions. eLife. 12, e81780 (2023).
- van Alphen, B., Winkelman, B. H., Frens, M. A. Three-dimensional optokinetic eye movements in the C57BL/6J mouse. Investigative Ophthalmology & Visual Science. 51 (1), 623-630 (2010).
- Stahl, J. S. Calcium channelopathy mutants and their role in ocular motor research. Annals of the New York Academy of Sciences. 956, 64-74 (2002).
- Endo, S., et al. Dual involvement of G-substrate in motor learning revealed by gene deletion. Proceedings of the National Academy of Sciences. 106 (9), 3525-3530 (2009).
- Thomas, B. B., Seiler, M. J., Sadda, S. R., Coffey, P. J., Aramant, R. B. Optokinetic test to evaluate visual acuity of each eye independently. Journal of Neuroscience Methods. 138 (1-2), 7-13 (2004).
- Burroughs, S. L., Kaja, S., Koulen, P. Quantification of deficits in spatial visual function of mouse models for glaucoma. Investigative Ophthalmology & Visual Science. 52 (6), 3654-3659 (2011).
- Wakita, R., et al. Differential regulations of vestibulo-ocular reflex and optokinetic response by β- and α2-adrenergic receptors in the cerebellar flocculus. Scientific Reports. 7 (1), 3944 (2017).
- Dehmelt, F. A., et al. Spherical arena reveals optokinetic response tuning to stimulus location, size, and frequency across entire visual field of larval zebrafish. eLife. 10, e63355 (2021).
- Magnusson, M., Pyykko, I., Jantti, V. Effect of alertness and visual attention on optokinetic nystagmus in humans. American Journal of Otolaryngology. 6 (6), 419-425 (1985).
- Collins, W. E., Schroeder, D. J., Elam, G. W. Effects of D-amphetamine and of secobarbital on optokinetic and rotation-induced nystagmus. Aviation, Space, and Environmental Medicine. 46 (4), 357-364 (1975).
- Reimer, J., et al. Pupil fluctuations track fast switching of cortical states during quiet wakefulness. Neuron. 84 (2), 355-362 (2014).
- Sakatani, T., Isa, T. PC-based high-speed video-oculography for measuring rapid eye movements in mice. Neuroscience Research. 49 (1), 123-131 (2004).
- Sakatani, T., Isa, T. Quantitative analysis of spontaneous saccade-like rapid eye movements in C57BL/6 mice. Neuroscience Research. 58 (3), 324-331 (2007).
- Vinck, M., Batista-Brito, R., Knoblich, U., Cardin, J. A. Arousal and locomotion make distinct contributions to cortical activity patterns and visual encoding. Neuron. 86 (3), 740-754 (2015).
- Bradley, M. M., Miccoli, L., Escrig, M. A., Lang, P. J. The pupil as a measure of emotional arousal and autonomic activation. Psychophysiology. 45 (4), 602-607 (2008).
- Hess, E. H., Polt, J. M. Pupil size as related to interest value of visual stimuli. Science. 132 (3423), 349-350 (1960).
- Di Stasi, L. L., Catena, A., Canas, J. J., Macknik, S. L., Martinez-Conde, S. Saccadic velocity as an arousal index in naturalistic tasks. Neuroscience and Biobehavioral Reviews. 37 (5), 968-975 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены