需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
小鼠视动反射视觉特征选择性的量化
摘要
在这里,我们描述了一种用于量化视动反射的标准方案。它结合了虚拟鼓刺激和视频眼部成像,因此可以精确评估行为的特征选择性及其自适应可塑性。
摘要
视动反射 (OKR) 是一种重要的先天性眼球运动,由视觉环境的整体运动触发,用于稳定视网膜图像。由于其重要性和稳健性,OKR 已被用于研究视觉运动学习并评估具有不同遗传背景、年龄和药物治疗的小鼠的视觉功能。在这里,我们介绍了一种高精度评估头部固定小鼠OKR响应的程序。头部固定可以排除前庭刺激对眼球运动的影响,从而可以测量仅由视觉运动触发的眼球运动。OKR 由虚拟鼓系统引发,其中三个计算机显示器上呈现的垂直光栅以振荡方式水平漂移或以恒定速度单向漂移。通过这个虚拟现实系统,我们可以系统地改变视觉参数,如空间频率、时间/振荡频率、对比度、亮度和光栅方向,并量化视觉特征选择性的调谐曲线。高速红外视频眼球造影可确保准确测量眼球运动的轨迹。对个体小鼠的眼睛进行校准,以提供比较不同年龄、性别和遗传背景的动物之间的OKR的机会。该技术的定量能力使其能够检测 OKR 的变化,当这种行为由于衰老、感官体验或运动学习而塑性地适应时;因此,它使该技术成为用于研究眼睛行为可塑性的工具库的宝贵补充。
引言
为了响应环境中的视觉刺激,我们的眼睛会移动以转移我们的视线、稳定视网膜图像、跟踪移动目标或将两只眼睛的中央凹与距离观察者不同距离的目标对齐,这对正常视力至关重要 1,2。动眼神经行为已被广泛用作有吸引力的感觉运动整合模型,以了解健康和疾病中的神经回路,至少部分原因是动眼神经系统的简单性3。在三对眼外肌的控制下,眼睛在眼眶中主要围绕三个相应的轴旋转:沿横轴的抬高和凹陷,沿垂直轴的内收和外展,以及沿前后轴的内收和外展1,2。这种简单的系统使研究人员能够在实验室环境中轻松准确地评估小鼠的动眼神经行为。
一种主要的动眼神经行为是视动反射 (OKR)。这种不自主的眼球运动是由视网膜上图像的缓慢漂移或滑动触发的,当动物的头部或其周围环境移动时,用于稳定视网膜图像2,4。OKR 作为一种行为范式,出于多种原因对研究人员来说很有趣。首先,它可以被可靠地刺激并准确量化5,6。其次,量化这种行为的程序相对简单和标准化,可用于评估大型动物群体的视觉功能7。第三,这种先天行为具有高度的可塑性5,8,9。当长时间重复性视网膜滑脱时,其振幅可以增强 5,8,9,或者当其工作伙伴前庭眼反射 (VOR)(由前庭输入2 触发的另一种稳定视网膜图像的机制)受损时5。这些OKR增强的实验范式使研究人员能够揭示动眼神经学习的电路基础。
在以前的研究中,主要使用两种非侵入性方法评估 OKR:(1) 视频眼部造影结合物理鼓 7,10,11,12,13 或 (2) 任意确定头部转动结合虚拟鼓6,14,15,16.尽管它们的应用在理解动眼神经可塑性的分子和电路机制方面取得了丰硕的发现,但这两种方法都存在一些缺点,限制了它们在定量检查OKR特性方面的能力。首先,带有黑白条纹或圆点印刷图案的物理鼓不允许轻松快速地改变视觉图案,这在很大程度上限制了 OKR 对某些视觉特征的依赖性的测量,例如移动光栅的空间频率、方向和对比度 8,17。相反,OKR 对这些视觉特征的选择性测试可以从计算机化的视觉刺激中受益,其中视觉特征可以方便地从试验到试验进行修改。通过这种方式,研究人员可以系统地研究多维视觉参数空间中的OKR行为。此外,OKR 测定的第二种方法仅报告触发可识别 OKR 的视觉参数的阈值,而不报告眼睛或头部运动的幅度6、14、15、16。因此,缺乏定量能力无法分析调谐曲线的形状和首选的视觉特征,或检测正常和病理条件下个体小鼠之间的细微差异。为了克服上述局限性,在最近的研究中,视频眼部造影和计算机虚拟视觉刺激相结合来检测 OKR 行为 5,17,18,19,20。然而,这些先前发表的研究没有提供足够的技术细节或分步说明,因此研究人员为自己的研究建立这样的OKR测试仍然具有挑战性。
在这里,我们提出了一种协议,通过视频眼部造影和计算机化虚拟视觉刺激的组合,精确量化明视或暗视条件下OKR行为的视觉特征选择性。将小鼠头部固定以避免前庭刺激引起的眼球运动。高速摄像机用于记录观察具有变化视觉参数的移动光栅的小鼠的眼球运动。校准单个小鼠眼球的物理大小,以确保推导眼球运动角度的准确性21。这种定量方法允许比较不同年龄或遗传背景的动物之间的OKR行为,或监测其由药物治疗或视觉运动学习引起的变化。
研究方案
本研究中进行的所有实验程序均已根据多伦多大学动物护理委员会和加拿大动物护理委员会制定的指南获得生物科学当地动物护理委员会的批准。
1. 在颅骨顶部植入头杆
注意:为避免 VOR 行为对眼球运动的贡献,在 OKR 测试期间固定鼠标头部。因此,通过手术将头杆植入颅骨顶部。
- 在气室中用4%异氟烷(v / v)和O 2的混合物麻醉小鼠(2-5 个月大的雌性和雄性C57BL / 6)。将小鼠转移到定制的手术平台上,将异氟醚的浓度降低到1.5%-2%。通过检查整个手术过程中的脚趾捏反应和呼吸频率来监测麻醉深度。
- 在动物身体下方放置加热垫以保持其体温。在双眼上涂上一层润滑眼膏,以保护它们免受干燥。用铝箔盖住眼睛,以保护它们免受光线照射。
- 皮下注射卡洛芬,剂量为 20 mg/kg,以减轻疼痛。用葡萄糖酸氯己定皮肤清洁剂润湿皮毛后,剃掉头骨顶部的皮毛。用70%异丙醇和氯己定酒精对暴露的头皮进行两次消毒。
- 在切口部位皮下注射布比卡因(8mg / kg),然后用剪刀去除头皮(~1cm2),露出颅骨背面,包括额后骨,顶骨和顶间骨。
- 在暴露的头骨上滴几滴 1% 利多卡因和 1:100,000 肾上腺素,以减轻局部疼痛和出血。用 Meyhoefer 刮匙刮除颅骨以去除筋膜并用磷酸盐缓冲盐水 (PBS) 清洁。
注意:颞肌与颅骨分离,以增加头杆连接的表面积。 - 轻轻向颅骨表面吹压缩空气,直到水分消失,骨头变白,擦干颅骨。在头骨的裸露表面(包括切开的头皮边缘)涂上一层薄薄的强力胶,然后涂上一层丙烯酸树脂。
注意:在使用强力胶之前,颅骨表面需要没有血液或水。 - 沿着颅骨顶部的中线放置一个不锈钢头杆(见 图1A)。涂抹更多的丙烯酸树脂,从头杆的边缘开始,直到头杆的底部完全嵌入丙烯酸树脂中。涂抹丙烯酸树脂两到三次以增加厚度。
- 等待约15分钟,直到丙烯酸树脂硬化。皮下注射 1 mL 乳酸林格氏液。然后,将鼠标放回放在加热垫上的笼子中,直到动物完全移动。
- 手术后让小鼠在家笼中恢复至少 5 天。一旦动物处于良好状态,将其头部在OKR设置中用头部杆固定15-30分钟,以使其熟悉头部固定和实验环境。每天重复一次熟悉,至少 3 天。
2. 虚拟鼓的设置和视频眼部成像
- 将三台显示器彼此垂直安装,形成一个方形外壳,覆盖视觉空间中~270°的方位角和63°的仰角(图1B左)。
- 使用独立显卡,将三台显示器合并到一个简单的显示器中,以确保所有显示器之间的同步。
- 如下所述校准显示器的亮度。
- 打开显示器所连接的计算机并等待 15 分钟。预热对于获得稳定的亮度至关重要。
- 以 0 为步长系统地将显示器上的亮度设置从 100 更改为 25。
- 对于每个亮度值,使用亮度计测量显示器在各种像素值(0-255,步长为 15)下的亮度。
- 使用线性回归拟合像素值 255 的亮度和亮度之间的关系,并估计产生 160 cd/m2 的亮度值。
- 对于亮度测量中使用的每个像素值(步骤 2.3.3),根据线性回归估计步骤 2.3.4 中派生的亮度值的亮度。使用幂函数 lum = A * pixel γ拟合一组新的亮度值(在 2.3.4 中派生的亮度值下)与其对应的像素值之间的关系,从而得出 gamma 因子 γ和系数 A。这些将用于生成所需亮度值的正弦光栅。
- 将所有三个显示器的亮度设置为步骤 2.3.4 中派生的值,以确保它们的亮度值对于相同的像素值相同。
- 使用视觉刺激工具包生成一个虚拟鼓,用于刺激 OKR 行为,如下所述。
- 在显示器上呈现垂直正弦光栅,并沿方位角调整周期(条纹之间的间距),以确保光栅在眼睛上的投影具有恒定的空间频率(鼓形光栅;图1B中右)。
- 确保动物头部固定在外壳的中心,以便它看到光栅在虚拟鼓的表面上具有恒定的空间频率。
- 修改视觉刺激码中移动光栅的参数,如振荡幅度、空间频率、时间/振荡频率、方向、对比度等。使用两种类型的视觉运动:(1)光栅在正弦函数之后以振荡方式顺时针或逆时针漂移:
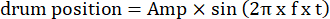
这里,Amp 是鼓轨迹的振幅,f 是振荡频率,t 是时间(振荡幅度:5°;光栅空间频率:0.04-0.45 cpd;振荡频率:0.1-0.8 Hz,对应刺激的峰值速度为 3.14-25.12 °/s [鼓速度 = Amp x 2π x f x cos (2π x f x t);对比度: 80%-100%;平均亮度:35-45 cd/m2;(2)光栅以恒定速度单向漂移: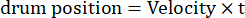
(空间频率:0.04-0.64 cpd;时间频率:0.25-1 Hz;鼓速度=时间频率/空间频率。
- 如下所述设置视频眼部摄影。
- 为避免阻塞动物的视野,请在距中线 60° 的位置放置红外 (IR) 镜以形成右眼的图像。
- 将红外摄像头放在鼠标后面的右侧(图1C左)以捕获右眼的图像。
- 将高速红外摄像机安装在摄像机臂上,使摄像机围绕右眼图像旋转±10°(图1C右)。
- 使用连接到其中一个监视器的光电二极管提供电信号,以同步视频眼部成像和视觉刺激的时间。
- 将四个由鹅颈臂支撑的红外发光二极管 (LED) 放在右眼周围,以提供眼睛的红外照明。
- 在相机上放置两个红外 LED 以提供角膜反射 (CR) 参考:一个固定在相机上方 (X-CR),而另一个位于相机左侧 (Y-CR; 图1D)。
- 使用校准载玻片测量视频眼部成像系统的光学放大倍率。
注意:当根据旋转眼球运动计算眼角时,参考 CR 用于抵消平移眼球运动。
- 如下所述,将动物的头部固定在显示器形成的外壳的中心。
- 将动物的头部与头板固定在钻机的中心,并使其面朝前。调整头部的倾斜度,使左右眼水平,鼻角和颞角水平对齐(图1E)。
- 通过头部固定装置提供的粗略调整和 2D 平移台提供的微调水平移动动物的头部,并通过头部固定装置和柱/柱支架对垂直移动,直到动物的右眼出现在摄像机的实时视频中。在校准和测量眼球运动之前,将热镜反射的动物右眼图像与相机臂的枢轴点叠加(详见下面的步骤 3.4)。
- 在 OKR 钻机周围构建一个定制的外壳,以阻挡室内光线(图 1F)。
3. 眼球运动的校准
注意:旋转眼球运动是根据瞳孔的运动和瞳孔运动的轨道半径(Rp,从瞳孔中心到眼球中心的距离)计算的。对于每只小鼠,该半径通过实验测量21。
- 如步骤 2.6.1 所述,将动物的头部固定在由三个监视器形成的外壳的中心。
- 打开相机并调整右眼周围的四个 LED,以实现均匀的红外照明。
- 在视觉引导下,调整右眼的位置,直到它出现在视频的中心,如步骤 2.6.2 中所述。
- 将右眼的虚拟图像与相机臂的枢轴点对齐,如下所述。
- 手动将相机臂旋转到左端 (-10°)。通过微调2D平移台(图1C,绿色箭头),在垂直于光轴的水平面上手动移动动物的右眼位置,直到X-CR位于图像的水平中心。
- 手动将相机臂旋转到另一端 (+10°)。如果X-CR偏离图像中心,则沿光轴微调右眼移动,直到X-CR到达中心(图1C,蓝色箭头)。
- 重复步骤 3.4.1-3.4.2 几次,直到相机臂左右摆动时 X-CR 停留在中心。如果右眼在一次重复中移动,请重新开始调整过程。
- 将相机臂锁定在中心位置后,测量 Y-CR 和 X-CR 之间的垂直距离。打开 Y-CR LED 并记录其在视频上的位置,然后切换到 X-CR LED 并记录其位置。
注意: Y-CR 和 X-CR 之间的垂直距离将用于在仅打开 X-CR LED 的眼球运动测量期间推导出 Y-CR 的位置。 - 测量瞳孔旋转半径 Rp,如下所述。
- 将相机臂旋转到左端 (-10°) 并记录视频中瞳孔 (Pp1) 和 X-CR (PCR1) 的位置。
- 然后,将相机臂旋转到右端(+10°),并在视频上记录瞳孔(Pp2)和X-CR(PCR2)的位置。多次重复此步骤。
注意:动物的右眼在每次重复期间都需要保持静止,以便电影中的瞳孔运动量准确反映相机臂的摆动程度。 - 根据上面记录的值,用以下公式计算瞳孔旋转半径Rp (图2A):
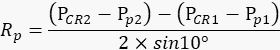
注意:物理空间中角膜反射和瞳孔中心之间的距离是根据它们在电影中的距离计算的:
PCR - Pp = 短片中的像素数 x 相机芯片的像素大小 x 放大倍率
- 发展Rp和瞳孔直径之间的关系,如下所述。当瞳孔扩张或收缩时,Rp 发生变化;近似地,其值与瞳孔大小成反比(图2B顶部)。
- 系统地将显示器的亮度从 0 更改为 160 cd/m2 以调节瞳孔大小。
- 对于每个亮度值,重复步骤 3.6 8-10 次并记录瞳孔的直径。
- 根据上面测量的值,将线性回归应用于Rp和瞳孔直径之间的关系,以得出斜率和截距(图2B底部)。
注意:在线性拟合之前,会删除由偶尔眼球运动引起的异常值。对于多个会话的重复测量,只需对一只动物进行一次校准,除非其眼睛在实验过程中变大。
4.记录OKR的眼球运动
- 按照步骤 3.1-3.4 将鼠标固定在装备中。如果在校准完成后立即进行记录,请跳过此步骤。将相机臂锁定在中心位置。
- 如下所述,为暗视 OKR 设置监视器和动物。跳过此步骤以获取明视 OKR。
- 用定制的滤镜覆盖每台显示器的屏幕,该滤镜由五层 1.2 中性密度 (ND) 薄膜制成。确保没有光线从过滤器和显示器之间的缝隙泄漏出来。
- 关闭房间灯。以下步骤是在红外护目镜的帮助下完成的。
- 将一滴毛果芸香碱溶液(2%的生理盐水)涂抹在右眼上,等待15分钟。确保滴剂留在眼睛上并且不会被鼠标擦掉。如果溶液被动物擦掉,则再滴一滴毛果芸香碱溶液。这会将瞳孔缩小到适当的大小,以便在暗视条件下进行眼动追踪。
注意:在暗视条件下,瞳孔显着扩张,使其边缘部分隐藏在眼睑后面。这会影响通过视频眼部摄影估计瞳孔中心的精度。从药理学上讲,右眼的瞳孔缩小会减少其视觉输入,因此视觉刺激会呈现给左眼。 - 用生理盐水冲洗右眼,彻底洗去毛果芸香碱溶液。拉下窗帘以完全密封外壳,从而防止杂散光干扰暗视。
- 在开始OKR测试之前,给动物5分钟以完全适应暗视环境。
- 运行视觉刺激软件和眼动追踪软件。对于明视OKR测量,确保鼓光栅以正弦轨迹水平振荡;对于暗视OKR测量,确保鼓光栅从左到右以恒定速度漂移,这是相对于左眼的颞鼻方向。
注意:当右眼的瞳孔而不是左眼的瞳孔在暗视条件下被毛果芸香碱缩小时,振荡鼓刺激引起的OKR是高度不对称的。因此,对于暗视 OKR 测量,左眼受到刺激,同时监测右眼的运动。 - 眼动追踪软件自动测量每帧的瞳孔大小、CR位置和瞳孔位置,并根据以下公式计算眼睛位置的角度(图2C):
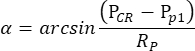
其中,P CR 是CR 位置,P p 是瞳孔位置,Rp 是瞳孔旋转半径。角膜反射和物理空间中瞳孔中心之间的距离是根据它们在电影中的距离计算的:
PCR - Pp = 短片中的像素数 x 相机芯片的像素大小 x 放大倍率
根据步骤3.7.3中的线性回归模型推导出相应瞳孔大小的Rp(图2B底部)。
5. 使用眼动分析软件分析OKR的眼球运动
- 使用中值滤波器(滤波器窗口 = 0.05 s)处理眼图迹线以消除高频噪声(图 3A 中间)。
- 如下所述去除扫视或眼球震颤。
- 通过计算眼球运动的一阶导数来估计眼速(图3A底部)。通过应用50°/ s的速度阈值来识别扫视或眼球震颤(图3A底部)。
- 通过基于线性回归从扫视或眼球震颤之前的节段推断这些快速眼球运动期间的眼睛位置来替换扫视或眼球震颤(图3B)。
- 如果鼓光栅振荡,则通过快速傅里叶变换(Goertzel算法)计算OKR眼球运动的幅度(图3C),或者如果鼓光栅在一个方向上以恒定速度移动,则计算视觉刺激期间眼球运动的平均速度(图3B底部)。
注:由傅里叶变换得出的振荡眼球运动的振幅类似于从具有正弦函数拟合的眼睛轨迹得出的振幅(图3D)。 - 计算 OKR 增益。对于振荡鼓运动,OKR增益定义为眼球运动的振幅与鼓运动振幅的比值(图3C右)。对于单向滚筒运动,OKR增益定义为眼速度与滚筒光栅速度之比(图3B底部)。
结果
通过上面详述的过程,我们评估了 OKR 对几个视觉特征的依赖性。此处显示的示例迹线是使用补充编码文件 1 中提供的分析代码得出的,示例迹线原始文件可在补充编码文件 2 中找到。当滚筒光栅以正弦轨迹(0.4 Hz)漂移时,动物的眼睛以类似的振荡方式自动跟随光栅的运动(图3B上图),这是OKR行为的特征2,5,8
讨论
此处介绍的 OKR 行为测定方法具有几个优点。首先,计算机生成的视觉刺激解决了物理鼓的内在问题。针对物理鼓不支持空间频率、方向或对比度调谐的系统检查8的问题,虚拟鼓允许在逐个试验的基础上改变这些视觉参数,从而有助于对OKR行为的特征选择性进行系统和定量分析(图4A);当物理鼓受到外部光源23的不均匀照明时,虚拟鼓可?...
披露声明
作者声明没有利益冲突。
致谢
我们感谢何颖天分享方向调整数据。这项工作得到了加拿大创新基金会和安大略省研究基金(CFI/ORF 项目编号 37597)、NSERC (RGPIN-2019-06479)、CIHR(项目资助 437007)和康诺特新研究员奖的资助。
材料
| Name | Company | Catalog Number | Comments |
| 2D translational stage | Thorlabs | XYT1 | |
| Acrylic resin | Lang Dental | B1356 | For fixing headplate on skull and protecting skull |
| Bupivacaine | STERIMAX | ST-BX223 | Bupivacaine Injection BP 0.5%. Local anesthesia |
| Carprofen | RIMADYL | 8507-14-1 | Analgesia |
| Compressed air | Dust-Off | ||
| Eye ointment | Alcon | Systane | For maintaining moisture of eyes |
| Graphic card | NVIDIA | Geforce GTX 1650 or Quadro P620. | For generating single screen among three monitors |
| Heating pad | Kent Scientific | HTP-1500 | For maintaining body temperature |
| High-speed infrared (IR) camera | Teledyne Dalsa | G3-GM12-M0640 | For recording eye rotation |
| IR LED | Digikey | PDI-E803-ND | For CR reference and the illumination of the eye |
| IR mirror | Edmund optics | 64-471 | For reflecting image of eye |
| Isoflurane | FRESENIUS KABI | CP0406V2 | |
| Labview | National instruments | version 2014 | eye tracking |
| Lactated ringer | BAXTER | JB2324 | Water and energy supply |
| Lidocaine and epinephrine mix | Dentsply Sirona | 82215-1 | XYLOCAINE. Local anesthesia |
| Luminance Meter | Konica Minolta | LS-150 | for calibration of monitors |
| Matlab | MathWorks | version xxx | analysis of eye movements |
| Meyhoefer Curette | World Precision Instruments | 501773 | For scraping skull and removing fascia |
| Microscope calibration slide | Amscope | MR095 | to measure the magnification of video-oculography |
| Monitors | Acer | B247W | Visual stimulation |
| Neutral density filter | Lee filters | 299 | to generate scotopic visual stimulation |
| Nigh vision goggle | Alpha optics | AO-3277 | for scotopic OKR |
| Photodiode | Digikey | TSL254-R-LF-ND | to synchronize visual stimulation and video-oculography |
| Pilocarpine hydrochloride | Sigma-Aldrich | P6503 | |
| Post | Thorlabs | TR1.5 | |
| Post holder | Thorlabs | PH1 | |
| PsychoPy | open source software | version xxx | visual stimulation toolkit |
| Scissor | RWD | S12003-09 | For skin removal |
| Superglue | Krazy Glue | Type: All purpose. For adhering headplate on the skull |
参考文献
- Gerhard, D. Neuroscience. 5th Edition. Yale Journal of Biology and Medicine. , (2013).
- Distler, C., Hoffmann, K. P. . The Oxford Handbook of Eye Movement. , 65-83 (2011).
- Sereno, A. B., Bolding, M. S. . Executive Functions: Eye Movements and Human Neurological Disorders. , (2017).
- Giolli, R. A., Blanks, R. H. I., Lui, F. The accessory optic system: basic organization with an update on connectivity, neurochemistry, and function. Progress in Brain Research. 151, 407-440 (2006).
- Liu, B. H., Huberman, A. D., Scanziani, M. Cortico-fugal output from visual cortex promotes plasticity of innate motor behaviour. Nature. 538 (7625), 383-387 (2016).
- Prusky, G. T., Alam, N. M., Beekman, S., Douglas, R. M. Rapid quantification of adult and developing mouse spatial vision using a virtual optomotor system. Investigative Ophthalmology & Visual Science. 45 (12), 4611-4616 (2004).
- Stahl, J. S., van Alphen, A. M., De Zeeuw, C. I. A comparison of video and magnetic search coil recordings of mouse eye movements. Journal of Neuroscience Methods. 99 (1-2), 101-110 (2000).
- Faulstich, B. M., Onori, K. A., du Lac, S. Comparison of plasticity and development of mouse optokinetic and vestibulo-ocular reflexes suggests differential gain control mechanisms. Vision Research. 44 (28), 3419-3427 (2004).
- Katoh, A., Kitazawa, H., Itohara, S., Nagao, S. Dynamic characteristics and adaptability of mouse vestibulo-ocular and optokinetic response eye movements and the role of the flocculo-olivary system revealed by chemical lesions. Proceedings of the National Academy of Sciences. 95 (13), 7705-7710 (1998).
- Cahill, H., Nathans, J. The optokinetic reflex as a tool for quantitative analyses of nervous system function in mice: application to genetic and drug-induced variation. PLoS One. 3 (4), 2055 (2008).
- Cameron, D. J., et al. The optokinetic response as a quantitative measure of visual acuity in zebrafish. Journal of Visualized Experiments. (80), 50832 (2013).
- de Jeu, M., De Zeeuw, C. I. Video-oculography in mice. Journal of Visualized Experiments. (65), e3971 (2012).
- Kodama, T., du Lac, S. Adaptive acceleration of visually evoked smooth eye movements in mice. The Journal of Neuroscience. 36 (25), 6836-6849 (2016).
- Doering, C. J., et al. Modified Ca(v)1.4 expression in the Cacna1f(nob2) mouse due to alternative splicing of an ETn inserted in exon 2. PLoS One. 3 (7), e2538 (2008).
- Shi, C., et al. Optimization of optomotor response-based visual function assessment in mice. Scientific Reports. 8 (1), 9708 (2018).
- Waldner, D. M., et al. Transgenic expression of Cacna1f rescues vision and retinal morphology in a mouse model of congenital stationary night blindness 2A (CSNB2A). Translational Vision Science & Technology. 9 (11), 19 (2020).
- Tabata, H., Shimizu, N., Wada, Y., Miura, K., Kawano, K. Initiation of the optokinetic response (OKR) in mice. Journal of Vision. 10 (1), 1-17 (2010).
- Al-Khindi, T., et al. The transcription factor Tbx5 regulates direction-selective retinal ganglion cell development and image stabilization. Current Biology. 32 (19), 4286-4298 (2022).
- Harris, S. C., Dunn, F. A. Asymmetric retinal direction tuning predicts optokinetic eye movements across stimulus conditions. eLife. 12, e81780 (2023).
- van Alphen, B., Winkelman, B. H., Frens, M. A. Three-dimensional optokinetic eye movements in the C57BL/6J mouse. Investigative Ophthalmology & Visual Science. 51 (1), 623-630 (2010).
- Stahl, J. S. Calcium channelopathy mutants and their role in ocular motor research. Annals of the New York Academy of Sciences. 956, 64-74 (2002).
- Endo, S., et al. Dual involvement of G-substrate in motor learning revealed by gene deletion. Proceedings of the National Academy of Sciences. 106 (9), 3525-3530 (2009).
- Thomas, B. B., Seiler, M. J., Sadda, S. R., Coffey, P. J., Aramant, R. B. Optokinetic test to evaluate visual acuity of each eye independently. Journal of Neuroscience Methods. 138 (1-2), 7-13 (2004).
- Burroughs, S. L., Kaja, S., Koulen, P. Quantification of deficits in spatial visual function of mouse models for glaucoma. Investigative Ophthalmology & Visual Science. 52 (6), 3654-3659 (2011).
- Wakita, R., et al. Differential regulations of vestibulo-ocular reflex and optokinetic response by β- and α2-adrenergic receptors in the cerebellar flocculus. Scientific Reports. 7 (1), 3944 (2017).
- Dehmelt, F. A., et al. Spherical arena reveals optokinetic response tuning to stimulus location, size, and frequency across entire visual field of larval zebrafish. eLife. 10, e63355 (2021).
- Magnusson, M., Pyykko, I., Jantti, V. Effect of alertness and visual attention on optokinetic nystagmus in humans. American Journal of Otolaryngology. 6 (6), 419-425 (1985).
- Collins, W. E., Schroeder, D. J., Elam, G. W. Effects of D-amphetamine and of secobarbital on optokinetic and rotation-induced nystagmus. Aviation, Space, and Environmental Medicine. 46 (4), 357-364 (1975).
- Reimer, J., et al. Pupil fluctuations track fast switching of cortical states during quiet wakefulness. Neuron. 84 (2), 355-362 (2014).
- Sakatani, T., Isa, T. PC-based high-speed video-oculography for measuring rapid eye movements in mice. Neuroscience Research. 49 (1), 123-131 (2004).
- Sakatani, T., Isa, T. Quantitative analysis of spontaneous saccade-like rapid eye movements in C57BL/6 mice. Neuroscience Research. 58 (3), 324-331 (2007).
- Vinck, M., Batista-Brito, R., Knoblich, U., Cardin, J. A. Arousal and locomotion make distinct contributions to cortical activity patterns and visual encoding. Neuron. 86 (3), 740-754 (2015).
- Bradley, M. M., Miccoli, L., Escrig, M. A., Lang, P. J. The pupil as a measure of emotional arousal and autonomic activation. Psychophysiology. 45 (4), 602-607 (2008).
- Hess, E. H., Polt, J. M. Pupil size as related to interest value of visual stimuli. Science. 132 (3423), 349-350 (1960).
- Di Stasi, L. L., Catena, A., Canas, J. J., Macknik, S. L., Martinez-Conde, S. Saccadic velocity as an arousal index in naturalistic tasks. Neuroscience and Biobehavioral Reviews. 37 (5), 968-975 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。