Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Quantifizierung der visuellen Merkmalsselektivität des optokinetischen Reflexes in Mäusen
In diesem Artikel
Zusammenfassung
Hier beschreiben wir ein Standardprotokoll zur Quantifizierung des optokinetischen Reflexes. Es kombiniert virtuelle Trommelstimulation und Video-Okulographie und ermöglicht so eine präzise Bewertung der Merkmalsselektivität des Verhaltens und seiner adaptiven Plastizität.
Zusammenfassung
Der optokinetische Reflex (OKR) ist eine essentielle angeborene Augenbewegung, die durch die globale Bewegung der visuellen Umgebung ausgelöst wird und der Stabilisierung von Netzhautbildern dient. Aufgrund seiner Bedeutung und Robustheit wurde das OKR verwendet, um visuell-motorisches Lernen zu untersuchen und die visuellen Funktionen von Mäusen mit unterschiedlichen genetischen Hintergründen, Altersgruppen und medikamentösen Behandlungen zu bewerten. Hier stellen wir ein Verfahren vor, um OKR-Antworten von kopffixierten Mäusen mit hoher Genauigkeit zu bewerten. Die Kopffixierung kann den Beitrag der vestibulären Stimulation zu den Augenbewegungen ausschließen, so dass Augenbewegungen gemessen werden können, die nur durch visuelle Bewegungen ausgelöst werden. Das OKR wird durch ein virtuelles Trommelsystem hervorgerufen, bei dem ein vertikales Gitter, das auf drei Computermonitoren präsentiert wird, horizontal oszillierend oder unidirektional mit konstanter Geschwindigkeit driftet. Mit diesem Virtual-Reality-System können wir visuelle Parameter wie Ortsfrequenz, Zeit-/Schwingungsfrequenz, Kontrast, Leuchtdichte und die Richtung von Gittern systematisch ändern und Abstimmungskurven der visuellen Merkmalsselektivität quantifizieren. Die Hochgeschwindigkeits-Infrarot-Videookulografie sorgt für eine genaue Messung der Flugbahn von Augenbewegungen. Die Augen einzelner Mäuse sind kalibriert, um die Möglichkeit zu bieten, die OKRs zwischen Tieren unterschiedlichen Alters, Geschlechts und genetischem Hintergrund zu vergleichen. Die quantitative Leistungsfähigkeit dieser Technik ermöglicht es, Veränderungen im OKR zu erkennen, wenn sich dieses Verhalten aufgrund von Alterung, sensorischer Erfahrung oder motorischem Lernen plastisch anpasst. Damit ist diese Technik eine wertvolle Ergänzung des Repertoires an Werkzeugen, die zur Untersuchung der Plastizität des Augenverhaltens verwendet werden.
Einleitung
Als Reaktion auf visuelle Reize in der Umgebung bewegen sich unsere Augen, um unseren Blick zu verschieben, Netzhautbilder zu stabilisieren, sich bewegende Ziele zu verfolgen oder die Foveen zweier Augen auf Ziele auszurichten, die sich in unterschiedlichen Entfernungen vom Beobachter befinden, was für das richtige Sehen von entscheidender Bedeutung ist 1,2. Okulomotorische Verhaltensweisen werden häufig als attraktive Modelle der sensomotorischen Integration verwendet, um die neuronalen Schaltkreise in Gesundheit und Krankheit zu verstehen, zumindest teilweise aufgrund der Einfachheit des okulomotorischen Systems3. Das Auge, das von drei Paaren extraokularer Muskeln gesteuert wird, dreht sich in der Augenhöhle hauptsächlich um drei korrespondierende Achsen: Hebung und Vertiefung entlang der Querachse, Adduktion und Abduktion entlang der vertikalen Achse sowie Intorion und Extorsion entlang der anteroposterioren Achse 1,2. Ein solch einfaches System ermöglicht es Forschern, das okulomotorische Verhalten von Mäusen in einer Laborumgebung einfach und genau zu bewerten.
Ein wichtigstes okulomotorisches Verhalten ist der optokinetische Reflex (OKR). Diese unwillkürliche Augenbewegung wird durch langsame Drifts oder Verrutscher von Bildern auf der Netzhaut ausgelöst und dient der Stabilisierung von Netzhautbildern, wenn sich der Kopf eines Tieres oder seine Umgebung bewegt 2,4. Das OKR als Verhaltensparadigma ist für Forscher aus mehreren Gründen interessant. Erstens kann es zuverlässig stimuliert und genau quantifiziert werden 5,6. Zweitens sind die Verfahren zur Quantifizierung dieses Verhaltens relativ einfach und standardisiert und können angewendet werden, um die visuellen Funktionen einer großen Kohorte von Tieren zu bewerten7. Drittens ist dieses angeborene Verhalten hochgradig plastisch 5,8,9. Seine Amplitude kann potenziert werden, wenn über einen längeren Zeitraum wiederholte Netzhautverschiebungen auftreten 5,8,9 oder wenn sein Arbeitspartner vestibulärer Augenreflex (VOR), ein weiterer Mechanismus zur Stabilisierung von Netzhautbildern, der durch vestibulären Input2 ausgelöst wird, beeinträchtigt ist5. Diese experimentellen Paradigmen der OKR-Potenzierung ermöglichen es den Forschern, die Schaltkreisbasis zu enthüllen, die dem okulomotorischen Lernen zugrunde liegt.
Zur Auswertung der OKR wurden in bisherigen Studien vor allem zwei nicht-invasive Methoden eingesetzt: (1) Video-Okulographie kombiniert mit einer physischen Trommel 7,10,11,12,13 oder (2) willkürliche Bestimmung von Kopfdrehungen in Kombination mit einer virtuellen Trommel 6,14,15,16. Obwohl ihre Anwendungen fruchtbare Entdeckungen zum Verständnis der molekularen und Schaltkreismechanismen der okulomotorischen Plastizität gemacht haben, haben diese beiden Methoden jeweils einige Nachteile, die ihre Möglichkeiten bei der quantitativen Untersuchung der Eigenschaften des OKR einschränken. Erstens erlauben physische Trommeln mit gedruckten Mustern aus schwarzen und weißen Streifen oder Punkten keine einfachen und schnellen Änderungen visueller Muster, was die Messung der Abhängigkeit des OKR von bestimmten visuellen Merkmalen wie Ortsfrequenz, Richtung und Kontrast von sich bewegenden Gittern weitgehend einschränkt 8,17. Stattdessen können Tests der Selektivität des OKR für diese visuellen Merkmale von einer computergestützten visuellen Stimulation profitieren, bei der visuelle Merkmale bequem von Versuch zu Versuch modifiziert werden können. Auf diese Weise können Forschende das OKR-Verhalten im mehrdimensionalen visuellen Parameterraum systematisch untersuchen. Darüber hinaus meldet die zweite Methode des OKR-Assays nur die Schwellenwerte visueller Parameter, die erkennbare OKRs auslösen, nicht aber die Amplituden von Augen- oder Kopfbewegungen 6,14,15,16. Der Mangel an quantitativer Aussagekraft verhindert daher die Analyse der Form von Abstimmungskurven und der bevorzugten visuellen Merkmale oder das Erkennen subtiler Unterschiede zwischen einzelnen Mäusen unter normalen und pathologischen Bedingungen. Um die oben genannten Einschränkungen zu überwinden, wurden Video-Okulographie und computergestützte virtuelle visuelle Stimulation kombiniert, um das OKR-Verhalten in neueren Studien zu untersuchen 5,17,18,19,20. Diese bisher veröffentlichten Studien lieferten jedoch nicht genügend technische Details oder Schritt-für-Schritt-Anleitungen, so dass es für Forschende immer noch eine Herausforderung ist, einen solchen OKR-Test für die eigene Forschung zu etablieren.
Hier stellen wir ein Protokoll vor, um die visuelle Merkmalsselektivität des OKR-Verhaltens unter photopischen oder skotopischen Bedingungen mit der Kombination von Video-Okulographie und computergestützter virtueller visueller Stimulation genau zu quantifizieren. Mäuse werden mit dem Kopf fixiert, um die durch vestibuläre Stimulation hervorgerufenen Augenbewegungen zu vermeiden. Eine Hochgeschwindigkeitskamera wird verwendet, um die Augenbewegungen von Mäusen aufzuzeichnen, die sich bewegende Gitter mit wechselnden visuellen Parametern betrachten. Die physikalische Größe der Augäpfel einzelner Mäuse wird kalibriert, um die Genauigkeit der Ableitung des Augenwinkels21 zu gewährleisten. Diese quantitative Methode ermöglicht es, das OKR-Verhalten zwischen Tieren unterschiedlichen Alters oder genetischen Hintergrunds zu vergleichen oder seine Veränderung durch pharmakologische Behandlungen oder visuell-motorisches Lernen zu überwachen.
Protokoll
Alle experimentellen Verfahren, die in dieser Studie durchgeführt wurden, wurden vom Biological Sciences Local Animal Care Committee in Übereinstimmung mit den Richtlinien des Animal Care Committee der University of Toronto und des Canadian Council on Animal Care genehmigt.
1. Implantation eines Kopfbügels auf dem Schädel
HINWEIS: Um den Beitrag des VOR-Verhaltens zu den Augenbewegungen zu vermeiden, wird der Kopf der Maus während des OKR-Tests bewegungsunfähig gemacht. Dazu wird ein Kopfbügel chirurgisch auf den Schädel implantiert.
- Eine Maus (2-5 Monate alte weibliche und männliche C57BL/6) wird in einer Gaskammer mit einer Mischung aus 4% Isofluran (v/v) undO2 betäubt. Übertragen Sie die Maus auf eine maßgeschneiderte Operationsplattform und reduzieren Sie die Konzentration von Isofluran auf 1,5 % bis 2 %. Überwachen Sie die Tiefe der Anästhesie, indem Sie die Zehenkneifreaktion und die Atemfrequenz während der gesamten Operation überprüfen.
- Legen Sie ein Heizkissen unter den Körper des Tieres, um seine Körpertemperatur aufrechtzuerhalten. Tragen Sie eine Schicht Gleitmittel-Augensalbe auf beide Augen auf, um sie vor dem Austrocknen zu schützen. Decken Sie die Augen mit Aluminiumfolie ab, um sie vor leichter Beleuchtung zu schützen.
- Subkutan injizieren Sie Carprofen in einer Dosis von 20 mg/kg, um Schmerzen zu lindern. Nachdem Sie das Fell mit Chlorhexidingluconat-Hautreiniger benetzt haben, rasieren Sie das Fell auf dem Schädel. Desinfizieren Sie die freiliegende Kopfhaut zweimal mit 70%igem Isopropylalkohol und Chlorhexidinalkohol.
- Injizieren Sie Bupivacain (8 mg/kg) subkutan an der Inzisionsstelle und entfernen Sie dann die Kopfhaut (~1 cm2) mit einer Schere, um die dorsale Oberfläche des Schädels freizulegen, einschließlich des hinteren Stirnbeins, des Scheitelbeins und des interparietalen Knochens.
- Tragen Sie mehrere Tropfen 1%iges Lidocain und 1:100.000 Epinephrin auf den freiliegenden Schädel auf, um lokale Schmerzen und Blutungen zu reduzieren. Kratzen Sie den Schädel mit einer Meyhoefer-Kürette ab, um die Faszie zu entfernen, und reinigen Sie ihn mit phosphatgepufferter Kochsalzlösung (PBS).
HINWEIS: Der Schläfenmuskel wird vom Schädel getrennt, um die Oberfläche für die Befestigung einer Kopfstange zu vergrößern. - Trocknen Sie den Schädel, indem Sie vorsichtig Druckluft in Richtung der Schädeloberfläche blasen, bis die Feuchtigkeit verschwunden ist und der Knochen weißlich wird. Tragen Sie eine dünne Schicht Sekundenkleber auf die freiliegende Oberfläche des Schädels auf, einschließlich des Randes der geschnittenen Kopfhaut, gefolgt von einer Schicht Acrylharz.
HINWEIS: Die Oberfläche des Schädels muss vor dem Auftragen von Sekundenkleber frei von Blut oder Wasser sein. - Platzieren Sie eine Kopfstange aus Edelstahl (siehe Abbildung 1A) entlang der Mittellinie auf dem Schädel. Tragen Sie mehr Acrylharz auf, beginnend mit der Kante der Kopfstange, bis die Basis der Kopfstange vollständig in das Acrylharz eingebettet ist. Tragen Sie zwei- bis dreimal Acrylharz auf, um die Dicke aufzubauen.
- Warten Sie ca. 15 min, bis das Acrylharz ausgehärtet ist. Subkutan injizieren Sie 1 ml Ringer-Laktatlösung. Setzen Sie die Maus dann wieder in einen Käfig, der auf einem Heizkissen steht, bis das Tier vollständig mobil ist.
- Lassen Sie die Maus nach der Operation mindestens 5 Tage lang im häuslichen Käfig entspannen. Sobald das Tier in guter Form ist, fixieren Sie seinen Kopf mit der Kopfleiste im OKR-Setup für 15-30 Minuten, um es mit der Kopffixierung und der experimentellen Umgebung vertraut zu machen. Wiederholen Sie die Eingewöhnung einmal täglich für mindestens 3 Tage.
2. Aufbau der virtuellen Trommel und Video-Okulografie
- Montieren Sie drei Monitore orthogonal zueinander, um ein quadratisches Gehäuse zu bilden, das ~270° des Azimuts und 63° der Elevation im visuellen Raum abdeckt (Abbildung 1B links).
- Mit einer separaten Grafikkarte können Sie die drei Monitore zu einem einfachen Display zusammenführen, um die Synchronisierung zwischen allen Monitoren zu gewährleisten.
- Kalibrieren Sie die Luminanz von Monitoren wie unten beschrieben.
- Schalten Sie den Computer ein, an den die Monitore angeschlossen sind, und warten Sie 15 Minuten. Das Aufwärmen ist wichtig, um eine stabile Leuchtdichte zu haben.
- Ändern Sie die Helligkeitseinstellung des Monitors systematisch in 25er-Schritten von 0 auf 100.
- Messen Sie für jeden Helligkeitswert die Leuchtdichte der Monitore unter verschiedenen Pixelwerten (0-255, 15er-Schritte) mit einem Luminanzmessgerät.
- Passen Sie die Beziehung zwischen Luminanz und Helligkeit für den Pixelwert 255 mit linearer Regression an und schätzen Sie den Helligkeitswert, der 160 cd/m2 ergibt.
- Schätzen Sie für jeden Pixelwert, der bei der Luminanzmessung (Schritt 2.3.3) verwendet wird, die Luminanz für den in Schritt 2.3.4 abgeleiteten Helligkeitswert auf der Grundlage der linearen Regression. Verwenden Sie die Potenzfunktion lum = A * Pixel γ, um die Beziehung zwischen dem neuen Satz von Luminanzwerten (unter dem in 2.3.4 abgeleiteten Helligkeitswert) und den entsprechenden Pixelwerten anzupassen, um den Gammafaktor γund den Koeffizienten A abzuleiten. Diese werden verwendet, um sinusförmige Gitter mit gewünschten Leuchtdichtewerten zu erzeugen.
- Stellen Sie die Helligkeit aller drei Monitore auf die in Schritt 2.3.4 ermittelten Werte ein, um sicherzustellen, dass ihre Luminanzwerte für denselben Pixelwert gleich sind.
- Generieren Sie eine virtuelle Trommel, die zur Stimulierung des OKR-Verhaltens verwendet wird, mit dem Visual Stimulation Toolkit, wie unten beschrieben.
- Präsentieren Sie ein vertikales sinusförmiges Gitter auf den Monitoren und passen Sie die Periode (Abstand zwischen den Streifen) entlang des Azimuts an, um sicherzustellen, dass die Projektion des Gitters auf das Auge eine konstante räumliche Frequenz hat (Trommelgitter; Abbildung 1B Mitte und rechts).
- Stellen Sie sicher, dass der Kopf des Tieres in der Mitte des Geheges befestigt ist, damit es sieht, dass das Gitter eine konstante räumliche Frequenz über die Oberfläche der virtuellen Trommel hat.
- Ändern Sie die Parameter des beweglichen Gitters, wie z. B. die Schwingungsamplitude, die Ortsfrequenz, die Zeit-/Schwingungsfrequenz, die Richtung, den Kontrast usw., in den visuellen Stimulationscodes. Verwenden Sie zwei Arten von visueller Bewegung: (1) Das Gitter driftet im Uhrzeigersinn oder gegen den Uhrzeigersinn oszillierend nach einer sinusförmigen Funktion:
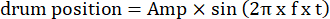
Dabei ist Amp die Amplitude der Trommeltrajektorie, f die Schwingungsfrequenz und t die Zeit (Schwingungsamplitude: 5°; Gitterortfrequenz: 0,04-0,45 cpd; Schwingungsfrequenz: 0,1-0,8 Hz, entsprechend einer Spitzengeschwindigkeit des Stimulus von 3,14-25,12 °/s [Trommelgeschwindigkeit = Amp x 2π x f x cos (2π x f x t); Kontrast: 80%-100%; mittlere Leuchtdichte: 35-45 cd/m2; (2) Das Gitter driftet unidirektional mit konstanter Geschwindigkeit: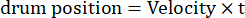
(Ortsfrequenz: 0,04-0,64 cpd; Zeitfrequenz: 0,25-1 Hz; Trommelgeschwindigkeit = Zeitfrequenz/Ortsfrequenz.)
- Richten Sie die Video-Okulografie wie unten beschrieben ein.
- Um eine Blockade des Gesichtsfeldes des Tieres zu vermeiden, platzieren Sie einen Infrarotspiegel (IR) 60° von der Mittellinie entfernt, um ein Bild des rechten Auges zu erstellen.
- Platzieren Sie eine IR-Kamera auf der rechten Seite hinter der Maus (Abbildung 1C links), um ein Bild des rechten Auges aufzunehmen.
- Montieren Sie die Hochgeschwindigkeits-IR-Kamera an einem Kameraarm, der es der Kamera ermöglicht, sich um ± 10° um das Bild des rechten Auges zu drehen (Abbildung 1C rechts).
- Verwenden Sie eine Fotodiode, die an einem der Monitore angebracht ist, um ein elektrisches Signal zu liefern, um das Timing von Videookulographie und visueller Stimulation zu synchronisieren.
- Platzieren Sie vier IR-Leuchtdioden (LEDs), die von Schwanenhalsarmen getragen werden, um das rechte Auge zu beleuchten.
- Platzieren Sie zwei IR-LEDs an der Kamera, um Hornhautreflexionsreferenzen (CR) bereitzustellen: Eine ist über der Kamera befestigt (X-CR), während sich die andere auf der linken Seite der Kamera befindet (Y-CR; Abbildung 1D).
- Messen Sie die optische Vergrößerung des Video-Okulographie-Systems mit einem Kalibrierungsobjektträger.
ANMERKUNG: Die Referenz-CRs werden verwendet, um die translatorischen Augenbewegungen aufzuheben, wenn der Augenwinkel basierend auf den rotierenden Augenbewegungen berechnet wird.
- Befestigen Sie den Kopf des Tieres in der Mitte des Geheges, das von den Monitoren gebildet wird, wie unten beschrieben.
- Befestigen Sie den Kopf des Tieres mit der Kopfplatte in der Mitte des Rigs und lassen Sie ihn nach vorne zeigen. Stellen Sie die Neigung des Kopfes so ein, dass das linke und rechte Auge auf gleicher Höhe sind und die Nasen- und Schläfenwinkel horizontal ausgerichtet sind (Abbildung 1E).
- Bewegen Sie den Kopf des Tieres horizontal durch grobe Justierung durch die Kopffixierungsvorrichtung und die Feinjustierung durch einen 2D-Translationstisch und vertikal durch die Kopffixierungsvorrichtung und ein Pfostenhalterpaar, bis das rechte Auge des Tieres im Live-Video der Kamera erscheint. Vor der Kalibrierung und Messung der Augenbewegungen wird das Bild des rechten Auges des Tieres, das vom heißen Spiegel reflektiert wird, mit dem Drehpunkt des Kameraarms überlagert (siehe Details in Schritt 3.4 unten).
- Bauen Sie ein maßgeschneidertes Gehäuse um das OKR-Rig herum, um das Raumlicht zu blockieren (Abbildung 1F).
3. Kalibrierung von Augenbewegungen
HINWEIS: Rotationsbewegungen der Augen werden auf der Grundlage der Bewegungen der Pupille und des Radius der Umlaufbahn der Pupillenbewegungen (Rp, der Abstand von der Mitte der Pupille zur Mitte des Augapfels) berechnet. Für jede einzelne Maus wird dieser Radius experimentell gemessen21.
- Befestigen Sie den Kopf des Tieres in der Mitte des Geheges, das von den drei Monitoren gebildet wird, wie in Schritt 2.6.1 beschrieben.
- Schalten Sie die Kamera ein und stellen Sie die vier LEDs rund um das rechte Auge ein, um eine gleichmäßige IR-Beleuchtung zu erzielen.
- Passen Sie unter visueller Anleitung die Position des rechten Auges an, bis es in der Mitte des Videos erscheint, wie in Schritt 2.6.2 beschrieben.
- Richten Sie das virtuelle Bild des rechten Auges am Drehpunkt des Kameraarms aus, wie unten beschrieben.
- Drehen Sie den Kameraarm manuell zum linken äußersten Ende (-10°). Verschieben Sie die Position des rechten Auges des Tieres manuell auf der horizontalen Ebene senkrecht zur optischen Achse mit Feinjustierung des 2D-Translationstisches (Abbildung 1C, grüner Pfeil), bis sich der X-CR in der horizontalen Bildmitte befindet.
- Drehen Sie den Kameraarm manuell zum anderen Ende (+10°). Wenn der X-CR von der Bildmitte wegläuft, bewegen Sie das rechte Auge mit Feinjustierung entlang der optischen Achse, bis der X-CR in die Mitte kommt (Abbildung 1C, blauer Pfeil).
- Wiederholen Sie die Schritte 3.4.1-3.4.2 einige Male, bis die X-CR in der Mitte bleibt, wenn der Kameraarm nach links und rechts schwenkt. Wenn sich das rechte Auge in der Mitte einer Wiederholung bewegt, starten Sie den Anpassungsprozess erneut.
- Messen Sie den vertikalen Abstand zwischen Y-CR und X-CR, nachdem Sie den Kameraarm in der Mittelposition arretiert haben. Schalten Sie die Y-CR-LED ein und zeichnen Sie ihre Position im Video auf, wechseln Sie dann zur X-CR-LED und zeichnen Sie ihre Position auf.
HINWEIS: Der vertikale Abstand zwischen Y-CR und X-CR wird verwendet, um die Position des Y-CR während der Messung von Augenbewegungen abzuleiten, bei denen nur die X-CR-LED eingeschaltet ist. - Messen Sie den Radius der Pupillendrehung Rp, wie unten beschrieben.
- Drehen Sie den Kameraarm nach links (-10°) und zeichnen Sie die Positionen der Pupille (Pp1) und X-CR (PCR1) auf dem Video auf.
- Drehen Sie dann den Kameraarm nach rechts (+10°) und zeichnen Sie die Positionen der Pupille (Pp2) und X-CR (PCR2) auf dem Video auf. Wiederholen Sie diesen Schritt mehrmals.
HINWEIS: Das rechte Auge des Tieres muss bei jeder Wiederholung stationär bleiben, damit die Anzahl der Pupillenbewegungen im Film den Grad des Schwingens des Kameraarms genau widerspiegelt. - Berechnen Sie auf der Grundlage der oben aufgezeichneten Werte den Radiusder Pupillendrehung Rp (Abbildung 2A) mit der folgenden Formel:
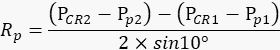
HINWEIS: Der Abstand zwischen der Hornhautreflexion und der Pupillenmitte im physischen Raum wird basierend auf ihrem Abstand im Film berechnet:
PCR - Pp = Anzahl der Pixel im Film x Pixelgröße des Kamerachips x Vergrößerung
- Entwickeln Sie die Beziehung zwischen Rp und dem Pupillendurchmesser, wie unten beschrieben. Rp ändert sich, wenn sich die Pupille erweitert oder verengt; sein Wert ist umgekehrt proportional zur Pupillengröße (Abbildung 2B oben).
- Ändern Sie die Leuchtdichte der Monitore systematisch von 0 bis 160 cd/m2 , um die Pupillengröße zu regulieren.
- Wiederholen Sie für jeden Luminanzwert Schritt 3.6 8-10 Mal und notieren Sie den Durchmesser der Pupille.
- Wenden Sie die lineare Regression auf die Beziehung zwischen Rp und Pupillendurchmesser basierend auf den oben gemessenen Werten an, um die Steigung und den Achsenabschnitt abzuleiten (Abbildung 2B unten).
HINWEIS: Die Ausreißer, die durch gelegentliche Augenbewegungen verursacht werden, werden vor der linearen Anpassung entfernt. Bei wiederholten Messungen in mehreren Sitzungen muss die Kalibrierung nur einmal für ein Tier durchgeführt werden, es sei denn, sein Auge wird während des Experiments größer.
4. Augenbewegungen des OKR aufzeichnen
- Befestigen Sie eine Maus mit dem Kopf im Rig, indem Sie die Schritte 3.1 bis 3.4 ausführen. Überspringen Sie diesen Schritt, wenn die Aufzeichnung direkt nach der Kalibrierung erfolgt. Arretieren Sie den Kameraarm in der Mittelposition.
- Richte die Monitore und das Tier wie unten beschrieben für skotopisches OKR ein. Überspringen Sie diesen Schritt für photopisches OKR.
- Decken Sie den Bildschirm jedes Monitors mit einem kundenspezifischen Filter ab, der aus fünf Schichten 1,2-Neutraldichte-Folie (ND) besteht. Stellen Sie sicher, dass kein Licht durch den Spalt zwischen dem Filter und dem Monitor austritt.
- Schalten Sie das Raumlicht aus. Die folgenden Schritte werden mit Hilfe einer IR-Brille durchgeführt.
- Tragen Sie einen Tropfen Pilocarpinlösung (2% in Kochsalzlösung) auf das rechte Auge auf und warten Sie 15 Minuten. Achten Sie darauf, dass der Tropfen auf dem Auge bleibt und nicht mit der Maus weggewischt wird. Wenn die Lösung vom Tier weggewischt wird, tragen Sie einen weiteren Tropfen Pilocarpinlösung auf. Dadurch wird die Pupille auf eine geeignete Größe für das Eye-Tracking unter der skotopischen Bedingung verkleinert.
ANMERKUNG: Bei der skotopischen Erkrankung weitet sich die Pupille erheblich, so dass ihr Rand teilweise hinter dem Augenlid verborgen ist. Dies wirkt sich auf die Genauigkeit der Schätzung des Pupillenzentrums mittels Videookulographie aus. Durch die pharmakologisch bedingte Verkleinerung der Pupille des rechten Auges verringert sich der visuelle Input, und somit werden die visuellen Reize dem linken Auge präsentiert. - Spülen Sie das rechte Auge mit Kochsalzlösung aus, um die Pilocarpin-Lösung gründlich abzuwaschen. Ziehen Sie den Vorhang herunter, um das Gehäuse vollständig abzudichten, wodurch verhindert wird, dass Streulicht das skotopische Sehen stört.
- Geben Sie dem Tier 5 Minuten Zeit, um sich vollständig an die skotopische Umgebung zu gewöhnen, bevor Sie mit dem OKR-Test beginnen.
- Führen Sie die visuelle Stimulationssoftware und die Eye-Tracking-Software aus. Stellen Sie für die photopische OKR-Messung sicher, dass das Trommelgitter horizontal mit einer sinusförmigen Trajektorie oszilliert. Stellen Sie für die skotopische OKR-Messung sicher, dass das Trommelgitter mit einer konstanten Geschwindigkeit von links nach rechts driftet, was der temporo-nasalen Richtung in Bezug auf das linke Auge entspricht.
HINWEIS: Wenn die Pupille des rechten Auges, aber nicht des linken Auges, unter der skotopischen Bedingung durch Pilocarpin geschrumpft ist, ist die durch oszillatorische Trommelstimulation hervorgerufene OKR stark asymmetrisch. So wird bei der skotopischen OKR-Messung das linke Auge stimuliert, während die Bewegung des rechten Auges überwacht wird. - Die Eye-Tracking-Software misst automatisch die Pupillengröße, die CR-Position und die Pupillenposition für jedes Bild und berechnet den Winkel der Augenposition basierend auf der folgenden Formel (Abbildung 2C):
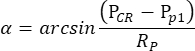
Hier ist P CR dieCR-Position, P p die Pupillenposition und Rp der Radius der Pupillendrehung. Der Abstand zwischen Hornhautreflexion und Pupillenzentrum im physischen Raum wird auf der Grundlage ihres Abstands im Film berechnet:
PCR - Pp = Anzahl der Pixel im Film x Pixelgröße des Kamerachips x Vergrößerung
Rp der entsprechenden Pupillengröße wird basierend auf dem linearen Regressionsmodell in Schritt 3.7.3 abgeleitet (Abbildung 2B unten).
5. Analyse der Augenbewegungen des OKR mit der Augenanalyse-Software
- Verarbeiten Sie die Eye-Traces mit einem Medianfilter (Filterfenster = 0,05 s), um hochfrequentes Rauschen zu entfernen (Abbildung 3A Mitte).
- Entfernen Sie die Sakkaden oder den Nystagmus wie unten beschrieben.
- Schätzen Sie die Augengeschwindigkeit, indem Sie die Ableitung erster Ordnung der Augenbewegungen berechnen (Abbildung 3A unten). Identifizieren Sie die Sakkaden oder den Nystagmus durch Anwendung einer Geschwindigkeitsschwelle von 50 °/s (Abbildung 3A unten).
- Ersetzen Sie die Sakkaden oder den Nystagmus, indem Sie die Augenpositionen während dieser schnellen Augenbewegungen aus dem Segment vor den Sakkaden oder dem Nystagmus auf der Grundlage der linearen Regression extrapolieren (Abbildung 3B).
- Berechnen Sie die Amplitude von OKR-Augenbewegungen durch schnelle Fourier-Transformation (Goertzel-Algorithmus), wenn das Trommelgitter oszilliert (Abbildung 3C), oder berechnen Sie die durchschnittliche Geschwindigkeit der Augenbewegungen während der visuellen Stimulation, wenn sich das Trommelgitter mit konstanter Geschwindigkeit in eine Richtung bewegt (Abbildung 3B unten).
ANMERKUNG: Die Amplitude der oszillatorischen Augenbewegungen, die aus der Fourier-Transformation abgeleitet wird, ähnelt der Amplitude, die sich aus der Anpassung der Augentrajektorie an eine sinusförmige Funktion ergibt (Abbildung 3D). - Berechne den OKR-Gewinn. Für oszillatorische Trommelbewegungen ist die OKR-Verstärkung definiert als das Verhältnis der Amplitude der Augenbewegungen zur Amplitude der Trommelbewegungen (Abbildung 3C rechts). Bei unidirektionalen Trommelbewegungen ist die OKR-Verstärkung als das Verhältnis von Augengeschwindigkeit zu Trommelgittergeschwindigkeit definiert (Abbildung 3B unten).
Ergebnisse
Mit der oben beschriebenen Vorgehensweise haben wir die Abhängigkeit des OKR von mehreren visuellen Merkmalen bewertet. Die hier gezeigten Beispiel-Traces wurden mit den Analysecodes in Supplementary Coding File 1 abgeleitet, und die Beispiel-Traces-Rohdatei befindet sich in Supplementary Coding File 2. Wenn das Trommelgitter in einer sinusförmigen Trajektorie (0,4 Hz) driftete, folgte das Auge des Tieres automatisch der Bewegung des Gitters in ähnlicher oszillatorischer Weise (
Diskussion
Die hier vorgestellte Methode des OKR-Verhaltensassays bietet mehrere Vorteile. Erstens löst die computergenerierte visuelle Stimulation die intrinsischen Probleme physischer Trommeln. Die virtuelle Trommel befasst sich mit dem Problem, dass physische Trommeln die systematische Untersuchung von Ortsfrequenz-, Richtungs- oder Kontrastabstimmung nicht unterstützen8 und ermöglicht es, diese visuellen Parameter versuchsweise zu ändern, wodurch eine systematische und quantitative Analyse der Merkma...
Offenlegungen
Die Autoren erklären, dass es keine konkurrierenden Interessen gibt.
Danksagungen
Wir danken Yingtian He für die Bereitstellung von Daten zur Richtungsabstimmung. Diese Arbeit wurde durch Zuschüsse der Canadian Foundation of Innovation und des Ontario Research Fund (CFI/ORF-Projekt Nr. 37597), NSERC (RGPIN-2019-06479), CIHR (Project Grant 437007) und Connaught New Researcher Awards unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 2D translational stage | Thorlabs | XYT1 | |
| Acrylic resin | Lang Dental | B1356 | For fixing headplate on skull and protecting skull |
| Bupivacaine | STERIMAX | ST-BX223 | Bupivacaine Injection BP 0.5%. Local anesthesia |
| Carprofen | RIMADYL | 8507-14-1 | Analgesia |
| Compressed air | Dust-Off | ||
| Eye ointment | Alcon | Systane | For maintaining moisture of eyes |
| Graphic card | NVIDIA | Geforce GTX 1650 or Quadro P620. | For generating single screen among three monitors |
| Heating pad | Kent Scientific | HTP-1500 | For maintaining body temperature |
| High-speed infrared (IR) camera | Teledyne Dalsa | G3-GM12-M0640 | For recording eye rotation |
| IR LED | Digikey | PDI-E803-ND | For CR reference and the illumination of the eye |
| IR mirror | Edmund optics | 64-471 | For reflecting image of eye |
| Isoflurane | FRESENIUS KABI | CP0406V2 | |
| Labview | National instruments | version 2014 | eye tracking |
| Lactated ringer | BAXTER | JB2324 | Water and energy supply |
| Lidocaine and epinephrine mix | Dentsply Sirona | 82215-1 | XYLOCAINE. Local anesthesia |
| Luminance Meter | Konica Minolta | LS-150 | for calibration of monitors |
| Matlab | MathWorks | version xxx | analysis of eye movements |
| Meyhoefer Curette | World Precision Instruments | 501773 | For scraping skull and removing fascia |
| Microscope calibration slide | Amscope | MR095 | to measure the magnification of video-oculography |
| Monitors | Acer | B247W | Visual stimulation |
| Neutral density filter | Lee filters | 299 | to generate scotopic visual stimulation |
| Nigh vision goggle | Alpha optics | AO-3277 | for scotopic OKR |
| Photodiode | Digikey | TSL254-R-LF-ND | to synchronize visual stimulation and video-oculography |
| Pilocarpine hydrochloride | Sigma-Aldrich | P6503 | |
| Post | Thorlabs | TR1.5 | |
| Post holder | Thorlabs | PH1 | |
| PsychoPy | open source software | version xxx | visual stimulation toolkit |
| Scissor | RWD | S12003-09 | For skin removal |
| Superglue | Krazy Glue | Type: All purpose. For adhering headplate on the skull |
Referenzen
- Gerhard, D. Neuroscience. 5th Edition. Yale Journal of Biology and Medicine. , (2013).
- Distler, C., Hoffmann, K. P. . The Oxford Handbook of Eye Movement. , 65-83 (2011).
- Sereno, A. B., Bolding, M. S. . Executive Functions: Eye Movements and Human Neurological Disorders. , (2017).
- Giolli, R. A., Blanks, R. H. I., Lui, F. The accessory optic system: basic organization with an update on connectivity, neurochemistry, and function. Progress in Brain Research. 151, 407-440 (2006).
- Liu, B. H., Huberman, A. D., Scanziani, M. Cortico-fugal output from visual cortex promotes plasticity of innate motor behaviour. Nature. 538 (7625), 383-387 (2016).
- Prusky, G. T., Alam, N. M., Beekman, S., Douglas, R. M. Rapid quantification of adult and developing mouse spatial vision using a virtual optomotor system. Investigative Ophthalmology & Visual Science. 45 (12), 4611-4616 (2004).
- Stahl, J. S., van Alphen, A. M., De Zeeuw, C. I. A comparison of video and magnetic search coil recordings of mouse eye movements. Journal of Neuroscience Methods. 99 (1-2), 101-110 (2000).
- Faulstich, B. M., Onori, K. A., du Lac, S. Comparison of plasticity and development of mouse optokinetic and vestibulo-ocular reflexes suggests differential gain control mechanisms. Vision Research. 44 (28), 3419-3427 (2004).
- Katoh, A., Kitazawa, H., Itohara, S., Nagao, S. Dynamic characteristics and adaptability of mouse vestibulo-ocular and optokinetic response eye movements and the role of the flocculo-olivary system revealed by chemical lesions. Proceedings of the National Academy of Sciences. 95 (13), 7705-7710 (1998).
- Cahill, H., Nathans, J. The optokinetic reflex as a tool for quantitative analyses of nervous system function in mice: application to genetic and drug-induced variation. PLoS One. 3 (4), 2055 (2008).
- Cameron, D. J., et al. The optokinetic response as a quantitative measure of visual acuity in zebrafish. Journal of Visualized Experiments. (80), 50832 (2013).
- de Jeu, M., De Zeeuw, C. I. Video-oculography in mice. Journal of Visualized Experiments. (65), e3971 (2012).
- Kodama, T., du Lac, S. Adaptive acceleration of visually evoked smooth eye movements in mice. The Journal of Neuroscience. 36 (25), 6836-6849 (2016).
- Doering, C. J., et al. Modified Ca(v)1.4 expression in the Cacna1f(nob2) mouse due to alternative splicing of an ETn inserted in exon 2. PLoS One. 3 (7), e2538 (2008).
- Shi, C., et al. Optimization of optomotor response-based visual function assessment in mice. Scientific Reports. 8 (1), 9708 (2018).
- Waldner, D. M., et al. Transgenic expression of Cacna1f rescues vision and retinal morphology in a mouse model of congenital stationary night blindness 2A (CSNB2A). Translational Vision Science & Technology. 9 (11), 19 (2020).
- Tabata, H., Shimizu, N., Wada, Y., Miura, K., Kawano, K. Initiation of the optokinetic response (OKR) in mice. Journal of Vision. 10 (1), 1-17 (2010).
- Al-Khindi, T., et al. The transcription factor Tbx5 regulates direction-selective retinal ganglion cell development and image stabilization. Current Biology. 32 (19), 4286-4298 (2022).
- Harris, S. C., Dunn, F. A. Asymmetric retinal direction tuning predicts optokinetic eye movements across stimulus conditions. eLife. 12, e81780 (2023).
- van Alphen, B., Winkelman, B. H., Frens, M. A. Three-dimensional optokinetic eye movements in the C57BL/6J mouse. Investigative Ophthalmology & Visual Science. 51 (1), 623-630 (2010).
- Stahl, J. S. Calcium channelopathy mutants and their role in ocular motor research. Annals of the New York Academy of Sciences. 956, 64-74 (2002).
- Endo, S., et al. Dual involvement of G-substrate in motor learning revealed by gene deletion. Proceedings of the National Academy of Sciences. 106 (9), 3525-3530 (2009).
- Thomas, B. B., Seiler, M. J., Sadda, S. R., Coffey, P. J., Aramant, R. B. Optokinetic test to evaluate visual acuity of each eye independently. Journal of Neuroscience Methods. 138 (1-2), 7-13 (2004).
- Burroughs, S. L., Kaja, S., Koulen, P. Quantification of deficits in spatial visual function of mouse models for glaucoma. Investigative Ophthalmology & Visual Science. 52 (6), 3654-3659 (2011).
- Wakita, R., et al. Differential regulations of vestibulo-ocular reflex and optokinetic response by β- and α2-adrenergic receptors in the cerebellar flocculus. Scientific Reports. 7 (1), 3944 (2017).
- Dehmelt, F. A., et al. Spherical arena reveals optokinetic response tuning to stimulus location, size, and frequency across entire visual field of larval zebrafish. eLife. 10, e63355 (2021).
- Magnusson, M., Pyykko, I., Jantti, V. Effect of alertness and visual attention on optokinetic nystagmus in humans. American Journal of Otolaryngology. 6 (6), 419-425 (1985).
- Collins, W. E., Schroeder, D. J., Elam, G. W. Effects of D-amphetamine and of secobarbital on optokinetic and rotation-induced nystagmus. Aviation, Space, and Environmental Medicine. 46 (4), 357-364 (1975).
- Reimer, J., et al. Pupil fluctuations track fast switching of cortical states during quiet wakefulness. Neuron. 84 (2), 355-362 (2014).
- Sakatani, T., Isa, T. PC-based high-speed video-oculography for measuring rapid eye movements in mice. Neuroscience Research. 49 (1), 123-131 (2004).
- Sakatani, T., Isa, T. Quantitative analysis of spontaneous saccade-like rapid eye movements in C57BL/6 mice. Neuroscience Research. 58 (3), 324-331 (2007).
- Vinck, M., Batista-Brito, R., Knoblich, U., Cardin, J. A. Arousal and locomotion make distinct contributions to cortical activity patterns and visual encoding. Neuron. 86 (3), 740-754 (2015).
- Bradley, M. M., Miccoli, L., Escrig, M. A., Lang, P. J. The pupil as a measure of emotional arousal and autonomic activation. Psychophysiology. 45 (4), 602-607 (2008).
- Hess, E. H., Polt, J. M. Pupil size as related to interest value of visual stimuli. Science. 132 (3423), 349-350 (1960).
- Di Stasi, L. L., Catena, A., Canas, J. J., Macknik, S. L., Martinez-Conde, S. Saccadic velocity as an arousal index in naturalistic tasks. Neuroscience and Biobehavioral Reviews. 37 (5), 968-975 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten