Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Cuantificación de la selectividad de las características visuales del reflejo optocinético en ratones
En este artículo
Resumen
A continuación, describimos un protocolo estándar para cuantificar el reflejo optocinético. Combina la estimulación virtual de tambores y la video-oculografía, y por lo tanto permite una evaluación precisa de la selectividad de las características del comportamiento y su plasticidad adaptativa.
Resumen
El reflejo optocinético (OKR) es un movimiento ocular innato esencial que se desencadena por el movimiento global del entorno visual y sirve para estabilizar las imágenes de la retina. Debido a su importancia y robustez, el OKR se ha utilizado para estudiar el aprendizaje visomotor y para evaluar las funciones visuales de ratones con diferentes antecedentes genéticos, edades y tratamientos farmacológicos. Aquí, presentamos un procedimiento para evaluar las respuestas OKR de ratones con la cabeza fija con alta precisión. La fijación de la cabeza puede descartar la contribución de la estimulación vestibular a los movimientos oculares, lo que permite medir los movimientos oculares desencadenados solo por el movimiento visual. El OKR es provocado por un sistema de tambor virtual, en el que una rejilla vertical presentada en tres monitores de computadora se desplaza horizontalmente de manera oscilatoria o unidireccional a una velocidad constante. Con este sistema de realidad virtual, podemos cambiar sistemáticamente parámetros visuales como la frecuencia espacial, la frecuencia temporal/oscilación, el contraste, la luminancia y la dirección de las rejillas, y cuantificar las curvas de sintonización de la selectividad de las características visuales. La videooculografía infrarroja de alta velocidad garantiza una medición precisa de la trayectoria de los movimientos oculares. Los ojos de ratones individuales se calibran para brindar oportunidades para comparar los OKR entre animales de diferentes edades, géneros y antecedentes genéticos. El poder cuantitativo de esta técnica le permite detectar cambios en el OKR cuando este comportamiento se adapta plásticamente debido al envejecimiento, la experiencia sensorial o el aprendizaje motor; Por lo tanto, hace que esta técnica sea una valiosa adición al repertorio de herramientas utilizadas para investigar la plasticidad de los comportamientos oculares.
Introducción
En respuesta a los estímulos visuales del entorno, nuestros ojos se mueven para desplazar la mirada, estabilizar las imágenes de la retina, rastrear objetivos en movimiento o alinear las fóveas de dos ojos con objetivos situados a diferentes distancias del observador, que son vitales para una visión adecuada 1,2. Las conductas oculomotoras han sido ampliamente utilizadas como modelos atractivos de integración sensoriomotora para comprender los circuitos neuronales en la salud y la enfermedad, al menos en parte debido a la simplicidad del sistema oculomotor3. Controlado por tres pares de músculos extraoculares, el ojo rota en la cavidad principalmente alrededor de tres ejes correspondientes: elevación y depresión a lo largo del eje transversal, aducción y abducción a lo largo del eje vertical, e intorsión y extorsión a lo largo del eje anteroposterior 1,2. Un sistema tan simple permite a los investigadores evaluar los comportamientos oculomotores de los ratones de manera fácil y precisa en un entorno de laboratorio.
Uno de los principales comportamientos oculomotores es el reflejo optocinético (OKR). Este movimiento ocular involuntario se desencadena por desplazamientos lentos o deslizamientos de imágenes en la retina y sirve para estabilizar las imágenes retinianas a medida que la cabeza de un animal o su entorno se mueven 2,4. El OKR, como paradigma conductual, es interesante para los investigadores por varias razones. En primer lugar, puede ser estimulado de forma fiable y cuantificado con precisión 5,6. En segundo lugar, los procedimientos para cuantificar este comportamiento son relativamente simples y estandarizados y pueden aplicarse para evaluar las funciones visuales de una gran cohorte de animales7. En tercer lugar, este comportamiento innato es altamente plástico 5,8,9. Su amplitud puede ser potenciada cuando se producen deslizamientos repetitivos de la retina durante mucho tiempo 5,8,9, o cuando su compañero de trabajo, el reflejo ocular vestibular (VOR), otro mecanismo de estabilización de las imágenes retinianas desencadenado por la entrada vestibular2, se ve afectado5. Estos paradigmas experimentales de potenciación de OKR permiten a los investigadores desvelar la base del circuito que subyace al aprendizaje oculomotor.
En estudios previos se han utilizado principalmente dos métodos no invasivos para evaluar el OKR: (1) video-oculografía combinada con un tambor físico 7,10,11,12,13 o (2) determinación arbitraria de los giros de cabeza combinados con un tambor virtual6,14,15,16. Aunque sus aplicaciones han hecho descubrimientos fructíferos en la comprensión de los mecanismos moleculares y de circuitos de la plasticidad oculomotora, estos dos métodos tienen algunos inconvenientes que limitan sus poderes para examinar cuantitativamente las propiedades del OKR. En primer lugar, los tambores físicos, con patrones impresos de rayas o puntos blancos y negros, no permiten cambios fáciles y rápidos de patrones visuales, lo que restringe en gran medida la medición de la dependencia del OKR de ciertas características visuales, como la frecuencia espacial, la dirección y el contraste de las rejillas móviles 8,17. En cambio, las pruebas de la selectividad del OKR a estas características visuales pueden beneficiarse de la estimulación visual computarizada, en la que las características visuales pueden modificarse convenientemente de un ensayo a otro. De esta manera, los investigadores pueden examinar sistemáticamente el comportamiento de los OKR en el espacio de parámetros visuales multidimensionales. Además, el segundo método del ensayo OKR informa solo de los umbrales de los parámetros visuales que activan los OKR discernibles, pero no de las amplitudes de los movimientos oculares o de la cabeza 6,14,15,16. Por lo tanto, la falta de potencia cuantitativa impide analizar la forma de las curvas de sintonía y las características visuales preferidas, o detectar diferencias sutiles entre ratones individuales en condiciones normales y patológicas. Para superar las limitaciones anteriores, la video-oculografía y la estimulación visual virtual computarizada se combinaron para ensayar el comportamiento de OKR en estudios recientes 5,17,18,19,20. Sin embargo, estos estudios publicados anteriormente no proporcionaron suficientes detalles técnicos o instrucciones paso a paso y, en consecuencia, sigue siendo un desafío para los investigadores establecer una prueba de OKR de este tipo para su propia investigación.
Aquí, presentamos un protocolo para cuantificar con precisión la selectividad de las características visuales del comportamiento de OKR en condiciones fotópicas o escotópicas con la combinación de video-oculografía y estimulación visual virtual computarizada. Los ratones están fijados a la cabeza para evitar el movimiento ocular evocado por la estimulación vestibular. Se utiliza una cámara de alta velocidad para registrar los movimientos oculares de los ratones que observan rejillas en movimiento con parámetros visuales cambiantes. El tamaño físico de los globos oculares de ratones individuales se calibra para garantizar la precisión de la derivación del ángulo de los movimientos oculares21. Este método cuantitativo permite comparar el comportamiento de OKR entre animales de diferentes edades o antecedentes genéticos, o monitorizar su cambio causado por tratamientos farmacológicos o aprendizaje visomotor.
Protocolo
Todos los procedimientos experimentales realizados en este estudio fueron aprobados por el Comité Local de Cuidado de Animales de Ciencias Biológicas, de acuerdo con las pautas establecidas por el Comité de Cuidado de Animales de la Universidad de Toronto y el Consejo Canadiense de Cuidado de Animales.
1. Implantación de una barra de cabeza en la parte superior del cráneo
NOTA: Para evitar la contribución del comportamiento VOR a los movimientos oculares, la cabeza del ratón se inmoviliza durante la prueba OKR. Por lo tanto, se implanta quirúrgicamente una barra de cabeza en la parte superior del cráneo.
- Anestesiar un ratón (hembra y macho de 2-5 meses de edad C57BL/6) mediante una mezcla de isoflurano (v/v) al 4% yO2 en una cámara de gas. Transfiera el ratón a una plataforma quirúrgica personalizada y reduzca la concentración de isoflurano al 1,5%-2%. Controle la profundidad de la anestesia comprobando la respuesta al pellizco de los dedos de los pies y la frecuencia respiratoria durante toda la cirugía.
- Coloque una almohadilla térmica debajo del cuerpo del animal para mantener su temperatura corporal. Aplique una capa de ungüento lubricante para los ojos en ambos ojos para protegerlos de la sequedad. Cubra los ojos con papel de aluminio para protegerlos de la iluminación ligera.
- Por vía subcutánea, inyecte carprofeno a una dosis de 20 mg/kg para reducir el dolor. Después de humedecer el pelaje con un limpiador cutáneo de gluconato de clorhexidina, afeita el pelaje de la parte superior del cráneo. Desinfecte el cuero cabelludo expuesto con alcohol isopropílico al 70% y alcohol clorhexidina dos veces.
- Inyecte bupivacaína (8 mg/kg) por vía subcutánea en el sitio de la incisión, luego retire el cuero cabelludo (~ 1 cm2) con unas tijeras para exponer la superficie dorsal del cráneo, incluido el hueso frontal posterior, el hueso parietal y el hueso interparietal.
- Aplique varias gotas de lidocaína al 1% y epinefrina 1:100.000 sobre el cráneo expuesto para reducir el dolor local y el sangrado. Raspe el cráneo con una cureta Meyhoefer para quitar la fascia y límpielo con solución salina tamponada con fosfato (PBS).
NOTA: El músculo temporal se separa del cráneo para aumentar el área de superficie para que se adhiera una barra de cabeza. - Seque el cráneo soplando suavemente aire comprimido hacia la superficie del cráneo hasta que la humedad desaparezca y el hueso se vuelva blanquecino. Aplique una capa delgada de superpegamento en la superficie expuesta del cráneo, incluido el borde del cuero cabelludo cortado, seguido de una capa de resina acrílica.
NOTA: La superficie del cráneo debe estar libre de sangre o agua antes de la aplicación de superpegamento. - Coloque una barra de acero inoxidable para la cabeza (véase la figura 1A) a lo largo de la línea media en la parte superior del cráneo. Aplique más resina acrílica, comenzando desde el borde de la barra de la cabeza hasta que la base de la barra de la cabeza esté completamente incrustada en la resina acrílica. Aplica resina acrílica dos o tres veces para aumentar el grosor.
- Espere unos 15 minutos hasta que la resina acrílica se endurezca. Por vía subcutánea, inyecte 1 ml de solución de ringer lactato. Luego, regrese el ratón a una jaula colocada en una almohadilla térmica hasta que el animal esté completamente móvil.
- Deje que el ratón se recupere en la jaula doméstica durante al menos 5 días después de la cirugía. Una vez que el animal esté en buena forma, fije su cabeza con la barra de cabeza en la configuración OKR durante 15-30 minutos para familiarizarlo con la fijación de la cabeza y el entorno experimental. Repita la familiarización una vez al día durante al menos 3 días.
2. Configuración del tambor virtual y video-oculografía
- Monte tres monitores ortogonalmente entre sí para formar un recinto cuadrado que cubra ~270° del acimut y 63° de la elevación en el espacio visual (Figura 1B izquierda).
- Con una tarjeta gráfica discreta, combine los tres monitores en una pantalla simple para garantizar la sincronización en todos los monitores.
- Calibre la luminancia de los monitores como se describe a continuación.
- Encienda el ordenador al que están conectados los monitores y espere 15 min. El calentamiento es esencial para tener una luminancia estable.
- Cambie sistemáticamente el ajuste de brillo del monitor de 0 a 100 mediante pasos de 25.
- Para cada valor de brillo, mida la luminancia de los monitores bajo varios valores de píxel (0-255, pasos de 15) con un medidor de luminancia.
- Ajuste la relación entre la luminancia y el brillo para el valor de píxel 255 con regresión lineal y estime el valor de brillo que da lugar a 160 cd/m2.
- Para cada valor de píxel utilizado en la medición de la luminancia (paso 2.3.3), estime la luminancia para el valor de brillo derivado en el paso 2.3.4 basándose en la regresión lineal. Utilice la función de potencia lum = A * pixel γ para ajustar la relación entre el nuevo conjunto de valores de luminancia (bajo el valor de brillo derivado en 2.3.4) y sus correspondientes valores de píxel para derivar el factor gamma γy el coeficiente A. Estos se utilizarán para generar rejillas sinusoidales de los valores de luminancia deseados.
- Ajuste el brillo de los tres monitores a los valores derivados en el paso 2.3.4 para asegurarse de que sus valores de luminancia sean los mismos para el mismo valor de píxel.
- Genere un tambor virtual, que se utiliza para estimular el comportamiento de OKR, con el kit de herramientas de estimulación visual, como se describe a continuación.
- Presentar una rejilla sinusoidal vertical en los monitores y ajustar el período (espaciado entre rayas) a lo largo del acimut para garantizar que la proyección de la rejilla en el ojo tenga una frecuencia espacial constante (rejilla de tambor; Figura 1B en el centro y a la derecha).
- Asegúrese de que la cabeza del animal fijada en el centro del recinto para que vea la rejilla tenga una frecuencia espacial constante en toda la superficie del tambor virtual.
- Modifique los parámetros de la rejilla en movimiento, como la amplitud oscilatoria, la frecuencia espacial, la frecuencia temporal/oscilación, la dirección, el contraste, etc., en los códigos de estimulación visual. Utilice dos tipos de movimiento visual: (1) la rejilla se desplaza en el sentido de las agujas del reloj o en sentido contrario a las agujas del reloj de manera oscilatoria siguiendo una función sinusoidal:
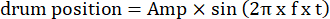
Aquí, Amp es la amplitud de la trayectoria del tambor, f es la frecuencia de oscilación y t es el tiempo (amplitud de oscilación: 5°; frecuencia espacial de la rejilla: 0,04-0,45 cpd; frecuencia de oscilación: 0,1-0,8 Hz, correspondiente a una velocidad máxima del estímulo de 3,14-25,12 °/s [velocidad del tambor = Amp x 2π x f x cos (2π x f x t); contraste: 80%-100%; luminancia media: 35-45 cd/m2; (2) la rejilla se desplaza unidireccionalmente a una velocidad constante: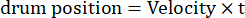
(Frecuencia espacial: 0,04-0,64 cpd; frecuencia temporal: 0,25-1 Hz; velocidad del tambor = frecuencia temporal/frecuencia espacial).
- Configure la video-oculografía como se describe a continuación.
- Para evitar el bloqueo del campo visual del animal, coloque un espejo infrarrojo (IR) a 60° de la línea media para formar una imagen del ojo derecho.
- Coloque una cámara infrarroja en el lado derecho detrás del mouse (Figura 1C izquierda) para capturar una imagen del ojo derecho.
- Monte la cámara infrarroja de alta velocidad en un brazo de cámara que permita que la cámara gire ± 10° alrededor de la imagen del ojo derecho (Figura 1C derecha).
- Utilice un fotodiodo conectado a uno de los monitores para proporcionar una señal eléctrica para sincronizar la sincronización de la videooculografía y la estimulación visual.
- Coloque cuatro diodos emisores de luz IR (LED) sostenidos por brazos de cuello de cisne alrededor del ojo derecho para proporcionar iluminación IR del ojo.
- Coloque dos LED IR en la cámara para proporcionar referencias de reflexión corneal (CR): uno está fijo sobre la cámara (X-CR), mientras que el otro está en el lado izquierdo de la cámara (Y-CR; Figura 1D).
- Mida el aumento óptico del sistema de video-oculografía con un portaobjetos de calibración.
NOTA: Los CR de referencia se utilizan para cancelar los movimientos oculares de traslación cuando el ángulo ocular se calcula en función de los movimientos oculares de rotación.
- Fije la cabeza del animal en el centro del recinto formado por los monitores, como se describe a continuación.
- Fija la cabeza del animal con la placa de la cabeza en el centro del aparejo y haz que mire hacia adelante. Ajuste la inclinación de la cabeza de modo que los ojos izquierdo y derecho estén nivelados, y las esquinas nasales y temporales de los ojos estén alineadas horizontalmente (Figura 1E).
- Mueva la cabeza del animal horizontalmente mediante el ajuste grueso proporcionado por el aparato de fijación de la cabeza y el ajuste fino proporcionado por una etapa de traslación 2D, y verticalmente a través del aparato de fijación de la cabeza y un par de soporte de poste/poste, hasta que el ojo derecho del animal aparezca en el video en vivo de la cámara. Antes de la calibración y medición de los movimientos oculares, superponga la imagen del ojo derecho del animal reflejada por el espejo caliente con el punto de pivote del brazo de la cámara (consulte los detalles en el paso 3.4 a continuación).
- Construya un recinto personalizado alrededor de la plataforma OKR para bloquear la luz de la habitación (Figura 1F).
3. Calibración de los movimientos oculares
NOTA: Los movimientos oculares rotacionales se calculan en función de los movimientos de la pupila y el radio de la órbita de los movimientos pupilares (Rp, la distancia desde el centro de la pupila hasta el centro del globo ocular). Para cada ratón individual, este radio se mide experimentalmente21.
- Fije la cabeza del animal en el centro del recinto formado por los tres monitores, como se describe en el paso 2.6.1.
- Encienda la cámara y ajuste los cuatro LED que rodean el ojo derecho para lograr una iluminación IR uniforme.
- Bajo guía visual, ajuste la posición del ojo derecho hasta que aparezca en el centro del video, como se describe en el paso 2.6.2.
- Alinee la imagen virtual del ojo derecho con el punto de pivote del brazo de la cámara, como se describe a continuación.
- Gire manualmente el brazo de la cámara hacia el extremo izquierdo (-10°). Mueva manualmente la posición del ojo derecho del animal en el plano horizontal perpendicular al eje óptico con un ajuste fino de la etapa de traslación 2D (Figura 1C, flecha verde), hasta que el X-CR esté en el centro horizontal de la imagen.
- Gire manualmente el brazo de la cámara hasta el otro extremo (+10°). Si el X-CR se aleja del centro de la imagen, mueva el ojo derecho a lo largo del eje óptico con un ajuste fino hasta que el X-CR llegue al centro (Figura 1C, flecha azul).
- Repita los pasos 3.4.1-3.4.2 varias veces hasta que la X-CR permanezca en el centro cuando el brazo de la cámara se balancee hacia la izquierda y hacia la derecha. Si el ojo derecho se mueve en medio de una repetición, reinicia el proceso de ajuste.
- Mida la distancia vertical entre el Y-CR y el X-CR después de bloquear el brazo de la cámara en la posición central. Encienda el LED Y-CR y grabe su posición en el video, y luego cambie al LED X-CR y grabe su posición.
NOTA: La distancia vertical entre el Y-CR y el X-CR se utilizará para derivar la posición del Y-CR durante la medición de los movimientos oculares en los que solo se enciende el LED X-CR. - Mida el radio de rotación de la pupila Rp, como se describe a continuación.
- Gire el brazo de la cámara hacia el extremo izquierdo (-10°) y grabe las posiciones de la pupila (Pp1) y X-CR (PCR1) en el vídeo.
- A continuación, gire el brazo de la cámara hacia el extremo derecho (+10°) y grabe las posiciones de la pupila (Pp2) y X-CR (PCR2) en el vídeo. Repita este paso varias veces.
NOTA: El ojo derecho del animal debe permanecer inmóvil durante cada repetición para que la cantidad de movimientos de la pupila en la película refleje con precisión el grado de balanceo del brazo de la cámara. - Con base en los valores registrados anteriormente, calcule el radio de rotación de la pupila Rp (Figura 2A) con la siguiente fórmula:
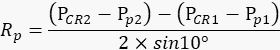
NOTA: La distancia entre el reflejo corneal y el centro de la pupila en el espacio físico se calcula en función de su distancia en la película:
PCR - Pp = número de píxeles de la película x tamaño de píxel del chip de la cámara x aumento
- Desarrollar la relación entre Rp y el diámetro de la pupila, como se describe a continuación. Rp cambia cuando la pupila se dilata o se contrae; aproximadamente, su valor es inversamente proporcional al tamaño de la pupila (Figura 2B arriba).
- Cambie la luminancia de los monitores sistemáticamente de 0 a 160 cd/m2 para regular el tamaño de la pupila.
- Para cada valor de luminancia, repita el paso 3.6 8-10 veces y registre el diámetro de la pupila.
- Aplique la regresión lineal a la relación entre Rp y el diámetro de la pupila en función de los valores medidos anteriormente para derivar la pendiente y la intersección (Figura 2B abajo).
NOTA: Los valores atípicos causados por movimientos oculares ocasionales se eliminan antes del ajuste lineal. En el caso de mediciones repetitivas en varias sesiones, la calibración debe realizarse solo una vez para un animal, a menos que su ojo crezca durante el experimento.
4. Registra los movimientos oculares del OKR
- Fije la cabeza de un mouse en la plataforma siguiendo los pasos 3.1-3.4. Omita este paso si la grabación se produce justo después de que se realice la calibración. Bloquee el brazo de la cámara en la posición central.
- Configure los monitores y el animal para OKR escotópico como se describe a continuación. Omita este paso para el OKR fotópico.
- Cubra la pantalla de cada monitor con un filtro personalizado, que está hecho de cinco capas de película de densidad neutra (ND) de 1,2. Asegúrese de que no se filtre luz a través del espacio entre el filtro y el monitor.
- Apague la luz de la habitación. Los siguientes pasos se realizan con la ayuda de unas gafas de infrarrojos.
- Aplicar una gota de solución de pilocarpina (2% en solución salina) en el ojo derecho y esperar 15 min. Asegúrese de que la gota permanezca en el ojo y no sea limpiada por el mouse. Si el animal limpia la solución, aplique otra gota de solución de pilocarpina. Esto reduce la pupila a un tamaño adecuado para el seguimiento ocular en condiciones escotópicas.
NOTA: Bajo la condición escotópica, la pupila se dilata sustancialmente de modo que su borde queda parcialmente oculto detrás del párpado. Esto afecta a la precisión de la estimación del centro de la pupila mediante video-oculografía. El encogimiento farmacológico de la pupila del ojo derecho disminuye su entrada visual y, por lo tanto, los estímulos visuales se presentan al ojo izquierdo. - Enjuague el ojo derecho con solución salina para eliminar completamente la solución de pilocarpina. Baje la cortina para sellar completamente el recinto, lo que evita que la luz parásita interfiera con la visión escotópica.
- Dale al animal 5 minutos para que se adapte completamente al entorno escotópico antes de comenzar la prueba OKR.
- Ejecute el software de estimulación visual y el software de seguimiento ocular. Para la medición de OKR fotópicos, asegúrese de que la rejilla del tambor oscile horizontalmente con una trayectoria sinusoidal; para la medición escotópica de OKR, asegúrese de que la rejilla del tambor se desplace a una velocidad constante de izquierda a derecha, que es la dirección temporonasal en referencia al ojo izquierdo.
NOTA: Cuando la pupila del ojo derecho, pero no del ojo izquierdo, es encogida por la pilocarpina en la condición escotópica, el OKR provocado por la estimulación oscilatoria del tambor es altamente asimétrico. Por lo tanto, para la medición escotópica de OKR, se estimula el ojo izquierdo mientras se monitorea el movimiento del ojo derecho. - El software de seguimiento ocular mide automáticamente el tamaño de la pupila, la posición de la RC y la posición de la pupila para cada fotograma, y calcula el ángulo de la posición de los ojos en función de la siguiente fórmula (Figura 2C):
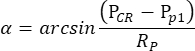
Aquí, PCR es la posición de la RC, P p es la posición de la pupila y Rp es el radio de rotación de la pupila. La distancia entre la reflexión corneal y el centro de la pupila en el espacio físico se calcula en función de su distancia en la película:
PCR - Pp = número de píxeles de la película x tamaño de píxel del chip de la cámara x aumento
Rp del tamaño de pupila correspondiente se obtiene sobre la base del modelo de regresión lineal del paso 3.7.3 (Figura 2B abajo).
5. Análisis de los movimientos oculares del OKR con el software de análisis ocular
- Procese los trazos oculares utilizando un filtro mediano (ventana de filtro = 0,05 s) para eliminar el ruido de alta frecuencia (Figura 3A en el centro).
- Retire las sacadas o el nistagmo como se describe a continuación.
- Calcule la velocidad ocular calculando la derivada de primer orden de los movimientos oculares (Figura 3A abajo). Identifique los movimientos sacádicos o nistagmo aplicando un umbral de velocidad de 50 °/s (Figura 3A abajo).
- Reemplace los movimientos sacádicos o nistagmo extrapolando las posiciones de los ojos durante estos movimientos oculares rápidos desde el segmento anterior a los movimientos sacádicos o nistagmo basado en la regresión lineal (Figura 3B).
- Calcule la amplitud de los movimientos oculares OKR mediante la transformada rápida de Fourier (algoritmo de Goertzel) si la rejilla del tambor oscila (Figura 3C), o calcule la velocidad media de los movimientos oculares durante la estimulación visual si la rejilla del tambor se mueve a una velocidad constante en una dirección (Figura 3B abajo).
NOTA: La amplitud de los movimientos oculares oscilatorios derivados de la transformada de Fourier es similar a la amplitud derivada del ajuste de la trayectoria ocular con una función sinusoidal (Figura 3D). - Calcule la ganancia de OKR. Para el movimiento oscilatorio del tambor, la ganancia OKR se define como la relación entre la amplitud de los movimientos oculares y la amplitud de los movimientos del tambor (Figura 3C derecha). Para el movimiento unidireccional del tambor, la ganancia OKR se define como la relación entre la velocidad del ojo y la velocidad de la rejilla del tambor (Figura 3B abajo).
Resultados
Con el procedimiento detallado anteriormente, evaluamos la dependencia del OKR de varias características visuales. Los seguimientos de ejemplo que se muestran aquí se derivaron utilizando los códigos de análisis proporcionados en el archivo de codificación suplementario 1, y el archivo sin procesar de seguimiento de ejemplo se puede encontrar en el archivo de codificación suplementaria 2. Cuando la rejilla del tambor se desvió en una trayectoria sinusoidal (0,4 Hz), el ojo del ani...
Discusión
El método del ensayo de comportamiento OKR que se presenta aquí ofrece varias ventajas. En primer lugar, la estimulación visual generada por ordenador resuelve los problemas intrínsecos de los tambores físicos. Teniendo en cuenta el problema de que los tambores físicos no admiten el examen sistemático de la frecuencia espacial, la dirección o la sintonización del contraste8, el tambor virtual permite cambiar estos parámetros visuales ensayo por ensayo, lo que facilita un análisis sistem...
Divulgaciones
Los autores declaran no tener intereses contrapuestos.
Agradecimientos
Estamos agradecidos a Yingtian He por compartir datos de ajuste de dirección. Este trabajo contó con el apoyo de subvenciones de la Fundación Canadiense de Innovación y el Fondo de Investigación de Ontario (proyecto CFI/ORF n.º 37597), NSERC (RGPIN-2019-06479), CIHR (Project Grant 437007) y Connaught New Researcher Awards.
Materiales
| Name | Company | Catalog Number | Comments |
| 2D translational stage | Thorlabs | XYT1 | |
| Acrylic resin | Lang Dental | B1356 | For fixing headplate on skull and protecting skull |
| Bupivacaine | STERIMAX | ST-BX223 | Bupivacaine Injection BP 0.5%. Local anesthesia |
| Carprofen | RIMADYL | 8507-14-1 | Analgesia |
| Compressed air | Dust-Off | ||
| Eye ointment | Alcon | Systane | For maintaining moisture of eyes |
| Graphic card | NVIDIA | Geforce GTX 1650 or Quadro P620. | For generating single screen among three monitors |
| Heating pad | Kent Scientific | HTP-1500 | For maintaining body temperature |
| High-speed infrared (IR) camera | Teledyne Dalsa | G3-GM12-M0640 | For recording eye rotation |
| IR LED | Digikey | PDI-E803-ND | For CR reference and the illumination of the eye |
| IR mirror | Edmund optics | 64-471 | For reflecting image of eye |
| Isoflurane | FRESENIUS KABI | CP0406V2 | |
| Labview | National instruments | version 2014 | eye tracking |
| Lactated ringer | BAXTER | JB2324 | Water and energy supply |
| Lidocaine and epinephrine mix | Dentsply Sirona | 82215-1 | XYLOCAINE. Local anesthesia |
| Luminance Meter | Konica Minolta | LS-150 | for calibration of monitors |
| Matlab | MathWorks | version xxx | analysis of eye movements |
| Meyhoefer Curette | World Precision Instruments | 501773 | For scraping skull and removing fascia |
| Microscope calibration slide | Amscope | MR095 | to measure the magnification of video-oculography |
| Monitors | Acer | B247W | Visual stimulation |
| Neutral density filter | Lee filters | 299 | to generate scotopic visual stimulation |
| Nigh vision goggle | Alpha optics | AO-3277 | for scotopic OKR |
| Photodiode | Digikey | TSL254-R-LF-ND | to synchronize visual stimulation and video-oculography |
| Pilocarpine hydrochloride | Sigma-Aldrich | P6503 | |
| Post | Thorlabs | TR1.5 | |
| Post holder | Thorlabs | PH1 | |
| PsychoPy | open source software | version xxx | visual stimulation toolkit |
| Scissor | RWD | S12003-09 | For skin removal |
| Superglue | Krazy Glue | Type: All purpose. For adhering headplate on the skull |
Referencias
- Gerhard, D. Neuroscience. 5th Edition. Yale Journal of Biology and Medicine. , (2013).
- Distler, C., Hoffmann, K. P. . The Oxford Handbook of Eye Movement. , 65-83 (2011).
- Sereno, A. B., Bolding, M. S. . Executive Functions: Eye Movements and Human Neurological Disorders. , (2017).
- Giolli, R. A., Blanks, R. H. I., Lui, F. The accessory optic system: basic organization with an update on connectivity, neurochemistry, and function. Progress in Brain Research. 151, 407-440 (2006).
- Liu, B. H., Huberman, A. D., Scanziani, M. Cortico-fugal output from visual cortex promotes plasticity of innate motor behaviour. Nature. 538 (7625), 383-387 (2016).
- Prusky, G. T., Alam, N. M., Beekman, S., Douglas, R. M. Rapid quantification of adult and developing mouse spatial vision using a virtual optomotor system. Investigative Ophthalmology & Visual Science. 45 (12), 4611-4616 (2004).
- Stahl, J. S., van Alphen, A. M., De Zeeuw, C. I. A comparison of video and magnetic search coil recordings of mouse eye movements. Journal of Neuroscience Methods. 99 (1-2), 101-110 (2000).
- Faulstich, B. M., Onori, K. A., du Lac, S. Comparison of plasticity and development of mouse optokinetic and vestibulo-ocular reflexes suggests differential gain control mechanisms. Vision Research. 44 (28), 3419-3427 (2004).
- Katoh, A., Kitazawa, H., Itohara, S., Nagao, S. Dynamic characteristics and adaptability of mouse vestibulo-ocular and optokinetic response eye movements and the role of the flocculo-olivary system revealed by chemical lesions. Proceedings of the National Academy of Sciences. 95 (13), 7705-7710 (1998).
- Cahill, H., Nathans, J. The optokinetic reflex as a tool for quantitative analyses of nervous system function in mice: application to genetic and drug-induced variation. PLoS One. 3 (4), 2055 (2008).
- Cameron, D. J., et al. The optokinetic response as a quantitative measure of visual acuity in zebrafish. Journal of Visualized Experiments. (80), 50832 (2013).
- de Jeu, M., De Zeeuw, C. I. Video-oculography in mice. Journal of Visualized Experiments. (65), e3971 (2012).
- Kodama, T., du Lac, S. Adaptive acceleration of visually evoked smooth eye movements in mice. The Journal of Neuroscience. 36 (25), 6836-6849 (2016).
- Doering, C. J., et al. Modified Ca(v)1.4 expression in the Cacna1f(nob2) mouse due to alternative splicing of an ETn inserted in exon 2. PLoS One. 3 (7), e2538 (2008).
- Shi, C., et al. Optimization of optomotor response-based visual function assessment in mice. Scientific Reports. 8 (1), 9708 (2018).
- Waldner, D. M., et al. Transgenic expression of Cacna1f rescues vision and retinal morphology in a mouse model of congenital stationary night blindness 2A (CSNB2A). Translational Vision Science & Technology. 9 (11), 19 (2020).
- Tabata, H., Shimizu, N., Wada, Y., Miura, K., Kawano, K. Initiation of the optokinetic response (OKR) in mice. Journal of Vision. 10 (1), 1-17 (2010).
- Al-Khindi, T., et al. The transcription factor Tbx5 regulates direction-selective retinal ganglion cell development and image stabilization. Current Biology. 32 (19), 4286-4298 (2022).
- Harris, S. C., Dunn, F. A. Asymmetric retinal direction tuning predicts optokinetic eye movements across stimulus conditions. eLife. 12, e81780 (2023).
- van Alphen, B., Winkelman, B. H., Frens, M. A. Three-dimensional optokinetic eye movements in the C57BL/6J mouse. Investigative Ophthalmology & Visual Science. 51 (1), 623-630 (2010).
- Stahl, J. S. Calcium channelopathy mutants and their role in ocular motor research. Annals of the New York Academy of Sciences. 956, 64-74 (2002).
- Endo, S., et al. Dual involvement of G-substrate in motor learning revealed by gene deletion. Proceedings of the National Academy of Sciences. 106 (9), 3525-3530 (2009).
- Thomas, B. B., Seiler, M. J., Sadda, S. R., Coffey, P. J., Aramant, R. B. Optokinetic test to evaluate visual acuity of each eye independently. Journal of Neuroscience Methods. 138 (1-2), 7-13 (2004).
- Burroughs, S. L., Kaja, S., Koulen, P. Quantification of deficits in spatial visual function of mouse models for glaucoma. Investigative Ophthalmology & Visual Science. 52 (6), 3654-3659 (2011).
- Wakita, R., et al. Differential regulations of vestibulo-ocular reflex and optokinetic response by β- and α2-adrenergic receptors in the cerebellar flocculus. Scientific Reports. 7 (1), 3944 (2017).
- Dehmelt, F. A., et al. Spherical arena reveals optokinetic response tuning to stimulus location, size, and frequency across entire visual field of larval zebrafish. eLife. 10, e63355 (2021).
- Magnusson, M., Pyykko, I., Jantti, V. Effect of alertness and visual attention on optokinetic nystagmus in humans. American Journal of Otolaryngology. 6 (6), 419-425 (1985).
- Collins, W. E., Schroeder, D. J., Elam, G. W. Effects of D-amphetamine and of secobarbital on optokinetic and rotation-induced nystagmus. Aviation, Space, and Environmental Medicine. 46 (4), 357-364 (1975).
- Reimer, J., et al. Pupil fluctuations track fast switching of cortical states during quiet wakefulness. Neuron. 84 (2), 355-362 (2014).
- Sakatani, T., Isa, T. PC-based high-speed video-oculography for measuring rapid eye movements in mice. Neuroscience Research. 49 (1), 123-131 (2004).
- Sakatani, T., Isa, T. Quantitative analysis of spontaneous saccade-like rapid eye movements in C57BL/6 mice. Neuroscience Research. 58 (3), 324-331 (2007).
- Vinck, M., Batista-Brito, R., Knoblich, U., Cardin, J. A. Arousal and locomotion make distinct contributions to cortical activity patterns and visual encoding. Neuron. 86 (3), 740-754 (2015).
- Bradley, M. M., Miccoli, L., Escrig, M. A., Lang, P. J. The pupil as a measure of emotional arousal and autonomic activation. Psychophysiology. 45 (4), 602-607 (2008).
- Hess, E. H., Polt, J. M. Pupil size as related to interest value of visual stimuli. Science. 132 (3423), 349-350 (1960).
- Di Stasi, L. L., Catena, A., Canas, J. J., Macknik, S. L., Martinez-Conde, S. Saccadic velocity as an arousal index in naturalistic tasks. Neuroscience and Biobehavioral Reviews. 37 (5), 968-975 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados