A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
כימות סלקטיביות תכונות חזותיות של רפלקס האופטוקינטי בעכברים
In This Article
Summary
במאמר זה אנו מתארים פרוטוקול סטנדרטי לכימות הרפלקס האופטוקינטי. הוא משלב גירוי תוף וירטואלי ווידאו-אוקולוגרפיה, ובכך מאפשר הערכה מדויקת של סלקטיביות התכונה של ההתנהגות והפלסטיות האדפטיבית שלה.
Abstract
הרפלקס האופטוקינטי (OKR) הוא תנועת עיניים מולדת חיונית המופעלת על ידי התנועה הגלובלית של הסביבה החזותית ומשמשת לייצוב תמונות רשתית. בשל חשיבותו וחוסנו, ה-OKR שימש לחקר למידה חזותית-מוטורית ולהערכת תפקודי הראייה של עכברים בעלי רקע גנטי שונה, גילאים שונים וטיפולים תרופתיים. כאן, אנו מציגים הליך להערכת תגובות OKR של עכברים קבועים ראש עם דיוק גבוה. קיבוע ראש יכול לשלול את תרומת הגירוי הווסטיבולרי על תנועות העיניים, מה שמאפשר למדוד תנועות עיניים המופעלות רק על ידי תנועה חזותית. ה-OKR מופעל על ידי מערכת תופים וירטואלית, שבה סורג אנכי המוצג על שלושה צגי מחשב נסחף אופקית באופן תנודתי או חד-כיווני במהירות קבועה. באמצעות מערכת מציאות מדומה זו, אנו יכולים לשנות באופן שיטתי פרמטרים חזותיים כמו תדר מרחבי, תדר טמפורלי/תנודה, ניגודיות, בהיקות וכיוון הגרגים, ולכמת עקומות כוונון של סלקטיביות תכונות חזותיות. וידאו-אוקוקולוגרפיה אינפרא אדום במהירות גבוהה מבטיחה מדידה מדויקת של מסלול תנועות העיניים. עיניהם של עכברים בודדים מכוילים כדי לספק הזדמנויות להשוות את ה-OKR בין בעלי חיים בגילאים, מינים שונים ומרקעים גנטיים שונים. כוחה הכמותי של טכניקה זו מאפשר לה לזהות שינויים ב- OKR כאשר התנהגות זו מסתגלת באופן פלסטי עקב הזדקנות, חוויה חושית או למידה מוטורית; לפיכך, היא הופכת טכניקה זו לתוספת רבת ערך לרפרטואר הכלים המשמשים לחקר הפלסטיות של התנהגויות עיניות.
Introduction
בתגובה לגירויים חזותיים בסביבה, העיניים שלנו נעות כדי להסיט את מבטנו, לייצב תמונות רשתית, לעקוב אחר מטרות נעות, או ליישר את הגומות של שתי עיניים עם מטרות הממוקמות במרחקים שונים מהצופה, שהן חיוניות לראייה תקינה 1,2. התנהגויות אוקולומוטוריות שימשו באופן נרחב כמודלים אטרקטיביים של אינטגרציה סנסומוטורית להבנת המעגלים העצביים בבריאות ובחולי, לפחות חלקית בגלל הפשטות של המערכת האוקולומוטורית3. נשלטת על ידי שלושה זוגות של שרירים חוץ-עיניים, העין מסתובבת בשקע בעיקר סביב שלושה צירים תואמים: הגבהה ודיכאון לאורך הציר הרוחבי, חטיפה וחטיפה לאורך הציר האנכי, וחדירה ושחול לאורך הציר הקדמי 1,2. מערכת פשוטה כזו מאפשרת לחוקרים להעריך את ההתנהגויות האוקולומוטוריות של עכברים בקלות ובדייקנות בסביבת מעבדה.
התנהגות אוקולומוטורית עיקרית אחת היא רפלקס אופטוקינטי (OKR). תנועת עיניים לא רצונית זו מופעלת על ידי סחף איטי או החלקות של תמונות על הרשתית ומשמשת לייצוב תמונות הרשתית כאשר ראשו של בעל חיים או סביבתו נעים 2,4. ה-OKR, כפרדיגמה התנהגותית, מעניינת את החוקרים מכמה סיבות. ראשית, ניתן לגרות אותו באופן אמין ולכמת אותו במדויק 5,6. שנית, ההליכים לכימות התנהגות זו הם פשוטים יחסית וסטנדרטיים וניתן ליישם אותם כדי להעריך את הפונקציות החזותיות של קבוצה גדולה של בעלי חיים7. שלישית, התנהגות מולדת זו היא פלסטית מאוד 5,8,9. המשרעת שלו יכולה להיות מוגברת כאשר החלקות רשתית חוזרות ונשנות מתרחשות במשך זמן רב 5,8,9, או כאשר שותפו לעבודה רפלקס עיני שיווי משקל (VOR), מנגנון נוסף של ייצוב תמונות רשתית המופעלות על ידי קלט שיווי משקל2, נפגע5. פרדיגמות ניסיוניות אלה של הגברה OKR מאפשרות לחוקרים לחשוף את הבסיס המעגלי העומד בבסיס הלמידה האוקולומוטורית.
שתי שיטות לא פולשניות שימשו בעיקר להערכת OKR במחקרים קודמים: (1) וידאו-אוקוקולוגרפיה בשילוב עם תוף פיזי 7,10,11,12,13 או (2) קביעה שרירותית של סיבובי ראש בשילוב עם תוף וירטואלי6,14,15,16. למרות שהיישומים שלהם הניבו תגליות פוריות בהבנת המנגנונים המולקולריים והמעגליים של פלסטיות אוקולומוטורית, לכל שתי שיטות אלה יש כמה חסרונות המגבילים את כוחן בבחינה כמותית של תכונות ה-OKR. ראשית, תופים פיזיים, עם תבניות מודפסות של פסים או נקודות בשחור לבן, אינם מאפשרים שינויים קלים ומהירים של תבניות חזותיות, מה שמגביל במידה רבה את מדידת התלות של ה- OKR בתכונות חזותיות מסוימות, כגון תדירות מרחבית, כיוון וניגודיות של גרגרים נעים 8,17. במקום זאת, בדיקות של הסלקטיביות של OKR לתכונות חזותיות אלה יכולות להפיק תועלת מגירוי חזותי ממוחשב, שבו ניתן לשנות בנוחות תכונות חזותיות מניסוי לניסוי. בדרך זו, חוקרים יכולים לבחון באופן שיטתי את התנהגות OKR במרחב הפרמטרים החזותיים הרב-ממדיים. יתר על כן, השיטה השנייה של בדיקת OKR מדווחת רק על ערכי הסף של פרמטרים חזותיים המפעילים OKR שניתן להבחין בהם, אך לא על המשרעת של תנועות עיניים או ראש 6,14,15,16. היעדר כוח כמותי מונע אפוא ניתוח צורת עקומות הכוונון ותכונות הראייה המועדפות, או איתור הבדלים עדינים בין עכברים בודדים בתנאים נורמליים ופתולוגיים. כדי להתגבר על המגבלות הנ"ל, וידאו-אוקולוגרפיה וגירוי חזותי וירטואלי ממוחשב שולבו כדי להעריך את התנהגות OKR במחקרים אחרונים 5,17,18,19,20. עם זאת, מחקרים אלה שפורסמו בעבר לא סיפקו מספיק פרטים טכניים או הוראות שלב אחר שלב, וכתוצאה מכך זה עדיין מאתגר עבור חוקרים להקים מבחן OKR כזה עבור המחקר שלהם.
כאן, אנו מציגים פרוטוקול לכימות מדויק של סלקטיביות התכונות החזותיות של התנהגות OKR בתנאים פוטופיקליים או סקוטופיים עם שילוב של וידאו-אוקוקולוגרפיה וגירוי חזותי וירטואלי ממוחשב. עכברים מקובעים בראשם כדי למנוע את תנועת העיניים המתעוררת על ידי גירוי שיווי משקל. מצלמה במהירות גבוהה משמשת לתיעוד תנועות העין מעכברים הצופים בגרגרים נעים עם פרמטרים חזותיים משתנים. הגודל הפיזי של גלגלי העיניים של עכברים בודדים מכויל כדי להבטיח את הדיוק של גזירת זווית תנועות העיניים21. שיטה כמותית זו מאפשרת להשוות התנהגות OKR בין בעלי חיים בגילאים שונים או מרקעים גנטיים שונים, או לעקוב אחר השינוי שלה הנגרם על ידי טיפולים תרופתיים או למידה חזותית-מוטורית.
Protocol
כל ההליכים הניסיוניים שבוצעו במחקר זה אושרו על ידי הוועדה המקומית לטיפול בבעלי חיים של מדעי הביולוגיה, בהתאם להנחיות שנקבעו על ידי הוועדה לטיפול בבעלי חיים באוניברסיטת טורונטו והמועצה הקנדית לטיפול בבעלי חיים.
1. השתלת מוט ראש על גבי הגולגולת
הערה: כדי למנוע את התרומה של התנהגות VOR לתנועות העיניים, ראש העכבר משותק במהלך מבחן OKR. לכן, מוט ראש מושתל בניתוח על גבי הגולגולת.
- מרדימים עכבר (נקבה בת 2-5 חודשים וזכר C57BL/6) על ידי תערובת של 4% איזופלורן (v/v) ו-O2 בתא גזים. מעבירים את העכבר לפלטפורמת ניתוח מותאמת אישית ומפחיתים את ריכוז האיזופלורן ל-1.5%-2%. עקוב אחר עומק ההרדמה על ידי בדיקת תגובת צביטת הבוהן וקצב הנשימה לאורך כל הניתוח.
- הניחו כרית חימום מתחת לגוף החיה כדי לשמור על טמפרטורת הגוף שלה. יש למרוח שכבה של משחת עיניים סיכה על שתי העיניים כדי להגן עליהן מפני ייבוש. כסו את העיניים ברדיד אלומיניום כדי להגן עליהן מפני תאורת אור.
- תת עורית להזריק carprofen במינון של 20 מ"ג / ק"ג כדי להפחית את הכאב. לאחר הרטבת הפרווה עם chlorhexidine gluconate העור ניקונה, לגלח את הפרווה על גבי הגולגולת. יש לחטא את הקרקפת החשופה עם 70% אלכוהול איזופרופיל וכלורהקסידין פעמיים.
- יש להזריק bupivacaine (8 מ"ג/ק"ג) תת עורית במקום החתך, ולאחר מכן להסיר את הקרקפת (~ 1 ס"מ2) עם מספריים כדי לחשוף את פני השטח הגביים של הגולגולת, כולל העצם המצחית האחורית, העצם הקודקודית והעצם הבין-קודקודית.
- יש למרוח מספר טיפות של 1% לידוקאין ו-1:100,000 אפינפרין על הגולגולת החשופה כדי להפחית כאב ודימום מקומיים. גרדו את הגולגולת עם קורט Meyhoefer כדי להסיר את הפאשיה ונקו אותה במי מלח חוצצים פוספט (PBS).
הערה: שריר הטמפורליס מופרד מהגולגולת כדי להגדיל את שטח הפנים לחיבור מוט ראש. - יבש את הגולגולת על ידי נשיפה עדינה של אוויר דחוס לכיוון פני הגולגולת עד שהלחות נעלמת והעצם הופכת לבנבנה. יש למרוח שכבה דקה של דבק-על על פני השטח החשופים של הגולגולת, כולל קצה הקרקפת החתוכה, ולאחר מכן שכבה של שרף אקרילי.
הערה: פני השטח של הגולגולת צריכים להיות נקיים מדם או מים לפני מריחת דבק-על. - הניחו מוט ראש מפלדת אל-חלד (ראו איור 1A) לאורך קו האמצע מעל הגולגולת. יש למרוח יותר שרף אקרילי, החל מקצה מוט הראש עד שבסיס מוט הראש מוטמע לחלוטין בשרף האקרילי. מרחו שרף אקרילי פעמיים או שלוש כדי לבנות את העובי.
- ממתינים כרבע שעה עד שהשרף האקרילי מתקשה. תת עורית להזריק 1 מ"ל של פתרון רינגר הנקה. לאחר מכן, החזירו את העכבר לכלוב המונח על כרית חימום עד שהחיה ניידת לחלוטין.
- לאפשר לעכבר להתאושש בכלוב הביתי לפחות 5 ימים לאחר הניתוח. ברגע שבעל החיים במצב טוב, קבע את ראשו עם מוט הראש במערך OKR למשך 15-30 דקות כדי להכיר את קיבוע הראש ואת סביבת הניסוי. חזור על ההיכרות פעם ביום במשך 3 ימים לפחות.
2. הגדרת התוף הווירטואלי ווידאו-אוקולוגרפיה
- הרכיבו שלושה צגים באופן אורתוגונלי זה לזה כדי ליצור מארז מרובע שמכסה ~270° של האזימוט ו-63° של הגובה במרחב הראייה (איור 1B משמאל).
- באמצעות כרטיס גרפי נפרד, מזג את שלושת הצגים לצג פשוט כדי להבטיח סנכרון בין כל הצגים.
- כייל את הבהיקות של צגים כמתואר להלן.
- הפעל את המחשב שאליו מחוברים הצגים והמתן 15 דקות. החימום חיוני כדי לקבל בהיקות יציבה.
- שנה באופן שיטתי את הגדרת הבהירות בצג מ- 0 ל- 100 בשלבים של 25.
- עבור כל ערך בהירות, מדוד את בהיקות הצגים תחת ערכי פיקסלים שונים (0-255, שלבים של 15) באמצעות מד בהיקות.
- התאם את הקשר בין בהיקות ובהירות עבור ערך פיקסל 255 עם רגרסיה ליניארית והערך את ערך הבהירות המוליד 160 cd/m2.
- עבור כל ערך פיקסל המשמש במדידת הזוהר (שלב 2.3.3), הערך את הזוהר עבור ערך הבהירות הנגזר בשלב 2.3.4 בהתבסס על רגרסיה ליניארית. השתמש בפונקצייתההספק lum = A * pixel γ כדי להתאים את הקשר בין קבוצת ערכי הזוהר החדשה (תחת ערך הבהירות הנגזר ב- 2.3.4) לבין ערכי הפיקסלים המתאימים להם כדי לגזור את גורם הגמא γ ואת מקדם A. אלה ישמשו ליצירת גרגרים סינוסואידים של ערכי הארה רצויים.
- הגדר את הבהירות של כל שלושת הצגים לערכים הנגזרים בשלב 2.3.4 כדי להבטיח שערכי הזוהר שלהם יהיו זהים עבור אותו ערך פיקסל.
- צור תוף וירטואלי, המשמש לגירוי התנהגות OKR, עם ערכת הכלים לגירוי חזותי, כמתואר להלן.
- הציגו סורג סינוסואידלי אנכי על הצגים והתאימו את התקופה (מרווח בין פסים) לאורך האזימוט כדי להבטיח שההקרנה של הסורג על העין תהיה בעלת תדירות מרחבית קבועה (סורג תוף; איור 1B באמצע ומימין).
- ודא שראשו של בעל החיים קבוע במרכז המתחם כך שהוא רואה שלסורג יש תדר מרחבי קבוע על פני השטח של התוף הווירטואלי.
- שנה את הפרמטרים של הסורג הנע, כגון משרעת תנודה, תדירות מרחבית, תדירות טמפורלית/תנודה, כיוון, ניגודיות וכו ', בקודים לגירוי חזותי. השתמש בשני סוגים של תנועה חזותית: (1) הסורג נסחף בכיוון השעון או נגד כיוון השעון באופן תנודתי בעקבות פונקציה סינוסואידית:
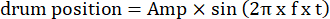
כאן, אמפר הוא המשרעת של מסלול התוף, f הוא תדירות התנודה, ו-t הוא הזמן (משרעת תנודה: 5°; תדר מרחב סורג: 0.04-0.45 cpd; תדירות תנודה: 0.1-0.8 הרץ, המתאימה למהירות שיא של הגירוי של 3.14-25.12 °/s [מהירות תוף = Amp x 2π x f x cos (2π x f x t); ניגודיות: 80%-100%; בהיקות ממוצעת: 35-45 cd/m2; (2) הסורג נסחף באופן חד-כיווני במהירות קבועה: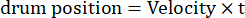
(תדר מרחבי: 0.04-0.64 cpd; תדר זמני: 0.25-1 הרץ; מהירות תוף = תדר זמני/תדר מרחבי).
- הגדר את וידאו-oculography כמתואר להלן.
- כדי למנוע חסימה של שדה הראייה של החיה, מקמו מראה אינפרא אדום (IR) 60° מקו האמצע כדי ליצור תמונה של עין ימין.
- מקם מצלמת אינפרא-אדום בצד ימין מאחורי העכבר (איור 1C משמאל) כדי לצלם תמונה של עין ימין.
- הרכיבו את מצלמת האינפרא-אדום במהירות גבוהה על זרוע מצלמה המאפשרת למצלמה להסתובב ב-10° ± סביב התמונה של עין ימין (איור 1C מימין).
- השתמש בפוטודיודה המחוברת לאחד הצגים כדי לספק אות חשמלי לסנכרון התזמון של וידאו-אוקוקולוגרפיה וגירוי חזותי.
- מקם ארבע דיודות פולטות אור IR (LED) הנתמכות על ידי זרועות צוואר ברווז סביב עין ימין כדי לספק הארת IR של העין.
- מקם שתי נוריות IR על המצלמה כדי לספק הפניות להחזר הקרנית (CR): אחת קבועה מעל המצלמה (X-CR), ואילו השנייה נמצאת בצד שמאל של המצלמה (Y-CR; איור 1D).
- מדוד את ההגדלה האופטית של מערכת וידאו-אוקוקולוגרפיה באמצעות שקופית כיול.
הערה: CRs הייחוס משמשים לביטול תנועות העיניים התרגומי כאשר זווית העין מחושבת בהתבסס על תנועות העיניים הסיבוביות.
- קבע את ראשו של בעל החיים במרכז המתחם שנוצר על ידי הצגים, כמתואר להלן.
- קבע את ראשו של בעל החיים עם לוחית הראש למרכז האסדה והפוך אותו עם הפנים קדימה. התאימו את הטיית הראש כך שהעיניים השמאלית והימנית יהיו מפולסות, וזוויות האף והרקתי של העיניים מיושרות אופקית (איור 1E).
- הזיזו את ראש החיה אופקית על ידי כוונון גס המסופק על ידי מנגנון קיבוע הראש וכוונון עדין המסופק על ידי שלב תרגום דו-ממדי, ואנכית דרך מנגנון קיבוע הראש וזוג מחזיק פוסט/עמוד, עד שעינו הימנית של החיה תופיע בסרטון החי של המצלמה. לפני הכיול והמדידה של תנועות העיניים, שכבו את תמונת עין ימין של בעל החיים המשתקף על ידי המראה החמה עם נקודת הציר של זרוע המצלמה (ראו פרטים בשלב 3.4 להלן).
- בנו מארז מותאם אישית סביב מתקן OKR כדי לחסום את תאורת החדר (איור 1F).
3. כיול תנועות העיניים
הערה: תנועות עיניים סיבוביות מחושבות על בסיס תנועות האישון ורדיוס מסלול תנועות האישונים (Rp, המרחק ממרכז האישון למרכז גלגל העין). עבור כל עכבר בודד, רדיוס זה נמדד באופן ניסיוני21.
- קבע את ראשו של בעל החיים במרכז המתחם שנוצר על ידי שלושת הצגים, כמתואר בשלב 2.6.1.
- הפעל את המצלמה וכוונן את ארבע נוריות ה- LED המקיפות את עין ימין כדי להשיג תאורת IR אחידה.
- תחת הנחיה חזותית, התאם את מיקום עין ימין עד שתופיע במרכז הסרטון, כמתואר בשלב 2.6.2.
- ישר את התמונה הווירטואלית של עין ימין עם נקודת הציר של זרוע המצלמה, כמתואר להלן.
- סובב ידנית את זרוע המצלמה לקצה השמאלי הקיצוני ( -10°). הזיזו ידנית את מיקום העין הימנית של החיה במישור האופקי בניצב לציר האופטי עם התאמה עדינה של שלב התרגום הדו-ממדי (איור 1C, חץ ירוק), עד שה-X-CR יגיע למרכז האופקי של התמונה.
- סובב ידנית את זרוע המצלמה לקצה השני (+10°). אם ה-X-CR בורח ממרכז התמונה, הזיזו את עין ימין לאורך הציר האופטי בכוונון עדין עד שה-X-CR יגיע למרכז (איור 1C, חץ כחול).
- חזור על שלבים 3.4.1-3.4.2 מספר פעמים עד שה-X-CR נשאר במרכז כאשר זרוע המצלמה מתנדנדת שמאלה וימינה. אם עין ימין זזה באמצע חזרה אחת, הפעל מחדש את תהליך ההסתגלות.
- מדוד את המרחק האנכי בין Y-CR ל-X-CR לאחר נעילת זרוע המצלמה במיקום המרכזי. הפעל את נורית ה- Y-CR LED והקלט את מיקומה בסרטון ולאחר מכן עבור ל- X-CR LED והקלט את מיקומה.
הערה: המרחק האנכי בין ה-Y-CR ל-X-CR ישמש כדי לגזור את המיקום של ה-Y-CR במהלך מדידת תנועות עיניים שבהן רק נורית ה-X-CR LED מופעלת. - מדוד את רדיוס סיבוב האישון Rp, כמתואר להלן.
- סובב את זרוע המצלמה לקצה השמאלי ( -10°) והקלט את מיקומי האישון (Pp1) ו- X-CR (PCR1) בסרטון.
- לאחר מכן, סובב את זרוע המצלמה לקצה הימני (+10°) והקלט את מיקומי האישון (Pp2) ו- X-CR (PCR2) בסרטון. חזור על שלב זה מספר פעמים.
הערה: עינו הימנית של בעל החיים צריכה להישאר נייחת במהלך כל חזרה, כך שכמות תנועות האישונים בסרט משקפת במדויק את מידת הנפת זרוע המצלמה. - בהתבסס על הערכים שנרשמו לעיל, חשב את רדיוס סיבוב האישון Rp (איור 2A) באמצעות הנוסחה הבאה:
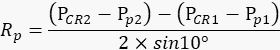
הערה: המרחק בין השתקפות הקרנית למרכז האישון במרחב הפיזי מחושב על סמך המרחק שלהם בסרט:
PCR - Pp = מספר הפיקסלים בסרט x גודל פיקסלים של שבב מצלמה x הגדלה
- לפתח את הקשר בין Rp וקוטר האישון, כמתואר להלן. Rp משתנה כאשר התלמיד מתרחב או מתכווץ; באופן קרוב, ערכו עומד ביחס הפוך לגודל האישון (איור 2B למעלה).
- שנה את הבהיקות של הצגים באופן שיטתי מ- 0 ל- 160 cd/m2 כדי לווסת את גודל האישון.
- עבור כל ערך זוהר, חזור על שלב 3.6 8-10 פעמים ורשום את קוטר האישון.
- החילו רגרסיה ליניארית על הקשר בין Rp לקוטר האישון בהתבסס על הערכים שנמדדו לעיל כדי לגזור את השיפוע והיירוט (איור 2B למטה).
הערה: החריגים הנגרמים על ידי תנועות עיניים מזדמנות מוסרים לפני ההתאמה הליניארית. עבור מדידות חוזרות במספר הפעלות, הכיול צריך להיעשות רק פעם אחת עבור חיה אחת, אלא אם כן העין שלה גדלה במהלך הניסוי.
4. הקלט תנועות עיניים של OKR
- תקן ראש עכבר במחשב לפי שלבים 3.1-3.4. דלג על שלב זה אם ההקלטה מתרחשת מיד לאחר סיום הכיול. נעל את זרוע המצלמה במיקום המרכזי.
- הגדר את הצגים ואת בעל החיים עבור OKR סקוטופי כמתואר להלן. דלג על שלב זה עבור OKR תמונה.
- כסה את המסך של כל צג במסנן מותאם אישית, המורכב מחמש שכבות של סרט בעל צפיפות נייטרלית (ND) של 1.2. ודא שאף נורית לא דולפת החוצה דרך הרווח בין המסנן לצג.
- כבו את האור בחדר. השלבים הבאים נעשים בעזרת משקפת IR.
- יש למרוח טיפה אחת של תמיסת פילוקרפין (2% במי מלח) על עין ימין ולהמתין 15 דקות. ודא שהטיפה נשארת על העין ולא נמחקת על ידי העכבר. אם התמיסה נמחקת על ידי החיה, להחיל טיפה נוספת של פתרון pilocarpine. זה מכווץ את האישון לגודל מתאים למעקב עיניים במצב סקוטופי.
הערה: במצב סקוטופי, האישון מתרחב באופן משמעותי כך שהקצה שלו מוסתר חלקית מאחורי העפעף. זה משפיע על הדיוק של הערכת מרכז התלמיד על ידי וידאו-oculography. כיווץ פרמקולוגי של אישון עין ימין מפחית את הקלט החזותי שלו, וכך הגירויים החזותיים מוצגים לעין שמאל. - לשטוף את עין ימין עם מלוחים כדי לשטוף ביסודיות את הפתרון pilocarpine. משכו את הווילון כלפי מטה כדי לאטום לחלוטין את המארז, מה שמונע מאור תועה להפריע לראייה הסקוטופית.
- תן לבעל החיים 5 דקות להסתגל באופן מלא לסביבה הסקוטופית לפני תחילת בדיקת OKR.
- הפעל את תוכנת הגירוי החזותי ואת תוכנת מעקב העיניים. למדידת OKR פוטופיקית, ודא שסורג התוף מתנודד אופקית עם מסלול סינוסואידלי; למדידת OKR סקוטופית, יש לוודא שסורג התוף נסחף במהירות קבועה משמאל לימין, שהוא כיוון הרקה-אף בהתייחס לעין שמאל.
הערה: כאשר האישון של עין ימין, אך לא של עין שמאל, מכווץ על ידי פילוקרפין במצב סקוטופי, ה- OKR המתעורר על ידי גירוי תוף תנודתי הוא מאוד לא סימטרי. לכן, עבור מדידת OKR סקוטופית, עין שמאל מגורה בעוד התנועה של עין ימין מנוטרת. - תוכנת המעקב אחר העיניים מודדת באופן אוטומטי את גודל האישון, מיקום CR ומיקום האישון עבור כל פריים, ומחשבת את זווית מיקום העין בהתבסס על הנוסחה הבאה (איור 2C):
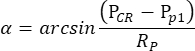
כאן, PCR הוא מיקום CR, P p הוא מיקום האישון, ו- Rp הוא רדיוס סיבוב האישון. המרחק בין השתקפות הקרנית למרכז האישון במרחב הפיזי מחושב על פי המרחק שלהם בסרט:
PCR - Pp = מספר הפיקסלים בסרט x גודל פיקסלים של שבב מצלמה x הגדלה
Rp של גודל האישון המתאים נגזר בהתבסס על מודל הרגרסיה הליניארית בשלב 3.7.3 (איור 2B למטה).
5. ניתוח תנועות עיניים של OKR עם תוכנת ניתוח העיניים
- עבד את עקבות העיניים באמצעות מסנן חציוני (חלון מסנן = 0.05 שניות) כדי להסיר רעש בתדר גבוה (איור 3A באמצע).
- הסר את סקאדות או ניסטגמוס כמתואר להלן.
- הערך את מהירות העין על-ידי חישוב הנגזרת מסדר ראשון של תנועות עיניים (איור 3A למטה). זהו את הסקאדות או הניסטגמוס על-ידי החלת סף מהירות של 50°/s (איור 3A למטה).
- החליפו את הסקדות או הניסטגמוס על-ידי אקסטרפולציה של מיקומי העיניים במהלך תנועות העיניים המהירות האלה מהמקטע שלפני הסקדות או הניסטגמוס בהתבסס על רגרסיה ליניארית (איור 3B).
- חשבו את המשרעת של תנועות עיניים OKR באמצעות התמרת פורייה מהירה (אלגוריתם גרצל) אם סורג התוף מתנודד (איור 3C), או חשבו את המהירות הממוצעת של תנועות העיניים במהלך הגירוי החזותי אם סורג התוף נע במהירות קבועה בכיוון אחד (איור 3B למטה).
הערה: המשרעת של תנועות עיניים מתנודדות הנגזרות מהתמרת פורייה דומה למשרעת הנגזרת מהתאמת מסלול העין לפונקציה סינוסואידלית (איור 3D). - חשב את רווח OKR. עבור תנועת תוף תנודתי, רווח OKR מוגדר כיחס בין המשרעת של תנועות העיניים למשרעת של תנועות התוף (איור 3C מימין). עבור תנועת תוף חד-כיוונית, רווח OKR מוגדר כיחס בין מהירות העין למהירות גרידת התוף (איור 3B למטה).
תוצאות
עם ההליך המפורט לעיל, הערכנו את התלות של OKR במספר תכונות חזותיות. העקבות לדוגמה המוצגות כאן נגזרו באמצעות קודי הניתוח שסופקו בקובץ קידוד משלים 1, ואת קובץ העקבות הגולמי לדוגמה ניתן למצוא בקובץ קידוד משלים 2. כאשר סורג התוף נסחף במסלול סינוסואידלי (0.4 הרץ), עינו של בעל החיים ?...
Discussion
השיטה של הבדיקה ההתנהגותית OKR המוצגת כאן מספקת מספר יתרונות. ראשית, גירוי חזותי שנוצר על ידי מחשב פותר את הבעיות המהותיות של תופים פיזיים. בהתמודדות עם הבעיה שתופים פיזיים אינם תומכים בבחינה שיטתית של תדר, כיוון או כוונון ניגודיות מרחבית8, התוף הווירטואלי מאפשר לשנות פרמטרים ח...
Disclosures
המחברים מצהירים כי אין אינטרסים מתחרים.
Acknowledgements
אנו מודים ליינגטיאן הא על שיתוף נתוני כוונון הכיוון. עבודה זו נתמכה על ידי מענקים מהקרן הקנדית לחדשנות וקרן המחקר של אונטריו (פרויקט CFI/ORF מס' 37597), NSERC (RGPIN-2019-06479), CIHR (Project Grant 437007) ופרסי Connaught New Research.
Materials
| Name | Company | Catalog Number | Comments |
| 2D translational stage | Thorlabs | XYT1 | |
| Acrylic resin | Lang Dental | B1356 | For fixing headplate on skull and protecting skull |
| Bupivacaine | STERIMAX | ST-BX223 | Bupivacaine Injection BP 0.5%. Local anesthesia |
| Carprofen | RIMADYL | 8507-14-1 | Analgesia |
| Compressed air | Dust-Off | ||
| Eye ointment | Alcon | Systane | For maintaining moisture of eyes |
| Graphic card | NVIDIA | Geforce GTX 1650 or Quadro P620. | For generating single screen among three monitors |
| Heating pad | Kent Scientific | HTP-1500 | For maintaining body temperature |
| High-speed infrared (IR) camera | Teledyne Dalsa | G3-GM12-M0640 | For recording eye rotation |
| IR LED | Digikey | PDI-E803-ND | For CR reference and the illumination of the eye |
| IR mirror | Edmund optics | 64-471 | For reflecting image of eye |
| Isoflurane | FRESENIUS KABI | CP0406V2 | |
| Labview | National instruments | version 2014 | eye tracking |
| Lactated ringer | BAXTER | JB2324 | Water and energy supply |
| Lidocaine and epinephrine mix | Dentsply Sirona | 82215-1 | XYLOCAINE. Local anesthesia |
| Luminance Meter | Konica Minolta | LS-150 | for calibration of monitors |
| Matlab | MathWorks | version xxx | analysis of eye movements |
| Meyhoefer Curette | World Precision Instruments | 501773 | For scraping skull and removing fascia |
| Microscope calibration slide | Amscope | MR095 | to measure the magnification of video-oculography |
| Monitors | Acer | B247W | Visual stimulation |
| Neutral density filter | Lee filters | 299 | to generate scotopic visual stimulation |
| Nigh vision goggle | Alpha optics | AO-3277 | for scotopic OKR |
| Photodiode | Digikey | TSL254-R-LF-ND | to synchronize visual stimulation and video-oculography |
| Pilocarpine hydrochloride | Sigma-Aldrich | P6503 | |
| Post | Thorlabs | TR1.5 | |
| Post holder | Thorlabs | PH1 | |
| PsychoPy | open source software | version xxx | visual stimulation toolkit |
| Scissor | RWD | S12003-09 | For skin removal |
| Superglue | Krazy Glue | Type: All purpose. For adhering headplate on the skull |
References
- Gerhard, D. Neuroscience. 5th Edition. Yale Journal of Biology and Medicine. , (2013).
- Distler, C., Hoffmann, K. P. . The Oxford Handbook of Eye Movement. , 65-83 (2011).
- Sereno, A. B., Bolding, M. S. . Executive Functions: Eye Movements and Human Neurological Disorders. , (2017).
- Giolli, R. A., Blanks, R. H. I., Lui, F. The accessory optic system: basic organization with an update on connectivity, neurochemistry, and function. Progress in Brain Research. 151, 407-440 (2006).
- Liu, B. H., Huberman, A. D., Scanziani, M. Cortico-fugal output from visual cortex promotes plasticity of innate motor behaviour. Nature. 538 (7625), 383-387 (2016).
- Prusky, G. T., Alam, N. M., Beekman, S., Douglas, R. M. Rapid quantification of adult and developing mouse spatial vision using a virtual optomotor system. Investigative Ophthalmology & Visual Science. 45 (12), 4611-4616 (2004).
- Stahl, J. S., van Alphen, A. M., De Zeeuw, C. I. A comparison of video and magnetic search coil recordings of mouse eye movements. Journal of Neuroscience Methods. 99 (1-2), 101-110 (2000).
- Faulstich, B. M., Onori, K. A., du Lac, S. Comparison of plasticity and development of mouse optokinetic and vestibulo-ocular reflexes suggests differential gain control mechanisms. Vision Research. 44 (28), 3419-3427 (2004).
- Katoh, A., Kitazawa, H., Itohara, S., Nagao, S. Dynamic characteristics and adaptability of mouse vestibulo-ocular and optokinetic response eye movements and the role of the flocculo-olivary system revealed by chemical lesions. Proceedings of the National Academy of Sciences. 95 (13), 7705-7710 (1998).
- Cahill, H., Nathans, J. The optokinetic reflex as a tool for quantitative analyses of nervous system function in mice: application to genetic and drug-induced variation. PLoS One. 3 (4), 2055 (2008).
- Cameron, D. J., et al. The optokinetic response as a quantitative measure of visual acuity in zebrafish. Journal of Visualized Experiments. (80), 50832 (2013).
- de Jeu, M., De Zeeuw, C. I. Video-oculography in mice. Journal of Visualized Experiments. (65), e3971 (2012).
- Kodama, T., du Lac, S. Adaptive acceleration of visually evoked smooth eye movements in mice. The Journal of Neuroscience. 36 (25), 6836-6849 (2016).
- Doering, C. J., et al. Modified Ca(v)1.4 expression in the Cacna1f(nob2) mouse due to alternative splicing of an ETn inserted in exon 2. PLoS One. 3 (7), e2538 (2008).
- Shi, C., et al. Optimization of optomotor response-based visual function assessment in mice. Scientific Reports. 8 (1), 9708 (2018).
- Waldner, D. M., et al. Transgenic expression of Cacna1f rescues vision and retinal morphology in a mouse model of congenital stationary night blindness 2A (CSNB2A). Translational Vision Science & Technology. 9 (11), 19 (2020).
- Tabata, H., Shimizu, N., Wada, Y., Miura, K., Kawano, K. Initiation of the optokinetic response (OKR) in mice. Journal of Vision. 10 (1), 1-17 (2010).
- Al-Khindi, T., et al. The transcription factor Tbx5 regulates direction-selective retinal ganglion cell development and image stabilization. Current Biology. 32 (19), 4286-4298 (2022).
- Harris, S. C., Dunn, F. A. Asymmetric retinal direction tuning predicts optokinetic eye movements across stimulus conditions. eLife. 12, e81780 (2023).
- van Alphen, B., Winkelman, B. H., Frens, M. A. Three-dimensional optokinetic eye movements in the C57BL/6J mouse. Investigative Ophthalmology & Visual Science. 51 (1), 623-630 (2010).
- Stahl, J. S. Calcium channelopathy mutants and their role in ocular motor research. Annals of the New York Academy of Sciences. 956, 64-74 (2002).
- Endo, S., et al. Dual involvement of G-substrate in motor learning revealed by gene deletion. Proceedings of the National Academy of Sciences. 106 (9), 3525-3530 (2009).
- Thomas, B. B., Seiler, M. J., Sadda, S. R., Coffey, P. J., Aramant, R. B. Optokinetic test to evaluate visual acuity of each eye independently. Journal of Neuroscience Methods. 138 (1-2), 7-13 (2004).
- Burroughs, S. L., Kaja, S., Koulen, P. Quantification of deficits in spatial visual function of mouse models for glaucoma. Investigative Ophthalmology & Visual Science. 52 (6), 3654-3659 (2011).
- Wakita, R., et al. Differential regulations of vestibulo-ocular reflex and optokinetic response by β- and α2-adrenergic receptors in the cerebellar flocculus. Scientific Reports. 7 (1), 3944 (2017).
- Dehmelt, F. A., et al. Spherical arena reveals optokinetic response tuning to stimulus location, size, and frequency across entire visual field of larval zebrafish. eLife. 10, e63355 (2021).
- Magnusson, M., Pyykko, I., Jantti, V. Effect of alertness and visual attention on optokinetic nystagmus in humans. American Journal of Otolaryngology. 6 (6), 419-425 (1985).
- Collins, W. E., Schroeder, D. J., Elam, G. W. Effects of D-amphetamine and of secobarbital on optokinetic and rotation-induced nystagmus. Aviation, Space, and Environmental Medicine. 46 (4), 357-364 (1975).
- Reimer, J., et al. Pupil fluctuations track fast switching of cortical states during quiet wakefulness. Neuron. 84 (2), 355-362 (2014).
- Sakatani, T., Isa, T. PC-based high-speed video-oculography for measuring rapid eye movements in mice. Neuroscience Research. 49 (1), 123-131 (2004).
- Sakatani, T., Isa, T. Quantitative analysis of spontaneous saccade-like rapid eye movements in C57BL/6 mice. Neuroscience Research. 58 (3), 324-331 (2007).
- Vinck, M., Batista-Brito, R., Knoblich, U., Cardin, J. A. Arousal and locomotion make distinct contributions to cortical activity patterns and visual encoding. Neuron. 86 (3), 740-754 (2015).
- Bradley, M. M., Miccoli, L., Escrig, M. A., Lang, P. J. The pupil as a measure of emotional arousal and autonomic activation. Psychophysiology. 45 (4), 602-607 (2008).
- Hess, E. H., Polt, J. M. Pupil size as related to interest value of visual stimuli. Science. 132 (3423), 349-350 (1960).
- Di Stasi, L. L., Catena, A., Canas, J. J., Macknik, S. L., Martinez-Conde, S. Saccadic velocity as an arousal index in naturalistic tasks. Neuroscience and Biobehavioral Reviews. 37 (5), 968-975 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved