Method Article
تحسين إنتاج وتحليل الحويصلات المملوءة بالبروتين المؤتلف من الإشريكية القولونية
In This Article
Summary
يصف هذا البروتوكول طريقة مفصلة لإنتاج البكتيريا للبروتينات المؤتلفة ، بما في ذلك البروتينات المحتوية على روابط غير قابلة للذوبان أو ثاني كبريتيد ، معبأة داخل حويصلات محاطة بغشاء خارج الخلية. ويمكن تطبيق ذلك على مجالات متنوعة من البحث العلمي، بما في ذلك التكنولوجيا الأحيائية التطبيقية والطب.
Abstract
يوفر هذا النظام المبتكر ، باستخدام علامة ببتيد قصيرة ، والتي تصدر بروتينات متعددة مؤتلفة في حويصلات مرتبطة بالغشاء من الإشريكية القولونية ، حلا فعالا لمجموعة من المشكلات المرتبطة بتعبير البروتين المؤتلف البكتيري. تعمل هذه الحويصلات المؤتلفة على تقسيم البروتينات داخل بيئة دقيقة تسهل إنتاج بروتينات صعبة أو سامة أو غير قابلة للذوبان أو تحتوي على روابط ثاني كبريتيد من البكتيريا. يزداد إنتاج البروتين بشكل كبير عند مقارنته بالتعبير البكتيري النموذجي في غياب علامة الببتيد ذات النواة الحويصلة. يدعم إطلاق البروتينات المعبأة في الحويصلة العزل عن وسط الاستزراع ويسمح بتخزين البروتين النشط على المدى الطويل. تؤدي هذه التكنولوجيا إلى زيادة غلة البروتينات الوظيفية المعبأة في الحويصلة من أجل المعالجة النهائية المبسطة لمجموعة متنوعة من التطبيقات من التكنولوجيا الحيوية التطبيقية إلى علوم الاكتشاف والطب. في هذه المقالة والفيديو المرتبط بها ، يتم توفير بروتوكول مفصل للطريقة ، والذي يسلط الضوء على الخطوات الرئيسية في المنهجية لزيادة إنتاج الحويصلات المملوءة بالبروتين المؤتلف.
Introduction
البكتيريا سالبة الجرام E. coli هي نظام جذاب لإنتاج البروتين المؤتلف على الصعيدين الصناعي والأكاديمي. إنها ليست فعالة من حيث التكلفة ومباشرة للاستزراع على دفعات إلى كثافات عالية فحسب ، بل تم إنشاء مجموعة واسعة من الكواشف والسلالات والأدوات والمروجين لتعزيز توليد البروتينات الوظيفية في الإشريكية القولونية1. بالإضافة إلى ذلك ، تتغلب تقنيات البيولوجيا التركيبية الآن على العقبات المتعلقة عادة بتطبيق تعديلات ما بعد الترجمة وطي البروتينات المعقدة2. تعد القدرة على استهداف إفراز البروتينات المؤتلفة في وسائط الاستزراع أمرا جذابا لتحسين الغلة وتقليل تكاليف التصنيع. يساعد التغليف الخاضع للرقابة للبروتينات المعرفة من قبل المستخدم في الحويصلات الغشائية على تطوير المنتجات والتقنيات في مجال التكنولوجيا الحيوية التطبيقية والصناعات الطبية. حتى الآن ، كان هناك نقص في الطرق القابلة للتطبيق على نطاق واسع لإفراز البروتينات المؤتلفة من E. coli 3.
طور Eastwood et al. مؤخرا طريقة قائمة على وضع العلامات على الببتيد لإنتاج وعزل الحويصلات المحتوية على البروتين المؤتلف من E. coli1. يسمح هذا الببتيد النواة الحويصلة (VNp) بإنتاج حويصلات غشائية بكتيرية خارج الخلية ، حيث يمكن استهداف البروتين المؤتلف المفضل لتبسيط تنقية وتخزين البروتين المستهدف ، ويسمح بإنتاجية أعلى بكثير مما يسمح به عادة من مزارع القارورة المهتزة. تم الإبلاغ عن غلة قريبة من 3 غرام من البروتين المؤتلف لكل لتر من زراعة القارورة ، مع غلة أعلى > 100 مرة من تلك التي تم الحصول عليها مع البروتينات المكافئة التي تفتقر إلى علامة VNp. يمكن تنقية هذه الحويصلات الغنية بالبروتين المؤتلف وتركيزها بسرعة من وسائط الاستزراع وتوفير بيئة مستقرة للتخزين. تمثل هذه التقنية طفرة كبيرة في إنتاج البروتين المؤتلف E. coli . تقوم الحويصلات بتقسيم البروتينات السامة وروابط ثاني كبريتيد المحتوية على شكل قابل للذوبان ووظيفي ، وتدعم التنقية البسيطة والفعالة والسريعة للبروتينات الوظيفية المعبأة في الحويصلة للتخزين طويل الأجل أو المعالجة المباشرة1.
المزايا الرئيسية التي تقدمها هذه التكنولوجيا على التقنيات الحالية هي: (1) قابلية التطبيق على مجموعة من الأحجام (1 كيلو دالتون إلى >100 كيلو دالتون) وأنواع البروتين. (2) تسهيل تكوين رابطة ثاني كبريتيد البروتين وداخلها ؛ (3) تنطبق على مجمعات متعددة البروتينات. (4) يمكن استخدامها مع مجموعة من المروجين وسلالات الإشريكية القولونية القياسية في المختبر ؛ (5) توليد غلات البروتينات من قوارير الاهتزاز التي لا ترى عادة إلا مع ثقافات التخمير ؛ يتم تصدير البروتينات وتعبئتها في حويصلات مرتبطة بالغشاء (6) توفر بيئة مستقرة لتخزين البروتين النشط القابل للذوبان. و (7) يبسط المعالجة النهائية وتنقية البروتين. من المرجح أن يكون لأداة البروتين المؤتلف البسيطة والفعالة من حيث التكلفة تأثير إيجابي على التكنولوجيا الحيوية والصناعات الطبية ، فضلا عن علم الاكتشاف.
هنا ، يصف بروتوكول مفصل ، تم تطويره على مدى عدة سنوات ، الظروف المثلى لإنتاج حويصلات مملوءة بالبروتين المؤتلف من البكتيريا باستخدام تقنية VNp. يتم عرض أمثلة على صور لهذا النظام في الممارسة العملية ، مع التعبير عن بروتين الفلورسنت ، مما يسمح بوجود حويصلات خلال مراحل مختلفة من الإنتاج والتنقية والتركيز. أخيرا ، يتم توفير إرشادات حول كيفية استخدام التصوير الخلوي الحي للتحقق من إنتاج الحويصلات المحتوية على اندماج VNp من البكتيريا.
Protocol
يتبع العمل البكتيري المضطلع به اللوائح المحلية والوطنية والدولية لاحتواء السلامة الأحيائية التي تتناسب مع مستوى مخاطر السلامة البيولوجية الخاص لكل سلالة.
1. اختيار VNps مختلفة
- حدد تسلسلات VNp.
ملاحظة: بالنسبة للدراسة الحالية ، تم تحديد ثلاثة تسلسلات VNp1 تؤدي إلى أقصى عائد وتصدير حويصلي للبروتينات التي تم فحصها حتى الآن: VNp2 و VNp6 و VNp15. ليس من الواضح حاليا سبب أداء بعض متغيرات VNp بشكل أكثر كفاءة مع بعض البروتينات من غيرها. لذلك ، يوصى بتوليد عمليات اندماج بين بروتين جديد مهم مع كل متغير VNp (أي VNp2 أو 6 أو 15).
VNp2: MDVFMKGLSKAKEGVVAAAEKTKQGVAEA
AGKTKEGVL
VNp6: MDVFKKGFSIADEGVVGAVEKTDQGVTEA
ايكتكيجفم
VNp15: MDVFKKGFSIADEGVVGAVE
تم توفير البلازميدات التي تسمح بالتعبير عن البروتين محل الاهتمام مع اندماجات طرفية أمينية مختلفة VNp تجاريا (انظر جدول المواد). - صمم استراتيجية استنساخ لإدخال الجين محل الاهتمام في نهاية 3 'من ترميز cDNA ل VNp في أحد هذه التركيبات ، أو تكييف بلازميد موجود عن طريق دمج VNp cDNA المركب في المنبع من أول كودون ATG لتشفير الجين للبروتين محل الاهتمام. استخدم الطرق كما هو موضح في1.
- بالنسبة للبروتينات السامة ، استخدم ناقلا مع محفز تعبير قابل للقمع أو مروج مع الحد الأدنى من ضوضاء التعبير غير المستحثة.
- استنساخ علامة تسلسل VNp في الطرف الأميني لبروتين الاندماج. تأكد من أن علامات التقارب ، وتسلسلات انقسام الأنزيم البروتيني ، وما إلى ذلك ، والبروتين محل الاهتمام موجودة على جانب الكربوكسيل من علامة VNp. يوصى بفصل VNp عن الببتيد المصب بمنطقة رابط مرنة ، مثل تكرارين أو ثلاثة تكرارات لتسلسل عديد الببتيد -G-G-S-G- (الشكل 1).
ملاحظة: استخدم البلازميدات مع اختيار المضادات الحيوية التي لا تستهدف الببتيدوغليكان ، مما يضعف سطح الخلية ويقلل من إنتاج الحويصلة. كان كاناميسين والكلورامفينيكول (انظر جدول المواد) المضادات الحيوية المفضلة المستخدمة في هذه الدراسة.
2. زراعة الخلايا البكتيرية وتحريض البروتين
ملاحظة: السلالات البكتيرية المستخدمة عادة في هذا البروتوكول هي إما الإشريكية القولونية BL21 (DE3) أو W3110. يتم استزراع خلايا الإشريكية القولونية في مرق الليزوجيني (LB) (10 جم / لتر تريبتون ؛ 10 جم / لتر كلوريد الصوديوم ؛ 5 جم / لتر من خلاصة الخميرة) أو مرق رائع (TB) (12 جم / لتر من التربتون ؛ 24 جم / لتر من خلاصة الخميرة ؛ 4 مل / لتر 10٪ جلسرين ؛ 17 مللي متر KH2PO 4 ؛ 72 مللي متر K2HPO4 ، أملاح معقمة بشكل منفصل) وسائط (انظر جدول المواد). يوضح الشكل 2 أمثلة على الصور التي توضح كل خطوة من خطوات تحريض البروتين وعملية العزل والتنقية اللاحقة.
- استزرع 5 مل رطل من التحولات البكتيرية الطازجة عند 37 درجة مئوية إلى التشبع واستخدامها لتلقيح 25 مل من السل في دورق مخروطي سعة 500 مل ، وكل ذلك مع اختيار مضاد حيوي مناسب.
- مساحة السطح: نسبة الحجم هي عامل مهم في تحسين هذا النظام. استخدم أكبر حجم ممكن من الدورق (على سبيل المثال ، قارورة 5 لتر تحتوي على 1 لتر من الثقافة ؛ لتشغيل التحسين ، استخدم 25 مل من الوسائط في دورق 500 مل).
- احتضان مزارع القارورة المهتزة الأكبر في حاضنة عند 37 درجة مئوية مع الاهتزاز عند 200 دورة في الدقيقة (رمي مداري ≥25 مم) حتى يتم الوصول إلى قيمة كثافة بصرية 600 نانومتر (OD600) من 0.8-1.0.
ملاحظة: الحويصلة هي الأمثل عندما تنمو الخلايا عند 37 درجة مئوية. ومع ذلك، تتطلب بعض البروتينات المعاد الاتحاد التعبير في درجات حرارة منخفضة. إذا كان هذا هو الحال بالنسبة للبروتين محل الاهتمام ، فيجب استخدام علامة VNp6 ، لأن هذا يسمح بتصدير الحويصلة عالية الغلة في درجات حرارة تصل إلى 25 درجة مئوية. - للحث على شفط البروتين المؤتلف من محفز T7 ، أضف الأيزوبروبيل β-D-1-thiogalactopyranoside (IPTG) إلى تركيز نهائي يصل إلى 20 ميكروغرام / مل (84 ميكرومتر) (انظر جدول المواد). يجب أن يحدث تحريض تعبير البروتين المؤتلف في مرحلة اللوغاريتم المتأخر (أي OD600 النموذجي من 0.8-1.0) لإنتاج الحويصلات.
ملاحظة: قد يختلف طول فترة الحث بين البروتينات ، حيث يصل بعضها إلى الحد الأقصى للإنتاج عند 4 ساعات والبعض الآخر بين عشية وضحاها (18 ساعة). حتى الآن ، تم الحصول على أقصى تصدير للحويصلة في الثقافات بين عشية وضحاها.
3. عزل الحويصلة المؤتلف
- قم بتجميع الخلايا عن طريق الطرد المركزي عند 3000 × جم (4 درجات مئوية) لمدة 20 دقيقة.
- لتعقيم الوسائط المحتوية على الحويصلة للتخزين طويل الأجل ، قم بتمرير وسائط الاستزراع التي تم تطهيرها من خلال مرشح بولي إيثر سلفون (PES) معقم وخالي من المنظفات 0.45 ميكرومتر (انظر جدول المواد).
ملاحظة: لاختبار استبعاد الخلايا القابلة للحياة من الراشح المحتوي على الحويصلة ، قم بوضعه على أجار LB واحتضانه طوال الليل عند 37 درجة مئوية. - لتركيز الحويصلات في حجم أصغر ، قم بتمرير الوسائط المحتوية على الحويصلة المعقمة من خلال مرشح استرات السليلوز المختلط (MCE) المعقم والخالي من المنظفات 0.1 ميكرومتر (انظر جدول المواد).
- اغسل الغشاء برفق باستخدام 0.5-1 مل من برنامج تلفزيوني معقم باستخدام مكشطة خلوية أو مفرشة بلاستيكية لإزالة الحويصلات بعناية من الغشاء. نقل إلى أنبوب microfuge جديدة.
ملاحظة: يمكن تخزين الحويصلات المنقاة في وسائط معقمة أو محلول ملحي مخزن بالفوسفات (PBS) عند 4 درجات مئوية. هناك أمثلة على البروتينات المؤتلفة المخزنة في هذه الحويصلات لمدة 6 أشهر ، بهذه الطريقة ، دون فقدان النشاط الأنزيمي.
4. إطلاق البروتين القابل للذوبان من الحويصلات المعزولة
- بمجرد عزل الحويصلات المحتوية على البروتين في الوسط / المخزن المؤقت المعقم ، قم بإخضاع الأغشية الدهنية الحويصلية للصوتنة باستخدام جدول زمني مناسب للجهاز (على سبيل المثال ، 6 × 20 ثانية دورات تشغيل وإيقاف) وأجهزة طرد مركزي عند 39000 × جم (4 درجات مئوية) لمدة 20 دقيقة لإزالة حطام الحويصلة.
ملاحظة: يمكن استخدام الصدمة التناضحية أو معالجة المنظفات كبديل لفتح الحويصلات ، ولكن يجب مراعاة التأثير على وظائف البروتين و / أو التطبيق النهائي. - إذا ظل اندماج VNp خلويا ولم يتم إطلاقه في الوسائط ، فقم بعزل البروتين باستخدام بروتوكولات قياسية (على سبيل المثال ، إعادة تعليق كريات الخلية في 5 مل من مخزن استخراج مناسب (20 mM tris ، 500 mM NaCl) ، سونيكات ، وإزالة حطام الخلية عن طريق الطرد المركزي).
5. تحديد تركيز البروتين
- تحديد تركيز البروتينات عن طريق تحليل قياس كثافة الهلام لعينات ثلاثية1. يعمل جنبا إلى جنب مع معايير تحميل ألبومين مصل الأبقار (BSA) على جل دوديسيل سلفات بولي أكريلاميد بولي أكريلاميد جل كهربائي (SDS-PAGE) مصبوغ بالكوماسي. مسح وتحليل المواد الهلامية باستخدام البرامج المناسبة (على سبيل المثال ، الصورة J ؛ انظر جدول المواد).
6. تصور تكوين الحويصلة والحويصلات المعزولة بواسطة المجهر الفلوري
ملاحظة: إذا كانت الخلايا تحتوي على علامات اندماج VNp أو علامات غشائية تحمل علامة الفلورسنت ، فيمكن استخدام تصوير الخلايا الحية لمتابعة تكوين الحويصلة. بدلا من ذلك ، يمكن استخدام أصباغ الدهون الفلورية لتصور الحويصلات لتأكيد الإنتاج والتنقية.
- تركيب الخلية
- حث على شفط VNp التفاعلي لعدة ساعات قبل تركيبه على غطاء الغطاء.
- طريقة وسادة الأغاروز (الشكل 3A-C): ماصة الخلايا على وسادة رقيقة (<1 مم) ، دائرية LB-agarose (2٪) سمح لها بالتشكل ووضعها على شريحة زجاجية نظيفة. اسمح للخلايا بالاستقرار والتوازن وضع غطاء 50 مم × 25 مم على الوسادة والخلايا. ثبت غطاء الغطاء في مكانه باستخدام الفواصل والشريط اللاصق.
- طريقة البولي إيثيلين (PEI) (الشكل 3D-F): انشر 20 ميكرولتر من 0.05٪ PEI (في dH2O) على غطاء بطرف ماصة واتركه لمدة 3-5 دقائق حتى يلتصق بالزجاج دون السماح له بالجفاف. أضف 50 ميكرولتر من زراعة الخلايا واتركها لمدة 5-10 دقائق للتأكد من ارتباط البكتيريا بالسطح المطلي ب PEI4. اغسل غطاء الغطاء ب 100 ميكرولتر من الوسائط قبل وضعه على الشريحة وثبته في مكانه باستخدام الفواصل والشريط اللاصق.
- تركيب الحويصلات
- الحويصلات المنقاة الماصة على وسادة رقيقة (<1 مم) دائرية من LB-agarose (2٪) تم السماح لها بالتشكل وتثبيتها على شريحة زجاجية نظيفة. بمجرد أن يجف السائل ، ضع غطاء 50 مم × 25 مم على الوسادة والحويصلات. ثبت غطاء الغطاء في مكانه باستخدام الفواصل والشريط اللاصق.
- صبغة الدهون الفلورية FM4-64 قادرة على تلطيخ الأغشية5 ، وبالتالي يمكن استخدامها لتصور الحويصلات. أضف FM4-64 (انظر جدول المواد) إلى الحويصلات المنقاة بتركيز نهائي يبلغ 2 ميكرومتر (من مخزون 2 مللي متر مذاب في ثنائي ميثيل سلفوكسيد [DMSO]) والصورة بعد حضانة مدتها 10 دقائق. هذا مفيد بشكل خاص لتحديد الحويصلات التي تحتوي على شحنات غير موسومة بالفلورسنت5.
- اشطف أغطية الأغطية بنفس الوسائط المستخدمة لزراعة الخلايا المرصودة.
ملاحظة: يمكن أن تظهر بعض الوسائط المعقدة (مثل السل) تألقا ذاتيا ، مما قد يؤدي إلى زيادة إشارة الخلفية.
- تصوير الحويصلات
ملاحظة: يمكن رؤية أمثلة على الصور المجهرية للحويصلات المؤتلفة VNp في الشكل 4.- قم بتركيب الشريحة على مجهر مقلوب (انظر جدول المواد) باستخدام هدف الغمر بالزيت واتركه لمدة 2-3 دقائق للسماح للعينة بالاستقرار وتوازن درجة الحرارة.
ملاحظة: يجب إكمال جميع صور الخلايا الحية لكل عينة في غضون 30 دقيقة من تركيب الخلايا على أغطية لتقليل تأثير السمية الضوئية والإجهاد اللاهوائي. لهذا السبب ، تفضل الصور أحادية المستوى على مكدسات z. - استخدم مصادر الضوء المناسبة (على سبيل المثال ، الصمام الثنائي الباعث للضوء [LED] أو لمبة الهالوجين ؛ انظر جدول المواد) ومجموعات المرشحات للبروتين (البروتينات) / الصبغة (الصبغات) الفلورية المستخدمة6.
- استخدم عدسة تكبير عالية (أي 100x أو 150x) وفتحة عددية عالية (أي NA ≥1.4) لتصوير الخلايا الميكروبية والحويصلات.
- تحديد الحد الأدنى من شدة الضوء المطلوبة لتصور إشارات مضان من الخلايا و / أو الحويصلات. قد يتطلب ذلك بعض الضبط لإعدادات التعرض والكسب للكاميرا المستخدمة.
ملاحظة: تتراوح أوقات التعرض النموذجية من كاميرات أشباه الموصلات التكميلية الحالية لأكسيد المعادن (CMOS) بين 50-200 مللي ثانية حسب نظام التصوير. - بالنسبة للصور أحادية الإطار، استخدم متوسط ثلاث صور لتقليل ضوضاء الخلفية العشوائية المعتمدة على الأجهزة.
- لتصوير الفاصل الزمني ، اترك 3-5 دقائق بين الإطارات الفردية.
ملاحظة: اعتمادا على إعداد المجهر ، قد يلزم ضبط التركيز بشكل متقطع خلال تجارب الفاصل الزمني الأطول.
- قم بتركيب الشريحة على مجهر مقلوب (انظر جدول المواد) باستخدام هدف الغمر بالزيت واتركه لمدة 2-3 دقائق للسماح للعينة بالاستقرار وتوازن درجة الحرارة.
النتائج
تم زراعة BL21 DE3 E. coli التي تحتوي على بنية تعبير VNp6-mNeongreen إلى مرحلة السجل المتأخر (الشكل 2A). تم تحفيز تعبير VNp6-mNeongreen عن طريق إضافة IPTG إلى المزرعة (20 ميكروغرام / مل أو 84 ميكرومتر تركيز نهائي) ، والذي ترك لاحقا لينمو بين عشية وضحاها عند 37 درجة مئوية مع اهتزاز قوي (200 دورة في الدقيقة ، ≥رمي مداري 25 مم). في صباح اليوم التالي ، أظهرت الثقافة مضان mNeongreen7 (الشكل 2B) ، والذي ظل مرئيا في الوسائط بعد إزالة الخلايا البكتيرية عن طريق الطرد المركزي (الشكل 2C). تم تأكيد وجود VNp-mNeongreen داخل الثقافة ووسائط الاستزراع التي تم تطهيرها بواسطة SDS-PAGE (الشكل 2D). تم عزل الحويصلات المحتوية على mNeongreen على مرشح MCE 0.1 ميكرومتر (الشكل 2E) وإعادة تعليقها في PBS (الشكل 2F). تم بعد ذلك تركيب الحويصلات المنقاة على وسادة أغاروز (الشكل 3A-C) وتم تصويرها باستخدام المجهر الفلوري واسع المجال (الشكل 4A). تم تأكيد وجود أغشية الحويصلة باستخدام صبغة الفلورسنت المحبة للدهون FM4-64 (الشكل 4B). تظهر خلايا الإشريكية القولونية التي تعبر عن بروتين الغشاء الداخلي CydB المنصهر في mNeongreen (الأخضر) و VNp6-mCherry2 (أرجواني)8 إنتاج الحويصلة وإدخال البضائع في الخلايا البكتيرية الحية (الشكل 4C). تم التقاط الشكل 4A ، B باستخدام مجهر مضان واسع المجال ، بينما تم الحصول على الشكل 4C باستخدام مجهر الإضاءة المنظم (SIM) ، باستخدام الطرق الموضحة سابقا9،10.
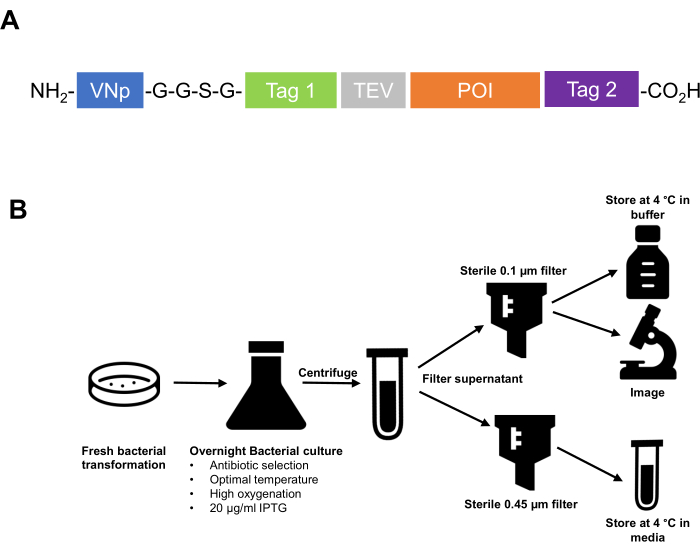
الشكل 1: ملخص تقنية VNp من تصميم استراتيجية الاستنساخ إلى تنقية وتخزين الحويصلات خارج الخلية. أ: رسم تخطيطي لبروتين اندماج VNp نموذجي. VNp في محطة NH2 ، متبوعا برابط مرن ومزيج مناسب من علامات التقارب والتألق (Tag1 ، Tag 2 ، موقع انقسام البروتياز [على سبيل المثال ، TEV]) والبروتين محل الاهتمام. (ب) مخطط تخطيطي يلخص بروتوكول التعبير عن الحويصلات الغشائية المملوءة بالبروتين المعاد الاتحاد وتنقيتها من الإشريكية القولونية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
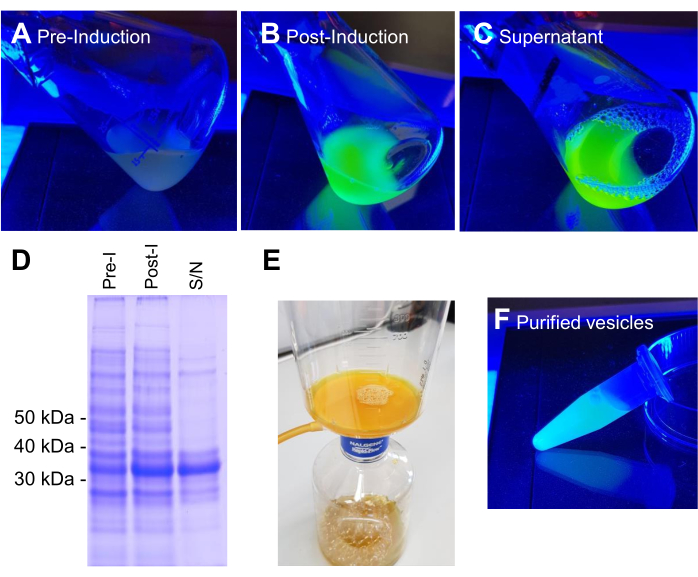
الشكل 2: مراحل إنتاج وتنقية حويصلات VNp6-mNG. تتراكم مزارع خلايا الإشريكية القولونية التي تحتوي على تعبير VNp-mNeongreen في الضوء الأزرق إما قبل (A) أو بعد (B) التعبير الناجم عن IPTG لبروتين الاندماج. أزيلت الخلايا من (ب) بالطرد المركزي، تاركة حويصلات مملوءة ب VNp-mNeongreen في الوسط (C). (د) تم تحليل العينات المكافئة من A و B و C بواسطة SDS-PAGE وتلطيخ coomasie. تم عزل الحويصلات على مرشح 0.1 ميكرومتر (E) ثم تم غسلها لاحقا إلى حجم مناسب من المخزن المؤقت (F). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
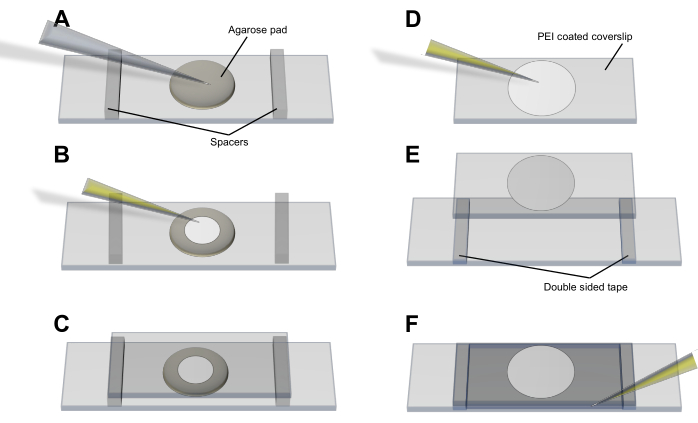
الشكل 3: إجراء تركيب الخلية لتصوير الحويصلات وإنتاج الحويصلات. (A-C) طريقة وسادة الأغاروز و (D-F) طريقة PEI لتركيب خلايا الإشريكية القولونية على غطاء الغطاء. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
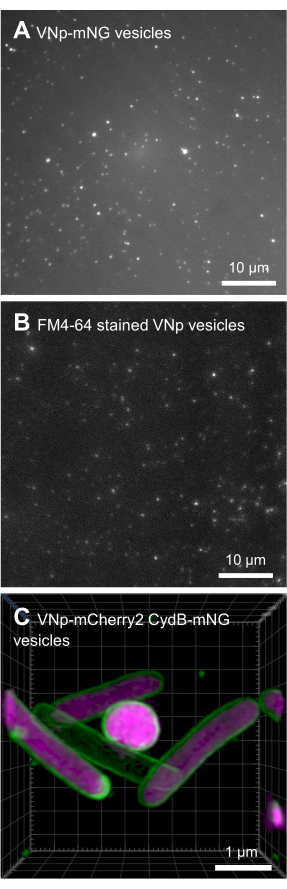
الشكل 4: الصور المجهرية للحويصلات المعاد الاتحاد VNp. صور انبعاث خضراء (A) وحمراء (B) من حقول مختلفة من FM4-64 المسمى VNp6-mNeongreen تحتوي على حويصلات مثبتة على وسادة أغاروز. (C) يظهر تصوير خلايا الإشريكية القولونية التي تعبر عن بروتين الغشاء الداخلي CydB المنصهر مع mNeongreen (الأخضر) و VNp6-mCherry2 (أرجواني) إنتاج الحويصلة وإدخال البضائع في الخلايا البكتيرية الحية. تم تصوير (A ، B) باستخدام مجهر مضان واسع المجال ، بينما تم الحصول على (C) باستخدام مجهر الإضاءة المنظم (SIM). أشرطة المقياس: (أ ، ب) = 10 ميكرومتر ؛ (ج) = 1 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
Discussion
طريقة الببتيد الأمينية الطرفية لإنتاج البروتينات المؤتلفة الموصوفة أعلاه هي عملية بسيطة تنتج باستمرار كميات كبيرة من البروتين يمكن عزلها و / أو تخزينها بكفاءة لعدة أشهر.
من المهم تسليط الضوء على الخطوات الرئيسية في البروتوكول المطلوبة للاستخدام الأمثل لهذا النظام. أولا ، يجب أن تكون علامة VNp1 موجودة في N-terminus ، متبوعة بالبروتين محل الاهتمام وأي علامات مناسبة. من المهم أيضا تجنب استخدام المضادات الحيوية التي تستهدف طبقة الببتيدوغليكان ، مثل الأمبيسلين.
من حيث ظروف النمو ، فإن الوسائط الغنية (على سبيل المثال ، وسائط LB أو TB) ومساحة السطح العالية: نسبة الحجم ضرورية لزيادة إنتاج الحويصلات إلى أقصى حد. درجة الحرارة المثلى لإنتاج الحويصلات خارج الخلية هي 37 درجة مئوية ، ولكن يجب مراعاة الظروف المطلوبة عادة للتعبير عن البروتين محل الاهتمام أيضا. لانخفاض درجات حرارة الحث ، يجب استخدام VNp6. بشكل حاسم ، يجب تحقيق تحريض محفز T7 باستخدام ما لا يزيد عن 20 ميكروغرام / مل (84 ميكرومتر) IPTG بمجرد وصول الخلايا إلى OD600 من 0.8-1.0. تصل البروتينات المعبر عنها باستخدام النظام إلى أقصى إنتاج للحويصلة إما في 4 ساعات أو بعد الحث الليلي.
على الرغم من بساطة هذا البروتوكول ، إلا أنه يتطلب التحسين. قد يختلف الانصهار المتغير VNp ودرجات حرارة التعبير والفترات الزمنية للحث اعتمادا على البروتين محل الاهتمام. علاوة على ذلك ، هناك حاجة لتحسين تنقية الحويصلات خارج الخلية وتركيزها لاحقا من الوسائط. الإجراء الحالي غير قابل للتطوير ويمكن أن يستغرق وقتا طويلا. هذه هي حدود هذه المنهجية.
تتمتع تقنية VNp بالعديد من المزايا مقارنة بالطرق التقليدية2. يسمح بالتصدير الحويصلي للبروتينات المتنوعة ، مع الحد الأقصى للحجم الذي تم التعبير عنه بنجاح حتى الآن هو 175 كيلو دالتون للحويصلات التي تظل داخلية و 85 كيلو دالتون لتلك التي يتم تصديرها. علاوة على ذلك ، يمكن لهذه التقنية أن تزيد بشكل كبير من إنتاجية البروتينات المؤتلفة مع مجموعة من الخصائص والأنشطة الفيزيائية. يمكن عزل الحويصلات المصدرة التي تحتوي على البروتين محل الاهتمام عن طريق الترشيح البسيط من الوسائط التي تم تطهيرها مسبقا ويمكن تخزينها لاحقا ، في وسط استزراع معقم أو مخزن مؤقت ، عند 4 درجات مئوية لعدة أشهر.
تطبيقات هذا النظام متنوعة ، من علم الاكتشاف إلى التكنولوجيا الحيوية التطبيقية والطب (على سبيل المثال ، من خلال إنتاج العلاجات الوظيفية)3. سهولة الإنتاج ، ومعالجة المصب ، والعائد العالي كلها صفات جذابة في هذه المجالات وخاصة في الصناعة.
Disclosures
يعلن المؤلفون عدم وجود مصالح مالية متنافسة أو تضارب مصالح آخر.
Acknowledgements
يشكر المؤلفون مستخدمي تويتر المتنوعين الذين أثاروا أسئلة حول البروتوكول المقدم في الورقة التي تصف تقنية VNp. تم إنشاء الشكل 1A باستخدام رموز من flaticon.com. تم دعم هذا العمل من قبل جامعة كنت وبتمويل من مجلس أبحاث التكنولوجيا الحيوية والعلوم البيولوجية (BB / T008/768/1 و BB / S005544/1).
Materials
| Name | Company | Catalog Number | Comments |
| Ampicillin | Melford | 69-52-3 | |
| Chloramphenicol | Acros Organics (Thermofisher Scientific) | 56-75-7 | |
| E. coli BL21 (DE3) | Lab Stock | N/A | |
| E. coli DH10β | Lab Stock | N/A | |
| Filters for microscope | Chroma | ||
| FM4-64 | Molecular Probes (Invitrogen) | T-3166 | Dissolved in DMSO, stock concentration 2 mM |
| ImageJ | Open Source | Downloaded from: https://imagej.net/ij/index.html | |
| Inverted microscope | Olympus | ||
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Melford | 367-93-1 | |
| Kanamycin sulphate | Gibco (Thermofisher Scientific) | 11815-024 | |
| LED light source for micrscope | Cairn Research Ltd | ||
| Lysogeny Broth (LB) / LB agar | Lab Stock | N/A | 10 g/L Tryptone; 10 g/L NaCl; 5 g/L Yeast Extract (1.5 g/L agar) |
| Metamorph imaging software | Molecular Devices | ||
| MF-Millipore Membrane filter (0.1 µm, MCE) | Merck | VCWP04700 | |
| Millipore Express PLUS membrane filter (0.45 µm, PES) | Merck | HPWP04700 | |
| Phosphate buffered saline (PBS) | Lab Stock | N/A | |
| Plasmids allowing expression of protein of interest with different VNp amino terminal fusions | Addgene | https://www.addgene.org/Dan_Mulvihill/ | |
| Terrific Broth (TB) | Lab Stock | N/A | 12 g/L Tryptone; 24 g/L Yeast Extract; 4 ml/L 10% glycerol; 17 mM KH2PO4 72 mM K2HPO4 |
References
- Eastwood, T. A., et al. High-yield vesicle-packaged recombinant protein production from E. coli. Cell Reports Methods. 3 (2), 100396 (2023).
- Makino, T., Skretas, G., Georgiou, G. Strain engineering for improved expression of recombinant proteins in bacteria. Microbial Cell Factories. 10, 32 (2011).
- Peng, C., et al. Factors influencing recombinant protein secretion efficiency in gram-positive bacteria: Signal peptide and beyond. Frontiers in Bioengineering and Biotechnology. 7, 139 (2019).
- Lewis, K., Klibanov, A. M. Surpassing nature: rational design of sterile-surface materials. Trends in Biotechnology. 23 (7), 343-348 (2005).
- Betz, W. J., Mao, F., Smith, C. B. Imaging exocytosis and endocytosis. Current Opinion in Neurobiology. 6 (3), 365-371 (1996).
- Mulvihill, D. P. Live cell imaging in fission yeast. Cold Spring Harbor Protocols. 2017 (10), (2017).
- Shaner, N. C., et al. A bright monomeric green fluorescent protein derived from Branchiostoma lanceolatum. Nature Methods. 10 (5), 407-409 (2013).
- Shen, Y., Chen, Y., Wu, J., Shaner, N. C., Campbell, R. E. Engineering of mCherry variants with long Stokes shift, red-shifted fluorescence, and low cytotoxicity. PloS One. 12 (2), e0171257 (2017).
- Periz, J., et al. A highly dynamic F-actin network regulates transport and recycling of micronemes in Toxoplasma gondii vacuoles. Nature Communications. 10 (1), 4183 (2019).
- Qiu, H., et al. Uniform patchy and hollow rectangular platelet micelles from crystallizable polymer blends. Science. 352 (6286), 697-701 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved