Method Article
E. coli의 재조합 단백질 충전 소포의 최적화된 생산 및 분석
요약
본 프로토콜은 세포외 막 결합 소포 내부에 포장된 전형적으로 불용성 또는 이황화 결합 함유 단백질을 포함하는 재조합 단백질의 박테리아 생산을 위한 상세한 방법을 설명합니다. 이것은 응용 생명 공학 및 의학을 포함한 과학 연구의 다양한 영역에 적용될 가능성이 있습니다.
초록
짧은 펩타이드 태그를 사용하여 대장균의 막 결합 소포에서 여러 재조합 단백질을 내보내는 이 혁신적인 시스템은 박테리아 재조합 단백질 발현과 관련된 다양한 문제에 대한 효과적인 솔루션을 제공합니다. 이러한 재조합 소포는 박테리아에서 어렵고 독성이 있거나 불용성 또는 이황화 결합 포함 단백질의 생산을 용이하게 하는 미세 환경 내에서 단백질을 구획화합니다. 단백질 수율은 소포-핵 형성 펩티드 태그가 없는 전형적인 박테리아 발현과 비교할 때 상당히 증가한다. 소포 포장 단백질의 방출은 배양 배지로부터의 분리를 지원하고 장기 활성 단백질 저장을 허용합니다. 이 기술은 응용 생명 공학에서 발견 과학 및 의학에 이르기까지 다양한 응용 분야에서 단순화된 다운스트림 처리를 위해 소포 포장된 기능성 단백질의 수율을 증가시킵니다. 본 논문 및 관련 비디오에서는 재조합 단백질로 채워진 소포 생산을 최대화하기 위한 방법론의 주요 단계를 강조하는 방법의 자세한 프로토콜이 제공됩니다.
서문
그람 음성 박테리아 E. coli는 산업 및 학술 규모 모두에서 재조합 단백질 생산을 위한 매력적인 시스템입니다. 비용 효율적이고 고밀도로 배치로 배양하는 것이 간단할 뿐만 아니라 대장균 1에서 기능성 단백질의 생성을 촉진하기 위해 광범위한 시약, 균주, 도구 및 촉진제가 확립되었습니다. 또한, 합성생물학 기술은 이제 번역 후 변형의 적용 및 복잡한 단백질의 접힘과 관련된 장애물을 극복하고 있다2. 배양 배지로의 재조합 단백질 분비를 표적으로 하는 능력은 수율을 개선하고 제조 비용을 절감하는 데 매력적입니다. 사용자 정의 단백질을 막 소포로 제어하여 패키징하면 응용 생명 공학 및 의료 산업 내에서 제품 및 기술 개발을 지원합니다. 지금까지 대장균 3에서 재조합 단백질을 분비하는 데 널리 적용할 수 있는 방법이 부족했습니다.
Eastwood et al. 최근 대장균1에서 재조합 단백질 함유 소포를 생산 및 분리하기 위한 펩타이드 태깅 기반 방법을 개발했습니다. 이 소포 핵 형성 펩타이드(VNp)는 세포외 박테리아 막 소포의 생산을 가능하게 하며, 선택한 재조합 단백질을 표적으로 삼아 표적 단백질의 정제 및 보관을 단순화할 수 있으며, 진탕 플라스크 배양에서 일반적으로 허용되는 것보다 훨씬 더 높은 수율을 허용합니다. 플라스크 배양 리터당 3g에 가까운 재조합 단백질의 수율이 보고되었으며, VNp 태그가 없는 동등한 단백질로 얻은 것보다 >100배 더 높은 수율이 있습니다. 이러한 재조합 단백질이 풍부한 소포는 배양 배지에서 빠르게 정제 및 농축될 수 있으며 안정적인 보관 환경을 제공합니다. 이 기술은 대장균 재조합 단백질 생산의 주요 돌파구를 나타냅니다. 소포는 독성 및 이황화 결합 함유 단백질을 가용성 및 기능성 형태로 구획화하고 장기 보관 또는 직접 처리를 위해 소포 포장된 기능성 단백질의 간단하고 효율적이며 신속한 정제를 지원합니다1.
이 기술이 현재 기술에 비해 제시하는 주요 이점은 다음과 같습니다 : (1) 다양한 크기 (1 kDa에서 >100 kDa) 및 단백질 유형에 대한 적용 가능성; (2) 단백질 간 및 단백질 내 이황화 결합 형성을 촉진합니다. (3) 다단백질 복합체에 적용 가능; (4) 다양한 프로모터 및 표준 실험실 대장균 균 주와 함께 사용할 수 있습니다. (5) 일반적으로 발효 배양에서만 볼 수 있는 진탕 플라스크로부터의 단백질 수율 생성; 단백질은 (6) 활성 가용성 단백질의 저장을 위한 안정적인 환경을 제공하는 막 결합 소포로 내보내지고 포장됩니다. (7) 다운스트림 처리 및 단백질 정제를 단순화합니다. 이 간단하고 비용 효율적인 재조합 단백질 도구는 생명 공학 및 의료 산업뿐만 아니라 발견 과학에도 긍정적인 영향을 미칠 것입니다.
여기에서는 수년에 걸쳐 개발된 상세한 프로토콜이 VNp 기술을 사용하여 박테리아에서 재조합 단백질로 채워진 소포를 생산하기 위한 최적의 조건을 설명합니다. 실제로 이 시스템의 예시 이미지가 표시되며, 형광 단백질이 발현되어 생산, 정제 및 농축의 여러 단계에서 소포의 존재를 시각화할 수 있습니다. 마지막으로, 박테리아에서 VNp 융합 함유 소포의 생산을 검증하기 위해 생세포 이미징을 사용하는 방법에 대한 지침이 제공됩니다.
프로토콜
수행되는 박테리아 작업은 각 균주의 특정 생물 안전 위험 수준에 맞는 지역, 국가 및 국제 생물 안전 봉쇄 규정을 따릅니다.
1. 다양한 VNp 선택
- VNp 시퀀스를 식별합니다.
참고: 본 연구를 위해 현재까지 조사된 단백질의 최대 수율 및 소포 수출을 초래하는 3개의 VNp 서열1 이 확인되었습니다: VNp2, VNp6 및 VNp15. 특정 VNp 변이체가 다른 단백질보다 일부 단백질에서 더 효율적으로 수행되는 이유는 현재 명확하지 않습니다. 따라서 각 VNp 변이체(즉, VNp2, 6 또는 15)를 가진 새로운 관심 단백질 간에 융합을 생성하는 것이 좋습니다.
VNp2: MDVFMKGLSKAKEGVVAAAEKTKQGVAEA
AGKTKEGVL
VNp6: MDVFKKGFSIADEGVVGAVEKTDQGVTEA
AEKTKEGVM
VNp15: MDVFKKGFSIADEGVVGAVE
상이한 VNp 아미노 말단 융합체와 함께 관심 단백질의 발현을 허용하는 플라스미드가 상업적으로 이용가능하다( 표 참조). - 이러한 구축물 중 하나에서 VNp를 암호화하는 cDNA의 3' 말단에 관심 유전자를 삽입하는 클로닝 전략을 설계하거나, 관심 단백질을 암호화하는 유전자의 첫 번째 ATG 코돈의 상류에 합성된 VNp cDNA를 통합하여 기존 플라스미드를 적응시킵니다. 1에 설명된 대로 방법을 사용합니다.
- 독성 단백질의 경우, 억제 가능한 발현 프로모터 또는 유도되지 않은 발현 노이즈가 최소화된 프로모터가 있는 벡터를 사용하십시오.
- 융합 단백질의 아미노 말단에 VNp 서열 태그를 복제합니다. 친화성 태그, 프로테아제 절단 서열 등 및 관심 단백질이 VNp 태그의 카르복실 쪽에 있는지 확인합니다. -G-G-S-G- 폴리펩티드 서열의 2개 또는 3개 반복과 같은 유연한 링커 영역을 사용하여 다운스트림 펩티드에서 VNp를 분리하는 것이 좋습니다(그림 1).
참고: 펩티도글리칸을 표적으로 하지 않는 항생제 선택과 함께 플라스미드를 사용하면 세포 표면이 약화되고 소포 수율이 감소합니다. 카나마이신과 클로람페니콜( 재료 표 참조)은 이 연구에 사용된 선호되는 항생제였습니다.
2. 세균세포 배양 및 단백질 유도
참고: 이 프로토콜에서 일반적으로 사용되는 박테리아 균주는 대장균 BL21(DE3) 또는 W3110입니다. 대장균 세포는 용원성 액체배지(LB)(10g/L 트립톤, 10g/L NaCl, 5g/L 효모 추출물) 또는 훌륭한 액체배지(TB)(12g/L 트립톤, 24g/L 효모 추출물, 4mL/L 10% 글리세롤, 17mM KH2PO4, 72mMK2HPO4, 별도로 고압멸균된 염) 배지(재료 표 참조)에서 배양됩니다. 단백질 유도 및 후속 분리 및 정제 공정의 각 단계를 보여주는 예시 이미지가 그림 2에 나와 있습니다.
- 37°C에서 포화 상태까지 신선한 박테리아 형질전환에서 5mL LB 스타터를 배양하고 이를 사용하여 500mL 원뿔형 플라스크에 25mL의 TB를 접종하고 모두 적절한 항생제 선택을 합니다.
- 표면적:부피 비율은 이 시스템을 최적화하는 데 중요한 요소입니다. 가능한 한 큰 부피의 플라스크를 사용합니다(예: 1L의 배양액이 들어 있는 5L 플라스크, 최적화를 위해 500mL 플라스크에 25mL의 배지 사용).
- 0.8-1.0의 600 nm 광학 밀도 값(OD600)에 도달할 때까지 200 rpm(≥25 mm 오비탈 스로우)에서 진탕하면서 37°C의 인큐베이터에서 더 큰 진탕 플라스크 배양물을 인큐베이션한다.
참고: 소포는 세포가 37°C에서 자랄 때 최적입니다. 그러나 일부 재조합 단백질은 더 낮은 온도에서 발현해야 합니다. 관심 단백질의 경우 VNp6 태그를 사용해야 하며, 이를 통해 최저 25°C의 온도에서 고수율 소포를 내보낼 수 있습니다. - T7 프로모터에서 재조합 단백질 발현을 유도하려면 이소프로필 β-D-1-티오갈락토피라노사이드(IPTG)를 최대 20μg/mL(84μM)의 최종 농도로 추가합니다( 재료 표 참조). 재조합 단백질 발현의 유도는 소포 생산을 위한 후기 로그 단계(즉, 0.8-1.0의 전형적인OD600 )에서 발생해야 합니다.
참고: 유도 기간의 길이는 단백질마다 다를 수 있으며, 일부는 4시간에 최대 생산에 도달하고 다른 일부는 하룻밤(18시간)에 도달할 수 있습니다. 현재까지, 최대 소포 수출은 하룻밤 배양에서 얻어졌다.
3. 재조합 소포 분리
- 세포를 3,000 x g (4°C)에서 20분 동안 원심분리하여 펠렛화한다.
- 장기 보관을 위해 소포 함유 배지를 멸균하려면 세척된 배양 배지를 멸균되고 세제가 없는 0.45μm 폴리에테르설폰(PES) 필터를 통과시킵니다( 재료 표 참조).
참고: 소포 함유 여과액에서 생존 세포의 배제를 테스트하기 위해 LB 한천에 플레이트를 넣고 37°C에서 밤새 배양합니다. - 소포를 더 작은 부피로 농축하려면 멸균 및 세제가 없는 0.1μm 혼합 셀룰로오스 에스테르(MCE) 필터를 통해 멸균 소포 함유 배지를 통과시킵니다( 재료 표 참조).
- 세포 스크레이퍼 또는 플라스틱 스프레더를 사용하여 0.5-1mL의 멸균 PBS로 멤브레인을 부드럽게 세척하여 멤브레인에서 소포를 조심스럽게 제거합니다. 새 마이크로퍼지 튜브로 옮깁니다.
참고: 정제된 소포는 4°C에서 멸균 배지 또는 인산염 완충 식염수(PBS)에 보관할 수 있습니다. 이러한 방식으로 효소 활성의 손실 없이 이러한 소포에 6개월 동안 저장된 재조합 단백질의 예가 있습니다.
4. 분리된 소포에서 가용성 단백질 방출
- 단백질 함유 소포가 멸균 배지/완충액으로 분리되면 소포 지질막을 장치에 대한 적절한 일정(예: 6x 20초 켜기 및 끄기 주기)을 사용하여 초음파 처리하고 39,000 x g (4°C)에서 20분 동안 원심분리하여 소포 파편을 제거합니다.
참고: 삼투압 쇼크 또는 세제 처리는 소포를 부수는 대안으로 사용할 수 있지만 단백질 기능 및/또는 다운스트림 적용에 미치는 영향을 고려해야 합니다. - VNp 융합이 세포질로 남아 있고 배지로 방출되지 않는 경우 표준 프로토콜을 사용하여 단백질을 분리합니다(예: 적절한 추출 완충액(20mM 트리스, 500mM NaCl) 5mL에 세포 펠릿을 재현탁하고 초음파 처리하고 원심분리로 세포 파편을 제거합니다).
5. 단백질 농도 결정
- 삼중 샘플의 겔 밀도 분석에 의한 단백질 농도 결정1. coomassie-stained sodium dodecyl-sulfate polyacrylamide gel electrophoresis(SDS-PAGE) 젤에서 소 혈청 알부민(BSA) 로딩 표준물질과 함께 실행합니다. 적절한 소프트웨어(예: 이미지 J, 재료 표 참조)를 사용하여 젤을 스캔하고 분석합니다.
6. 형광 현미경에 의한 소포 형성 및 분리된 소포의 시각화
참고: 세포에 형광 표지된 VNp 융합 또는 막 마커가 포함된 경우 생세포 이미징을 사용하여 소포 형성을 추적할 수 있습니다. 대안적으로, 형광 지질 염료를 사용하여 소포를 시각화하여 생산 및 정제를 확인할 수 있습니다.
- 셀 마운팅
- 커버슬립에 장착하기 전에 몇 시간 동안 VNp 융합 발현을 유도합니다.
- 아가로스 패드 방법 (도 3A-C): 세포를 얇은 (<1 mm) 원형 LB-아가로스 (2%) 패드 상에 피펫팅하고, 깨끗한 유리 슬라이드 상에 세팅하였다. 세포가 안정되고 평형을 이루도록 하고 50mm x 25mm 커버슬립을 패드와 세포에 놓습니다. 스페이서와 접착 테이프로 커버슬립을 제자리에 고정합니다.
- 폴리에틸렌이민(PEI) 방법(그림 3D-F): 0.05% PEI(dH 2O 단위) 20μL를 피펫 팁이 있는 커버슬립에 펴 바르고 건조시키지 않고 유리에 결합하도록 3-5분 동안 그대로 둡니다. 세포 배양액 50 μL를 넣고 5-10분 동안 그대로 두어 박테리아가 PEI 코팅 표면과 연관되도록 합니다4. 커버슬립을 슬라이드에 놓기 전에 100μL의 미디어로 세척하고 스페이서와 접착 테이프로 제자리에 고정합니다.
- 소포 장착
- 정제된 소포를 얇은(<1mm) 원형 LB-아가로스(2%) 패드에 피펫팅하여 깨끗한 유리 슬라이드에 형성하고 고정합니다. 액체가 건조되면 50mm x 25mm 커버슬립을 패드와 소포에 놓습니다. 스페이서와 접착 테이프로 커버슬립을 제자리에 고정합니다.
- 형광 지질 염료 FM4-64는 멤브레인5를 염색 할 수 있으므로 소포를 시각화하는 데 사용할 수 있습니다. FM4-64( 재료 표 참조)를 2μM의 최종 농도(디메틸 설폭사이드[DMSO]에 용해된 2mM 스톡에서)로 정제된 소포에 추가하고 10분 배양 후 이미지를 생성합니다. 이는 형광 표지화물이 아닌 5개를 함유하는 소포체를 확인하는데 특히 유용하다.
- 관찰된 세포를 배양하는 데 사용된 것과 동일한 매체로 커버슬립을 헹굽니다.
참고: 일부 복잡한 배지(예: TB)는 자가형광을 나타낼 수 있으며, 이로 인해 과도한 배경 신호가 발생할 수 있습니다.
- 이미징 소포
참고: VNp 재조합 소포의 현미경 이미지 예는 그림 4에서 볼 수 있습니다.- 오일 이멀젼 대물렌즈를 사용하여 도립 현미경( 재료 표 참조)에 슬라이드를 장착하고 샘플이 가라앉고 온도가 평형을 이룰 수 있도록 2-3분 동안 그대로 둡니다.
알림: 각 샘플에 대한 모든 라이브 셀 이미징은 광독성 및 혐기성 스트레스의 영향을 최소화하기 위해 커버슬립에 셀을 장착한 후 30분 이내에 완료되어야 합니다. 이러한 이유로 단일 평면 이미지가 z-스택보다 선호됩니다. - 사용 중인 형광 단백질/염료에 대한 적절한 광원(예: 발광 다이오드[LED] 또는 할로겐 전구; 재료 표 참조)과 필터 조합을 사용하십시오6.
- 고배율(즉, 100x 또는 150x) 및 높은 개구수(즉, NA≥1.4) 렌즈를 사용하여 미생물 세포 및 소포를 이미징합니다.
- 세포 및/또는 소포에서 형광 신호를 시각화하는 데 필요한 최소 광도를 결정합니다. 이를 위해서는 사용 중인 카메라의 노출 및 게인 설정을 약간 조정해야 할 수 있습니다.
참고: 현재 CMOS(Complementary Metal-Oxide Semiconductor) 카메라의 일반적인 노출 시간은 이미징 시스템에 따라 50-200ms 사이입니다. - 단일 프레임 이미지의 경우 3개 이미지 평균화를 사용하여 하드웨어에 종속된 임의 배경 노이즈를 줄입니다.
- 타임랩스 이미징의 경우 개별 프레임 사이에 3-5분의 간격을 두십시오.
참고: 현미경 설정에 따라 더 긴 타임랩스 실험에서 초점을 간헐적으로 조정해야 할 수도 있습니다.
- 오일 이멀젼 대물렌즈를 사용하여 도립 현미경( 재료 표 참조)에 슬라이드를 장착하고 샘플이 가라앉고 온도가 평형을 이룰 수 있도록 2-3분 동안 그대로 둡니다.
결과
BL21 DE3 VNp6-mNeongreen 발현 작제물을 함유하는 대장균은 후기 로그 상으로 성장하였다(도 2A). 배양물에 IPTG를 첨가하여 VNp6-mNeongreen 발현을 유도하고(20μg/mL 또는 84μM 최종 농도), 이어서 격렬한 진탕(200rpm, ≥25mm 오비탈 스로우)과 함께 37°C에서 밤새 성장하도록 방치했습니다. 다음날 아침, 배양액은 mNeongreen 형광7 (그림 2B)을 나타 냈으며, 원심 분리로 박테리아 세포를 제거한 후에도 배지에서 볼 수있었습니다 (그림 2C). 배양 및 투명화된 배양 배지 내에서 VNp-mNeongreen의 존재를 SDS-PAGE로 확인했습니다(그림 2D). mNeongreen 함유 소포를 0.1μm MCE 필터(그림 2E)에서 분리하고 PBS(그림 2F)에 재현탁했습니다. 정제된 소포를 후속적으로 아가로스 패드(도 3A-C)에 장착하고, 광시야 형광 현미경(도 4A)을 사용하여 이미지화하였다. 소포 막의 존재는 친유성 형광 염료 FM4-64를 사용하여 확인되었습니다(그림 4B). mNeongreen(녹색) 및 VNp6-mCherry2(자홍색)8에 융합된 내막 단백질 CydB를 발현하는 대장균 세포는 살아있는 박테리아 세포에서 소포 생산 및 화물 삽입을 보여줍니다(그림 4C). 그림 4A,B는 광시야 형광 현미경을 사용하여 캡처한 반면, 그림 4C는 이전에 설명한 방법 9,10을 사용하여 구조화된 조명 현미경(SIM)을 사용하여 캡처했습니다.
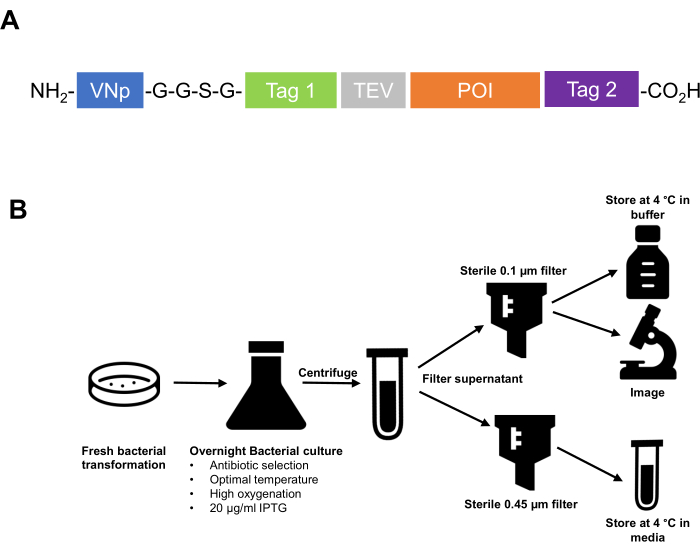
그림 1: 복제 전략 설계부터 세포외 소포체의 정제 및 보관에 이르는 VNp 기술 요약. (A) 전형적인 VNp 융합 단백질의 개략도. NH2 말단의 VNp, 유연한 링커와 친화성 및 형광 태그(Tag1, 태그 2, 프로테아제 절단 부위[예: TEV]) 및 관심 단백질의 적절한 조합이 뒤따릅니다. (B) 대장균에서 재조합 단백질로 채워진 막 소포의 발현 및 정제를 위한 프로토콜을 요약한 개략도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
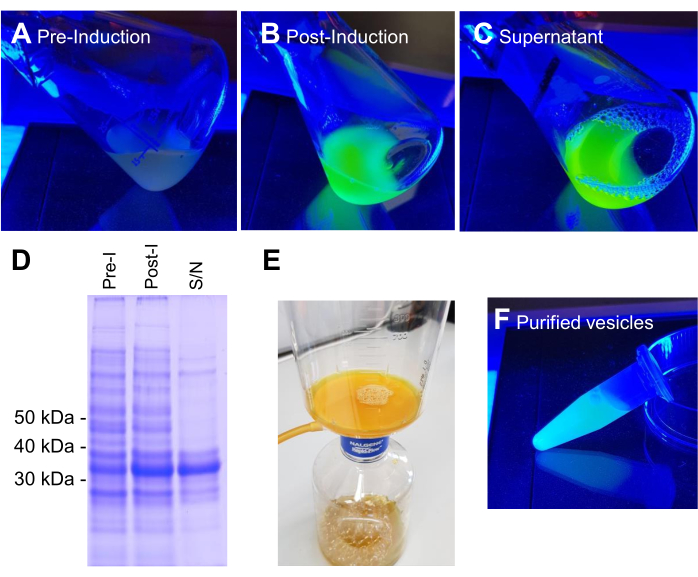
그림 2: VNp6-mNg 소포의 생산 및 정제 단계. VNp-mNeongreen 발현 구조체를 포함하는 대장균 세포를 청색광에서 배양하여 융합 단백질의 IPTG 유도 발현 전(A) 또는 후(B)에 배양합니다. (B)로부터의 세포는 원심분리에 의해 제거되었고, 배지 (C)에 VNp-mNeongreen-채워진 소포를 남겼다. (D) A, B, 및 C 로부터의 등가 샘플을 SDS-PAGE 및 쿠마시 염색에 의해 분석하였다. 소포를 0.1μm 필터(E)로 분리한 후 적절한 부피의 완충액(F)으로 세척했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
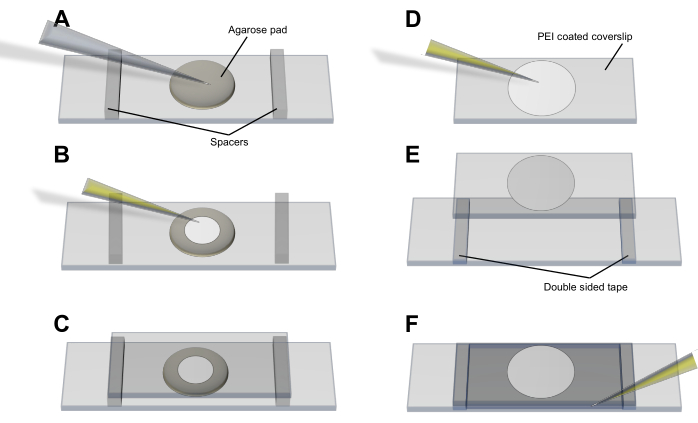
그림 3: 이미징 소포 및 소포 생산을 위한 세포 장착 절차. (A-C) 아가로스 패드 방법 및 (D-F) 대장균 세포를 커버슬립에 장착하기 위한 PEI 방법. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
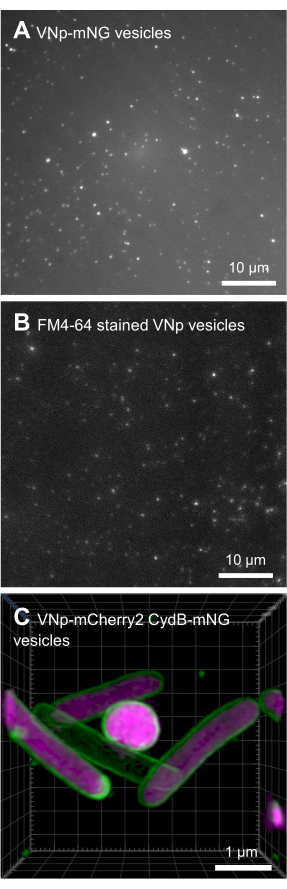
그림 4: VNp 재조합 소포의 현미경 이미지. 아가로스 패드에 장착된 FM4-64 표지 VNp6-mNeongreen 함유 소포의 서로 다른 필드에서 나온 녹색(A) 및 빨간색(B) 방출 이미지. (C) mNeongreen(녹색) 및 VNp6-mCherry2(자홍색)에 융합된 내막 단백질 CydB를 발현하는 대장균 세포 이미징은 살아있는 박테리아 세포에서 소포 생산 및 화물 삽입을 보여줍니다. (A, B)는 광시야 형광 현미경을 사용하여 이미지화하고 (C)는 구조화 된 조명 현미경 (SIM)을 사용하여 획득했습니다. 스케일 바: (A,B) = 10 μm; (C) = 1 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
상술한 재조합 단백질의 생산을 위한 아미노-말단 펩티드-태깅된 방법은 수개월 동안 효율적으로 분리 및/또는 저장될 수 있는 다량의 단백질을 일관되게 산출하는 간단한 과정이다.
이 시스템을 최적으로 사용하는 데 필요한 프로토콜의 주요 단계를 강조하는 것이 중요합니다. 첫째, VNp 태그1 은 N-말단에 위치해야 하며, 그 뒤에 관심 단백질과 적절한 태그가 있어야 합니다. 암피실린과 같은 펩티도글리칸 층을 표적으로 하는 항생제 사용을 피하는 것도 중요합니다.
성장 조건 측면에서 풍부한 배지(예: LB 또는 TB 배지)와 높은 표면적:부피 비율은 소포 생산을 최대화하는 데 필요합니다. 세포밖 소포체 생산을 위한 최적 온도는 37°C이지만 일반적으로 관심 단백질의 발현에 필요한 조건도 고려해야 합니다. 낮은 유도 온도의 경우 VNp6을 사용해야 합니다. 결정적으로, T7 프로모터의 유도는 세포가 0.8-1.0의 OD600에 도달하면 20μg /mL(84μM) 이하의 IPTG를 사용하여 달성되어야 합니다. 시스템을 사용하여 발현된 단백질은 4시간 또는 하룻밤 유도 후 최대 소포 생산에 도달합니다.
이 프로토콜의 단순성에도 불구하고 최적화가 필요합니다. VNp 변이체 융합, 발현 온도 및 유도 기간은 관심 단백질에 따라 다를 수 있습니다. 또한, 배지로부터 세포외 소포체의 정제 및 후속 농도를 최적화할 필요가 있다. 현재 절차는 확장 가능하지 않으며 시간이 오래 걸릴 수 있습니다. 이것이 이 방법론의 한계입니다.
VNp 기술은 기존 방법에 비해 많은 장점이 있습니다2. 이를 통해 다양한 단백질의 소포 수출이 가능하며, 현재까지 성공적으로 발현된 최대 크기는 내부에 남아 있는 소포의 경우 175kDa, 수출되는 소포의 경우 85kDa입니다. 또한, 이 기술은 다양한 물리적 특성과 활성을 가진 재조합 단백질의 수율을 크게 증가시킬 수 있습니다. 관심 단백질을 함유한 수출된 소포는 사전 세척된 배지에서 간단한 여과로 분리할 수 있으며, 이후 멸균 배양 배지 또는 완충액에 4°C에서 몇 개월 동안 보관할 수 있습니다.
이 시스템의 응용 분야는 발견 과학에서 응용 생명 공학 및 의학(예: 기능성 치료제 생산을 통해)에 이르기까지 다양합니다3. 생산의 용이성, 다운스트림 가공 및 높은 수율은 모두 이 분야, 특히 산업에서 매력적인 특성입니다.
공개
저자는 경쟁적인 재정적 이익이나 기타 이해 상충을 선언하지 않습니다.
감사의 말
저자는 VNp 기술을 설명하는 논문에 제시된 프로토콜에 대해 질문을 제기 한 다양한 트위터 사용자에게 감사드립니다. 그림 1A 는 flaticon.com 의 아이콘을 사용하여 생성되었습니다. 이 연구는 켄트 대학교의 지원과 생명 공학 및 생물 과학 연구 위원회(BB/T008/768/1 및 BB/S005544/1)의 자금 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Ampicillin | Melford | 69-52-3 | |
| Chloramphenicol | Acros Organics (Thermofisher Scientific) | 56-75-7 | |
| E. coli BL21 (DE3) | Lab Stock | N/A | |
| E. coli DH10β | Lab Stock | N/A | |
| Filters for microscope | Chroma | ||
| FM4-64 | Molecular Probes (Invitrogen) | T-3166 | Dissolved in DMSO, stock concentration 2 mM |
| ImageJ | Open Source | Downloaded from: https://imagej.net/ij/index.html | |
| Inverted microscope | Olympus | ||
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Melford | 367-93-1 | |
| Kanamycin sulphate | Gibco (Thermofisher Scientific) | 11815-024 | |
| LED light source for micrscope | Cairn Research Ltd | ||
| Lysogeny Broth (LB) / LB agar | Lab Stock | N/A | 10 g/L Tryptone; 10 g/L NaCl; 5 g/L Yeast Extract (1.5 g/L agar) |
| Metamorph imaging software | Molecular Devices | ||
| MF-Millipore Membrane filter (0.1 µm, MCE) | Merck | VCWP04700 | |
| Millipore Express PLUS membrane filter (0.45 µm, PES) | Merck | HPWP04700 | |
| Phosphate buffered saline (PBS) | Lab Stock | N/A | |
| Plasmids allowing expression of protein of interest with different VNp amino terminal fusions | Addgene | https://www.addgene.org/Dan_Mulvihill/ | |
| Terrific Broth (TB) | Lab Stock | N/A | 12 g/L Tryptone; 24 g/L Yeast Extract; 4 ml/L 10% glycerol; 17 mM KH2PO4 72 mM K2HPO4 |
참고문헌
- Eastwood, T. A., et al. High-yield vesicle-packaged recombinant protein production from E. coli. Cell Reports Methods. 3 (2), 100396 (2023).
- Makino, T., Skretas, G., Georgiou, G. Strain engineering for improved expression of recombinant proteins in bacteria. Microbial Cell Factories. 10, 32 (2011).
- Peng, C., et al. Factors influencing recombinant protein secretion efficiency in gram-positive bacteria: Signal peptide and beyond. Frontiers in Bioengineering and Biotechnology. 7, 139 (2019).
- Lewis, K., Klibanov, A. M. Surpassing nature: rational design of sterile-surface materials. Trends in Biotechnology. 23 (7), 343-348 (2005).
- Betz, W. J., Mao, F., Smith, C. B. Imaging exocytosis and endocytosis. Current Opinion in Neurobiology. 6 (3), 365-371 (1996).
- Mulvihill, D. P. Live cell imaging in fission yeast. Cold Spring Harbor Protocols. 2017 (10), (2017).
- Shaner, N. C., et al. A bright monomeric green fluorescent protein derived from Branchiostoma lanceolatum. Nature Methods. 10 (5), 407-409 (2013).
- Shen, Y., Chen, Y., Wu, J., Shaner, N. C., Campbell, R. E. Engineering of mCherry variants with long Stokes shift, red-shifted fluorescence, and low cytotoxicity. PloS One. 12 (2), e0171257 (2017).
- Periz, J., et al. A highly dynamic F-actin network regulates transport and recycling of micronemes in Toxoplasma gondii vacuoles. Nature Communications. 10 (1), 4183 (2019).
- Qiu, H., et al. Uniform patchy and hollow rectangular platelet micelles from crystallizable polymer blends. Science. 352 (6286), 697-701 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유