A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تم قياس إنتاج الجلوكوز الكبدي وتكوين اليوريا وتحلل الدهون باستخدام نموذج كبد الفأر المنحرف
In This Article
Summary
هنا ، نقدم طريقة قوية للتروية الموضعية لكبد الفأر لدراسة التنظيم الحاد والمباشر لعملية التمثيل الغذائي للكبد دون الإخلال بالبنية الكبدية ولكن في حالة عدم وجود عوامل خارج الكبد.
Abstract
الكبد له وظائف عديدة ، بما في ذلك التمثيل الغذائي للمغذيات. على عكس النماذج الأخرى في المختبر وفي الجسم الحي لأبحاث الكبد ، يسمح الكبد المعزول بدراسة بيولوجيا الكبد والتمثيل الغذائي في الكبد كله ببنية كبدية سليمة ، مفصولة عن تأثير العوامل خارج الكبد. تم تطوير نضح الكبد في الأصل للفئران ، ولكن تم تكييف الطريقة مع الفئران أيضا. هنا نصف بروتوكول التروية في الموقع من كبد الفأر. يتم اختراق الكبد مسبقا عبر الوريد البابي باستخدام عازل بيكربونات كريبس-هنسليت المؤكسج ، ويتم جمع الإخراج من الوريد الأجوف السفلي فوق الكبدي مع تثبيت الوريد الأجوف السفلي تحت الكبدي لإغلاق الدائرة. باستخدام هذه الطريقة ، يمكن تقييم التأثيرات الكبدية المباشرة لمركب الاختبار بدقة زمنية مفصلة. وظائف الكبد وصلاحيتها مستقرة لمدة 3 ساعات على الأقل ، مما يسمح بإدراج الضوابط الداخلية في نفس التجربة. الاحتمالات التجريبية باستخدام هذا النموذج عديدة وقد تستنتج نظرة ثاقبة في فسيولوجيا الكبد وأمراض الكبد.
Introduction
الكبد هو عضو أساسي في عملية التمثيل الغذائي. يلعب دورا رئيسيا في التحكم في توازن طاقة الجسم بالكامل من خلال تنظيم استقلاب الجلوكوز والدهون والأحماض الأمينية. تبرز الزيادة في أمراض الكبد في جميع أنحاء العالم كعبء صحي عالمي كبير ، وهناك حاجة إلى مزيد من المعرفة حول الفيزيولوجيا المرضية وعواقبها على وظائف الكبد.
تم تطوير نماذج مختلفة في المختبر للبحث في الكبد لاستكمال الدراسات في الجسم الحي. تستخدم على نطاق واسع خلايا الكبد الأولية المعزولة والمستزرعة من القوارض والبشر. يمكن فصل الخلايا غير المتنية عن خلايا الكبد باستخدام الطرد المركزي التفاضلي والمتدرج ، كما أن الثقافة المشتركة لأنواع الخلايا المختلفة مفيدة لدراسة الحديث المتبادل بين الخلايا1. على الرغم من أن خلايا الكبد البشرية الأولية تعتبر المعيار الذهبي لاختبار سمية الدواء ، فقد أظهرت العديد من الدراسات أن خلايا الكبد تتمايز بسرعة في زراعة الأنسجة مما يؤدي إلى فقدان وظائف الكبد2،3،4. تعمل ثقافة خلايا الكبد في نظام كروي ثلاثي الأبعاد على تحسين عدم التمايز ، وهي أكثر استقرارا ، ويبدو أنها تحاكي الكبد في الجسم الحي بدرجة أعلى من أنظمة الثقافة 2D التقليدية5. شرائح الكبد المقطوعة بدقة هي نموذج آخر راسخ في المختبر يحافظ على بنية الأنسجة سليمة ويحتوي على الخلايا غير المتنية الموجودة في الكبد6. تشمل النماذج الأكثر تقدما في المختبر الكبد على رقاقة7 وعضويات الكبد8. ومع ذلك ، مع كل هذه الأساليب ، هناك فقدان للسلامة الهيكلية وديناميكيات التدفق ، بما في ذلك تدفق الوريد البابي الكبدي المتجه ، والذي من المحتمل أن يؤثر على قابلية التعميم.
تم وصف كبد الفئران المعزول لأول مرة من قبل كلود برنارد في عام 18559 ، ولا يزال يستخدم في مختلف المجالات العلمية لدراسات بيولوجيا الكبد وعلم السموم والفيزيولوجيا المرضية. تشمل مزايا الكبد المثقوب مقارنة بالنماذج المختبرية المذكورة أعلاه الحفاظ على البنية الكبدية ، وتدفق الأوعية الدموية ، وقطبية خلايا الكبد وتقسيم المناطق ، والتفاعلات بين خلايا الكبد والخلايا غير المتنية. بالمقارنة مع الدراسات في الجسم الحي ، يسمح الكبد المثقوب بدراسة استقلاب الكبد بطريقة معزولة لتجنب العوامل الكبدية الإضافية التي يحملها الدم مع التحكم الكامل في الظروف التجريبية. تم إجراء العديد من التعديلات لتحسين نموذج نضح كبد الفئران على مر السنين10،11،12،13. على الرغم من استخدام الفئران لدراسات الكبد المعزولة ، إلا أن الأدبيات المتاحة أقل. هنا ، نقدم طريقة للتروية في الموقع لكبد الفأر عن طريق قنية الوريد البابي والوريد الأجوف فوق الكبدي السفلي لدراسة الاستجابات الأيضية الحادة والمباشرة للركائز والهرمونات الأيضية كما تم قياسها في النفايات السائلة الوريدية الكبدية من كبد الفأر في الوقت الفعلي.
Access restricted. Please log in or start a trial to view this content.
Protocol
أجريت جميع التجارب على بإذن من مفتشية التجارب الحيوانية الدنماركية ، ووزارة البيئة والأغذية في الدنمارك (تصريح 2018-15-0201-01397) ، ولجنة الأخلاقيات المحلية وفقا لتوجيه الاتحاد الأوروبي 2010/63 / EU ، والمعاهد الوطنية للصحة (المنشور رقم 85-3) واتباع المبادئ التوجيهية للتشريعات الدنماركية التي تحكم التجارب على (1987). هذا إجراء نهائي ، وسبب الوفاة هو استنزاف وانثقاب الحجاب الحاجز تحت التخدير العميق.
1. التجارب
- الحصول على الفئران من السلالة المطلوبة والعمر والجنس. استخدمت هذه الدراسة ذكور الفئران C57BL / 6JRj الذين تتراوح أعمارهم بين 11-16 أسبوعا. إيواء ما يصل إلى 5 ذكور أو 8 إناث من الفئران لكل قفص مع إمكانية الوصول إلى الطعام والماء والحفاظ على دورة 12 ساعة / 12 ساعة من الضوء والظلام مع إضاءة الأضواء من الساعة 6 صباحا حتى 6 مساء.
2. الاستعدادات قبل الجراحة
- جعل التروية الكبد عازلة.
- كريبس-هنسليت عازلة. امزج وأذب 118 ملليمول/لتر كلوريد الصوديوم، و4.7 ملليمول/لتر كيلوجرام، و1.2 ملليمول/لتر مغسو 4، و1.2 ملليمول/لتر KH 2 PO4 في dH2O.قم بإذابة 1.25 ملليمول/لتر CaCl2 في دورق منفصل وأضف المخزن المؤقت.
- قم بإذابة 25 مليمول / لتر NaHCO3 وأضفه ببطء إلى المخزن المؤقت مع التحريك. قم بتخزين المخزن المؤقت في 4 درجات. المخزن المؤقت مستقر لمدة 1 شهر على الأقل.
ملاحظة: قد يحدث هطول الأمطار إذا لم يتم إذابة CaCl2 و NaHCO3 بشكل فردي قبل إضافتهما.
- قم بتصفية المخزن المؤقت للتروية من خلال مرشح 2 ميكرومتر واضبط الأس الهيدروجيني على 7.5 باستخدام حمض الهيدروكلوريك.
ملاحظة: يجب تنفيذ هذه الخطوة في اليوم التجريبي ، حيث يزداد الرقم الهيدروجيني بمرور الوقت ، حتى عند تخزينه في قوارير مغلقة. - تحضير مركبات الاختبار بتركيز أعلى من التركيز النهائي المطلوب (على سبيل المثال ، تركيز 20x عند غرسه بمعدل 0.175 مل / دقيقة عبر مضخة ذراع جانبية) في مخزن كروب هنسليت للتروية المصفى والمعدل حسب الأس الهيدروجيني. إذا كان ذلك مناسبا ، قم بتخفيف مركبات الاختبار في المخزن المؤقت للتروية Krebs-Henseleit مع إضافة 1٪ BSA كحامل (لتجنب الالتصاق بالأنابيب والأواني الزجاجية ، الضرورية لجميع الببتيدات) ، والتي تمت تصفيتها من خلال مرشح الحجم المناسب.
3. العملية والتروية
ملاحظة: يرد توضيح لإعداد التروية المستخدم في هذه الدراسة في الشكل 1.
- غاز مخزن التروية المؤقت (95٪ O 2 ، 5٪ CO2) لمدة 30 دقيقة على الأقل لتزويد الكبد بالأكسجين الكافي والحفاظ على الرقم الهيدروجيني الصحيح من بداية العملية (سيصل نظام عازلة البيكربونات إلى درجة حموضة 7.4 تحت الغاز المستمر ، انظر الشكل التكميلي 1).
- تخدير الفأر عن طريق إعطاء الكيتامين (90 ملغ/كغ) والزيلازين (10 ملغ/كغ) عن طريق الحقن داخل الصفاق.
- ضع الماوس مستلقيا على طاولة تشغيل ساخنة وتأكد من عدم وجود ردود فعل استجابة لقرص إصبع القدم. رش بالإيثانول بنسبة 70٪ لمنع الشعر من الالتصاق بالمقص. يساعد تثبيت الماوس على السطح الدافئ على زيادة الاستقرار للإجراءات التالية.
- قم بعمل شق بمقص في قاعدة البطن وقطعه لأعلى إلى القفص الصدري على كلا الجانبين لفضح تجويف البطن. حرك الأمعاء إلى اليمين باستخدام قطعة قطن ، وفضح الوريد البابي.
- ضع رباطين تحت الوريد البابي باستخدام ملقط منحني وقم بإعداد عقدة فضفاضة لكل رباط.
- أدخل قسطرة 0.7 مم في الوريد البابي. عند الانثقاب، أخرج المؤشر من القسطرة ووجه القسطرة عبر الوريد حتى يصبح طرف القسطرة قريبا من الكبد، كما هو موضح في الشكل 2. يتدفق الدم إلى القسطرة.
- تشديد الأربطة. إذا لم تكن القسطرة مملوءة بالدم ، فاملأها بمخزن التروية لتجنب إدخال فقاعة هواء.
- قم بتوصيل أنبوب التروية وابدأ نضح الكبد باستخدام عازل بيكربونات كريبس هينسليت عند 37 درجة مئوية عن طريق بدء تشغيل مضخة الأسطوانة بمعدل تدفق تروية يبلغ 0.8 مل / دقيقة. يتحول الكبد إلى شاحب في غضون ثوان.
- قطع القفص الصدري والحجاب الحاجز باستخدام مقص. عند هذه النقطة ، يتم القتل الرحيم للحيوان. ضع الرباط تحت الوريد الأجوف السفلي فوق الكبدي باستخدام ملقط نقطة دقيقة. ضع قلما أو شاشا ملفوفا أو أي عنصر آخر يمكن التخلص منه أسفل الجزء الخلفي من الماوس لتسهيل الوصول إلى الوريد.
- أدخل قسطرة في الوريد الأجوف السفلي فوق الكبدي عبر الأذين الأيمن للقلب. عند ثقبها ، قم بإزالة الإبرة من القسطرة وتوجيه القسطرة عبر الوريد حتى يصبح طرف القسطرة قريبا من الكبد. ينفد الدم والتروية العازلة على الفور.
- شد الرباط وأرفق أنبوبا لجمع النفايات السائلة النضوية. قم بتأمين جميع الأنابيب بشريط مقاوم للماء (شريط أملس أو ما شابه).
- استخدم محول مشبك الوعاء لوضع مشبك وعاء عبر الوريد الأجوف تحت الكبدي مباشرة فوق الوريد الكلوي الأيمن لمنع الاختلاط (الشكل 2).
- قم بزيادة معدل تدفق التروية إلى 3.5 مل / دقيقة وابدأ مؤقتا. ابدأ تسجيل الضغط. عادة ما يؤدي التروية الناجحة إلى ضغط ~ 10 مم / زئبق.
- غطي الكبد بستارة معقمة مبللة بالمحلول الملحي وأضيفي محلول ملحي أثناء التجربة لمنعه من الجفاف.
- اجمع نفايات التروية السائلة لمدة 1 دقيقة وقم بقياس الحجم. يجب أن يكون الحجم حوالي 3.5 مل / دقيقة. لا يتوقع اختلاط الدم في هذه المرحلة ، ولا يضخ القلب بعد الآن.
- انتظر فترة توازن مدتها 30 دقيقة قبل بدء التجربة.
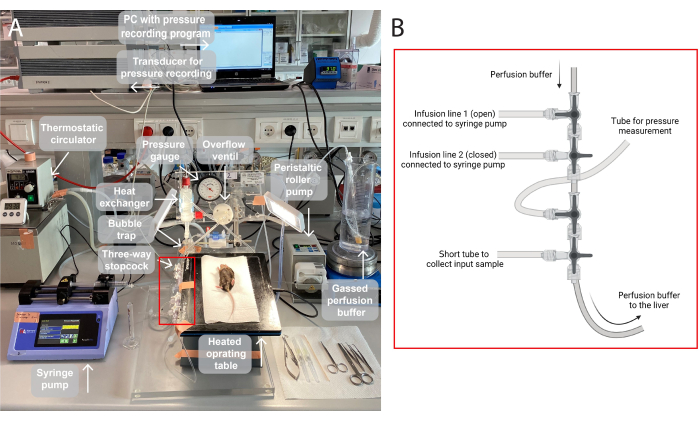
الشكل 1: رسم توضيحي لإعداد التروية. ( أ) ترفع طاولة العمليات على حامل ثلاثي القوائم وتسخن إلى 37 درجة مئوية. يتم ضخ محلول التروية بالغاز (95٪ O 2 ، 5٪ CO2) ، ويتم ضخه عبر مضخة أسطوانية تمعجية ، ويتم تسخينه في المبادل الحراري باستخدام مصيدة فقاعات مدمجة. علاوة على ذلك ، يتكون النظام من مقياس ضغط ومضخة مغزل لتعديل ضغط التروية. يتم تسجيل ضغط التروية وتصوره باستمرار عبر محول طاقة على جهاز كمبيوتر ، وهو برنامج تسجيل الضغط. (ب) يلتقط الصندوق الأحمر وصلات محبس ثلاثي الاتجاهات. أول محبس ثلاثي الاتجاهات مفتوح لضخ مركب اختبار عبر مضخة حقنة ، والثاني مغلق. والثالث مفتوح لقياسات الضغط المستمر. يمكن استخدام المحبس الرابع لجمع عينات المدخلات ، على سبيل المثال ، تحليل الغاز عبر الكبد المثقوب. يمكن تعديل الموصلات حسب الحاجة لتجارب محددة تتطلب خطوط تسريب أكثر أو أقل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
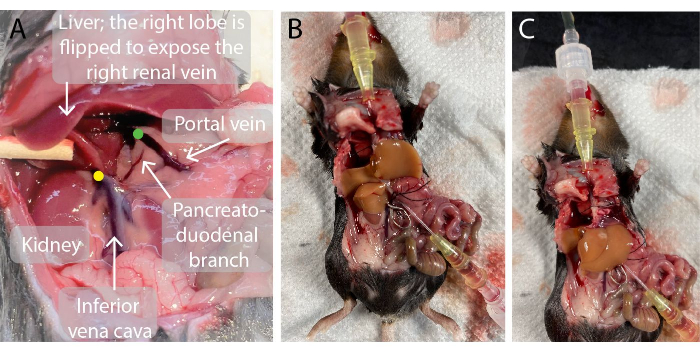
الشكل 2: صور تجويف بطن الفأر قبل التروية الكبدية وأثناءها. (أ) تشير النقطة الخضراء إلى موقع طرف قسطرة الوريد البابي. من المهم أن يتم وضع طرف القسطرة أسفل نقطة التفرع من الوريد البابي مباشرة في الأوردة البابية الكبدية اليسرى واليمنى ولكن فوق فرع البنكرياس والاثني عشر لتجنب التسرب. تشير النقطة الصفراء إلى الموقع الصحيح لمشبك الوعاء الدموي على الوريد الأجوف السفلي تحت الكبدي بين الوريد الكلوي الأيمن والكبد لتجنب ارتجاع الدم إلى الكبد المثقوب. (ب، ج) كبد فأر معطر مع قسطرين يتم إدخالهما في الوريد البابي (B) والوريد الأجوف السفلي فوق الكبدي (C) ومشبك الوعاء على الوريد الأجوف السفلي تحت الكبدي (B). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. التجربة
- ابدأ التجربة بجمع عينات خط الأساس الأولى باستخدام جامع الكسور في نهاية فترة التوازن. اجمع العينات في الفاصل الزمني المطلوب وضعها على الجليد على الفور.
- تحقق من مصيدة الفقاعات بانتظام وأعد تعبئتها بمخزن التروية المؤقت عندما تكون قريبة من الفراغ.
- اجمع عينة من المخزن المؤقت من خلال محبس ثلاثي الاتجاهات مباشرة قبل دخوله إلى العضو ومن القسطرة الجامعة التي يتم إدخالها في الوريد الأجوف السفلي (بعد أن يتم اختراقها عبر الكبد).
- قم بقياس العينات باستخدام محلل غازات الدم للتأكد من أن العضو نشط في التمثيل الغذائي (يشار إليه بزيادة الضغط الجزئي لثاني أكسيد الكربون2 وانخفاض في درجة الحموضة).
- كرر الخطوات 4.3-4.4 في نهاية التجربة لتقييم الجدوى طوال التجربة (الشكل التكميلي 2).
ملاحظة: لا يوفر انخفاض الضغط الجزئي للأكسجين مقياسا موثوقا للتنفس بسبب فقدان الأكسجين من الأنابيب والعضو وما إلى ذلك. - بعد 15 دقيقة من التروية الأساسية، ابدأ التحفيز الأول عن طريق غرس مادة اختبار من خلال محبس ثلاثي الاتجاهات بمعدل التدفق المطلوب باستخدام مضخة حقنة (على سبيل المثال، تركيز 20 ضعفا من مادة الاختبار عند غرسها بمعدل 0.175 مل/دقيقة عبر مضخة ذراع جانبية). بدلا من ذلك ، قم بتبديل المخزن المؤقت الأساسي إلى مخزن مؤقت جديد (مؤكسج ومسخن) يحتوي على مركب الاختبار في التركيز النهائي.
- أوقف التحفيز واجمع عينات خط الأساس لمدة 20-30 دقيقة قبل بدء التحفيز الثاني.
- في نهاية التجربة ، قم ببث عنصر تحكم إيجابي مناسب لمدة 5-10 دقائق.
- بعد التجربة ، قم باستئصال الكبد المثقوب ووزنه لتطبيع الناتج إلى وزن الكبد. قم بتجميد الكبد في النيتروجين السائل للقياس المحتمل لمحتوى البروتين لتطبيع الناتج إلى محتوى البروتين.
5. القياسات البيوكيميائية
- تحديد تركيز الجزيء محل الاهتمام باستخدام المقايسات المناسبة للقياسات في محلول التروية (مقايسات القياس اللوني أو ELISA الداخلية أو المتاحة تجاريا). المخزن المؤقت متوافق مع معظم التقنيات القائمة على omics مثل الأيض والبروتينات.
ملاحظة: في هذه الدراسة ، تم قياس اليوريا بناء على مقايسة لونية موصوفة سابقا14. تم قياس كمية الجلوكوز والأحماض الدهنية غير الأسترية باستخدام مجموعات متاحة تجاريا.
6. تحليل البيانات
- اعرض البيانات في الرسوم البيانية XY التي توضح الإخراج الإفرازي بمرور الوقت.
ملاحظة: من مزايا نظام التروية في المختبر أنه من الممكن التعبير عن البيانات كناتج فعلي (التركيز × معدل التدفق ، على سبيل المثال ، ميكرومول / دقيقة) بدلا من التركيز المقاس في الناتج (مليمول / لتر) كما هو الحال في الدراسات في الجسم الحي . ضع في اعتبارك تطبيع الناتج إلى وزن الكبد عند مقارنة نماذج الفئران المختلفة أو بمحتوى البروتين الكلي (الذي تم قياسه بواسطة BCA) عند مقارنة الفئران الضابطة بنماذج الفئران المصابة بالسمنة أو أمراض الكبد حيث قد تكون الزيادة في وزن الكبد بسبب زيادة محتوى الدهون. - تقديم البيانات الموجزة كنقاط فردية لكل تمثل متوسط أو إجمالي الناتج خلال خط الأساس وخلال فترة التحفيز (عادة 15-30 دقيقة) أو ناتج إضافي باستخدام خط الأساس السابق لكل فترة تحفيز تعتمد على تصميم الدراسة.
- تحليل البيانات باستخدام اختبار t المقترن (مجموعتان) أو ANOVA أحادي الاتجاه مع التحفيز المتكرر (أكثر من مجموعتين) مع اختبار مناسب بعد مخصص للاختبار المتعدد.
Access restricted. Please log in or start a trial to view this content.
النتائج
مطلوب خط أساس ثابت لتحديد ما إذا كان المثير أو الركيزة يؤدي إلى إطلاق الجزيء محل الاهتمام. يوضح الشكل 3 أ مثالا على تجربة ناجحة. يتم قياس إنتاج اليوريا في الكبد المفعم بالثقب على فترات 2 دقيقة ويظهر كمتوسط ± SEM. فترات خط الأساس التي تسبق كل من فترتي التحفيز ث?...
Access restricted. Please log in or start a trial to view this content.
Discussion
يعد كبد الفأر المعزول أداة بحث قوية لدراسات الديناميات والآليات الجزيئية لعملية التمثيل الغذائي الكبدي. توفر إمكانية جمع العينات من دقيقة إلى دقيقة تقييما مفصلا للتأثير المباشر لمركب الاختبار على الكبد. بالمقارنة مع الدراسات في الجسم الحي ، يسمح لنا الكبد المثقوب بدراسة استقلاب الكبد ب?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
يعلن المؤلفون عدم وجود تضارب في المصالح ذات صلة بهذه المقالة.
Acknowledgements
تم دعم الدراسات ونيكولاي ج. وير ألبريشتسن من قبل منحة الباحث الناشئ المتميز لمؤسسة نوفو نورديسك - الغدد الصماء والتمثيل الغذائي (الطلب رقم. NNF19OC0055001) ، جائزة المؤسسة الأوروبية لدراسة مرض السكري في المستقبل (NNF21SA0072746) وصندوق البحوث المستقل الدنمارك ، Sapere Aude (1052-00003B). يتم دعم مركز مؤسسة نوفو نورديسك لأبحاث البروتين ماليا من قبل مؤسسة نوفو نورديسك (اتفاقية المنحة NNF14CC0001). تم إنشاء الشكل 1B باستخدام biorender.com. نشكر الدكتور رون إي كوهري (نوفو نورديسك إيه / إس) على المناقشات المثمرة حول كبد الفأر المثقوب.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 3-way stopcock | BD | 394601 | |
| Altromin breeding diet | Altromin Spezialfutter | 1319 | |
| Calcium chloride dihydrate (CaCl2·2H2O) | Sigma | C8106 | |
| Catheters (0.7 mm) | BD | 381812 | |
| Filter paper (pore size 2.0 µm) | Millipore | AP2029325 | |
| Glucose kit | QuantiChromTM | DIGL-100 | Low concentration protocol |
| Ketamine | MSD Animal Health | 511485 | 90 mg/kg |
| Ligature (black sterile silk) | Agnthos | 14739 | |
| Magnesium sulfate (MgSO4) | Sigma | 230391 | |
| Non-esterified fatty acids kit | Fujifilm Wako Chemicals | NEFA-HR(2) | |
| Operating table, heated on tripod stand, type 873 | Harvard Bioscience, Inc. | 733776 | |
| Potassium chloride (KCl) | Sigma | P9541 | |
| Potassium dihydrogen phosphate(KH2PO4) | Merck | 1.04877 | |
| Roller Pump, with four channels | Harvard Bioscience, Inc. | 730100 | |
| Sleek tape | Mediq danmark | 4001910 | |
| Sodium bicarbonate (NaHCO3) | Sigma | S5761 | |
| Sodium chloride (NaCl) | Sigma | S1679 | |
| Thermostatic Circulator | Harvard Bioscience, Inc. | 730125 | Bath Volume 3 L, 230 V/50 Hz |
| Tubing | Tygon | E3603 | Inner diameter 1.59 mm, outer diameter 3.18 mm |
| Universal perfusion system | Harvard Bioscience, Inc. | 732316 | Basic unit uniper UP-100, type 834 |
| Vamin | Fresenius Kabi | B05ABA01 | Mixed amino acids |
| Vessel clamp adaptor | Deutsche Biomedical | DBC1002 | |
| Vessel clamps | Deutsche Biomedical | DBC1005 | |
| Windkessel | Harvard Bioscience, Inc. | 732068 | |
| Xylazine | Rompun Vet | 530701 | 10 mg/kg |
References
- Bale, S. S., Geerts, S., Jindal, R., Yarmush, M. L. Isolation and co-culture of rat parenchymal and non-parenchymal liver cells to evaluate cellular interactions and response. Scientific Reports. 6, 25329(2016).
- Lauschke, V. M., et al. Massive rearrangements of cellular MicroRNA signatures are key drivers of hepatocyte dedifferentiation. Hepatology. 64 (5), 1743-1756 (2016).
- Seirup, M., et al. Rapid changes in chromatin structure during dedifferentiation of primary hepatocytes in vitro. Genomics. 114 (3), 110330(2022).
- Gupta, R., et al. Comparing in vitro human liver models to in vivo human liver using RNA-Seq. Archive of Toxicology. 95 (2), 573-589 (2021).
- Bell, C. C., et al. Characterization of primary human hepatocyte spheroids as a model system for drug-induced liver injury, liver function, and disease. Scientific Reports. 6, 25187(2016).
- Dewyse, L., Reynaert, H., van Grunsven, L. A. Best practices and progress in precision-cut liver slice cultures. International Journal of Molecular Sciences. 22 (13), 7137(2021).
- Li, X., George, S. M., Vernetti, L., Gough, A. H., Taylor, D. L. A glass-based, continuously zonated and vascularized human liver acinus microphysiological system (vLAMPS) designed for experimental modeling of diseases and ADME/TOX. Lab on a Chip. 18 (17), 2614-2631 (2018).
- Broutier, L., et al. Culture and establishment of self-renewing human and mouse adult liver and pancreas 3D organoids and their genetic manipulation. Nature Protocols. 11 (9), 1724-1743 (2016).
- Bartošek, I., Guaitani, A., Miller, L. L. Isolated Liver Perfusion and its Applications. , Raven Press. New York. (1973).
- Gores, G. J., Kost, L. J., LaRusso, N. F. The isolated perfused rat liver: conceptual and practical considerations. Hepatology. 6 (3), 511-517 (1986).
- Mischinger, H. J., et al. An improved technique for isolated perfusion of rat livers and an evaluation of perfusates. Journal of Surgical Research. 53 (2), 158-165 (1992).
- Vairetti, M., et al. Correlation between the liver temperature employed during machine perfusion and reperfusion damage: role of Ca2. Liver Transplantation. 14 (4), 494-503 (2008).
- Ferrigno, A., Richelmi, P., Vairetti, M. Troubleshooting and improving the mouse and rat isolated perfused liver preparation. Journal of Pharmacological and Toxicological Methods. 67 (2), 107-114 (2013).
- Zawada, R. J. X., Kwan, P., Olszewski, K. L., Llinas, M., Huang, S. -G. Quantitative determination of urea concentrations in cell culture medium. Biochemistry and Cell Biology. 87 (3), 541-544 (2009).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved