需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用灌注小鼠肝脏模型量化肝葡萄糖生成、尿素生成和脂肪分解
摘要
在这里,我们提出了一种用于小鼠肝脏 原位 灌注的稳健方法,以研究肝脏代谢的急性和直接调节,而不会干扰肝脏结构,但不存在肝外因素。
摘要
肝脏具有多种功能,包括营养代谢。与其他体 外 和 体内 肝脏研究模型相比,分离的灌注肝脏允许研究整个肝脏的肝脏生物学和代谢,具有完整的肝脏结构,不受肝外因素的影响。肝脏灌注最初是为大鼠开发的,但该方法也适用于小鼠。在这里,我们描述了小鼠肝脏 原位 灌注的方案。用含氧的Krebs-Henseleit碳酸氢盐缓冲液通过门静脉对肝脏进行顺行灌注,并从肝上下腔静脉收集输出物,并夹紧肝下腔静脉以关闭回路。使用这种方法,可以用详细的时间分辨率评估测试化合物的直接肝脏效应。肝功能和活力稳定至少3小时,允许在同一实验中加入内部对照。使用该模型的实验可能性很多,可以推断出对肝脏生理学和肝脏疾病的见解。
引言
肝脏是新陈代谢的重要器官。它通过调节葡萄糖、脂质和氨基酸代谢,在控制全身能量平衡方面发挥关键作用。全球肝脏疾病的增加正在成为全球的主要健康负担,需要更多的关于病理生理学及其对肝功能的影响的知识。
已经开发了各种用于肝脏研究的体外模型,以补充体内研究。从啮齿动物和人类中分离和培养的原代肝细胞被广泛使用。非实质细胞可以使用差速离心和梯度离心从肝细胞中分离出来,不同细胞类型的共培养可用于研究细胞间串扰1。尽管原代人肝细胞被认为是测试药物毒性的金标准,但一些研究表明,肝细胞在组织培养物中迅速去分化,导致肝功能丧失2,3,4。与传统的 2D 培养系统相比,3D 球状体系统中的肝细胞培养可改善去分化,更稳定,并且似乎在更高程度上模拟体内肝脏5。精确切割的肝切片是另一种成熟的体外模型,可保持组织结构完整并包含肝脏中存在的非实质细胞6。更先进的体外模型包括肝脏芯片7 和肝脏类器官8。然而,对于所有这些方法,结构完整性和流动动力学都会丢失,包括矢量门静脉-肝静脉流动,这可能会影响可推广性。
18559 年,克劳德·伯纳德 (Claude Bernard) 首次描述了分离的灌注大鼠肝脏,至今仍用于肝脏生物学、毒理学和病理生理学研究的各个科学领域。与上述体外模型相比,灌注肝脏的优势包括维持肝脏结构、血管流动、肝细胞极性和分区,以及肝细胞与非实质细胞之间的相互作用。与体内研究相比,灌注肝脏允许以孤立的方式研究肝脏代谢,避免血液携带的肝外因子,并完全控制实验条件。多年来,已经进行了一些修改以改进大鼠肝脏灌注模型10,11,12,13。尽管小鼠已被用于离体灌注肝脏研究,但可用的文献较少。在这里,我们提出了一种通过插管门静脉和肝上腔静脉对小鼠肝脏进行原位灌注的方法,以研究对代谢底物和激素的急性和直接代谢反应,如在小鼠肝脏的肝静脉流出物中实时测量。
Access restricted. Please log in or start a trial to view this content.
研究方案
所有动物实验均在丹麦环境和食品部丹麦动物实验监察局(许可证 2018-15-0201-01397)和当地伦理委员会的许可下进行,符合欧盟指令 2010/63/EU、美国国立卫生研究院(出版物编号 85-3)并遵循丹麦动物实验立法指南(1987 年)。这是一个终末手术,死因是在深度麻醉下放血和横膈膜穿孔。
1.实验动物
- 获得所需品系,年龄和性别的小鼠。本研究使用11-16周龄的雄性C57BL / 6JRj小鼠。每个笼子最多饲养5只雄性或8只雌性小鼠,随意获取食物和水,并保持12小时/ 12小时的明暗循环,从早上6点到下午6点开灯。
2.术前准备
- 配制肝灌注缓冲液。
- Krebs-Henseleit 缓冲区。将 118 mmol/L NaCl、4.7 mmol/L KCl、1.2 mmol/L MgSO 4 和 1.2 mmol/L KH 2 PO4 混合并溶解在 dH 2 O 中,将 1.25 mmol/L CaCl2溶解在单独的烧杯中并加入缓冲液。
- 溶解 25 mmol/L NaHCO3 ,并在搅拌的同时缓慢加入缓冲液中。将缓冲液储存在4°C。缓冲液可稳定保存至少 1 个月。
注意:如果 CaCl2 和 NaHCO3 在添加之前未单独溶解,则可能会发生沉淀。
- 通过2μm过滤器过滤灌注缓冲液,并使用HCl将pH调节至7.5。
注意:此步骤应在实验当天进行,因为pH值会随着时间的推移而增加,即使储存在密闭烧瓶中也是如此。 - 在过滤和 pH 调节的 Krebs-Henseleit 灌注缓冲液中制备高于所需最终浓度的测试化合物(例如,通过侧臂泵以 0.175 mL/min 的速率输注时为 20 倍浓度)。如果相关,在 Krebs-Henseleit 灌注缓冲液中稀释测试化合物,添加 1% BSA 作为载体(以避免粘附在管子和玻璃器皿上,这对所有肽都是必不可少的),通过适当尺寸的过滤器过滤。
3.操作和灌注
注:图1提供了本研究中使用的灌注设置的 图示。
- 将灌注缓冲液(95%O 2,5%CO2)充气至少30分钟,以向肝脏提供足够的氧气,并从操作开始保持正确的pH值(碳酸氢盐缓冲系统在连续充气下将达到7.4的pH值,参见补充图1)。
- 通过腹膜内注射给予氯胺酮(90mg / kg)和甲苯噻嗪(10mg / kg)麻醉小鼠。
- 将鼠标仰卧在加热的手术台上,并确认脚趾捏合时缺乏反射。喷洒 70% 乙醇以防止头发粘在剪刀上。将鼠标固定在温暖的表面上有助于提高以下过程的稳定性。
- 用剪刀在腹部底部切开一个切口,向上切到两侧的胸腔,露出腹腔。用棉签将肠道向右移动,露出门静脉。
- 使用弯曲的镊子在门静脉下放置两个结扎线,并为每个结扎准备一个松散的结。
- 将一根 0.7 毫米的导管插入门静脉。穿孔后,从导管上取下针头并引导导管穿过静脉,直到导管尖端靠近肝脏,如图 2 所示。血液流入导管。
- 收紧结扎线。如果导管没有充满血液,请用灌注缓冲液填充,以避免引入气泡。
- 连接灌注管,并通过以0.8mL / min的灌注流速启动滚筒泵,在37°C下用Krebs-Henseleit碳酸氢盐缓冲液开始肝脏灌注。肝脏在几秒钟内变得苍白。
- 用剪刀剪开胸腔和横膈膜。此时,动物被安乐死。使用细尖镊子在肝上下腔静脉下放置结扎。将笔、卷起的纱布或其他一次性物品放在鼠标背面下方,使静脉更容易触及。
- 通过心脏右心房将导管插入肝上下腔静脉。穿孔时,从导管上取下针头,引导导管穿过静脉,直到导管尖端靠近肝脏。血液和灌注缓冲液立即用完。
- 拧紧结扎线并连接一根用于收集灌注流出物的管子。用防水胶带(光滑胶带或类似胶带)固定所有管子。
- 使用血管夹适配器将血管夹穿过右肾静脉正上方的肝下腔静脉,以防止混入(图2)。
- 将灌注流速增加到 3.5 mL/min 并启动计时器。开始压力记录。成功的灌注通常会导致压力为 ~10 mm/Hg。
- 用蘸有生理盐水的无菌帷幔覆盖肝脏,并在实验过程中加入生理盐水以防止其干燥。
- 收集灌注流出物1分钟并测量体积。体积应约为 3.5 mL/min。在这个阶段,预计不会混入血液,心脏不再泵血。
- 等待30分钟的平衡期后再开始实验。
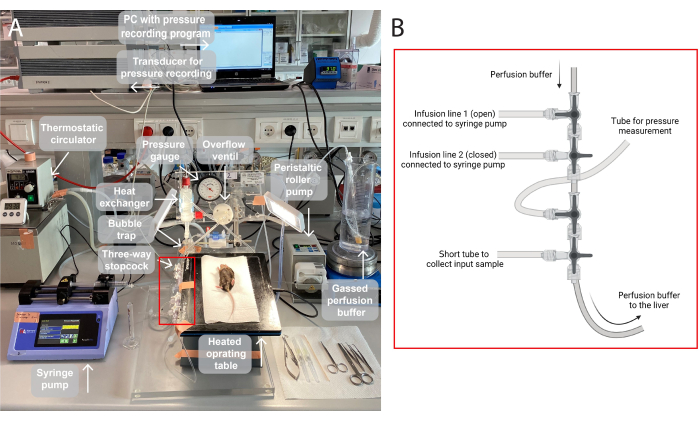
图 1:灌注设置图示。 (A)将手术台抬高在三脚架上,加热至37°C。 灌注缓冲液被充气(95% O 2,5% CO2),通过蠕动辊泵泵送,并在带有内置气泡捕集器的热交换器中加热。该系统还包括压力表和转子泵,用于调节灌注压力。灌注压力通过PC上的传感器(压力记录程序)连续记录和可视化。(B) 红框表示三通旋塞阀的连接。第一个三通旋塞阀打开,用于通过注射泵输注测试化合物,第二个旋塞阀关闭。第三个是开放的,用于连续压力测量。第四个旋塞阀可用于收集输入样本,例如,通过灌注肝脏进行气体分析。连接器可以根据需要进行修改,以满足需要更多或更少输液管路的特定实验。请点击这里查看此图的较大版本.
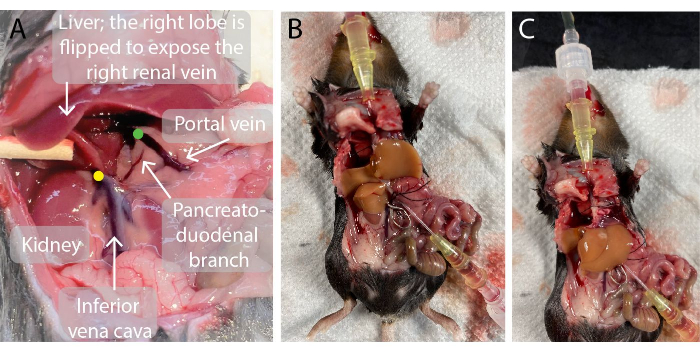
图2:肝灌注前和肝灌注期间小鼠腹腔的照片 。 (A)绿点表示门静脉导管尖端的位置。重要的是,导管的尖端应位于进入左右肝门静脉的门静脉分支点的正下方,但胰十二指肠分支上方,以避免渗漏。黄点表示血管钳在右肾静脉和肝脏之间的肝下下腔静脉上的正确位置,以避免血液回流到灌注的肝脏中。 (乙, 丙)灌注小鼠肝脏,将两根导管插入门静脉 (B) 和肝上下腔静脉 (C),血管夹在肝下下腔静脉 (B) 上。 请点击这里查看此图的较大版本.
4. 实验
- 通过在平衡期结束时使用馏分收集器收集第一个基线样品来开始实验。在所需的时间间隔收集样品并立即将其放在冰上。
- 定期检查气泡收集器,并在接近空时重新填充灌注缓冲液。
- 在缓冲液进入器官之前,立即通过三通旋塞阀从插入下腔静脉的收集导管(在通过肝脏灌注后)收集缓冲液样本。
- 用血气分析仪测量样品以确认器官具有代谢活性(由CO2 分压增加和pH值降低表示)。
- 在实验结束时重复步骤4.3-4.4,以评估整个实验过程中的活力(补充图2)。
注意:氧分压的降低不能提供可靠的呼吸测量,因为管道、器官等会损失氧气。 - 基线灌注 15 分钟后,通过使用注射泵以所需的流速通过三通旋塞阀输注测试物质来开始第一次刺激(例如,当通过侧臂泵以 0.175 mL/min 的速率输注时,测试物质的浓度为 20 倍)。或者,将基线缓冲液切换到含有最终浓度的测试化合物的新(氧化和加热)缓冲液。
- 在开始第二次刺激之前,停止刺激并收集基线样本20-30分钟。
- 在实验结束时,输注适当的阳性对照5-10分钟。
- 实验结束后,切除灌注的肝脏并称重,使输出量归一化为肝脏重量。在液氮中快速冷冻肝脏,以潜在地测量蛋白质含量,以将输出标准化为蛋白质含量。
5. 生化测量
- 使用适用于灌注缓冲液中测量的测定法(内部或市售比色法或ELISA测定法)定量目标分子的浓度。该缓冲液与大多数基于组学的技术兼容,例如代谢组学和蛋白质组学。
注:在这项研究中,尿素是根据前面描述的比色测定法测量的14.使用市售试剂盒对葡萄糖和非酯化脂肪酸进行定量。
6. 数据分析
- 以 XY 图的形式呈现数据,显示分泌物随时间推移的输出。
注: 体外 灌注系统的优点之一是可以将数据表示为实际输出(浓度×流速, 例如μmol/min),而不是像 体内 研究那样将输出中的测量浓度(mmol/L)表示。在比较不同的小鼠模型时,考虑将输出归一化为肝脏重量,或在将对照小鼠与患有肥胖或肝脏疾病的小鼠模型进行比较时,考虑将输出归一化为肝脏重量(通过BCA测量),其中肝脏重量的增加可能是由于脂肪含量增加。 - 将汇总数据呈现为每只动物的单个点,代表基线期间和刺激期间(通常为 15-30 分钟)的平均或总输出,或使用前一个基线的增量输出,具体取决于研究设计。
- 使用配对 t 检验(两组)或具有重复刺激(两组以上)的单因素方差分析数据分析,并使用适当的事后检验进行多次测试。
Access restricted. Please log in or start a trial to view this content.
结果
需要一个稳定的基线来确定刺激物或底物是否导致目标分子的释放。 图3A 显示了一个成功的实验示例。以 2 分钟的间隔测量灌注肝脏中尿素的产生,并显示为 SEM ±平均值。两个刺激期之前的基线期是稳定的。 图3B显示了两个刺激期的平均尿素产量和各自的基线。使用单因素方差分析和重复测量来检验各时期之间的统计显着性?...
Access restricted. Please log in or start a trial to view this content.
讨论
分离的灌注小鼠肝脏是研究肝脏代谢动力学和分子机制的有力研究工具。每分钟样本采集的可能性提供了对测试化合物对肝脏的直接影响的详细评估。 与体内 研究相比,灌注肝脏使我们能够以孤立的方式研究肝脏代谢,避免血液携带的肝外因子,并完全控制实验条件。与使用分离肝细胞的 体外 研究相比,肝脏灌注的优势在于维持肝脏结构、极性、纬向分裂和血管完整性。肝脏灌注...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者声明与本文无关的利益冲突。
致谢
这些研究和Nicolai J. Wewer Albrechtsen得到了诺和诺德基金会卓越新兴研究者资助-内分泌学和代谢(申请号)的支持。NNF19OC0055001)、欧洲糖尿病研究基金会未来领袖奖(NNF21SA0072746)和丹麦独立研究基金,Sapere Aude(1052-00003B)。诺和诺德基金会蛋白质研究中心由诺和诺德基金会提供资金支持(赠款协议NNF14CC0001)。图1B是使用 biorender.com 创建的。我们感谢 Rune E. Kuhre 博士(诺和诺德 A/S)对灌注小鼠肝脏的富有成效的讨论。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 3-way stopcock | BD | 394601 | |
| Altromin breeding diet | Altromin Spezialfutter | 1319 | |
| Calcium chloride dihydrate (CaCl2·2H2O) | Sigma | C8106 | |
| Catheters (0.7 mm) | BD | 381812 | |
| Filter paper (pore size 2.0 µm) | Millipore | AP2029325 | |
| Glucose kit | QuantiChromTM | DIGL-100 | Low concentration protocol |
| Ketamine | MSD Animal Health | 511485 | 90 mg/kg |
| Ligature (black sterile silk) | Agnthos | 14739 | |
| Magnesium sulfate (MgSO4) | Sigma | 230391 | |
| Non-esterified fatty acids kit | Fujifilm Wako Chemicals | NEFA-HR(2) | |
| Operating table, heated on tripod stand, type 873 | Harvard Bioscience, Inc. | 733776 | |
| Potassium chloride (KCl) | Sigma | P9541 | |
| Potassium dihydrogen phosphate(KH2PO4) | Merck | 1.04877 | |
| Roller Pump, with four channels | Harvard Bioscience, Inc. | 730100 | |
| Sleek tape | Mediq danmark | 4001910 | |
| Sodium bicarbonate (NaHCO3) | Sigma | S5761 | |
| Sodium chloride (NaCl) | Sigma | S1679 | |
| Thermostatic Circulator | Harvard Bioscience, Inc. | 730125 | Bath Volume 3 L, 230 V/50 Hz |
| Tubing | Tygon | E3603 | Inner diameter 1.59 mm, outer diameter 3.18 mm |
| Universal perfusion system | Harvard Bioscience, Inc. | 732316 | Basic unit uniper UP-100, type 834 |
| Vamin | Fresenius Kabi | B05ABA01 | Mixed amino acids |
| Vessel clamp adaptor | Deutsche Biomedical | DBC1002 | |
| Vessel clamps | Deutsche Biomedical | DBC1005 | |
| Windkessel | Harvard Bioscience, Inc. | 732068 | |
| Xylazine | Rompun Vet | 530701 | 10 mg/kg |
参考文献
- Bale, S. S., Geerts, S., Jindal, R., Yarmush, M. L. Isolation and co-culture of rat parenchymal and non-parenchymal liver cells to evaluate cellular interactions and response. Scientific Reports. 6, 25329(2016).
- Lauschke, V. M., et al. Massive rearrangements of cellular MicroRNA signatures are key drivers of hepatocyte dedifferentiation. Hepatology. 64 (5), 1743-1756 (2016).
- Seirup, M., et al. Rapid changes in chromatin structure during dedifferentiation of primary hepatocytes in vitro. Genomics. 114 (3), 110330(2022).
- Gupta, R., et al. Comparing in vitro human liver models to in vivo human liver using RNA-Seq. Archive of Toxicology. 95 (2), 573-589 (2021).
- Bell, C. C., et al. Characterization of primary human hepatocyte spheroids as a model system for drug-induced liver injury, liver function, and disease. Scientific Reports. 6, 25187(2016).
- Dewyse, L., Reynaert, H., van Grunsven, L. A. Best practices and progress in precision-cut liver slice cultures. International Journal of Molecular Sciences. 22 (13), 7137(2021).
- Li, X., George, S. M., Vernetti, L., Gough, A. H., Taylor, D. L. A glass-based, continuously zonated and vascularized human liver acinus microphysiological system (vLAMPS) designed for experimental modeling of diseases and ADME/TOX. Lab on a Chip. 18 (17), 2614-2631 (2018).
- Broutier, L., et al. Culture and establishment of self-renewing human and mouse adult liver and pancreas 3D organoids and their genetic manipulation. Nature Protocols. 11 (9), 1724-1743 (2016).
- Bartošek, I., Guaitani, A., Miller, L. L. Isolated Liver Perfusion and its Applications. , Raven Press. New York. (1973).
- Gores, G. J., Kost, L. J., LaRusso, N. F. The isolated perfused rat liver: conceptual and practical considerations. Hepatology. 6 (3), 511-517 (1986).
- Mischinger, H. J., et al. An improved technique for isolated perfusion of rat livers and an evaluation of perfusates. Journal of Surgical Research. 53 (2), 158-165 (1992).
- Vairetti, M., et al. Correlation between the liver temperature employed during machine perfusion and reperfusion damage: role of Ca2. Liver Transplantation. 14 (4), 494-503 (2008).
- Ferrigno, A., Richelmi, P., Vairetti, M. Troubleshooting and improving the mouse and rat isolated perfused liver preparation. Journal of Pharmacological and Toxicological Methods. 67 (2), 107-114 (2013).
- Zawada, R. J. X., Kwan, P., Olszewski, K. L., Llinas, M., Huang, S. -G. Quantitative determination of urea concentrations in cell culture medium. Biochemistry and Cell Biology. 87 (3), 541-544 (2009).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。