A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ייצור גלוקוז בכבד, אורגנזה וליפוליזה מכומתים באמצעות מודל הכבד של עכבר מחורר
In This Article
Summary
כאן, אנו מציגים שיטה חזקה עבור זילוח באתרו של כבד העכבר כדי ללמוד את הרגולציה החריפה והישירה של חילוף החומרים בכבד מבלי להפריע לארכיטקטורה הכבדית אלא בהיעדר גורמים מחוץ לכבד.
Abstract
לכבד יש תפקידים רבים, כולל מטבוליזם של חומרים מזינים. בניגוד למודלים אחרים של חקר הכבד במבחנה ו-in vivo , הכבד המבודד מחורר מאפשר ללמוד ביולוגיה של הכבד ומטבוליזם בכבד כולו עם ארכיטקטורה כבדית שלמה, המופרדת מהשפעת גורמים חוץ-כבדיים. זילוח כבד פותח במקור עבור חולדות, אך השיטה הותאמה גם לעכברים. כאן אנו מתארים פרוטוקול לזילוח באתרו של כבד העכבר. הכבד מחורר באופן מקדים דרך וריד הפורטל עם חיץ קרבס-הנסלייט ביקרבונט מחומצן, והפלט נאסף מהווריד הנבוב התחתון העל-כבד עם הידוק של הווריד הנבוב התחתון האינפרא-הפטי כדי לסגור את המעגל. באמצעות שיטה זו, ההשפעות הכבדיות הישירות של מתחם הבדיקה ניתן להעריך עם רזולוציית זמן מפורטת. תפקוד הכבד והכדאיות יציבים למשך 3 שעות לפחות, ומאפשרים הכללת בקרות פנימיות באותו ניסוי. אפשרויות הניסוי באמצעות מודל זה הן רבות ועשויות להסיק תובנה לגבי פיזיולוגיה של הכבד ומחלות כבד.
Introduction
הכבד הוא איבר חיוני בחילוף החומרים. הוא ממלא תפקיד מפתח בשליטה על מאזן האנרגיה של כל הגוף על ידי ויסות חילוף החומרים של גלוקוז, שומנים וחומצות אמינו. העלייה במחלות כבד ברחבי העולם מסתמנת כנטל בריאותי עולמי גדול, ויש צורך בידע נוסף על הפתופיזיולוגיה והשלכותיה על תפקודי הכבד.
מודלים שונים במבחנה פותחו למחקר על הכבד כדי להשלים מחקרי in vivo. הפטוציטים ראשוניים מבודדים ומתורבתים ממכרסמים ובני אדם נמצאים בשימוש נרחב. תאים שאינם פרנכימליים יכולים להיות מופרדים מהפטוציטים באמצעות צנטריפוגה דיפרנציאלית והדרגתית, והתרבות המשותפת של סוגי תאים שונים שימושית לחקר crosstalkבין-תאי 1. למרות שהפטוציטים האנושיים הראשוניים נחשבים לתקן הזהב לבדיקת רעילות תרופות, מספר מחקרים הראו כי הפטוציטים מתמיינים במהירות בתרבית רקמה וכתוצאה מכך מאבדים תפקודי כבד 2,3,4. תרבית הפטוציטים במערכת ספרואידית תלת-ממדית משפרת את הדיפרנציאציה, יציבה יותר, ונראה כי היא מחקה את הכבד in vivo במידה גבוהה יותר מאשר מערכות התרבית הדו-ממדיות המסורתיות5. פרוסות כבד חתוכות במדויק הן מודל מבוסס היטב נוסף במבחנה השומר על ארכיטקטורת הרקמה שלמה ומכיל את התאים הלא פרנכימליים הנמצאים בכבד6. מודלים מתקדמים יותר במבחנה כוללים כבד על שבב7 ואורגנואידים בכבד8. עם זאת, עם כל הגישות הללו, יש אובדן של שלמות מבנית ודינמיקה זרימה, כולל זרימת ורידים פורטליים-כבדיים וקטוריאליים, אשר ככל הנראה משפיע על הכללה.
כבד החולדה המבודד תואר לראשונה על ידי קלוד ברנרד בשנת 18559, והוא עדיין משמש בתחומים מדעיים שונים למחקרים בביולוגיה של הכבד, טוקסיקולוגיה ופתופיזיולוגיה. היתרונות של הכבד המחורר בהשוואה למודלים במבחנה שהוזכרו לעיל כוללים שמירה על ארכיטקטורת הכבד, זרימת כלי הדם, קוטביות הפטוציטים והאזור, והאינטראקציות בין הפטוציטים לתאים שאינם פרנכימליים. בהשוואה למחקרי in vivo, הכבד המחורר מאפשר ללמוד את חילוף החומרים בכבד באופן מבודד תוך הימנעות מגורמים חוץ-כבדיים הנישאים על ידי הדם ועם שליטה מלאה על תנאי הניסוי. מספר שינויים נעשו כדי לשפר את מודל זילוח כבד חולדה במהלך השנים10,11,12,13. למרות שעכברים שימשו למחקרי כבד מחוררים מבודדים, פחות ספרות זמינה. כאן, אנו מציגים שיטה לזילוח באתרו של כבד העכבר על ידי קנולציה של הווריד הפורטלי והווריד הנבוב העל-כבד נחות כדי לחקור את התגובות המטבוליות החריפות והישירות למצעים מטבוליים ולהורמונים כפי שנמדדו בשפכים הורידיים של הכבד מכבד העכבר בזמן אמת.
Access restricted. Please log in or start a trial to view this content.
Protocol
כל הניסויים בבעלי חיים נערכו באישור הפיקוח הדני על ניסויים בבעלי חיים, המשרד לאיכות הסביבה והמזון של דנמרק (היתר 2018-15-0201-01397), וועדת האתיקה המקומית בהתאם להנחיית האיחוד האירופי 2010/63/EU, המכונים הלאומיים לבריאות (פרסום מס' 85-3) ובהתאם להנחיות החקיקה הדנית המסדירה ניסויים בבעלי חיים (1987). זהו הליך סופני, וסיבת המוות היא ניקוב וניקוב הסרעפת בהרדמה עמוקה.
1. חיות ניסוי
- השג עכברים מהזן הרצוי, גיל ומין. במחקר זה נעשה שימוש בעכברי C57BL/6JRj זכרים בגילאי 11-16 שבועות. החזיקו עד 5 עכברים זכרים או 8 נקבות בכל כלוב עם גישה ל-ad libitum לצ'או ומים ושמרו על מחזור אור-חושך של 12 שעות/12 שעות עם אורות דולקים בין השעות 06:00 ל-18:00.
2. הכנות טרום ניתוחיות
- הפוך את חיץ זילוח הכבד.
- חיץ קרבס-הנסלייט. יש לערבב ולהמיס 118 mmol / L NaCl, 4.7 mmol / L KCl, 1.2 mmol / L MgSO 4 ו- 1.2 mmol / L KH 2 PO4 in dH 2 O. ממיסים 1.25 mmol / L CaCl2בכוס נפרדת ומוסיפים את החיץ.
- יש להמיס 25 mmol / L NaHCO3 ולהוסיף לאט למאגר תוך כדי ערבוב. אחסן את המאגר ב- 4 מעלות. החיץ יציב למשך חודש אחד לפחות.
הערה: משקעים עשויים להתרחש אם CaCl2 ו- NaHCO3 אינם מומסים בנפרד לפני הוספתם.
- סנן את מאגר הזילוח דרך מסנן 2 מיקרומטר וכוונן את ה- pH ל- 7.5 באמצעות HCl.
הערה: שלב זה צריך להתבצע ביום הניסוי, שכן ה- pH עולה עם הזמן, גם כאשר מאוחסן בצלוחיות סגורות. - הכינו תרכובות בדיקה בריכוז גבוה יותר מהריכוז הסופי הרצוי (למשל, ריכוז פי 20 כאשר מחדירים בקצב של 0.175 מ"ל/דקה באמצעות משאבת זרוע) בחיץ זילוח Krebs-Henseleit מסונן ומותאם pH. במידת הצורך, יש לדלל את תרכובות הבדיקה בחיץ זילוח Krebs-Henseleit בתוספת BSA של 1% כנשא (כדי למנוע היצמדות לצנרת וכלי זכוכית, החיוניים לכל הפפטידים), מסוננים דרך מסנן בגודל מתאים.
3. פעולה וזילוח
הערה: איור של מערך הזילוח ששימש במחקר זה מוצג באיור 1.
- גזים את חיץ הזילוח (95% O 2, 5% CO2) למשך 30 דקות לפחות כדי לספק מספיק חמצן לכבד ולשמור על רמת החומציות הנכונה מתחילת הפעולה (מערכת חיץ הביקרבונט תגיע ל-pH של 7.4 תחת גזים רציפים, ראו איור משלים 1).
- מרדימים עכבר על ידי מתן קטמין (90 מ"ג/ק"ג) וקסילזין (10 מ"ג/ק"ג) בזריקה תוך צפקית.
- הניחו את העכבר בשכיבה על שולחן ניתוחים מחומם ואשרו את היעדר הרפלקסים בתגובה לצביטת הבוהן. רססו באתנול 70% כדי למנוע מהשיער להידבק למספריים. תיקון העכבר למשטח החם מסייע להגביר את היציבות עבור ההליכים הבאים.
- בצע חתך עם מספריים בבסיס הבטן וחתך כלפי מעלה לכלוב הצלעות משני הצדדים כדי לחשוף את חלל הבטן. הזיזו את המעיים ימינה באמצעות צמר גפן, וחשפו את וריד הפורטל.
- מניחים שתי ליגטורות מתחת לווריד הפורטל באמצעות מלקחיים מעוקלים ומכינים קשר רופף לכל ליגטורה.
- הכנס קטטר 0.7 מ"מ לווריד הפורטל. כאשר מחוררים, הוציאו את המחט מהקטטר והובילו את הצנתר דרך הווריד עד שקצה הצנתר קרוב לכבד, כפי שמודגם באיור 2. הדם זורם לתוך הצנתר.
- הדקו את הליגטורות. אם הצנתר אינו מלא בדם, מלא אותו בחיץ זילוח כדי למנוע הכנסת בועת אוויר.
- חבר את צינור הזילוח והתחל זילוח של הכבד עם חיץ Krebs-Henseleit ביקרבונט ב- 37 ° C על ידי הפעלת משאבת הרולר בקצב זרימת זילוח של 0.8 מ"ל / דקה. הכבד מחוויר תוך שניות.
- חותכים את כלוב הצלעות והסרעפת באמצעות מספריים. בשלב זה, החיה מורדמת. מניחים רצועה מתחת לווריד הנבוב התחתון העל-כבד באמצעות מלקחיים נקודתיים עדינים. הניחו עט, גזה מגולגלת או פריט חד פעמי אחר מתחת לגב העכבר כדי להפוך את הווריד לנגיש יותר.
- הכנס קטטר לתוך הווריד הנבוב התחתון suprahepatic דרך אטריום ימין של הלב. בעת ניקוב, מוציאים את המחט מהקטטר ומנחים את הצנתר דרך הווריד עד שקצה הצנתר קרוב לכבד. חיץ הדם והזילוח נגמר מיד.
- מהדקים את הרצועה ומחברים צינור לאיסוף שפכי זילוח. אבטח את כל הצינורות באמצעות סרט עמיד למים (סרט אלגנטי או דומה).
- השתמשו במתאם מהדק כלי דם כדי למקם מהדק כלי דם על פני הווריד הוורידי האינפרא-הפטי שנמצא ממש מעל וריד הכליה הימני כדי למנוע ערבוב (איור 2).
- הגדל את קצב זרימת הזילוח ל -3.5 מ"ל / דקה והפעל טיימר. התחל את הקלטת הלחץ. זילוח מוצלח בדרך כלל גורם ללחץ של ~ 10 מ"מ / כספית.
- כסו את הכבד בוילון סטרילי טבול במי מלח והוסיפו מלח במהלך הניסוי כדי למנוע ממנו להתייבש.
- אספו את השפכים במשך דקה אחת ומדדו את עוצמת הקול. הנפח צריך להיות בערך 3.5 מ"ל/דקה. תערובת של דם אינה צפויה בשלב זה, והלב אינו פועם עוד.
- המתן לתקופת שיווי משקל של 30 דקות לפני תחילת הניסוי.
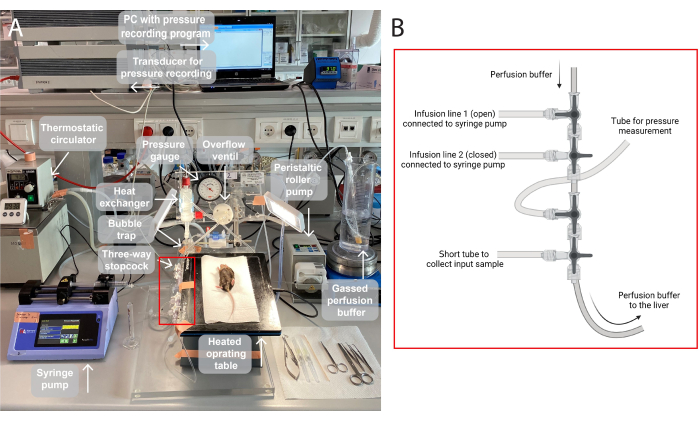
איור 1: איור של מערך הזילוח. (A)שולחן הניתוחים מוגבה על מעמד חצובה ומחומם ל-37°C. חיץ הזילוח מוגז (95% O2, 5%CO2), נשאב באמצעות משאבת גלילה פריסטלטית ומחומם במחליף החום באמצעות מלכודת בועות מובנית. המערכת מורכבת גם ממד לחץ ומשאבת ציר להתאמת לחץ הזילוח. לחץ הזילוח נרשם ברציפות ומוצג באמצעות מתמר במחשב, תוכנית הקלטת לחץ. (B) התיבה האדומה לוכדת את החיבורים של סטופקוקים תלת-כיווניים. הסטופקוק המשולש הראשון פתוח לעירוי של תרכובת בדיקה באמצעות משאבת מזרק, והשני סגור. השלישי פתוח למדידות לחץ רציפות. הסטופקוק הרביעי עשוי לשמש לאיסוף דגימות קלט, למשל, ניתוח גזים על פני הכבד המחורר. ניתן לשנות את המחברים לפי הצורך עבור ניסויים ספציפיים הדורשים יותר או פחות קווי עירוי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
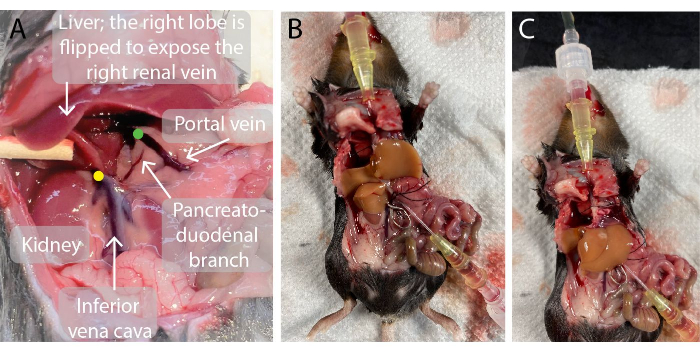
איור 2: תמונות של חלל הבטן של העכבר לפני ובמהלך זילוח הכבד. (A)הנקודה הירוקה מציינת את מיקום קצה צנתר הווריד הפורטלי. חשוב שקצה הצנתר ימוקם ממש מתחת לנקודת ההסתעפות של וריד הפורטל אל ורידי פורטל הכבד השמאלי והימני אך מעל ענף הלבלב-תריסריון כדי למנוע דליפה. הנקודה הצהובה מציינת את המיקום הנכון של מהדק כלי הדם על הווריד הווריד התחתון אינפרא-הפטי בין וריד הכליה הימני לבין הכבד, כדי למנוע את זרימת הדם חזרה לתוך הכבד המחורר. (ב, ג) כבד עכבר מחורר עם שני הצנתרים המוחדרים לווריד הפורטל (B) ולווריד הווריד התחתון העל-הכבד (C) והכלי מהדק על הווריד הוורידי התחתון האינפרא-הפטי (B). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
4. ניסוי
- התחל את הניסוי על ידי איסוף דגימות הבסיס הראשונות באמצעות אוסף שברים בסוף תקופת שיווי המשקל. לאסוף דגימות במרווח הזמן הרצוי ולהניח אותם על קרח מיד.
- בדוק את מלכודת הבועות באופן קבוע ומלא מחדש במאגר זילוח כאשר הוא קרוב לריק.
- אספו דגימה של החיץ דרך סטופקוק תלת-כיווני מיד לפני שהוא נכנס לאיבר ומצנתר האיסוף שהוחדר לווריד הנבוב התחתון (לאחר שהוא נוקב דרך הכבד).
- למדוד את הדגימות עם מנתח גז דם כדי לאשר כי האיבר פעיל מטבולית (מסומן על ידי עלייה בלחץ חלקי של CO2 וירידה ב- pH).
- חזרו על שלבים 4.3-4.4 בסוף הניסוי כדי להעריך את הכדאיות לאורך כל הניסוי (איור משלים 2).
הערה: הירידה בלחץ החלקי של החמצן אינה מספקת מדד אמין לנשימה בגלל אובדן חמצן מצינורות, האיבר וכו '. - לאחר 15 דקות של זילוח בקו הבסיס, התחל את הגירוי הראשון על ידי החדרת חומר בדיקה דרך סטופקוק תלת-כיווני בקצב זרימה רצוי באמצעות משאבת מזרק (למשל, ריכוז פי 20 של חומר הבדיקה בעת עירוי בקצב של 0.175 מ"ל/דקה באמצעות משאבת זרוע). לחלופין, העבר את מאגר קו הבסיס למאגר חדש (מחומצן ומחומם) המכיל את תרכובת הבדיקה בריכוז הסופי.
- עצור את הגירוי ואסוף דגימות בסיסיות למשך 20-30 דקות לפני תחילת הגירוי השני.
- בסוף הניסוי, להחדיר בקרה חיובית מתאימה במשך 5-10 דקות.
- לאחר הניסוי, הבלו את הכבד המחורר ולשקול אותו כדי לנרמל את התפוקה למשקל הכבד. הקפיאו את הכבד בחנקן נוזלי למדידה אפשרית של תכולת החלבונים כדי לנרמל את התפוקה לתכולת החלבון.
5. מדידות ביוכימיות
- כמת את ריכוז המולקולה המעניינת באמצעות בדיקות המתאימות למדידות במאגר זילוח (מבחני colorimetric או ELISA פנימיים או זמינים מסחרית). החיץ מתאים לרוב הטכניקות מבוססות האומיקס כגון מטבולומיקה ופרוטאומיקה.
הערה: במחקר זה, אוריאה נמדדה בהתבסס על בדיקה קולורימטרית שתוארה קודם לכן14. גלוקוז וחומצות שומן לא אסטריות כומתו באמצעות ערכות מסחריות.
6. ניתוח נתונים
- הצג את הנתונים בגרפים XY המציגים את תפוקת ההפרשה לאורך זמן.
הערה: אחת ממעלותיה של מערכת הזלוף במבחנה היא שניתן לבטא נתונים כפלט בפועל (ריכוז × קצב זרימה, למשל, μmol/min) במקום הריכוז הנמדד בפלט (mmol / L) כמו במחקרי in vivo . שקול לנרמל את התפוקה למשקל הכבד בעת השוואת מודלים שונים של עכברים או לתכולת החלבון הכוללת (הנמדדת על ידי BCA) בעת השוואת עכברי ביקורת למודלים של עכברים עם השמנת יתר או מחלות כבד שבהן עלייה במשקל הכבד עשויה לנבוע מתכולת שומן מוגברת. - הצג נתוני סיכום כנקודות בודדות לכל חיה המייצגות את התפוקה הממוצעת או הכוללת במהלך קו הבסיס ולאורך תקופת גירוי (בדרך כלל 15-30 דקות) או תפוקה מצטברת באמצעות קו הבסיס הקודם עבור כל תקופת גירוי בהתאם לתכנון המחקר.
- נתח את הנתונים באמצעות מבחן t זוגי (שתי קבוצות) או ANOVA חד-כיווני עם גירויים חוזרים (יותר משתי קבוצות) עם מבחן פוסט-הוק מתאים לבדיקות מרובות.
Access restricted. Please log in or start a trial to view this content.
תוצאות
נדרש קו בסיס יציב כדי לקבוע אם גירוי או מצע מובילים לשחרור המולקולה המעניינת. איור 3A מראה דוגמה לניסוי מוצלח. ייצור אוריאה בכבד המחורר נמדד במרווחים של 2 דקות ומוצג כממוצע ± SEM. תקופות הבסיס שקדמו לכל אחת משתי תקופות הגירוי הן יציבות. ייצור האוראה הממוצע במ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
כבד העכבר המבודד הוא כלי מחקר חזק לחקר הדינמיקה והמנגנונים המולקולריים של חילוף החומרים בכבד. האפשרות של איסוף דגימות מדקה לדקה מספקת הערכה מפורטת של ההשפעה הישירה של תרכובת בדיקה על הכבד. בהשוואה למחקרי in vivo, הכבד המחורר מאפשר לנו לחקור את חילוף החומרים בכבד באופן מבודד תוך הימנעות ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
המחברים מצהירים כי אין ניגודי עניינים הרלוונטיים למאמר זה.
Acknowledgements
המחקרים וניקולאי ג'יי וור אלברכטסן נתמכו על ידי קרן נובו נורדיסק Excellence Emerging Investigator Grant - אנדוקרינולוגיה ומטבוליזם (Application No. NNF19OC0055001), פרס מנהיג העתיד של הקרן האירופית לחקר הסוכרת (NNF21SA0072746) וקרן המחקר העצמאית דנמרק, Sapere Aude (1052-00003B). מרכז נובו נורדיסק לחקר חלבונים נתמך כספית על ידי קרן נובו נורדיסק (הסכם מענק NNF14CC0001). איור 1B נוצר באמצעות biorender.com. אנו מודים לד"ר רונה א. קוהר (Novo Nordisk A/S) על דיונים פוריים על כבד עכבר מחורר.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 3-way stopcock | BD | 394601 | |
| Altromin breeding diet | Altromin Spezialfutter | 1319 | |
| Calcium chloride dihydrate (CaCl2·2H2O) | Sigma | C8106 | |
| Catheters (0.7 mm) | BD | 381812 | |
| Filter paper (pore size 2.0 µm) | Millipore | AP2029325 | |
| Glucose kit | QuantiChromTM | DIGL-100 | Low concentration protocol |
| Ketamine | MSD Animal Health | 511485 | 90 mg/kg |
| Ligature (black sterile silk) | Agnthos | 14739 | |
| Magnesium sulfate (MgSO4) | Sigma | 230391 | |
| Non-esterified fatty acids kit | Fujifilm Wako Chemicals | NEFA-HR(2) | |
| Operating table, heated on tripod stand, type 873 | Harvard Bioscience, Inc. | 733776 | |
| Potassium chloride (KCl) | Sigma | P9541 | |
| Potassium dihydrogen phosphate(KH2PO4) | Merck | 1.04877 | |
| Roller Pump, with four channels | Harvard Bioscience, Inc. | 730100 | |
| Sleek tape | Mediq danmark | 4001910 | |
| Sodium bicarbonate (NaHCO3) | Sigma | S5761 | |
| Sodium chloride (NaCl) | Sigma | S1679 | |
| Thermostatic Circulator | Harvard Bioscience, Inc. | 730125 | Bath Volume 3 L, 230 V/50 Hz |
| Tubing | Tygon | E3603 | Inner diameter 1.59 mm, outer diameter 3.18 mm |
| Universal perfusion system | Harvard Bioscience, Inc. | 732316 | Basic unit uniper UP-100, type 834 |
| Vamin | Fresenius Kabi | B05ABA01 | Mixed amino acids |
| Vessel clamp adaptor | Deutsche Biomedical | DBC1002 | |
| Vessel clamps | Deutsche Biomedical | DBC1005 | |
| Windkessel | Harvard Bioscience, Inc. | 732068 | |
| Xylazine | Rompun Vet | 530701 | 10 mg/kg |
References
- Bale, S. S., Geerts, S., Jindal, R., Yarmush, M. L. Isolation and co-culture of rat parenchymal and non-parenchymal liver cells to evaluate cellular interactions and response. Scientific Reports. 6, 25329(2016).
- Lauschke, V. M., et al. Massive rearrangements of cellular MicroRNA signatures are key drivers of hepatocyte dedifferentiation. Hepatology. 64 (5), 1743-1756 (2016).
- Seirup, M., et al. Rapid changes in chromatin structure during dedifferentiation of primary hepatocytes in vitro. Genomics. 114 (3), 110330(2022).
- Gupta, R., et al. Comparing in vitro human liver models to in vivo human liver using RNA-Seq. Archive of Toxicology. 95 (2), 573-589 (2021).
- Bell, C. C., et al. Characterization of primary human hepatocyte spheroids as a model system for drug-induced liver injury, liver function, and disease. Scientific Reports. 6, 25187(2016).
- Dewyse, L., Reynaert, H., van Grunsven, L. A. Best practices and progress in precision-cut liver slice cultures. International Journal of Molecular Sciences. 22 (13), 7137(2021).
- Li, X., George, S. M., Vernetti, L., Gough, A. H., Taylor, D. L. A glass-based, continuously zonated and vascularized human liver acinus microphysiological system (vLAMPS) designed for experimental modeling of diseases and ADME/TOX. Lab on a Chip. 18 (17), 2614-2631 (2018).
- Broutier, L., et al. Culture and establishment of self-renewing human and mouse adult liver and pancreas 3D organoids and their genetic manipulation. Nature Protocols. 11 (9), 1724-1743 (2016).
- Bartošek, I., Guaitani, A., Miller, L. L. Isolated Liver Perfusion and its Applications. , Raven Press. New York. (1973).
- Gores, G. J., Kost, L. J., LaRusso, N. F. The isolated perfused rat liver: conceptual and practical considerations. Hepatology. 6 (3), 511-517 (1986).
- Mischinger, H. J., et al. An improved technique for isolated perfusion of rat livers and an evaluation of perfusates. Journal of Surgical Research. 53 (2), 158-165 (1992).
- Vairetti, M., et al. Correlation between the liver temperature employed during machine perfusion and reperfusion damage: role of Ca2. Liver Transplantation. 14 (4), 494-503 (2008).
- Ferrigno, A., Richelmi, P., Vairetti, M. Troubleshooting and improving the mouse and rat isolated perfused liver preparation. Journal of Pharmacological and Toxicological Methods. 67 (2), 107-114 (2013).
- Zawada, R. J. X., Kwan, P., Olszewski, K. L., Llinas, M., Huang, S. -G. Quantitative determination of urea concentrations in cell culture medium. Biochemistry and Cell Biology. 87 (3), 541-544 (2009).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved