Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Glukoseproduktion, Harnstoffgenese und Lipolyse in der Leber quantifiziert mit dem perfundierten Mauslebermodell
In diesem Artikel
Zusammenfassung
In dieser Arbeit stellen wir eine robuste Methode für die in situ Perfusion der Mausleber vor, um die akute und direkte Regulation des Leberstoffwechsels zu untersuchen, ohne die Leberarchitektur zu stören, aber in Abwesenheit von extrahepatischen Faktoren.
Zusammenfassung
Die Leber hat zahlreiche Funktionen, unter anderem den Nährstoffstoffwechsel. Im Gegensatz zu anderen in vitro und in vivo Modellen der Leberforschung ermöglicht die isolierte perfundierte Leber die Untersuchung der Leberbiologie und des Leberstoffwechsels in der gesamten Leber mit einer intakten Leberarchitektur, getrennt vom Einfluss extrahepatischer Faktoren. Leberperfusionen wurden ursprünglich für Ratten entwickelt, aber die Methode wurde auch an Mäuse angepasst. Hier beschreiben wir ein Protokoll für die in situ Perfusion der Mausleber. Die Leber wird antegrad durch die Pfortader mit sauerstoffhaltigem Krebs-Henseleit-Bicarbonatpuffer perfundiert, und der Ausgang wird von der suprahepatischen unteren Hohlvene unter Klemmung der infrahepatischen unteren Hohlvene gesammelt, um den Kreislauf zu schließen. Mit dieser Methode können die direkten hepatischen Effekte einer Testverbindung mit einer detaillierten Zeitauflösung bewertet werden. Leberfunktion und Lebensfähigkeit sind für mindestens 3 h stabil, so dass interne Kontrollen in dasselbe Experiment einbezogen werden können. Die experimentellen Möglichkeiten mit diesem Modell sind zahlreich und können Aufschluss über die Leberphysiologie und Lebererkrankungen geben.
Einleitung
Die Leber ist ein essentielles Organ im Stoffwechsel. Es spielt eine Schlüsselrolle bei der Kontrolle des Energiehaushalts des gesamten Körpers, indem es den Glukose-, Lipid- und Aminosäurestoffwechsel reguliert. Die Zunahme von Lebererkrankungen weltweit entwickelt sich zu einer großen globalen Gesundheitsbelastung, und es wird mehr Wissen über die Pathophysiologie und ihre Folgen für die Leberfunktionen benötigt.
Für die Forschung an der Leber wurden verschiedene In-vitro-Modelle entwickelt, die In-vivo-Studien ergänzen. Isolierte und kultivierte primäre Hepatozyten von Nagetieren und Menschen sind weit verbreitet. Nicht-parenchymale Zellen können mit Hilfe von Differential- und Gradientenzentrifugation von Hepatozyten getrennt werden, und die Kokultur verschiedener Zelltypen ist nützlich für die Untersuchung des interzellulären Crosstalks1. Obwohl primäre menschliche Hepatozyten als Goldstandard für die Prüfung der Arzneimitteltoxizität gelten, haben mehrere Studien gezeigt, dass die Hepatozyten in Gewebekulturen schnell dedifferenzieren, was zu einem Verlust der Leberfunktionen führt 2,3,4. Die Hepatozytenkultur in einem 3D-Sphäroidsystem verbessert die Dedifferenzierung, ist stabiler und scheint die Leber in vivo in höherem Maße nachzuahmen als die herkömmlichen 2D-Kultursysteme5. Präzisionsgeschnittene Leberschnitte sind ein weiteres etabliertes In-vitro-Modell, das die Gewebearchitektur intakt hält und die in der Leber vorhandenen nicht-parenchymalen Zellen enthält6. Zu den fortgeschritteneren In-vitro-Modellen gehören Liver-on-a-Chip7 und Leberorganoide8. Bei all diesen Ansätzen kommt es jedoch zu einem Verlust der strukturellen Integrität und der Strömungsdynamik, einschließlich des vektoriellen portal-hepatischen Venenflusses, was sich wahrscheinlich auf die Generalisierbarkeit auswirkt.
Die isolierte perfundierte Rattenleber wurde erstmals 1855 von Claude Bernard beschrieben 9 und wird immer noch in verschiedenen wissenschaftlichen Bereichen für Studien der Leberbiologie, Toxikologie und Pathophysiologie verwendet. Zu den Vorteilen der perfundierten Leber im Vergleich zu den oben genannten In-vitro-Modellen gehören die Aufrechterhaltung der Leberarchitektur, des Gefäßflusses, der Hepatozytenpolarität und -zonierung sowie die Wechselwirkungen zwischen Hepatozyten und nicht-parenchymalen Zellen. Im Vergleich zu In-vivo-Studien ermöglicht die perfundierte Leber die isolierte Untersuchung des Leberstoffwechsels unter Vermeidung von extrahepatischen Faktoren, die vom Blut getragen werden, und mit vollständiger Kontrolle über die Versuchsbedingungen. Im Laufe der Jahre wurden mehrere Modifikationen vorgenommen, um das Leberperfusionsmodell der Ratte zu verbessern10,11,12,13. Obwohl Mäuse für isolierte perfundierte Leberstudien verwendet wurden, ist weniger Literatur verfügbar. Hier stellen wir eine Methode zur in situ Perfusion der Mausleber durch Kanülierung der Pfortader und der suprahepatischen Vena cava inferior vor, um die akuten und direkten metabolischen Reaktionen auf metabolische Substrate und Hormone zu untersuchen, wie sie im hepatischen venösen Ausfluss aus der Mausleber in Echtzeit gemessen werden.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Alle Tierversuche wurden mit Genehmigung der dänischen Tierversuchsinspektion, des dänischen Ministeriums für Umwelt und Ernährung (Genehmigung 2018-15-0201-01397) und der lokalen Ethikkommission in Übereinstimmung mit der EU-Richtlinie 2010/63/EU, den Nationalen Gesundheitsinstituten (Veröffentlichung Nr. 85-3) und gemäß den Richtlinien der dänischen Gesetzgebung für Tierversuche (1987) durchgeführt. Dies ist ein endgültiger Eingriff, und die Todesursache ist eine Ausblutung und Perforation des Zwerchfells unter Tiefenanästhesie.
1. Versuchstiere
- Besorge dir Mäuse der gewünschten Sorte, des gewünschten Alters und Geschlechts. In dieser Studie wurden männliche C57BL/6JRj-Mäuse im Alter von 11-16 Wochen verwendet. Unterbringung von bis zu 5 männlichen oder 8 weiblichen Mäusen pro Käfig mit ad libitum Zugang zu Futter und Wasser und Einhaltung eines 12 h/12 h Hell-Dunkel-Zyklus mit eingeschaltetem Licht von 6 bis 18 Uhr.
2. Präoperative Vorbereitungen
- Stellen Sie Leberperfusionspuffer her.
- Krebs-Henseleit-Puffer. Mischen und lösen Sie 118 mmol/L NaCl, 4,7 mmol/L KCl, 1,2 mmol/LMgSO4 und 1,2 mmol/L KH2PO4 indH2O. 1,25 mmol/L CaCl2werden in einem separaten Becherglas gelöst und der Puffer hinzugefügt.
- 25 mmol/L NaHCO3 auflösen und unter Rühren langsam in den Puffer geben. Lagern Sie den Puffer bei 4 Grad. Der Puffer ist mindestens 1 Monat stabil.
HINWEIS: Es kann zu Ausfällungen kommen, wenn CaCl2 und NaHCO3 vor der Zugabe nicht einzeln gelöst werden.
- Filtern Sie den Perfusionspuffer durch einen 2-μm-Filter und stellen Sie den pH-Wert mit HCl auf 7,5 ein.
HINWEIS: Dieser Schritt sollte am Versuchstag durchgeführt werden, da der pH-Wert mit der Zeit ansteigt, auch wenn er in geschlossenen Kolben gelagert wird. - Bereiten Sie Testverbindungen in einer höheren Konzentration als der gewünschten Endkonzentration (z. B. 20-fache Konzentration bei Infusion mit einer Rate von 0,175 ml/min über eine Seitenarmpumpe) in filtriertem und pH-angepasstem Krebs-Henseleit-Perfusionspuffer vor. Falls relevant, verdünnen Sie die Testverbindungen in Krebs-Henseleit-Perfusionspuffer mit 1 % BSA als Träger (um das Anhaften an Schläuchen und Glaswaren zu vermeiden, die für alle Peptide unerlässlich sind), und filtrieren Sie sie durch einen Filter geeigneter Größe.
3. Operation und Perfusion
HINWEIS: Eine Abbildung des in dieser Studie verwendeten Perfusionsaufbaus ist in Abbildung 1 dargestellt.
- Begasen Sie den Perfusionspuffer (95 % O2, 5 %CO2) mindestens 30 Minuten lang, um die Leber ausreichend mit Sauerstoff zu versorgen und den korrekten pH-Wert von Beginn der Operation an aufrechtzuerhalten (das Bikarbonatpuffersystem erreicht bei kontinuierlicher Begasung einen pH-Wert von 7,4, siehe ergänzende Abbildung 1).
- Betäubung einer Maus durch Verabreichung von Ketamin (90 mg/kg) und Xylazin (10 mg/kg) durch intraperitoneale Injektion.
- Legen Sie die Maus in Rückenlage auf einen beheizten Operationstisch und bestätigen Sie das Fehlen von Reflexen als Reaktion auf das Einklemmen der Zehen. Sprühen Sie mit 70% Ethanol, um zu verhindern, dass die Haare an der Schere kleben. Das Befestigen der Maus an der warmen Oberfläche hilft, die Stabilität für die folgenden Vorgänge zu erhöhen.
- Machen Sie einen Schnitt mit einer Schere an der Basis des Bauches und schneiden Sie auf beiden Seiten nach oben bis zum Brustkorb, um die Bauchhöhle freizulegen. Bewegen Sie den Darm mit einem Wattestäbchen nach rechts und legen Sie die Pfortader frei.
- Legen Sie mit einer gebogenen Pinzette zwei Ligaturen unter die Pfortader und bereiten Sie für jede Ligatur einen lockeren Knoten vor.
- Führen Sie einen 0,7 mm Katheter in die Pfortader ein. Wenn die Nadel perforiert ist, entfernen Sie die Nadel aus dem Katheter und führen Sie den Katheter durch die Vene, bis sich die Spitze des Katheters in der Nähe der Leber befindet, wie in Abbildung 2 dargestellt. Blut fließt in den Katheter.
- Ziehen Sie die Ligaturen fest. Wenn der Katheter nicht mit Blut gefüllt ist, füllen Sie ihn mit Perfusionspuffer auf, um das Eindringen einer Luftblase zu vermeiden.
- Befestigen Sie den Perfusionsschlauch und leiten Sie die Perfusion der Leber mit Krebs-Henseleit-Bicarbonatpuffer bei 37 °C ein, indem Sie die Rollenpumpe mit einer Perfusionsflussrate von 0,8 ml/min starten. Die Leber wird innerhalb von Sekunden blass.
- Schneiden Sie den Brustkorb und das Zwerchfell mit einer Schere ab. Zu diesem Zeitpunkt wird das Tier eingeschläfert. Platzieren Sie eine Ligatur mit einer feinen Pinzette unter der suprahepatischen unteren Hohlvene. Lege einen Stift, gerollte Gaze oder einen anderen Einwegartikel unter die Rückseite der Maus, um die Vene besser zugänglich zu machen.
- Über den rechten Vorhof des Herzens wird ein Katheter in die suprahepatische untere Hohlvene eingeführt. Wenn die Nadel perforiert ist, entfernen Sie die Nadel aus dem Katheter und führen Sie den Katheter durch die Vene, bis sich die Spitze des Katheters in der Nähe der Leber befindet. Der Blut- und Perfusionspuffer geht sofort zur Neige.
- Ziehen Sie die Ligatur fest und befestigen Sie einen Schlauch zum Auffangen des Perfusionsabflusses. Befestigen Sie alle Röhrchen mit wasserdichtem Klebeband (Sleek Tape o.ä.).
- Verwenden Sie einen Gefäßklemmadapter, um eine Gefäßklemme über die infrahepatische Hohlvene unmittelbar über der rechten Nierenvene zu platzieren, um eine Vermischung zu verhindern (Abbildung 2).
- Erhöhen Sie die Perfusionsflussrate auf 3,5 ml/min und starten Sie einen Timer. Starten Sie die Druckaufzeichnung. Eine erfolgreiche Perfusion führt in der Regel zu einem Druck von ~10 mm/Hg.
- Bedecken Sie die Leber mit einem sterilen, mit Kochsalzlösung angefeuchteten Tuch und fügen Sie während des Experiments Kochsalzlösung hinzu, um ein Austrocknen zu verhindern.
- Sammeln Sie das Perfusionsabwasser für 1 Minute und messen Sie das Volumen. Das Volumen sollte ca. 3,5 ml/min betragen. Eine Beimischung von Blut ist in diesem Stadium nicht zu erwarten, und das Herz pumpt nicht mehr.
- Warten Sie eine Äquilibrierungsperiode von 30 Minuten, bevor Sie mit dem Experiment beginnen.
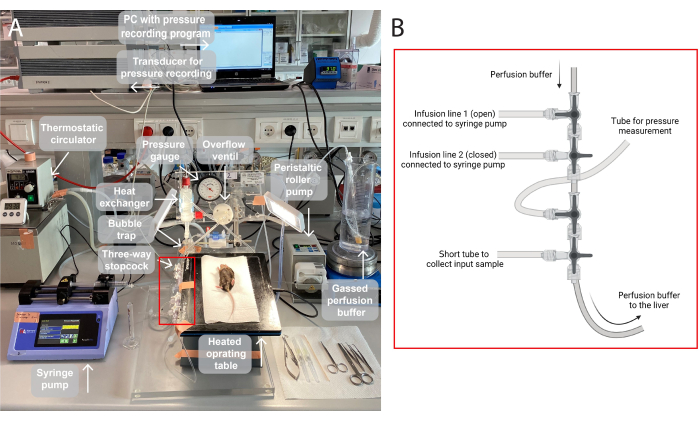
Abbildung 1: Eine Illustration des Perfusionsaufbaus. (A)Der OP-Tisch wird auf einem Stativ erhöht und auf 37 °C erhitzt. Der Perfusionspuffer wird begast (95 % O2, 5 %CO2), über eine Peristaltikrollenpumpe gepumpt und im Wärmetauscher mit einer eingebauten Blasenfalle erhitzt. Das System besteht außerdem aus einem Manometer und einer Spindelpumpe zur Einstellung des Perfusionsdrucks. Der Perfusionsdruck wird kontinuierlich aufgezeichnet und über einen Wandler auf einem PC, ein Druckaufzeichnungsprogramm, visualisiert. (B) Das rote Kästchen erfasst die Anschlüsse von Dreiwegehähnen. Der erste Dreiwegehahn ist für die Infusion einer Testverbindung über eine Spritzenpumpe geöffnet, der zweite ist geschlossen. Der dritte ist offen für kontinuierliche Druckmessungen. Der vierte Absperrhahn kann verwendet werden, um Eingangsproben zu sammeln, z. B. für die Gasanalyse in der durchbluteten Leber. Die Konnektoren können je nach Bedarf für spezifische Experimente modifiziert werden, die mehr oder weniger Infusionsleitungen erfordern. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
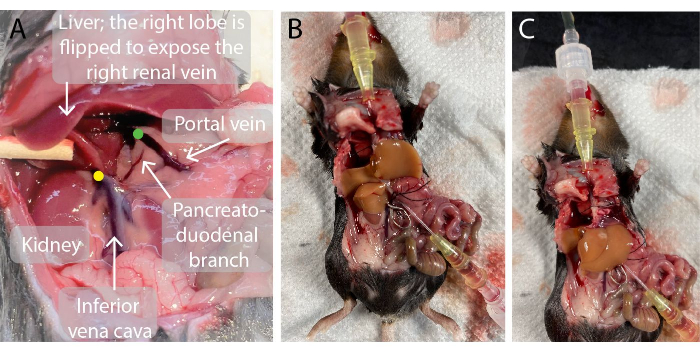
Abbildung 2: Fotos der Bauchhöhle der Maus vor und während der Leberperfusion. (A)Der grüne Punkt zeigt die Lage der Spitze des Pfortaderkatheters an. Es ist wichtig, dass die Spitze des Katheters knapp unter dem Verzweigungspunkt der Pfortader in die linke und rechte Leberpfortader, aber oberhalb des Pankreas-Duodenalastes positioniert wird, um eine Leckage zu vermeiden. Der gelbe Punkt zeigt die korrekte Lage der Gefäßklemme an der infrahepatischen unteren Hohlvene zwischen der rechten Nierenvene und der Leber an, um den Rückfluss von Blut in die durchblutete Leber zu vermeiden. (B, C) Eine perfundierte Mäuseleber mit den beiden Kathetern, die in die Pfortader (B) und die suprahepatische untere Hohlvene (C) eingeführt werden, und die Gefäßklemme an der infrahepatischen unteren Hohlvene (B). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
4. Experimentieren
- Beginnen Sie das Experiment, indem Sie am Ende der Äquilibrierungsperiode die ersten Basislinienproben mit einem Fraktionssammler sammeln. Sammeln Sie Proben im gewünschten Zeitintervall und legen Sie sie sofort auf Eis.
- Kontrollieren Sie die Blasenfalle regelmäßig und füllen Sie sie mit Perfusionspuffer auf, wenn sie fast leer ist.
- Eine Probe des Puffers wird durch einen Drei-Wege-Absperrhahn entnommen, unmittelbar bevor er in das Organ eintritt und aus dem Sammelkatheter, der in die untere Hohlvene eingeführt wird (nachdem er durch die Leber perfundiert wurde).
- Messen Sie die Proben mit einem Blutgasanalysator, um zu bestätigen, dass das Organ metabolisch aktiv ist (angezeigt durch einen Anstieg desCO2-Partialdrucks und eine Abnahme des pH-Werts).
- Wiederholen Sie die Schritte 4.3 bis 4.4 am Ende des Experiments, um die Durchführbarkeit während des gesamten Versuchs zu beurteilen (ergänzende Abbildung 2).
HINWEIS: Die Abnahme des Sauerstoffpartialdrucks liefert kein zuverlässiges Maß für die Atmung, da Sauerstoff aus den Schläuchen, dem Organ usw. verloren geht. - Nach 15 Minuten Ausgangsperfusion ist die erste Stimulation zu starten, indem eine Prüfsubstanz durch einen Dreiwegehahn mit der gewünschten Durchflussrate unter Verwendung einer Spritzenpumpe infundiert wird (z. B. 20-fache Konzentration der Prüfsubstanz bei einer Infusionsrate von 0,175 ml/min über eine Seitenarmpumpe). Alternativ kann der Basispuffer auf einen neuen (sauerstoffhaltigen und erhitzten) Puffer umgestellt werden, der die Testverbindung in der endgültigen Konzentration enthält.
- Beenden Sie die Stimulation und sammeln Sie Basisproben für 20-30 Minuten, bevor Sie mit der zweiten Stimulation beginnen.
- Am Ende des Experiments wird eine geeignete Positivkontrolle für 5-10 Minuten infundiert.
- Nach dem Experiment wird die durchblutete Leber herausgeschnitten und gewogen, um die Leistung auf das Lebergewicht zu normalisieren. Frieren Sie die Leber in flüssigem Stickstoff ein, um den Proteingehalt zu messen, um den Output auf den Proteingehalt zu normalisieren.
5. Biochemische Messungen
- Quantifizieren Sie die Konzentration des interessierenden Moleküls mit Assays, die für Messungen in Perfusionspuffer geeignet sind (interne oder kommerziell erhältliche kolorimetrische oder ELISA-Assays). Der Puffer ist mit den meisten Omics-basierten Techniken wie Metabolomik und Proteomik kompatibel.
HINWEIS: In dieser Studie wurde Harnstoff auf der Grundlage eines zuvor beschriebenen kolorimetrischen Assays gemessen14. Glukose und nicht veresterte Fettsäuren wurden mit kommerziell erhältlichen Kits quantifiziert.
6. Datenanalyse
- Stellen Sie die Daten in XY-Diagrammen dar, die die sekretorische Ausgabe im Zeitverlauf zeigen.
ANMERKUNG: Es ist einer der Vorzüge des In-vitro-Perfusionssystems, dass es möglich ist, Daten als tatsächlicher Output (Konzentration × Flussrate, z. B. μmol/min) anstelle der gemessenen Konzentration im Output (mmol/L) wie in In-vivo-Studien auszudrücken. Erwägen Sie, die Ausgabe auf das Lebergewicht zu normalisieren, wenn Sie verschiedene Mausmodelle vergleichen, oder auf den Gesamtproteingehalt (gemessen durch BCA), wenn Sie Kontrollmäuse mit Mausmodellen mit Fettleibigkeit oder Lebererkrankungen vergleichen, bei denen eine Zunahme des Lebergewichts auf einen erhöhten Fettgehalt zurückzuführen sein kann. - Präsentieren Sie zusammenfassende Daten als einzelne Punkte pro Tier, die den Mittelwert oder die Gesamtleistung während der Baseline und über einen Stimulationszeitraum (in der Regel 15-30 Minuten) oder den inkrementellen Output unter Verwendung der vorhergehenden Baseline für jeden Stimulationszeitraum je nach Studiendesign darstellen.
- Analysieren Sie die Daten mit einem gepaarten t-Test (zwei Gruppen) oder einer Einweg-ANOVA mit wiederholten Stimulationen (mehr als zwei Gruppen) mit einem geeigneten Post-hoc-Test für mehrere Tests.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Eine stabile Basislinie ist erforderlich, um festzustellen, ob ein Stimulus oder ein Substrat zur Freisetzung des interessierenden Moleküls führt. Abbildung 3A zeigt ein Beispiel für ein erfolgreiches Experiment. Die Produktion von Harnstoff in der durchbluteten Leber wird in 2-Minuten-Intervallen gemessen und als Mittelwert ± REM angezeigt. Die Ausgangsperioden, die jeder der beiden Stimulationsperioden vorausgehen, sind stabil. Die mittlere Harnstoffpro...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Die isolierte perfundierte Mäuseleber ist ein starkes Forschungswerkzeug für die Untersuchung der Dynamik und der molekularen Mechanismen des Leberstoffwechsels. Die Möglichkeit der minütlichen Probenentnahme ermöglicht eine detaillierte Bewertung der direkten Wirkung einer Testsubstanz auf die Leber. Im Vergleich zu In-vivo-Studien ermöglicht uns die perfundierte Leber, den Leberstoffwechsel isoliert zu untersuchen, extrahepatische Faktoren aus dem Blut zu vermeiden und die Versuchsbedingungen vollständ...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren erklären, dass für diesen Artikel keine Interessenkonflikte relevant sind.
Danksagungen
Die Studien und Nicolai J. Wewer Albrechtsen wurden durch den Novo Nordisk Foundation Excellence Emerging Investigator Grant - Endocrinology and Metabolism (Antrags-Nr. NNF19OC0055001), European Foundation for the Study of Diabetes Future Leader Award (NNF21SA0072746) und Independent Research Fund Denmark, Sapere Aude (1052-00003B). Das Novo Nordisk Foundation Center for Protein Research wird von der Novo Nordisk Foundation finanziell unterstützt (Grant Agreement NNF14CC0001). Abbildung 1B wurde mit biorender.com erstellt. Wir danken Dr. Rune E. Kuhre (Novo Nordisk A/S) für die fruchtbaren Diskussionen über die perfundierte Mäuseleber.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| 3-way stopcock | BD | 394601 | |
| Altromin breeding diet | Altromin Spezialfutter | 1319 | |
| Calcium chloride dihydrate (CaCl2·2H2O) | Sigma | C8106 | |
| Catheters (0.7 mm) | BD | 381812 | |
| Filter paper (pore size 2.0 µm) | Millipore | AP2029325 | |
| Glucose kit | QuantiChromTM | DIGL-100 | Low concentration protocol |
| Ketamine | MSD Animal Health | 511485 | 90 mg/kg |
| Ligature (black sterile silk) | Agnthos | 14739 | |
| Magnesium sulfate (MgSO4) | Sigma | 230391 | |
| Non-esterified fatty acids kit | Fujifilm Wako Chemicals | NEFA-HR(2) | |
| Operating table, heated on tripod stand, type 873 | Harvard Bioscience, Inc. | 733776 | |
| Potassium chloride (KCl) | Sigma | P9541 | |
| Potassium dihydrogen phosphate(KH2PO4) | Merck | 1.04877 | |
| Roller Pump, with four channels | Harvard Bioscience, Inc. | 730100 | |
| Sleek tape | Mediq danmark | 4001910 | |
| Sodium bicarbonate (NaHCO3) | Sigma | S5761 | |
| Sodium chloride (NaCl) | Sigma | S1679 | |
| Thermostatic Circulator | Harvard Bioscience, Inc. | 730125 | Bath Volume 3 L, 230 V/50 Hz |
| Tubing | Tygon | E3603 | Inner diameter 1.59 mm, outer diameter 3.18 mm |
| Universal perfusion system | Harvard Bioscience, Inc. | 732316 | Basic unit uniper UP-100, type 834 |
| Vamin | Fresenius Kabi | B05ABA01 | Mixed amino acids |
| Vessel clamp adaptor | Deutsche Biomedical | DBC1002 | |
| Vessel clamps | Deutsche Biomedical | DBC1005 | |
| Windkessel | Harvard Bioscience, Inc. | 732068 | |
| Xylazine | Rompun Vet | 530701 | 10 mg/kg |
Referenzen
- Bale, S. S., Geerts, S., Jindal, R., Yarmush, M. L. Isolation and co-culture of rat parenchymal and non-parenchymal liver cells to evaluate cellular interactions and response. Scientific Reports. 6, 25329(2016).
- Lauschke, V. M., et al. Massive rearrangements of cellular MicroRNA signatures are key drivers of hepatocyte dedifferentiation. Hepatology. 64 (5), 1743-1756 (2016).
- Seirup, M., et al. Rapid changes in chromatin structure during dedifferentiation of primary hepatocytes in vitro. Genomics. 114 (3), 110330(2022).
- Gupta, R., et al. Comparing in vitro human liver models to in vivo human liver using RNA-Seq. Archive of Toxicology. 95 (2), 573-589 (2021).
- Bell, C. C., et al. Characterization of primary human hepatocyte spheroids as a model system for drug-induced liver injury, liver function, and disease. Scientific Reports. 6, 25187(2016).
- Dewyse, L., Reynaert, H., van Grunsven, L. A. Best practices and progress in precision-cut liver slice cultures. International Journal of Molecular Sciences. 22 (13), 7137(2021).
- Li, X., George, S. M., Vernetti, L., Gough, A. H., Taylor, D. L. A glass-based, continuously zonated and vascularized human liver acinus microphysiological system (vLAMPS) designed for experimental modeling of diseases and ADME/TOX. Lab on a Chip. 18 (17), 2614-2631 (2018).
- Broutier, L., et al. Culture and establishment of self-renewing human and mouse adult liver and pancreas 3D organoids and their genetic manipulation. Nature Protocols. 11 (9), 1724-1743 (2016).
- Bartošek, I., Guaitani, A., Miller, L. L. Isolated Liver Perfusion and its Applications. , Raven Press. New York. (1973).
- Gores, G. J., Kost, L. J., LaRusso, N. F. The isolated perfused rat liver: conceptual and practical considerations. Hepatology. 6 (3), 511-517 (1986).
- Mischinger, H. J., et al. An improved technique for isolated perfusion of rat livers and an evaluation of perfusates. Journal of Surgical Research. 53 (2), 158-165 (1992).
- Vairetti, M., et al. Correlation between the liver temperature employed during machine perfusion and reperfusion damage: role of Ca2. Liver Transplantation. 14 (4), 494-503 (2008).
- Ferrigno, A., Richelmi, P., Vairetti, M. Troubleshooting and improving the mouse and rat isolated perfused liver preparation. Journal of Pharmacological and Toxicological Methods. 67 (2), 107-114 (2013).
- Zawada, R. J. X., Kwan, P., Olszewski, K. L., Llinas, M., Huang, S. -G. Quantitative determination of urea concentrations in cell culture medium. Biochemistry and Cell Biology. 87 (3), 541-544 (2009).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten