A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الجمع بين مقياس الشم المتزامن مع التنفس ومحاكاة الدماغ لدراسة تأثير الروائح على استثارة القشرية الشوكية والاتصال الفعال
In This Article
Summary
تصف هذه الورقة استخدام مقياس الشم المتزامن مع التنفس لتحفيز التحفيز المغناطيسي عبر الجمجمة أحادي ومزدوج الملف (TMS) أثناء عرض الرائحة المتزامن مع التنفس الأنفي البشري. يسمح لنا هذا المزيج بالتحقيق بشكل موضوعي في كيفية تأثير الروائح اللطيفة وغير السارة على استثارة القشرية الشوكية والاتصال الفعال للدماغ لدى فرد معين.
Abstract
من المقبول على نطاق واسع أن التحفيز الشمي يثير السلوكيات الحركية ، مثل الاقتراب من الروائح اللطيفة وتجنب الروائح الكريهة ، في والبشر. في الآونة الأخيرة ، أظهرت الدراسات التي تستخدم تخطيط كهربية الدماغ والتحفيز المغناطيسي عبر الجمجمة (TMS) وجود صلة قوية بين المعالجة في الجهاز الشمي والنشاط في القشرة الحركية لدى البشر. لفهم التفاعلات بين الأنظمة الشمية والحركية بشكل أفضل وللتغلب على بعض القيود المنهجية السابقة ، قمنا بتطوير طريقة جديدة تجمع بين مقياس الشم الذي يتزامن مع عرض الترتيب العشوائي للروائح بقيم المتعة المختلفة و TMS (ملف واحد ومزدوج) يؤدي إلى مراحل التنفس الأنفي. تسمح هذه الطريقة بفحص تعديلات استثارة القشرية الشوكية والاتصال المماثل الفعال بين قشرة الفص الجبهي الظهري الوحشي والقشرة الحركية الأولية التي يمكن أن تحدث أثناء إدراك الرائحة اللطيفة وغير السارة. سيسمح تطبيق هذه الطريقة بالتمييز الموضوعي لقيمة اللطف للرائحة في مشارك معين ، مما يشير إلى التأثير البيولوجي للرائحة على الاتصال الفعال للدماغ واستثارته. بالإضافة إلى ذلك ، يمكن أن يمهد هذا الطريق للتحقيقات السريرية في المرضى الذين يعانون من اضطرابات عصبية أو نفسية عصبية والذين قد يظهرون تغيرات في رائحة المتعة وسلوكيات تجنب النهج غير التكيفي.
Introduction
من المقبول على نطاق واسع أن التحفيز الشمي يثير ردود فعل تلقائية وسلوكيات حركية. على سبيل المثال ، في البشر ، تم مؤخرا إثبات وجود استجابة حركية لتجنب (تميل بعيدا عن مصدر الرائحة) تحدث بعد 500 مللي ثانية من ظهور الرائحة السلبية1. من خلال تسجيل المشاركين البشريين الذين يتحركون بحرية وهم يستكشفون الروائح المنبعثة من القوارير ، أظهر Chalençon et al. (2022) أن السلوكيات الحركية (أي سرعة الاقتراب من الأنف وسحب القارورة التي تحتوي على الرائحة) ترتبط ارتباطا وثيقا برائحة المتعة2. علاوة على ذلك ، تم مؤخرا إثبات وجود صلة وثيقة بين المعالجة في الجهاز الشمي والنشاط في القشرة الحركية في البشر باستخدام تخطيط كهربيةالدماغ 1. على وجه التحديد ، بعد حوالي 350 مللي ثانية من ظهور الروائح السلبية ، لوحظ عدم تزامن إيقاع مو محدد ، والمعروف أنه يعكس عمليات إعداد العمل ، فوق وداخل القشرة الحركية الأولية (M1) ، تليها بعد فترة وجيزة حركة سلوكية للخلف1. لتعزيز فكرة العلاقة بين الجهاز الشمي والحركي ، أظهرت دراسة حديثة أخرى أن التعرض لرائحة لطيفة زاد من استثارة القشرية الشوكية مقارنة بحالة عدم الرائحة3. في هذه الدراسة ، تم تطبيق التحفيز المغناطيسي عبر الجمجمة أحادي النبضة (spTMS) على M1 لاستحضار إمكانات مستثارة بمحرك (MEP) في عضلة اليد المستهدفة ، مسجلة محيطيا باستخدام تخطيط كهربية العضل (EMG) أثناء إدراك الرائحة. تم توفير التعرض للرائحة اللطيفة بشكل سلبي بواسطة شرائط ورقية مبللة بزيت البرغموت الأساسي النقي وتوضع على حامل معدني تحت الأنف3. في هذا السياق ، لا يزال من غير الواضح ما إذا كان تسهيل استثارة القشرية الشوكية يرجع إلى تحفيز الرائحة اللطيف أو إلى تأثيرات سلوكية غير محددة مثل الاستنشاق وصرير الأسنان 4,5. علاوة على ذلك ، لا يزال من غير المعروف كيف تعدل الرائحة الكريهة استثارة M1 التي تم فحصها بواسطة TMS.
باختصار ، يسلط هذا الضوء على الحاجة إلى تطوير طريقة تقدم المزايا التالية على التقنيات الحالية المستخدمة في الدراسات السابقة3،6: (1) التوزيع العشوائي لعرض ظروف الرائحة المختلفة (لطيفة / غير سارة / عديمة الرائحة) في نفس المرحلة التجريبية ، (2) مزامنة عرض الرائحة بدقة وتوقيت TMS وفقا لمراحل التنفس الأنفي البشري (الإلهام وانتهاء الصلاحية) عند دراسة النظام الحركي.
يمكن أيضا استخدام TMS كأداة للتحقيق في التفاعلات القشرية القشرية ، والتي تسمى أيضا الاتصال الفعال ، بين مناطق قشرية متعددة و M1 بدقة زمنية عالية7،8،9،10،11،12. هنا ، نستخدم نموذج TMS ثنائي الموقع (dsTMS) ، حيث يقوم تحفيز التكييف الأول (CS) بتنشيط منطقة قشرية مستهدفة ، ويتم تطبيق تحفيز الاختبار الثاني (TS) على M1 باستخدام ملف آخر لاستحضار MEP. يتم تقييم تأثير CS عن طريق تطبيع سعة MEP المشروطة (حالة dsTMS) إلى سعة MEP غير المشروطة (حالة spTMS) 13. بعد ذلك ، تشير قيم النسبة السالبة إلى تفاعلات قشرية قشرية قمعية ، بينما تشير قيم النسبة الموجبة إلى تفاعلات قشرية قشرية ميسرة بين المنطقتين المحفزتين. وبالتالي ، يوفر نموذج dsTMS فرصة فريدة لتحديد الطبيعة (أي الميسرة أو القمعية) ، والقوة ، وتشكيلات الاتصال الفعال بين المنطقة المنشطة مسبقا و M1. الأهم من ذلك ، أن التفاعلات القشرية القشرية تعكس توازنا معقدا من التيسير والقمع الذي يمكن تعديله في توقيت مختلف وحالات أو مهام عقلية 7,14.
على حد علمنا ، لم يتم استخدام نموذج dsTMS الجديد نسبيا للتحقيق في التفاعلات القشرية القشرية أثناء إدراك الرائحة بقيم المتعة المختلفة. ومع ذلك ، فقد أظهرت دراسات التصوير العصبي أن التعرض للروائح اللطيفة وغير السارة يؤدي إلى تغييرات في الاتصال في المناطق المشاركة في العاطفة واتخاذ القرار والتحكم في العمل ، بما في ذلك المنطقة الحركية التكميلية ، والقشرة الحزامية الأمامية ، وقشرة الفص الجبهي الظهري الوحشي (DLPFC)15،16. في الواقع ، يعد DLPFC عقدة رئيسية تتوسط في التحكم العاطفي والمعالجة الحسية والجوانب ذات المستوى الأعلى للتحكم في المحركات ، مثل العمليات التحضيرية17،18،19. بالإضافة إلى ذلك ، قدمت كل من الدراسات البشرية والحيوانية دليلا على أن DLPFC لديه توقعات عصبية متنوعة إلى M117،18،20،21،22. اعتمادا على السياق ، يمكن لتوقعات DLPFC هذه إما تسهيل أو تثبيط نشاط M17،19،20. وبالتالي ، يبدو من الممكن أن يتم تعديل الاتصال الفعال بين DLPFC و M1 أثناء عرض الرائحة وأن الروائح اللطيفة وغير السارة تجند شبكات قشرية منفصلة ، مما يؤدي إلى تأثير تفاضلي على اتصال DLPFC-M1.
هنا ، نقترح طريقة جديدة مناسبة للدراسة المنهجية الصارمة لتعديلات استثارة القشرية الشوكية والاتصال الفعال الذي قد يحدث أثناء إدراك الروائح اللطيفة وغير السارة ، وكلها يتم تسليمها بالتزامن مع التنفس الأنفي البشري.
Protocol
تمت الموافقة على جميع الإجراءات التجريبية الموضحة في الأقسام التالية من قبل لجنة الأخلاقيات (CPP Ile de France VII، باريس، فرنسا، رقم البروتوكول 2022-A01967-36) وفقا لإعلان هلسنكي. قدم جميع المشاركين موافقة خطية مستنيرة قبل التسجيل في الدراسة.
1. توظيف المشاركين
- معايير الإدراج / الاستبعاد.
- قم بتضمين المشاركين البالغين (> 18 عاما). افحص جميع المشاركين بحثا عن أي موانع ل TMS وفقا لإرشادات الخبراء الدوليين23.
- استبعد المشاركين الذين لديهم أجهزة طبية مزروعة (على سبيل المثال ، زراعة القوقعة الصناعية ، جهاز تنظيم ضربات القلب ، إلخ) ، وتاريخ شخصي أو عائلي من النوبات ، والصداع ، وصدمة الدماغ ، والأدوية العصبية النشطة. استبعاد المشاركين الذين يعتبرون "فقدان الشهية" وفقا للاختبار الأوروبي للقدرات الشمية24.
- استخدام اليدين: تحقق من استخدام اليد اليمنى كما تم تقييمه بواسطة استبيان جرد إدنبرةلليد 25.
ملاحظه. يوصى بشدة بتجنيد المشاركين الذين يستخدمون اليد اليمنى فقط في الدراسات التي تقيم استثارة القشرية الشوكية والاتصال الفعال في النظام الحركي26,27. - المعلومات والموافقة المستنيرة: قدم لجميع المشاركين معلومات أساسية حول أهداف الدراسة وإجراءاتها والمخاطر التي وافقت عليها لجنة الأخلاقيات واطلب منهم التوقيع على موافقة خطية مستنيرة.
2. الإجراء التجريبي
- تركيب المريض: اطلب من المشارك الجلوس على كرسي مريح (نوع كرسي الأسنان) مع استرخاء كلتا يديه وحثيثهما. ضع رأس المشارك على مسند الذقن لتقليل حركة الرأس أثناء التحفيز.
- تسجيلات تخطيط كهربية العضل
- قم بإعداد جلد المشارك قبل تطبيق القطب باستخدام مقشر مقشر لكشط المناطق برفق وتنظيف المناطق باستخدام ضمادات كحولية حيث سيتم وضع الأقطاب الكهربائية.
- ضع قطبين كهربائيين للتسجيل من كلوريد الفضة / الفضة مع مونتاج وتر البطن للعضلة الظهرية الأولى بين العظام (FDI). أضف القطب الأرضي إلى عملية الإبرة في الزند (الشكل 1).
- قم بتوصيل الأقطاب الكهربائية بمكبر الصوت باستخدام الكابلات ونظام الحصول على البيانات.
- سجل إشارة EMG باستخدام نظام تحويل تناظري إلى رقمي (AD). تضخيم وتصفية إشارات EMG (الكسب = 1000) باستخدام تردد عرض النطاق الترددي بين 10 هرتز و 1 كيلو هرتز. قم بالرقمنة بمعدل أخذ عينات يبلغ 2000 هرتز وقم بتخزين كل ملف EMG لتحليله في وضع عدم الاتصال.
- تحقق من جودة الإشارة المعروضة على شاشة الكمبيوتر المتصلة بنظام الحصول على البيانات.
- TMS لفائفموقف M1 .
- قم بتوصيل هذا الملف بالمحفز A (الشكل 1).
- ضع قبعة ضيقة على رأس المشارك. استخدم شريط قياس لإجراء قياسات nasion-inion و tragus-tragus ومحيط الرأس بناء على معالم الجمجمة القياسية. حدد وعلم بقلم قمة فروة الرأس عند تقاطع خطوط منتصف السهمي (nasion-inion) وبين الأذنين (tragus-tragus)28.
- ضع بشكل عرضي على فروة الرأس أول ملف صغير من ثمانية أشكال (القطر الداخلي: 40 مم) فوق منطقة اليد المفترضة لليسار M1 (الملفM1) ، وهو جانبي 5 سم من الرأس ، مع توجيه المقبض للخلف وبشكل جانبي بزاوية 45 درجة إلى الخط السهمي الأوسط ، مما يؤدي إلى تدفق تيار خلفي أمامي (شكل موجة تيار أحادي الطور). يتوافق هذا الاتجاه مع الحد الأقصى للتيار المستحث المتدفق داخل M1 داخل M129.
- تأكد من أن وضع الملفM1 هو الأمثل ، وفقا لأحدث التوصيات الدولية30. ابدأ بتوصيل بضع نبضات مفردة بنسبة 30٪ من الحد الأقصى لإخراج المحفز (٪ MSO) وتحقق من أن التحفيز ينتج MEP كما هو مسجل بواسطة نظام EMG ويتم عرضه على شاشة الكمبيوتر المتصلة بنظام الحصول على البيانات.
- إذا لم تكن هناك استجابات مرئية ، فقم بزيادة شدة التحفيز تدريجيا (زيادات 5٪ MSO) حتى يتم ملاحظة MEPs. بعد ذلك ، اختبر أربع نقاط حول الموقع الأول عن طريق توصيل نبضات متعددة. حدد متوسط سعة MEP من الذروة إلى الذروة لكل موقع.
- حدد الموقع الذي يكون فيه متوسط سعة MEP من الذروة إلى الذروة هو الأعلى. هذا هو ما يسمى موقع نقطة الاتصال للمشارك30. ضع علامة على موقعالملف M1 على الغطاء لضمان وضع الملف بشكل صحيح طوال التجربة.
- عتبة محرك الراحة (rMT) وشدة TMS
- حدد عتبة محرك الراحة (rMT) المعرفة على أنها شدة TMS التي تنتج احتمالا بنسبة 50٪ لاستنباط MEP23,30.
- استخدم البرنامج المجاني المتاح عبر الإنترنت (أداة تقييم عتبة محرك TMS ، MTAT 2.1) ، والذي يعتمد على تقدير معلمة الاحتمال الأقصى باستخدام استراتيجية اختبار تسلسلية29. يبدأ تسلسل التحفيز دائما بالشدة المحددة عند 37٪ MSO.
- دع أحد المجربين يمسك الملفM1 بينما يشير آخر إلى ما إذا كانت سعة MEP > 0.05 mV. ثم تحدد الخوارزمية التنبؤية شدة التحفيز التالية التي سيتم تسليمها ويتم إيقافها بعد 20 تحفيزا ، مما يوفر دقة كافية لتقدير rMT وفقا للدراسات السابقة31-34.
- اضبط٪ MSO للتكييف وتحفيز نبض الاختبار. استخدم قيمة rMT المحددة مسبقا للمشارك.
ملاحظة: هنا ، تم ضبط شدة تحفيز التكييف الأول (ملفDLPFC) على 110٪ من rMT19,20. تم تحديد شدة تحفيز الاختبار (الملفM1) بنسبة 120٪ من rMT ، وهي شدة تختلف قليلا عن الدراسات السابقة التي استخدمت شدة TS التي أثارت MEP ~ 1 mV في جميع المشاركين19,20 . تحدث هذه الكثافة الثابتة من الذروة إلى الذروة في نقاط مختلفة جدا على منحنيات توظيف المدخلات والمخرجات بسبب التباين العالي بين الموضوعات في خرج المحرك35. لذلك ، يمكن تحسين شدة التحفيز باستخدام كثافة RMT بنسبة 120٪ عبر الأفراد.
- حدد عتبة محرك الراحة (rMT) المعرفة على أنها شدة TMS التي تنتج احتمالا بنسبة 50٪ لاستنباط MEP23,30.
- TMS لفائفDLPFC تحديد المواقع
- قم بتوصيل هذا الملف بمحفز B (الشكل 1).
- استخدم الاستدلال على فروة الرأس الذي تم تحديثه مؤخرا لتحديد منطقة فروة الرأس المقابلة ل DLPFC36,37 الأيسر لتقدير موضع الملف الثاني الصغير المكون من ثمانية (القطر الداخلي: 40 مم) فوق DLPFC (الملفDLPFC). قم بتنزيل أداة حساب جدول بيانات Excelعبر الإنترنت 36 وأدخل مسافات nasion-inion و tragus-tragus ومحيط الرأس بالسنتيمتر كمدخلات. أبلغ عن مسافات XLA و YLA مباشرة على رأس المشارك.
- ضع الملفDLPFC بشكل عرضي على فروة الرأس فوق موقع DLPFC الأيسر المفترض ، مع توجيه المقبض لأسفل وجانبيا بزاوية -45 درجة إلى منتصف الخط السهمي. ضع علامة على وضع الملفDLPFC على الغطاء لضمان وضع الملف بشكل صحيح طوال التجربة.
ملاحظة: طريقة الاستهداف المستندة إلى فروة الرأس لكل من مواقع الملفM1 والملفDLPFC ليست مثالية. في الواقع ، من المعروف أنها أقل دقة من طريقة الملاحة العصبية المستخدمة لاستهداف مناطق الاهتمام في الدماغ بناء على التصوير بالرنين المغناطيسي التشريحي T1 (MRI) 38.
- التأخير بين نبضات التكييف والاختبار: اضبط هذا التأخير على 10 مللي ثانية على جهاز مولد النبضات.
ملاحظة: هنا ، تم إصلاح التأخير عند 10 مللي ثانية بناء على الدراسات السابقة التي تظهر تأثيرا مثبطا من DLPFC الأيسر إلى M1 الأيسر في هذه الفترة19,20. من المحتمل أن يكون هذا التأثير المثبط الذي لوحظ عند 10 مللي ثانية بسبب تنشيط العقد القاعدية عبر إسقاطات DLPFC إلى ما قبل SMA ، وبالتالي ممارسة تأثير غير مباشر على M139. يمكن تعديل التأخير في الكود وفقا لاحتياجات المستخدم. على سبيل المثال ، يمكن استخدام فترة تحفيز بيني أطول (أي 25 مللي ثانية) للتحقيق في الدوائر القشرية تحت القشرية غير القشرية غير المباشرة متعددة المشابك التي تربط DLPFC ب M119. علاوة على ذلك ، تم إثبات التأثيرات الميسرة / المثبطة التفاضلية باستخدام ppTMS ثنائي الموقع بين مناطق قشرية متعددة ، مع فترات تتراوح من 1 مللي ثانية إلى 150 مللي ثانية40,41. وبالتالي ، فإن حقيقة أنه يمكن تعديل الفاصل الزمني يفتح الطريق أمام مجموعة واسعة من الاحتمالات للدراسات البحثية المستقبلية. - إعدادات مقياس الشم
- حدد الروائح ذات قيم المتعة اللطيفة وغير السارة. تمييع مقدما الروائح بشكل فردي في الزيوت المعدنية لخلق إدراك متساوي الكثافة.
ملاحظة: هنا ، استند اختيار وتركيز الروائح (أي أسيتات الأيزو أميل وحمض الزبد المخفف إلى 0.6٪ و 0.11٪ من تركيزات المجلد / المجلد ، على التوالي) إلى الدراسات السابقة التي أجرتها مجموعتنا باستخدام نفس إعداد مقياس الشم والروائح42،43. تؤكد دراسة تجريبية أن الروائح الإيجابية والسلبية لم تختلف من حيث الشدة ولكنها كانت معاكسة في قيمة المتعة. في حالة التحكم (أي عدم وجود رائحة) ، يتم تسليم تدفق الهواء فقط إلى المشارك. - اكتب الكود لتوصيل الروائح. لكل تجربة ، حدد المدة الإجمالية للتجربة ، والرائحة التي سيتم تسليمها ، ومعدل تدفق وحدة التحكم في الرائحة (بالملليلتر في الدقيقة) ، ومعدل تدفق منظم الهواء الناقل (بالملليلتر في الدقيقة) ، ومعدل تدفق منظم الشفط.
ملاحظة: يمكن أن يكون ترتيب الرائحة التي يتم تسليمها عشوائيا بين الإيجابية والسلبية والخالية من الرائحة. هنا ، كل تجربة لها مدة 12 ثانية. كان ترتيب الرائحة التي تم تسليمها عشوائيا زائفا. بالإضافة إلى ذلك ، بناء على تجربة تجريبية ، تم ضبط معدل تدفق وحدة التحكم في الرائحة على 200 مل / دقيقة ، ومعدل تدفق منظم الهواء الناقل عند 500 مل / دقيقة ، ومعدل تدفق منظم الشفط عند 100 مل / دقيقة. - ضع قنية الأنف بالقرب من أنف المشارك لقياس التنفس الأنفي. اطلب من المشارك التنفس بشكل طبيعي من خلال الأنف.
- قم بتشغيل ضاغط الهواء المحمول وعلبة مقياس الشم والكمبيوتر الذي يحتوي على البرنامج. تحقق من جميع توصيلات الكابلات (الشكل 1).
ملاحظة: تم وصف مقياس الشم المستخدم في الدراسة الحالية بالتفصيل في منشور سابق44 ولكن تم تعديله هنا للسماح بتشغيل TMS مع تأخيرات متغيرة بعد اكتشاف بداية الإلهام. باختصار ، يتكون الجهاز من عدة وحدات ، بما في ذلك 1) مصدر الهواء ونظام معالجة الهواء القادم من ضاغط هواء محمول ، 2) نظام تحفيز بما في ذلك الأجهزة الإلكترونية والهوائية ، 3) رأس خلط محلي الصنع مقترن بنظام توصيل يسمح بنشر الروائح في أنف المشارك ، 4) نظام حسي تنفسي يقوم بتشغيل مقياس الشم وفقا لقياس التنفس الأنفي باستخدام قنية أنفية و 5) برنامج نظام التحكم44. - المعايرة: انتقل إلى مرحلة المعايرة (حوالي 20 ثانية) ، والتي تسمح بمعايرة الإشارة التنفسية للمشارك وضبط عتبات الكشف عن مرحلتي الزفير والشهيق. في هذا البرنامج ، تكون مرحلة الزفير إيجابية ، ومرحلة الشهيق سلبية.
- تصنيفات المتعة وشدة الرائحة: قم بتسليم الروائح بترتيب عشوائي واطلب من المشاركين تقييم قيمة المتعة وشدة كل رائحة على مقاييس تناظرية بصرية تتراوح من 1 "ليس لطيفا على الإطلاق" إلى 9 "لطيف للغاية" ومن 1 "ليس مكثفا على الإطلاق" إلى "شديد للغاية".
- حدد الروائح ذات قيم المتعة اللطيفة وغير السارة. تمييع مقدما الروائح بشكل فردي في الزيوت المعدنية لخلق إدراك متساوي الكثافة.
- الجمع بين مقياس الشم والتحفيز المغناطيسي عبر الجمجمة (TMS): اضبط التأخير بين اكتشاف مرحلة الإلهام ومشغل إرسال TMS عند 600 مللي ثانية.
ملاحظة: يعد إعداد التأخير أمرا مهما ويجب تحديده وفقا للأدبيات واحتياجات المستخدم. في هذا البروتوكول ، تم تعيين التأخير عند 600 مللي ثانية ، والذي ثبت أنه أقصى تمثيل إدراكي واع للروائح45. بالنسبة لحالة TMS أحادية النبضة ، يقوم هذا الزناد على الفور بتنشيط المحفز A ، ويتم توصيل نبضة بواسطة الملف الموجود على M1 الأيسر لاستحضار MEP غير مشروط. بالنسبة لحالة TMS ثنائية الملف ، يتم إرسال هذا المشغل إلى جهازين مختلفين (عبر كبلين متحدي المحور متصلين بواسطة اتصال T): الأول ينشط على الفور محفز B ويتم توصيل نبضة تكييف بواسطة الملف الموجود على DLPFC الأيسر ؛ يتم استقبال الثاني بواسطة مولد نبض يجعل من الممكن إحداث تأخير ثابت قبل تنشيط المحفز A ، وبالتالي تقديم تحفيز اختبار من خلال الملف الموجود على M1 الأيسر لاستحضار MEP مشروط (الشكل 1).
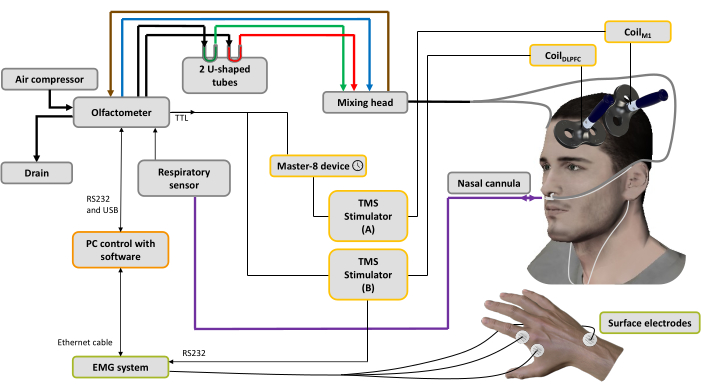
الشكل 1: الإعداد التجريبي. تمثل الخطوط الجريئة اتصالات هوائية. يتم توصيل ضاغط الهواء بمقياس الشم لتوليد تدفقات هواء مختلفة. يتحكم المنظم في الضغط ، ويتم توجيه تدفق الهواء الداخل إلى 3 قنوات (من خلال 3 منظمات كتلة): واحدة لناقل الهواء (الخط الأزرق) ، وواحدة لنظام الشفط (الخط البني) للتنظيف والمساعدة في التحكم في وقت التحفيز والأخيرة للروائح44. يحتوي أنبوبان على شكل حرف U على الروائح (أخضر: لطيف ؛ أحمر: غير سار) حيث يتم تكييفهما تحت الضغط في حالة البخار المشبع ، مما يضمن تدفق هواء ذو رائحة بكثافة مستقرة بمرور الوقت. يستخدم رأس الخلط لخلط تيارات الهواء النظيفة والرائحة. يتم توصيل تدفق الهواء (ذو الرائحة أو النقية) إلى فتحتي الأنف من خلال أنبوبين (خطوط رمادية) متصلين بقنية أنفية ، والتي تستخدم أيضا لتسجيل التنفس الأنفي (الخط الأرجواني). بناء على الإشارة التنفسية ، بمجرد اكتشاف مرحلة الاستنشاق ، بالنسبة لحالة spTMS ، يتم إرسال الزناد إلى جهاز مولد النبض المستخدم لضبط التأخير (هنا: 10 مللي ثانية) ، ثم إلى محفز TMS A المتصل بالملفM1 المطبق على تمثيل عضلة اليد M1 الأيسر ، بينما يتم إيقاف تشغيل محفز TMS B. بالنسبة لحالة dsTMS ، يتم إرسال مشغل على الفور إلى محفز TMS B المتصل بملفDLPFC المطبق على DLPFC الأيسر ، ويتم استخدام جهاز مولد النبض لضبط تأخير (هنا: 10 مللي ثانية) قبل تشغيل محفز TMS A المتصل بالملفM1. يتم تسجيل الإشارة التنفسية وسعة MEP المكتسبة بواسطة نظام EMG بواسطة برنامج مثبت على جهاز كمبيوتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. القياسات
- قم بتشغيل البرنامج النصي للترميز المخصص في برنامج مقياس الشم (انظر الخطوة 2.7.2) لتقديم جميع مجموعات spTMS و dsTMS مع روائح لطيفة وغير سارة ولا روائح تحدث بترتيب عشوائي.
ملاحظة: سجلت هنا 20 تجربة لكل حالة (120 تجربة إجمالا). تم تقسيم التجربة إلى 6 كتل من 20 تجربة لكل منها. يمكن تغيير عدد التجارب لكل حالة وفقا لاحتياجات المستخدم.
4. تحليل البيانات
- لكل مشارك وحالة وتجربة ، استخرج سعة MEP من الذروة إلى الذروة. يمكن القيام بذلك باستخدام أحد صناديق الأدوات مفتوحة المصدر المتاحة عبر الإنترنت46,47.
- تطبيع البيانات عن طريق حساب نسبة MEP التي تعبر عن MEPs المستنبطة بواسطة تحفيز الاختبار في تجارب dsTMS بالنسبة إلى MEPs المستمدة من تحفيز الاختبار في تجارب spTMS12. افعل ذلك بشكل منفصل لكل مشارك ولكل حالة رائحة (أي لا رائحة ، رائحة إيجابية ، ورائحة سلبية). بعد هذا الإجراء ، قم بتفسير النتائج على النحو التالي: تشير نسب MEP فوق 1 إلى تأثير ميسر ل DLPFC على M1 ، بينما تشير نسب MEP أقل من 1 إلى تأثير مثبط ل DLPFC على M1.
النتائج
تعكس البيانات التمثيلية المقدمة هنا تسجيلات من المشاركين بعد إكمال البروتوكول خطوة بخطوة أعلاه لتقديم نظرة ثاقبة أولية لما قد نتوقعه.
يوضح الشكل 2 مثالا على الإشارات التنفسية لمشارك تمثيلي مسجلة باستخدام برنامج مقياس الشم. يتم اكتشاف مراحل الزفير والشهيق ?...
Discussion
يصف البروتوكول أعلاه طريقة جديدة تجمع بين استخدام مقياس الشم المتزامن مع التنفس مع TMS أحادي ومزدوج الملف للتحقيق في التغيرات في استثارة القشرية الشوكية والاتصال الفعال اعتمادا على قيمة المتعة للروائح. سيسمح هذا الإعداد بالتمييز الموضوعي لقيمة اللطف للرائحة في مشارك معين ، مما يشير إلى ا?...
Disclosures
JB هو عضو مجلس إدارة قسم تحفيز الدماغ (STEP) التابع للجمعية الفرنسية للطب النفسي البيولوجي وعلم الأدوية النفسية العصبية (AFPBN) ، التابع للجمعية الأوروبية لتحفيز الدماغ (ESBS) ، ويقدم تقارير عن منح بحثية أكاديمية في مجال تحفيز الدماغ من CIHR (كندا) و ANR و PHRC (فرنسا). المؤلفون الآخرون ليس لديهم ما يكشفون عنه.
Acknowledgements
تم دعم هذا العمل من قبل مؤسسة فرنسا ، المنحة رقم: 00123049 / WB-2021-35902 (منحة تلقاها J.B. و N.M.). يود المؤلفون أن يشكروا مؤسسة Pierre Deniker على دعمها (المنحة التي تلقتها C.N.) وموظفي منصة Neuro-Immersion لمساعدتهم القيمة في تصميم الإعداد.
Materials
| Name | Company | Catalog Number | Comments |
| Acquisition board (8 channels) | National Instrument | NI USB-6009 | |
| Air compressor | Jun-Air | Model6-15 | |
| Alcohol prep pads | Any | ||
| Butyric acid | Sigma-Aldrich | B103500 | Negative odorant |
| Desktop computer | Dell | Latitude 3520 | |
| EMG system | Biopac System | MP150 | |
| Isoamyl acetate | Sigma-Aldrich | W205508 | Positive odorant |
| Nasal cannula | SEBAC France | O1320 | |
| Programmable pulse generator | A.M.P.I | Master-8 | |
| Surface electrodes | Kendall Medi-trace | FS327 | |
| TMS coil (X2) | MagStim | D40 Alpha B.I. coil | |
| TMS machine | MagStim | Bistim2 | |
| Tube 6 mm x 20 m | Radiospare | 686-2671 | Pneumatic connection |
| USB-RS232 | Radiospare | 687-7806 | |
| U-shaped tubes | VS technologies | VS110115 |
References
- Iravani, B., Schaefer, M., Wilson, D. A., Arshamian, A., Lundström, J. N. The human olfactory bulb processes odor valence representation and cues motor avoidance behavior. Proceedings of the National Academy of Sciences. 118 (42), e2101209118 (2021).
- Chalençon, L., Thevenet, M., Noury, N., Bensafi, M., Mandairon, N. Identification of new behavioral parameters to assess odorant hedonic value in humans: A naturalistic approach. Journal of Neuroscience Methods. 366, 109422 (2022).
- Infortuna, C., et al. Motor cortex response to pleasant odor perception and imagery: The differential role of personality dimensions and imagery ability. Frontiers in Human Neuroscience. 16, 943469 (2022).
- Ozaki, I., Kurata, K. The effects of voluntary control of respiration on the excitability of the primary motor hand area, evaluated by end-tidal CO2 monitoring. Clinical Neurophysiology. 126 (11), 2162-2169 (2015).
- Boroojerdi, B., Battaglia, F., Muellbacher, W., Cohen, L. G. Voluntary teeth clenching facilitates human motor system excitability. Clinical Neurophysiology. 111 (6), 988-993 (2000).
- Rossi, S., et al. Distinct olfactory cross-modal effects on the human motor system. PLOS One. 3 (2), e1702 (2008).
- Neige, C., Rannaud Monany, D., Lebon, F. Exploring cortico-cortical interactions during action preparation by means of dual-coil transcranial magnetic stimulation: A systematic review. Neuroscience and Biobehavioral Reviews. 128 (October 2020), 678-692 (2020).
- Koch, G. Cortico-cortical connectivity: the road from basic neurophysiological interactions to therapeutic applications. Experimental Brain Research. 238 (7-8), 1677-1684 (2020).
- Derosiere, G., Vassiliadis, P., Duque, J. Advanced TMS approaches to probe corticospinal excitability during action preparation. NeuroImage. 213 (November 2019), 116746 (2020).
- Goldenkoff, E. R., Mashni, A., Michon, K. J., Lavis, H., Vesia, M. Measuring and manipulating functionally specific neural pathways in the human motor system with transcranial magnetic stimulation. Journal of Visualized Experiments JoVE. 156, 60706 (2020).
- Malderen, S. V., Hehl, M., Verstraelen, S., Swinnen, S. P., Cuypers, K. Dual-site TMS as a tool to probe effective interactions within the motor network: a review. Reviews in the Neurosciences. 34 (2), 129-221 (2023).
- Neige, C., et al. Connecting the dots: Harnessing dual-site transcranial magnetic stimulation to assess the causal influence of medial frontal areas on the motor cortex. Cerebral Cortex. , bhad370 (2023).
- Ferbert, A., Priori, A., Rothwell, J. C., Day, B. L., Colebatch, J. G., Marsden, C. D. Interhemispheric inhibition of the human motor cortex. The Journal of physiology. 453, 525-546 (1992).
- Rothwell, J. C. Using transcranial magnetic stimulation methods to probe connectivity between motor areas of the brain. Human Movement Science. 30 (5), 906-915 (2011).
- Carlson, H., Leitão, J., Delplanque, S., Cayeux, I., Sander, D., Vuilleumier, P. Sustained effects of pleasant and unpleasant smells on resting state brain activity. Cortex. 132, 386-403 (2020).
- Farruggia, M. C., Pellegrino, R., Scheinost, D. Functional connectivity of the chemosenses: A review. Frontiers in Systems Neuroscience. 16, 865929 (2022).
- Hasan, A., Galea, J. M., Casula, E. P., Falkai, P., Bestmann, S., Rothwell, J. C. Muscle and timing-specific functional connectivity between the dorsolateral prefrontal cortex and the primary motor cortex. Journal of Cognitive Neuroscience. 25 (4), 558-570 (2013).
- Brown, M. J. N., Goldenkoff, E. R., Chen, R., Gunraj, C., Vesia, M. Using dual-site transcranial magnetic stimulation to probe connectivity between the dorsolateral prefrontal cortex and ipsilateral primary motor cortex in humans. Brain Sciences. 9 (8), 177 (2019).
- Xia, X., et al. Connectivity from ipsilateral and contralateral dorsolateral prefrontal cortex to the active primary motor cortex during approaching-avoiding behavior. Cortex. 157, 155-166 (2022).
- Wang, Y., Cao, N., Lin, Y., Chen, R., Zhang, J. Hemispheric differences in functional interactions between the dorsal lateral prefrontal cortex and ipsilateral motor cortex. Frontiers in Human Neuroscience. 14, 1-6 (2020).
- Gabbott, P. L. A., Warner, T. A., Jays, P. R. L., Salway, P., Busby, S. J. Prefrontal cortex in the rat: Projections to subcortical autonomic, motor, and limbic centers. Journal of Comparative Neurology. 492 (2), 145-177 (2005).
- Yeterian, E. H., Pandya, D. N., Tomaiuolo, F., Petrides, M. The cortical connectivity of the prefrontal cortex in the monkey brain. Cortex. 48 (1), 58-81 (2012).
- Rossi, S., et al. Safety and recommendations for TMS use in healthy subjects and patient populations, with updates on training, ethical and regulatory issues: Expert guidelines. Clinical Neurophysiology. 132 (1), 269-306 (2021).
- Joussain, P., et al. Application of the European Test of Olfactory Capabilities in patients with olfactory impairment. European Archives of Oto-Rhino-Laryngology. 273 (2), 381-390 (2016).
- Oldfield, R. C. The assessment and analysis of handedness: The Edinburgh inventory. Neuropsychologia. 9 (1), 97-113 (1971).
- Daligadu, J., Haavik, H., Yielder, P. C., Baarbe, J., Murphy, B. Alterations in cortical and cerebellar motor processing in subclinical neck pain patients following spinal manipulation. Journal of Manipulative and Physiological Therapeutics. 36 (8), 527-537 (2013).
- Andersen, K. W., Siebner, H. R. Mapping dexterity and handedness: recent insights and future challenges. Current Opinion in Behavioral Sciences. 20, 123-129 (2018).
- Fried, P. J., et al. Training in the practice of noninvasive brain stimulation: Recommendations from an IFCN committee. Clinical Neurophysiology. 132 (3), 819-837 (2021).
- Mills, K. R., Boniface, S. J., Schubert, M. Magnetic brain stimulation with a double coil: the importance of coil orientation. Electroencephalography and Clinical Neurophysiology. 85 (1), 17-21 (1992).
- Rossini, P. M., et al. Non-invasive electrical and magnetic stimulation of the brain, spinal cord, roots and peripheral nerves: Basic principles and procedures for routine clinical and research application. An updated report from an I.F.C.N. Committee. Clinical Neurophysiology. 126 (6), 1071-1107 (2015).
- Awiszus, F. TMS and threshold hunting. Supplements to Clinical Neurophysiology. 56, 13-23 (2003).
- Awiszus, F. Using relative frequency estimation of transcranial magnetic stimulation motor threshold does not allow to draw any conclusions about true threshold. Clinical Neurophysiology. 125 (6), 1285-1286 (2014).
- Ah Sen, C. B., Fassett, H. J., El-Sayes, J., Turco, C. V., Hameer, M. M., Nelson, A. J. Active and resting motor threshold are efficiently obtained with adaptive threshold hunting. PLoS One. 12 (10), 1-9 (2017).
- Neige, C., Rannaud Monany, D., Stinear, C. M., Byblow, W. D., Papaxanthis, C., Lebon, F. Unravelling the modulation of intracortical inhibition during motor imagery: An adaptive threshold-hunting study. Neuroscience. 434, 102-110 (2020).
- Burke, D., Pierrot-Deseilligny, E. Caveats when studying motor cortex excitability and the cortical control of movement using transcranial magnetic stimulation. Clinical Neurophysiology. 121 (2), 121-123 (2010).
- Mir-Moghtadaei, A., et al. Updated scalp heuristics for localizing the dorsolateral prefrontal cortex based on convergent evidence of lesion and brain stimulation studies in depression. Brain Stimulation. 15 (2), 291-295 (2022).
- Siddiqi, S. H., et al. Brain stimulation and brain lesions converge on common causal circuits in neuropsychiatric disease. Nature Human Behaviour. 5 (12), 1707-1716 (2021).
- Caulfield, K. A., Fleischmann, H. H., Cox, C. E., Wolf, J. P., George, M. S., McTeague, L. M. Neuronavigation maximizes accuracy and precision in TMS positioning: Evidence from 11,230 distance, angle, and electric field modeling measurements. Brain Stimulation. 15 (5), 1192-1205 (2022).
- Cao, N., et al. Plasticity changes in dorsolateral prefrontal cortex associated with procedural sequence learning are hemisphere-specific. NeuroImage. 259, 119406 (2022).
- Brown, M. J. N., et al. Somatosensory-motor cortex interactions measured using dual-site transcranial magnetic stimulation. Brain Stimulation. 12 (5), 1229-1243 (2019).
- Fiori, F., Chiappini, E., Candidi, M., Romei, V., Borgomaneri, S., Avenanti, A. Long-latency interhemispheric interactions between motor-related areas and the primary motor cortex: a dual site TMS study. Scientific reports. 7 (1), 14936 (2017).
- Fournel, A., Ferdenzi, C., Sezille, C., Rouby, C., Bensafi, M. Multidimensional representation of odors in the human olfactory cortex. Human Brain Mapping. 37 (6), 2161-2172 (2016).
- Midroit, M., et al. Neural processing of the reward value of pleasant odorants. Current Biology. 31 (8), 1592-1605.e9 (2021).
- Sezille, C., Messaoudi, B., Bertrand, A., Joussain, P., Thévenet, M., Bensafi, M. A portable experimental apparatus for human olfactory fMRI experiments. Journal of Neuroscience Methods. 218 (1), 29-38 (2013).
- Kato, M., et al. Spatiotemporal dynamics of odor representations in the human brain revealed by EEG decoding. Proceedings of the National Academy of Sciences. 119 (21), e2114966119 (2022).
- Jackson, N., Greenhouse, I. VETA: An open-source Matlab-based toolbox for the collection and analysis of electromyography combined with transcranial magnetic stimulation. Frontiers in Neuroscience. 13, 975 (2019).
- Cunningham, D., Zhang, B., Cahn, A. Transcranial magnetic stimulation (TMS) analysis toolbox: A user friendly open source software for basic and advanced analysis and data sharing of TMS related outcomes. Brain Stimulation: Basic, Translational, and Clinical Research in Neuromodulation. 14 (6), 1641-1642 (2021).
- Julkunen, P., Säisänen, L., Hukkanen, T., Danner, N., Könönen, M. Does second-scale intertrial interval affect motor evoked potentials induced by single-pulse transcranial magnetic stimulation. Brain Stimulation. 5 (4), 526-532 (2012).
- Pellicciari, M. C., Miniussi, C., Ferrari, C., Koch, G., Bortoletto, M. Ongoing cumulative effects of single tms pulses on corticospinal excitability: An intra- and inter-block investigation. Clinical Neurophysiology. 127 (1), 621-628 (2016).
- Li, S., Rymer, W. Z. Voluntary breathing influences corticospinal excitability of nonrespiratory finger muscles. Journal of Neurophysiology. 105 (2), 512-521 (2011).
- Boesveldt, S., Frasnelli, J., Gordon, A. R., Lundström, J. N. The fish is bad: Negative food odors elicit faster and more accurate reactions than other odors. Biological Psychology. 84 (2), 313-317 (2010).
- Neige, C., Mavromatis, N., Gagné, M., Bouyer, L. J., Mercier, C. Effect of movement-related pain on behaviour and corticospinal excitability changes associated with arm movement preparation. Journal of Physiology. 596 (14), 2917-2929 (2018).
- Bergmann, T. O., Hartwigsen, G. Inferring causality from noninvasive brain stimulation in cognitive neuroscience. Journal of Cognitive Neuroscience. 33 (2), 195-225 (2021).
- Kulason, S., et al. A comparative neuroimaging perspective of olfaction and higher-order olfactory processing: on health and disease. Seminars in Cell & Developmental Biology. 129, 22-30 (2022).
- Athanassi, A., Dorado Doncel, R., Bath, K. G., Mandairon, N. Relationship between depression and olfactory sensory function: a review. Chemical Senses. 46, bjab044 (2021).
- Grimm, S., et al. Imbalance between left and right dorsolateral prefrontal cortex in major depression is linked to negative emotional judgment: An fmri study in severe major depressive disorder. Biological Psychiatry. 63 (4), 369-376 (2008).
- Naudin, M., El-Hage, W., Gomes, M., Gaillard, P., Belzung, C., Atanasova, B. State and trait olfactory markers of major depression. PLOS One. 7 (10), e46938 (2012).
- Guidali, G., Roncoroni, C., Bolognini, N. Modulating frontal networks' timing-dependent-like plasticity with paired associative stimulation protocols: Recent advances and future perspectives. Frontiers in Human Neuroscience. 15, 658723 (2021).
- Hernandez-Pavon, J. C., San Agustín, A., Wang, M. C., Veniero, D., Pons, J. L. Can we manipulate brain connectivity? A systematic review of cortico-cortical paired associative stimulation effects. Clinical Neurophysiology. 154, 169-193 (2023).
- Deng, Z. -. D., Robins, P. L., Dannhauer, M., Haugen, L. M., Port, J. D., Croarkin, P. E. Optimizing TMS coil placement approaches for targeting the dorsolateral prefrontal cortex in depressed adolescents: An electric field modeling study. Biomedicines. 11 (8), 2320 (2023).
- Gomez, L. J., Dannhauer, M., Peterchev, A. V. Fast computational optimization of TMS coil placement for individualized electric field targeting. NeuroImage. 228, 117696 (2021).
- Derosiere, G., Duque, J. Tuning the corticospinal system: How distributed brain circuits shape human actions. The Neuroscientist. 26 (4), 359-379 (2020).
- Bestmann, S., Krakauer, J. W. The uses and interpretations of the motor-evoked potential for understanding behaviour. Experimental Brain Research. 233 (3), 679-689 (2015).
- Reis, J., et al. Contribution of transcranial magnetic stimulation to the understanding of cortical mechanisms involved in motor control. Journal of Physiology. 586 (2), 325-351 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved