É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Combinando um Olfatômetro Sincronizado com a Respiração com Simulação Cerebral para Estudar o Impacto dos Odores na Excitabilidade Corticoespinhal e Conectividade Eficaz
Neste Artigo
Resumo
Este trabalho descreve o uso de um olfatômetro sincronizado com a respiração para desencadear a estimulação magnética transcraniana (EMT) de bobina única e dupla durante a apresentação do odor sincronizada à respiração nasal humana. Essa combinação nos permite investigar objetivamente como odores agradáveis e desagradáveis afetam a excitabilidade corticoespinhal e a conectividade cerebral efetiva em um determinado indivíduo.
Resumo
É amplamente aceito que a estimulação olfatória provoca comportamentos motores, como aproximar-se de odorantes agradáveis e evitar os desagradáveis, em animais e humanos. Recentemente, estudos utilizando eletroencefalografia e estimulação magnética transcraniana (EMT) têm demonstrado uma forte ligação entre o processamento no sistema olfatório e a atividade no córtex motor em humanos. Para melhor compreender as interações entre os sistemas olfatório e motor e superar algumas das limitações metodológicas anteriores, desenvolvemos um novo método combinando um olfatômetro que sincroniza a apresentação em ordem aleatória de odorantes com diferentes valores hedônicos e o disparo da EMT (bobina única e dupla) com as fases da respiração nasal. Este método permite sondar as modulações da excitabilidade corticoespinhal e conectividade ipsilateral efetiva entre o córtex pré-frontal dorsolateral e o córtex motor primário que poderiam ocorrer durante a percepção de odor agradável e desagradável. A aplicação deste método permitirá discriminar objetivamente o valor de agradabilidade de um odorante em um determinado participante, indicando o impacto biológico do odorante na conectividade e excitabilidade efetiva do cérebro. Além disso, isso poderia abrir caminho para investigações clínicas em pacientes com distúrbios neurológicos ou neuropsiquiátricos que podem apresentar alterações hedônicas de odor e comportamentos desadaptativos de evitação de abordagem.
Introdução
É amplamente aceito que a estimulação olfatória provoca reações automáticas e comportamentos motores. Por exemplo, em humanos, a existência de uma resposta motora de evitação (inclinando-se para longe da fonte de odor) ocorrendo 500 ms após o início do odor negativo foi recentemente demonstrada1. Ao registrar participantes humanos em movimento livre explorando odores emanados de frascos, Chalençon e colaboradores (2022) mostraram que comportamentos motores (ou seja, velocidade de aproximação ao nariz e retirada do frasco contendo o odorante) estão intimamente ligados aos odors hedônicos2. Além disso, uma estreita ligação entre o processamento no sistema olfatório e a atividade no córtex motor foi recentemente demonstrada em humanos usando eletroencefalografia1. Especificamente, aproximadamente 350 ms após o início dos odores negativos, uma dessincronização específica do ritmo mu, conhecida por refletir processos de preparação da ação, foi observada sobre e dentro do córtex motor primário (M1), logo seguida por um movimento comportamental para trás1. Fortalecendo a ideia de uma relação entre os sistemas olfatório e motor, outro estudo recente mostrou que a exposição a um odorante agradável aumentou a excitabilidade corticoespinhal em comparação com uma condição sem odor3. Neste estudo, a estimulação magnética transcraniana de pulso único (EMTsp) foi aplicada a M1 para evocar um potencial evocado motor (PEmáx) em um músculo alvo da mão, registrado perifericamente com eletromiografia (EMG) durante a percepção do odor. A exposição ao odorante agradável foi proporcionada passivamente por tiras de papel sodden com óleo essencial de bergamota puro e colocadas em um suporte metálico sob o nariz3. Nesse contexto, ainda não está claro se a facilitação da excitabilidade corticoespinhal se deve à estimulação odorante agradável ou a efeitos comportamentais inespecíficos, como cheirar e apertar os dentes 4,5. Além disso, ainda não se sabe como um odorante desagradável modula a excitabilidade M1 sondada pela EMT.
Em síntese, ressalta-se a necessidade de se desenvolver um método que ofereça as seguintes vantagens em relação às técnicas existentes em estudosanteriores3,6: (1) randomizar a apresentação de diferentes condições de odor (agradável/desagradável/sem odor) dentro de uma mesma fase experimental, (2) sincronizar com precisão a apresentação odorante e o tempo da EMT de acordo com as fases da respiração nasal humana (inspiração e expiração) ao estudar o sistema motor.
A EMT também pode ser utilizada como ferramenta para investigar interações córtico-corticais, também chamadas de conectividade efetiva, entre múltiplas áreas corticais e M1 com alta resolução temporal7,8,9,10,11,12. Aqui, usamos um paradigma de EMT de sítio duplo (EMTd), no qual uma estimulação de primeiro condicionamento (EC) ativa uma área cortical alvo, e uma estimulação de segundo teste (TS) é aplicada sobre M1 usando outra bobina para evocar uma PEmáx. O efeito do EC é avaliado normalizando a amplitude da PEmáx condicionada (condição EMTd) para a amplitude da PEmáx não condicionada (condição EMTsp)13. Assim, valores de razão negativa indicam interações corticocorticais supressoras, enquanto valores de razão positiva indicam interações corticocorticais facilitatórias entre as duas áreas estimuladas. O paradigma dsTMS fornece, portanto, uma oportunidade única para identificar a natureza (isto é, facilitatória ou supressiva), a força e as modulações da conectividade efetiva entre a área pré-ativada e M1. É importante ressaltar que as interações corticocorticais refletem um complexo equilíbrio de facilitação e supressão que pode ser modulado em diferentes tempos e estados mentais ou tarefas 7,14.
Até onde sabemos, o paradigma relativamente novo da dsTMS nunca foi usado para investigar interações córtico-corticais durante a percepção de odor com diferentes valores hedônicos. No entanto, estudos de neuroimagem têm mostrado que a exposição a odorantes agradáveis e desagradáveis induz alterações de conectividade em áreas envolvidas na emoção, tomada de decisão e controle da ação, incluindo a área motora suplementar, o córtex cingulado anterior e o córtex pré-frontal dorsolateral (CPFDL)15,16. De fato, o CPFDL é um nó chave mediador do controle emocional, do processamento sensorial e de aspectos de alto nível do controle motor, como processos preparatórios 17,18,19. Além disso, estudos em humanos e animais têm fornecido evidências de que o CPFDL possui diversas projeções neuronais para M1 17,18,20,21,22. Dependendo do contexto, essas projeções de CPFD podem facilitar ou inibir a atividade de M1 7,19,20. Assim, parece possível que a conectividade efetiva entre o CPFDL e M1 seja modulada durante a apresentação do odor e que odorantes agradáveis e desagradáveis recrutem redes corticais separadas, levando a um efeito diferencial na conectividade DLPFC-M1.
Aqui, propomos um novo método adequado para o estudo metodologicamente rigoroso das modulações da excitabilidade corticoespinhal e conectividade efetiva que podem ocorrer durante a percepção de odores agradáveis e desagradáveis, todos entregues em sincronia com a respiração nasal humana.
Protocolo
Todos os procedimentos experimentais descritos nas seções a seguir foram aprovados por um Comitê de Ética (CPP Ile de France VII, Paris, França, número de protocolo 2022-A01967-36) de acordo com a Declaração de Helsinque. Todos os participantes assinaram o termo de consentimento livre e esclarecido antes da inclusão no estudo.
1. Recrutamento de participantes
- Critérios de inclusão/exclusão.
- Incluir participantes adultos (> 18 anos). Rastrear todos os participantes quanto a qualquer contraindicação à EMT de acordo com as diretrizes internacionais de especialistas23.
- Exclua participantes com dispositivos médicos implantados (por exemplo, implante coclear, marcapasso cardíaco, etc.), história pessoal ou familiar de convulsão, dor de cabeça, trauma cerebral e medicação neuroativa. Excluir participantes considerados "anômicos" de acordo com o Teste Europeu de Capacidades Olfativas24.
- Lateralidade: Verificar a lateralidade destra avaliada pelo questionário Edinburgh Handedness Inventory25.
NOTA. É altamente recomendável recrutar apenas participantes destros em estudos que avaliem a excitabilidade corticoespinhal e a conectividade efetiva no sistema motor26,27. - Informação e consentimento informado: Fornecer a todos os participantes informações básicas sobre os objetivos, procedimentos e riscos do estudo aprovados pelo Comitê de Ética e solicitar que assinem o termo de consentimento livre e esclarecido.
2. Procedimento experimental
- Instalação do paciente: Solicitar ao participante que se sente em uma cadeira confortável (tipo cadeira odontológica) com as duas mãos relaxadas e pronadas. Posicione a cabeça do paricipant sobre um apoio para o queixo para minimizar o movimento da cabeça durante a estimulação.
- Registros eletromiográficos
- Preparar a pele do participante antes da aplicação do eletrodo usando um esfoliante para abrasar levemente as áreas e limpar as áreas com almofadas de álcool onde os eletrodos serão aplicados.
- Aplicar dois eletrodos de gravação descartáveis de prata/cloreto de prata com uma montagem ventre-tendão do primeiro músculo interósseo dorsal (IDF). Acrescentar o eletrodo terra ao processo estiloide da ulna (Figura 1).
- Conecte os eletrodos ao amplificador com cabos e ao sistema de aquisição de dados.
- Grave o sinal EMG usando um sistema de conversão analógico-digital (AD). Amplificar e filtrar sinais EMG (ganho = 1000) usando uma frequência de largura de banda entre 10 Hz e 1 kHz. Digitalize a uma taxa de amostragem de 2.000 Hz e armazene cada arquivo EMG para análise off-line.
- Verifique a qualidade do sinal exibido na tela do computador conectado ao sistema de aquisição de dados.
- BobinaTMS posição M1 .
- Conecte essa bobina ao estimulador A (Figura 1).
- Coloque uma touca apertada sobre a cabeça do participante. Use uma fita métrica para realizar medidas de nasion-ínion, tragus-tragus e perímetro cefálico com base em pontos de referência cranianos padrão. Identificar e marcar com caneta o vértice do couro cabeludo na intersecção das linhas sagital média (nasion-ínion) e interaural (tragus-tragus)28.
- Colocar tangencialmente ao couro cabeludo a primeira bobina pequena de oito (diâmetro interno: 40 mm) sobre a área presumida da mão do M1 esquerdo (bobinaM1), que fica 5 cm lateral do vértice, com o cabo apontando para trás e lateralmente em um ângulo de 45° em relação à linha sagital média, resultando em um fluxo de corrente póstero-anterior (forma de onda de corrente monofásica). Esta orientação corresponde a uma corrente induzida máxima fluindo dentro de M1 dentro de M129.
- Garantir que o posicionamento da bobinaM1 seja ideal, de acordo com as mais recentes recomendações internacionais30. Comece aplicando alguns pulsos únicos a 30% da saída máxima do estimulador (%MSO) e verifique se a estimulação produz uma PEmáx registrada pelo sistema EMG e exibida na tela do computador conectado ao sistema de aquisição de dados.
- Se não houver respostas visíveis, aumente gradualmente a intensidade da estimulação (incrementos de 5% da MSO) até que os PEmáx sejam observados. Em seguida, teste quatro pontos ao redor do primeiro local, entregando vários pulsos. Determinar a amplitude média pico-a-pico da PEmáx para cada local.
- Selecione o local onde a amplitude média pico-a-pico da PEmáx é a mais alta. Esta é a chamada localização do hotspot para o participante30. Marque a localização da bobinaM1 na tampa para garantir a colocação adequada da bobina durante todo o experimento.
- Limiar motor de repouso (rMT) e intensidades de EMT
- Determinar o limiar motor de repouso (rMT) definido como a intensidade da EMT que produz 50% de probabilidade de eliciar umaPEmáx 23,30.
- Utilizar o freeware online disponível (TMS Motor Threshold Assessment Tool, MTAT 2.1), que se baseia na estimação de parâmetros de máxima verossimilhança utilizando uma estratégia de teste sequencial29. A sequência de estimulação inicia-se sempre com a intensidade fixada em 37 %MSO.
- Deixe um experimentador segurar a bobinaM1 enquanto outro indica se a amplitude da PEmáx está > 0,05 mV. O algoritmo preditivo determina, então, a próxima intensidade de estimulação a ser aplicada e é interrompido após 20 estimulações, o que fornece acurácia suficiente para a estimativa da rMT de acordo com estudos prévios31-34.
- Defina o %MSO para o condicionamento e a estimulação do pulso de teste. Use o valor de rMT previamente determinado do participante.
OBS: Aqui, a intensidade para a primeira estimulação do condicionamento (DLPFC da bobina) foi ajustada para 110% da rMT19,20. A intensidade da estimulação do teste (bobinaM1) foi fixada em 120% da rMT, intensidade ligeiramente diferente de estudos anteriores que utilizaram uma intensidade de ST que evocou uma PEmáx de ~1 mV em todos os participantes19,20 . Essa intensidade fixa pico-a-pico ocorre em pontos muito diferentes nas curvas de recrutamento de insumo-produto devido à alta variabilidade intersujeitos na saída motora35. Portanto, a intensidade da estimulação poderia ser otimizada usando 120% da intensidade do TMR entre os indivíduos.
- Determinar o limiar motor de repouso (rMT) definido como a intensidade da EMT que produz 50% de probabilidade de eliciar umaPEmáx 23,30.
- PosicionamentoDLPFC da bobina TMS
- Conecte esta bobina ao estimulador B (Figura 1).
- Utilizar a heurística do couro cabeludo recentemente atualizada para localizar a região do couro cabeludo correspondente ao CPFDL esquerdo36,37 para estimar a posição da segunda bobina de oito pequenos números (diâmetro interno: 40 mm) sobre o CPFDL (DLPFC da bobina). Baixe a Ferramenta de Cálculo de Planilha Excel36 online e insira as distâncias nasion-inion e tragus-tragus e o perímetro cefálico em centímetros como entradas. Relate as distâncias XLA e YLA diretamente na cabeça do participante.
- Colocar tangencialmente ao couro cabeludo oCPFDL da bobina sobre a suposta localização do CPFDL esquerdo, com a alça apontada para baixo e lateralmente em um ângulo de -45° em relação à linha sagital média. Marque a colocação doDLPFC da bobina na tampa para garantir a colocação adequada da bobina durante todo o experimento.
NOTA: Este método de segmentação baseado em couro cabeludo para os locaisde DLPFC da bobinaM1 e da bobina não é o ideal. De fato, sabe-se que é menos preciso do que o método de neuronavegação usado para atingir as áreas de interesse cerebrais com base na ressonância magnética (RM) anatômica T1 individual38.
- Atraso entre os pulsos de condicionamento e teste: Ajuste esse atraso para 10 ms no dispositivo gerador de pulsos.
OBS: Aqui, o atraso é fixado em 10 ms com base em estudos prévios que mostram uma influência inibitória do CPFDL esquerdo para o M1 esquerdo nesse intervalo19,20. Esse efeito inibitório observado em 10 ms provavelmente se deve à ativação dos gânglios da base via projeções do CPFDL para a pré-AME, exercendo assim uma influência indireta sobre M139. O atraso pode ser ajustado no código de acordo com as necessidades do usuário. Por exemplo, um intervalo de interestimulação mais longo (isto é, 25 ms) poderia ser usado para investigar circuitos córtico-subcorticais-corticais indiretos polissinápticos conectando o CPFDL a M119. Além disso, influências diferenciais facilitatórias/inibitórias têm sido demonstradas usando ppTMS de duplo sítio entre múltiplas áreas corticais, com intervalos variando de 1 ms a 150 ms40,41. Assim, o fato de o intervalo poder ser ajustado abre caminho para um amplo leque de possibilidades para futuras pesquisas. - Configurações do olfatômetro
- Selecione odorantes com valores hedônicos agradáveis e desagradáveis. Diluir antecipadamente os odorantes individualmente em óleo mineral para criar percepção iso-intensa.
NOTA: Aqui, a seleção e a concentração de odorantes (isto é, acetato de isoamila e ácido butírico diluídos em concentrações de 0,6% e 0,11% vol/vol, respectivamente) foram baseadas em estudos anteriores de nosso grupo utilizando o mesmo arranjo olfométrico e odorantes 42,43. Um estudo piloto confirma que os odores positivos e negativos não diferiram em termos de intensidade, mas foram opostos em valor hedônico. Na condição de controle (ou seja, sem odorante), apenas o fluxo de ar é entregue ao participante. - Escreva o código para entregar os odorantes. Para cada ensaio, indicar a duração total do ensaio, o odorante a ser administrado, a taxa de fluxo do controlador odorante (em mililitros por minuto), a taxa de fluxo do regulador de ar transportador (em mililitros por minuto) e a taxa de fluxo do regulador de sucção.
OBS: A ordem do odorante entregue pode ser aleatória entre positivo, negativo e sem odor. Aqui, cada ensaio tem uma duração de 12 s. A ordem de entrega dos odores foi pseudo-randomizada. Além disso, com base em um experimento piloto, a taxa de fluxo do controlador de odor foi ajustada para 200 mL/min, a taxa de fluxo do regulador de ar transportador em 500 mL/min e a taxa de fluxo do regulador de sucção em 100 mL/min. - Posicionar a cânula nasal próximo às narinas do participante para mensuração da respiração nasal. Instruir o participante a respirar normalmente pelo nariz.
- Ligue o compressor de ar portátil, a caixa do olfatômetro e o PC que contém o software. Verifique todas as conexões do cabo (Figura 1).
NOTA: O olfatômetro usado no presente estudo foi descrito em detalhes em uma publicação anterior44 , mas foi modificado aqui para permitir o disparo da EMT com atrasos variáveis após a detecção do início da inspiração. Resumidamente, o dispositivo é composto por vários módulos, incluindo 1) uma fonte de ar e um sistema de tratamento de ar provenientes de um compressor de ar portátil, 2) um sistema de estimulação incluindo dispositivos eletrônicos e pneumáticos, 3) uma cabeça de mistura caseira acoplada a um sistema de liberação que permite a difusão de odorantes no nariz do participante, 4) um sistema sensorial respiratório que aciona o olfatômetro de acordo com a medida da respiração nasal com uma cânula nasal e 5) um software sistema de controle44. - Calibração: Proceder à fase de calibração (cerca de 20 s.), que permite calibrar o sinal respiratório do participante e ajustar os limiares de detecção das fases expiratória e inspiratória. Nesse software, a fase expiratória é positiva e a fase inspiratória é negativa.
- Classificações de odor hedônico e intensidade: Entregue os dois odorantes em uma ordem aleatória e peça aos participantes que classifiquem o valor hedônico e a intensidade de cada odorante em escalas analógicas visuais que variam de 1 "nada agradável" a 9 "extremamente agradável" e de 1 "nada intenso" a "extremamente intenso".
- Selecione odorantes com valores hedônicos agradáveis e desagradáveis. Diluir antecipadamente os odorantes individualmente em óleo mineral para criar percepção iso-intensa.
- Combinando olfatômetro e EMT: Defina o atraso entre a detecção da fase de inspiração e o gatilho para o envio da EMT em 600 ms.
NOTA: O ajuste do atraso é importante e deve ser determinado de acordo com a literatura e as necessidades do usuário. Nesse protocolo, o atraso foi fixado em 600 ms, que tem se mostrado a máxima representação perceptiva consciente dos odores45. Para a condição de EMT de pulso único, esse gatilho ativa imediatamente o estimulador A, e um pulso é liberado pela bobina posicionada no M1 esquerdo para evocar uma PEmáx não condicionada. Para a condição de EMT de bobina dupla, este gatilho é enviado para dois dispositivos diferentes (através de dois cabos coaxiais conectados por uma conexão T): o primeiro ativa imediatamente o estimulador B e um pulso de condicionamento é liberado pela bobina posicionada no DLPFC esquerdo; o segundo é recebido por um gerador de pulsos que permite induzir um atraso fixo antes de acionar o estimulador A, liberando assim um teste-estimulação através da bobina posicionada em M1 esquerda para evocar uma PEmáx condicionada (Figura 1).
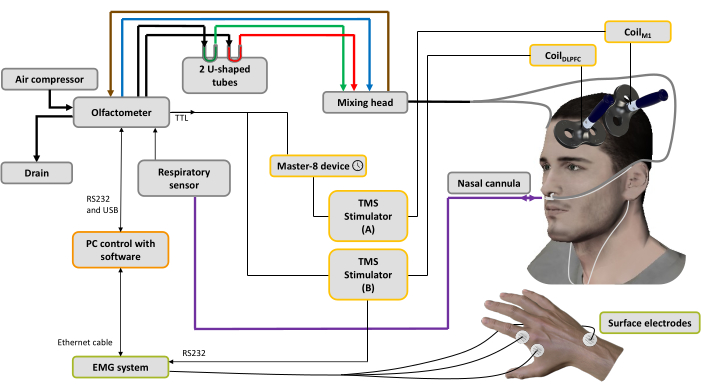
Figura 1: Montagem experimental. As linhas em negrito representam conexões pneumáticas. Um compressor de ar é conectado ao olfatômetro para gerar diferentes fluxos de ar. Um regulador controla a pressão, e o fluxo de ar de entrada é direcionado para 3 canais (através de 3 reguladores de massa): um para o transportador de ar (linha azul), um para o sistema de aspiração (linha marrom) para limpar e ajudar a controlar o tempo de estimulação e o último para os odorantes44. Dois tubos em forma de U contêm os odorantes (verde: agradável; vermelho: desagradável) nos quais são condicionados sob pressão no estado de vapor saturado, garantindo um fluxo de ar odorizado com intensidade estável ao longo do tempo. A cabeça de mistura é usada para misturar as correntes de ar limpas e odorizadas. O fluxo de ar (odorizado ou puro) é entregue às narinas através de dois tubos (linhas cinzas) ligados a uma cânula nasal, que também é usada para registrar a respiração nasal (linha roxa). Com base no sinal respiratório, assim que a fase de inspiração é detectada, para a condição de EMTp um gatilho é enviado para um dispositivo gerador de pulsos usado para definir um atraso (aqui: 10 ms), em seguida, para um estimulador de EMT A conectado à bobinaM1 aplicado sobre a representação muscular da mão M1 esquerda, enquanto o estimulador B da EMT é desligado. Para a condição dsTMS, um gatilho é imediatamente enviado para o estimulador B da EMT conectado aoDLPFC da bobina aplicado sobre a DLPFC esquerda, e o dispositivo gerador de pulsos é usado para definir um atraso (aqui: 10 ms) antes de acionar o estimulador de EMT A conectado à bobinaM1. O sinal respiratório e a amplitude da PEmáx adquiridos pelo sistema EMG são registrados por um software instalado em um computador. Clique aqui para ver uma versão maior desta figura.
3. Medições
- Execute o script de codificação personalizado no software olfatômetro (consulte a etapa 2.7.2) para fornecer todas as combinações de spTMS e dsTMS com odores agradáveis e desagradáveis e sem odores ocorrendo em uma ordem aleatória.
NOTA: Aqui, 20 ensaios foram registrados para cada condição (120 ensaios no total). O experimento foi dividido em 6 blocos de 20 ensaios cada. O número de testes para cada condição pode ser alterado de acordo com as necessidades do usuário.
4. Análise dos dados
- Para cada participante, condição e ensaio, extraia a amplitude pico a pico da PEmáx. Isso pode ser feito usando uma das caixas de ferramentas de código aberto disponíveis on-line46,47.
- Normalizar os dados calculando uma razão PEmáx expressando PEmáx eliciada pela estimulação do teste em ensaios de EMTd em relação às PEmáx eliciadas pela estimulação do teste em ensaios deEMTp 12. Faça isso separadamente para cada participante e para cada condição de odor (ou seja, sem odor, odor positivo e odor negativo). Após esse procedimento, interprete os resultados da seguinte forma: razões de PEmáx acima de 1 indicam uma influência facilitatória do CPFDL sobre M1, enquanto razões de PEmáx abaixo de 1 indicam uma influência inibitória do CPFDL sobre M1.
Resultados
Os dados representativos aqui apresentados refletem gravações dos participantes após o preenchimento do protocolo passo-a-passo acima para fornecer uma visão preliminar sobre o que poderíamos esperar.
A Figura 2 mostra um exemplo de sinais respiratórios representativos de um participante registrados com o software olfatômetro. As fases expiratória e inspiratória são bem detectadas quando os limiares são ultrapassados. O odorante é acionado imediatament...
Discussão
O protocolo acima descreve um novo método combinando o uso de um olfatômetro sincronizado com respiração sincronizada com EMT de bobina única e dupla para investigar mudanças na excitabilidade corticoespinhal e conectividade efetiva dependendo do valor hedônico dos odorantes. Esta configuração permitirá discriminar objetivamente o valor de agradabilidade de um odorante em um determinado participante, indicando o impacto biológico do odorante na conectividade e reatividade efetiva do cérebro. As etapas crític...
Divulgações
JB é membro do conselho da Seção de Estimulação Cerebral (STEP) da Associação Francesa de Psiquiatria Biológica e Neuropsicofarmacologia (AFPBN), da Sociedade Europeia de Estimulação Cerebral (ESBS), e relata bolsas de pesquisa acadêmica na área de estimulação cerebral da CIHR (Canadá), ANR e PHRC (França). Outros autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pela Fondation de France, Grant N°: 00123049/WB-2021-35902 (uma bolsa recebida por J.B. e N.M.). Os autores gostariam de agradecer à Fondation Pierre Deniker por seu apoio (bolsa recebida por C.N.) e à equipe da plataforma Neuro-Immersion por sua valiosa ajuda na concepção da configuração.
Materiais
| Name | Company | Catalog Number | Comments |
| Acquisition board (8 channels) | National Instrument | NI USB-6009 | |
| Air compressor | Jun-Air | Model6-15 | |
| Alcohol prep pads | Any | ||
| Butyric acid | Sigma-Aldrich | B103500 | Negative odorant |
| Desktop computer | Dell | Latitude 3520 | |
| EMG system | Biopac System | MP150 | |
| Isoamyl acetate | Sigma-Aldrich | W205508 | Positive odorant |
| Nasal cannula | SEBAC France | O1320 | |
| Programmable pulse generator | A.M.P.I | Master-8 | |
| Surface electrodes | Kendall Medi-trace | FS327 | |
| TMS coil (X2) | MagStim | D40 Alpha B.I. coil | |
| TMS machine | MagStim | Bistim2 | |
| Tube 6 mm x 20 m | Radiospare | 686-2671 | Pneumatic connection |
| USB-RS232 | Radiospare | 687-7806 | |
| U-shaped tubes | VS technologies | VS110115 |
Referências
- Iravani, B., Schaefer, M., Wilson, D. A., Arshamian, A., Lundström, J. N. The human olfactory bulb processes odor valence representation and cues motor avoidance behavior. Proceedings of the National Academy of Sciences. 118 (42), e2101209118 (2021).
- Chalençon, L., Thevenet, M., Noury, N., Bensafi, M., Mandairon, N. Identification of new behavioral parameters to assess odorant hedonic value in humans: A naturalistic approach. Journal of Neuroscience Methods. 366, 109422 (2022).
- Infortuna, C., et al. Motor cortex response to pleasant odor perception and imagery: The differential role of personality dimensions and imagery ability. Frontiers in Human Neuroscience. 16, 943469 (2022).
- Ozaki, I., Kurata, K. The effects of voluntary control of respiration on the excitability of the primary motor hand area, evaluated by end-tidal CO2 monitoring. Clinical Neurophysiology. 126 (11), 2162-2169 (2015).
- Boroojerdi, B., Battaglia, F., Muellbacher, W., Cohen, L. G. Voluntary teeth clenching facilitates human motor system excitability. Clinical Neurophysiology. 111 (6), 988-993 (2000).
- Rossi, S., et al. Distinct olfactory cross-modal effects on the human motor system. PLOS One. 3 (2), e1702 (2008).
- Neige, C., Rannaud Monany, D., Lebon, F. Exploring cortico-cortical interactions during action preparation by means of dual-coil transcranial magnetic stimulation: A systematic review. Neuroscience and Biobehavioral Reviews. 128 (October 2020), 678-692 (2020).
- Koch, G. Cortico-cortical connectivity: the road from basic neurophysiological interactions to therapeutic applications. Experimental Brain Research. 238 (7-8), 1677-1684 (2020).
- Derosiere, G., Vassiliadis, P., Duque, J. Advanced TMS approaches to probe corticospinal excitability during action preparation. NeuroImage. 213 (November 2019), 116746 (2020).
- Goldenkoff, E. R., Mashni, A., Michon, K. J., Lavis, H., Vesia, M. Measuring and manipulating functionally specific neural pathways in the human motor system with transcranial magnetic stimulation. Journal of Visualized Experiments JoVE. 156, 60706 (2020).
- Malderen, S. V., Hehl, M., Verstraelen, S., Swinnen, S. P., Cuypers, K. Dual-site TMS as a tool to probe effective interactions within the motor network: a review. Reviews in the Neurosciences. 34 (2), 129-221 (2023).
- Neige, C., et al. Connecting the dots: Harnessing dual-site transcranial magnetic stimulation to assess the causal influence of medial frontal areas on the motor cortex. Cerebral Cortex. , bhad370 (2023).
- Ferbert, A., Priori, A., Rothwell, J. C., Day, B. L., Colebatch, J. G., Marsden, C. D. Interhemispheric inhibition of the human motor cortex. The Journal of physiology. 453, 525-546 (1992).
- Rothwell, J. C. Using transcranial magnetic stimulation methods to probe connectivity between motor areas of the brain. Human Movement Science. 30 (5), 906-915 (2011).
- Carlson, H., Leitão, J., Delplanque, S., Cayeux, I., Sander, D., Vuilleumier, P. Sustained effects of pleasant and unpleasant smells on resting state brain activity. Cortex. 132, 386-403 (2020).
- Farruggia, M. C., Pellegrino, R., Scheinost, D. Functional connectivity of the chemosenses: A review. Frontiers in Systems Neuroscience. 16, 865929 (2022).
- Hasan, A., Galea, J. M., Casula, E. P., Falkai, P., Bestmann, S., Rothwell, J. C. Muscle and timing-specific functional connectivity between the dorsolateral prefrontal cortex and the primary motor cortex. Journal of Cognitive Neuroscience. 25 (4), 558-570 (2013).
- Brown, M. J. N., Goldenkoff, E. R., Chen, R., Gunraj, C., Vesia, M. Using dual-site transcranial magnetic stimulation to probe connectivity between the dorsolateral prefrontal cortex and ipsilateral primary motor cortex in humans. Brain Sciences. 9 (8), 177 (2019).
- Xia, X., et al. Connectivity from ipsilateral and contralateral dorsolateral prefrontal cortex to the active primary motor cortex during approaching-avoiding behavior. Cortex. 157, 155-166 (2022).
- Wang, Y., Cao, N., Lin, Y., Chen, R., Zhang, J. Hemispheric differences in functional interactions between the dorsal lateral prefrontal cortex and ipsilateral motor cortex. Frontiers in Human Neuroscience. 14, 1-6 (2020).
- Gabbott, P. L. A., Warner, T. A., Jays, P. R. L., Salway, P., Busby, S. J. Prefrontal cortex in the rat: Projections to subcortical autonomic, motor, and limbic centers. Journal of Comparative Neurology. 492 (2), 145-177 (2005).
- Yeterian, E. H., Pandya, D. N., Tomaiuolo, F., Petrides, M. The cortical connectivity of the prefrontal cortex in the monkey brain. Cortex. 48 (1), 58-81 (2012).
- Rossi, S., et al. Safety and recommendations for TMS use in healthy subjects and patient populations, with updates on training, ethical and regulatory issues: Expert guidelines. Clinical Neurophysiology. 132 (1), 269-306 (2021).
- Joussain, P., et al. Application of the European Test of Olfactory Capabilities in patients with olfactory impairment. European Archives of Oto-Rhino-Laryngology. 273 (2), 381-390 (2016).
- Oldfield, R. C. The assessment and analysis of handedness: The Edinburgh inventory. Neuropsychologia. 9 (1), 97-113 (1971).
- Daligadu, J., Haavik, H., Yielder, P. C., Baarbe, J., Murphy, B. Alterations in cortical and cerebellar motor processing in subclinical neck pain patients following spinal manipulation. Journal of Manipulative and Physiological Therapeutics. 36 (8), 527-537 (2013).
- Andersen, K. W., Siebner, H. R. Mapping dexterity and handedness: recent insights and future challenges. Current Opinion in Behavioral Sciences. 20, 123-129 (2018).
- Fried, P. J., et al. Training in the practice of noninvasive brain stimulation: Recommendations from an IFCN committee. Clinical Neurophysiology. 132 (3), 819-837 (2021).
- Mills, K. R., Boniface, S. J., Schubert, M. Magnetic brain stimulation with a double coil: the importance of coil orientation. Electroencephalography and Clinical Neurophysiology. 85 (1), 17-21 (1992).
- Rossini, P. M., et al. Non-invasive electrical and magnetic stimulation of the brain, spinal cord, roots and peripheral nerves: Basic principles and procedures for routine clinical and research application. An updated report from an I.F.C.N. Committee. Clinical Neurophysiology. 126 (6), 1071-1107 (2015).
- Awiszus, F. TMS and threshold hunting. Supplements to Clinical Neurophysiology. 56, 13-23 (2003).
- Awiszus, F. Using relative frequency estimation of transcranial magnetic stimulation motor threshold does not allow to draw any conclusions about true threshold. Clinical Neurophysiology. 125 (6), 1285-1286 (2014).
- Ah Sen, C. B., Fassett, H. J., El-Sayes, J., Turco, C. V., Hameer, M. M., Nelson, A. J. Active and resting motor threshold are efficiently obtained with adaptive threshold hunting. PLoS One. 12 (10), 1-9 (2017).
- Neige, C., Rannaud Monany, D., Stinear, C. M., Byblow, W. D., Papaxanthis, C., Lebon, F. Unravelling the modulation of intracortical inhibition during motor imagery: An adaptive threshold-hunting study. Neuroscience. 434, 102-110 (2020).
- Burke, D., Pierrot-Deseilligny, E. Caveats when studying motor cortex excitability and the cortical control of movement using transcranial magnetic stimulation. Clinical Neurophysiology. 121 (2), 121-123 (2010).
- Mir-Moghtadaei, A., et al. Updated scalp heuristics for localizing the dorsolateral prefrontal cortex based on convergent evidence of lesion and brain stimulation studies in depression. Brain Stimulation. 15 (2), 291-295 (2022).
- Siddiqi, S. H., et al. Brain stimulation and brain lesions converge on common causal circuits in neuropsychiatric disease. Nature Human Behaviour. 5 (12), 1707-1716 (2021).
- Caulfield, K. A., Fleischmann, H. H., Cox, C. E., Wolf, J. P., George, M. S., McTeague, L. M. Neuronavigation maximizes accuracy and precision in TMS positioning: Evidence from 11,230 distance, angle, and electric field modeling measurements. Brain Stimulation. 15 (5), 1192-1205 (2022).
- Cao, N., et al. Plasticity changes in dorsolateral prefrontal cortex associated with procedural sequence learning are hemisphere-specific. NeuroImage. 259, 119406 (2022).
- Brown, M. J. N., et al. Somatosensory-motor cortex interactions measured using dual-site transcranial magnetic stimulation. Brain Stimulation. 12 (5), 1229-1243 (2019).
- Fiori, F., Chiappini, E., Candidi, M., Romei, V., Borgomaneri, S., Avenanti, A. Long-latency interhemispheric interactions between motor-related areas and the primary motor cortex: a dual site TMS study. Scientific reports. 7 (1), 14936 (2017).
- Fournel, A., Ferdenzi, C., Sezille, C., Rouby, C., Bensafi, M. Multidimensional representation of odors in the human olfactory cortex. Human Brain Mapping. 37 (6), 2161-2172 (2016).
- Midroit, M., et al. Neural processing of the reward value of pleasant odorants. Current Biology. 31 (8), 1592-1605.e9 (2021).
- Sezille, C., Messaoudi, B., Bertrand, A., Joussain, P., Thévenet, M., Bensafi, M. A portable experimental apparatus for human olfactory fMRI experiments. Journal of Neuroscience Methods. 218 (1), 29-38 (2013).
- Kato, M., et al. Spatiotemporal dynamics of odor representations in the human brain revealed by EEG decoding. Proceedings of the National Academy of Sciences. 119 (21), e2114966119 (2022).
- Jackson, N., Greenhouse, I. VETA: An open-source Matlab-based toolbox for the collection and analysis of electromyography combined with transcranial magnetic stimulation. Frontiers in Neuroscience. 13, 975 (2019).
- Cunningham, D., Zhang, B., Cahn, A. Transcranial magnetic stimulation (TMS) analysis toolbox: A user friendly open source software for basic and advanced analysis and data sharing of TMS related outcomes. Brain Stimulation: Basic, Translational, and Clinical Research in Neuromodulation. 14 (6), 1641-1642 (2021).
- Julkunen, P., Säisänen, L., Hukkanen, T., Danner, N., Könönen, M. Does second-scale intertrial interval affect motor evoked potentials induced by single-pulse transcranial magnetic stimulation. Brain Stimulation. 5 (4), 526-532 (2012).
- Pellicciari, M. C., Miniussi, C., Ferrari, C., Koch, G., Bortoletto, M. Ongoing cumulative effects of single tms pulses on corticospinal excitability: An intra- and inter-block investigation. Clinical Neurophysiology. 127 (1), 621-628 (2016).
- Li, S., Rymer, W. Z. Voluntary breathing influences corticospinal excitability of nonrespiratory finger muscles. Journal of Neurophysiology. 105 (2), 512-521 (2011).
- Boesveldt, S., Frasnelli, J., Gordon, A. R., Lundström, J. N. The fish is bad: Negative food odors elicit faster and more accurate reactions than other odors. Biological Psychology. 84 (2), 313-317 (2010).
- Neige, C., Mavromatis, N., Gagné, M., Bouyer, L. J., Mercier, C. Effect of movement-related pain on behaviour and corticospinal excitability changes associated with arm movement preparation. Journal of Physiology. 596 (14), 2917-2929 (2018).
- Bergmann, T. O., Hartwigsen, G. Inferring causality from noninvasive brain stimulation in cognitive neuroscience. Journal of Cognitive Neuroscience. 33 (2), 195-225 (2021).
- Kulason, S., et al. A comparative neuroimaging perspective of olfaction and higher-order olfactory processing: on health and disease. Seminars in Cell & Developmental Biology. 129, 22-30 (2022).
- Athanassi, A., Dorado Doncel, R., Bath, K. G., Mandairon, N. Relationship between depression and olfactory sensory function: a review. Chemical Senses. 46, bjab044 (2021).
- Grimm, S., et al. Imbalance between left and right dorsolateral prefrontal cortex in major depression is linked to negative emotional judgment: An fmri study in severe major depressive disorder. Biological Psychiatry. 63 (4), 369-376 (2008).
- Naudin, M., El-Hage, W., Gomes, M., Gaillard, P., Belzung, C., Atanasova, B. State and trait olfactory markers of major depression. PLOS One. 7 (10), e46938 (2012).
- Guidali, G., Roncoroni, C., Bolognini, N. Modulating frontal networks' timing-dependent-like plasticity with paired associative stimulation protocols: Recent advances and future perspectives. Frontiers in Human Neuroscience. 15, 658723 (2021).
- Hernandez-Pavon, J. C., San Agustín, A., Wang, M. C., Veniero, D., Pons, J. L. Can we manipulate brain connectivity? A systematic review of cortico-cortical paired associative stimulation effects. Clinical Neurophysiology. 154, 169-193 (2023).
- Deng, Z. -. D., Robins, P. L., Dannhauer, M., Haugen, L. M., Port, J. D., Croarkin, P. E. Optimizing TMS coil placement approaches for targeting the dorsolateral prefrontal cortex in depressed adolescents: An electric field modeling study. Biomedicines. 11 (8), 2320 (2023).
- Gomez, L. J., Dannhauer, M., Peterchev, A. V. Fast computational optimization of TMS coil placement for individualized electric field targeting. NeuroImage. 228, 117696 (2021).
- Derosiere, G., Duque, J. Tuning the corticospinal system: How distributed brain circuits shape human actions. The Neuroscientist. 26 (4), 359-379 (2020).
- Bestmann, S., Krakauer, J. W. The uses and interpretations of the motor-evoked potential for understanding behaviour. Experimental Brain Research. 233 (3), 679-689 (2015).
- Reis, J., et al. Contribution of transcranial magnetic stimulation to the understanding of cortical mechanisms involved in motor control. Journal of Physiology. 586 (2), 325-351 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados