需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
将呼吸同步嗅觉计与大脑模拟相结合,研究气味对皮质脊髓兴奋性和有效连接性的影响
摘要
本文描述了在与人类鼻呼吸同步的气味呈现过程中,使用呼吸同步嗅觉计触发单线圈和双线圈经颅磁刺激 (TMS)。这种组合使我们能够客观地研究令人愉快和不愉快的气味如何影响特定个体的皮质脊髓兴奋性和大脑有效连接。
摘要
人们普遍认为,嗅觉刺激会引发动物和人类的运动行为,例如接近令人愉悦的气味并避免令人不快的气味。最近,使用脑电图和经颅磁刺激 (TMS) 的研究表明,嗅觉系统的处理与人类运动皮层的活动之间存在密切联系。为了更好地理解嗅觉和运动系统之间的相互作用,并克服以前的一些方法学局限性,我们开发了一种新方法,将嗅觉计与嗅觉计同步具有不同享乐值的气味剂的随机顺序呈现,以及TMS(单线圈和双线圈)触发与鼻呼吸阶段。这种方法可以探测皮质脊髓兴奋性的调节以及背外侧前额叶皮层和初级运动皮层之间的有效同侧连接,这些连接可能在愉快和不愉快的气味感知期间发生。该方法的应用将允许客观地区分给定参与者中气味剂的愉悦值,表明气味剂对大脑有效连接性和兴奋性的生物学影响。此外,这可能为神经或神经精神疾病患者的临床研究铺平道路,这些患者可能表现出气味享乐改变和适应不良的回避行为。
引言
人们普遍认为,嗅觉刺激会引起自动反应和运动行为。例如,在人类中,最近已经证明在负气味发作后 500 毫秒内存在回避运动反应(远离气味源)1。Chalençon 等人(2022 年)通过记录自由移动的人类参与者探索烧瓶散发出的气味,表明运动行为(即接近鼻子的速度和取出含有气味剂的烧瓶)与气味享乐密切相关2.此外,最近通过使用脑电图1,在人类中证明了嗅觉系统的处理与运动皮层活动之间的密切联系。具体来说,在负气味开始后大约 350 毫秒,在初级运动皮层 (M1) 上方和内部观察到特定的 mu 节律不同步,已知反映了动作准备过程,随后不久是行为向后运动1。最近的另一项研究表明,与无气味条件相比,暴露于令人愉悦的气味剂会增加皮质脊髓兴奋性3。在这项研究中,对 M1 施加单脉冲经颅磁刺激 (spTMS) 以唤起目标手肌中的运动诱发电位 (MEP),在气味感知期间用肌电图 (EMG) 在外周记录。暴露于令人愉悦的气味剂是通过浸有纯佛手柑精油的纸条被动提供的,并放置在鼻子下方的金属支架上 3.在这种情况下,尚不清楚皮质脊髓兴奋性的促进是由于令人愉悦的气味刺激还是由于非特异性行为影响,例如嗅探和咬牙4,5。此外,目前尚不清楚令人不快的气味如何调节 TMS 探测的 M1 兴奋性。
总之,这突出了开发一种方法的必要性,该方法与先前研究中使用的现有技术相比具有以下优势3,6:(1)在同一实验阶段随机呈现不同的气味条件(令人愉悦/令人不快/无气味),(2)在研究运动系统时,根据人类鼻呼吸阶段(吸气和呼气)精确同步气味呈现和TMS时间。
TMS 还可以用作研究多个皮质区域和 M1 之间皮质-皮质相互作用的工具,也称为有效连接,具有高时间分辨率7、8、9、10、11、12。在这里,我们使用双位点 TMS (dsTMS) 范式,其中第一次调节刺激 (CS) 激活目标皮质区域,第二次测试刺激 (TS) 使用另一个线圈在 M1 上施加以唤起 MEP。通过将条件 MEP(dsTMS 条件)的振幅归一化为非条件 MEP(spTMS 条件)的振幅来评估 CS 的影响13。然后,负比率值表示抑制性皮质-皮质相互作用,而正比率值表示两个刺激区域之间的促进皮质-皮质相互作用。因此,dsTMS 范式提供了一个独特的机会来识别预激活区域和 M1 之间有效连接的性质(即促进或抑制)、强度和调节。重要的是,皮质-皮层相互作用反映了促进和抑制的复杂平衡,这种平衡可能在不同的时间和精神状态或任务中受到调节7,14。
据我们所知,相对较新的dsTMS范式从未用于研究具有不同享乐值的气味感知过程中的皮质-皮质相互作用。然而,神经影像学研究表明,暴露于令人愉悦和令人不快的气味会诱导情绪、决策和行动控制区域的连接性变化,包括辅助运动区、前扣带回皮层和背外侧前额叶皮层 (DLPFC)15,16。事实上,DLPFC是介导情绪控制、感觉处理和运动控制的更高层次方面的关键节点,例如准备过程17,18,19。此外,人类和动物研究都提供了证据表明,DLPFC 对 M117、18、20、21、22 具有不同的神经元投射。根据上下文,这些 DLPFC 投影可以促进或抑制 M1 活性 7,19,20。因此,DLPFC 和 M1 之间的有效连接似乎有可能在气味呈现过程中受到调节,并且令人愉快和令人不快的气味会招募分离的皮层网络,从而导致对 DLPFC-M1 连接的不同影响。
在这里,我们提出了一种新方法,适用于方法学上的严格研究,即在感知令人愉快和不愉快的气味时可能发生的皮质脊髓兴奋性和有效连接的调节,所有这些都与人类鼻呼吸同步传递。
研究方案
以下各节中描述的所有实验程序均已获得伦理委员会(CPP Ile de France VII,法国巴黎,协议编号 2022-A01967-36)根据赫尔辛基宣言的批准。所有受试者在入组前都提供了书面知情同意书。
1. 参与者招募
- 纳入/排除标准。
- 包括成人(> 18 岁)参与者。根据国际专家指南筛查所有参与者是否有任何 TMS 禁忌症23.
- 排除植入医疗设备(例如人工耳蜗、心脏起搏器等)、癫痫发作、头痛、脑外伤和神经活性药物的个人或家族史的参与者。排除根据欧洲嗅觉能力测试24 被认为“嗅觉异常”的参与者。
- 惯用手:检查爱丁堡惯用手量表问卷25 评估的右撇子。
注意。强烈建议在评估皮质脊髓兴奋性和运动系统有效连接性的研究中仅招募右撇子参与者26,27。 - 信息和知情同意书:向所有参与者提供有关伦理委员会批准的研究目标、程序和风险的基本信息,并要求他们签署书面知情同意书。
2.实验程序
- 患者安装:要求参与者坐在舒适的椅子(牙科椅类型)上,双手放松并旋前。将参与者的头部放在下巴托上,以尽量减少刺激期间的头部运动。
- 肌电图记录
- 在使用去角质磨砂膏之前,使用去角质磨砂膏轻轻擦拭该区域,并使用酒精垫清洁将应用电极的区域。
- 使用两个银/氯化银一次性记录电极,并对第一背侧骨间 (FDI) 肌肉进行腹肌腱蒙太奇。将接地电极添加到尺骨的茎突上(图1)。
- 将电极连接到放大器上,使用电缆和数据采集系统。
- 使用模数 (AD) 转换系统记录 EMG 信号。使用 10 Hz 和 10 kHz 之间的带宽频率放大和滤波 EMG 信号(增益 = 1000)。以 2,000 Hz 的采样率进行数字化,并存储每个 EMG 文件以供离线分析。
- 检查连接到数据采集系统的计算机屏幕上显示的信号质量。
- TMS 线圈M1 位置。
- 将此线圈连接到 A 刺激器(图 1)。
- 将一顶紧身帽戴在参与者的头上。使用卷尺根据标准颅骨标志进行鼻腔、耳屏耳屏和头围测量。识别并用笔标记中矢状面(鼻-耳廓)和耳间(耳屏-耳屏)线交叉处的头皮顶点28.
- 将第一个小的八字形线圈(内径:40 毫米)切向头皮放置在左侧 M1(线圈M1)的假定手部区域(距顶点外侧 5 厘米)上,手柄向后指向,横向指向中矢状线成 45° 角,产生后前电流(单相电流波形)。该方向对应于 M129 内 M1 内流动的最大感应电流。
- 确保线圈M1 的放置符合最新的国际建议30。首先以最大刺激器输出 (%MSO) 的 30% 提供几个单个脉冲,并检查刺激是否产生 EMG 系统记录的 MEP 并显示在与数据采集系统相连的计算机屏幕上。
- 如果没有明显的反应,逐渐增加刺激强度(5%MSO增量),直到观察到MEP。然后,通过传递多个脉冲来测试第一个站点周围的四个点。确定每个站点的平均峰峰值 MEP 振幅。
- 选择平均峰峰值 MEP 振幅最高的位置。这就是参与者30 的所谓热点位置。在盖子上标记线圈M1 位置,以确保在整个实验过程中正确放置线圈。
- 静息运动阈值 (rMT) 和 TMS 强度
- 确定静息运动阈值 (rMT),定义为产生 50% 概率引发 MEP23,30 的 TMS 强度。
- 使用可用的在线免费软件(TMS电机阈值评估工具,MTAT 2.1),该工具基于使用顺序测试策略29的最大似然参数估计。刺激序列始终以设置为 37 %MSO 的强度开始。
- 让一个实验者握住线圈M1,而另一个实验者指示 MEP 幅度是否> 0.05 mV。然后,预测算法确定要传递的下一个刺激强度,并在 20 次刺激后停止,这为根据先前研究31-34 的 rMT 估计提供了足够的准确性。
- 设置调节和测试脉冲刺激的 %MSO。使用参与者先前确定的 rMT 值。
注意:在这里,第一次调节刺激(线圈DLPFC)的强度设置为 rMT110 的 19,20%。测试刺激的强度(线圈M1)设置为 rMT 的 120%,该强度与之前使用 TS 强度的研究略有不同,该研究在所有参与者中诱发了 ~1 mV 的 MEP 19,20。由于运动输出的高度可变性,这种固定的峰峰值强度发生在输入-输出募集曲线上非常不同的点35。因此,可以使用个体的 120% RMT 强度来优化刺激强度。
- 确定静息运动阈值 (rMT),定义为产生 50% 概率引发 MEP23,30 的 TMS 强度。
- TMS线圈DLPFC 定位
- 将此线圈连接到 B 刺激器(图 1)。
- 使用最近更新的头皮启发式方法定位与左侧 DLPFC36,37 相对应的头皮区域,以估计第二个小的八字形线圈(内径:40 mm)在 DLPFC(线圈DLPFC)上的位置。下载在线 Excel 电子表格计算工具36 并输入鼻孔距离和耳屏耳屏距离以及以厘米为单位的头围作为输入。直接在参与者的头上报告 XLA 和 YLA 距离。
- 将线圈DLPFC 切向头皮放置在假定的左侧 DLPFC 位置上,手柄向下并横向指向矢状中线成 -45° 角。在盖子上标记线圈DLPFC 的位置,以确保在整个实验过程中正确放置线圈。
注意:这种基于头皮的线圈M1 和线圈DLPFC 位置的定位方法不是最佳的。事实上,众所周知,它不如基于单个 T1 解剖磁共振成像 (MRI) 38 用于靶向大脑感兴趣区域的神经导航方法准确。
- 调节脉冲和测试脉冲之间的延迟:在脉冲发生器设备上将此延迟设置为 10 毫秒。
注意:在这里,根据先前的研究,延迟固定在 10 毫秒,显示在此间隔19,20 从左侧 DLPFC 到左侧 M1 的抑制影响。在 10 ms 时观察到的这种抑制作用可能是由于基底神经节通过 DLPFC 投射到前 SMA 激活,从而对 M139 产生间接影响。延迟可以根据用户的需要在代码中调整。例如,更长的刺激间隔(即 25 ms)可用于研究连接 DLPFC 至 M1 的多突触间接皮质-皮质下-皮质回路19。此外,在多个皮质区域之间使用双位点 ppTMS 证明了不同的促进/抑制影响,间隔范围为 1 ms 至 150 ms40,41。因此,可以调整间隔的事实为未来的研究开辟了广泛的可能性。 - 嗅觉计设置
- 选择具有令人愉快和不愉快的享乐价值的气味剂。提前在矿物油中单独稀释气味剂,以产生等强度的感知。
注意:在这里,气味剂的选择和浓度(即分别稀释至0.6%和0.11%体积/体积浓度的乙酸异戊酯和丁酸)基于我们小组使用相同的嗅觉计设置和气味剂42,43的先前研究。一项初步研究证实,正气味和负气味在强度上没有差异,但在享乐价值上是相反的。在控制条件下(即无气味剂),只有气流传递给参与者。 - 编写代码以提供气味剂。对于每次试验,请注明试验的总持续时间、要输送的加臭剂、加臭剂控制器的流速(以毫升/分钟为单位)、载体空气调节器的流速(以毫升/分钟为单位)和吸入调节器的流速。
注意:输送的加臭剂的顺序可以在正、负和无气味之间随机分配。在这里,每个试验的持续时间为 12 秒。传递气味的顺序是伪随机的。此外,在中试实验的基础上,气味控制器的流速设置为200 mL/min,载气调节器的流速为500 mL/min,吸入调节器的流速为100 mL/min。 - 将鼻插管放置在参与者的鼻孔附近以测量鼻呼吸。指导参与者通过鼻子正常呼吸。
- 打开便携式空气压缩机、嗅觉计外壳和包含该软件的 PC。检查所有电缆连接(图 1)。
注意:当前研究中使用的嗅觉计已在先前的出版物44 中详细描述,但在此处进行了修改,以允许在吸气开始检测后以可变延迟触发 TMS。简而言之,该设备由几个模块组成,包括 1) 来自便携式空气压缩机的气源和空气处理系统,2) 包括电子和气动设备的刺激系统,3) 与输送系统耦合的自制混合头,允许气味剂在参与者的鼻子中扩散,4) 根据鼻插管的鼻呼吸测量值触发嗅觉计的呼吸感觉系统,以及 5) 软件控制系统44. - 校准:进入校准阶段(约 20 秒),允许校准参与者的呼吸信号并调整呼气和吸气阶段的检测阈值。在该软件中,呼气期为正,吸气期为负。
- 气味享乐和强度等级:以随机顺序提供两种气味剂,并要求参与者在视觉模拟量表上对每种气味的享乐值和强度进行评分,范围从 1“完全不愉快”到 9“非常愉快”,从 1 “一点也不强烈”到“非常强烈”。
- 选择具有令人愉快和不愉快的享乐价值的气味剂。提前在矿物油中单独稀释气味剂,以产生等强度的感知。
- 结合嗅觉计和 TMS:将吸气相位检测和触发发送 TMS 之间的延迟设置为 600 毫秒。
注意:延迟的设置很重要,必须根据文献和用户的需求来确定。在该协议中,延迟设置为600 ms,这已被证明是气味45的最大有意识感知表示。对于单脉冲 TMS 条件,该触发器立即激活 A 刺激器,并且位于左侧 M1 上的线圈传递脉冲以唤起未调节的 MEP。对于双线圈 TMS 条件,该触发器被发送到两个不同的设备(通过 T 形连接连接的两根同轴电缆):第一个立即激活 B 刺激器,并且调节脉冲由位于左侧 DLPFC 上的线圈传递;第二个由脉冲发生器接收,这使得在激活 A 刺激器之前可以诱导固定延迟,从而通过位于左侧 M1 上的线圈提供测试刺激以唤起条件 MEP(图 1)。
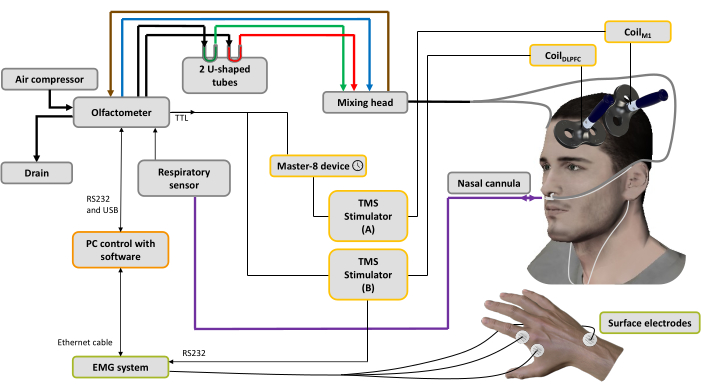
图 1:实验设置。 粗线表示气动连接。空气压缩机连接到嗅觉计以产生不同的气流。调节器控制压力,输入气流被引导到 3 个通道(通过 3 个质量调节器):一个用于空气输送机(蓝线),一个用于吸气系统(棕色线)以清洁和帮助控制刺激时间,最后一个用于气味剂44。两个U形管包含气味剂(绿色:令人愉快;红色:令人不快),它们在饱和蒸汽状态下的压力下调节,确保随着时间的推移具有稳定强度的气味气流。混合头用于混合清洁和有气味的气流。气流(有气味的或纯净的)通过连接到鼻插管的两根管子(灰线)输送到鼻孔,该管管也用于记录鼻呼吸(紫线)。基于呼吸信号,一旦检测到吸入阶段,对于spTMS条件,触发器被发送到用于设置延迟的脉冲发生器设备(此处:10 ms),然后发送到连接到施加在左侧M1手肌表示上的线圈M1 的TMS刺激器A,同时关闭TMS刺激器B。对于 dsTMS 条件,触发器立即发送到连接到施加在左侧 DLPFC 上的线圈DLPFC 的 TMS 刺激器 B,并且脉冲发生器设备用于在触发连接到线圈M1 的 TMS 刺激器 A 之前设置延迟(此处:10 ms)。EMG系统采集的呼吸信号和MEP振幅由安装在PC上的软件记录。 请点击这里查看此图的较大版本.
3. 测量
- 在嗅觉计软件中运行定制的编码脚本(参见步骤 2.7.2),以随机顺序提供具有令人愉快和不愉快的气味以及无气味的 spTMS 和 dsTMS 的所有组合。
注意:在这里,每种情况记录了 20 项试验(总共 120 项试验)。实验分为 6 个区组,每组 20 个试验。每种条件的试验次数可以根据用户的需要进行更改。
4. 数据分析
- 对于每个参与者、条件和试验,提取峰峰值 MEP 振幅。这可以使用在线提供的开源工具箱之一来完成 46,47。
- 通过计算 dsTMS 试验中测试刺激引发的 MEP 表达 MEP 的 MEP 相对于 spTMS 试验中测试刺激引发的 MEP 的 MEP 比率来归一化数据12。为每个参与者和每种气味条件(即无气味、正气味和负气味)分别执行此操作。在此过程之后,将结果解释如下:MEP 比值高于 1 表示 DLPFC 对 M1 的促进作用,而 MEP 比值低于 1 表示 DLPFC 对 M1 的抑制作用。
结果
这里提供的代表性数据反映了参与者在完成上述分步协议后的录音,以初步了解我们可能期望的内容。
图 2 显示了使用嗅觉计软件记录的代表性参与者的呼吸信号示例。当超过阈值时,呼气期和吸气期可以很好地检测到。气味剂在过期阈值后立即触发并扩散 5 秒。在吸气相位阈值之后,以延迟(600 ms)触发 TMS 脉冲。
该结果表明,?...
讨论
上述方案描述了一种新方法,将呼吸同步嗅觉计与单线圈和双线圈 TMS 的使用相结合,以根据气味剂的享乐值研究皮质脊髓兴奋性和有效连接的变化。这种设置将允许客观地区分给定参与者中气味剂的愉悦值,表明气味剂对大脑有效连接和反应性的生物学影响。该协议中的关键步骤涉及 TMS 参数(位置、强度)和嗅觉计参数(气味选择、相对于呼吸相的时间)。
spTMS 和 dsTMS 与...
披露声明
JB 是法国生物精神病学和神经精神药理学协会 (AFPBN) 脑刺激科 (STEP) 的董事会成员,也是欧洲脑刺激学会 (ESBS) 的董事会成员,并报告了 CIHR(加拿大)、ANR 和 PHRC(法国)在脑刺激领域的学术研究资助。其他作者没有什么可披露的。
致谢
这项工作得到了法兰西基金会的支持,资助号:00123049/WB-2021-35902(J.B.和N.M.获得的资助)。作者要感谢皮埃尔·丹尼克基金会(Pierre Deniker)的支持(C.N.获得的资助)和Neuro-Immersion平台的工作人员在设计设置方面的宝贵帮助。
材料
| Name | Company | Catalog Number | Comments |
| Acquisition board (8 channels) | National Instrument | NI USB-6009 | |
| Air compressor | Jun-Air | Model6-15 | |
| Alcohol prep pads | Any | ||
| Butyric acid | Sigma-Aldrich | B103500 | Negative odorant |
| Desktop computer | Dell | Latitude 3520 | |
| EMG system | Biopac System | MP150 | |
| Isoamyl acetate | Sigma-Aldrich | W205508 | Positive odorant |
| Nasal cannula | SEBAC France | O1320 | |
| Programmable pulse generator | A.M.P.I | Master-8 | |
| Surface electrodes | Kendall Medi-trace | FS327 | |
| TMS coil (X2) | MagStim | D40 Alpha B.I. coil | |
| TMS machine | MagStim | Bistim2 | |
| Tube 6 mm x 20 m | Radiospare | 686-2671 | Pneumatic connection |
| USB-RS232 | Radiospare | 687-7806 | |
| U-shaped tubes | VS technologies | VS110115 |
参考文献
- Iravani, B., Schaefer, M., Wilson, D. A., Arshamian, A., Lundström, J. N. The human olfactory bulb processes odor valence representation and cues motor avoidance behavior. Proceedings of the National Academy of Sciences. 118 (42), e2101209118 (2021).
- Chalençon, L., Thevenet, M., Noury, N., Bensafi, M., Mandairon, N. Identification of new behavioral parameters to assess odorant hedonic value in humans: A naturalistic approach. Journal of Neuroscience Methods. 366, 109422 (2022).
- Infortuna, C., et al. Motor cortex response to pleasant odor perception and imagery: The differential role of personality dimensions and imagery ability. Frontiers in Human Neuroscience. 16, 943469 (2022).
- Ozaki, I., Kurata, K. The effects of voluntary control of respiration on the excitability of the primary motor hand area, evaluated by end-tidal CO2 monitoring. Clinical Neurophysiology. 126 (11), 2162-2169 (2015).
- Boroojerdi, B., Battaglia, F., Muellbacher, W., Cohen, L. G. Voluntary teeth clenching facilitates human motor system excitability. Clinical Neurophysiology. 111 (6), 988-993 (2000).
- Rossi, S., et al. Distinct olfactory cross-modal effects on the human motor system. PLOS One. 3 (2), e1702 (2008).
- Neige, C., Rannaud Monany, D., Lebon, F. Exploring cortico-cortical interactions during action preparation by means of dual-coil transcranial magnetic stimulation: A systematic review. Neuroscience and Biobehavioral Reviews. 128 (October 2020), 678-692 (2020).
- Koch, G. Cortico-cortical connectivity: the road from basic neurophysiological interactions to therapeutic applications. Experimental Brain Research. 238 (7-8), 1677-1684 (2020).
- Derosiere, G., Vassiliadis, P., Duque, J. Advanced TMS approaches to probe corticospinal excitability during action preparation. NeuroImage. 213 (November 2019), 116746 (2020).
- Goldenkoff, E. R., Mashni, A., Michon, K. J., Lavis, H., Vesia, M. Measuring and manipulating functionally specific neural pathways in the human motor system with transcranial magnetic stimulation. Journal of Visualized Experiments JoVE. 156, 60706 (2020).
- Malderen, S. V., Hehl, M., Verstraelen, S., Swinnen, S. P., Cuypers, K. Dual-site TMS as a tool to probe effective interactions within the motor network: a review. Reviews in the Neurosciences. 34 (2), 129-221 (2023).
- Neige, C., et al. Connecting the dots: Harnessing dual-site transcranial magnetic stimulation to assess the causal influence of medial frontal areas on the motor cortex. Cerebral Cortex. , bhad370 (2023).
- Ferbert, A., Priori, A., Rothwell, J. C., Day, B. L., Colebatch, J. G., Marsden, C. D. Interhemispheric inhibition of the human motor cortex. The Journal of physiology. 453, 525-546 (1992).
- Rothwell, J. C. Using transcranial magnetic stimulation methods to probe connectivity between motor areas of the brain. Human Movement Science. 30 (5), 906-915 (2011).
- Carlson, H., Leitão, J., Delplanque, S., Cayeux, I., Sander, D., Vuilleumier, P. Sustained effects of pleasant and unpleasant smells on resting state brain activity. Cortex. 132, 386-403 (2020).
- Farruggia, M. C., Pellegrino, R., Scheinost, D. Functional connectivity of the chemosenses: A review. Frontiers in Systems Neuroscience. 16, 865929 (2022).
- Hasan, A., Galea, J. M., Casula, E. P., Falkai, P., Bestmann, S., Rothwell, J. C. Muscle and timing-specific functional connectivity between the dorsolateral prefrontal cortex and the primary motor cortex. Journal of Cognitive Neuroscience. 25 (4), 558-570 (2013).
- Brown, M. J. N., Goldenkoff, E. R., Chen, R., Gunraj, C., Vesia, M. Using dual-site transcranial magnetic stimulation to probe connectivity between the dorsolateral prefrontal cortex and ipsilateral primary motor cortex in humans. Brain Sciences. 9 (8), 177 (2019).
- Xia, X., et al. Connectivity from ipsilateral and contralateral dorsolateral prefrontal cortex to the active primary motor cortex during approaching-avoiding behavior. Cortex. 157, 155-166 (2022).
- Wang, Y., Cao, N., Lin, Y., Chen, R., Zhang, J. Hemispheric differences in functional interactions between the dorsal lateral prefrontal cortex and ipsilateral motor cortex. Frontiers in Human Neuroscience. 14, 1-6 (2020).
- Gabbott, P. L. A., Warner, T. A., Jays, P. R. L., Salway, P., Busby, S. J. Prefrontal cortex in the rat: Projections to subcortical autonomic, motor, and limbic centers. Journal of Comparative Neurology. 492 (2), 145-177 (2005).
- Yeterian, E. H., Pandya, D. N., Tomaiuolo, F., Petrides, M. The cortical connectivity of the prefrontal cortex in the monkey brain. Cortex. 48 (1), 58-81 (2012).
- Rossi, S., et al. Safety and recommendations for TMS use in healthy subjects and patient populations, with updates on training, ethical and regulatory issues: Expert guidelines. Clinical Neurophysiology. 132 (1), 269-306 (2021).
- Joussain, P., et al. Application of the European Test of Olfactory Capabilities in patients with olfactory impairment. European Archives of Oto-Rhino-Laryngology. 273 (2), 381-390 (2016).
- Oldfield, R. C. The assessment and analysis of handedness: The Edinburgh inventory. Neuropsychologia. 9 (1), 97-113 (1971).
- Daligadu, J., Haavik, H., Yielder, P. C., Baarbe, J., Murphy, B. Alterations in cortical and cerebellar motor processing in subclinical neck pain patients following spinal manipulation. Journal of Manipulative and Physiological Therapeutics. 36 (8), 527-537 (2013).
- Andersen, K. W., Siebner, H. R. Mapping dexterity and handedness: recent insights and future challenges. Current Opinion in Behavioral Sciences. 20, 123-129 (2018).
- Fried, P. J., et al. Training in the practice of noninvasive brain stimulation: Recommendations from an IFCN committee. Clinical Neurophysiology. 132 (3), 819-837 (2021).
- Mills, K. R., Boniface, S. J., Schubert, M. Magnetic brain stimulation with a double coil: the importance of coil orientation. Electroencephalography and Clinical Neurophysiology. 85 (1), 17-21 (1992).
- Rossini, P. M., et al. Non-invasive electrical and magnetic stimulation of the brain, spinal cord, roots and peripheral nerves: Basic principles and procedures for routine clinical and research application. An updated report from an I.F.C.N. Committee. Clinical Neurophysiology. 126 (6), 1071-1107 (2015).
- Awiszus, F. TMS and threshold hunting. Supplements to Clinical Neurophysiology. 56, 13-23 (2003).
- Awiszus, F. Using relative frequency estimation of transcranial magnetic stimulation motor threshold does not allow to draw any conclusions about true threshold. Clinical Neurophysiology. 125 (6), 1285-1286 (2014).
- Ah Sen, C. B., Fassett, H. J., El-Sayes, J., Turco, C. V., Hameer, M. M., Nelson, A. J. Active and resting motor threshold are efficiently obtained with adaptive threshold hunting. PLoS One. 12 (10), 1-9 (2017).
- Neige, C., Rannaud Monany, D., Stinear, C. M., Byblow, W. D., Papaxanthis, C., Lebon, F. Unravelling the modulation of intracortical inhibition during motor imagery: An adaptive threshold-hunting study. Neuroscience. 434, 102-110 (2020).
- Burke, D., Pierrot-Deseilligny, E. Caveats when studying motor cortex excitability and the cortical control of movement using transcranial magnetic stimulation. Clinical Neurophysiology. 121 (2), 121-123 (2010).
- Mir-Moghtadaei, A., et al. Updated scalp heuristics for localizing the dorsolateral prefrontal cortex based on convergent evidence of lesion and brain stimulation studies in depression. Brain Stimulation. 15 (2), 291-295 (2022).
- Siddiqi, S. H., et al. Brain stimulation and brain lesions converge on common causal circuits in neuropsychiatric disease. Nature Human Behaviour. 5 (12), 1707-1716 (2021).
- Caulfield, K. A., Fleischmann, H. H., Cox, C. E., Wolf, J. P., George, M. S., McTeague, L. M. Neuronavigation maximizes accuracy and precision in TMS positioning: Evidence from 11,230 distance, angle, and electric field modeling measurements. Brain Stimulation. 15 (5), 1192-1205 (2022).
- Cao, N., et al. Plasticity changes in dorsolateral prefrontal cortex associated with procedural sequence learning are hemisphere-specific. NeuroImage. 259, 119406 (2022).
- Brown, M. J. N., et al. Somatosensory-motor cortex interactions measured using dual-site transcranial magnetic stimulation. Brain Stimulation. 12 (5), 1229-1243 (2019).
- Fiori, F., Chiappini, E., Candidi, M., Romei, V., Borgomaneri, S., Avenanti, A. Long-latency interhemispheric interactions between motor-related areas and the primary motor cortex: a dual site TMS study. Scientific reports. 7 (1), 14936 (2017).
- Fournel, A., Ferdenzi, C., Sezille, C., Rouby, C., Bensafi, M. Multidimensional representation of odors in the human olfactory cortex. Human Brain Mapping. 37 (6), 2161-2172 (2016).
- Midroit, M., et al. Neural processing of the reward value of pleasant odorants. Current Biology. 31 (8), 1592-1605.e9 (2021).
- Sezille, C., Messaoudi, B., Bertrand, A., Joussain, P., Thévenet, M., Bensafi, M. A portable experimental apparatus for human olfactory fMRI experiments. Journal of Neuroscience Methods. 218 (1), 29-38 (2013).
- Kato, M., et al. Spatiotemporal dynamics of odor representations in the human brain revealed by EEG decoding. Proceedings of the National Academy of Sciences. 119 (21), e2114966119 (2022).
- Jackson, N., Greenhouse, I. VETA: An open-source Matlab-based toolbox for the collection and analysis of electromyography combined with transcranial magnetic stimulation. Frontiers in Neuroscience. 13, 975 (2019).
- Cunningham, D., Zhang, B., Cahn, A. Transcranial magnetic stimulation (TMS) analysis toolbox: A user friendly open source software for basic and advanced analysis and data sharing of TMS related outcomes. Brain Stimulation: Basic, Translational, and Clinical Research in Neuromodulation. 14 (6), 1641-1642 (2021).
- Julkunen, P., Säisänen, L., Hukkanen, T., Danner, N., Könönen, M. Does second-scale intertrial interval affect motor evoked potentials induced by single-pulse transcranial magnetic stimulation. Brain Stimulation. 5 (4), 526-532 (2012).
- Pellicciari, M. C., Miniussi, C., Ferrari, C., Koch, G., Bortoletto, M. Ongoing cumulative effects of single tms pulses on corticospinal excitability: An intra- and inter-block investigation. Clinical Neurophysiology. 127 (1), 621-628 (2016).
- Li, S., Rymer, W. Z. Voluntary breathing influences corticospinal excitability of nonrespiratory finger muscles. Journal of Neurophysiology. 105 (2), 512-521 (2011).
- Boesveldt, S., Frasnelli, J., Gordon, A. R., Lundström, J. N. The fish is bad: Negative food odors elicit faster and more accurate reactions than other odors. Biological Psychology. 84 (2), 313-317 (2010).
- Neige, C., Mavromatis, N., Gagné, M., Bouyer, L. J., Mercier, C. Effect of movement-related pain on behaviour and corticospinal excitability changes associated with arm movement preparation. Journal of Physiology. 596 (14), 2917-2929 (2018).
- Bergmann, T. O., Hartwigsen, G. Inferring causality from noninvasive brain stimulation in cognitive neuroscience. Journal of Cognitive Neuroscience. 33 (2), 195-225 (2021).
- Kulason, S., et al. A comparative neuroimaging perspective of olfaction and higher-order olfactory processing: on health and disease. Seminars in Cell & Developmental Biology. 129, 22-30 (2022).
- Athanassi, A., Dorado Doncel, R., Bath, K. G., Mandairon, N. Relationship between depression and olfactory sensory function: a review. Chemical Senses. 46, bjab044 (2021).
- Grimm, S., et al. Imbalance between left and right dorsolateral prefrontal cortex in major depression is linked to negative emotional judgment: An fmri study in severe major depressive disorder. Biological Psychiatry. 63 (4), 369-376 (2008).
- Naudin, M., El-Hage, W., Gomes, M., Gaillard, P., Belzung, C., Atanasova, B. State and trait olfactory markers of major depression. PLOS One. 7 (10), e46938 (2012).
- Guidali, G., Roncoroni, C., Bolognini, N. Modulating frontal networks' timing-dependent-like plasticity with paired associative stimulation protocols: Recent advances and future perspectives. Frontiers in Human Neuroscience. 15, 658723 (2021).
- Hernandez-Pavon, J. C., San Agustín, A., Wang, M. C., Veniero, D., Pons, J. L. Can we manipulate brain connectivity? A systematic review of cortico-cortical paired associative stimulation effects. Clinical Neurophysiology. 154, 169-193 (2023).
- Deng, Z. -. D., Robins, P. L., Dannhauer, M., Haugen, L. M., Port, J. D., Croarkin, P. E. Optimizing TMS coil placement approaches for targeting the dorsolateral prefrontal cortex in depressed adolescents: An electric field modeling study. Biomedicines. 11 (8), 2320 (2023).
- Gomez, L. J., Dannhauer, M., Peterchev, A. V. Fast computational optimization of TMS coil placement for individualized electric field targeting. NeuroImage. 228, 117696 (2021).
- Derosiere, G., Duque, J. Tuning the corticospinal system: How distributed brain circuits shape human actions. The Neuroscientist. 26 (4), 359-379 (2020).
- Bestmann, S., Krakauer, J. W. The uses and interpretations of the motor-evoked potential for understanding behaviour. Experimental Brain Research. 233 (3), 679-689 (2015).
- Reis, J., et al. Contribution of transcranial magnetic stimulation to the understanding of cortical mechanisms involved in motor control. Journal of Physiology. 586 (2), 325-351 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。