Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Combinación de un olfatómetro sincronizado con la respiración con simulación cerebral para estudiar el impacto de los olores en la excitabilidad corticoespinal y la conectividad efectiva
En este artículo
Resumen
Este artículo describe el uso de un olfatómetro sincronizado con la respiración para desencadenar la estimulación magnética transcraneal (TMS) de bobina simple y doble durante la presentación del odorante sincronizada con la respiración nasal humana. Esta combinación nos permite investigar objetivamente cómo los olores agradables y desagradables afectan la excitabilidad corticoespinal y la conectividad cerebral efectiva en un individuo determinado.
Resumen
Es ampliamente aceptado que la estimulación olfativa provoca comportamientos motores, como acercarse a olores agradables y evitar los desagradables, en animales y humanos. Recientemente, los estudios que utilizan la electroencefalografía y la estimulación magnética transcraneal (EMT) han demostrado un fuerte vínculo entre el procesamiento en el sistema olfativo y la actividad en la corteza motora en humanos. Para comprender mejor las interacciones entre el sistema olfativo y el motor y superar algunas de las limitaciones metodológicas anteriores, desarrollamos un nuevo método que combina un olfatómetro que sincroniza la presentación en orden aleatorio de los odorantes con diferentes valores hedónicos y el disparo de TMS (bobina simple y doble) con las fases de respiración nasal. Este método permite sondear las modulaciones de la excitabilidad corticoespinal y la conectividad ipsilateral efectiva entre la corteza prefrontal dorsolateral y la corteza motora primaria que podría ocurrir durante la percepción de olores agradables y desagradables. La aplicación de este método permitirá discriminar objetivamente el valor de placer de un odorante en un participante determinado, indicando el impacto biológico del odorante en la conectividad efectiva y la excitabilidad del cerebro. Además, esto podría allanar el camino para investigaciones clínicas en pacientes con trastornos neurológicos o neuropsiquiátricos que pueden presentar alteraciones hedónicas del olor y conductas desadaptativas de evitación del enfoque.
Introducción
Es ampliamente aceptado que la estimulación olfativa provoca reacciones automáticas y comportamientos motores. Por ejemplo, en humanos, se ha demostrado recientemente la existencia de una respuesta motora de evitación (alejarse de la fuente de olor) que ocurre 500 ms después del inicio del olor negativo1. Al registrar a los participantes humanos que se movían libremente explorando los olores que emanaban de los matraces, Chalençon et al. (2022) demostraron que los comportamientos motores (es decir, la velocidad de aproximación a la nariz y la retirada del matraz que contiene el odorante) están estrechamente relacionados con la hedónica del olor2. Además, recientemente se ha demostrado en humanos una estrecha relación entre el procesamiento en el sistema olfativo y la actividad en la corteza motora mediante el uso de electroencefalografía. Específicamente, aproximadamente 350 ms después del inicio de los olores negativos, se observó una desincronización específica del ritmo mu, conocida por reflejar los procesos de preparación de la acción, sobre y dentro de la corteza motora primaria (M1), seguida poco después por un movimiento conductual hacia atrás1. Reforzando la idea de una relación entre el sistema olfativo y el motor, otro estudio reciente mostró que la exposición a un olor agradable aumentó la excitabilidad corticoespinal en comparación con una condición sin olor3. En este estudio, se aplicó estimulación magnética transcraneal de pulso único (EMTsp) a M1 para evocar un potencial evocado motor (MEP) en un músculo de la mano objetivo, registrado periféricamente con electromiografía (EMG) durante la percepción del olor. La exposición al agradable odorante se realizaba de forma pasiva mediante tiras de papel empapadas con aceite esencial puro de bergamota y colocadas en un soporte metálico debajo de la nariz3. En este contexto, no está claro si la facilitación de la excitabilidad corticoespinal se debe a la estimulación odorífera agradable o a efectos conductuales inespecíficos, como olfatear y apretar los dientes 4,5. Además, todavía se desconoce cómo un olor desagradable modula la excitabilidad M1 sondeada por TMS.
En resumen, esto pone de manifiesto la necesidad de desarrollar un método que ofrezca las siguientes ventajas sobre las técnicas existentes utilizadas en estudios previos 3,6: (1) aleatorizar la presentación de diferentes condiciones de olor (agradable/desagradable/sin olor) dentro de la misma fase experimental, (2) sincronizar con precisión la presentación del odorante y el tiempo de TMS de acuerdo con las fases de respiración nasal humana (inspiración y espiración) cuando se estudia el sistema motor.
La EMT también se puede utilizar como una herramienta para investigar las interacciones cortico-corticales, también llamadas conectividad efectiva, entre múltiples áreas corticales y M1 con una alta resolución temporal 7,8,9,10,11,12. Aquí, utilizamos un paradigma de TMS de doble sitio (dsTMS), en el que una estimulación de primer condicionamiento (CS) activa un área cortical objetivo, y una estimulación de segunda prueba (TS) se aplica sobre M1 utilizando otra bobina para evocar un MEP. El efecto del SC se evalúa normalizando la amplitud de la MEP condicionada (condición dsTMS) a la amplitud de la MEP no condicionada (condición spTMS)13. Entonces, los valores de razón negativa indican interacciones cortico-corticales supresoras, mientras que los valores de razón positiva indican interacciones cortico-corticales facilitadoras entre las dos áreas estimuladas. Por lo tanto, el paradigma dsTMS ofrece una oportunidad única para identificar la naturaleza (es decir, facilitadora o supresiva), la fuerza y las modulaciones de la conectividad efectiva entre el área preactivada y M1. Es importante destacar que las interacciones cortico-corticales reflejan un complejo equilibrio de facilitación y supresión que puede ser modulado en diferentes tiempos y estados mentales o tareas 7,14.
Hasta donde sabemos, el paradigma dsTMS, relativamente nuevo, nunca se ha utilizado para investigar las interacciones cortico-corticales durante la percepción de olores con diferentes valores hedónicos. Sin embargo, estudios de neuroimagen han demostrado que la exposición a olores agradables y desagradables induce cambios en la conectividad en áreas involucradas en la emoción, la toma de decisiones y el control de la acción, incluyendo el área motora suplementaria, la corteza cingulada anterior y la corteza prefrontal dorsolateral (DLPFC)15,16. De hecho, el DLPFC es un nodo clave que media el control emocional, el procesamiento sensorial y los aspectos de nivel superior del control motor, como los procesos preparatorios 17,18,19. Además, tanto los estudios en humanos como en animales han proporcionado evidencia de que el DLPFC tiene diversas proyecciones neuronales a M1 17,18,20,21,22. Dependiendo del contexto, estas proyecciones de DLPFC pueden facilitar o inhibir la actividadM1 7,19,20. Por lo tanto, parece posible que la conectividad efectiva entre DLPFC y M1 se module durante la presentación del olor y que los olores agradables y desagradables recluten redes corticales separadas, lo que lleva a un efecto diferencial en la conectividad DLPFC-M1.
Aquí, proponemos un nuevo método adecuado para el estudio metodológicamente riguroso de las modulaciones de la excitabilidad corticoespinal y la conectividad efectiva que pueden ocurrir durante la percepción de olores agradables y desagradables, todo ello en sincronía con la respiración nasal humana.
Protocolo
Todos los procedimientos experimentales descritos en las siguientes secciones han sido aprobados por un Comité de Ética (CPP Ile de France VII, París, Francia, número de protocolo 2022-A01967-36) de acuerdo con la Declaración de Helsinki. Todos los participantes dieron su consentimiento informado por escrito antes de la inscripción en el estudio.
1. Reclutamiento de participantes
- Criterios de inclusión/exclusión.
- Incluya participantes adultos (> 18 años). Evaluar a todos los participantes para detectar cualquier contraindicación para la EMT de acuerdo con las directrices internacionales de expertos23.
- Excluir a los participantes con dispositivos médicos implantados (p. ej., implante coclear, marcapasos cardíaco, etc.), antecedentes personales o familiares de convulsiones, dolor de cabeza, traumatismo cerebral y medicación neuroactiva. Excluir a los participantes considerados "anósmicos" según el Test Europeo de Capacidades Olfativas24.
- Lateralidad: Comprobar la diestra evaluada por el cuestionario del Inventario de Lateralidad de Edimburgo25.
NOTA. Se recomienda encarecidamente reclutar solo participantes diestros en los estudios que evalúen la excitabilidad corticoespinal y la conectividad efectiva en el sistema motor26,27. - Información y consentimiento informado: Proporcione a todos los participantes información básica sobre los objetivos, procedimientos y riesgos del estudio aprobados por el Comité de Ética y pídales que firmen un consentimiento informado por escrito.
2. Procedimiento experimental
- Instalación del paciente: Pida al participante que se siente en un sillón cómodo (tipo sillón dental) con ambas manos relajadas y pronadas. Coloque la cabeza del participante en un mentonera para minimizar el movimiento de la cabeza durante la estimulación.
- Registros electromigráficos
- Prepare la piel del participante antes de la aplicación de los electrodos con un exfoliante para desgastar ligeramente las áreas y limpie las áreas con almohadillas con alcohol donde se aplicarán los electrodos.
- Aplique dos electrodos de registro desechables de plata/cloruro de plata con un montaje vientre-tendón del primer músculo interóseo dorsal (FDI). Agregue el electrodo de tierra a la apófisis estiloides del cúbito (Figura 1).
- Conecte los electrodos al amplificador con cables y al sistema de adquisición de datos.
- Registre la señal EMG utilizando un sistema de conversión de analógico a digital (AD). Amplifique y filtre las señales EMG (ganancia = 1000) utilizando una frecuencia de ancho de banda entre 10 Hz y 1 kHz. Digitalice a una frecuencia de muestreo de 2.000 Hz y almacene cada archivo EMG para su análisis fuera de línea.
- Compruebe la calidad de la señal mostrada en la pantalla del ordenador conectado al sistema de adquisición de datos.
- PosiciónM1 de la bobina TMS.
- Conecte esta bobina al estimulador A (Figura 1).
- Coloque una gorra ajustada sobre la cabeza del participante. Utilice una cinta métrica para realizar mediciones de nasión-inion, trago-trago y circunferencia de la cabeza basadas en puntos de referencia craneales estándar. Identifique y marque con un bolígrafo el vértice del cuero cabelludo en la intersección de las líneas sagital media (nasion-inion) e interaural (trago-trago)28.
- Coloque tangencialmente al cuero cabelludo la primera bobina pequeña en forma de ocho (diámetro interior: 40 mm) sobre la presunta área de la mano del M1 izquierdo (bobinaM1), que está a 5 cm lateral del vértice, con el mango apuntando hacia atrás y lateralmente en un ángulo de 45° con respecto a la línea sagital media, lo que resulta en un flujo de corriente posterior-anterior (forma de onda de corriente monofásica). Esta orientación corresponde a una corriente inducida máxima que fluye dentro de M1 dentro de M129.
- Asegúrese de que la colocación de la bobinaM1 sea óptima, de acuerdo con las recomendaciones internacionales más recientes30. Comience administrando unos pocos pulsos individuales al 30% de la salida máxima del estimulador (%MSO) y verifique que la estimulación produzca un MEP registrado por el sistema EMG y mostrado en la pantalla de la computadora conectada al sistema de adquisición de datos.
- Si no hay respuestas visibles, aumente gradualmente la intensidad de la estimulación (incrementos del 5 % de MSO) hasta que se observen los eurodiputados. Luego, pruebe cuatro puntos alrededor del primer sitio administrando múltiples pulsos. Determine la amplitud media de la MEP de pico a pico para cada sitio.
- Seleccione la ubicación en la que la amplitud media de MEP de pico a pico sea la más alta. Esta es la llamada ubicación de punto de acceso para el participante30. Marque la ubicación de la bobinaM1 en la tapa para garantizar la colocación adecuada de la bobina durante todo el experimento.
- Umbral motor en reposo (rMT) e intensidades TMS
- Determinar el umbral motor en reposo (rMT) definido como la intensidad TMS que produce una probabilidad del 50% de provocar un MEP23,30.
- Utilice el software gratuito en línea disponible (TMS Motor Threshold Assessment Tool, MTAT 2.1), que se basa en una estimación de parámetros de máxima verosimilitud utilizando una estrategia de prueba secuencial29. La secuencia de estimulación siempre comienza con la intensidad establecida en 37 % MSO.
- Deje que un experimentador sostenga la bobinaM1 mientras otro indica si la amplitud MEP es > 0,05 mV. A continuación, el algoritmo predictivo determina la siguiente intensidad de estimulación que se administrará y se detiene después de 20 estimulaciones, lo que proporciona suficiente precisión para la estimación de la rMT de acuerdo con estudios previos31-34.
- Establezca el % MSO para el acondicionamiento y la estimulación del pulso de prueba. Utilice el valor de rMT previamente determinado del participante.
NOTA: Aquí, la intensidad para la primera estimulación de acondicionamiento (DLPFC de bobina) se fijó en el 110% de la rMT19,20. La intensidad de la estimulación de la prueba (bobinaM1) se fijó en el 120% de la rMT, una intensidad que difiere ligeramente de estudios previos que utilizaron una intensidad de TS que evocó una MEP de ~1 mV en todos los participantes19,20 . Esta intensidad fija de pico a pico se produce en puntos muy diferentes de las curvas de reclutamiento de entrada-salida debido a la alta variabilidad entre sujetos en la potencia motora35. Por lo tanto, la intensidad de la estimulación podría optimizarse utilizando una intensidad de RMT del 120% en todos los individuos.
- Determinar el umbral motor en reposo (rMT) definido como la intensidad TMS que produce una probabilidad del 50% de provocar un MEP23,30.
- Bobina TMSPosicionamiento DLPFC
- Conecte esta bobina al estimulador B (Figura 1).
- Utilice la heurística del cuero cabelludo recientemente actualizada para localizar la región del cuero cabelludo correspondiente a la DLPFCizquierda 36,37 para estimar la posición de la segunda bobina pequeña en forma de ocho (diámetro interno: 40 mm) sobre la DLPFC (bobinaDLPFC). Descargue la Herramienta de cálculo de hoja de cálculode Excel en línea 36 e ingrese las distancias nasion-inion y trago-trago y la circunferencia de la cabeza en centímetros como entradas. Informar las distancias XLA e YLA directamente en la cabeza del participante.
- Coloque tangencialmente al cuero cabelludo la bobinaDLPFC sobre la presunta ubicación izquierda de DLPFC, con el mango apuntando hacia abajo y lateralmente en un ángulo de -45° con respecto a la línea sagital media. Marque la colocación de la bobinaDLPFC en la tapa para garantizar la colocación adecuada de la bobina durante todo el experimento.
NOTA: Este método de focalización basado en el cuero cabelludo para las ubicaciones de la bobinaM1 yla bobina DLPFC no es óptimo. De hecho, se sabe que es menos preciso que el método de neuronavegación utilizado para apuntar a las áreas cerebrales de interés basadas en imágenes de resonancia magnética (RM) anatómicas (RM) T1 individuales38.
- Retardo entre los pulsos de acondicionamiento y de prueba: Establezca este retardo en 10 ms en el dispositivo generador de impulsos.
NOTA: En este caso, el retardo se fija en 10 ms en base a estudios previos que muestran una influencia inhibitoria de la DLPFC izquierda a la M1 izquierda en este intervalo19,20. Este efecto inhibidor observado a los 10 ms se debe probablemente a la activación de los ganglios basales a través de las proyecciones de DLPFC a la pre-AME, ejerciendo así una influencia indirecta sobre M139. El retardo se puede ajustar en el código según las necesidades del usuario. Por ejemplo, se podría utilizar un intervalo de interestimulación más largo (es decir, 25 ms) para investigar los circuitos cortico-subcorticales-corticales indirectos polisinápticos que conectan la DLPFC con M119. Además, se han demostrado influencias facilitadoras/inhibitorias diferenciales utilizando PPTmS de doble sitio entre múltiples áreas corticales, con intervalos que van de 1 ms a 150 ms40,41. Así, el hecho de que el intervalo se pueda ajustar abre el camino a un amplio abanico de posibilidades para futuros estudios de investigación. - Ajustes del olfatómetro
- Seleccionar olores con valores hedónicos agradables y desagradables. Diluir de antemano los odorantes individualmente en aceite mineral para crear una percepción iso-intensa.
NOTA: En este caso, la selección y concentración de los odorantes (es decir, acetato de isoamilo y ácido butírico diluidos a concentraciones de 0,6% y 0,11% vol/vol, respectivamente) se basaron en estudios previos realizados por nuestro grupo utilizando la misma configuración de olfatómetro y odorantes42,43. Un estudio piloto confirma que los olores positivos y negativos no diferían en términos de intensidad, sino que eran opuestos en valor hedónico. En la condición de control (es decir, sin odorante), solo se suministra flujo de aire al participante. - Escribe el código para entregar los odorantes. Para cada prueba, indique la duración total de la prueba, el odorante que se suministrará, el caudal del controlador de odorante (en mililitros por minuto), el caudal del regulador de aire portador (en mililitros por minuto) y el caudal del regulador de succión.
NOTA: El orden del odorante entregado se puede aleatorizar entre positivo, negativo y sin olor. Aquí, cada prueba tiene una duración de 12 s. El orden de entrega del olor fue pseudoaleatorio. Además, sobre la base de un experimento piloto, el caudal del controlador de olores se ajustó a 200 ml/min, el caudal del regulador de aire portador a 500 ml/min y el caudal del regulador de succión a 100 ml/min. - Coloque la cánula nasal cerca de las fosas nasales del participante para medir la respiración nasal. Indíquele al participante que respire normalmente por la nariz.
- Encienda el compresor de aire portátil, la caja del olfatómetro y la PC que contiene el software. Compruebe todas las conexiones de los cables (Figura 1).
NOTA: El olfatómetro utilizado en el presente estudio se ha descrito en detalle en una publicación anterior44 , pero se ha modificado aquí para permitir la activación de la EMT con retrasos variables después de la detección del inicio de la inspiración. Brevemente, el dispositivo se compone de varios módulos, que incluyen 1) una fuente de aire y un sistema de tratamiento de aire proveniente de un compresor de aire portátil, 2) un sistema de estimulación que incluye dispositivos electrónicos y neumáticos, 3) un cabezal mezclador casero acoplado a un sistema de entrega que permite la difusión de olores en la nariz del participante, 4) un sistema sensorial respiratorio que activa el olfatómetro de acuerdo con la medición de la respiración nasal con una cánula nasal y 5) un software Sistema de control44. - Calibración: Pasar a la fase de calibración (unos 20 s.), que permite calibrar la señal respiratoria del participante y ajustar los umbrales de detección de las fases espiratoria e inspiratoria. En este software, la fase espiratoria es positiva y la fase inspiratoria es negativa.
- Calificaciones hedónicas y de intensidad de olores: Entregue los dos odorantes en un orden aleatorio y pida a los participantes que califiquen el valor hedónico y la intensidad de cada odorante en escalas analógicas visuales que van de 1 "nada agradable" a 9 "extremadamente agradable" y de 1 "nada intenso" a "extremadamente intenso".
- Seleccionar olores con valores hedónicos agradables y desagradables. Diluir de antemano los odorantes individualmente en aceite mineral para crear una percepción iso-intensa.
- Combinación de olfatómetro y TMS: Ajuste el retardo entre la detección de la fase de inspiración y el disparo para el envío del TMS a 600 ms.
NOTA: El ajuste del retardo es importante y debe determinarse de acuerdo con la literatura y las necesidades del usuario. En este protocolo, el retardo se fijó en 600 ms, que ha demostrado ser la máxima representación perceptual consciente de los olores45. Para la condición de TMS de un solo pulso, este disparador activa inmediatamente el estimulador A, y la bobina colocada en el M1 izquierdo emite un pulso para evocar un MEP no condicionado. Para la condición TMS de doble bobina, este disparador se envía a dos dispositivos diferentes (a través de dos cables coaxiales conectados por una conexión en T): el primero activa inmediatamente el estimulador B y la bobina colocada en el DLPFC izquierdo emite un pulso de acondicionamiento; el segundo es recibido por un generador de impulsos que permite inducir un retardo fijo antes de activar el estimulador A, entregando así una estimulación-prueba a través de la bobina colocada en el M1 izquierdo para evocar un MEP condicionado (Figura 1).
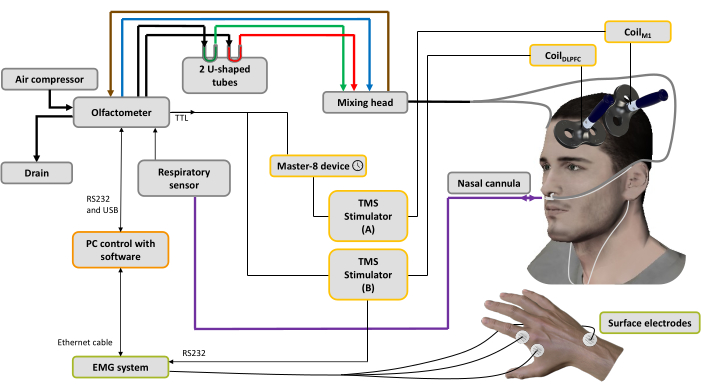
Figura 1: Configuración experimental. Las líneas en negrita representan conexiones neumáticas. Un compresor de aire está conectado al olfatómetro para generar diferentes flujos de aire. Un regulador controla la presión, y el flujo de aire de entrada se dirige a 3 canales (a través de 3 reguladores de masa): uno para el transportador de aire (línea azul), otro para el sistema de aspiración (línea marrón) para limpiar y ayudar a controlar el tiempo de estimulación y el último para los odorantes44. Dos tubos en forma de U contienen los odorantes (verde: agradable; rojo: desagradable) en los que se acondicionan a presión en estado de vapor saturado, asegurando un flujo de aire odorizado con intensidad estable en el tiempo. El cabezal mezclador se utiliza para mezclar las corrientes de aire limpio y odorizado. El flujo de aire (odorizado o puro) se envía a las fosas nasales a través de dos tubos (líneas grises) conectados a una cánula nasal, que también se utiliza para registrar la respiración nasal (línea morada). Sobre la base de la señal respiratoria, tan pronto como se detecta la fase de inhalación, para la condición de EMTsp se envía un disparador a un dispositivo generador de impulsos utilizado para establecer un retardo (en este caso: 10 ms), luego a un estimulador TMS A conectado a la bobinaM1 aplicado sobre la representación muscular de la mano M1 izquierda, mientras que el estimulador TMS B está apagado. Para la condición dsTMS, se envía inmediatamente un disparador al estimulador TMS B conectado a la bobinaDLPFC aplicada sobre la DLPFC izquierda, y el dispositivo generador de impulsos se utiliza para establecer un retardo (aquí: 10 ms) antes de activar el estimulador TMS A conectado a la bobinaM1. La señal respiratoria y la amplitud MEP adquiridas por el sistema EMG se registran mediante un software instalado en un PC. Haga clic aquí para ver una versión más grande de esta figura.
3. Medidas
- Ejecute el script de codificación personalizado en el software del olfatómetro (consulte el paso 2.7.2) para obtener todas las combinaciones de spTMS y dsTMS con olores agradables y desagradables y sin olores que se producen en un orden aleatorio.
NOTA: Aquí se registraron 20 ensayos para cada afección (120 ensayos en total). El experimento se dividió en 6 bloques de 20 ensayos cada uno. El número de ensayos para cada condición se puede cambiar según las necesidades del usuario.
4. Análisis de datos
- Para cada participante, afección y ensayo, extraiga la amplitud de MEP de pico a pico. Esto se puede hacer utilizando una de las cajas de herramientas de código abierto disponibles en línea46,47.
- Normalizar los datos calculando una relación de PEM que exprese los PEM provocados por la estimulación de la prueba en los ensayos de EMTds en relación con los PEM provocados por la estimulación de la prueba en los ensayos de EMTsp12. Haga esto por separado para cada participante y para cada condición de olor (es decir, sin olor, olor positivo y olor negativo). Después de este procedimiento, interprete los resultados de la siguiente manera: las relaciones de MEP por encima de 1 indican una influencia facilitadora de la DLPFC en M1, mientras que las relaciones de MEP por debajo de 1 indican una influencia inhibitoria de la DLPFC en M1.
Resultados
Los datos representativos presentados aquí reflejan las grabaciones de los participantes después de completar el protocolo paso a paso anterior para proporcionar una visión preliminar de lo que podríamos esperar.
La Figura 2 muestra un ejemplo de las señales respiratorias de un participante representativo registradas con el software del olfatómetro. Las fases espiratoria e inspiratoria se detectan bien cuando se cruzan los umbrales. El odorante se activa inm...
Discusión
El protocolo anterior describe un método novedoso que combina el uso de un olfatómetro sincronizado con la respiración sincronizada con TMS de bobina simple y doble para investigar los cambios en la excitabilidad corticoespinal y la conectividad efectiva dependiendo del valor hedónico de los odorantes. Esta configuración permitirá discriminar objetivamente el valor agradable de un odorante en un participante determinado, lo que indica el impacto biológico del odorante en la conectividad y reactividad efectivas del...
Divulgaciones
JB es miembro de la junta directiva de la Sección de Estimulación Cerebral (STEP) de la Asociación Francesa de Psiquiatría Biológica y Neuropsicofarmacología (AFPBN), de la Sociedad Europea de Estimulación Cerebral (ESBS), y reporta becas de investigación académica en el campo de la estimulación cerebral del CIHR (Canadá), ANR y PHRC (Francia). Otros autores no tienen nada que revelar.
Agradecimientos
Este trabajo contó con el apoyo de la Fondation de France, subvención n°: 00123049/WB-2021-35902 (una subvención recibida por J.B. y N.M.). Los autores desean agradecer a la Fundación Pierre Deniker por su apoyo (beca recibida por C.N.) y al personal de la plataforma Neuro-Immersion por su valiosa ayuda en el diseño de la configuración.
Materiales
| Name | Company | Catalog Number | Comments |
| Acquisition board (8 channels) | National Instrument | NI USB-6009 | |
| Air compressor | Jun-Air | Model6-15 | |
| Alcohol prep pads | Any | ||
| Butyric acid | Sigma-Aldrich | B103500 | Negative odorant |
| Desktop computer | Dell | Latitude 3520 | |
| EMG system | Biopac System | MP150 | |
| Isoamyl acetate | Sigma-Aldrich | W205508 | Positive odorant |
| Nasal cannula | SEBAC France | O1320 | |
| Programmable pulse generator | A.M.P.I | Master-8 | |
| Surface electrodes | Kendall Medi-trace | FS327 | |
| TMS coil (X2) | MagStim | D40 Alpha B.I. coil | |
| TMS machine | MagStim | Bistim2 | |
| Tube 6 mm x 20 m | Radiospare | 686-2671 | Pneumatic connection |
| USB-RS232 | Radiospare | 687-7806 | |
| U-shaped tubes | VS technologies | VS110115 |
Referencias
- Iravani, B., Schaefer, M., Wilson, D. A., Arshamian, A., Lundström, J. N. The human olfactory bulb processes odor valence representation and cues motor avoidance behavior. Proceedings of the National Academy of Sciences. 118 (42), e2101209118 (2021).
- Chalençon, L., Thevenet, M., Noury, N., Bensafi, M., Mandairon, N. Identification of new behavioral parameters to assess odorant hedonic value in humans: A naturalistic approach. Journal of Neuroscience Methods. 366, 109422 (2022).
- Infortuna, C., et al. Motor cortex response to pleasant odor perception and imagery: The differential role of personality dimensions and imagery ability. Frontiers in Human Neuroscience. 16, 943469 (2022).
- Ozaki, I., Kurata, K. The effects of voluntary control of respiration on the excitability of the primary motor hand area, evaluated by end-tidal CO2 monitoring. Clinical Neurophysiology. 126 (11), 2162-2169 (2015).
- Boroojerdi, B., Battaglia, F., Muellbacher, W., Cohen, L. G. Voluntary teeth clenching facilitates human motor system excitability. Clinical Neurophysiology. 111 (6), 988-993 (2000).
- Rossi, S., et al. Distinct olfactory cross-modal effects on the human motor system. PLOS One. 3 (2), e1702 (2008).
- Neige, C., Rannaud Monany, D., Lebon, F. Exploring cortico-cortical interactions during action preparation by means of dual-coil transcranial magnetic stimulation: A systematic review. Neuroscience and Biobehavioral Reviews. 128 (October 2020), 678-692 (2020).
- Koch, G. Cortico-cortical connectivity: the road from basic neurophysiological interactions to therapeutic applications. Experimental Brain Research. 238 (7-8), 1677-1684 (2020).
- Derosiere, G., Vassiliadis, P., Duque, J. Advanced TMS approaches to probe corticospinal excitability during action preparation. NeuroImage. 213 (November 2019), 116746 (2020).
- Goldenkoff, E. R., Mashni, A., Michon, K. J., Lavis, H., Vesia, M. Measuring and manipulating functionally specific neural pathways in the human motor system with transcranial magnetic stimulation. Journal of Visualized Experiments JoVE. 156, 60706 (2020).
- Malderen, S. V., Hehl, M., Verstraelen, S., Swinnen, S. P., Cuypers, K. Dual-site TMS as a tool to probe effective interactions within the motor network: a review. Reviews in the Neurosciences. 34 (2), 129-221 (2023).
- Neige, C., et al. Connecting the dots: Harnessing dual-site transcranial magnetic stimulation to assess the causal influence of medial frontal areas on the motor cortex. Cerebral Cortex. , bhad370 (2023).
- Ferbert, A., Priori, A., Rothwell, J. C., Day, B. L., Colebatch, J. G., Marsden, C. D. Interhemispheric inhibition of the human motor cortex. The Journal of physiology. 453, 525-546 (1992).
- Rothwell, J. C. Using transcranial magnetic stimulation methods to probe connectivity between motor areas of the brain. Human Movement Science. 30 (5), 906-915 (2011).
- Carlson, H., Leitão, J., Delplanque, S., Cayeux, I., Sander, D., Vuilleumier, P. Sustained effects of pleasant and unpleasant smells on resting state brain activity. Cortex. 132, 386-403 (2020).
- Farruggia, M. C., Pellegrino, R., Scheinost, D. Functional connectivity of the chemosenses: A review. Frontiers in Systems Neuroscience. 16, 865929 (2022).
- Hasan, A., Galea, J. M., Casula, E. P., Falkai, P., Bestmann, S., Rothwell, J. C. Muscle and timing-specific functional connectivity between the dorsolateral prefrontal cortex and the primary motor cortex. Journal of Cognitive Neuroscience. 25 (4), 558-570 (2013).
- Brown, M. J. N., Goldenkoff, E. R., Chen, R., Gunraj, C., Vesia, M. Using dual-site transcranial magnetic stimulation to probe connectivity between the dorsolateral prefrontal cortex and ipsilateral primary motor cortex in humans. Brain Sciences. 9 (8), 177 (2019).
- Xia, X., et al. Connectivity from ipsilateral and contralateral dorsolateral prefrontal cortex to the active primary motor cortex during approaching-avoiding behavior. Cortex. 157, 155-166 (2022).
- Wang, Y., Cao, N., Lin, Y., Chen, R., Zhang, J. Hemispheric differences in functional interactions between the dorsal lateral prefrontal cortex and ipsilateral motor cortex. Frontiers in Human Neuroscience. 14, 1-6 (2020).
- Gabbott, P. L. A., Warner, T. A., Jays, P. R. L., Salway, P., Busby, S. J. Prefrontal cortex in the rat: Projections to subcortical autonomic, motor, and limbic centers. Journal of Comparative Neurology. 492 (2), 145-177 (2005).
- Yeterian, E. H., Pandya, D. N., Tomaiuolo, F., Petrides, M. The cortical connectivity of the prefrontal cortex in the monkey brain. Cortex. 48 (1), 58-81 (2012).
- Rossi, S., et al. Safety and recommendations for TMS use in healthy subjects and patient populations, with updates on training, ethical and regulatory issues: Expert guidelines. Clinical Neurophysiology. 132 (1), 269-306 (2021).
- Joussain, P., et al. Application of the European Test of Olfactory Capabilities in patients with olfactory impairment. European Archives of Oto-Rhino-Laryngology. 273 (2), 381-390 (2016).
- Oldfield, R. C. The assessment and analysis of handedness: The Edinburgh inventory. Neuropsychologia. 9 (1), 97-113 (1971).
- Daligadu, J., Haavik, H., Yielder, P. C., Baarbe, J., Murphy, B. Alterations in cortical and cerebellar motor processing in subclinical neck pain patients following spinal manipulation. Journal of Manipulative and Physiological Therapeutics. 36 (8), 527-537 (2013).
- Andersen, K. W., Siebner, H. R. Mapping dexterity and handedness: recent insights and future challenges. Current Opinion in Behavioral Sciences. 20, 123-129 (2018).
- Fried, P. J., et al. Training in the practice of noninvasive brain stimulation: Recommendations from an IFCN committee. Clinical Neurophysiology. 132 (3), 819-837 (2021).
- Mills, K. R., Boniface, S. J., Schubert, M. Magnetic brain stimulation with a double coil: the importance of coil orientation. Electroencephalography and Clinical Neurophysiology. 85 (1), 17-21 (1992).
- Rossini, P. M., et al. Non-invasive electrical and magnetic stimulation of the brain, spinal cord, roots and peripheral nerves: Basic principles and procedures for routine clinical and research application. An updated report from an I.F.C.N. Committee. Clinical Neurophysiology. 126 (6), 1071-1107 (2015).
- Awiszus, F. TMS and threshold hunting. Supplements to Clinical Neurophysiology. 56, 13-23 (2003).
- Awiszus, F. Using relative frequency estimation of transcranial magnetic stimulation motor threshold does not allow to draw any conclusions about true threshold. Clinical Neurophysiology. 125 (6), 1285-1286 (2014).
- Ah Sen, C. B., Fassett, H. J., El-Sayes, J., Turco, C. V., Hameer, M. M., Nelson, A. J. Active and resting motor threshold are efficiently obtained with adaptive threshold hunting. PLoS One. 12 (10), 1-9 (2017).
- Neige, C., Rannaud Monany, D., Stinear, C. M., Byblow, W. D., Papaxanthis, C., Lebon, F. Unravelling the modulation of intracortical inhibition during motor imagery: An adaptive threshold-hunting study. Neuroscience. 434, 102-110 (2020).
- Burke, D., Pierrot-Deseilligny, E. Caveats when studying motor cortex excitability and the cortical control of movement using transcranial magnetic stimulation. Clinical Neurophysiology. 121 (2), 121-123 (2010).
- Mir-Moghtadaei, A., et al. Updated scalp heuristics for localizing the dorsolateral prefrontal cortex based on convergent evidence of lesion and brain stimulation studies in depression. Brain Stimulation. 15 (2), 291-295 (2022).
- Siddiqi, S. H., et al. Brain stimulation and brain lesions converge on common causal circuits in neuropsychiatric disease. Nature Human Behaviour. 5 (12), 1707-1716 (2021).
- Caulfield, K. A., Fleischmann, H. H., Cox, C. E., Wolf, J. P., George, M. S., McTeague, L. M. Neuronavigation maximizes accuracy and precision in TMS positioning: Evidence from 11,230 distance, angle, and electric field modeling measurements. Brain Stimulation. 15 (5), 1192-1205 (2022).
- Cao, N., et al. Plasticity changes in dorsolateral prefrontal cortex associated with procedural sequence learning are hemisphere-specific. NeuroImage. 259, 119406 (2022).
- Brown, M. J. N., et al. Somatosensory-motor cortex interactions measured using dual-site transcranial magnetic stimulation. Brain Stimulation. 12 (5), 1229-1243 (2019).
- Fiori, F., Chiappini, E., Candidi, M., Romei, V., Borgomaneri, S., Avenanti, A. Long-latency interhemispheric interactions between motor-related areas and the primary motor cortex: a dual site TMS study. Scientific reports. 7 (1), 14936 (2017).
- Fournel, A., Ferdenzi, C., Sezille, C., Rouby, C., Bensafi, M. Multidimensional representation of odors in the human olfactory cortex. Human Brain Mapping. 37 (6), 2161-2172 (2016).
- Midroit, M., et al. Neural processing of the reward value of pleasant odorants. Current Biology. 31 (8), 1592-1605.e9 (2021).
- Sezille, C., Messaoudi, B., Bertrand, A., Joussain, P., Thévenet, M., Bensafi, M. A portable experimental apparatus for human olfactory fMRI experiments. Journal of Neuroscience Methods. 218 (1), 29-38 (2013).
- Kato, M., et al. Spatiotemporal dynamics of odor representations in the human brain revealed by EEG decoding. Proceedings of the National Academy of Sciences. 119 (21), e2114966119 (2022).
- Jackson, N., Greenhouse, I. VETA: An open-source Matlab-based toolbox for the collection and analysis of electromyography combined with transcranial magnetic stimulation. Frontiers in Neuroscience. 13, 975 (2019).
- Cunningham, D., Zhang, B., Cahn, A. Transcranial magnetic stimulation (TMS) analysis toolbox: A user friendly open source software for basic and advanced analysis and data sharing of TMS related outcomes. Brain Stimulation: Basic, Translational, and Clinical Research in Neuromodulation. 14 (6), 1641-1642 (2021).
- Julkunen, P., Säisänen, L., Hukkanen, T., Danner, N., Könönen, M. Does second-scale intertrial interval affect motor evoked potentials induced by single-pulse transcranial magnetic stimulation. Brain Stimulation. 5 (4), 526-532 (2012).
- Pellicciari, M. C., Miniussi, C., Ferrari, C., Koch, G., Bortoletto, M. Ongoing cumulative effects of single tms pulses on corticospinal excitability: An intra- and inter-block investigation. Clinical Neurophysiology. 127 (1), 621-628 (2016).
- Li, S., Rymer, W. Z. Voluntary breathing influences corticospinal excitability of nonrespiratory finger muscles. Journal of Neurophysiology. 105 (2), 512-521 (2011).
- Boesveldt, S., Frasnelli, J., Gordon, A. R., Lundström, J. N. The fish is bad: Negative food odors elicit faster and more accurate reactions than other odors. Biological Psychology. 84 (2), 313-317 (2010).
- Neige, C., Mavromatis, N., Gagné, M., Bouyer, L. J., Mercier, C. Effect of movement-related pain on behaviour and corticospinal excitability changes associated with arm movement preparation. Journal of Physiology. 596 (14), 2917-2929 (2018).
- Bergmann, T. O., Hartwigsen, G. Inferring causality from noninvasive brain stimulation in cognitive neuroscience. Journal of Cognitive Neuroscience. 33 (2), 195-225 (2021).
- Kulason, S., et al. A comparative neuroimaging perspective of olfaction and higher-order olfactory processing: on health and disease. Seminars in Cell & Developmental Biology. 129, 22-30 (2022).
- Athanassi, A., Dorado Doncel, R., Bath, K. G., Mandairon, N. Relationship between depression and olfactory sensory function: a review. Chemical Senses. 46, bjab044 (2021).
- Grimm, S., et al. Imbalance between left and right dorsolateral prefrontal cortex in major depression is linked to negative emotional judgment: An fmri study in severe major depressive disorder. Biological Psychiatry. 63 (4), 369-376 (2008).
- Naudin, M., El-Hage, W., Gomes, M., Gaillard, P., Belzung, C., Atanasova, B. State and trait olfactory markers of major depression. PLOS One. 7 (10), e46938 (2012).
- Guidali, G., Roncoroni, C., Bolognini, N. Modulating frontal networks' timing-dependent-like plasticity with paired associative stimulation protocols: Recent advances and future perspectives. Frontiers in Human Neuroscience. 15, 658723 (2021).
- Hernandez-Pavon, J. C., San Agustín, A., Wang, M. C., Veniero, D., Pons, J. L. Can we manipulate brain connectivity? A systematic review of cortico-cortical paired associative stimulation effects. Clinical Neurophysiology. 154, 169-193 (2023).
- Deng, Z. -. D., Robins, P. L., Dannhauer, M., Haugen, L. M., Port, J. D., Croarkin, P. E. Optimizing TMS coil placement approaches for targeting the dorsolateral prefrontal cortex in depressed adolescents: An electric field modeling study. Biomedicines. 11 (8), 2320 (2023).
- Gomez, L. J., Dannhauer, M., Peterchev, A. V. Fast computational optimization of TMS coil placement for individualized electric field targeting. NeuroImage. 228, 117696 (2021).
- Derosiere, G., Duque, J. Tuning the corticospinal system: How distributed brain circuits shape human actions. The Neuroscientist. 26 (4), 359-379 (2020).
- Bestmann, S., Krakauer, J. W. The uses and interpretations of the motor-evoked potential for understanding behaviour. Experimental Brain Research. 233 (3), 679-689 (2015).
- Reis, J., et al. Contribution of transcranial magnetic stimulation to the understanding of cortical mechanisms involved in motor control. Journal of Physiology. 586 (2), 325-351 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados