A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שילוב של אולפקטומטר מסונכרן נשימה עם סימולציה מוחית כדי לחקור את ההשפעה של ריחות על עוררות קורטיקושדרלית וקישוריות יעילה
In This Article
Summary
מאמר זה מתאר שימוש באולפקטומטר מסונכרן נשימה כדי להפעיל גירוי מגנטי טרנס-גולגולתי יחיד וכפול סליל (TMS) במהלך הצגת ריח המסונכרן עם נשימת האף האנושי. שילוב זה מאפשר לנו לחקור באופן אובייקטיבי כיצד ריחות נעימים ולא נעימים משפיעים על עוררות קורטיקוספינלית ועל קישוריות יעילה למוח אצל אדם נתון.
Abstract
מקובל כי גירוי חוש הריח מעורר התנהגויות מוטוריות, כגון התקרבות לריחות נעימים והימנעות מריחות לא נעימים, אצל בעלי חיים ובני אדם. לאחרונה, מחקרים שהשתמשו באלקטרואנצפלוגרפיה ובגירוי מגנטי טרנס-גולגולתי (TMS) הדגימו קשר חזק בין עיבוד במערכת חוש הריח לבין פעילות בקליפת המוח המוטורית בבני אדם. כדי להבין טוב יותר את יחסי הגומלין בין חוש הריח למערכת המוטורית ולהתגבר על כמה מהמגבלות המתודולוגיות הקודמות, פיתחנו שיטה חדשה המשלבת אולפקטומטר המסנכרן את הצגת הסדר האקראי של ריחות בעלי ערכים הדוניים שונים ואת ה-TMS (סליל יחיד וכפול) המופעל עם שלבי נשימה באף. שיטה זו מאפשרת לחקור את המודולציות של עוררות קורטיקו-שדרתית וקישוריות איפסילטרלית יעילה בין קליפת המוח הקדם-מצחית הגבית-צדית לבין קליפת המוח המוטורית הראשונית שעלולה להתרחש במהלך תפיסת ריח נעימה ולא נעימה. יישום שיטה זו יאפשר להבחין באופן אובייקטיבי בערך הנעימות של ריחן אצל משתתף נתון, ולהצביע על ההשפעה הביולוגית של הריח על קישוריות ורגישות יעילות במוח. בנוסף, זה יכול לסלול את הדרך למחקרים קליניים בחולים עם הפרעות נוירולוגיות או נוירופסיכיאטריות שעשויים להציג שינויים נהנתניים בריח והתנהגויות הימנעות מגישה לא מסתגלות.
Introduction
מקובל כי גירוי חוש הריח מעורר תגובות אוטומטיות והתנהגויות מוטוריות. לדוגמה, בבני אדם, הוכח לאחרונה קיומה של תגובה מוטורית נמנעת (הנוטה הרחק ממקור הריח) המתרחשת 500 מילישניות לאחר הופעת ריח שלילי1. על ידי תיעוד משתתפים אנושיים הנעים בחופשיות הבוחנים ריחות הנובעים מצלוחיות, Chalençon et al. (2022) הראו כי התנהגויות מוטוריות (כלומר, מהירות התקרבות לאף ונסיגה של הבקבוק המכיל את הריח) קשורות קשר הדוק להדוניקת ריח2. יתר על כן, קשר הדוק בין עיבוד במערכת חוש הריח לבין פעילות בקליפת המוח המוטורית הוכח לאחרונה בבני אדם באמצעות אלקטרואנצפלוגרפיה1. באופן ספציפי, כ-350 מילישניות לאחר הופעת ריחות שליליים, נצפתה דה-סנכרון ספציפי של קצב Mu, הידוע כמשקף תהליכי הכנה לפעולה, מעל ובתוך קליפת המוח המוטורית הראשונית (M1), זמן קצר לאחר מכן תנועה התנהגותית לאחור1. חיזוק הרעיון של קשר בין חוש הריח לבין המערכת המוטורית, מחקר נוסף שנערך לאחרונה הראה כי חשיפה לריח נעים הגבירה את ההתרגשות קורטיקוספינלית בהשוואה למצב ללא ריח3. במחקר זה, גירוי מגנטי טרנס-גולגולתי בפולס יחיד (spTMS) הוחל על M1 כדי לעורר פוטנציאל מוטורי-מעורר (MEP) בשריר יד המטרה, שתועד באופן היקפי עם אלקטרומיוגרפיה (EMG) במהלך תפיסת ריח. החשיפה לריח הנעים סופקה באופן פסיבי על ידי רצועות נייר ספוגות בשמן אתרי ברגמוט טהור והונחו על מחזיק מתכת מתחת לאף3. בהקשר זה, עדיין לא ברור אם ההקלה על ההתרגשות הקורטיקוספנלית נובעת מגירוי הריח הנעים או מהשפעות התנהגותיות לא ספציפיות כגון רחרוח והידוק שיניים 4,5. יתר על כן, עדיין לא ידוע כיצד ריח לא נעים מווסת את רגישות M1 הנבדקת על ידי TMS.
לסיכום, זה מדגיש את הצורך לפתח שיטה המציעה את היתרונות הבאים על פני טכניקות קיימות ששימשו במחקרים קודמים 3,6: (1) הצגה אקראית של מצבי ריח שונים (נעים/לא נעים/ללא ריח) בתוך אותו שלב ניסוי, (2) סנכרון מדויק של הצגת ריחות ותזמון TMS בהתאם לשלבי נשימת האף האנושי (השראה ותפוגה) בעת לימוד המערכת המוטורית.
TMS יכול לשמש גם ככלי לחקר אינטראקציות קורטיקו-קליפת המוח, הנקראות גם קישוריות יעילה, בין אזורים קליפתיים מרובים לבין M1 ברזולוציה טמפורלית גבוהה 7,8,9,10,11,12. כאן, אנו משתמשים בפרדיגמת TMS דו-אתר (dsTMS), שבה גירוי התניה ראשון (CS) מפעיל אזור קליפת המוח המטרה, וגירוי מבחן שני (TS) מוחל על M1 באמצעות סליל אחר כדי לעורר MEP. ההשפעה של CS מוערכת על ידי נרמול המשרעת של MEP מותנה (תנאי dsTMS) למשרעת של MEP בלתי מותנה (תנאי spTMS)13. לאחר מכן, ערכי יחס שלילי מצביעים על אינטראקציות קורטיקו-קליפת המוח מדכאות, בעוד ערכי יחס חיובי מצביעים על אינטראקציות קורטיקו-קליפת המוח בין שני האזורים המגורים. פרדיגמת dsTMS מספקת אפוא הזדמנות ייחודית לזהות את הטבע (כלומר, מקל או מדכא), את החוזק ואת המודולציות של הקישוריות היעילה בין האזור המופעל מראש לבין M1. חשוב לציין, אינטראקציות קורטיקו-קורטיקליות משקפות איזון מורכב של הנחיה ודיכוי שעשוי להיות מווסת בתזמון שונה ובמצבים מנטליים שונים או משימות 7,14.
למיטב ידיעתנו, פרדיגמת dsTMS החדשה יחסית מעולם לא שימשה לחקר אינטראקציות קורטיקו-קליפת המוח במהלך תפיסת ריח עם ערכים הדוניים שונים. עם זאת, מחקרי דימות מוחי הראו כי חשיפה לריחות נעימים ולא נעימים גורמת לשינויי קישוריות באזורים המעורבים ברגש, קבלת החלטות ובקרת פעולה, כולל האזור המוטורי המשלים, פיתול החגורה הקדמי וקליפת המוח הקדם-מצחית הגבית-צדית (DLPFC)15,16. ואכן, DLPFC הוא צומת מפתח המתווך שליטה רגשית, עיבוד חושי, והיבטים ברמה גבוהה יותר של שליטה מוטורית, כגון תהליכי הכנה 17,18,19. בנוסף, מחקרים בבני אדם ובבעלי חיים סיפקו ראיות לכך של-DLPFC יש תחזיות עצביות מגוונות ל-M1 17,18,20,21,22. בהתאם להקשר, תחזיות DLPFC אלה יכולות להקל או לעכב את פעילות M1 7,19,20. לפיכך, נראה כי ייתכן שהקישוריות היעילה בין DLPFC ו-M1 מווסתת במהלך הצגת ריחות וכי ריחות נעימים ולא נעימים מגייסים רשתות קליפת המוח המופרדות, מה שמוביל להשפעה דיפרנציאלית על קישוריות DLPFC-M1.
כאן, אנו מציעים שיטה חדשה המתאימה למחקר מתודולוגי קפדני של מודולציות של עוררות קורטיקוספינלית וקישוריות יעילה שעלולות להתרחש במהלך תפיסה של ריחות נעימים ולא נעימים, כולם מועברים בסנכרון עם נשימת האף האנושית.
Protocol
כל הליכי הניסוי המתוארים בסעיפים הבאים אושרו על ידי ועדת אתיקה (CPP Ile de France VII, פריז, צרפת, פרוטוקול מספר 2022-A01967-36) בהתאם להצהרת הלסינקי. כל המשתתפים סיפקו הסכמה מדעת בכתב לפני ההרשמה למחקר.
1. גיוס משתתפים
- קריטריוני הכללה/אי-הכללה.
- כלול משתתפים מבוגרים (> 18 שנים). סנן את כל המשתתפים עבור כל התוויות נגד TMS על פי הנחיות מומחים בינלאומיים23.
- אין לכלול משתתפים עם מכשירים רפואיים מושתלים (למשל, שתל שבלול, קוצב לב וכו'), היסטוריה אישית או משפחתית של התקפים, כאבי ראש, טראומה מוחית ותרופות נוירואקטיביות. לא לכלול משתתפים הנחשבים "אנוסמיים" על פי המבחן האירופי של יכולות חוש הריח24.
- כפיות טובה: בדוק את מידת הידיים הימנית, כפי שהוערכה על-ידי שאלון Edinburgh Handedness Inventory25.
הערה. מומלץ מאוד לגייס רק משתתפים ימניים במחקרים המעריכים רגישות קורטיקוספינלית וקישוריות יעילה במערכת המוטורית26,27. - מידע והסכמה מדעת: תן לכל המשתתפים מידע בסיסי על מטרות המחקר, הנהלים והסיכונים שאושרו על ידי ועדת האתיקה ובקש מהם לחתום על הסכמה מדעת בכתב.
2. הליך ניסיוני
- התקנת מטופל: בקשו מהמשתתפים לשבת על כיסא נוח (סוג כיסא שיניים) כששתי ידיו רפויות ופרומות. מקם את ראשו של המשתתף על משענת סנטר כדי למזער את תנועת הראש במהלך הגירוי.
- הקלטות אלקטרומיוגרפיה
- הכינו את עורו של המתאמן לפני מריחת האלקטרודות באמצעות פילינג פילינג כדי לגרד קלות את האזורים ונקו את האזורים באמצעות רפידות אלכוהול בהן יושמו אלקטרודות.
- יש למרוח שתי אלקטרודות הקלטה חד-פעמיות מסוג כסף/כסף כלוריד עם מונטאז' גיד בטן של השריר הבין-גידי הגבי הראשון (FDI). הוסיפו את האלקטרודה הקרקעית לתהליך הסטילואיד של האולנה (איור 1).
- חבר את האלקטרודות למגבר באמצעות כבלים ומערכת קליטת הנתונים.
- הקלט את אות ה- EMG באמצעות מערכת המרה אנלוגית לדיגיטלית (AD). הגבר וסנן אותות EMG (רווח = 1000) באמצעות תדר רוחב פס בין 10 הרץ ל -1 קילוהרץ. בצע דיגיטציה בקצב דגימה של 2,000 הרץ ואחסן כל קובץ EMG לניתוח לא מקוון.
- בדוק את איכות האות המוצג על מסך המחשב המחובר למערכת איסוף הנתונים.
- מיקום סלילTMS M1 .
- חברו את הסליל הזה לממריץ A (איור 1).
- הניחו כובע צמוד על ראשו של המשתתף. השתמש בסרט מדידה כדי לבצע מדידות nasion-inion, tragus-tragus והיקף ראש בהתבסס על ציוני דרך גולגולתיים סטנדרטיים. זהה וסמן בעט את קודקוד הקרקפת בהצטלבות הקווים האמצעי-סגיטלי (nasion-inion) והבין-שמיעתי (tragus-tragus)28.
- מניחים באופן משיק לקרקפת את הסליל הקטן הראשון של שמונה (קוטר פנימי: 40 מ"מ) מעל אזור היד המשוער של M1 השמאלי (סלילM1), הנמצא 5 ס"מ לרוחב מהקודקוד, כאשר הידית מצביעה אחורה ולרוחב בזווית של 45° לקו האמצעי, וכתוצאה מכך נוצרת זרימת זרם אחורית-קדמית (צורת גל זרם מונופאזית). כיוון זה מתאים לזרם המושרה מרבי הזורם בתוך M1 בתוך M1 בתוך M129.
- ודא כי מיקום הסלילM1 הוא אופטימלי, בהתאם להמלצות הבינלאומיות העדכניות ביותר30. התחל על ידי מתן כמה פולסים בודדים ב 30% מפלט הממריץ המרבי (%MSO) ובדוק שהגירוי מייצר MEP כפי שנרשם על ידי מערכת EMG ומוצג על מסך המחשב המחובר למערכת איסוף הנתונים.
- אם אין תגובות נראות לעין, הגדל בהדרגה את עוצמת הגירוי (5% הפרשי MSO) עד לצפייה בחברי פרלמנט. לאחר מכן, בדוק ארבע נקודות סביב האתר הראשון על ידי מתן פולסים מרובים. קבע את משרעת MEP הממוצעת משיא לשיא עבור כל אתר.
- בחר את המיקום שבו משרעת MEP הממוצעת משיא לשיא היא הגבוהה ביותר. זהו מה שנקרא מיקום נקודה חמה עבור המשתתף30. סמן את מיקום הסלילM1 על המכסה כדי להבטיח מיקום סליל תקין לאורך כל הניסוי.
- סף מנוע מנוחה (rMT) ועוצמות TMS
- קבע את סף מנוע המנוחה (rMT) המוגדר כעוצמת TMS המייצרת הסתברות של 50% לעורר MEP23,30.
- השתמש בתוכנה החופשית המקוונת הזמינה (TMS Motor Threshold Assessment Tool, MTAT 2.1), המבוססת על הערכת פרמטר סבירות מרבית באמצעות אסטרטגיית בדיקה רציפה29. רצף הגירוי מתחיל תמיד בעוצמה שנקבעה על 37% MSO.
- תן לנסיין אחד להחזיק את הסלילM1 בעוד אחר מציין אם משרעת MEP היא > 0.05 mV. לאחר מכן אלגוריתם החיזוי קובע את עוצמת הגירוי הבאה שתועבר ונעצר לאחר 20 גירויים, מה שמספק דיוק מספיק להערכת rMT על פי מחקרים קודמים31-34.
- הגדר את %MSO עבור ההתניה וגירוי דופק הבדיקה. השתמש בערך rMT שנקבע בעבר של המשתתף.
הערה: כאן, עוצמת גירוי ההתניה הראשון (סליל DLPFC) נקבעה ל-110% מה-rMT19,20. עוצמת גירוי הבדיקה (סלילM1) נקבעה על 120% מה- rMT, עוצמה השונה מעט ממחקרים קודמים שהשתמשו בעוצמת TS שעוררה MEP של ~ 1 mV בכל המשתתפים19,20 . עוצמת שיא קבועה זו מתרחשת בנקודות שונות מאוד בעקומות גיוס הקלט-פלט בשל השונות הגבוהה בין נושאים בתפוקה מוטורית35. לכן, ניתן למטב את עוצמת הגירוי באמצעות 120% עוצמת RMT בקרב אנשים.
- קבע את סף מנוע המנוחה (rMT) המוגדר כעוצמת TMS המייצרת הסתברות של 50% לעורר MEP23,30.
- מיקוםDLPFC סליל TMS
- חברו את הסליל הזה למגרה B (איור 1).
- השתמש בהיוריסטיקת הקרקפת שעודכנה לאחרונה כדי לאתר את אזור הקרקפת המתאים ל- DLPFC36,37 השמאלי כדי להעריך את המיקום של הסליל הקטן השני של שמונה (קוטר פנימי: 40 מ"מ) מעל DLPFC (סלילDLPFC). הורד את כלי חישוב הגיליון האלקטרוני המקווןשל Excel 36 והזן את מרחקי nasion-inion ו- tragus-tragus ואת היקף הראש בסנטימטרים כקלט. דווח על מרחקי XLA ו- YLA ישירות על ראשו של המשתתף.
- הניחו באופן משיק לקרקפת את סלילה-DLPFC מעל המיקום השמאלי המשוער של DLPFC, כאשר הידית מצביעה כלפי מטה ולרוחב בזווית של -45° לקו האמצע-קשת. סמן את מיקום סלילDLPFC על המכסה כדי להבטיח מיקום סליל תקין לאורך כל הניסוי.
הערה: שיטת מיקוד מבוססת קרקפת זו הן עבור מיקומי סלילM1 והן עבור מיקומיסליל DLPFC אינה מיטבית. למעשה, היא ידועה כפחות מדויקת משיטת הניווט העצבי המשמשת למיקוד אזורי העניין במוח בהתבסס על דימות תהודה מגנטית אנטומית T1 (MRI)38.
- השהיה בין המיזוג לפעימות הבדיקה: הגדר השהיה זו ל- 10 אלפיות השנייה במכשיר מחולל הדופק.
הערה: כאן, ההשהיה קבועה ב- 10 אלפיות השנייה בהתבסס על מחקרים קודמים שהראו השפעה מעכבת מה- DLPFC השמאלי ל- M1 השמאלי במרווחזה 19,20. השפעה מעכבת זו שנצפתה ב -10 מילישניות נובעת ככל הנראה מהפעלת גרעיני הבסיס באמצעות תחזיות DLPFC לטרום SMA, ובכך מפעילה השפעה עקיפה על M139. ניתן להתאים את העיכוב בקוד בהתאם לצרכי המשתמש. לדוגמה, מרווח אינטרסטימולציה ארוך יותר (כלומר, 25 מילישניות) יכול לשמש לחקר מעגלים קורטיקו-תת-קורטיקליים עקיפים פוליסינפטיים המחברים DLPFC ל-M119. יתר על כן, השפעות מקלות / מעכבות דיפרנציאליות הודגמו באמצעות ppTMS דו-אתרי בין אזורים מרובים בקליפת המוח, עם מרווחים הנעים בין 1 ms ל 150 ms40,41. לפיכך, העובדה שניתן לכוונן את המרווח פותחת את הדרך למגוון רחב של אפשרויות למחקרים עתידיים. - הגדרות אולפקטומטר
- ריחות נבחרים עם ערכים נהנתניים נעימים ולא נעימים. לדלל מראש את הריחות בנפרד בשמן מינרלי כדי ליצור תפיסה איזו-אינטנסיבית.
הערה: כאן, הבחירה והריכוז של ריחות (כלומר, איזואמיל אצטט וחומצה בוטירית מדוללים לריכוזים של 0.6% ו-0.11% vol/vol, בהתאמה) התבססו על מחקרים קודמים של הקבוצה שלנו שהשתמשו באותו מערך אולפקטומטר וריחות42,43. מחקר פיילוט מאשר כי הריחות החיוביים והשליליים לא היו שונים מבחינת העוצמה אלא היו הפוכים בערך הדוני. במצב הבקרה (כלומר, ללא ריח), רק זרימת האוויר מועברת למשתתף. - כתוב את הקוד כדי לספק את הריחות. עבור כל ניסוי, ציין את משך הניסוי הכולל, את הריח שיש לספק, את קצב הזרימה של בקר הריח (במיליליטר לדקה), את קצב הזרימה של וסת האוויר המוביל (במיליליטר לדקה), ואת קצב הזרימה של וסת היניקה.
הערה: סדר הריח הנמסר יכול להיות אקראי בין חיובי, שלילי וללא ריח. כאן, לכל ניסיון יש משך של 12 שניות. סדר הריח שנמסר היה פסאודו-אקראי. בנוסף, בהתבסס על ניסוי פיילוט, קצב הזרימה של בקר הריח נקבע ל-200 מ"ל/דקה, קצב הזרימה של וסת האוויר המוביל הוא 500 מ"ל/דקה, וקצב הזרימה של וסת היניקה הוא 100 מ"ל/דקה. - מקמו את צינורית האף ליד נחיריו, כדי למדוד את נשימת האף. הנחו את המשתתף לנשום כרגיל דרך האף.
- הפעל את מדחס האוויר הנייד, את מארז האולפקטומטר ואת המחשב המכיל את התוכנה. בדוק את כל חיבורי הכבלים (איור 1).
הערה: מד האולפקטומטר המשמש במחקר הנוכחי תואר בפירוט בפרסום קודם44 אך שונה כאן כדי לאפשר הפעלת TMS עם עיכובים משתנים לאחר זיהוי הופעת ההשראה. בקצרה, המכשיר מורכב ממספר מודולים, ביניהם: 1) מקור אוויר ומערכת טיפול באוויר המגיעים ממדחס אוויר נייד, 2) מערכת גירוי הכוללת מכשירים אלקטרוניים ופנאומטיים, 3) ראש ערבוב ביתי המחובר למערכת הולכה המאפשרת פיזור ריחות באפו של המשתתף, 4) מערכת חישה נשימתית המפעילה את מד הריח על פי מדידת הנשימה באף באמצעות צינורית אף ו-5) תוכנה מערכת בקרה44. - כיול: המשך לשלב הכיול (כ-20 שניות), המאפשר כיול אות הנשימה של המשתתף והתאמת ספי הזיהוי של שלבי התפוגה וההשראה. בתוכנה זו, שלב התפוגה הוא חיובי, והשלב ההשראתי הוא שלילי.
- דירוגי ריח, נהנתנות ועוצמה: ספקו את שני הריחות בסדר אקראי ובקשו מהמשתתפים לדרג את הערך והעוצמה הנהנתניים של כל ריח בסקאלות אנלוגיות חזותיות שנעות בין 1 "בכלל לא נעים" ל-9 "נעים מאוד" ומ-1 "בכלל לא אינטנסיבי" ל"אינטנסיבי במיוחד".
- ריחות נבחרים עם ערכים נהנתניים נעימים ולא נעימים. לדלל מראש את הריחות בנפרד בשמן מינרלי כדי ליצור תפיסה איזו-אינטנסיבית.
- שילוב של אולפקטומטר ו-TMS: הגדר את ההשהיה בין זיהוי שלב ההשראה לבין הטריגר לשליחת ה-TMS ב-600ms.
הערה: הגדרת העיכוב חשובה ויש לקבוע אותה בהתאם לספרות ולצרכי המשתמש. בפרוטוקול זה, ההשהיה נקבעה על 600 מילישניות, אשר הוכח כייצוג התפיסתי המודע המרבי של ריחות45. במצב TMS של פעימה אחת, טריגר זה מפעיל מיד את ממריץ A, ופולס מועבר על ידי הסליל הממוקם על M1 השמאלי כדי לעורר MEP בלתי מותנה. עבור מצב TMS עם סליל כפול, טריגר זה נשלח לשני מכשירים שונים (באמצעות שני כבלים קואקסיאליים המחוברים באמצעות חיבור T): הראשון מפעיל מיד את מגרה B ופולס מיזוג מועבר על ידי הסליל הממוקם על DLPFC השמאלי; השני מתקבל על-ידי מחולל פולסים אשר מאפשר לגרום להשהיה קבועה לפני הפעלת ממריץ A, ובכך להעביר גירוי בדיקה דרך הסליל הממוקם על M1 השמאלי כדי לעורר MEP מותנה (איור 1).
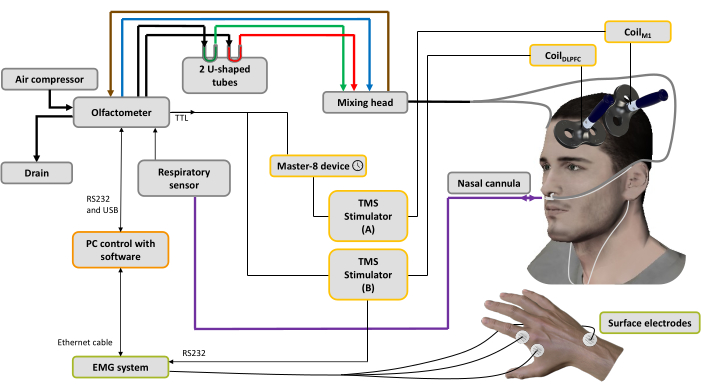
איור 1: מערך ניסויי. הקווים המודגשים מייצגים חיבורים פניאומטיים. מדחס אוויר מחובר לאולפקטומטר כדי ליצור זרימות אוויר שונות. וסת שולט בלחץ, וזרימת האוויר הנכנס מופנית ל-3 ערוצים (דרך 3 ווסתי מסה): אחד למסוע האוויר (קו כחול), אחד למערכת השאיפה (קו חום) לניקוי וסיוע בשליטה על זמן הגירוי והאחרון לריחות44. שני צינורות בצורת U מכילים את הריחות (ירוק: נעים; אדום: לא נעים) בהם הם מותנים בלחץ במצב קיטור רווי, מה שמבטיח זרימת אוויר ריחנית בעוצמה יציבה לאורך זמן. ראש הערבוב משמש לערבוב זרמי האוויר הנקיים והריחניים. זרימת האוויר (ריחנית או טהורה) מועברת לנחיריים דרך שני צינורות (קווים אפורים) המחוברים לצינורית האף, המשמשת גם לרישום נשימת האף (הקו הסגול). בהתבסס על האות הנשימתי, ברגע ששלב השאיפה מזוהה, עבור מצב spTMS טריגר נשלח למכשיר מחולל דופק המשמש להגדרת השהיה (כאן: 10 מילישניות), ולאחר מכן לממריץ TMS A המחובר לסלילM1 המופעל על ייצוג שריר היד M1 השמאלי, בעוד שממריץ TMS B כבוי. עבור מצב dsTMS, טריגר נשלח מיד לממריץ TMS B המחובר לסלילDLPFC המופעל על DLPFC השמאלי, ומכשיר מחולל הדופק משמש להגדרת השהיה (כאן: 10 אלפיות השנייה) לפני הפעלת ממריץ TMS A המחובר לסלילM1. אות הנשימה ומשרעת MEP הנרכשים על ידי מערכת EMG נרשמים על ידי תוכנה המותקנת במחשב. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
3. מדידות
- הפעל את סקריפט הקידוד בהתאמה אישית בתוכנת האולפקטומטר (ראה שלב 2.7.2) כדי לספק את כל השילובים של spTMS ו- dsTMS עם ריחות נעימים ולא נעימים וללא ריחות המתרחשים בסדר אקראי.
הערה: כאן, נרשמו 20 ניסויים עבור כל מצב (120 ניסויים בסך הכל). הניסוי חולק ל-6 בלוקים של 20 ניסויים כל אחד. ניתן לשנות את מספר הניסויים עבור כל תנאי בהתאם לצרכי המשתמש.
4. ניתוח נתונים
- עבור כל משתתף, תנאי וניסוי, חלץ את משרעת MEP משיא לשיא. ניתן לעשות זאת באמצעות אחד מארגז הכלים בקוד פתוח הזמין באינטרנט46,47.
- נרמל את הנתונים על ידי חישוב יחס MEP המבטא MEPs שהתעוררו על ידי גירוי הבדיקה בניסויי dsTMS ביחס ל- MEPs שהתעוררו על ידי גירוי הבדיקה בניסויי spTMS12. עשו זאת בנפרד עבור כל משתתף ועבור כל מצב ריח (כלומר, ללא ריח, ריח חיובי וריח שלילי). לאחר הליך זה, פרש את התוצאות באופן הבא: יחסי MEP מעל 1 מצביעים על השפעה מקלה של DLPFC על M1, בעוד שיחסי MEP מתחת ל-1 מצביעים על השפעה מעכבת של DLPFC על M1.
תוצאות
הנתונים המייצגים המוצגים כאן משקפים הקלטות של המשתתפים לאחר השלמת הפרוטוקול שלב אחר שלב לעיל כדי לספק תובנה ראשונית למה אנו עשויים לצפות.
איור 2 מראה דוגמה של אותות נשימה מייצגים של משתתפים שנרשמו באמצעות תוכנת האולפקטומטר. שלבי התפוגה וההשראה מזוהים היטב ?...
Discussion
הפרוטוקול לעיל מתאר שיטה חדשנית המשלבת שימוש באולפקטומטר מסונכרן נשימה עם TMS סליל יחיד וכפול כדי לחקור שינויים בעוררות קורטיקוספינלית וקישוריות יעילה בהתאם לערך הנהנתני של הריחות. מערך זה יאפשר להבחין באופן אובייקטיבי בערך הנעימות של ריחן אצל משתתף נתון, ולהצביע על ההשפעה הביולוגית של ה...
Disclosures
JB הוא חבר מועצת המנהלים של המחלקה לגירוי מוחי (STEP) של האגודה הצרפתית לפסיכיאטריה ביולוגית ונוירופסיכופרמקולוגיה (AFPBN), של האגודה האירופית לגירוי מוחי (ESBS), ומדווח על מענקי מחקר אקדמיים בתחום גירוי המוח מ- CIHR (קנדה), ANR ו- PHRC (צרפת). למחברים אחרים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי Fondation de France, Grant N°: 00123049/WB-2021-35902 (מענק שהתקבל על ידי J.B. ו- N.M). המחברים רוצים להודות לקרן פייר דניקר על תמיכתה (מענק שקיבלה C.N.) ולצוות פלטפורמת Neuro-Immersion על עזרתם רבת הערך בעיצוב המערך.
Materials
| Name | Company | Catalog Number | Comments |
| Acquisition board (8 channels) | National Instrument | NI USB-6009 | |
| Air compressor | Jun-Air | Model6-15 | |
| Alcohol prep pads | Any | ||
| Butyric acid | Sigma-Aldrich | B103500 | Negative odorant |
| Desktop computer | Dell | Latitude 3520 | |
| EMG system | Biopac System | MP150 | |
| Isoamyl acetate | Sigma-Aldrich | W205508 | Positive odorant |
| Nasal cannula | SEBAC France | O1320 | |
| Programmable pulse generator | A.M.P.I | Master-8 | |
| Surface electrodes | Kendall Medi-trace | FS327 | |
| TMS coil (X2) | MagStim | D40 Alpha B.I. coil | |
| TMS machine | MagStim | Bistim2 | |
| Tube 6 mm x 20 m | Radiospare | 686-2671 | Pneumatic connection |
| USB-RS232 | Radiospare | 687-7806 | |
| U-shaped tubes | VS technologies | VS110115 |
References
- Iravani, B., Schaefer, M., Wilson, D. A., Arshamian, A., Lundström, J. N. The human olfactory bulb processes odor valence representation and cues motor avoidance behavior. Proceedings of the National Academy of Sciences. 118 (42), e2101209118 (2021).
- Chalençon, L., Thevenet, M., Noury, N., Bensafi, M., Mandairon, N. Identification of new behavioral parameters to assess odorant hedonic value in humans: A naturalistic approach. Journal of Neuroscience Methods. 366, 109422 (2022).
- Infortuna, C., et al. Motor cortex response to pleasant odor perception and imagery: The differential role of personality dimensions and imagery ability. Frontiers in Human Neuroscience. 16, 943469 (2022).
- Ozaki, I., Kurata, K. The effects of voluntary control of respiration on the excitability of the primary motor hand area, evaluated by end-tidal CO2 monitoring. Clinical Neurophysiology. 126 (11), 2162-2169 (2015).
- Boroojerdi, B., Battaglia, F., Muellbacher, W., Cohen, L. G. Voluntary teeth clenching facilitates human motor system excitability. Clinical Neurophysiology. 111 (6), 988-993 (2000).
- Rossi, S., et al. Distinct olfactory cross-modal effects on the human motor system. PLOS One. 3 (2), e1702 (2008).
- Neige, C., Rannaud Monany, D., Lebon, F. Exploring cortico-cortical interactions during action preparation by means of dual-coil transcranial magnetic stimulation: A systematic review. Neuroscience and Biobehavioral Reviews. 128 (October 2020), 678-692 (2020).
- Koch, G. Cortico-cortical connectivity: the road from basic neurophysiological interactions to therapeutic applications. Experimental Brain Research. 238 (7-8), 1677-1684 (2020).
- Derosiere, G., Vassiliadis, P., Duque, J. Advanced TMS approaches to probe corticospinal excitability during action preparation. NeuroImage. 213 (November 2019), 116746 (2020).
- Goldenkoff, E. R., Mashni, A., Michon, K. J., Lavis, H., Vesia, M. Measuring and manipulating functionally specific neural pathways in the human motor system with transcranial magnetic stimulation. Journal of Visualized Experiments JoVE. 156, 60706 (2020).
- Malderen, S. V., Hehl, M., Verstraelen, S., Swinnen, S. P., Cuypers, K. Dual-site TMS as a tool to probe effective interactions within the motor network: a review. Reviews in the Neurosciences. 34 (2), 129-221 (2023).
- Neige, C., et al. Connecting the dots: Harnessing dual-site transcranial magnetic stimulation to assess the causal influence of medial frontal areas on the motor cortex. Cerebral Cortex. , bhad370 (2023).
- Ferbert, A., Priori, A., Rothwell, J. C., Day, B. L., Colebatch, J. G., Marsden, C. D. Interhemispheric inhibition of the human motor cortex. The Journal of physiology. 453, 525-546 (1992).
- Rothwell, J. C. Using transcranial magnetic stimulation methods to probe connectivity between motor areas of the brain. Human Movement Science. 30 (5), 906-915 (2011).
- Carlson, H., Leitão, J., Delplanque, S., Cayeux, I., Sander, D., Vuilleumier, P. Sustained effects of pleasant and unpleasant smells on resting state brain activity. Cortex. 132, 386-403 (2020).
- Farruggia, M. C., Pellegrino, R., Scheinost, D. Functional connectivity of the chemosenses: A review. Frontiers in Systems Neuroscience. 16, 865929 (2022).
- Hasan, A., Galea, J. M., Casula, E. P., Falkai, P., Bestmann, S., Rothwell, J. C. Muscle and timing-specific functional connectivity between the dorsolateral prefrontal cortex and the primary motor cortex. Journal of Cognitive Neuroscience. 25 (4), 558-570 (2013).
- Brown, M. J. N., Goldenkoff, E. R., Chen, R., Gunraj, C., Vesia, M. Using dual-site transcranial magnetic stimulation to probe connectivity between the dorsolateral prefrontal cortex and ipsilateral primary motor cortex in humans. Brain Sciences. 9 (8), 177 (2019).
- Xia, X., et al. Connectivity from ipsilateral and contralateral dorsolateral prefrontal cortex to the active primary motor cortex during approaching-avoiding behavior. Cortex. 157, 155-166 (2022).
- Wang, Y., Cao, N., Lin, Y., Chen, R., Zhang, J. Hemispheric differences in functional interactions between the dorsal lateral prefrontal cortex and ipsilateral motor cortex. Frontiers in Human Neuroscience. 14, 1-6 (2020).
- Gabbott, P. L. A., Warner, T. A., Jays, P. R. L., Salway, P., Busby, S. J. Prefrontal cortex in the rat: Projections to subcortical autonomic, motor, and limbic centers. Journal of Comparative Neurology. 492 (2), 145-177 (2005).
- Yeterian, E. H., Pandya, D. N., Tomaiuolo, F., Petrides, M. The cortical connectivity of the prefrontal cortex in the monkey brain. Cortex. 48 (1), 58-81 (2012).
- Rossi, S., et al. Safety and recommendations for TMS use in healthy subjects and patient populations, with updates on training, ethical and regulatory issues: Expert guidelines. Clinical Neurophysiology. 132 (1), 269-306 (2021).
- Joussain, P., et al. Application of the European Test of Olfactory Capabilities in patients with olfactory impairment. European Archives of Oto-Rhino-Laryngology. 273 (2), 381-390 (2016).
- Oldfield, R. C. The assessment and analysis of handedness: The Edinburgh inventory. Neuropsychologia. 9 (1), 97-113 (1971).
- Daligadu, J., Haavik, H., Yielder, P. C., Baarbe, J., Murphy, B. Alterations in cortical and cerebellar motor processing in subclinical neck pain patients following spinal manipulation. Journal of Manipulative and Physiological Therapeutics. 36 (8), 527-537 (2013).
- Andersen, K. W., Siebner, H. R. Mapping dexterity and handedness: recent insights and future challenges. Current Opinion in Behavioral Sciences. 20, 123-129 (2018).
- Fried, P. J., et al. Training in the practice of noninvasive brain stimulation: Recommendations from an IFCN committee. Clinical Neurophysiology. 132 (3), 819-837 (2021).
- Mills, K. R., Boniface, S. J., Schubert, M. Magnetic brain stimulation with a double coil: the importance of coil orientation. Electroencephalography and Clinical Neurophysiology. 85 (1), 17-21 (1992).
- Rossini, P. M., et al. Non-invasive electrical and magnetic stimulation of the brain, spinal cord, roots and peripheral nerves: Basic principles and procedures for routine clinical and research application. An updated report from an I.F.C.N. Committee. Clinical Neurophysiology. 126 (6), 1071-1107 (2015).
- Awiszus, F. TMS and threshold hunting. Supplements to Clinical Neurophysiology. 56, 13-23 (2003).
- Awiszus, F. Using relative frequency estimation of transcranial magnetic stimulation motor threshold does not allow to draw any conclusions about true threshold. Clinical Neurophysiology. 125 (6), 1285-1286 (2014).
- Ah Sen, C. B., Fassett, H. J., El-Sayes, J., Turco, C. V., Hameer, M. M., Nelson, A. J. Active and resting motor threshold are efficiently obtained with adaptive threshold hunting. PLoS One. 12 (10), 1-9 (2017).
- Neige, C., Rannaud Monany, D., Stinear, C. M., Byblow, W. D., Papaxanthis, C., Lebon, F. Unravelling the modulation of intracortical inhibition during motor imagery: An adaptive threshold-hunting study. Neuroscience. 434, 102-110 (2020).
- Burke, D., Pierrot-Deseilligny, E. Caveats when studying motor cortex excitability and the cortical control of movement using transcranial magnetic stimulation. Clinical Neurophysiology. 121 (2), 121-123 (2010).
- Mir-Moghtadaei, A., et al. Updated scalp heuristics for localizing the dorsolateral prefrontal cortex based on convergent evidence of lesion and brain stimulation studies in depression. Brain Stimulation. 15 (2), 291-295 (2022).
- Siddiqi, S. H., et al. Brain stimulation and brain lesions converge on common causal circuits in neuropsychiatric disease. Nature Human Behaviour. 5 (12), 1707-1716 (2021).
- Caulfield, K. A., Fleischmann, H. H., Cox, C. E., Wolf, J. P., George, M. S., McTeague, L. M. Neuronavigation maximizes accuracy and precision in TMS positioning: Evidence from 11,230 distance, angle, and electric field modeling measurements. Brain Stimulation. 15 (5), 1192-1205 (2022).
- Cao, N., et al. Plasticity changes in dorsolateral prefrontal cortex associated with procedural sequence learning are hemisphere-specific. NeuroImage. 259, 119406 (2022).
- Brown, M. J. N., et al. Somatosensory-motor cortex interactions measured using dual-site transcranial magnetic stimulation. Brain Stimulation. 12 (5), 1229-1243 (2019).
- Fiori, F., Chiappini, E., Candidi, M., Romei, V., Borgomaneri, S., Avenanti, A. Long-latency interhemispheric interactions between motor-related areas and the primary motor cortex: a dual site TMS study. Scientific reports. 7 (1), 14936 (2017).
- Fournel, A., Ferdenzi, C., Sezille, C., Rouby, C., Bensafi, M. Multidimensional representation of odors in the human olfactory cortex. Human Brain Mapping. 37 (6), 2161-2172 (2016).
- Midroit, M., et al. Neural processing of the reward value of pleasant odorants. Current Biology. 31 (8), 1592-1605.e9 (2021).
- Sezille, C., Messaoudi, B., Bertrand, A., Joussain, P., Thévenet, M., Bensafi, M. A portable experimental apparatus for human olfactory fMRI experiments. Journal of Neuroscience Methods. 218 (1), 29-38 (2013).
- Kato, M., et al. Spatiotemporal dynamics of odor representations in the human brain revealed by EEG decoding. Proceedings of the National Academy of Sciences. 119 (21), e2114966119 (2022).
- Jackson, N., Greenhouse, I. VETA: An open-source Matlab-based toolbox for the collection and analysis of electromyography combined with transcranial magnetic stimulation. Frontiers in Neuroscience. 13, 975 (2019).
- Cunningham, D., Zhang, B., Cahn, A. Transcranial magnetic stimulation (TMS) analysis toolbox: A user friendly open source software for basic and advanced analysis and data sharing of TMS related outcomes. Brain Stimulation: Basic, Translational, and Clinical Research in Neuromodulation. 14 (6), 1641-1642 (2021).
- Julkunen, P., Säisänen, L., Hukkanen, T., Danner, N., Könönen, M. Does second-scale intertrial interval affect motor evoked potentials induced by single-pulse transcranial magnetic stimulation. Brain Stimulation. 5 (4), 526-532 (2012).
- Pellicciari, M. C., Miniussi, C., Ferrari, C., Koch, G., Bortoletto, M. Ongoing cumulative effects of single tms pulses on corticospinal excitability: An intra- and inter-block investigation. Clinical Neurophysiology. 127 (1), 621-628 (2016).
- Li, S., Rymer, W. Z. Voluntary breathing influences corticospinal excitability of nonrespiratory finger muscles. Journal of Neurophysiology. 105 (2), 512-521 (2011).
- Boesveldt, S., Frasnelli, J., Gordon, A. R., Lundström, J. N. The fish is bad: Negative food odors elicit faster and more accurate reactions than other odors. Biological Psychology. 84 (2), 313-317 (2010).
- Neige, C., Mavromatis, N., Gagné, M., Bouyer, L. J., Mercier, C. Effect of movement-related pain on behaviour and corticospinal excitability changes associated with arm movement preparation. Journal of Physiology. 596 (14), 2917-2929 (2018).
- Bergmann, T. O., Hartwigsen, G. Inferring causality from noninvasive brain stimulation in cognitive neuroscience. Journal of Cognitive Neuroscience. 33 (2), 195-225 (2021).
- Kulason, S., et al. A comparative neuroimaging perspective of olfaction and higher-order olfactory processing: on health and disease. Seminars in Cell & Developmental Biology. 129, 22-30 (2022).
- Athanassi, A., Dorado Doncel, R., Bath, K. G., Mandairon, N. Relationship between depression and olfactory sensory function: a review. Chemical Senses. 46, bjab044 (2021).
- Grimm, S., et al. Imbalance between left and right dorsolateral prefrontal cortex in major depression is linked to negative emotional judgment: An fmri study in severe major depressive disorder. Biological Psychiatry. 63 (4), 369-376 (2008).
- Naudin, M., El-Hage, W., Gomes, M., Gaillard, P., Belzung, C., Atanasova, B. State and trait olfactory markers of major depression. PLOS One. 7 (10), e46938 (2012).
- Guidali, G., Roncoroni, C., Bolognini, N. Modulating frontal networks' timing-dependent-like plasticity with paired associative stimulation protocols: Recent advances and future perspectives. Frontiers in Human Neuroscience. 15, 658723 (2021).
- Hernandez-Pavon, J. C., San Agustín, A., Wang, M. C., Veniero, D., Pons, J. L. Can we manipulate brain connectivity? A systematic review of cortico-cortical paired associative stimulation effects. Clinical Neurophysiology. 154, 169-193 (2023).
- Deng, Z. -. D., Robins, P. L., Dannhauer, M., Haugen, L. M., Port, J. D., Croarkin, P. E. Optimizing TMS coil placement approaches for targeting the dorsolateral prefrontal cortex in depressed adolescents: An electric field modeling study. Biomedicines. 11 (8), 2320 (2023).
- Gomez, L. J., Dannhauer, M., Peterchev, A. V. Fast computational optimization of TMS coil placement for individualized electric field targeting. NeuroImage. 228, 117696 (2021).
- Derosiere, G., Duque, J. Tuning the corticospinal system: How distributed brain circuits shape human actions. The Neuroscientist. 26 (4), 359-379 (2020).
- Bestmann, S., Krakauer, J. W. The uses and interpretations of the motor-evoked potential for understanding behaviour. Experimental Brain Research. 233 (3), 679-689 (2015).
- Reis, J., et al. Contribution of transcranial magnetic stimulation to the understanding of cortical mechanisms involved in motor control. Journal of Physiology. 586 (2), 325-351 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved