Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Combinaison d’un olfactomètre synchronisé avec la respiration et d’une simulation cérébrale pour étudier l’impact des odeurs sur l’excitabilité corticospinale et la connectivité efficace
Dans cet article
Résumé
Cet article décrit l’utilisation d’un olfactomètre synchronisé avec la respiration pour déclencher une stimulation magnétique transcrânienne (TMS) à simple et double bobine lors de la présentation de l’odorant synchronisée avec la respiration nasale humaine. Cette combinaison nous permet d’étudier objectivement l’impact des odeurs agréables et désagréables sur l’excitabilité corticospinale et la connectivité cérébrale efficace chez un individu donné.
Résumé
Il est largement admis que la stimulation olfactive suscite des comportements moteurs, tels que l’approche des odeurs agréables et l’évitement des odeurs désagréables, chez les animaux et les humains. Récemment, des études utilisant l’électroencéphalographie et la stimulation magnétique transcrânienne (TMS) ont démontré un lien étroit entre le traitement dans le système olfactif et l’activité dans le cortex moteur chez l’homme. Pour mieux comprendre les interactions entre les systèmes olfactif et moteur et surmonter certaines des limites méthodologiques précédentes, nous avons développé une nouvelle méthode combinant un olfactomètre qui synchronise la présentation en ordre aléatoire des odorants avec différentes valeurs hédoniques et le déclenchement TMS (single- and dual-coil) avec les phases de respiration nasale. Cette méthode permet de sonder les modulations de l’excitabilité corticospinale et de la connectivité ipsilatérale efficace entre le cortex préfrontal dorsolatéral et le cortex moteur primaire qui pourraient se produire lors de la perception d’odeurs agréables et désagréables. L’application de cette méthode permettra de discriminer objectivement la valeur d’agrément d’un odorant chez un participant donné, indiquant l’impact biologique de l’odorant sur la connectivité effective et l’excitabilité du cerveau. En outre, cela pourrait ouvrir la voie à des investigations cliniques chez les patients atteints de troubles neurologiques ou neuropsychiatriques qui peuvent présenter des altérations hédoniques des odeurs et des comportements d’évitement d’approche inadaptés.
Introduction
Il est largement admis que la stimulation olfactive provoque des réactions automatiques et des comportements moteurs. Par exemple, chez l’homme, l’existence d’une réponse motrice d’évitement (s’éloigner de la source d’odeur) se produisant 500 ms après l’apparition d’une odeur négative a été récemment démontrée1. En enregistrant des participants humains se déplaçant librement explorant les odeurs émanant des flacons, Chalençon et al. (2022) ont montré que les comportements moteurs (c’est-à-dire la vitesse d’approche du nez et le retrait de la fiole contenant l’odorant) sont étroitement liés à l’hédonisme olfactif2. De plus, un lien étroit entre le traitement dans le système olfactif et l’activité dans le cortex moteur a été récemment démontré chez l’homme en utilisant l’électroencéphalographie1. Plus précisément, environ 350 ms après l’apparition des odeurs négatives, une désynchronisation spécifique du rythme mu, connue pour refléter des processus de préparation à l’action, a été observée au-dessus et à l’intérieur du cortex moteur primaire (M1), suivie peu de temps d’un mouvement comportemental vers l’arrière1. Renforçant l’idée d’une relation entre les systèmes olfactif et moteur, une autre étude récente a montré que l’exposition à un odorant agréable augmentait l’excitabilité corticospinale par rapport à une condition sans odeur3. Dans cette étude, la stimulation magnétique transcrânienne à impulsion unique (spTMS) a été appliquée à M1 pour évoquer un potentiel évoqué moteur (MEP) dans un muscle cible de la main, enregistré en périphérie avec électromyographie (EMG) lors de la perception des odeurs. L’exposition à l’odorant agréable était fournie passivement par des bandes de papier imbibées d’huile essentielle de bergamote pure et placées sur un support métallique sous le nez3. Dans ce contexte, il n’est pas clair si la facilitation de l’excitabilité corticospinale est due à la stimulation odorante agréable ou à des effets comportementaux non spécifiques tels que le reniflement et le serrement des dents 4,5. De plus, on ne sait toujours pas comment un odorant désagréable module l’excitabilité M1 sondée par TMS.
En résumé, cela met en évidence la nécessité de développer une méthode qui offre les avantages suivants par rapport aux techniques existantes utilisées dans les études précédentes 3,6 : (1) randomiser la présentation de différentes conditions olfactives (agréable/désagréable/sans odeur) au sein d’une même phase expérimentale, (2) synchroniser précisément la présentation des odorants et le timing de la TMS en fonction des phases de respiration nasale humaine (inspiration et expiration) lors de l’étude du système moteur.
La TMS peut également être utilisée comme un outil pour étudier les interactions cortico-corticales, également appelées connectivité effective, entre plusieurs aires corticales et M1 avec une résolution temporelle élevée 7,8,9,10,11,12. Ici, nous utilisons un paradigme TMS à double site (dsTMS), dans lequel une stimulation de premier conditionnement (CS) active une zone corticale cible, et une stimulation de second test (TS) est appliquée sur M1 en utilisant une autre bobine pour évoquer une MEP. L’effet de la CS est évalué en normalisant l’amplitude de la MEP conditionnée (condition dsTMS) à l’amplitude de la MEP non conditionnée (condition spTMS)13. Ensuite, les valeurs négatives indiquent des interactions cortico-corticales suppressives, tandis que les valeurs positives indiquent des interactions cortico-corticales facilitatrices entre les deux zones stimulées. Le paradigme de la SMTd offre donc une occasion unique d’identifier la nature (c’est-à-dire facilitatrice ou suppressive), la force et les modulations de la connectivité effective entre la zone préactivée et M1. Il est important de noter que les interactions cortico-corticales reflètent un équilibre complexe de facilitation et de suppression qui peut être modulé en fonction du moment et des états mentauxou des tâches 7,14.
À notre connaissance, le paradigme relativement nouveau de la SMTd n’a jamais été utilisé pour étudier les interactions cortico-corticales lors de la perception d’odeurs avec différentes valeurs hédoniques. Cependant, des études de neuroimagerie ont montré que l’exposition à des odeurs agréables et désagréables induit des changements de connectivité dans les zones impliquées dans l’émotion, la prise de décision et le contrôle de l’action, y compris l’aire motrice supplémentaire, le cortex cingulaire antérieur et le cortex préfrontal dorsolatéral (DLPFC)15,16. En effet, le DLPFC est un nœud clé qui médie le contrôle émotionnel, le traitement sensoriel et les aspects de niveau supérieur du contrôle moteur, tels que les processus préparatoires 17,18,19. De plus, des études chez l’homme et l’animal ont fourni des preuves que le DLPFC a diverses projections neuronales vers M1 17,18,20,21,22. Selon le contexte, ces projections DLPFC peuvent faciliter ou inhiber l’activité de M1 7,19,20. Ainsi, il semble possible que la connectivité effective entre DLPFC et M1 soit modulée lors de la présentation des odeurs et que les odorants agréables et désagréables recrutent des réseaux corticaux séparés, conduisant à un effet différentiel sur la connectivité DLPFC-M1.
Nous proposons ici une nouvelle méthode adaptée à l’étude méthodologiquement rigoureuse des modulations de l’excitabilité corticospinale et de la connectivité effective qui pourraient se produire lors de la perception d’odeurs agréables et désagréables, le tout délivré en synchronie avec la respiration nasale humaine.
Protocole
Toutes les procédures expérimentales décrites dans les sections suivantes ont été approuvées par un Comité d’éthique (CPP Ile de France VII, Paris, France, numéro de protocole 2022-A01967-36) conformément à la Déclaration d’Helsinki. Tous les participants ont donné leur consentement éclairé par écrit avant l’inscription à l’étude.
1. Recrutement des participants
- Critères d’inclusion/exclusion.
- Inclure les participants adultes (> 18 ans). Dépister tous les participants pour toute contre-indication à la SMT conformément aux directives d’experts internationaux23.
- Exclure les participants porteurs d’un dispositif médical implanté (p. ex., implant cochléaire, stimulateur cardiaque, etc.), ayant des antécédents personnels ou familiaux de convulsions, de maux de tête, de traumatisme crânien et de médicaments neuroactifs. Exclure les participants considérés comme « anosmiques » selon le Test Européen des Capacités Olfactives24.
- Mains : Vérifiez si vous êtes droitier tel qu’évalué par le questionnaire de l’Edinburgh Handedness Inventory25.
NOTE. Il est fortement recommandé de ne recruter que des droitiers dans les études évaluant l’excitabilité corticospinale et la connectivité effective dans le système moteur26,27. - Information et consentement éclairé : Donnez à tous les participants des informations de base sur les objectifs, les procédures et les risques de l’étude approuvés par le comité d’éthique et demandez-leur de signer un consentement éclairé écrit.
2. Procédure expérimentale
- Installation par le patient : Demandez au participant de s’asseoir sur une chaise confortable (type fauteuil dentaire) avec les deux mains détendues et en pronation. Positionnez la tête du participant sur une mentonnière pour minimiser les mouvements de la tête pendant la stimulation.
- Enregistrements d’électromyographie
- Préparez la peau du participant avant l’application de l’électrode à l’aide d’un gommage exfoliant pour abraser légèrement les zones et nettoyez les zones à l’aide de tampons imbibés d’alcool où les électrodes seront appliquées.
- Appliquer deux électrodes d’enregistrement jetables en argent/chlorure d’argent avec un montage ventre-tendon du premier muscle interosseux dorsal (FDI). Ajoutez l’électrode de masse au processus styloïde du cubitus (Figure 1).
- Connectez les électrodes à l’amplificateur à l’aide de câbles et du système d’acquisition de données.
- Enregistrez le signal EMG à l’aide d’un système de conversion analogique-numérique (AD). Amplifiez et filtrez les signaux EMG (gain = 1000) en utilisant une fréquence de bande passante comprise entre 10 Hz et 1 kHz. Numérisez à une fréquence d’échantillonnage de 2 000 Hz et stockez chaque fichier EMG pour une analyse hors ligne.
- Vérifiez la qualité du signal affiché sur l’écran de l’ordinateur connecté au système d’acquisition de données.
- Bobine TMSposition M1 .
- Connectez cette bobine au stimulateur A (Figure 1).
- Placez un bonnet bien ajusté sur la tête du participant. Utilisez un ruban à mesurer pour effectuer des mesures de nasion-inion, tragus-tragus et de circonférence de la tête en fonction de repères crâniens standard. Identifiez et marquez avec un stylo le vertex du cuir chevelu à l’intersection des lignes médiane sagittale (nasion-inion) et interaurale (tragus-tragus)28.
- Placez tangentiellement au cuir chevelu la première petite bobine en forme de huit (diamètre intérieur : 40 mm) sur la zone présumée de la main de la gauche M1 (bobineM1), qui est à 5 cm latérale du sommet, avec la poignée pointant vers l’arrière et latéralement à un angle de 45° par rapport à la ligne médiane sagittale, ce qui entraîne un flux de courant postérieur-antérieur (forme d’onde de courant monophasique). Cette orientation correspond à un courant induit maximal circulant dans M1 à l’intérieur de M129.
- S’assurer que le placement de la bobineM1 est optimal, conformément aux recommandations internationales les plus récentes30. Commencez par délivrer quelques impulsions individuelles à 30 % de la puissance maximale du stimulateur (%MSO) et vérifiez que la stimulation produit une MEP telle qu’elle est enregistrée par le système EMG et affichée sur l’écran de l’ordinateur connecté au système d’acquisition de données.
- S’il n’y a pas de réponses visibles, augmentez progressivement l’intensité de la stimulation (incréments de 5 % MSO) jusqu’à ce que les MEP soient observés. Ensuite, testez quatre points autour du premier site en délivrant plusieurs impulsions. Déterminez l’amplitude MEP moyenne crête à crête pour chaque site.
- Sélectionnez l’emplacement où l’amplitude moyenne crête à crête MEP est la plus élevée. Il s’agit de ce que l’on appelle l’emplacement du hotspot pour le participant30. Marquez l’emplacement de la bobineM1 sur le capuchon pour assurer un placement correct de la bobine tout au long de l’expérience.
- Seuil moteur au repos (rMT) et intensités TMS
- Déterminer le seuil moteur au repos (rMT) défini comme l’intensité TMS qui produit une probabilité de 50 % d’obtenir un MEP 23,30.
- Utilisez le logiciel gratuit disponible en ligne (TMS Motor Threshold Assessment Tool, MTAT 2.1), qui est basé sur une estimation des paramètres du maximum de vraisemblance à l’aide d’une stratégie de test séquentiel29. La séquence de stimulation commence toujours avec l’intensité réglée à 37 % MSO.
- Supposons qu’un expérimentateur tienne la bobineM1 pendant qu’un autre indique si l’amplitude MEP est > 0,05 mV. L’algorithme prédictif détermine ensuite la prochaine intensité de stimulation à délivrer et s’arrête après 20 stimulations, ce qui fournit une précision suffisante pour l’estimation de la rMT selon les études précédentes31-34.
- Réglez le %MSO pour le conditionnement et la stimulation par impulsions de test. Utilisez la valeur rMT du participant déterminée précédemment.
REMARQUE : Ici, l’intensité de la première stimulation de conditionnement (bobineDLPFC) a été réglée à 110% de la rMT19,20. L’intensité de la stimulation du test (bobineM1) a été fixée à 120% de la rMT, une intensité qui diffère légèrement des études précédentes qui utilisaient une intensité TS qui évoquait une MEP de ~1 mV chez tous les participants19,20 . Cette intensité fixe d’un pic à l’autre se produit à des points très différents sur les courbes de recrutement entrées-sorties en raison de la forte variabilité inter-sujets de la sortie du moteur35. Par conséquent, l’intensité de la stimulation pourrait être optimisée en utilisant une intensité RMT de 120 % chez les individus.
- Déterminer le seuil moteur au repos (rMT) défini comme l’intensité TMS qui produit une probabilité de 50 % d’obtenir un MEP 23,30.
- PositionnementDLPFC de la bobine TMS
- Connectez cette bobine au stimulateur B (Figure 1).
- Utilisez l’heuristique du cuir chevelu récemment mise à jour pour localiser la région du cuir chevelu correspondant au DLPFCgauche 36,37 afin d’estimer la position de la deuxième petite bobine en forme de huit (diamètre interne : 40 mm) sur le DLPFC (bobineDLPFC). Téléchargez l’outil de calcul Excel en ligne36 et entrez les distances nasion-inion et tragus-tragus ainsi que le périmètre crânien en centimètres comme entrées. Indiquez les distances XLA et YLA directement sur la tête du participant.
- Placez tangentiellement au cuir chevelu la bobineDLPFC sur l’emplacement gauche présumé de DLPFC, avec la poignée pointant vers le bas et latéralement à un angle de -45° par rapport à la ligne médio-sagittale. Marquez l’emplacement de la bobineDLPFC sur le capuchon pour assurer un placement correct de la bobine tout au long de l’expérience.
REMARQUE : Cette méthode de ciblage basée sur le cuir chevelu pour les emplacements de la bobineM1 etde la bobine DLPFC n’est pas optimale. En fait, elle est connue pour être moins précise que la méthode de neuronavigation utilisée pour cibler les zones d’intérêt du cerveau sur la base de l’imagerie par résonance magnétique anatomique (IRM) T1 individuelle38.
- Délai entre les impulsions de conditionnement et les impulsions de test : Réglez ce délai sur 10 ms sur le générateur d’impulsions.
NOTE : Ici, le délai est fixé à 10 ms sur la base d’études antérieures montrant une influence inhibitrice du DLPFC gauche vers le M1 gauche à cet intervalle19,20. Cet effet inhibiteur observé à 10 ms est probablement dû à l’activation des noyaux gris centraux via les projections DLPFC vers la pré-SMA, exerçant ainsi une influence indirecte sur M139. Le délai peut être ajusté dans le code en fonction des besoins de l’utilisateur. Par exemple, un intervalle d’interstimulation plus long (c’est-à-dire 25 ms) pourrait être utilisé pour étudier les circuits cortico-sous-corticaux-corticaux indirects polysynaptiques reliant DLPFC à M119. De plus, des influences différentielles facilitatrices/inhibitrices ont été démontrées à l’aide d’une ppTMS à double site entre plusieurs aires corticales, avec des intervalles allant de 1 ms à 150 ms40,41. Ainsi, le fait que l’intervalle puisse être ajusté ouvre la voie à un large éventail de possibilités pour les études de recherche futures. - Réglages de l’olfactomètre
- Sélectionnez des odorants avec des valeurs hédoniques agréables et désagréables. Diluez à l’avance les odorants individuellement dans de l’huile minérale pour créer une perception iso-intense.
REMARQUE : Ici, la sélection et la concentration des odorants (c’est-à-dire l’acétate d’isoamyle et l’acide butyrique dilués à 0,6% et 0,11% vol/vol, respectivement) ont été basées sur des études antérieures menées par notre groupe en utilisant la même configuration d’olfactomètre et les odorants42,43. Une étude pilote confirme que les odeurs positives et négatives ne différaient pas en termes d’intensité, mais étaient opposées en valeur hédonique. Dans la condition de contrôle (c’est-à-dire sans odorant), seul le flux d’air est délivré au participant. - Écrivez le code pour délivrer les odorants. Pour chaque essai, indiquez la durée totale de l’essai, l’odorant à délivrer, le débit du programmateur odorisant (en millilitres par minute), le débit du régulateur d’air porteur (en millilitres par minute) et le débit du régulateur d’aspiration.
REMARQUE : L’ordre de l’odorant livré peut être aléatoire entre positif, négatif et sans odeur. Ici, chaque essai a une durée de 12 s. L’ordre des odeurs délivrées était pseudo-aléatoire. De plus, sur la base d’une expérience pilote, le débit du régulateur d’odeur a été réglé à 200 mL/min, le débit du régulateur d’air porteur à 500 mL/min et le débit du régulateur d’aspiration à 100 mL/min. - Placez la canule nasale près des narines du participant pour mesurer la respiration nasale. Demandez au participant de respirer normalement par le nez.
- Mettez sous tension le compresseur d’air portable, le boîtier de l’olfactomètre et le PC contenant le logiciel. Vérifiez toutes les connexions des câbles (Figure 1).
NOTE : L’olfactomètre utilisé dans la présente étude a été décrit en détail dans une publication précédente44 , mais il a été modifié ici pour permettre le déclenchement de la SMT avec des délais variables après la détection de l’apparition de l’inspiration. En bref, l’appareil est composé de plusieurs modules, dont 1) une source d’air et un système de traitement de l’air provenant d’un compresseur d’air portable, 2) un système de stimulation comprenant des dispositifs électroniques et pneumatiques, 3) une tête de mélange artisanale couplée à un système de diffusion qui permet la diffusion des odorants dans le nez du participant, 4) un système sensoriel respiratoire qui déclenche l’olfactomètre en fonction de la mesure de la respiration nasale avec une canule nasale et 5) un logiciel Système de contrôle44. - Calibrage : Passer à la phase de calibration (environ 20 s.), qui permet de calibrer le signal respiratoire du participant et d’ajuster les seuils de détection des phases expiratoire et inspiratoire. Dans ce logiciel, la phase expiratoire est positive et la phase inspiratoire est négative.
- Cotes hédoniques et d’intensité des odeurs : Présentez les deux odorants dans un ordre aléatoire et demandez aux participants d’évaluer la valeur hédonique et l’intensité de chaque odorant sur des échelles visuelles analogiques allant de 1 « pas du tout agréable » à 9 « extrêmement agréable » et de 1 « pas du tout intense » à « extrêmement intense ».
- Sélectionnez des odorants avec des valeurs hédoniques agréables et désagréables. Diluez à l’avance les odorants individuellement dans de l’huile minérale pour créer une perception iso-intense.
- Combinaison d’un olfactomètre et d’un TMS : Réglez le délai entre la détection de la phase d’inspiration et le déclenchement de l’envoi du TMS à 600 ms.
REMARQUE : Le réglage du délai est important et doit être déterminé en fonction de la littérature et des besoins de l’utilisateur. Dans ce protocole, le délai a été fixé à 600 ms, ce qui s’est avéré être la représentation perceptive consciente maximale des odeurs45. Pour les conditions TMS à impulsion unique, ce déclencheur active immédiatement le stimulateur A, et une impulsion est délivrée par la bobine positionnée sur le M1 gauche pour évoquer un MEP inconditionné. Pour les conditions TMS à double bobine, ce déclenchement est envoyé à deux appareils différents (via deux câbles coaxiaux reliés par une connexion en T) : le premier active immédiatement le stimulateur B et une impulsion de conditionnement est délivrée par la bobine positionnée sur le DLPFC gauche ; le second est reçu par un générateur d’impulsions qui permet d’induire un délai fixe avant d’activer le stimulateur A, délivrant ainsi un test-stimulation à travers la bobine positionnée sur le M1 gauche pour évoquer une MEP conditionnée (Figure 1).
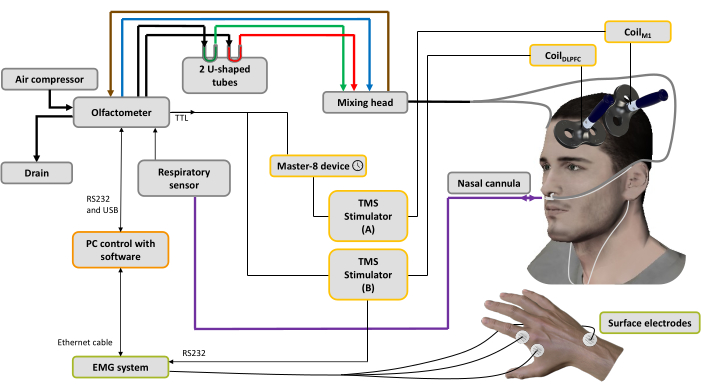
Figure 1 : Dispositif expérimental. Les lignes en gras représentent les connexions pneumatiques. Un compresseur d’air est relié à l’olfactomètre pour générer différents flux d’air. Un régulateur contrôle la pression, et le flux d’air d’entrée est dirigé vers 3 canaux (à travers 3 régulateurs de masse) : un pour le convoyeur d’air (ligne bleue), un pour le système d’aspiration (ligne brune) pour nettoyer et aider à contrôler le temps de stimulation et le dernier pour les odorants44. Deux tubes en forme de U contiennent les odorants (vert : agréable ; rouge : désagréable) dans lesquels ils sont conditionnés sous pression à l’état de vapeur saturée, assurant un flux d’air odorisé avec une intensité stable dans le temps. La tête de mélange est utilisée pour mélanger les flux d’air propre et odorisé. Le flux d’air (odorisé ou pur) est délivré aux narines par deux tubes (lignes grises) attachés à une canule nasale, qui est également utilisée pour enregistrer la respiration nasale (ligne violette). Sur la base du signal respiratoire, dès que la phase d’inhalation est détectée, pour la condition spTMS, un déclencheur est envoyé à un dispositif générateur d’impulsions utilisé pour régler un délai (ici : 10 ms), puis à un stimulateur TMS A connecté à la bobineM1 appliquée sur la représentation musculaire de la main gauche M1, tandis que le stimulateur TMS B est éteint. Pour la condition dsTMS, un déclencheur est immédiatement envoyé au stimulateur TMS B connecté à la bobineDLPFC appliquée sur le DLPFC gauche, et le dispositif générateur d’impulsions est utilisé pour régler un délai (ici : 10 ms) avant de déclencher le stimulateur TMS A connecté à la bobineM1. Le signal respiratoire et l’amplitude MEP acquis par le système EMG sont enregistrés par un logiciel installé sur un PC. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Mesures
- Exécutez le script de codage personnalisé dans le logiciel olfactomètre (voir l’étape 2.7.2) pour fournir toutes les combinaisons de spTMS et de dsTMS avec des odeurs agréables et désagréables et des odeurs sans odeur se produisant dans un ordre aléatoire.
NOTE : Ici, 20 essais ont été enregistrés pour chaque condition (120 essais au total). L’expérience a été divisée en 6 blocs de 20 essais chacun. Le nombre d’essais pour chaque condition peut être modifié en fonction des besoins de l’utilisateur.
4. Analyses de données
- Pour chaque participant, condition et essai, extrayez l’amplitude MEP crête à crête. Cela peut être fait à l’aide de l’une des boîtes à outils open-source disponibles en ligne46,47.
- Normaliser les données en calculant un rapport MEP exprimant les MEP provoquées par la stimulation du test dans les essais de dsTMS par rapport aux MEP provoquées par la stimulation du test dans les essais de spTMS12. Faites-le séparément pour chaque participant et pour chaque condition d’odeur (c’est-à-dire absence d’odeur, odeur positive et odeur négative). Après cette procédure, interprétez les résultats comme suit : les ratios MEP supérieurs à 1 indiquent une influence facilitatrice du DLPFC sur M1, tandis que les ratios MEP inférieurs à 1 indiquent une influence inhibitrice du DLPFC sur M1.
Résultats
Les données représentatives présentées ici reflètent les enregistrements des participants après avoir suivi le protocole étape par étape ci-dessus pour donner un aperçu préliminaire de ce à quoi nous pourrions nous attendre.
La figure 2 montre un exemple de signaux respiratoires représentatifs d’un participant enregistré avec le logiciel d’olfactomètre. Les phases expiratoire et inspiratoire sont bien détectées lorsque les seuils sont franchis....
Discussion
Le protocole ci-dessus décrit une nouvelle méthode combinant l’utilisation d’un olfactomètre synchronisé avec la respiration avec une TMS à simple et double bobine pour étudier les changements dans l’excitabilité corticospinale et la connectivité effective en fonction de la valeur hédonique des odorants. Cette configuration permettra de discriminer objectivement la valeur d’agrément d’un odorant chez un participant donné, indiquant l’impact biologique de l’odorant sur la connectivité et la réac...
Déclarations de divulgation
JB est membre du conseil d’administration de la Section de Stimulation Cérébrale (STEP) de l’Association Française de Psychiatrie Biologique et de Neuropsychopharmacologie (AFPBN), de la Société Européenne de Stimulation Cérébrale (ESBS), et rapporte des subventions de recherche académique dans le domaine de la stimulation cérébrale des IRSC (Canada), de l’ANR et du PHRC (France). D’autres auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par la Fondation de France, Subvention N° : 00123049/WB-2021-35902 (subvention reçue par J.B. et N.M.). Les auteurs remercient la Fondation Pierre Deniker pour son soutien (subvention reçue par C.N.) et le personnel de la plateforme Neuro-Immersion pour leur aide précieuse dans la conception du dispositif.
matériels
| Name | Company | Catalog Number | Comments |
| Acquisition board (8 channels) | National Instrument | NI USB-6009 | |
| Air compressor | Jun-Air | Model6-15 | |
| Alcohol prep pads | Any | ||
| Butyric acid | Sigma-Aldrich | B103500 | Negative odorant |
| Desktop computer | Dell | Latitude 3520 | |
| EMG system | Biopac System | MP150 | |
| Isoamyl acetate | Sigma-Aldrich | W205508 | Positive odorant |
| Nasal cannula | SEBAC France | O1320 | |
| Programmable pulse generator | A.M.P.I | Master-8 | |
| Surface electrodes | Kendall Medi-trace | FS327 | |
| TMS coil (X2) | MagStim | D40 Alpha B.I. coil | |
| TMS machine | MagStim | Bistim2 | |
| Tube 6 mm x 20 m | Radiospare | 686-2671 | Pneumatic connection |
| USB-RS232 | Radiospare | 687-7806 | |
| U-shaped tubes | VS technologies | VS110115 |
Références
- Iravani, B., Schaefer, M., Wilson, D. A., Arshamian, A., Lundström, J. N. The human olfactory bulb processes odor valence representation and cues motor avoidance behavior. Proceedings of the National Academy of Sciences. 118 (42), e2101209118 (2021).
- Chalençon, L., Thevenet, M., Noury, N., Bensafi, M., Mandairon, N. Identification of new behavioral parameters to assess odorant hedonic value in humans: A naturalistic approach. Journal of Neuroscience Methods. 366, 109422 (2022).
- Infortuna, C., et al. Motor cortex response to pleasant odor perception and imagery: The differential role of personality dimensions and imagery ability. Frontiers in Human Neuroscience. 16, 943469 (2022).
- Ozaki, I., Kurata, K. The effects of voluntary control of respiration on the excitability of the primary motor hand area, evaluated by end-tidal CO2 monitoring. Clinical Neurophysiology. 126 (11), 2162-2169 (2015).
- Boroojerdi, B., Battaglia, F., Muellbacher, W., Cohen, L. G. Voluntary teeth clenching facilitates human motor system excitability. Clinical Neurophysiology. 111 (6), 988-993 (2000).
- Rossi, S., et al. Distinct olfactory cross-modal effects on the human motor system. PLOS One. 3 (2), e1702 (2008).
- Neige, C., Rannaud Monany, D., Lebon, F. Exploring cortico-cortical interactions during action preparation by means of dual-coil transcranial magnetic stimulation: A systematic review. Neuroscience and Biobehavioral Reviews. 128 (October 2020), 678-692 (2020).
- Koch, G. Cortico-cortical connectivity: the road from basic neurophysiological interactions to therapeutic applications. Experimental Brain Research. 238 (7-8), 1677-1684 (2020).
- Derosiere, G., Vassiliadis, P., Duque, J. Advanced TMS approaches to probe corticospinal excitability during action preparation. NeuroImage. 213 (November 2019), 116746 (2020).
- Goldenkoff, E. R., Mashni, A., Michon, K. J., Lavis, H., Vesia, M. Measuring and manipulating functionally specific neural pathways in the human motor system with transcranial magnetic stimulation. Journal of Visualized Experiments JoVE. 156, 60706 (2020).
- Malderen, S. V., Hehl, M., Verstraelen, S., Swinnen, S. P., Cuypers, K. Dual-site TMS as a tool to probe effective interactions within the motor network: a review. Reviews in the Neurosciences. 34 (2), 129-221 (2023).
- Neige, C., et al. Connecting the dots: Harnessing dual-site transcranial magnetic stimulation to assess the causal influence of medial frontal areas on the motor cortex. Cerebral Cortex. , bhad370 (2023).
- Ferbert, A., Priori, A., Rothwell, J. C., Day, B. L., Colebatch, J. G., Marsden, C. D. Interhemispheric inhibition of the human motor cortex. The Journal of physiology. 453, 525-546 (1992).
- Rothwell, J. C. Using transcranial magnetic stimulation methods to probe connectivity between motor areas of the brain. Human Movement Science. 30 (5), 906-915 (2011).
- Carlson, H., Leitão, J., Delplanque, S., Cayeux, I., Sander, D., Vuilleumier, P. Sustained effects of pleasant and unpleasant smells on resting state brain activity. Cortex. 132, 386-403 (2020).
- Farruggia, M. C., Pellegrino, R., Scheinost, D. Functional connectivity of the chemosenses: A review. Frontiers in Systems Neuroscience. 16, 865929 (2022).
- Hasan, A., Galea, J. M., Casula, E. P., Falkai, P., Bestmann, S., Rothwell, J. C. Muscle and timing-specific functional connectivity between the dorsolateral prefrontal cortex and the primary motor cortex. Journal of Cognitive Neuroscience. 25 (4), 558-570 (2013).
- Brown, M. J. N., Goldenkoff, E. R., Chen, R., Gunraj, C., Vesia, M. Using dual-site transcranial magnetic stimulation to probe connectivity between the dorsolateral prefrontal cortex and ipsilateral primary motor cortex in humans. Brain Sciences. 9 (8), 177 (2019).
- Xia, X., et al. Connectivity from ipsilateral and contralateral dorsolateral prefrontal cortex to the active primary motor cortex during approaching-avoiding behavior. Cortex. 157, 155-166 (2022).
- Wang, Y., Cao, N., Lin, Y., Chen, R., Zhang, J. Hemispheric differences in functional interactions between the dorsal lateral prefrontal cortex and ipsilateral motor cortex. Frontiers in Human Neuroscience. 14, 1-6 (2020).
- Gabbott, P. L. A., Warner, T. A., Jays, P. R. L., Salway, P., Busby, S. J. Prefrontal cortex in the rat: Projections to subcortical autonomic, motor, and limbic centers. Journal of Comparative Neurology. 492 (2), 145-177 (2005).
- Yeterian, E. H., Pandya, D. N., Tomaiuolo, F., Petrides, M. The cortical connectivity of the prefrontal cortex in the monkey brain. Cortex. 48 (1), 58-81 (2012).
- Rossi, S., et al. Safety and recommendations for TMS use in healthy subjects and patient populations, with updates on training, ethical and regulatory issues: Expert guidelines. Clinical Neurophysiology. 132 (1), 269-306 (2021).
- Joussain, P., et al. Application of the European Test of Olfactory Capabilities in patients with olfactory impairment. European Archives of Oto-Rhino-Laryngology. 273 (2), 381-390 (2016).
- Oldfield, R. C. The assessment and analysis of handedness: The Edinburgh inventory. Neuropsychologia. 9 (1), 97-113 (1971).
- Daligadu, J., Haavik, H., Yielder, P. C., Baarbe, J., Murphy, B. Alterations in cortical and cerebellar motor processing in subclinical neck pain patients following spinal manipulation. Journal of Manipulative and Physiological Therapeutics. 36 (8), 527-537 (2013).
- Andersen, K. W., Siebner, H. R. Mapping dexterity and handedness: recent insights and future challenges. Current Opinion in Behavioral Sciences. 20, 123-129 (2018).
- Fried, P. J., et al. Training in the practice of noninvasive brain stimulation: Recommendations from an IFCN committee. Clinical Neurophysiology. 132 (3), 819-837 (2021).
- Mills, K. R., Boniface, S. J., Schubert, M. Magnetic brain stimulation with a double coil: the importance of coil orientation. Electroencephalography and Clinical Neurophysiology. 85 (1), 17-21 (1992).
- Rossini, P. M., et al. Non-invasive electrical and magnetic stimulation of the brain, spinal cord, roots and peripheral nerves: Basic principles and procedures for routine clinical and research application. An updated report from an I.F.C.N. Committee. Clinical Neurophysiology. 126 (6), 1071-1107 (2015).
- Awiszus, F. TMS and threshold hunting. Supplements to Clinical Neurophysiology. 56, 13-23 (2003).
- Awiszus, F. Using relative frequency estimation of transcranial magnetic stimulation motor threshold does not allow to draw any conclusions about true threshold. Clinical Neurophysiology. 125 (6), 1285-1286 (2014).
- Ah Sen, C. B., Fassett, H. J., El-Sayes, J., Turco, C. V., Hameer, M. M., Nelson, A. J. Active and resting motor threshold are efficiently obtained with adaptive threshold hunting. PLoS One. 12 (10), 1-9 (2017).
- Neige, C., Rannaud Monany, D., Stinear, C. M., Byblow, W. D., Papaxanthis, C., Lebon, F. Unravelling the modulation of intracortical inhibition during motor imagery: An adaptive threshold-hunting study. Neuroscience. 434, 102-110 (2020).
- Burke, D., Pierrot-Deseilligny, E. Caveats when studying motor cortex excitability and the cortical control of movement using transcranial magnetic stimulation. Clinical Neurophysiology. 121 (2), 121-123 (2010).
- Mir-Moghtadaei, A., et al. Updated scalp heuristics for localizing the dorsolateral prefrontal cortex based on convergent evidence of lesion and brain stimulation studies in depression. Brain Stimulation. 15 (2), 291-295 (2022).
- Siddiqi, S. H., et al. Brain stimulation and brain lesions converge on common causal circuits in neuropsychiatric disease. Nature Human Behaviour. 5 (12), 1707-1716 (2021).
- Caulfield, K. A., Fleischmann, H. H., Cox, C. E., Wolf, J. P., George, M. S., McTeague, L. M. Neuronavigation maximizes accuracy and precision in TMS positioning: Evidence from 11,230 distance, angle, and electric field modeling measurements. Brain Stimulation. 15 (5), 1192-1205 (2022).
- Cao, N., et al. Plasticity changes in dorsolateral prefrontal cortex associated with procedural sequence learning are hemisphere-specific. NeuroImage. 259, 119406 (2022).
- Brown, M. J. N., et al. Somatosensory-motor cortex interactions measured using dual-site transcranial magnetic stimulation. Brain Stimulation. 12 (5), 1229-1243 (2019).
- Fiori, F., Chiappini, E., Candidi, M., Romei, V., Borgomaneri, S., Avenanti, A. Long-latency interhemispheric interactions between motor-related areas and the primary motor cortex: a dual site TMS study. Scientific reports. 7 (1), 14936 (2017).
- Fournel, A., Ferdenzi, C., Sezille, C., Rouby, C., Bensafi, M. Multidimensional representation of odors in the human olfactory cortex. Human Brain Mapping. 37 (6), 2161-2172 (2016).
- Midroit, M., et al. Neural processing of the reward value of pleasant odorants. Current Biology. 31 (8), 1592-1605.e9 (2021).
- Sezille, C., Messaoudi, B., Bertrand, A., Joussain, P., Thévenet, M., Bensafi, M. A portable experimental apparatus for human olfactory fMRI experiments. Journal of Neuroscience Methods. 218 (1), 29-38 (2013).
- Kato, M., et al. Spatiotemporal dynamics of odor representations in the human brain revealed by EEG decoding. Proceedings of the National Academy of Sciences. 119 (21), e2114966119 (2022).
- Jackson, N., Greenhouse, I. VETA: An open-source Matlab-based toolbox for the collection and analysis of electromyography combined with transcranial magnetic stimulation. Frontiers in Neuroscience. 13, 975 (2019).
- Cunningham, D., Zhang, B., Cahn, A. Transcranial magnetic stimulation (TMS) analysis toolbox: A user friendly open source software for basic and advanced analysis and data sharing of TMS related outcomes. Brain Stimulation: Basic, Translational, and Clinical Research in Neuromodulation. 14 (6), 1641-1642 (2021).
- Julkunen, P., Säisänen, L., Hukkanen, T., Danner, N., Könönen, M. Does second-scale intertrial interval affect motor evoked potentials induced by single-pulse transcranial magnetic stimulation. Brain Stimulation. 5 (4), 526-532 (2012).
- Pellicciari, M. C., Miniussi, C., Ferrari, C., Koch, G., Bortoletto, M. Ongoing cumulative effects of single tms pulses on corticospinal excitability: An intra- and inter-block investigation. Clinical Neurophysiology. 127 (1), 621-628 (2016).
- Li, S., Rymer, W. Z. Voluntary breathing influences corticospinal excitability of nonrespiratory finger muscles. Journal of Neurophysiology. 105 (2), 512-521 (2011).
- Boesveldt, S., Frasnelli, J., Gordon, A. R., Lundström, J. N. The fish is bad: Negative food odors elicit faster and more accurate reactions than other odors. Biological Psychology. 84 (2), 313-317 (2010).
- Neige, C., Mavromatis, N., Gagné, M., Bouyer, L. J., Mercier, C. Effect of movement-related pain on behaviour and corticospinal excitability changes associated with arm movement preparation. Journal of Physiology. 596 (14), 2917-2929 (2018).
- Bergmann, T. O., Hartwigsen, G. Inferring causality from noninvasive brain stimulation in cognitive neuroscience. Journal of Cognitive Neuroscience. 33 (2), 195-225 (2021).
- Kulason, S., et al. A comparative neuroimaging perspective of olfaction and higher-order olfactory processing: on health and disease. Seminars in Cell & Developmental Biology. 129, 22-30 (2022).
- Athanassi, A., Dorado Doncel, R., Bath, K. G., Mandairon, N. Relationship between depression and olfactory sensory function: a review. Chemical Senses. 46, bjab044 (2021).
- Grimm, S., et al. Imbalance between left and right dorsolateral prefrontal cortex in major depression is linked to negative emotional judgment: An fmri study in severe major depressive disorder. Biological Psychiatry. 63 (4), 369-376 (2008).
- Naudin, M., El-Hage, W., Gomes, M., Gaillard, P., Belzung, C., Atanasova, B. State and trait olfactory markers of major depression. PLOS One. 7 (10), e46938 (2012).
- Guidali, G., Roncoroni, C., Bolognini, N. Modulating frontal networks' timing-dependent-like plasticity with paired associative stimulation protocols: Recent advances and future perspectives. Frontiers in Human Neuroscience. 15, 658723 (2021).
- Hernandez-Pavon, J. C., San Agustín, A., Wang, M. C., Veniero, D., Pons, J. L. Can we manipulate brain connectivity? A systematic review of cortico-cortical paired associative stimulation effects. Clinical Neurophysiology. 154, 169-193 (2023).
- Deng, Z. -. D., Robins, P. L., Dannhauer, M., Haugen, L. M., Port, J. D., Croarkin, P. E. Optimizing TMS coil placement approaches for targeting the dorsolateral prefrontal cortex in depressed adolescents: An electric field modeling study. Biomedicines. 11 (8), 2320 (2023).
- Gomez, L. J., Dannhauer, M., Peterchev, A. V. Fast computational optimization of TMS coil placement for individualized electric field targeting. NeuroImage. 228, 117696 (2021).
- Derosiere, G., Duque, J. Tuning the corticospinal system: How distributed brain circuits shape human actions. The Neuroscientist. 26 (4), 359-379 (2020).
- Bestmann, S., Krakauer, J. W. The uses and interpretations of the motor-evoked potential for understanding behaviour. Experimental Brain Research. 233 (3), 679-689 (2015).
- Reis, J., et al. Contribution of transcranial magnetic stimulation to the understanding of cortical mechanisms involved in motor control. Journal of Physiology. 586 (2), 325-351 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon