Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kokuların Kortikospinal Uyarılabilirlik ve Etkili Bağlantı Üzerindeki Etkisini İncelemek için Nefesle Senkronize Olfaktometreyi Beyin Simülasyonu ile Birleştirmek
Bu Makalede
Özet
Bu makale, insan burun solunumuyla senkronize koku sunumu sırasında tek ve çift bobinli transkraniyal manyetik stimülasyonu (TMS) tetiklemek için nefesle senkronize bir olfaktometre kullanmayı açıklamaktadır. Bu kombinasyon, hoş ve hoş olmayan kokuların belirli bir bireyde kortikospinal uyarılabilirliği ve beyin etkili bağlantıyı nasıl etkilediğini objektif olarak araştırmamızı sağlar.
Özet
Koku stimülasyonunun, hayvanlarda ve insanlarda hoş koku verici maddelere yaklaşmak ve hoş olmayanlardan kaçınmak gibi motor davranışları ortaya çıkardığı yaygın olarak kabul edilmektedir. Son zamanlarda, elektroensefalografi ve transkraniyal manyetik stimülasyon (TMS) kullanan çalışmalar, insanlarda koku alma sistemindeki işleme ile motor korteksteki aktivite arasında güçlü bir bağlantı olduğunu göstermiştir. Koku alma ve motor sistemler arasındaki etkileşimleri daha iyi anlamak ve önceki metodolojik sınırlamaların bazılarının üstesinden gelmek için, farklı hedonik değerlere sahip koku maddelerinin rastgele sıralı sunumunu senkronize eden bir olfaktometreyi ve TMS'yi (tek ve çift bobin) nazal solunum fazları ile tetiklemeyi birleştiren yeni bir yöntem geliştirdik. Bu yöntem, hoş ve hoş olmayan koku algısı sırasında ortaya çıkabilecek kortikospinal uyarılabilirlik modülasyonlarının ve dorsolateral prefrontal korteks ile birincil motor korteks arasında etkili ipsilateral bağlantının araştırılmasına izin verir. Bu yöntemin uygulanması, belirli bir katılımcıda bir koku maddesinin hoşluk değerinin objektif olarak ayırt edilmesine izin verecek ve koku maddesinin beynin etkili bağlantısı ve uyarılabilirliği üzerindeki biyolojik etkisini gösterecektir. Ayrıca bu, koku hedonik değişiklikleri ve uyumsuz yaklaşım-kaçınma davranışları sergileyebilen nörolojik veya nöropsikiyatrik bozukluğu olan hastalarda klinik araştırmaların önünü açabilir.
Giriş
Koku stimülasyonunun otomatik reaksiyonları ve motor davranışları ortaya çıkardığı yaygın olarak kabul edilmektedir. Örneğin, insanlarda, negatif koku başlangıcından 500 ms sonra meydana gelen bir kaçınma motor tepkisinin (koku kaynağından uzaklaşma) varlığı yakın zamanda gösterilmiştir1. Chalençon ve ark. (2022), şişelerden yayılan kokuları keşfeden serbestçe hareket eden insan katılımcıları kaydederek, motor davranışların (yani, buruna yaklaşma hızı ve koku maddesini içeren şişenin geri çekilmesi) koku hedoniği2 ile yakından bağlantılı olduğunu gösterdi. Ayrıca, koku alma sistemindeki işleme ile motor korteksteki aktivite arasında yakın bir ilişki yakın zamanda insanlarda elektroensefalografi1 kullanılarak gösterilmiştir. Spesifik olarak, negatif kokuların başlamasından yaklaşık 350 ms sonra, birincil motor korteks (M1) üzerinde ve içinde eylem hazırlama süreçlerini yansıttığı bilinen spesifik bir mu ritmi senkronizasyonu gözlendi ve kısa bir süre sonra davranışsal bir geriye doğru hareket1 izledi. Koku alma ve motor sistemler arasındaki ilişki fikrini güçlendiren yakın tarihli bir başka çalışma, hoş bir koku maddesine maruz kalmanın, kokusuz bir duruma kıyasla kortikospinal uyarılabilirliği artırdığını göstermiştir3. Bu çalışmada, koku algısı sırasında elektromiyografi (EMG) ile periferik olarak kaydedilen bir hedef el kasında motor uyarılmış bir potansiyeli (MEP) uyandırmak için M1'e tek atımlı transkraniyal manyetik stimülasyon (spTMS) uygulandı. Hoş koku maddesine maruz kalma, saf bergamot esansiyel yağı ile ıslatılmış ve burnun altındaki metal bir tutucuya yerleştirilmiş kağıt şeritler tarafından pasif olarak sağlandı3. Bu bağlamda, kortikospinal uyarılabilirliğin kolaylaştırılmasının hoş koku uyarımından mı yoksa koklama ve diş sıkmagibi spesifik olmayan davranışsal etkilerden mi kaynaklandığı belirsizliğini korumaktadır 4,5. Ayrıca, hoş olmayan bir koku maddesinin TMS tarafından araştırılan M1 uyarılabilirliğini nasıl modüle ettiği hala bilinmemektedir.
Özetle, bu, önceki çalışmalarda kullanılan mevcut tekniklere göre aşağıdaki avantajları sunan bir yöntem geliştirme ihtiyacını vurgulamaktadır 3,6: (1) aynı deney aşamasında farklı koku koşullarının (hoş / hoş olmayan / kokusuz) sunumunu randomize etmek, (2) motor sistemi incelerken insan burun solunum fazlarına (inspirasyon ve ekspirasyon) göre koku verici sunumunu ve TMS zamanlamasını tam olarak senkronize etmek.
TMS ayrıca, yüksek zamansal çözünürlüğesahip çoklu kortikal alanlar ve M1 arasındaki etkili bağlantı olarak da adlandırılan kortiko-kortikal etkileşimleri araştırmak için bir araç olarak kullanılabilir 7,8,9,10,11,12. Burada, bir birinci koşullandırma stimülasyonunun (CS) bir hedef kortikal alanı aktive ettiği ve bir MEP'yi uyandırmak için başka bir bobin kullanılarak M1 üzerine ikinci bir test stimülasyonunun (TS) uygulandığı çift bölgeli bir TMS (dsTMS) paradigması kullanıyoruz. CS'nin etkisi, koşullandırılmış MEP'in genliğinin (dsTMS koşulu) koşulsuz MEP'in (spTMS koşulu) genliğine normalleştirilmesiyle değerlendirilir13. Daha sonra, negatif oran değerleri baskılayıcı kortiko-kortikal etkileşimleri gösterirken, pozitif oran değerleri, uyarılan iki alan arasındaki kolaylaştırıcı kortiko-kortikal etkileşimleri gösterir. Bu nedenle dsTMS paradigması, önceden etkinleştirilmiş alan ile M1 arasındaki etkili bağlantının doğasını (yani kolaylaştırıcı veya baskılayıcı), gücünü ve modülasyonlarını tanımlamak için eşsiz bir fırsat sağlar. Daha da önemlisi, kortiko-kortikal etkileşimler, farklı zamanlama ve zihinsel durumlarda veya görevlerde modüle edilebilen karmaşık bir kolaylaştırma ve bastırma dengesini yansıtır 7,14.
Bildiğimiz kadarıyla, nispeten yeni dsTMS paradigması, farklı hedonik değerlerle koku algısı sırasında kortiko-kortikal etkileşimleri araştırmak için hiç kullanılmamıştır. Bununla birlikte, nörogörüntüleme çalışmaları, hoş ve hoş olmayan koku maddelerine maruz kalmanın, ek motor alan, ön singulat korteks ve dorsolateral prefrontal korteks (DLPFC) dahil olmak üzere duygu, karar verme ve eylem kontrolü ile ilgili alanlarda bağlantı değişikliklerine neden olduğunu göstermiştir15,16. Gerçekten de, DLPFC, duygusal kontrole, duyusal işlemeye ve hazırlık süreçleri 17,18,19 gibi motor kontrolün daha üst düzey yönlerine aracılık eden önemli bir düğümdür. Ek olarak, hem insan hem de hayvan çalışmaları, DLPFC'nin M1 17,18,20,21,22'ye çeşitli nöronal projeksiyonlara sahip olduğuna dair kanıtlar sağlamıştır. Bağlama bağlı olarak, bu DLPFC projeksiyonları M1 aktivitesinikolaylaştırabilir veya engelleyebilir 7,19,20. Bu nedenle, DLPFC ve M1 arasındaki etkili bağlantının koku sunumu sırasında modüle edilmesi ve hoş ve hoş olmayan koku maddelerinin ayrı kortikal ağları işe alması ve DLPFC-M1 bağlantısı üzerinde farklı bir etkiye yol açması mümkün görünmektedir.
Burada, tümü insan burun solunumu ile senkronize olarak iletilen, hoş ve hoş olmayan kokuların algılanması sırasında ortaya çıkabilecek kortikospinal uyarılabilirlik ve etkili bağlantı modülasyonlarının metodolojik olarak titiz bir şekilde incelenmesi için uygun yeni bir yöntem öneriyoruz.
Protokol
Aşağıdaki bölümlerde açıklanan tüm deneysel prosedürler, Helsinki Bildirgesi'ne uygun olarak bir Etik Kurul (CPP Ile de France VII, Paris, Fransa, protokol numarası 2022-A01967-36) tarafından onaylanmıştır. Tüm katılımcılar, çalışmaya kaydolmadan önce yazılı bilgilendirilmiş onam verdiler.
1. Katılımcı alımı
- Dahil etme/hariç tutma kriterleri.
- Yetişkin (> 18 yaş) katılımcıları dahil edin. Tüm katılımcıları TMS'ye herhangi bir kontrendikasyon açısından uluslararası uzman kılavuzlarına göre tarayın23.
- İmplante edilmiş tıbbi cihazları (örneğin, koklear implant, kalp pili vb.), kişisel veya ailevi nöbet öyküsü, baş ağrısı, beyin travması ve nöroaktif ilaçları olan katılımcıları hariç tutun. Avrupa Koku Alma Yetenekleri Testi24'e göre "anosmik" olarak kabul edilen katılımcıları hariç tutun.
- El Becerisi: Edinburgh El Becerisi Envanteri anketi25 tarafından değerlendirilen sağ elini kontrol edin.
NOT. Kortikospinal uyarılabilirliği ve motor sistemde etkili bağlantıyı değerlendiren çalışmalarda sadece sağ elini kullanan katılımcıların işe alınması şiddetle tavsiye edilir26,27. - Bilgi ve bilgilendirilmiş onam: Tüm katılımcılara Etik Kurul tarafından onaylanan çalışma hedefleri, prosedürleri ve riskleri hakkında temel bilgiler verin ve onlardan yazılı bilgilendirilmiş onam imzalamalarını isteyin.
2. Deneysel prosedür
- Hasta kurulumu: Katılımcıdan iki eli rahat ve pronasyonlu olarak rahat bir sandalyeye (dişçi koltuğu tipi) oturmasını isteyin. Stimülasyon sırasında baş hareketini en aza indirmek için katılımcının başını çene desteğine yerleştirin.
- Elektromiyografi kayıtları
- Elektrot uygulamasından önce katılımcının cildini, alanları hafifçe aşındırmak için bir eksfoliyan ovma kullanarak hazırlayın ve elektrotların uygulanacağı alanları alkollü pedler kullanarak temizleyin.
- İlk dorsal interosseöz (FDI) kasın göbek tendonu montajı ile iki gümüş / gümüş klorür tek kullanımlık kayıt elektrotu uygulayın. Toprak elektrodunu ulnanın stiloid işlemine ekleyin (Şekil 1).
- Elektrotları kablolar ve veri toplama sistemi ile amplifikatöre bağlayın.
- Analogdan dijitale (AD) dönüştürme sistemi kullanarak EMG sinyalini kaydedin. 10 Hz ile 1 kHz arasında bir bant genişliği frekansı kullanarak EMG sinyallerini (kazanç = 1000) yükseltin ve filtreleyin. 2.000 Hz örnekleme hızında sayısallaştırın ve her EMG dosyasını çevrimdışı analiz için saklayın.
- Veri toplama sistemine bağlı bilgisayar ekranında görüntülenen sinyalin kalitesini kontrol edin.
- TMS bobiniM1 konumu.
- Bu bobini A stimülatörüne bağlayın (Şekil 1).
- Katılımcının kafasına sıkı oturan bir başlık yerleştirin. Standart kraniyal yer işaretlerine dayalı olarak nasion-inion, tragus-tragus ve baş çevresi ölçümleri yapmak için bir mezura kullanın. Orta sagital (nasion-inion) ve interaural (tragus-tragus) çizgilerin kesiştiği noktada kafa derisi tepe noktasını bir kalemle tanımlayın ve işaretleyin28.
- Tepe noktasından 5 cm yanal olan sol M1'in (M1 bobini) varsayılan el alanı üzerine, sap geriye doğru bakacak şekilde ilk küçük sekiz rakamlı bobini (iç çap: 40 mm) kafa derisine teğet olarak yerleştirin ve yanal olarak midsagital çizgiye 45°'lik bir açıyla arka-anterior akım akışı (monofazik akım dalga formu) elde edin. Bu oryantasyon, M129 içinde M1 içinde akan maksimum indüklenen akıma karşılık gelir.
- M1 bobininin yerleşiminin en son uluslararası tavsiyelere uygun olarak optimum olduğundan emin olun30. Maksimum stimülatör çıkışının %30'unda (%MSO) birkaç tek darbe vererek başlayın ve stimülasyonun EMG sistemi tarafından kaydedildiği ve veri toplama sistemine bağlı bilgisayar ekranında görüntülendiği gibi bir MEP ürettiğini kontrol edin.
- Görünür bir yanıt yoksa, MEP'ler gözlemlenene kadar stimülasyon yoğunluğunu (% 5 MSO artışları) kademeli olarak artırın. Ardından, birden fazla darbe vererek ilk sitenin etrafındaki dört noktayı test edin. Her site için ortalama tepeden tepeye MEP genliğini belirleyin.
- Ortalama tepeden tepeye MEP genliğinin en yüksek olduğu konumu seçin. Bu, katılımcı30 için sözde etkin nokta konumudur. Deney boyunca bobinin doğru yerleştirilmesini sağlamak için kapaktaki bobinM1 konumunu işaretleyin.
- Dinlenme motor eşiği (rMT) ve TMS şiddetleri
- Bir MEP 23,30 ortaya çıkarmak için %50 olasılık üreten TMS yoğunluğu olarak tanımlanan dinlenme motor eşiğini (rMT) belirleyin.
- Sıralı bir test stratejisi 29 kullanarak maksimum olabilirlik parametresi tahminine dayanan mevcut çevrimiçi ücretsiz yazılımı (TMS Motor Threshold Assessment Tool, MTAT2.1) kullanın. Stimülasyon dizisi her zaman %37 MSO olarak ayarlanan yoğunlukla başlar.
- Bir deneycininM1 bobinini tutmasına izin verirken, diğeri MEP genliğinin 0.05 mV'> olup olmadığını gösterir. Öngörücü algoritma daha sonra verilecek bir sonraki stimülasyon yoğunluğunu belirler ve 20 stimülasyondan sonra durdurulur, bu da önceki çalışmalaragöre rMT tahmini için yeterli doğruluğu sağlar 31-34.
- Koşullandırma ve test nabzı stimülasyonu için %MSO'yu ayarlayın. Katılımcının önceden belirlenmiş rMT değerini kullanın.
NOT: Burada, ilk koşullandırma stimülasyonu (bobinDLPFC) için yoğunluk, rMT 110'nin %19,20'una ayarlanmıştır. Test stimülasyonunun yoğunluğu (M1 bobini) rMT'nin% 120'sine ayarlandı, bu yoğunluk, tüm katılımcılarda ~ 1 mV'luk bir MEP uyandıran bir TS yoğunluğu kullanan önceki çalışmalardan biraz farklıbir yoğunluk 19,20 . Bu sabit tepeden tepeye yoğunluk, motor çıkışındaki yüksek denekler arası değişkenlik nedeniyle giriş-çıkış işe alım eğrilerinde çok farklı noktalarda meydana gelir35. Bu nedenle, stimülasyon yoğunluğu, bireyler arasında %120 RMT yoğunluğu kullanılarak optimize edilebilir.
- Bir MEP 23,30 ortaya çıkarmak için %50 olasılık üreten TMS yoğunluğu olarak tanımlanan dinlenme motor eşiğini (rMT) belirleyin.
- TMS bobiniDLPFC konumlandırma
- Bu bobini B stimülatörüne bağlayın (Şekil 1).
- İkinci küçük sekiz rakamlı bobinin (iç çap: 40 mm) DLPFC (bobinDLPFC) üzerindeki konumunu tahmin etmek için kafa derisinin sol DLPFC 36,37'ye karşılık gelen bölgesini bulmak için yakın zamanda güncellenen kafa derisi buluşsal yöntemini kullanın. Çevrimiçi Excel Elektronik Tablo Hesaplama Aracı36'yı indirin ve nasion-inion ve tragus-tragus mesafelerini ve santimetre cinsinden baş çevresini girdi olarak girin. XLA ve YLA mesafelerini doğrudan katılımcının kafasına bildirin.
- Sap aşağı doğru bakacak ve orta sagital çizgiye -45°'lik bir açıyla yanal olarak spiralDLPFC'yi varsayılan sol DLPFC konumunun üzerine kafa derisine teğet olarak yerleştirin. Deney boyunca bobinin doğru yerleştirilmesini sağlamak için bobinDLPFC yerleşimini kapakta işaretleyin.
NOT: Hem bobinM1 hem de bobinDLPFC konumları için bu kafa derisi tabanlı hedefleme yöntemi optimal değildir. Aslında, bireysel T1 anatomik manyetik rezonans görüntülemeye (MRI) dayalı olarak beynin ilgi alanlarını hedeflemek için kullanılan nöronavigasyon yönteminden daha az doğru olduğu bilinmektedir38.
- Koşullandırma ve test darbeleri arasındaki gecikme: Darbe üreteci cihazında bu gecikmeyi 10 ms'ye ayarlayın.
NOT: Burada, bu aralıkta sol DLPFC'den sol M1'e inhibitör bir etki gösteren önceki çalışmalara dayanarak gecikme 10 ms'de sabitlenmiştir19,20. 10 ms'de gözlenen bu inhibitör etki, muhtemelen bazal gangliyonların DLPFC projeksiyonları yoluyla pre-SMA'ya aktivasyonundan kaynaklanır ve böylece M139 üzerinde dolaylı bir etki uygular. Gecikme, kullanıcının ihtiyaçlarına göre kodda ayarlanabilir. Örneğin, DLPFC'yi M119'a bağlayan polisinaptik dolaylı kortiko-subkortikal-kortikal devreleri araştırmak için daha uzun bir stimülasyon aralığı (yani 25 ms) kullanılabilir. Ayrıca, 1 ms ila 150 ms arasında değişen aralıklarla çoklu kortikal alanlar arasında çift bölgeli ppTMS kullanılarak diferansiyel kolaylaştırıcı/inhibitör etkiler gösterilmiştir40,41. Bu nedenle, aralığın ayarlanabiliyor olması, gelecekteki araştırma çalışmaları için çok çeşitli olasılıkların önünü açmaktadır. - Olfaktometre ayarları
- Hoş ve hoş olmayan hedonik değerlere sahip koku vericileri seçin. İzo-yoğun algı oluşturmak için koku maddelerini mineral yağda ayrı ayrı önceden seyreltin.
NOT: Burada, koku vericilerin seçimi ve konsantrasyonu (yani, sırasıyla% 0.6 ve% 0.11 hacim / hacim konsantrasyonlarına seyreltilmiş izoamil asetat ve bütirik asit), aynı olfaktometre kurulumunu ve koku vericileri42,43 kullanan grubumuz tarafından yapılan önceki çalışmalara dayanmaktadır. Bir pilot çalışma, pozitif ve negatif kokuların yoğunluk açısından farklılık göstermediğini, ancak hedonik değerde zıt olduğunu doğrulamaktadır. Kontrol durumunda (yani koku verici yok), katılımcıya sadece hava akışı iletilir. - Koku vericileri iletmek için kodu yazın. Her deneme için, denemenin toplam süresini, verilecek koku maddesini, koku verici kontrolörünün akış hızını (dakikada mililitre cinsinden), taşıyıcı hava regülatörünün akış hızını (dakikada mililitre cinsinden) ve emme regülatörünün akış hızını belirtin.
NOT: Verilen koku maddesinin sırası pozitif, negatif ve kokusuz arasında rastgele seçilebilir. Burada, her denemenin süresi 12 saniyedir. Verilen koku sırası sözde randomize edildi. Ek olarak, bir pilot deneye dayanarak, koku kontrolörünün akış hızı 200 mL/dk, taşıyıcı hava regülatörünün akış hızı 500 mL/dk ve emme regülatörünün akış hızı 100 mL/dk olarak ayarlanmıştır. - Burun solunumunu ölçmek için nazal kanülü katılımcının burun deliklerine yakın konumlandırın. Katılımcıya burundan normal nefes almasını söyleyin.
- Taşınabilir hava kompresörünü, olfaktometre kasasını ve yazılımı içeren bilgisayarı açın. Tüm kablo bağlantılarını kontrol edin (Şekil 1).
NOT: Mevcut çalışmada kullanılan olfaktometre, önceki bir yayında44 ayrıntılı olarak açıklanmıştır, ancak burada, inspirasyon başlangıcı tespitinden sonra değişken gecikmelerle TMS tetiklemesine izin verecek şekilde değiştirilmiştir. Kısaca cihaz, 1) taşınabilir bir hava kompresöründen gelen bir hava kaynağı ve hava şartlandırma sistemi, 2) elektronik ve pnömatik cihazları içeren bir stimülasyon sistemi, 3) katılımcının burnundaki koku maddelerinin difüzyonunu sağlayan bir dağıtım sistemine bağlı ev yapımı bir karıştırma başlığı, 4) nazal kanül ile burun solunumu ölçümüne göre olfaktometreyi tetikleyen bir solunum duyu sistemi ve 5) bir yazılım olmak üzere birkaç modülden oluşmaktadır Kontrol sistemi44. - Kalibrasyon: Katılımcının solunum sinyalini kalibre etmeye ve ekspiratuar ve inspiratuar fazların algılama eşiklerini ayarlamaya izin veren kalibrasyon aşamasına (yaklaşık 20 s.) geçin. Bu yazılımda, ekspiratuar faz pozitiftir ve inspiratuar faz negatiftir.
- Koku hedonik ve yoğunluk derecelendirmeleri: İki koku maddesini rastgele bir sırayla verin ve katılımcılardan her bir koku maddesinin hedonik değerini ve yoğunluğunu görsel analog ölçeklerde 1 "hiç hoş değil" ile 9 "son derece hoş" ve 1 "hiç yoğun değil" ile "son derece yoğun" arasında derecelendirmelerini isteyin.
- Hoş ve hoş olmayan hedonik değerlere sahip koku vericileri seçin. İzo-yoğun algı oluşturmak için koku maddelerini mineral yağda ayrı ayrı önceden seyreltin.
- Olfaktometre ve TMS'yi birleştirme: İnspirasyon fazının algılanması ile TMS'yi 600 ms'de gönderme tetikleyicisi arasındaki gecikmeyi ayarlayın.
NOT: Gecikmenin ayarı önemlidir ve literatüre ve kullanıcının ihtiyaçlarına göre belirlenmelidir. Bu protokolde, gecikme 600 ms olarak ayarlanmıştır ve bu, kokuların maksimum bilinçli algısal temsiliolarak gösterilmiştir 45. Tek darbeli TMS koşulu için, bu tetikleyici hemen A stimülatörünü etkinleştirir ve koşulsuz bir MEP'yi uyandırmak için sol M1'e yerleştirilmiş bobin tarafından bir darbe verilir. Çift bobinli TMS koşulu için, bu tetikleme iki farklı cihaza gönderilir (bir T-bağlantısıyla bağlanan iki koaksiyel kablo aracılığıyla): ilki hemen B stimülatörünü etkinleştirir ve sol DLPFC'ye yerleştirilmiş bobin tarafından bir koşullandırma darbesi verilir; ikincisi, A stimülatörünü etkinleştirmeden önce sabit bir gecikmeyi indüklemeyi mümkün kılan bir puls üreteci tarafından alınır, böylece koşullu bir MEP'yi uyandırmak için sol M1'e yerleştirilmiş bobin aracılığıyla bir test stimülasyonu sağlar (Şekil 1).
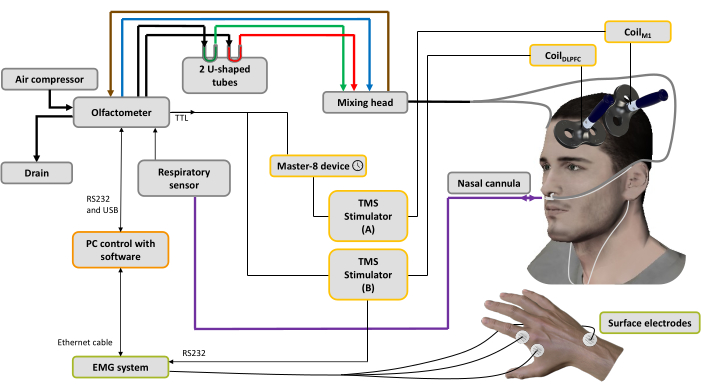
Şekil 1: Deney düzeneği. Kalın çizgiler pnömatik bağlantıları temsil eder. Farklı hava akışları oluşturmak için olfaktometreye bir hava kompresörü bağlanır. Bir regülatör basıncı kontrol eder ve giriş hava akışı 3 kanala yönlendirilir (3 kütle regülatörü aracılığıyla): biri hava konveyörü için (mavi çizgi), biri aspirasyon sistemi için (kahverengi çizgi) stimülasyon süresini temizlemek ve kontrol etmeye yardımcı olmak için ve sonuncusu koku vericileriçin 44. İki U şeklindeki tüp, doymuş buhar durumunda basınç altında şartlandırıldıkları koku vericileri (yeşil: hoş; kırmızı: hoş olmayan) içerir ve zaman içinde sabit yoğunlukta kokulu bir hava akışı sağlar. Karıştırma kafası, temiz ve kokulu hava akımlarını karıştırmak için kullanılır. Hava akışı (kokulu veya saf), burun solunumunu (mor çizgi) kaydetmek için de kullanılan bir burun kanülüne bağlı iki tüp (gri çizgiler) aracılığıyla burun deliklerine iletilir. Solunum sinyaline bağlı olarak, inhalasyon fazı tespit edilir edilmez, spTMS durumu için bir gecikme ayarlamak için kullanılan bir puls üreteci cihazına (burada: 10 ms), ardından TMS stimülatörü B kapalıyken solM1 el kası temsili üzerine uygulanan Bobin M1'e bağlı bir TMS stimülatörü A'ya bir tetikleyici gönderilir. dsTMS koşulu için, sol DLPFC üzerine uygulanan BobinDLPFC'ye bağlı TMS stimülatörü B'ye hemen bir tetikleyici gönderilir ve BobinM1'e bağlı TMS stimülatörü A'yı tetiklemeden önce bir gecikme (burada: 10 ms) ayarlamak için puls üreteci cihazı kullanılır. EMG sistemi tarafından elde edilen solunum sinyali ve MEP genliği, bir PC'ye yüklenen yazılım tarafından kaydedilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. Ölçümler
- Rastgele bir sırada meydana gelen hoş ve hoş olmayan kokular ve kokusuzluklar ile spTMS ve dsTMS'nin tüm kombinasyonlarını sunmak için olfaktometre yazılımında (bkz. adım 2.7.2) özel yapım kodlama komut dosyasını çalıştırın.
NOT: Burada her koşul için 20 deneme kaydedildi (toplam 120 deneme). Deney, her biri 20 denemeden oluşan 6 bloğa bölündü. Her koşul için deneme sayısı kullanıcının ihtiyacına göre değiştirilebilir.
4. Veri analizleri
- Her katılımcı, koşul ve deneme için tepeden tepeye MEP genliğini çıkarın. Bu, çevrimiçi olarak sunulan açık kaynaklı Araç Kutularından biri kullanılarak yapılabilir46,47.
- spTMS denemelerinde test stimülasyonu tarafından ortaya çıkarılan MEP'lere göre dsTMS denemelerinde test stimülasyonu tarafından ortaya çıkarılan MEP'leri ifade eden bir MEP oranı hesaplayarak verileri normalleştirin12. Bunu her katılımcı ve her koku durumu için ayrı ayrı yapın (yani koku yok, pozitif koku ve negatif koku). Bu prosedürden sonra sonuçları şu şekilde yorumlayın: 1'in üzerindeki MEP oranları, DLPFC'nin M1 üzerindeki kolaylaştırıcı etkisini gösterirken, 1'in altındaki MEP oranları, DLPFC'nin M1 üzerindeki inhibitör etkisini gösterir.
Sonuçlar
Burada sunulan temsili veriler, ne bekleyebileceğimize dair bir ön fikir sağlamak için yukarıdaki adım adım protokolü tamamladıktan sonra katılımcılardan gelen kayıtları yansıtmaktadır.
Şekil 2, temsili bir katılımcının olfaktometre yazılımıyla kaydedilen solunum sinyallerinin bir örneğini göstermektedir. Ekspiratuar ve inspiratuar fazlar, eşikler aşıldığında iyi tespit edilir. Koku verici, son kullanma fazı eşiğinden hemen sonr...
Tartışmalar
Yukarıdaki protokol, koku vericilerin hedonik değerine bağlı olarak kortikospinal uyarılabilirlik ve etkili bağlantıdaki değişiklikleri araştırmak için nefesle senkronize olfaktometrenin kullanımını tek ve çift bobinli TMS ile birleştiren yeni bir yöntemi açıklamaktadır. Bu kurulum, belirli bir katılımcıda bir koku maddesinin hoşluk değerini objektif olarak ayırt etmeye izin verecek ve koku maddesinin beyin etkili bağlantı ve reaktivite üzerindeki biyolojik etkisini gösterecektir. Bu protok...
Açıklamalar
JB, Fransız Biyolojik Psikiyatri ve Nöropsikofarmakoloji Derneği'nin (AFPBN) Beyin Stimülasyon Bölümü'nün (STEP) ve Avrupa Beyin Stimülasyonu Derneği'nin (ESBS) yönetim kurulu üyesidir ve CIHR (Kanada), ANR ve PHRC'den (Fransa) beyin stimülasyonu alanında akademik araştırma hibeleri bildirmektedir. Diğer yazarların ifşa edecek hiçbir şeyi yoktur.
Teşekkürler
Bu çalışma, Fondation de France, Grant N°: 00123049/WB-2021-35902 (J.B. ve N.M. tarafından alınan bir hibe) tarafından desteklenmiştir. Yazarlar, desteği için Fondation Pierre Deniker'e (CN tarafından alınan hibe) ve kurulumun tasarlanmasındaki değerli yardımları için Neuro-Immersion platformunun personeline teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Acquisition board (8 channels) | National Instrument | NI USB-6009 | |
| Air compressor | Jun-Air | Model6-15 | |
| Alcohol prep pads | Any | ||
| Butyric acid | Sigma-Aldrich | B103500 | Negative odorant |
| Desktop computer | Dell | Latitude 3520 | |
| EMG system | Biopac System | MP150 | |
| Isoamyl acetate | Sigma-Aldrich | W205508 | Positive odorant |
| Nasal cannula | SEBAC France | O1320 | |
| Programmable pulse generator | A.M.P.I | Master-8 | |
| Surface electrodes | Kendall Medi-trace | FS327 | |
| TMS coil (X2) | MagStim | D40 Alpha B.I. coil | |
| TMS machine | MagStim | Bistim2 | |
| Tube 6 mm x 20 m | Radiospare | 686-2671 | Pneumatic connection |
| USB-RS232 | Radiospare | 687-7806 | |
| U-shaped tubes | VS technologies | VS110115 |
Referanslar
- Iravani, B., Schaefer, M., Wilson, D. A., Arshamian, A., Lundström, J. N. The human olfactory bulb processes odor valence representation and cues motor avoidance behavior. Proceedings of the National Academy of Sciences. 118 (42), e2101209118 (2021).
- Chalençon, L., Thevenet, M., Noury, N., Bensafi, M., Mandairon, N. Identification of new behavioral parameters to assess odorant hedonic value in humans: A naturalistic approach. Journal of Neuroscience Methods. 366, 109422 (2022).
- Infortuna, C., et al. Motor cortex response to pleasant odor perception and imagery: The differential role of personality dimensions and imagery ability. Frontiers in Human Neuroscience. 16, 943469 (2022).
- Ozaki, I., Kurata, K. The effects of voluntary control of respiration on the excitability of the primary motor hand area, evaluated by end-tidal CO2 monitoring. Clinical Neurophysiology. 126 (11), 2162-2169 (2015).
- Boroojerdi, B., Battaglia, F., Muellbacher, W., Cohen, L. G. Voluntary teeth clenching facilitates human motor system excitability. Clinical Neurophysiology. 111 (6), 988-993 (2000).
- Rossi, S., et al. Distinct olfactory cross-modal effects on the human motor system. PLOS One. 3 (2), e1702 (2008).
- Neige, C., Rannaud Monany, D., Lebon, F. Exploring cortico-cortical interactions during action preparation by means of dual-coil transcranial magnetic stimulation: A systematic review. Neuroscience and Biobehavioral Reviews. 128 (October 2020), 678-692 (2020).
- Koch, G. Cortico-cortical connectivity: the road from basic neurophysiological interactions to therapeutic applications. Experimental Brain Research. 238 (7-8), 1677-1684 (2020).
- Derosiere, G., Vassiliadis, P., Duque, J. Advanced TMS approaches to probe corticospinal excitability during action preparation. NeuroImage. 213 (November 2019), 116746 (2020).
- Goldenkoff, E. R., Mashni, A., Michon, K. J., Lavis, H., Vesia, M. Measuring and manipulating functionally specific neural pathways in the human motor system with transcranial magnetic stimulation. Journal of Visualized Experiments JoVE. 156, 60706 (2020).
- Malderen, S. V., Hehl, M., Verstraelen, S., Swinnen, S. P., Cuypers, K. Dual-site TMS as a tool to probe effective interactions within the motor network: a review. Reviews in the Neurosciences. 34 (2), 129-221 (2023).
- Neige, C., et al. Connecting the dots: Harnessing dual-site transcranial magnetic stimulation to assess the causal influence of medial frontal areas on the motor cortex. Cerebral Cortex. , bhad370 (2023).
- Ferbert, A., Priori, A., Rothwell, J. C., Day, B. L., Colebatch, J. G., Marsden, C. D. Interhemispheric inhibition of the human motor cortex. The Journal of physiology. 453, 525-546 (1992).
- Rothwell, J. C. Using transcranial magnetic stimulation methods to probe connectivity between motor areas of the brain. Human Movement Science. 30 (5), 906-915 (2011).
- Carlson, H., Leitão, J., Delplanque, S., Cayeux, I., Sander, D., Vuilleumier, P. Sustained effects of pleasant and unpleasant smells on resting state brain activity. Cortex. 132, 386-403 (2020).
- Farruggia, M. C., Pellegrino, R., Scheinost, D. Functional connectivity of the chemosenses: A review. Frontiers in Systems Neuroscience. 16, 865929 (2022).
- Hasan, A., Galea, J. M., Casula, E. P., Falkai, P., Bestmann, S., Rothwell, J. C. Muscle and timing-specific functional connectivity between the dorsolateral prefrontal cortex and the primary motor cortex. Journal of Cognitive Neuroscience. 25 (4), 558-570 (2013).
- Brown, M. J. N., Goldenkoff, E. R., Chen, R., Gunraj, C., Vesia, M. Using dual-site transcranial magnetic stimulation to probe connectivity between the dorsolateral prefrontal cortex and ipsilateral primary motor cortex in humans. Brain Sciences. 9 (8), 177 (2019).
- Xia, X., et al. Connectivity from ipsilateral and contralateral dorsolateral prefrontal cortex to the active primary motor cortex during approaching-avoiding behavior. Cortex. 157, 155-166 (2022).
- Wang, Y., Cao, N., Lin, Y., Chen, R., Zhang, J. Hemispheric differences in functional interactions between the dorsal lateral prefrontal cortex and ipsilateral motor cortex. Frontiers in Human Neuroscience. 14, 1-6 (2020).
- Gabbott, P. L. A., Warner, T. A., Jays, P. R. L., Salway, P., Busby, S. J. Prefrontal cortex in the rat: Projections to subcortical autonomic, motor, and limbic centers. Journal of Comparative Neurology. 492 (2), 145-177 (2005).
- Yeterian, E. H., Pandya, D. N., Tomaiuolo, F., Petrides, M. The cortical connectivity of the prefrontal cortex in the monkey brain. Cortex. 48 (1), 58-81 (2012).
- Rossi, S., et al. Safety and recommendations for TMS use in healthy subjects and patient populations, with updates on training, ethical and regulatory issues: Expert guidelines. Clinical Neurophysiology. 132 (1), 269-306 (2021).
- Joussain, P., et al. Application of the European Test of Olfactory Capabilities in patients with olfactory impairment. European Archives of Oto-Rhino-Laryngology. 273 (2), 381-390 (2016).
- Oldfield, R. C. The assessment and analysis of handedness: The Edinburgh inventory. Neuropsychologia. 9 (1), 97-113 (1971).
- Daligadu, J., Haavik, H., Yielder, P. C., Baarbe, J., Murphy, B. Alterations in cortical and cerebellar motor processing in subclinical neck pain patients following spinal manipulation. Journal of Manipulative and Physiological Therapeutics. 36 (8), 527-537 (2013).
- Andersen, K. W., Siebner, H. R. Mapping dexterity and handedness: recent insights and future challenges. Current Opinion in Behavioral Sciences. 20, 123-129 (2018).
- Fried, P. J., et al. Training in the practice of noninvasive brain stimulation: Recommendations from an IFCN committee. Clinical Neurophysiology. 132 (3), 819-837 (2021).
- Mills, K. R., Boniface, S. J., Schubert, M. Magnetic brain stimulation with a double coil: the importance of coil orientation. Electroencephalography and Clinical Neurophysiology. 85 (1), 17-21 (1992).
- Rossini, P. M., et al. Non-invasive electrical and magnetic stimulation of the brain, spinal cord, roots and peripheral nerves: Basic principles and procedures for routine clinical and research application. An updated report from an I.F.C.N. Committee. Clinical Neurophysiology. 126 (6), 1071-1107 (2015).
- Awiszus, F. TMS and threshold hunting. Supplements to Clinical Neurophysiology. 56, 13-23 (2003).
- Awiszus, F. Using relative frequency estimation of transcranial magnetic stimulation motor threshold does not allow to draw any conclusions about true threshold. Clinical Neurophysiology. 125 (6), 1285-1286 (2014).
- Ah Sen, C. B., Fassett, H. J., El-Sayes, J., Turco, C. V., Hameer, M. M., Nelson, A. J. Active and resting motor threshold are efficiently obtained with adaptive threshold hunting. PLoS One. 12 (10), 1-9 (2017).
- Neige, C., Rannaud Monany, D., Stinear, C. M., Byblow, W. D., Papaxanthis, C., Lebon, F. Unravelling the modulation of intracortical inhibition during motor imagery: An adaptive threshold-hunting study. Neuroscience. 434, 102-110 (2020).
- Burke, D., Pierrot-Deseilligny, E. Caveats when studying motor cortex excitability and the cortical control of movement using transcranial magnetic stimulation. Clinical Neurophysiology. 121 (2), 121-123 (2010).
- Mir-Moghtadaei, A., et al. Updated scalp heuristics for localizing the dorsolateral prefrontal cortex based on convergent evidence of lesion and brain stimulation studies in depression. Brain Stimulation. 15 (2), 291-295 (2022).
- Siddiqi, S. H., et al. Brain stimulation and brain lesions converge on common causal circuits in neuropsychiatric disease. Nature Human Behaviour. 5 (12), 1707-1716 (2021).
- Caulfield, K. A., Fleischmann, H. H., Cox, C. E., Wolf, J. P., George, M. S., McTeague, L. M. Neuronavigation maximizes accuracy and precision in TMS positioning: Evidence from 11,230 distance, angle, and electric field modeling measurements. Brain Stimulation. 15 (5), 1192-1205 (2022).
- Cao, N., et al. Plasticity changes in dorsolateral prefrontal cortex associated with procedural sequence learning are hemisphere-specific. NeuroImage. 259, 119406 (2022).
- Brown, M. J. N., et al. Somatosensory-motor cortex interactions measured using dual-site transcranial magnetic stimulation. Brain Stimulation. 12 (5), 1229-1243 (2019).
- Fiori, F., Chiappini, E., Candidi, M., Romei, V., Borgomaneri, S., Avenanti, A. Long-latency interhemispheric interactions between motor-related areas and the primary motor cortex: a dual site TMS study. Scientific reports. 7 (1), 14936 (2017).
- Fournel, A., Ferdenzi, C., Sezille, C., Rouby, C., Bensafi, M. Multidimensional representation of odors in the human olfactory cortex. Human Brain Mapping. 37 (6), 2161-2172 (2016).
- Midroit, M., et al. Neural processing of the reward value of pleasant odorants. Current Biology. 31 (8), 1592-1605.e9 (2021).
- Sezille, C., Messaoudi, B., Bertrand, A., Joussain, P., Thévenet, M., Bensafi, M. A portable experimental apparatus for human olfactory fMRI experiments. Journal of Neuroscience Methods. 218 (1), 29-38 (2013).
- Kato, M., et al. Spatiotemporal dynamics of odor representations in the human brain revealed by EEG decoding. Proceedings of the National Academy of Sciences. 119 (21), e2114966119 (2022).
- Jackson, N., Greenhouse, I. VETA: An open-source Matlab-based toolbox for the collection and analysis of electromyography combined with transcranial magnetic stimulation. Frontiers in Neuroscience. 13, 975 (2019).
- Cunningham, D., Zhang, B., Cahn, A. Transcranial magnetic stimulation (TMS) analysis toolbox: A user friendly open source software for basic and advanced analysis and data sharing of TMS related outcomes. Brain Stimulation: Basic, Translational, and Clinical Research in Neuromodulation. 14 (6), 1641-1642 (2021).
- Julkunen, P., Säisänen, L., Hukkanen, T., Danner, N., Könönen, M. Does second-scale intertrial interval affect motor evoked potentials induced by single-pulse transcranial magnetic stimulation. Brain Stimulation. 5 (4), 526-532 (2012).
- Pellicciari, M. C., Miniussi, C., Ferrari, C., Koch, G., Bortoletto, M. Ongoing cumulative effects of single tms pulses on corticospinal excitability: An intra- and inter-block investigation. Clinical Neurophysiology. 127 (1), 621-628 (2016).
- Li, S., Rymer, W. Z. Voluntary breathing influences corticospinal excitability of nonrespiratory finger muscles. Journal of Neurophysiology. 105 (2), 512-521 (2011).
- Boesveldt, S., Frasnelli, J., Gordon, A. R., Lundström, J. N. The fish is bad: Negative food odors elicit faster and more accurate reactions than other odors. Biological Psychology. 84 (2), 313-317 (2010).
- Neige, C., Mavromatis, N., Gagné, M., Bouyer, L. J., Mercier, C. Effect of movement-related pain on behaviour and corticospinal excitability changes associated with arm movement preparation. Journal of Physiology. 596 (14), 2917-2929 (2018).
- Bergmann, T. O., Hartwigsen, G. Inferring causality from noninvasive brain stimulation in cognitive neuroscience. Journal of Cognitive Neuroscience. 33 (2), 195-225 (2021).
- Kulason, S., et al. A comparative neuroimaging perspective of olfaction and higher-order olfactory processing: on health and disease. Seminars in Cell & Developmental Biology. 129, 22-30 (2022).
- Athanassi, A., Dorado Doncel, R., Bath, K. G., Mandairon, N. Relationship between depression and olfactory sensory function: a review. Chemical Senses. 46, bjab044 (2021).
- Grimm, S., et al. Imbalance between left and right dorsolateral prefrontal cortex in major depression is linked to negative emotional judgment: An fmri study in severe major depressive disorder. Biological Psychiatry. 63 (4), 369-376 (2008).
- Naudin, M., El-Hage, W., Gomes, M., Gaillard, P., Belzung, C., Atanasova, B. State and trait olfactory markers of major depression. PLOS One. 7 (10), e46938 (2012).
- Guidali, G., Roncoroni, C., Bolognini, N. Modulating frontal networks' timing-dependent-like plasticity with paired associative stimulation protocols: Recent advances and future perspectives. Frontiers in Human Neuroscience. 15, 658723 (2021).
- Hernandez-Pavon, J. C., San Agustín, A., Wang, M. C., Veniero, D., Pons, J. L. Can we manipulate brain connectivity? A systematic review of cortico-cortical paired associative stimulation effects. Clinical Neurophysiology. 154, 169-193 (2023).
- Deng, Z. -. D., Robins, P. L., Dannhauer, M., Haugen, L. M., Port, J. D., Croarkin, P. E. Optimizing TMS coil placement approaches for targeting the dorsolateral prefrontal cortex in depressed adolescents: An electric field modeling study. Biomedicines. 11 (8), 2320 (2023).
- Gomez, L. J., Dannhauer, M., Peterchev, A. V. Fast computational optimization of TMS coil placement for individualized electric field targeting. NeuroImage. 228, 117696 (2021).
- Derosiere, G., Duque, J. Tuning the corticospinal system: How distributed brain circuits shape human actions. The Neuroscientist. 26 (4), 359-379 (2020).
- Bestmann, S., Krakauer, J. W. The uses and interpretations of the motor-evoked potential for understanding behaviour. Experimental Brain Research. 233 (3), 679-689 (2015).
- Reis, J., et al. Contribution of transcranial magnetic stimulation to the understanding of cortical mechanisms involved in motor control. Journal of Physiology. 586 (2), 325-351 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır