Method Article
تحضير نوى الدماغ ونخاع العظم عالي الجودة لمقايسات النوى المتعددة أحادية النوى
In This Article
Summary
يعتمد نجاح النسخ أحادي الخلية / أحادي النوى ومتعدد الأوميكس إلى حد كبير على جودة الخلايا / النوى. لذلك ، يجب أن يكون عزل الخلايا / النوى عن الأنسجة وتنقيتها موحدا للغاية. يصف هذا البروتوكول تحضير النوى من الدماغ ونخاع العظم لمقايسة النوى المتعددة أحادية النوى في اتجاه مجرى النهر.
Abstract
أصبح تحليل الخلية الواحدة هو النهج المفضل لكشف تعقيد العمليات البيولوجية التي تتطلب تقييم تباين الاستجابات الخلوية الفردية للعلاج أو العدوى بدقة خلية واحدة.
تم تطوير العديد من التقنيات للتنميط الجزيئي أحادي الخلية على مدى السنوات ال 10 الماضية ، وتم تسويق العديد من التقنيات المخصصة. يعد التنميط أحادي الخلية القائم على قطرات 10X Genomics تقنية واسعة الانتشار توفر كواشف جاهزة للاستخدام للتنميط أحادي الخلية النسخي ومتعدد الأوميك. تتضمن التقنية سير العمل لتسلسل الحمض النووي الريبي أحادي الخلية وأحادي النوى (scRNA-Seq و snRNA-Seq ، على التوالي) ، scATAC-Seq ، التنميط المناعي أحادي الخلية (تسلسل BCR / TCR) ، و multiome. يجمع الأخير بين النسخ (scRNA-Seq) والمعلومات اللاجينية (scATAC-Seq) القادمة من نفس الخلية.
تعد جودة (الجدوى والسلامة والنقاء) للمعلقات أحادية الخلية أو أحادية النوى المعزولة من الأنسجة وتحليلها بواسطة أي من هذه الأساليب أمرا بالغ الأهمية لتوليد بيانات عالية الجودة. لذلك ، يجب تكييف بروتوكولات تحضير العينات مع خصوصيات كل نسيج بيولوجي وضمان توليد معلقات عالية الجودة للخلايا والنوى.
توضح هذه المقالة بروتوكولين لإعداد عينات الدماغ ونخاع العظام لخط أنابيب Multiome 10X Genomics في اتجاه مجرى النهر. يتم تنفيذ البروتوكولات بشكل تدريجي وتغطي تفكك الأنسجة ، وفرز الخلايا ، وعزل النوى ، ومراقبة جودة تعليق النوى المحضر الذي يستخدم كمواد أولية لتقسيم الخلايا والترميز الشريطي وإعداد المكتبة والتسلسل. تنتج هذه البروتوكولات الموحدة مكتبات نوى عالية الجودة وبيانات قوية وموثوقة.
Introduction
لسنوات عديدة ، كانت تقنيات الخلية الواحدة هي المعيار الذهبي لتحليل العمليات البيولوجية. كانت تقتصر في البداية على التنميط الظاهري أحادي الخلية من خلال الفحص المجهري وقياس التدفق الخلوي والمقايسات المماثلة. جاء اختراق في تحليل الخلية الواحدة مع تطوير مناهج التنميط الجزيئي أحادي الخلية ، ولا سيما تسلسل الحمض النووي الريبي أحادي الخلية (scRNA-Seq) الذي مكن من توصيف النسخ الكامل للخلايا الفردية. قوي للغاية ، يولد scRNA-Seq معلومات حول حالة النسخ للخلية في حالة ونقطة زمنية معينة. ومع ذلك ، فإنه لا يوفر رؤية حول تنظيم الجينات الذي يدفع النسخ ، أو على التعديلات الجزيئية التي تحدث بمرور الوقت. للتغلب على هذا القيد ، تم استثمار العديد من الجهود في تطوير مقايسات متعددة الخلايا أحادية الخلية تمكن من تحليل عوامل وعمليات متعددة من نفس الخلية1،2،3،4. جاء أول قياس ناجح لطريقتين داخل الخلايا المفردة من خلال ربط أنماط تعبير البروتين السطحي المتعدد مع النسخ الكامل للخلايا الفردية في نهج CITE-Seq5. تجمع التطورات الحديثة بين التعبير الجيني وإمكانية الوصول إلى الكروماتين (فحص الكروماتين الذي يمكن الوصول إليه باستخدام التسلسل ، ATAC-Seq) ، وبالتالي التقاط طرائق النسخ وفوق الجينوم في نفس الخلايا في نفس الخلايا (على سبيل المثال ، sci-CAR) 6. جاءت الحلول التجارية الأولى التي سمحت بربط النسخ بالنمط الظاهري للخلية أو بالتغيرات اللاجينية لنفس الخلية من 10X Genomics.
تحتوي تجارب التنميط الجزيئي أحادي الخلية على الخطوات التالية: (1) تفكك الأنسجة أو تحضير معلقات أحادية الخلية. (2) تنقية الخلايا و / أو عزل النوى ؛ (3) التقسيم والترميز الشريطي ؛ (4) بناء المكتبة ومراقبة الجودة ؛ (5) تسلسل الجيل التالي ؛ (6) تحليل البيانات. في حين أن الخطوات (3) - (6) قد تختلف اختلافا كبيرا اعتمادا على التكنولوجيا المستخدمة ، فإن الخطوات الأولية مشتركة بشكل عام مع كل منهم. ستحدد جودة تعليق الخلية / النوى المحضرة النتيجة الإجمالية للتجربة. اعتمادا على نوع الأنسجة ، قد يكون الحصول على معلقات أحادية الخلية / نوى عالية الجودة أمرا صعبا. تتطلب خصوصيات بعض الأنسجة ، مثل القلب والعضلات والدماغ والرئة والأمعاء وغيرها ، طرقا لتعطيل الأنسجة وعزل النوى تتكيف مع كل نوع من العينات من أجل ضمان إنتاج نوى عالية الجودة للتحليل الجزيئي7،8،9،10. يمكن أن تكون طرق تعطيل الأنسجة وبروتوكولات التفكك ميكانيكية أو إنزيمية (على سبيل المثال ، مزيج من الكولاجين و DNase) ، أو مزيج من الاثنين ، ويمكن إجراؤها يدويا أو بواسطة أدوات (على سبيل المثال ، Qiagen DSC-400 ، gentleMACS).
أصبحت تقنيات الخلية الواحدة أداة مفضلة للبحوث الطبية الحيوية. في علم الأعصاب ، يتطلب تنوع الخلايا في الدماغ وتعقيد وظائفها تحليلا عالي الدقة وعالي الإنتاجية لتصور مجموعات الخلايا النادرة ولتقييم عدم تجانسها11،12،13،14. يوفر ربط الهوية الخلوية والآليات التنظيمية الجينية للخلايا الفردية نظرة ثاقبة لنمو الدماغ وعلم وظائف الأعضاء. مثال آخر هو دراسات الاستجابة المناعية في سياق الأمراض المعدية أو المناعة الذاتية أو السرطان ، والتي تعتمد بشدة على تحليلات الخلية الواحدة. يتطلب عدم تجانس المجموعات الفرعية للخلايا المناعية وتعقيد نشاطها وتفاعلاتها مع أنواع الخلايا الأخرى دقة خلية واحدة في فك رموز الآليات الكامنة وراء الاستجابة المناعية. تنشأ الخلايا المناعية من نخاع العظم ، حيث تتكون الأسلاف المكونة للدم من خلايا متمايزة تدريجيا تكتسب وتفقد علامات سطح الخلية خلال عملية تدريجية قبل الخروج من نخاع العظم إلى المنزل في المحيط. يسمح تحليل الخلية الواحدة بالتوصيف الدقيق لمراحل النمو الخلوي. يمكن تحقيق ذلك من خلال التنميط الظاهري أحادي الخلية ، والذي يتم إجراؤه تقليديا بواسطة قياس التدفق الخلوي متعدد المعلمات. ومع ذلك ، فقد ثبت أن التوقيعات النسخية أحادية الخلية تكشف عن تحديد أكثر دقة للأنواع الفرعية للخلايا السلفية نظرا لأن هذه الخلايا موزعة في مجموعات تقع في بعضها البعض وبالتالي يمكن التعرف عليها بشكل خاطئ عند استخدام نهج علامة سطح الخليةالخشنة 15. يكشف عدد متزايد من الدراسات عن التعديلات اللاجينية التي يمكن أن تكتسبها الخلايا الجذعية والسلفية المكونة للدم (HSPCs) من التعرض لعوامل مختلفة ، مما يؤدي إلى تأثير كبير على الاستجابة طويلة المدى لجهاز المناعة16،17،18،19. تتيح تقنيات multi-omics الجديدة دراسة هذه العمليات بدقة خلية واحدة.
تم وصف العديد من بروتوكولات عزل الخلايا والنوى للدماغ11،20،21،22 وعينات نخاع العظم23،24. لتقليل التحيز بسبب التباين التجريبي ، من الضروري التحقق من صحة بروتوكولات تحضير النوى المفردة المحسنة للتسلسل النسخي وفوق الجيني المشترك أحادي الخلية ، وبالتالي ضمان قابلية استنساخ المقايسات متعددة الخلايا أحادية الخلية.
هنا ، يتم وصف بروتوكولين قويين لإعداد النوى من (1) أنسجة المخ المجمدة الطازجة و (2) HSPCs لنخاع العظم الطازج لتحليل Multiome أحادي الخلية في المصب (الشكل 1).
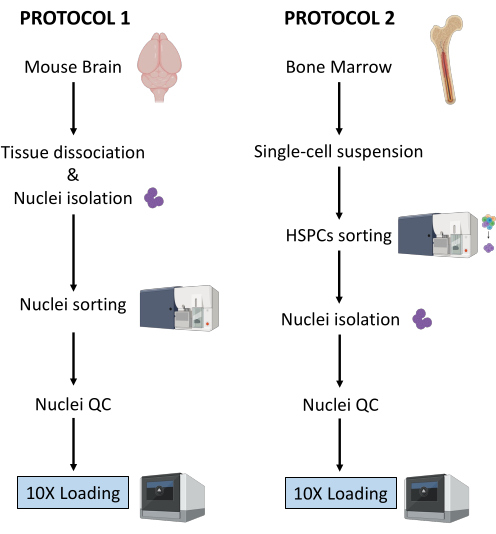
الشكل 1: تمثيل تخطيطي لبروتوكولات عزل النوى من أنسجة الدماغ ونخاع العظم المجمدة حديثا. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
Protocol
تم إجراء الإجراءات التجريبية بموجب الامتثال التنظيمي الصارم للبروتوكولات المعتمدة من قبل لجنة الأخلاقيات في التجارب على (CETEA). لعزل نوى الدماغ ، تم استخدام الفئران C57BL / 6 البالغة من العمر 3 أشهر. لعزل نخاع العظم ، تم استخدام إناث الفئران C57BL / 6J البالغة من العمر 8 أسابيع والتي تزن 18 جم.
1. تنقية النوى من دماغ الفأر
ملاحظة: ارتداء قفازات اللاتكس أو النتريل في جميع الأوقات أثناء العملية. ينصح بشدة أن يقوم شخصان بإجراء التجربة ، وأن يتم تنفيذ الخطوات من 1 إلى 3 (أي إعداد تعليق النوى المفردة) بواسطة شخص واحد ، والخطوة 4 (أي تحضير الفارز) بالتوازي من قبل شخص آخر. نظرا لأن البروتوكول حساس للغاية للوقت ، فمن الأهمية بمكان تقليل وقت معالجة العينة من خلال تجهيز الفارز بمجرد تحضير تعليق النوى المفردة.
- تحضير الكواشف والمواد
- تعقيم أدوات التشريح بعناية بواسطة الأوتوكلاف (عند 121 درجة مئوية لمدة 20 دقيقة) وغسلها بالإيثانول بنسبة 70٪ قبل الاستخدام مباشرة. قم بإعداد طبق بتري واحد لكل عينة ، مملوء ب 2-3 مل من محلول ملحي مخزن بالفوسفات من Dulbecco (DPBS) المثلج البارد.
- قم بتبريد جهاز الطرد المركزي الصغير إلى 4 درجات مئوية ، واملأ دلوا بالثلج ، وضع الخالط الزجاجي على الجليد.
- تحضير محلول تحلل النوى بإضافة ديجيتونين لتركيز نهائي قدره 0.01٪ ، 10 مل لكل عينة.
- قم بإعداد المخزن المؤقت للتلطيخ عن طريق إضافة مثبطات RNase إلى المخزن المؤقت لتلطيخ الخلايا لتركيز نهائي قدره 0.2 وحدة / ميكرولتر ، 20 مل لكل عينة.
- تحضير DPBS 0.04٪ BSA عن طريق إضافة مثبطات RNase لتركيز نهائي قدره 0.2 وحدة / ميكرولتر ، 2 مل لكل عينة.
- تحضير 1 مل من المخزن المؤقت للنوى المخففة وفقا لبروتوكول Multiome25.
- احتفظ بجميع الكواشف والعينات على الجليد.
- تشريح الأنسجة
- تضحية الفئران باستخدام البروتوكولات المعتمدة من قبل المؤسسة. في هذا البروتوكول ، تم قطع رأس الفئران بعد جرعة زائدة من الكيتامين / الزيلازين.
- قطع رأس الفأر بالمقص وإزالة الدماغ من الجمجمة كما هو موضح في Meyerhoff et al.26. انقل الدماغ على الفور إلى طبق بتري محضر باستخدام 1x DPBS المثلج البارد تحت مجهر ستيريو مضاء بالصمام الثنائي الباعث للضوء (LED).
- قطع أنسجة المخ بمشرط لفصل مناطق الدماغ ذات الأهمية (على سبيل المثال ، القشرة المخية ، الحصين ، قشرة الفص الجبهي) ونقل كل منطقة إلى طبق بتري منفصل يحتوي على 1x DPBS مثلج بارد. ابق على الجليد.
- باستخدام مشرط ، قم بفرم المنديل إلى قطع <0.5 سم لتسهيل التجانس في الخطوة التالية.
- باستخدام ماصة P1000 الدقيقة ، انقل الأنسجة المفرومة و 1x DPBS من طبق بتري إلى أنبوب 1.5 مل. تأكد من استخدام أنابيب مصنوعة من البلاستيك منخفض الارتباط بالبروتين. اسمح لقطع الأنسجة بالانفصال عن طريق الجاذبية. قم بإزالة الفائض من 1x DPBS بعناية باستخدام ماصة P1000 الدقيقة.
ملاحظة: بعد هذه الخطوة ، من الممكن تجميد الأنسجة المفرومة عن طريق نقل أنابيب البروتين منخفضة الارتباط إلى الثلج الجاف ثم تخزينها عند -80 درجة مئوية حتى الشروع في عزل النوى.
- عزل النوى
- املأ ارتداد الزجاج ب 2 مل من محلول تحلل النوى الجليدية الباردة بنسبة 0.01٪ ديجيتونين. أضف قطع المناديل في الارتداد.
ملاحظة: في حالة العمل مع الأنسجة الطازجة المجمدة ، أضف الأنسجة المجمدة المفرومة مباشرة إلى محلول تحلل النوى 0.01٪ ديجيتونين ؛ لا تدع ذوبان الأنسجة من قبل. - التجانس باستخدام خالط الأنسجة dounce الزجاج 25 مرة مع المدقة A ثم 25 مرة مع المدقة B. نقل المجانسة إلى أنبوب 15 مل.
- أضف 2 مل إضافية من محلول تحلل النوى المثلج البارد مع 0.01٪ ديجيتونين واحتضانها على الثلج لمدة 5 دقائق. نوى الطرد المركزي عند 500 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- قم بإزالة المادة الطافية باستخدام ماصة دقيقة وأضف 4 مل من محلول تحلل النوى الباردة مع 0.01٪ ديجيتونين. احتضان على الجليد لمدة 5 دقائق وتصفية من خلال مصفاة خلية 40 ميكرومتر.
- نوى الطرد المركزي عند 500 × جم لمدة 5 دقائق عند 4 درجات مئوية وإزالة المادة الطافية باستخدام ماصة ميكروية.
- أضف 4 مل من محلول التلوين لغسل النوى وأجهزة الطرد المركزي عند 500 × جم لمدة 5 دقائق عند 4 درجات مئوية. قم بإزالة المادة الطافية باستخدام ماصة دقيقة وأعد تعليق الحبيبات في 4 مل من المخزن المؤقت للتلطيخ.
- قم بالتصفية من خلال مصفاة خلية 40 ميكرومتر وأجهزة طرد مركزي عند 500 × جم لمدة 5 دقائق عند 4 درجات مئوية. أعد التعليق في 1 مل من PBS مع 0.04٪ BSA.
- عد النوى لضمان اتساق تحضير الأنسجة / النوى عبر عينات مختلفة. من المتوقع الحصول على عدد نوى مماثل من نفس مناطق الدماغ:
- أضف 10 ميكرولتر من 0.4٪ تريبان أزرق إلى أنبوب فارغ سعة 0.5 مل. أضف 10 ميكرولتر من النوى واخلط 5x عن طريق الماصة.
- عد النوى باستخدام عداد الخلايا الآلي باتباع توصيات المورد. الحفاظ على النوى على الجليد.
- تحضير النوى للفرز.
ملاحظة: تتضمن النوى المستخرجة 7-AAD ، ويستخدم هذا التلوين لتنقيتها بواسطة فارز الخلايا المنشط بالفلورة (FACS).- نقل 100 ميكرولتر من النوى إلى أنبوب FACS للتحكم غير الملوث. أضف 10 ميكرولتر من 7-AAD إلى النوى المتبقية ، واحتفظ ب 5 دقائق عند 4 درجات مئوية.
- فرز ما لا يقل عن 0.5 × 106 نوى حسب FACS للتخلص من الازدواجيات والحطام.
- املأ ارتداد الزجاج ب 2 مل من محلول تحلل النوى الجليدية الباردة بنسبة 0.01٪ ديجيتونين. أضف قطع المناديل في الارتداد.
- فرز النوى باستخدام نظام مراقبة الأصول الميدانية
ملاحظة: بينما يمكن إجراء فرز النوى على مجموعة متنوعة من أجهزة فرز الخلايا ، فإن الإجراء الخاص باستخدام أدوات BD FACSAria Fusion أو BD FACSAria III موصوف هنا. يوصى بشدة بإجراء معايرة وإعداد فارز الخلايا تحت الإشراف ، أو بواسطة مستخدم متمرس للأداة. لتقليل وقت معالجة العينة ، من الأهمية بمكان أن يكون جهاز الفرز جاهزا بمجرد تحضير تعليق النوى المفردة.- معايرة أداة FACS
- قم بتشغيل فارز الخلايا والكمبيوتر. بمجرد توصيل البرنامج بالجهاز ، قم بتشغيل إجراء بدء التشغيل السائل. حدد Cytometer > Fluidic start-up في القائمة الرئيسية واتبع الخطوات الأربع. انقر فوق تم بعد الانتهاء من كل منها.
- أدخل فوهة 70 ميكرومتر ، وقم بتشغيل التيار ، واترك التيار يستقر لمدة 15 دقيقة. اضبط السعة للحصول على تشكيل قطرة وانقر على Sweet Spot.
- ضع مرشح الكثافة المحايدة (N.D) 1.0 وافتح واجهة إعداد مقياس الخلايا وتتبعه (CST).
- مراقبة الجودة اليومية: تمييع حبات CST في وسط FACS (انظر توصيات المورد) وإجراء مراقبة CST. بمجرد الانتهاء ، استبدل N.D 1.0 ب N.D 2.0.
- قم بتخفيف Accudrops في وسط FACS (انظر توصيات المورد) وقم بإجراء تأخير السقوط كما هو موضح في الخطوات من 6 إلى 10.
- في قالب التجربة، حدد تجربة تأخير إسقاط Accudrop وافتح تخطيط الفرز للأنبوب.
- داخل نافذة الكاميرا السفلية ، انقر فوق الجهد ثم على الفلتر البصري لتمكين تطبيق الشحن على لوحات الانحراف واستخدام مرشح بصري محدد أمام الكاميرا. تأكد من أن الربع الموجود على الجانب الأيمن يشير إلى 100. إذا لزم الأمر ، اضبط برغي الليزر الأحمر لتحسين تأثير الليزر.
- اضبط معدل التدفق للوصول إلى سرعة 1000 إلى 3000 حدث في الثانية.
- انقر فوق فرز وإلغاء. تأكد من أن الربع الأيسر يساوي 100 ، والربع الأيمن هو 0. إذا كان الربع الأيسر أقل من 95 ، فقم بإجراء التأخير التلقائي.
- انقر فوق الجهد ، ثم اختبار الفرز. التحكم في جودة رواسب التدفقات الجانبية في أنابيب التجميع. إذا لزم الأمر ، اضبط موضع التدفقات الجانبية عن طريق تحريك أشرطة التمرير.
- إعداد أداة FACS لفرز النوى.
- ابدأ في الحصول على النوى غير الملوثة. تستخدم هذه لتحديد التشتتات الأمامية والجانبية ، وجهد الكاشف للمعلمة 7-ADD. قم بتعيين المعلمات بحيث تقع إشارة 7-AAD للعينة غير الملوثة داخل العقد الأول من مقياس اللوغاريتم على مخطط النقطة.
- ابدأ في الحصول على أنبوب من نوى ملطخة ب 7-AAD وحدد مجموعات النوى باستخدام استراتيجية بوابة تعتمد على (1) FSC-A / SCC-A ثم FSC-H / SSC-H للحجم والدقة ، (2) FSC-H / FSC-A للتمييز المزدوج ، و (3) SSC-A / 7-AAD للنوى الموجبة 7-AAD (انظر الشكل 2A).
- تأكد من استقرار الدفق والانحراف.
- في كاميرا الدفق الجانبي ، قم بتشغيل فرز الاختبار ، وتشغيل الجهد ، وتأكد من الفرز الدقيق للسقوط في أنبوب سعة 1.5 مل مثبت على الجانب الأيسر.
- في نافذة تخطيط الفرز ، حدد المحتوى محل الاهتمام، كما هو محدد في الخطوة 2 (أعلاه). في الأحداث المستهدفة ، حدد الحد في مستمر للحصول على ما لا يقل عن 0.5 × 106 نوى لكل عينة. ضمن الدقة ، حدد نقاء 4 اتجاهات.
- بمجرد أن تصبح جاهزا ، انقر فوق فرز و OK لبدء فرز النوى.
- معايرة أداة FACS
- مراقبة الجودة وعد النوى المنقاة
ملاحظة: يجب القيام بهذه الخطوة فقط أثناء التجربة التجريبية لتحسين خطوات تحضير العينات ، بهدف اختبار نقاء النوى المصنفة التي سيتم تحميلها على شريحة الكروم 10X. بمجرد تحسين البروتوكول بالكامل ، لا ينصح بإجراء خطوة مراقبة الجودة هذه في تجارب المتابعة لتجنب الهدر غير الضروري للنوى المجمعة التي قد تكون متاحة بأعداد منخفضة.- التحكم في النقاء عن طريق قياس التدفق الخلوي
- نقل 10 ميكرولتر من النوى التي تم فرزها إلى أنبوب FACS جديد يحتوي على 90 ميكرولتر من DPBS مع 2٪ مصل جنيني بقري معطل بالحرارة (HI-FBS).
- الحصول على بيانات ما بعد الفرز وتسجيلها للتحقق من نقاء الفرز وصلاحيته. تأكد من ظهور 98٪ على الأقل من النوى في بوابة الاهتمام ، كما هو محدد في 4.2 (انظر الشكل 2 ب).
- عد النوى المنقاة
- تقوم أجهزة الطرد المركزي بفرز النوى لمدة 5 دقائق عند 500 × جم وعند 4 درجات مئوية وإزالة المادة الطافية تماما بعناية باستخدام ماصة دقيقة. أعد التعليق في 100 ميكرولتر من المخزن المؤقت للنوى المخففة.
- أضف 10 ميكرولتر من 0.4٪ تريبان أزرق إلى أنبوب فارغ سعة 0.5 مل. أضف 10 ميكرولتر من النوى التي تم فرزها واخلط 5 مرات عن طريق الماصة.
- عد النوى باستخدام عداد الخلايا الآلي باتباع توصيات المورد. اضبط تركيز النوى على 3.5 × 106 / مل ، أي 16000 نواة لكل 5 ميكرولتر.
- مراقبة جودة النوى المنقاة عن طريق الفحص المجهري
ملاحظة: يجب القيام بهذه الخطوة فقط أثناء التجربة التجريبية لتحسين خطوات تحضير العينة لاختبار جودة النوى التي سيتم تحميلها على شريحة الكروم 10X. بمجرد تحسين البروتوكول بالكامل ، لا ينصح بإجراء خطوة مراقبة الجودة هذه في تجارب المتابعة لتجنب الهدر غير الضروري للنوى المجمعة التي قد تكون متاحة بأعداد منخفضة.- تأكد من أن شرائح المجهر وأغطية الغطاء نظيفة وخالية من الغبار. إذا لزم الأمر ، اغسل وشطف أغطية الإيثانول المطلق وجففها بمناديل خالية من النسالة.
- قم بتوزيع 25 ميكرولتر من poly-l-lysine في الآبار المنزلقة التي سيتم استخدامها واحتضانها لمدة 10 دقائق في درجة حرارة الغرفة (RT) ، محمية من الغبار.
- قم بإزالة poly-l-lysine الزائد وأضف 10 ميكرولتر من تعليق النوى المنقى. احتضان لمدة 5 دقائق في RT ، محمية من الغبار.
- أضف قطرة من وسيط التثبيت إلى كل بئر ، وتجنب الفقاعات.
- ضع غطاء فوق الآبار المصنفة. قم بتغطيتها بمناديل ورقية واضغط على غطاء الغطاء بإحكام لإزالة وسيط التثبيت الزائد. احرص على عدم تحريك غطاء الغطاء ، ولا تقم بتنظيف وسيط التثبيت الزائد.
- التقط عدة صور باستخدام مجهر مقلوب مع ضوء برايتفيلد وتكبير لا يقل عن 40x.
- التحكم في النقاء عن طريق قياس التدفق الخلوي
- أداء مقايسة multiome.
- انتقل فورا إلى Chromium Next GEM أحادي الخلية Multiome ATAC + دليل مستخدم التعبير الجيني (CG000338 - Rev F)25.
2. تنقية النوى من الخلايا الجذعية المكونة للدم والخلايا السلفية المكونة للدم في نخاع عظم الفأر (HSPCs)
ملاحظة يصف هذا البروتوكول تنقية النوى من ثلاث مجموعات فرعية من HSPCs نخاع العظم: Lineage-c-Kit + Sca-1 + الخلايا الجذعية المكونة للدم (HSC) ، و Lineage-c-Kit + Sca-1-CD34 + FcγR- السلف النخاعي المشترك (CMP) ، والنسب- c-Kit + Sca-1-CD34 + FcγR + أسلاف الخلايا المحببة وحيدات (GMP). ارتداء قفازات اللاتكس أو النتريل في جميع الأوقات أثناء العملية. هذا البروتوكول عبارة عن تكييف لبروتوكول 10X Genomics الموضح - عزل النوى لتسلسل ATAC + GEX متعدد الخلايا أحادي الخلية (CG000365 - Rev C) 27. تم إدخال تعديلات في البروتوكول الأصلي لتحقيق أقصى قدر من استعادة النوى. ينصح بشدة أن يقوم شخصان بإجراء التجربة ، للحصول على الخطوات 1. إلى 3. (أي تحضير محلول الخلية الواحدة) الذي يقوم به شخص واحد ، والخطوة 4 (أي تحضير الفرز) التي يقوم بها شخص آخر بالتوازي. نظرا لأن البروتوكول حساس للغاية للوقت ، فمن الأهمية بمكان تقليل وقت معالجة العينة من خلال تجهيز آلة الفرز بمجرد إعداد التعليق أحادي الخلية.
- تحضير الكواشف والمواد
- املأ دلوا بالثلج.
- تحضير المخزن المؤقت FACS: DPBS بمحلول HI-FBS 2٪ (حوالي 500 مل ل 6 عينات) والتصفية من خلال مرشح 0.2 ميكرومتر.
- تحضير وسط التجميع: DPBS بمحلول HI-FBS بنسبة 10٪ (500 ميكرولتر لكل عينة) ، وقم بالتصفية من خلال مرشح 0.2 ميكرومتر.
- عزل خلايا نخاع العظم
- تضحية الفئران باستخدام البروتوكولات المعتمدة من قبل المؤسسة. في هذه التجربة ، تم التضحية بالفئران عن طريق خلع عنق الرحم بعد جرعة زائدة من الكيتامين / الزيلازين.
- رش بطن الفئران والساقين الخلفيتين بنسبة 70 ٪ من الإيثانول.
- استخدم ملقط ومقص معقم لعمل شق صغير في منتصف أسفل البطن وفتح الصفاق من قاعدة الساقين الخلفيتين إلى الحجاب الحاجز (الشكل التكميلي 1).
- قم بعمل قطع إضافي لكل ساق خلفية عموديا على الصفاق المفتوح ، ثم أمسك جانبي أحد هذه الجروح الإضافية واسحبه بعيدا لتقشير الجلد من كلتا الساقين الخلفيتين بعد مفصل الكاحل لكشف عضلات كلتا الساقين الخلفيتين (الشكل التكميلي 1 أ).
- قم بتبطين المقص على طول العمود الفقري عند مفصل الورك في إحدى الساقين الخلفيتين لقطع الساق دون قطع عظم الفخذ (الشكل التكميلي 1B ، C). كرر الشيء نفسه للساق الأخرى.
- لعزل عظم الفخذ ، قم بقطع معظم الأنسجة العضلية ، ثم أمسك عظم الفخذ والساق في كل يد بأطراف الأصابع عند المفصل (الشكل التكميلي 1D ، E). قم بطي الساق برفق ضد الانحناء الطبيعي لخلع الساق من عظم الفخذ (الشكل التكميلي 1E) ثم اقطع النسيج الضام بعناية بالمقص لفصل عظم الفخذ والساق.
- استخدم المقص بحركات التواء خفيفة لخلع جزء العمود الفقري من الطرف العلوي لعظم الفخذ (الشكل التكميلي 1E).
- نظف عظم الفخذ المعزول بمناديل ورقية لإزالة العضلات المتبقية والنسيج الضام.
- حافظ على البرودة على الجليد في طبق من 12 بئرا مملوء جيدا ب 2 مل من DMEM (1x) + GlutaMAX-I.
- بمجرد جمع جميع عظم الفخذ ، تأكد من إزالة العضلات والأنسجة الليفية تماما من العظام. لا تقطع العظم مفتوحا من أجل (أ) إبقاء النخاع داخل معقم و (ب) تجنب فقدان الخلايا في البئر. استخدم الخطوات التالية لمسح الخلايا من عظمي الفخذ لفأر واحد ، مقتبس من Haag و Murthy28.
- تحضير أنبوب واحد 1.5 مل وأنبوب واحد 0.5 مل. أضف 150 ميكرولتر من المخزن المؤقت FACS إلى أنبوب 1.5 مل ، ثم قم بعمل ثقب في الجزء السفلي من الأنبوب 0.5 مل باستخدام إبرة 18 جم وقم بتركيب أنبوب 0.5 مل في أنبوب 1.5 مل.
- افتح الجزء البعيد من كل عظم الفخذ باستخدام مقص جراحي للفأر (الشكل التكميلي 1F): قفل المشاش البعيد بين الشفرات واضغط برفق أثناء قلب المقص لفصل المشاش البعيد بسلاسة دون قطع العظم بقسوة. في حالة النجاح ، يجب أن تكون 4 نتوءات مرئية في نهاية الجسم المكشوفة الآن (الشكل التكميلي 1G).
- قم بتركيب عظمي الفخذ بحيث يكون الطرف المفتوح متجها لأسفل في الأنبوب المحضر سعة 0.5 مل الموضوع داخل أنبوب سعة 1.5 مل يحتوي على مخزن مؤقت FACS (الشكل التكميلي 1H).
- ضع مصفاة خلية 70 ميكرومتر على أنبوب سعة 50 مل وبلل المصفاة مسبقا ب 2 مل من المخزن المؤقت FACS.
- لغسل نخاع العظم ، قم بطرد الأنابيب (أغطية مفتوحة) عند 12000 × جم حتى يصل جهاز الطرد المركزي إلى قيمة 12000 × جم ، ثم أوقف جهاز الطرد المركزي على الفور.
- تحقق من أن خلايا نخاع العظم محببة في أنبوب سعة 1.5 مل وأن عظم الفخذ أبيض (قبل تنظيف الخلايا ، تكون حمراء) (الشكل التكميلي 1I). تخلص من أنابيب 0.5 مل مع عظم الفخذ 2.
- تخلص من المادة الطافية سعة 150 ميكرولتر باستخدام ماصة.
- أعد تعليق الحبيبات باستخدام ماصة دقيقة في 1 مل من محلول تحلل كلوريد الأمونيوم والبوتاسيوم (ACK) لمدة 1-2 دقيقة في RT لتحلل خلايا الدم الحمراء. تجنب أوقات الحضانة الأطول لأنها قد تؤدي إلى انخفاض صلاحية الخلايا النواة.
- نقل إلى أنبوب 50 مل من خلال مصفاة خلية 70 ميكرومتر مبللة مسبقا.
- أضف 10 مل من المخزن المؤقت FACS لتخفيف المخزن المؤقت لتحلل ACK وبالتالي إيقاف التحلل.
- أجهزة الطرد المركزي عند 400 × جم لمدة 5 دقائق عند 4 درجات مئوية. أعد التعليق في مخزن مؤقت FACS سعة 10 مل عن طريق التعليق أولا في 1 مل ثم تعبئته ب 9 مل.
- قم بإعداد الخلايا للعد كما هو موضح في 1.3.8.
- عد الخلايا باستخدام عداد خلايا آلي باتباع توصيات المورد. ومن المتوقع أن يجمع ما يقرب من 40 مليون خلية من 2 عظم الفخذ.
- تلطيخ نخاع العظم HSPC
- قم بطرد الخلايا عند 400 × جم لمدة 5 دقائق عند 4 درجات مئوية وأعد تعليق الحبيبات بماصة دقيقة في المخزن المؤقت FACS إلى تركيز نهائي قدره 1 × 107 خلايا / مل.
- باستخدام ماصة P1000 الدقيقة ، انقل التعليق إلى أنبوب FACS ، وقم بالترشيح من خلال غطاء مصفاة خلية 35 ميكرومتر.
- قم بإعداد عينات أنبوب اختبار بقعة واحدة لكل جسم مضاد مدرج في الجدول 1 لإعداد تعويضات الفلوروكرومات على فارز الخلايا:
- قم بإعداد أنبوب FACS واحد لكل جسم مضاد واملأ الأنابيب ب 200 ميكرولتر من PBS.
- أضف 15 ميكرولتر من حبات تعويض الفلوروكروم في كل أنبوب FACS من الأجسام المضادة المقترنة بالفلوروكروم. في أنابيب FACS للخلايا غير الملوثة والخلايا الحية / الميتة الملطخة ، أضف 500000 خلية بدلا من الخرز.
- أضف 1 ميكرولتر من كل جسم مضاد مقترن بالفلوروكروم (انظر الجدول 1) إلى أنبوب FACS المقابل له. أضف 0.5 ميكرولتر من البقعة الحية / الميتة إلى أنبوب FACS للبقع المفردة الحية / الميتة.
- يحفظ على الثلج لمدة 15 دقيقة محميا من الضوء.
- تحضير الخلطات 1 و 2 كما هو موضح في الجدول 2.
ملاحظة: أحجام الأجسام المضادة المشار إليها في الجدول 2 صالحة للأجسام المضادة المشار إليها في جدول المواد. يجب تحسينها لأي مرجع جديد للأجسام المضادة أو مجموعة مختلفة من نفس مرجع الأجسام المضادة. - أضف 300 ميكرولتر من المزيج 1 إلى أنبوب العينة ، وأعد وضعه ، واحتفظ به لمدة 15 دقيقة على ثلج محمي من الضوء.
- أضف 300 ميكرولتر من Mix 2 إلى أنبوب العينة ، وأعد وضعه ، واحتفظ به لمدة 20 دقيقة على ثلج محمي من الضوء.
- أضف 3 مل من المخزن المؤقت FACS إلى الأنابيب أحادية اللون وأنابيب العينات الملطخة بالمزيج. قم بتدويرها لأسفل عند 400 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- تخلص بعناية من المادة الطافية باستخدام ماصة دقيقة وأعد تعليق الحبيبات في 500 ميكرولتر من المخزن المؤقت FACS.
- قم بإعداد أنبوب سعة 1.5 مل مملوء مسبقا ب 500 ميكرولتر من وسط التجميع.
ملاحظة: يتم تحضير المزيج 1 في DPBS لأنه يحتوي على بقعة حية / ميتة تتأثر بشكل كبير ب HI-FBS. بمجرد تلطيخ الخلايا بواسطة Live / Dead ، تتم إضافة Mix 2 ، والذي يحتوي على الأجسام المضادة المترافقة بالفلوروكروم المعاد تعليقها في مخزن FACS المؤقت الذي يحتوي على HI-FBS. الاستثناء الوحيد هو الجسم المضاد ل CD16 / 32 المضمن في Antibody Mix 1 ليكون بمثابة مانع مستقبلات Fc الذي يمنع الارتباط غير المحدد للأجسام المضادة الأخرى المضافة في الخطوة التالية.
- فرز الخلايا باستخدام FACS
ملاحظة: بينما يمكن إجراء فرز الخلايا على مجموعة متنوعة من أجهزة فرز الخلايا ، هنا ، يتم وصف الإجراء الخاص باستخدام أدوات BD FACSAria Fusion أو BD FACSAria III. يوصى بشدة بإجراء معايرة وإعداد فارز الخلايا تحت إشراف أو بواسطة مستخدم متمرس للأداة.- معايرة أداة نظام مراقبة الأصول الميدانية: يرجى الرجوع إلى البروتوكول 1، الخطوة 4-1.
- إعداد أداة FACS لفرز الخلايا:
- البدء في الحصول على الخلايا غير الملوثة. تستخدم هذه لتحديد التشتتات الأمامية والجانبية وجهد الكاشف لكل فلوروفور. اضبط المعلمات بحيث تقع إشارة الفلورسنت لكل فلوروفور داخل العقد الأول من مقياس اللوغاريتم على مخطط النقطة.
- احصل على عناصر تحكم أحادية اللون لإعداد التعويضات يدويا (يجب محاذاة متوسط السكان الموجبة والسلبية) أو استخدم برنامج الحساب التلقائي (قياسات المنحدر). تأكد من تطابق عناصر التحكم في التعويض مع إعدادات الفلوروكرومات التجريبية والكاشف. سجل 10000 حدث للخلايا و 5000 حدث للخرز.
- استخدم أنبوب العينة (أي الخلايا متعددة الألوان) لتحديد تجمعات الخلايا محل الاهتمام باستخدام إستراتيجية البوابات الموضحة في الشكل 3 أ. اتبع الخطوات من 4 إلى 6 (أدناه).
- لتحديد HSPCs نخاع العظم الثلاثة ذات الأهمية (HSC و CMP و GMP) ، ابدأ البوابة باستخدام الحجم (FSC-A) والدقة (SSC-A) لبوابة كريات الدم البيضاء ، ثم FSC-H / FSC-A لتمييز الثنائيات.
- استنادا إلى SSC-A / علامة الخلايا الميتة ، بوابة الخلايا الحية. استخدم Lineage/c-Kit لتحديد الخلايا السالبة للنسب والتي تعبر عن مستويات متوسطة إلى عالية من c-Kit. من خلال c-Kit / Sca-1 ، بوابة على HSCs من نوع النسب-c-Kit + Sca-1 + (LKS +) ، وهي واحدة من المجموعات السكانية الثلاثة ذات الاهتمام.
- من بين السلف النخاعي (Lineage-c-Kit + Sca-1-) ، استخدم FcγR / CD34 لاستبعاد CD34-FcγR- خلايا النواة وأسلاف الكريات الحمر (MEP) ، مع تضمين CD34 + FcγR- CMP ، وكذلك CD34 + FcγR + GMP في مجموعات الخلايا المراد فرزها.
- تأكد من استقرار التيار والانحراف.
- في كاميرا الدفق الجانبية، قم بتشغيل فرز الاختبار، وتشغيل الجهد، وتأكد من الفرز الدقيق للسقوط في أنبوب سعة 1.5 مل مثبت على الجانب الأيسر.
- في نافذة تخطيط الفرز ، حدد السكان (السكان) محل الاهتمام (على سبيل المثال، "LKS+" و"أسلاف النخاعي CD34+ " الموضحين في هذا المثال). ضمن الجهاز، حدد 2 أنبوب. ضمن الدقة، حدد نقاء. في الأحداث المستهدفة، حدد مستمر للفرز بين 160,000 و200,000 من أسلاف LKS+ وCD34+ النخاعي.
- أضف 500 ميكرولتر من المخزن المؤقت FACS إلى معلق الخلية وانقل 1 مل من العينة عن طريق الترشيح إلى أنبوب FACS جديد مغطى بمصفاة 35 ميكرومتر لضمان وجود جميع الخلايا في تعليق واحد قبل الاستحواذ مباشرة. هذا يزيل كتل الخلايا التي يمكن أن تسد الجهاز.
- بمجرد أن تصبح جاهزا ، انقر فوق فرز و موافق لبدء الفرز. اضبط معدل التدفق للحفاظ على السرعة أقل من 10000 حدث في الثانية.
ملاحظة: النسبة المتوقعة من LKS + إلى أسلاف CD34 + النخاعية هي 1: 3 للبالغين (8-12 أسبوعا) C57BL / 6J أنثى الفأر في حالة مستقرة. عادة ما يتم الوصول إلى أرقام الخلايا المستهدفة التي تم فرزها في غضون 30 دقيقة من الفرز.
- مراقبة الجودة وعد الخلايا التي تم فرزها
ملاحظة: يجب القيام بهذه الخطوة فقط أثناء التجربة التجريبية لتحسين خطوات تحضير العينة ، بهدف اختبار نقاء الخلايا التي تم فرزها والتي سيتم استخدامها لعزل النوى. بمجرد تحسين البروتوكول بالكامل ، لا ينصح بإجراء خطوة مراقبة الجودة هذه في تجارب المتابعة لتجنب الهدر غير الضروري للمواد الأولية التي قد تكون متاحة بأعداد منخفضة لعزل النوى.- التحكم في النقاء عن طريق قياس التدفق الخلوي
- نقل 10 ميكرولتر من الخلايا التي تم فرزها إلى أنبوب FACS جديد يحتوي على 90 ميكرولتر من المخزن المؤقت FACS.
- الحصول على بيانات ما بعد الفرز وتسجيلها للتحقق من نقاء الفرز وصلاحيته. تأكد من ظهور 95٪ على الأقل من الخلايا في بوابة الاهتمام ، كما هو محدد في 3 - 6 وموضح في الشكل 3 ب.
- التحكم في النقاء عن طريق قياس التدفق الخلوي
- عزل النوى من HSPCs نخاع العظم المصنف
- استخدم بروتوكول "عزل نوى إدخال الخلايا المنخفضة" في الملحق من بروتوكول 10X Genomics الموضح - عزل النوى لتسلسل ATAC + GEX متعدد الخلايا أحادي الخلية (CG000365 - Rev C) 27 ، مع إجراء التعديلات التالية لتحسين استعادة النوى:
- وقت التحلل: قم بإجراء تجربة تجريبية لهذا البروتوكول لتحديد أفضل وقت تحلل لعزل النوى. تأكد من تحقيق تحلل كامل للخلية مع الحفاظ على النوى سليمة.
ملاحظة: الخطوة f من بروتوكول الجينوم 10X27 المذكور أعلاه ترشد إلى "احتضان [في Lysis Buffer] لمدة 3-5 دقائق على الجليد". أثناء التجربة التجريبية ، اختبر على الأقل لمدة 3 دقائق و 4 دقائق و 5 دقائق وقم بتقييم كمية النوى المستردة عن طريق العد والجودة عن طريق قياس التدفق الخلوي والتصوير المجهري لاختيار مدة التحلل المثلى (انظر وصف فحوصات مراقبة الجودة أدناه). لتجنيب الكواشف ، استبدل المخزن المؤقت للنوى المخففة ب PBS 0.04٪ BSA في التجربة التجريبية. بالنسبة ل HSPCs لنخاع العظم ، تم تحديد 3 دقائق كمدة تحلل مثالية. - أجهزة الطرد المركزي للخلية: بالنسبة لجميع أجهزة الطرد المركزي لتعليق الخلية ، أجهزة الطرد المركزي عند 300 × جم لمدة 7 دقائق (بدلا من 5 دقائق في CG000365 - Rev C) 27 عند 4 درجات مئوية.
- أجهزة الطرد المركزي للنوى: قم بإجراء جميع عمليات الطرد المركزي لتعليق النوى عند 500 × جم لمدة 5 دقائق حسب CG000365 - Rev C27.
- جمع النوى: في الخطوة ب ، بعد التعليق في 50 ميكرولتر من PBS 0.04٪ BSA والانتقال إلى أنبوب 0.2 مل ، أضف 50 ميكرولتر من PBS 0.04٪ BSA إلى الأنبوب الأصلي ومزيج الماصة لجمع أي خلايا متبقية. نقل إلى أنبوب 0.2 مل للوصول إلى حجم إجمالي 100 ميكرولتر.
- من الآن فصاعدا ، سيكون الحجم الإجمالي 100 ميكرولتر بدلا من 50 ميكرولتر من البروتوكول. اضبط خطوات المصب وفقا لذلك (على سبيل المثال ، بالنسبة للخطوة d ، قم بإزالة 90 ميكرولتر بدلا من 45 ميكرولتر ؛ بالنسبة للخطوة e ، أضف 90 ميكرولتر من المخزن المؤقت للتحلل بدلا من 45 ميكرولتر).
- بالنسبة للخطوة m ، أعد تعليق حبيبات النوى في 12 ميكرولتر من المخزن المؤقت للنوى المخففة بدلا من 7 ميكرولتر.
- عد النوى المعزولة. في أنبوب فارغ سعة 0.5 مل ، أضف 10 ميكرولتر من 0.4٪ تريبان أزرق و 8 ميكرولتر من PBS 0.04٪ BSA.
- أضف 2 ميكرولتر من النوى إلى الأنبوب وعد النوى كما هو موضح في 1.3.8. استخدم عداد خلايا آلي باتباع توصيات المورد.
- وقت التحلل: قم بإجراء تجربة تجريبية لهذا البروتوكول لتحديد أفضل وقت تحلل لعزل النوى. تأكد من تحقيق تحلل كامل للخلية مع الحفاظ على النوى سليمة.
- استخدم بروتوكول "عزل نوى إدخال الخلايا المنخفضة" في الملحق من بروتوكول 10X Genomics الموضح - عزل النوى لتسلسل ATAC + GEX متعدد الخلايا أحادي الخلية (CG000365 - Rev C) 27 ، مع إجراء التعديلات التالية لتحسين استعادة النوى:
- التحكم في النقاء عن طريق قياس التدفق الخلوي
ملاحظة: يجب القيام بهذه الخطوة فقط أثناء التجربة التجريبية لتحسين خطوات تحضير العينة لاختبار نقاء النوى التي سيتم تحميلها على شريحة الكروم 10X. بمجرد تحسين البروتوكول بالكامل ، لا ينصح بإجراء خطوة مراقبة الجودة هذه في تجارب المتابعة لتجنب الهدر غير الضروري للنوى المجمعة التي قد تكون متاحة بأعداد منخفضة.- بعد الانتهاء من عزل النوى، انقل 6 ميكرولتر من إعادة تعليق النوى في أنبوب FACS جديد مملوء مسبقا ب 150 ميكرولتر من المخزن المؤقت FACS. أضف 3 ميكرولتر من 7-AAD واحتضانها لمدة 5 دقائق على الثلج.
- الحصول على بيانات ما بعد الفرز وتسجيلها للتحقق من نقاء الفرز وصلاحيته. تأكد من ظهور 95٪ على الأقل من النوى في بوابة الاهتمام ، على النحو المحدد في البروتوكول 1 الخطوة 4.2 (انظر الشكل 4).
- مراقبة جودة النوى المنقاة بالمجهر:
ملاحظة: يجب القيام بهذه الخطوة فقط أثناء التجربة التجريبية لتحسين خطوات تحضير العينة لاختبار جودة النوى التي سيتم تحميلها على شريحة الكروم 10X. بمجرد تحسين البروتوكول بالكامل ، لا ينصح بإجراء خطوة مراقبة الجودة هذه في تجارب المتابعة لتجنب الهدر غير الضروري للنوى المجمعة التي قد تكون متاحة بأعداد منخفضة.- تابع كما هو موضح في الخطوة 1.5.3.
- إجراء مقايسة متعددة
- انتقل فورا إلى Chromium Next GEM أحادي الخلية Multiome ATAC + دليل مستخدم التعبير الجيني (CG000338 - Rev F)25.
النتائج
يوضح البروتوكولان الموصوفان أعلاه عزل النوى بدءا من نوعين مختلفين من الأنسجة. يتم تمثيل الاختلافات والتشابهات بين البروتوكولين بشكل تخطيطي في الشكل 1.
تنقية النوى من دماغ الفأر
في البروتوكول الموصوف هنا ، نقترح طريقة لطيفة لإعداد النوى من عينات الدماغ. يبدأ بتفكك ميكانيكي لأنسجة المخ في مخزن مؤقت للتحلل ، تليها خطوات الغسيل وتصفية المصفاة التي تزيل الأنسجة المتبقية من التعليق. يتم تحقيق الإزالة اللاحقة للحطام والخلايا غير المحللة والجسيمات الصغيرة بواسطة FACS لضمان تحميل النوى النقية فقط لبروتوكول Multiome النهائي. يوضح الشكل 2 صورة النوى قبل الفرز وبعده. بعد الترشيح وقبل فرز النوى ، تحتوي العينة على كمية عالية من الحطام ، مع أكثر من 99٪ من "المفردات" الإيجابية للبقع النووية (7-AAD) ، مما يشير إلى تحلل الخلية الأمثل (الشكل 2 أ). يتم فرز النوى بناء على البوابة الموجبة 7-AAD. يتم الحصول على جزء من المواد التي تم فرزها للتحقق من نقاء النوى المعدة. يوضح الشكل 2 ب ملف تعريف نوى الدماغ بعد الفرز. سمح فرز النوى بزيادة نقاء النوى من 36٪ الأولية (الشكل 2 أ) إلى ما يقرب من 100٪ (الشكل 2 ب).
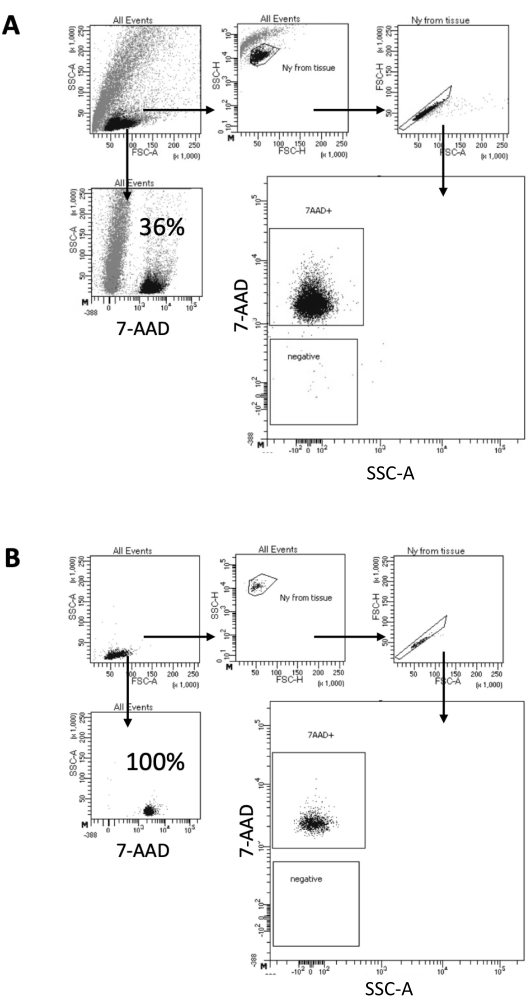
الشكل 2: استراتيجية البوابات لفرز النوى واختبار النقاء بعد الفرز. تم تلطيخ النوى ب 7-AAD وتم الحصول عليها بواسطة فارز الخلية. (أ) يتم أولا بوابات النوى بناء على حجمها ودقتها (FSC-A و SSC-A ، على التوالي). ثم يتم اختيار الجسيمات المفردة بناء على خصائص FSC-A / FSC-H وتلطيخ 7-AAD. (ب) بعد فرز الخلايا، يختبر جزء من النوى من أنبوب التجميع للتأكد من نقائه باستخدام استراتيجية البوابات نفسها المستخدمة في الخيار (أ). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
تنقية أسلاف الخلايا الجذعية المكونة للدم في نخاع عظم الفأر (HSPCs)
عند العزل عن نخاع العظم ، يتم فرز ما يصل إلى 2 × 105 HSPCs بواسطة FACS ، وفقا لاستراتيجية البوابات الموضحة في الشكل 3A. يتم تقييم فعالية الفرز ونقاء العينة (الشكل 3 ب).
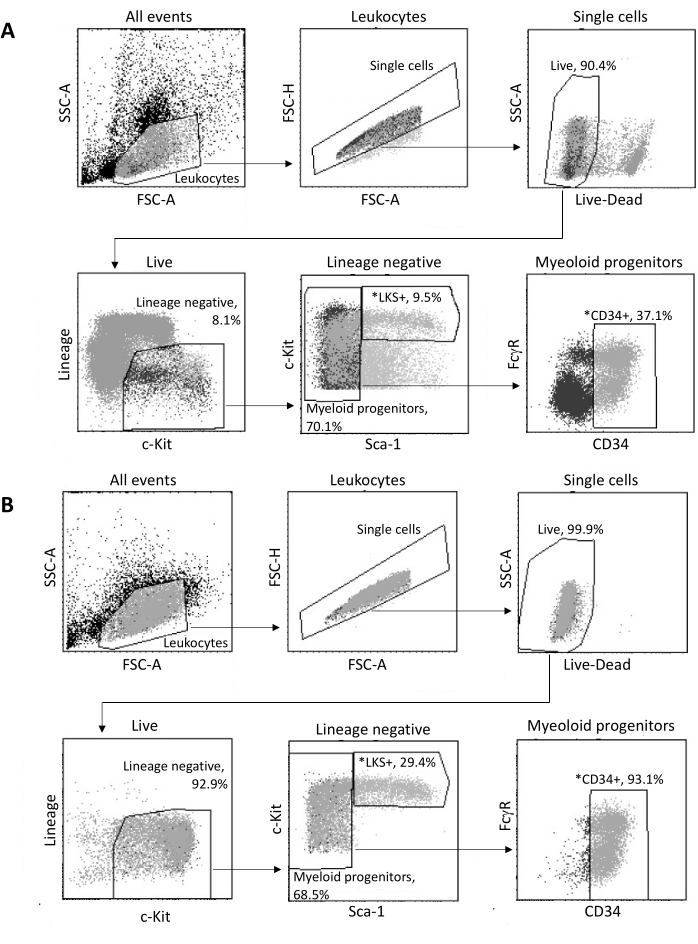
الشكل 3: استراتيجية البوابات لفرز HSPCs نخاع العظم. (أ) استراتيجية بوابة FACS تمثيلية لفرز الخلايا الجذعية المكونة للدم LKS + القابلة للحياة وأسلاف CD34 + النخاعية لعزل النوى. (ب) مخططات FACS التمثيلية المستخدمة للتحقق من نقاء مجموعات الخلايا المصنفة. تظهر نسب مجموعات الخلايا الفرعية المختلفة بالنسبة إلى المجتمع الأصلي. * السكان المصنفون. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
يسمح بروتوكول "عزل نوى إدخال الخلايا المنخفضة" بعزل النوى من العينات بحد أقصى 105 خلايا. يتضمن عددا منخفضا من خطوات الطرد المركزي ، وبالتالي تقليل فقد الخلية / النوى. لقد قمنا بتعديل حجم التحلل وغسل المخازن المؤقتة بشكل متناسب مع مدخلات الخلية وزدنا وقت الطرد المركزي لاستعادة النوى إلى أقصى حد. لقد أجرينا تجربة تجريبية لتقييم كمية النوى المستعادة عن طريق العد وجودتها عن طريق قياس التدفق الخلوي والتصوير المجهري. يوضح الشكل 4 عينة HSPCs بعد تحلل الخلية. ولد هذا البروتوكول نوى عالية الجودة ، كما لوحظ في الشكل 5 أ ، دون أي حطام يمكن أن يؤثر على بروتوكول المصب متعدد الليومات.
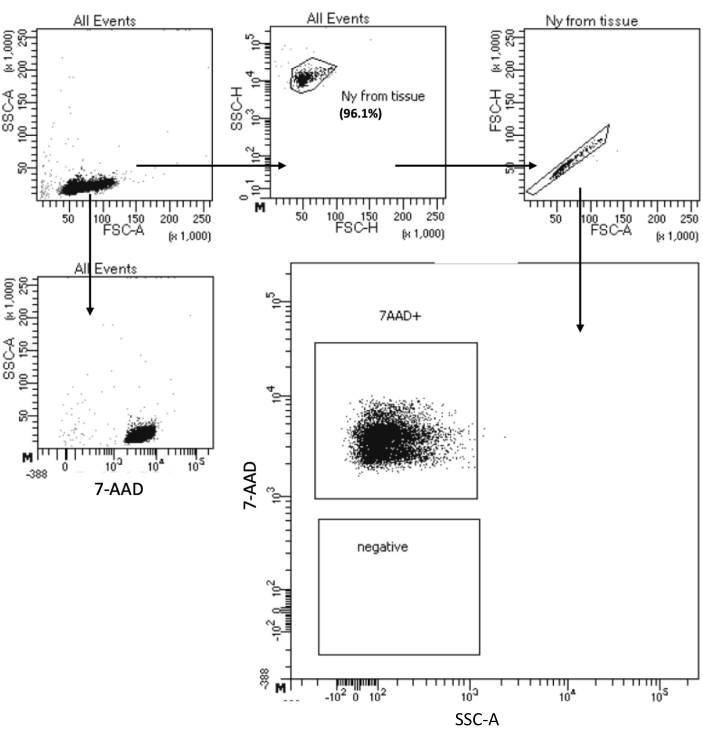
الشكل 4: فرز اختبار نقاء نوى HSPC لنخاع العظم المعزول. تم تلطيخ النوى ب 7-AAD وتم الحصول عليها بواسطة فارز الخلية. تم إدخال النوى أولا بناء على حجمها ودقتها (FSC-A و SSC-A ، على التوالي) لتقييم نقاء العينة. يشار إلى نسبة النوى فيما يتعلق بالسكان الأصليين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| رقم الأنبوب | اسم الأنبوب | كيان ملطخ | مقدار الكيان الملطخ | الجسم المضاد / الصبغة (ميكرولتر) | المخزن المؤقت للتجميع (ميكرولتر) |
| 1 | غير ملوثة | خلايا | 5,00,000 | غير متوفر | 200 |
| 2 | LIVE / DEAD قابل للإصلاح أكوا الخلايا الميتة وصمة عار | خلايا | 5,00,000 | 0.5 | |
| 3 | APC / سيانين 7 مضاد للماوس CD16 / 32 (FcγR) | OneComp eBeads | 15 ميكرولتر | 1 | |
| 4 | المحيط الهادئ الأزرق مكافحة الماوس كوكتيل النسب | OneComp eBeads | 15 ميكرولتر | 1 | |
| 5 | PE المضادة للماوس Ly-6A / E (SCA-1) | OneComp eBeads | 15 ميكرولتر | 1 | |
| 6 | APC المضادة للماوس CD117 (c-Kit) | OneComp eBeads | 15 ميكرولتر | 1 | |
| 7 | مكافحة الماوس FITC CD34 | OneComp eBeads | 15 ميكرولتر | 1 |
الجدول 1: ضوابط بقعة واحدة لإعدادات التعويض على مقياس التدفق الخلوي. يشار إلى عناصر التحكم المطلوبة في البقع المفردة ، وعدد الخلايا أو الخرزات المراد تلطيخها ، وكميات الأجسام المضادة.
| ماستر ميكس | الكاشف | التخفيف النهائي | الجسم المضاد / الصبغة (ميكرولتر) | نوع المخزن المؤقت | العازلة (ميكرولتر) |
| ميكس 1 | APC / سيانين 7 مضاد للماوس CD16 / 32 (FcγR) | 1/500 | 1.2 | دب ب س | 300 |
| LIVE / DEAD قابل للإصلاح أكوا الخلايا الميتة وصمة عار | 1/250 | 2.4 | |||
| ميكس 2 | المحيط الهادئ الأزرق مكافحة الماوس كوكتيل النسب | 1/20 | 30 | المخزن المؤقت FACS | 300 |
| PE المضادة للماوس Ly-6A / E (SCA-1) | 1/200 | 3 | |||
| APC المضادة للماوس CD117 (c-Kit) | 1/200 | 3 | |||
| مكافحة الماوس FITC CD34 | 1/50 | 12 | |||
| إجمالي حجم التلوين | 600 |
الجدول 2: تكوين مزيج تلطيخ لنخاع العظم HSPCs. تظهر كميات الكواشف اللازمة لتلطيخ عينة واحدة تحتوي على 40 مليون خلية. لتلطيخ عدد أكبر من العينات ، اضرب الحجم المشار إليه في العدد المطلوب من العينات وأضف نصف حجم عينة إضافي لضمان حجم كاف من المزيج الرئيسي.
الشكل التكميلي 1: بروتوكول عزل خلايا نخاع العظم. أ: افتح الصفاق. تشير الخطوط المنقطة البيضاء إلى الخط الذي يجب قطعه. (ب) بعد تقشير الجلد من الساق الخلفية، قم بتبطين المقص على طول العمود الفقري عند مفصل الورك لقطع الساق دون قطع عظم الفخذ. ج: ظهور الساق منفصلة عن الجسم قبل استئصال العضلات. د: ظهور الساق بعد إزالة العضلات. ه: إجراء فصل عظم الفخذ عند مفصل الركبة، ثم عند مفصل الورك، مع الحرص على عدم فتح عظم الفخذ. تظهر الأسهم البيضاء المنحنية الحركة المطلوبة. تشير الأسهم المنقطة البيضاء إلى المنطقة المراد فصلها برفق باستخدام المقص للقرص. (و) إجراء لفتح الجزء البعيد من عظم الفخذ (أي الجزء المتصل سابقا بالساق عند مفصل الركبة) عن طريق الإمساك بإحكام بالغضروف والمشاش البعيد بالمقص وقلبه للخلف لكشف نخاع العظم. (ز) يجب أن تكون أربعة نتوءات ، يشار إليها بأسهم سوداء ، مرئية في نهاية الجسم المكشوف. (ح) ظهور عظم الفخذ مع توجيه الطرف المفتوح لأسفل في الأنبوب المحضر سعة 0.5 مل الموضوع داخل أنبوب سعة 1.5 مل يحتوي على 150 ميكرولتر من المخزن المؤقت لنظام مراقبة الأصول المعرضة للرقابة المالية. (I) ظهور خلايا نخاع العظم المحببة وعظم الفخذ الأبيض الآن بعد الطرد المركزي السريع عند 12000 × جم. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
يعد تحضير معلق خلية أو نوى عالي الجودة ذا أهمية حاسمة لنجاح تحليل RNA-Seq أحادي الخلية أو أحادي النوىوتحليلات متعددة الخلايا أحادية الخلية 29،30،31. هنا ، وصفنا بروتوكولات تحضير العينات وعزل النوى لمقايسات multiome من نوعين من الأنسجة: الدماغ ونخاع العظام.
يسمح بروتوكول الدماغ الموصوف في هذه الورقة باستعادة نوى عالية الجودة من أنسجة المخ الطازجة المجمدة. ويشمل الخطوات التالية: تعطيل الأنسجة المجمدة ، وعزل النوى ، وتنقية النوى ، ومراقبة جودة المواد المحضرة. يتكون نسيج المخ من العديد من أنواع الخلايا المختلفة ، ويجب أن يحافظ إجراء تفكك الأنسجة وعزل النوى على نسب مجموعات الخلايا الموجودة في الأنسجة الأولية. هنا ، تم تحسين تكوين المخزن المؤقت للتحلل ووقت الحضانة لتمكين التحلل الكامل واللطيف لجميع مجموعات الخلايا التي تشكل الأنسجة.
يختلف بروتوكول HSPCs لنخاع العظم إلى حد ما لأنه يتطلب خطوة إضافية واحدة في بداية التجربة لعزل مجموعة الخلايا ذات الأهمية من تعليق خلوي غير متجانس. بعد جمع الأنسجة الطازجة ، يتم تحليل خلايا الدم الحمراء ، ويتم إثراء العينة لمجموعة فرعية من الخلايا ذات الأهمية. يتم تحليل الخلايا المستهدفة ، ويتم عزل النوى ، ويتم التحكم في جودة المواد المعدة.
يوفر 10X Genomics العديد من البروتوكولات التي تم التحقق من صحتها لعزل النوى في العديد من الأنسجة المختلفة32,33. تقوم الشركة أيضا بتسويق مجموعة عزل النوى مع خط أنابيب مباشر لعزل النوى من الأنسجة التي تم التحقق من صحتها34. ومع ذلك ، تحتاج هذه البروتوكولات إلى تحسين إضافي لتكييف خصوصيات عينات معينة. مثال على ذلك هو العينات التي تتطلب العمل مع إدخال خلية منخفضة. بالنسبة لهذه العينات ، فإن الخطوات الأكثر تحديا هي أجهزة الطرد المركزي التي يجب أن تكون صارمة بما يكفي لتنظيف العينة ولطيفة بما يكفي لتجنب فقدان الخلية / النوى. باستخدام البروتوكول الموضح هنا ، قمنا بتكييف بروتوكول 10X Genomics الموضح - عزل النوى لتسلسل ATAC + GEX متعدد الخلية أحادي الخلية (CG000365 - Rev C) 27 لإيجاد توازن دقيق بين هذين المتطلبين. كما هو موضح في مثال تحضير النوى من HSPCs المصنفة ، قمنا بتحسين استعادة النوى دون أي تأثير على جودة العينة.
التحدي الإضافي هو خطوة تحلل الخلايا النقية لعزل النوى. يمكن أن تؤدي ظروف التحلل الأكثر قسوة وأوقات الحضانة الأطول إلى إتلاف النوى وبالتالي التأثير على جودة بيانات التسلسل. يوضح الشكل 5 تصوير النوى التمثيلية من عينات نخاع العظم في أوقات حضانة مختلفة باستخدام مخزن التحلل، ويوضح مدى اختلاف حالة النوى اعتمادا على تحلل الخلية. في مثال HSPCs ، حددنا تحلل 3 دقائق كحالة تؤدي إلى أعلى نسبة من النوى السليمة ذات المظهر الصحي وأقل نسبة من النوى التالفة. يجب تحسين أوقات حضانة التحلل لكل نوع جديد من العينات.
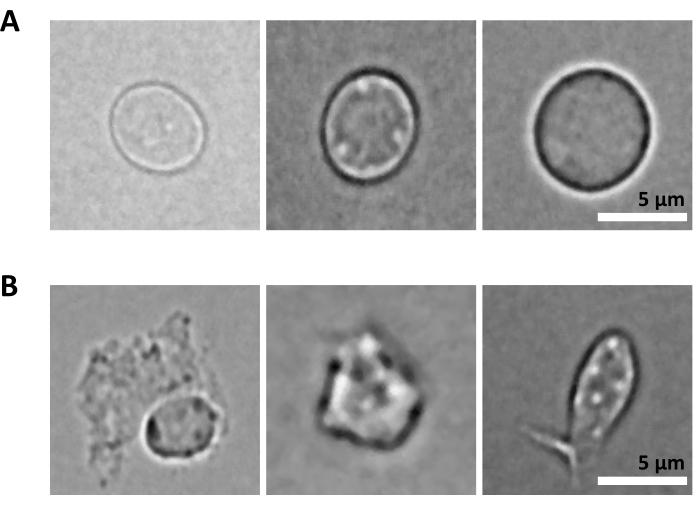
الشكل 5: مراقبة جودة النوى عن طريق الفحص المجهري. تظهر صور برايت فيلد تمثيلية لنوى معزولة من نخاع عظم الفأر مع (أ) سليمة و (ب) نوى تالفة. مقياس الرسم 5 ميكرومتر. تم التقاط الصور باستخدام مجهر مقلوب باستخدام هدف 40x ELWD NA 0.60 وتقريب رقمي 1.5x. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
يعتمد كلا البروتوكولين المفصلين في هذا العمل على تنقية الخلايا أو النوى المستهدفة بواسطة أدوات FACS عالية الإنتاجية. هذه الخطوة ذات أهمية حاسمة لبروتوكولات تحضير الخلية الواحدة / النوى حيث يتم عزل مجموعات فرعية نادرة من الخلايا من المعلقات غير المتجانسة. في هذه ، كما هو الحال في المثال الموضح هنا لفرز HSPCs ، قد تكون هناك حاجة إلى لوحة قياس التدفق الخلوي عالية الأبعاد لتمكين "البوابة" على مجموعة الخلايا ذات الأهمية. الفرز سريع ودقيق للغاية ، مما يؤدي إلى نقاء أكثر من 95٪ من المجموعات الفرعية للخلايا التي تم فرزها. يعرض هذا النهج التعليق الخلوي لضغط يصل إلى 70 رطل لكل بوصة مربعة ، وبالتالي قد يكون مقيدا لفرز الخلايا الهشة (على سبيل المثال ، الخلايا المتغصنة ، العدلات) لأنه قد يتسبب في تمزق غشاء الخلية. وفي هذه الحالات، ينبغي اختيار حلول بديلة للتنقية الخلوية، بما في ذلك الفرز المغناطيسي، وتطبيق أدوات الجيل الجديد (مثل CellenOne، وCellenion؛ وCellenion؛ وCellenion). MACSQuant Tyto، Miltenyi)35,36، أو الأنظمة القائمة على القطيرات (على سبيل المثال، ODIN، Sensific)37. ومع ذلك ، فإن سرعة الفرز البطيئة لهذه التقنيات ، مع فرز الخلايا الذي يستمر لساعات بدلا من دقائق ، هو عامل مقيد قوي لتطبيق هذه الأساليب في إعداد خلايا قابلة للحياة ل Multiome وغيرها من تطبيقات الخلية المفردة بناء على تحليل أعداد الخلايا الكبيرة.
لتنقية النوى المعزولة من الأنسجة ، FACS هي الطريقة المفضلة بسبب إنتاجيتها ونقاء المادة المعزولة. النوى ليست حساسة للضغط ، ويمكن بسهولة تنقية عزلات الأنسجة المفلترة من خلال فارز الخلايا. وإذا لم يكن المختبر مجهزا بأداة من أدوات نظام مراقبة الأصول الميدانية، توجد بدائل أخرى، أقل كفاءة إلى حد ما ولكنها جيدة بما فيه الكفاية. ومن الأمثلة على ذلك الطرد المركزي الفائق أو استخدام معدات صغيرة مثل MARS (الخلية التطبيقية) التي تفصل الجسيمات بناء على اختلافها في الحجم ، باستخدام الموجات الصوتية. غسالة CURIOX الصفائحية التي تستخدم خصائص كارهة للماء لمعلقات الخلية / النوى ؛ أو LEVITAS bio الذي يعتمد على الخصائص الفيزيائية للخلايا (الرفع) لفصلها عن الحطام.
هنا ، نصف البروتوكولات للحصول على عدد كبير من النوى وأفضل نقاء لبروتوكول Multiome النهائي. ويؤدي فرز نظام مراقبة الأصول الميدانية وخطوات الطرد المركزي المتكررة إلى خسارة كبيرة في المواد الأولية. لهذا السبب ، في بروتوكول تحضير النوى من الدماغ الذي نصفه هنا يتطلب مواد أولية وفيرة بما فيه الكفاية لينتج عنها جمع ما لا يقل عن 500000 نواة بعد فرز FACS. يجب تطبيق بروتوكولات بديلة إذا لم يكن من الممكن مطابقة هذا المعيار. عند العمل مع مجموعات الخلايا النادرة أو أقسام الأنسجة الصغيرة ، يمكن أن تكون الكمية المتاحة من المواد الأولية عاملا مقيدا. لمعالجة هذه المشكلة ، من الممكن تحسين استعادة النوى عن طريق (أ) تقليل حجم التحلل ، (ب) تقليل حجم الغسيل ، (ج) استخدام غسلة واحدة مع وقت طرد مركزي ممتد لمحاولة تحسين الاسترداد كما هو موضح في بروتوكولات الجينوم 10X لعزل نوى مدخلات الخلايا المنخفضة. بالنسبة للتحليل متعدد الألوان للمواد منخفضة المحتوى ، يجدر النظر في التطبيقات القائمة على الألواح مثل scNMT و SNARE-seq و Paired-seq38 التي تتطلب عينات إدخال أقل بكثير.
باختصار ، لقد وصفنا بروتوكولين قويين لإعداد النوى من الدماغ ونخاع العظم HSPCs لتحليل Multiome في اتجاه مجرى النهر. هذه البروتوكولات قابلة للتطبيق في أي مشروع علمي يتطلب معلقات نوى مفردة عالية الجودة من هذين النوعين من الأنسجة ، بغض النظر عن السؤال العلمي المطروح. تقوم مجموعتنا بتطبيق بروتوكول عزل نوى الدماغ في دراسات نمو الدماغ عند تعطيل مختلف الجينات المستهدفة وفي دراسات الاستجابة المناعية في سياق الأمراض العصبية. نحن نستخدم بروتوكول عزل نوى نخاع العظم لفك رموز مشاركة مختلف المجموعات السكانية الفرعية المكونة للدم في إنشاء جهاز المناعة.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
حصلت آنا جيمين تشوي على دعم من راتب من برنامج الدكتوراه الدولي بجامعة باستور - باريس (PPU).
Materials
| Name | Company | Catalog Number | Comments |
| 18 G x 1 ½ (1.2 mm x 38 mm) Agani needles | Terumo | AN*1838S1 | |
| 15 mL tubes | Falcon | 352097 | |
| 5 mL round bottom FACS tube with cell strainer cap 35 µm | falcon | 352235 | |
| 50 mL tubes | Falcon | 352070 | |
| 7-AAD | BD pharmagen | 559925 | |
| ACK Lysing Buffer | Gibco | A10492-01 | |
| APC anti-mouse CD117 (c-Kit) | BioLegend | 105812 | Clone: 2B8 |
| APC/Cyanine 7 anti-mouse CD16/32 (FcγR) | BioLegend | 101328 | Clone: 93 |
| BD FACSAria III | BD Biosciences | non-applicable | |
| BD FACSDiva Software v8.0.1 | BD Biosciences | non-applicable | |
| Bovine Serum Albumin stock solution 10% | Miltenyi Biotec | 130-091-376 | |
| Cell staining buffer | Biolegend | 420201 | |
| CFI Suprplan Fluor ELWD 40XC ON 0.6 | Nikon | non-applicable | |
| CMOS camera Prime 95B 25 mm | Photometrix | non-applicable | |
| Countess II FL Automated Cell Counter | Invitrogen | AMQAF1000 | |
| Countess cell counting chamber slide | Invitrogen | C10283 | |
| Coverglass 24 mm x 24 mm 0.13-0.17 mm | Brand | BR470819 | |
| Digitonine 5% | Invitrogen | BN2006 | |
| Disposable Scalpels | Swann-Morton | 0508 | |
| DMEM (1x) + GlutaMAX-I | Gibco | 31966-021 | |
| DPBS (10x) | Gibco | 14200-067 | |
| DTT | Sigma aldrich | 646563 | |
| Epifluorescence inverted microscope Nikon Ti2 -E | Nikon | non-applicable | |
| Eppendorf Safe-Lock Tubes 0.5 mL | Eppendorf | 30123603 | |
| Ethanol 70% | VWR | 83801.290 | |
| FITC anti-mouse CD34 | Invitrogen | 11-0341-85 | Clone: RAM34 |
| Forceps for dissection | FST | 11152-10 | |
| Heat-inactivated Fetal Bovine Serum (FBS) | Gibco | 11533387 | |
| Dounce Homogeniser 2 mL | Bellco glass | 1984-10002 | Pestle “A” Large Clearance: .0030-.0050″ and Pestle “B” Small Clearance: .0005-.0025″ |
| LIVE/DEAD fixable aqua dead cell stain kit | Invitrogen | L34957 | |
| Magnesium chloride solution 1 M | Sigma aldrich | M1028 | |
| Microcentrifuge | Eppendorf | 5424R | |
| Mounting medium Fluoromount-G | invitrogen | 00-4958-02 | |
| Nonidet P40 substitute | Sigma aldrich | 74385 | |
| Nuclease free water | ThermoFischer | AM9932 | |
| Nuclei buffer 20x | 10X Genomics | 2000153/2000207 | |
| Nuclei isolation kit EZ prep | Sigma Aldrich | NUC-101 | |
| OneComp eBeads compensation beads | Invitrogen | 01-1111-41 | |
| Pacific Blue anti-mouse lineage cocktail (including anti-mouse CD3, Ly-6G/Ly-6C, CD11b, CD45R/B220, TER-119) | BioLegend | 133310 | Clones (in the same order as the antibodies listed): 17A2, RB6-8C5, M1/70, RA3-6B2, Ter-119 |
| PCR Tube Strips 0.2 mL | Eppendorf | 951010022 | |
| PE anti-mouse Ly-6A/E (Sca-1) | BioLegend | 122507 | Clone: E13-161.7 |
| Petri dish 100 mm x 20 mm OPTILUX | Falcon | 353003 | |
| Ply-L-lysine 0.01% sterile-filtered suitable for cell culture | Sigma | P4707 | |
| Printed microscope slides 8 well 6 mm numbered | Epredia | ER-301B-CE24 | |
| Protein LoBind Tubes 1.5 mL | Eppendorf | 30108116 | |
| Recombinant Rnase inhibitor 5000 U | Takara | 2313A | |
| Scissors for dissection | FST | 14090-09 | |
| Sodium chloride solution 5 M | Sigma aldrich | 59222C | |
| Syringe filters, PES, 0.2 µm | Fisher Scientific | 15206869 | |
| Transparent nail polish | any | non-applicable | |
| Trizma Hydrochloride solution pH 7.4 | Sigma aldrich | T2194 | |
| Trypan Blue 0.4% | gibco | 15250061 | |
| Tween 20 | Biorad | 1662404 | |
| UltraPure Distilated Water Dnase/Rnase Free | Invitrogen | 10977-035 |
References
- Clark, S. J., et al. scNMT-seq enables joint profiling of chromatin accessibility DNA methylation and transcription in single cells. Nature Communications. 9 (1), 781(2018).
- Lee, J., Hyeon, D. Y., Hwang, D. Single-cell multiomics: technologies and data analysis methods. Experimental & Molecular Medicine. 52 (9), 1428-1442 (2020).
- Cerrizuela, S., et al. High-throughput scNMT protocol for multiomics profiling of single cells from mouse brain and pancreatic organoids. STAR Protocols. 3 (3), 101555(2022).
- Dimitriu, M. A., Lazar-Contes, I., Roszkowski, M., Mansuy, I. M. Single-cell multiomics techniques: From conception to applications. Frontiers in Cell and Developmental Biology. 10, 854317(2022).
- Stoeckius, M., et al. Simultaneous epitope and transcriptome measurement in single cells. Nature Methods. 14 (9), 865-868 (2017).
- Cao, J., et al. Joint profiling of chromatin accessibility and gene expression in thousands of single cells. Science (New York, N.Y.). 361 (6409), 1380-1385 (2018).
- Narayanan, A., et al. Nuclei Isolation from Fresh Frozen Brain Tumors for Single-Nucleus RNA-seq and ATAC-seq. Journal of Visualized Experiments: JoVE. (162), e61542(2020).
- Kim, M., et al. Single-nucleus transcriptomics reveals functional compartmentalization in syncytial skeletal muscle cells. Nature Communications. 11 (1), 6375(2020).
- Santos, M. D., et al. Extraction and sequencing of single nuclei from murine skeletal muscles. STAR Protocols. 2 (3), 100694(2021).
- Safabakhsh, S., et al. Isolating nuclei from frozen human heart tissue for single-nucleus RNA sequencing. Current Protocols. 2 (7), e480(2022).
- Lau, S. -F., Cao, H., Fu, A. K. Y., Ip, N. Y. Single-nucleus transcriptome analysis reveals dysregulation of angiogenic endothelial cells and neuroprotective glia in Alzheimer's disease. Proceedings of the National Academy of Sciences of the United States of America. 117 (41), 25800-25809 (2020).
- Armand, E. J., Li, J., Xie, F., Luo, C., Mukamel, E. A. Single-cell sequencing of brain cell transcriptomes and epigenomes. Neuron. 109 (1), 11-26 (2021).
- Morabito, S., et al. Single-nucleus chromatin accessibility and transcriptomic characterization of Alzheimer's disease. Nature Genetics. 53 (8), 1143-1155 (2021).
- Chen, S., et al. Spatially resolved transcriptomics reveals genes associated with the vulnerability of middle temporal gyrus in Alzheimer's disease. Acta Neuropathologica Communications. 10 (1), 188(2022).
- Paul, F., et al. Transcriptional heterogeneity and lineage commitment in myeloid progenitors. Cell. 163 (7), 1663-1677 (2015).
- Kaufmann, E., et al. BCG educates hematopoietic stem cells to generate protective innate immunity against tuberculosis. Cell. 172 (1-2), 176-190.e19 (2018).
- Christ, A., et al. Western diet triggers NLRP3-dependent innate immune reprogramming. Cell. 172 (1-2), 162-175.e14 (2018).
- Moorlag, S. J. C. F. M., et al. β-Glucan Induces protective trained immunity against mycobacterium tuberculosis infection: A key role for IL-1. Cell Reports. 31 (7), 107634(2020).
- de Laval, B., et al. C/EBPβ-dependent epigenetic memory induces trained immunity in hematopoietic stem cells. Cell Stem Cell. 26 (5), 657-674.e8 (2020).
- Renthal, W., et al. Characterization of human mosaic Rett syndrome brain tissue by single-nucleus RNA sequencing. Nature Neuroscience. 21 (12), 1670-1679 (2018).
- Yang, A. C., et al. A human brain vascular atlas reveals diverse mediators of Alzheimer's risk. Nature. 603 (7903), 885-892 (2022).
- Lee, D. R., Zhang, Y., Rhodes, C. T., Petros, T. J. Generation of single-cell and single-nuclei suspensions from embryonic and adult mouse brains. STAR Protocols. 4 (1), 101944(2022).
- Corces, M. R., et al. Lineage-specific and single-cell chromatin accessibility charts human hematopoiesis and leukemia evolution. Nature Genetics. 48 (10), 1193-1203 (2016).
- Ranzoni, A. M., et al. Integrative single-cell RNA-seq and ATAC-seq analysis of human developmental hematopoiesis. Cell Stem Cell. 28 (3), 472-487.e7 (2021).
- 10X Genomics Chromium Next GEM Single Cell Multiome ATAC + Gene Expression User Guide, Document Number CG000338 Rev F. , At https://www.10xgenomics.com/support/single-cell-multiome-atac-plus-gene-expression/documentation/steps/library-prep/chromium-next-gem-single-cell-multiome-atac-plus-gene-expression-reagent-kits-user-guide (2022).
- Meyerhoff,, et al. Microdissection of mouse brain into functionally and anatomically different regions. Journal of Visualized Experiments: JoVE. (168), e61941(2021).
- 10X Genomics 10X Genomics Demonstrated Protocol - Nuclei Isolation for Single Cell Multiome ATAC + GEX sequencing (CG000365 - Rev C). , At https://www.10xgenomics.com/support/single-cell-multiome-atac-plus-gene-expression/documentation/steps/sample-prep/nuclei-isolation-for-single-cell-multiome-atac-plus-gene-expression-sequencing (2022).
- Haag, S., Murthy, A. Murine monocyte and macrophage culture. Bio-Protocol. 11 (6), e3928(2021).
- Haque, A., Engel, J., Teichmann, S. A., Lönnberg, T. A practical guide to single-cell RNA-sequencing for biomedical research and clinical applications. Genome Medicine. 9 (1), 75(2017).
- Jiang, P. Quality control of single-cell RNA-seq. Methods in Molecular Biology (Clifton, N.J). 1935, 1-9 (2019).
- Regan, C., Preall, J. Practical considerations for single-cell genomics. Current Protocols. 2 (8), e498(2022).
- 10X Genomics 10X Genomics Demonstrated Protocol - Nuclei Isolation for Single Cell ATAC Sequencing (CG000169 - Rev E). , At https://www.10xgenomics.com/support/single-cell-atac/documentation/steps/sample-prep/nuclei-isolation-for-single-cell-atac-sequencing (2022).
- 10X Genomics 10X Genomics Demonstrated Protocol - Nuclei Isolation from Complex Tissues for Single Cell Multiome ATAC + Gene Expression Sequencing. (CG000375 - Rev C). , At https://www.10xgenomics.com/support/single-cell-multiome-atac-plus-gene-expression/documentation/steps/sample-prep/nuclei-isolation-from-complex-tissues-for-single-cell-multiome-atac-plus-gene-expression-sequencing (2022).
- 10X Genomics 10X Genomics - Chromium Nuclei Isolation Kit (CG000505 - Rev A). , At https://www.10xgenomics.com/support/single-cell-gene-expression/documentation/steps/sample-prep/chromium-nuclei-isolation-kit-sample-prep-user-guide (2022).
- Shomroni, O., et al. A novel single-cell RNA-sequencing approach and its applicability connecting genotype to phenotype in ageing disease. Scientific Reports. 12 (1), 4091(2022).
- Ocañas, S. R., Pham, K. D., Blankenship, H. E., Machalinski, A. H., Chucair-Elliott, A. J., Freeman, W. M. Minimizing the ex vivo confounds of cell-isolation techniques on transcriptomic and translatomic profiles of purified microglia. eNeuro. 9 (2), (2022).
- Gérard, A., et al. High-throughput single-cell activity-based screening and sequencing of antibodies using droplet microfluidics. Nature Biotechnology. 38 (6), 715-721 (2020).
- Vandereyken, K., Sifrim, A., Thienpont, B., Voet, T. Methods and applications for single-cell and spatial multi-omics. Nature Reviews. Genetics. 24, 494-515 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved