Method Article
Tek Çekirdekli Multiom Tahlilleri için Yüksek Kaliteli Beyin ve Kemik İliği Çekirdeği Hazırlığı
Bu Makalede
Özet
Tek hücreli/tek çekirdekli transkriptomiklerin ve multi-omiklerin başarısı büyük ölçüde hücrelerin/çekirdeklerin kalitesine bağlıdır. Bu nedenle, hücrelerin/çekirdeklerin dokudan izole edilmesi ve saflaştırılması yüksek düzeyde standartlaştırılmalıdır. Bu protokol, aşağı akış tek çekirdekli multiom testi için beyin ve kemik iliğinden çekirdeklerin hazırlanmasını açıklar.
Özet
Tek hücreli analiz, tek hücreli çözünürlük ile tedaviye veya enfeksiyona bireysel hücresel yanıtların değişkenliğini değerlendirmeyi gerektiren biyolojik süreçlerin karmaşıklığını çözmek için tercih edilen yaklaşım haline gelmiştir.
Son 10 yılda tek hücreli moleküler profilleme için birçok teknik geliştirildi ve birkaç özel teknoloji ticarileştirildi. 10X Genomik damlacık tabanlı tek hücreli profilleme, transkriptomik ve multi-omik tek hücreli profilleme için kullanıma hazır reaktifler sunan yaygın bir teknolojidir. Teknoloji, tek hücreli ve tek çekirdekli RNA dizilimi (sırasıyla scRNA-Seq ve snRNA-Seq), scATAC-Seq, tek hücreli bağışıklık profili oluşturma (BCR/TCR dizilimi) ve multiom için iş akışlarını içerir. İkincisi, aynı hücreden gelen transkripsiyonel (scRNA-Seq) ve epigenetik bilgiyi (scATAC-Seq) birleştirir.
Dokulardan izole edilen ve bu yaklaşımlardan herhangi biri ile analiz edilen tek hücreli veya tek çekirdekli süspansiyonların kalitesi (canlılığı, bütünlüğü, saflığı), yüksek kaliteli veriler üretmek için kritik öneme sahiptir. Bu nedenle, numune hazırlama protokolleri her biyolojik dokunun özelliklerine uyarlanmalı ve yüksek kaliteli hücre ve çekirdek süspansiyonlarının üretilmesini sağlamalıdır.
Bu makalede, aşağı akış multiomlu 10X Genomik boru hattı için beyin ve kemik iliği örneklerinin hazırlanmasına yönelik iki protokol açıklanmaktadır. Protokoller aşamalı olarak gerçekleştirilir ve hücre bölümleme ve barkodlama, kütüphane hazırlama ve dizileme için başlangıç materyali olarak kullanılan doku ayrışmasını, hücre sıralamasını, çekirdek izolasyonunu ve hazırlanmış çekirdek süspansiyonunun kalite kontrolünü kapsar. Bu standartlaştırılmış protokoller, yüksek kaliteli çekirdek kitaplıkları ve sağlam ve güvenilir veriler üretir.
Giriş
Uzun yıllar boyunca, tek hücreli teknikler biyolojik süreçlerin analizi için altın standart olmuştur. Başlangıçta mikroskopi, akış sitometrisi ve benzeri tahliller yoluyla tek hücreli fenotipleme ile sınırlıydılar. Tek hücreli analizde bir atılım, tek hücreli moleküler profilleme, özellikle tek tek hücrelerin tüm transkriptomunun karakterize edilmesini sağlayan tek hücreli RNA dizilimi (scRNA-Seq) yaklaşımlarının geliştirilmesiyle geldi. Son derece güçlü olan scRNA-Seq, belirli bir koşul ve zaman noktasındaki bir hücrenin transkripsiyonel durumu hakkında bilgi üretir. Bununla birlikte, transkripsiyonu yönlendiren gen regülasyonu veya zaman içinde meydana gelen moleküler modifikasyonlar hakkında görünürlük sağlamaz. Bu sınırlamanın üstesinden gelmek için, aynı hücreden birden fazla faktörün ve işleminanalizini sağlayan tek hücreli multi-omik tahlillerin geliştirilmesine birçok çaba harcanmıştır 1,2,3,4. Tek hücreler içindeki iki modalitenin ilk başarılı ölçümü, CITE-Seq yaklaşımında5 tek tek hücrelerin tam transkriptomu ile multipleks yüzey protein ekspresyon modellerinin bağlanmasıyla geldi. Daha yeni evrimler, gen ekspresyonunu kromatin erişilebilirliği ile birleştirir (Dizileme kullanarak Transpozaz Erişilebilir Kromatin Testi, ATAC-Seq), böylece aynı hücrelerde (örneğin, sci-CAR) aynı anda transkriptomik ve epigenomik modaliteleri yakalar6. Transkriptomiklerin hücre fenotipi veya aynı hücrenin epigenetik değişiklikleri ile ilişkilendirilmesine izin veren ilk ticari çözümler 10X Genomics'ten geldi.
Tek hücreli moleküler profilleme deneyleri aşağıdaki adımları içerir: (1) doku ayrışması veya tek hücreli süspansiyonların hazırlanması; (2) hücre saflaştırma ve/veya çekirdek izolasyonu; (3) bölümleme ve barkodlama; (4) kütüphane inşaatı ve kalite kontrolü; (5) yeni nesil dizileme; (6) veri analizi. Adımlar (3)-(6) kullanılan teknolojiye bağlı olarak önemli ölçüde değişebilse de, ilk adımlar genellikle hepsi için ortaktır. Hazırlanan hücre/çekirdek süspansiyonunun kalitesi, deneyin genel sonucunu belirleyecektir. Doku tipine bağlı olarak, yüksek kaliteli tek hücreli/çekirdek süspansiyonları elde etmek zor olabilir. Kalp, kas, beyin, akciğer, bağırsak ve diğerleri gibi bazı dokuların özellikleri, moleküler analiz için yüksek kaliteli çekirdeklerin üretimini garanti etmek için her bir numune tipine uyarlanmış doku bozulması ve çekirdek izolasyonu için yöntemler gerektirir 7,8,9,10. Doku parçalama yöntemleri ve ayrışma protokolleri mekanik, enzimatik (örneğin, kollajenaz ve DNaz karışımı) veya ikisinin bir kombinasyonu olabilir ve manuel olarak veya aletlerle (örneğin, Qiagen DSC-400, gentleMACS) gerçekleştirilebilir.
Tek hücreli teknikler, biyomedikal araştırmalar için tercih edilen bir araç haline gelmiştir. Nörobiyolojide, beyindeki hücre çeşitliliği ve işlevlerinin karmaşıklığı, nadir hücre popülasyonlarının görselleştirilmesi ve heterojenliklerinin değerlendirilmesi için yüksek çözünürlüklü ve yüksek verimli analiz gerektirir 11,12,13,14. Bireysel hücrelerin hücresel kimliğini ve gen düzenleyici mekanizmalarını birbirine bağlamak, beyin gelişimi ve fizyolojisi hakkında fikir verir. Başka bir örnek, güçlü bir şekilde tek hücreli analizlere dayanan enfeksiyöz, otoimmün veya kanser hastalıkları bağlamında bağışıklık tepkisi çalışmalarıdır. İmmün hücre alt kümelerinin heterojenliği ve aktivitelerinin karmaşıklığı ve diğer hücre tipleri ile etkileşimleri, immün yanıtın altında yatan mekanizmaların deşifre edilmesinde tek hücreli çözünürlük gerektirir. Bağışıklık hücreleri, hematopoietik progenitörlerin, kemik iliğinden periferdeki eve çıkmadan önce aşamalı bir süreç boyunca hücre yüzey belirteçlerini alan ve kaybeden kademeli olarak farklılaşan hücrelerden oluştuğu kemik iliğinden kaynaklanır. Tek hücreli analiz, hücresel gelişim aşamalarının dakika karakterizasyonuna izin verir. Geleneksel olarak çok parametreli akış sitometrisi ile gerçekleştirilen tek hücreli fenotipleme yoluyla elde edilebilir. Bununla birlikte, tek hücreli transkriptomik imzaların, progenitör hücre alt tiplerinin daha kesin bir şekilde tanımlanmasını ortaya çıkardığı gösterilmiştir, çünkü bu hücreler birbirine düşen kümeler halinde dağılmıştır ve bu nedenle kaba bir hücre yüzeyi işaretleyici yaklaşımı kullanıldığında yanlış tanımlanabilir15. Artan sayıda çalışma, hematopoietik kök ve progenitör hücrelerin (HSPC'ler) çeşitli ajanlara maruz kalmaktan elde edebileceği epigenetik modifikasyonları ortaya çıkarmakta ve bu da bağışıklık sisteminin uzun vadeli duyarlılığı üzerinde önemli bir etkiye yol açmaktadır 16,17,18,19. Yeni multi-omik teknolojileri, bu süreçlerin tek hücreli çözünürlükle incelenmesini sağlar.
Beyin 11,20,21,22 ve kemik iliği örnekleri23,24 için hücre ve çekirdek izolasyonu için birçok protokol tanımlanmıştır. Deneysel değişkenlikten kaynaklanan yanlılığı en aza indirmek için, ortak tek hücreli transkriptomik ve epigenomik dizileme için optimize edilmiş tek çekirdekli hazırlama protokollerini doğrulamak ve böylece tek hücreli multiomik testlerin tekrarlanabilirliğini sağlamak gerekir.
Burada, (1) taze dondurulmuş beyin dokusundan ve (2) aşağı akış tek hücreli Multiom analizi için taze kemik iliği HSPC'lerinden çekirdek hazırlığı için iki sağlam protokol açıklanmaktadır (Şekil 1).
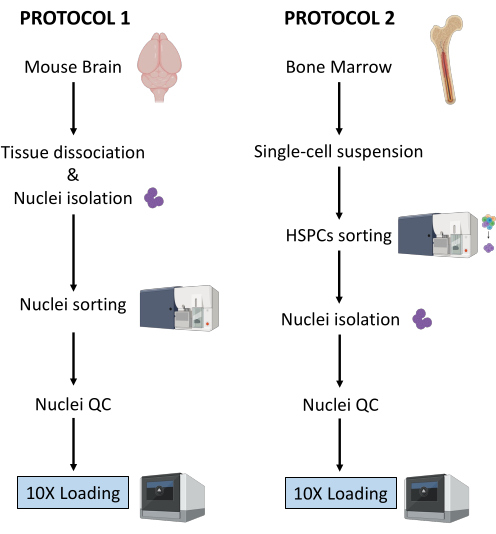
Şekil 1: Taze dondurulmuş beyin ve kemik iliği dokularından çekirdek izolasyonu için protokollerin şematik gösterimi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protokol
Deneysel prosedürler, Hayvan Deneylerinde Etik Komitesi (CETEA) tarafından onaylanan protokollerin sıkı mevzuata uygunluğu altında yürütülmüştür. Beyin çekirdeği izolasyonu için 3 aylık C57BL/6 fareler kullanıldı. Kemik iliği izolasyonu için 18 g ağırlığındaki 8 haftalık dişi C57BL/6J fareler kullanıldı.
1. Fare beyninden çekirdeklerin saflaştırılması
NOT: İşlem sırasında her zaman lateks veya nitril eldiven giyin. Deneyi iki kişinin yapması, 1'den 3'e kadar olan adımların (yani, tek çekirdek süspansiyonunun hazırlanması) bir kişi tarafından gerçekleştirilmesi ve 4. adımın (yani ayıklayıcının hazırlanması) başka bir kişi tarafından paralel olarak gerçekleştirilmesi şiddetle tavsiye edilir. Protokol zamana son derece duyarlı olduğundan, tek çekirdek süspansiyonu hazırlanır hazırlanmaz sıralayıcıyı hazır bulundurarak numune işleme süresini en aza indirmek çok önemlidir.
- Reaktiflerin ve malzemelerin hazırlanması
- Diseksiyon aletlerini otoklavda (121 °C'de 20 dakika) dikkatlice sterilize edin ve kullanmadan hemen önce %70 etanol ile yıkayın. Numune başına 2-3 mL buz gibi 1x Dulbecco'nun fosfat tamponlu salini (DPBS) ile doldurulmuş bir Petri kabı hazırlayın.
- Mikrosantrifüjü 4 °C'ye soğutun, bir kovayı buzla doldurun ve cam dounce homojenizatörü buzun üzerine koyun.
- Numune başına %0.01, 10 mL'lik bir nihai konsantrasyon için digitonin ekleyerek çekirdek lizis tamponu hazırlayın.
- Numune başına 0.2 U / μL, 20 mL'lik bir nihai konsantrasyon için hücre boyama tamponuna RNaz inhibitörleri ekleyerek boyama tamponunu hazırlayın.
- Numune başına 0.2 U / μL, 2 mL'lik bir nihai konsantrasyon için RNaz inhibitörleri ekleyerek DPBS% 0.04 BSA hazırlayın.
- Multiome protokolüne25 göre 1 mL seyreltilmiş çekirdek tamponu hazırlayın.
- Tüm reaktifleri ve numuneleri buz üzerinde tutun.
- Doku diseksiyonu
- Kurum tarafından onaylanan protokolleri kullanarak fareleri kurban edin. Bu protokolde, fareler aşırı dozda ketamin / ksilazin doz aşımından sonra dekapite edildi.
- Fare kafasını makasla kesin ve Meyerhoff ve ark.26'da anlatıldığı gibi beyni kafatasından çıkarın. Beyni hemen ışık yayan diyot (LED) aydınlatmalı stereo mikroskop altında buz gibi 1x DPBS ile hazırlanmış bir Petri kabına aktarın.
- Beynin ilgilendiği alanları (örneğin, Entorinal korteks, hipokampus, prefrontal korteks) ayırmak için beyin dokusunu bir neşter ile kesin ve her bölgeyi buz gibi 1x DPBS içeren ayrı bir Petri kabına aktarın. Buzda kal.
- Bir sonraki adımda homojenizasyonu kolaylaştırmak için bir neşter ile dokuyu <0,5 cm'lik parçalar halinde kıyın.
- Bir P1000 mikropipet ile kıyılmış dokuyu ve 1x DPBS'yi Petri kabından 1,5 mL'lik bir tüpe aktarın. Protein açısından düşük bağlayıcı plastikten yapılmış tüpler kullandığınızdan emin olun. Doku parçalarının yerçekimi ile ayrılmasına izin verin. Bir P1 mikropipet kullanarak 1000x DPBS'nin fazlalığını dikkatlice çıkarın.
NOT: Bu adımdan sonra, protein düşük bağlayıcı tüpleri kuru buza aktararak ve ardından çekirdek izolasyonuna geçene kadar -80 °C'de saklayarak kıyılmış dokuyu dondurmak mümkündür.
- Çekirdek izolasyonu
- Cam dounce'u %0.01 digitonin içeren 2 mL buz gibi soğuk çekirdek lizis tamponu ile doldurun. Doku parçalarını dounce'a ekleyin.
NOT: taze donmuş doku ile çalışıyorsanız, kıyılmış donmuş dokuyu doğrudan çekirdek lizis tamponuna% 0.01 digitonin ekleyin; Dokunun daha önce çözülmesine izin vermeyin. - Bir cam dounce doku homojenizatörü kullanarak 25 kez havaneli A ile ve ardından 25 kez havaneli B ile homojenize edin.
- % 0.01 digitonin içeren 2 mL buz gibi soğuk çekirdek lizis tamponu ekleyin ve 5 dakika buz üzerinde inkübe edin. Çekirdekleri 500 °C'de 5 dakika boyunca 4 x g'da santrifüjleyin.
- Süpernatanı bir mikropipetle çıkarın ve% 0.01 digitonin ile 4 mL buz gibi soğuk çekirdek lizis tamponu ekleyin. Buz üzerinde 5 dakika inkübe edin ve 40 μm'lik bir hücre süzgecinden süzün.
- Çekirdekleri 500 °C'de 5 dakika boyunca 4 x g'da santrifüjleyin ve süpernatanı bir mikropipetle çıkarın.
- Çekirdekleri yıkamak için 4 mL boyama tamponu ekleyin ve 500 x g'de 4 °C'de 5 dakika santrifüjleyin. Süpernatanı bir mikropipetle çıkarın ve peleti 4 mL boyama tamponunda yeniden süspanse edin.
- 40 μm'lik bir hücre süzgecinden geçirin ve 500 °C'de 5 dakika boyunca 4 x g'da santrifüjleyin. % 0.04 BSA ile 1 mL PBS'de yeniden süspanse edin.
- Farklı numuneler arasında doku/çekirdek hazırlığının tutarlılığını sağlamak için çekirdekleri sayın. Aynı beyin bölgelerinden benzer çekirdek sayıları elde edilmesi bekleniyor:
- Boş bir 0,5 mL tüpe 10 μL %0,4 tripan mavisi ekleyin. 10 μL çekirdek ekleyin ve pipetleme ile 5x karıştırın.
- Tedarikçinin tavsiyelerine uyarak otomatik bir hücre sayacı kullanarak çekirdekleri sayın. Çekirdekleri buz üzerinde tutun.
- Çekirdekleri sıralama için hazırlayın.
NOT: Ekstrakte edilen çekirdekler 7-AAD içerir ve bu boyama, floresanla aktive edilen hücre sıralayıcısı (FACS) ile saflaştırılmaları için kullanılır.- Boyanmamış kontrol için 100 μL çekirdeği bir FACS tüpüne aktarın. Kalan çekirdeğe 10 μL 7-AAD ekleyin ve 4 ° C'de 5 dakika tutun.
- Çiftleri ve kalıntıları ortadan kaldırmak için en az 0,5 x 106 çekirdeği FACS'ye göre sıralayın.
- Cam dounce'u %0.01 digitonin içeren 2 mL buz gibi soğuk çekirdek lizis tamponu ile doldurun. Doku parçalarını dounce'a ekleyin.
- FACS kullanarak çekirdek sıralama
NOT: Çekirdek ayıklama çok çeşitli hücre sıralayıcılarda gerçekleştirilebilirken, BD FACSAria Fusion veya BD FACSAria III cihazlarını kullanma prosedürü burada açıklanmıştır. Hücre sıralayıcının kalibrasyonunun ve kurulumunun gözetim altında veya cihazın deneyimli bir kullanıcısı tarafından yapılması şiddetle tavsiye edilir. Numune işleme süresini azaltmak için, tek çekirdek süspansiyonu hazırlanır hazırlanmaz ayıklayıcının hazır olması çok önemlidir.- FACS cihazının kalibrasyonu
- Hücre sıralayıcıyı ve bilgisayarı açın. Yazılım cihaza bağlandıktan sonra, akışkan başlatma prosedürünü başlatın. Ana menüde Sitometre > Fluidic başlatma'yı seçin ve dört adımı izleyin. Her birini tamamladıktan sonra Bitti'ye tıklayın.
- 70 μm'lik nozulu takın, akışı açın ve akışı 15 dakika stabilize etmeye bırakın. Damla oluşumunu elde etmek için genliği ayarlayın ve Sweet Spot'a tıklayın.
- Nötr yoğunluk (ND) filtresini 1.0 yerleştirin ve sitometre kurulum ve izleme (CST) arayüzünü açın.
- Günlük kalite kontrol: CST boncuklarını FACS ortamında seyreltin (tedarikçinin tavsiyelerine bakın) ve CST kontrolü gerçekleştirin. Tamamlandığında, ND 1.0'ı ND 2.0 ile değiştirin.
- Accudrops'u FACS ortamında seyreltin (tedarikçinin tavsiyelerine bakın) ve 6 ila 10. adımlarda açıklandığı gibi düşme gecikmesi gerçekleştirin.
- Deney şablonunda, Accudrop Düşme Gecikmesi deneyini seçin ve tüp için Sıralama Düzeni'ni açın.
- Alt kamera penceresinin içinde, saptırma plakalarına şarj uygulanmasını ve kameranın önünde belirli bir optik filtre kullanılmasını sağlamak için Voltaj'a ve ardından Optik Filtre'ye tıklayın. Sağ taraftaki çeyreğin 100'ü gösterdiğinden emin olun. Gerekirse, lazer etkisini optimize etmek için kırmızı lazer vidasını ayarlayın.
- Akış hızını saniyede 1.000 ila 3.000 olay hızına ulaşacak şekilde ayarlayın.
- Sırala ve İptal Et'e tıklayın. Sol çeyreğin 100'e eşit olduğundan ve sağ çeyreğin 0 olduğundan emin olun. Sol kadran 95'in altındaysa, Otomatik Gecikme gerçekleştirin.
- Voltaj'a ve ardından Test Sıralaması'na tıklayın. Toplama tüplerinde biriken yan akışların kalitesini kontrol edin. Gerekirse, kaydırıcıları hareket ettirerek yan akışların konumunu ayarlayın.
- Çekirdek ayıklama için FACS cihazının kurulması.
- Boyanmamış çekirdeklerin edinimine başlayın. Bunlar, ileri ve yan saçılmaları ve 7-ADD parametresi için dedektör voltajını tanımlamak için kullanılır. Parametreleri, boyanmamış örneğin 7-AAD sinyali, nokta grafiğindeki günlük ölçeğinin ilk on yılı içinde kalacak şekilde ayarlayın.
- 7-AAD ile boyanmış çekirdeklerin tüpünü edinmeye başlayın ve boyut ve taneciklik için (1) FSC-A/SCC-A ve ardından FSC-H/SSC-H'ye, (2) çiftler ayrımı için FSC-H/FSC-A'ya ve (3) 7-AAD pozitif çekirdekler için SSC-A/7-AAD'ye dayalı bir geçit stratejisi kullanarak çekirdek popülasyonlarını tanımlayın (bkz. Şekil 2A).
- Akışın ve sapmanın sabit olduğundan emin olun.
- Yan akış kamerasında, test sıralamasını açın, voltaj AÇIK ve sol tarafa takılan 1.5 mL'lik bir tüpte doğru damla sıralamasını onaylayın.
- Sıralama Düzeni penceresinde, 2. adımda (yukarıda) tanımlandığı gibi ilgilendiğiniz popülasyonu seçin. Hedef Olaylar'da, örnek başına en az 0,5 x 106 çekirdek elde etmek için Sürekli'de eşiği seçin. Hassasiyet altında, 4 Yönlü Saflık'ı seçin.
- Hazır olduğunuzda, çekirdek sıralamaya başlamak için Sırala ve Tamam'ı tıklayın.
- FACS cihazının kalibrasyonu
- Saflaştırılmış çekirdeklerin kalite kontrolü ve sayımı
NOT: Bu adım, 10X krom çipine yüklenecek sıralanmış çekirdeklerin saflığını test etmek amacıyla, yalnızca numune hazırlama adımlarının optimizasyonu için pilot deney sırasında yapılmalıdır. Protokol tamamen optimize edildikten sonra, düşük sayılarda bulunabilecek toplanan çekirdeklerin gereksiz yere israfını önlemek için takip deneylerinde bu kalite kontrol adımının gerçekleştirilmesi tavsiye edilmez.- Akış sitometrisi ile saflık kontrolü
- Sıralanan çekirdeklerin 10 μL'sini,% 2 ısıyla inaktive edilmiş Fetal Sığır Serumu (HI-FBS) ile 90 μL DPBS içeren yeni bir FACS tüpüne aktarın.
- Sıralama saflığını ve canlılığını doğrulamak için sıralama sonrası verileri alın ve kaydedin. Çekirdeklerin en az %98'inin 4.2'de tanımlandığı gibi ilgilenilen kapıda göründüğünden emin olun (bkz. Şekil 2B).
- Saflaştırılmış çekirdeklerin sayılması
- Sıralanmış çekirdekleri 500 x g'da ve 4 °C'de 5 dakika santrifüjleyin ve bir mikropipet kullanarak süpernatanı dikkatlice tamamen çıkarın. 100 μL seyreltilmiş çekirdek tamponunda yeniden süspanse edin.
- Boş bir 0,5 mL tüpe 10 μL %0,4 tripan mavisi ekleyin. Sıralanan çekirdeklerden 10 μL ekleyin ve pipetleme ile 5x karıştırın.
- Tedarikçinin tavsiyelerine uyarak otomatik bir hücre sayacı kullanarak çekirdekleri sayın. Çekirdek konsantrasyonunu 3.5 x 106 / mL'ye, yani 5 μL'de 16.000 çekirdeğe ayarlayın.
- Saflaştırılmış çekirdeklerin mikroskopi ile kalite kontrolü
NOT: Bu adım, yalnızca 10X krom çipine yüklenecek çekirdeklerin kalitesini test etmek için numune hazırlama adımlarının optimizasyonu için pilot deney sırasında yapılmalıdır. Protokol tamamen optimize edildikten sonra, düşük sayılarda bulunabilecek toplanan çekirdeklerin gereksiz yere israfını önlemek için takip deneylerinde bu kalite kontrol adımının gerçekleştirilmesi tavsiye edilmez.- Mikroskop lamlarının ve lamellerin temiz ve tozsuz olduğundan emin olun. Gerekirse, lamelleri mutlak etanol ile yıkayın ve durulayın ve tüy bırakmayan mendillerle kurulayın.
- Kullanılacak slayt kuyucuklarına 25 μL poli-l-lizin dağıtın ve tozdan korunarak oda sıcaklığında (RT) 10 dakika inkübe edin.
- Fazla poli-l-lizini çıkarın ve 10 μL saflaştırılmış çekirdek süspansiyonu ekleyin. RT'de tozdan korunarak 5 dakika inkübe edin.
- Kabarcıklardan kaçınarak her kuyucuğa bir damla montaj ortamı ekleyin.
- Tohumlanan kuyuların üzerine bir lamel yerleştirin. Kağıt mendillerle örtün ve fazla montaj ortamını çıkarmak için lamel sıkıca bastırın. Lameli hareket ettirmemeye dikkat edin ve fazla montaj ortamını temizlemeyin.
- Parlak alan ışığına ve minimum 40x büyütmeye sahip ters çevrilmiş bir mikroskopla birkaç görüntü çekin.
- Akış sitometrisi ile saflık kontrolü
- Çoklu tahlil yapın.
- Hemen Chromium Next GEM Tek Hücreli Çoklu ATAC + Gen İfadesi Kullanıcı Kılavuzuna (CG000338 - Rev F)25'e geçin.
2. Fare kemik iliği, hematopoietik kök ve progenitör hücrelerden (HSPC'ler) çekirdeklerin saflaştırılması
NOT: Bu protokol, kemik iliği HSPC'lerinin üç alt kümesinden çekirdeklerin saflaştırılmasını açıklar: soy-c-Kit+Sca-1+ hematopoietik kök hücreler (HSC), soy-c-Kit+Sca-1-CD34+FcγR- ortak miyeloid progenitörler (CMP) ve soy- c-Kit+Sca-1-CD34+FcγR+ granülosit-monosit progenitörleri (GMP). İşlem sırasında her zaman lateks veya nitril eldiven giyin. Bu protokol, 10X Genomik Gösterilmiş Protokol - Tek Hücreli Çoklu ATAC + GEX dizilimi için Çekirdek İzolasyonu (CG000365 - Rev C)27'nin bir uyarlamasıdır. Çekirdek geri kazanımını en üst düzeye çıkarmak için orijinal protokolde değişiklikler yapılmıştır. Deneyi iki kişinin yapması, 1. adımların olması şiddetle tavsiye edilir. 3'e kadar. (yani, tek hücreli çözeltinin hazırlanması) bir kişi tarafından gerçekleştirilir ve adım 4 (yani, sıralayıcının hazırlanması) başka bir kişi tarafından paralel olarak gerçekleştirilir. Protokol zamana son derece duyarlı olduğundan, tek hücreli süspansiyon hazırlanır hazırlanmaz sıralayıcıyı hazır hale getirerek numune işleme süresini en aza indirmek çok önemlidir.
- Reaktiflerin ve malzemelerin hazırlanması
- Bir kovayı buzla doldurun.
- FACS tamponunu hazırlayın:% 2 HI-FBS çözeltisi (6 numune için yaklaşık 500 mL) içeren DPBS ve 0,2 μm'lik bir filtreden süzün.
- Toplama ortamını hazırlayın: %10 HI-FBS solüsyonlu DPBS (numune başına 500 μL) ve 0,2 μm'lik bir filtreden süzün.
- Kemik iliği hücrelerinin izolasyonu
- Kurum tarafından onaylanan protokolleri kullanarak fareleri kurban edin. Bu deneyde, fareler ketamin / ksilazin doz aşımından sonra servikal çıkık ile sakrifiye edildi.
- Farelerin karnına ve arka bacaklarına% 70 etanol püskürtün.
- Alt karın ortasında küçük bir kesi yapmak için steril forseps ve makas kullanın ve peritonu arka bacakların tabanından diyaframa kadar açın (Ek Şekil 1).
- Açılan peritona dik olan her bir arka bacak için ek bir kesim yapın, ardından bu ek kesiklerden birinin her iki tarafını tutun ve her iki arka bacağın kaslarını ortaya çıkarmak için ayak bileği eklemini geçecek şekilde her iki arka bacaktan deriyi soymak için ayırın (Ek Şekil 1A).
- Femuru kesmeden bacağı kesmek için makası bir arka bacağın kalça ekleminde omurga boyunca hizalayın (Ek Şekil 1B, C). Aynısını diğer bacak için de tekrarlayın.
- Femuru izole etmek için, kas dokusunun çoğunu kesin, ardından femur ve tibiayı her iki elinizde parmak uçlarıyla eklemde tutun (Ek Şekil 1D, E). Tibiayı femurdan çıkarmak için bacağı doğal kıvrıma doğru hafifçe katlayın (Ek Şekil 1E) ve ardından femur ve tibiayı ayırmak için bağ dokusunu makasla dikkatlice kesin.
- Omurga ucunu femurun üst ucundan çıkarmak için makası hafif büküm hareketleriyle kullanın (Ek Şekil 1E).
- Kalan kas ve bağ dokusunu çıkarmak için izole edilmiş uyluk kemiğini kağıt mendille temizleyin.
- 2 mL DMEM (1x) + GlutaMAX-I ile iyice doldurulmuş 12 oyuklu bir plakada buz üzerinde soğuk tutun.
- Tüm femurlar toplandıktan sonra, kas ve fibröz dokuların kemikten tamamen çıkarıldığından emin olun. (a) İçindeki iliği steril tutmak ve (b) kuyudaki hücreleri kaybetmemek için kemiği kesmeyin. Haag ve Murthy28'den uyarlanan bir farenin iki uyluk kemiğinden hücreleri yıkamak için aşağıdaki adımları kullanın.
- Bir adet 1.5 mL ve bir adet 0.5 mL tüp hazırlayın. 1.5 mL'lik tüpe 150 μL FACS tamponu ekleyin, ardından 18 G'lik bir iğne kullanarak 0.5 mL'lik tüpün dibine bir delik açın ve 0.5 mL'lik tüpü 1.5 mL'lik tüpe yerleştirin.
- Fare cerrahi makası kullanarak her bir femurun distal kısmını açın (Ek Şekil 1F): Distal epifizi bıçaklar arasında kilitleyin ve kemiği sert bir şekilde kesmeden distal epifizi düzgün bir şekilde ayırmak için makası çevirirken hafif bir baskı uygulayın. Başarılı olursa, şimdi açıkta kalan fizis ucunda 4 çıkıntı görünmelidir (Ek Şekil 1G).
- İki uyluk kemiğini, açık ucu aşağı bakacak şekilde, FACS tamponu içeren 1,5 mL'lik bir tüpün içine yerleştirilmiş hazırlanmış 0,5 mL'lik tüpe yerleştirin (Ek Şekil 1H).
- 50 mL'lik bir tüpe 70 μm'lik bir hücre süzgeci yerleştirin ve süzgeci 2 mL FACS tamponu ile önceden ıslatın.
- Kemik iliğini yıkamak için, santrifüj 12.000 x g değerine ulaşana kadar tüpleri (kapaklar açık) 12.000 x g'da santrifüjleyin, ardından santrifüjü hemen durdurun.
- Kemik iliği hücrelerinin 1.5 mL'lik tüpte peletlendiğini ve femurların beyaz olduğunu doğrulayın (hücre yıkamadan önce kırmızıdır) (Ek Şekil 1I). 0.5 mL'lik tüpleri 2 femur ile atın.
- Bir pipet kullanarak 150 μL süpernatanı atın.
- Kırmızı kan hücrelerini parçalamak için peleti 1 mL Amonyum-Klorür-Potasyum (ACK) parçalama tamponunda 1-2 dakika boyunca bir mikropipetle yeniden süspanse edin. Çekirdekli hücrelerin canlılığının azalmasına neden olabileceğinden daha uzun inkübasyon sürelerinden kaçının.
- Önceden ıslatılmış 70 μm hücre süzgecinden 50 mL'lik tüpe aktarın.
- ACK parçalama tamponunu seyreltmek için 10 mL FACS tamponu ekleyin ve böylece lizizi durdurun.
- 400 °C'de 5 dakika boyunca 4 x g'da santrifüjleyin. Önce 1 mL'de yeniden süspanse ederek 10 mL FACS tamponunda yeniden süspansiyon yapın, ardından 9 mL ile doldurun.
- Hücreleri 1.3.8'de açıklandığı gibi sayım için hazırlayın.
- Tedarikçinin tavsiyelerine uyarak otomatik bir hücre sayacı kullanarak hücreleri sayın. 2 uyluk kemiğinden yaklaşık 40 milyon hücre toplanması bekleniyor.
- Kemik iliği HSPC'nin boyanması
- Hücreleri 400 x g'da 4 ° C'de 5 dakika santrifüjleyin ve peleti FACS tamponunda bir mikropipet ile 1 x 107 hücre / mL'lik bir nihai konsantrasyona kadar yeniden süspanse edin.
- Bir P1000 mikropipet ile, süspansiyonu 35 μm'lik bir hücre süzgeci kapağından süzerek bir FACS tüpüne aktarın.
- Hücre sıralayıcıda florokromların telafilerini ayarlamak için Tablo 1'de listelenen her antikor için tek lekeli test tüpü numuneleri hazırlayın:
- Antikor başına bir FACS tüpü hazırlayın ve tüpleri 200 μL PBS ile doldurun.
- Florokrom konjuge antikorun her bir FACS tüpüne 15 μL florokrom dengeleme boncukları ekleyin. Boyanmamış ve Canlı/Ölü tek lekeli hücreler için FACS tüplerinde boncuklar yerine 500.000 hücre ekleyin.
- Her bir florokrom konjuge antikorun 1 μL'sini (bakınız Tablo 1) karşılık gelen FACS tüpüne ekleyin. Live/Dead tek lekeli FACS tüpüne 0,5 μL Canlı/Ölü leke ekleyin.
- Işıktan koruyarak 15 dakika buz üzerinde tutun.
- Karışım 1 ve 2'yi Tablo 2'de gösterildiği gibi hazırlayın.
NOT: Tablo 2'de belirtilen antikor hacimleri, Malzeme Tablosunda atıfta bulunulan antikorlar için geçerlidir. Herhangi bir yeni antikor referansı veya aynı antikor referansının farklı bir lotu için optimize edilmeleri gerekir. - Numune tüpüne 300 μL Karışım 1 ekleyin, tekrar süspanse edin ve ışıktan korunan buz üzerinde 15 dakika tutun.
- Numune tüpüne 300 μL Karışım 2 ekleyin, tekrar süspanse edin ve ışıktan korunan buz üzerinde 20 dakika tutun.
- Tek lekeli tüplere ve Karışık lekeli numune tüplerine 3 mL FACS tamponu ekleyin. 4°C'de 5 dakika boyunca 400 x g'da döndürün.
- Süpernatanı bir mikropipet kullanarak dikkatlice atın ve peleti 500 μL FACS tamponunda yeniden süspanse edin.
- 500 μL toplama ortamı ile önceden doldurulmuş 1,5 mL'lik bir tüp hazırlayın.
NOT: Karışım 1, HI-FBS'den önemli ölçüde etkilenen Canlı/Ölü lekesini içerdiğinden DPBS'de hazırlanmıştır. Hücreler Canlı / Ölü ile boyandıktan sonra, HI-FBS içeren FACS tamponunda yeniden süspanse edilen florokrom konjuge antikorları içeren Mix 2 eklenir. Bunun tek istisnası, bir sonraki adımda eklenen diğer antikorların spesifik olmayan bağlanmasını önleyen Fc Reseptör blokeri olarak hizmet etmek üzere Antikor Karışımı 1'e dahil edilen anti-CD16/32 antikorudur.
- FACS kullanarak hücre sıralama
NOT: Hücre sıralaması çok çeşitli hücre sıralayıcılarda gerçekleştirilebilse de, burada BD FACSAria Fusion veya BD FACSAria III cihazlarını kullanma prosedürü açıklanmaktadır. Hücre sıralayıcının kalibrasyonunun ve kurulumunun gözetim altında veya cihazın deneyimli bir kullanıcısı tarafından yapılması şiddetle tavsiye edilir.- FACS cihazının kalibrasyonu: Protokol 1 adım 4.1'e bakın.
- Hücre sıralama için FACS cihazının kurulumu:
- Boyanmamış hücrelerin alımına başlayın. Bunlar, her bir florofor için ileri ve yan saçılmaları ve dedektör voltajını tanımlamak için kullanılır. Parametreleri, her bir floroforun floresan sinyali, nokta grafiğindeki log ölçeğinin ilk on yılı içinde kalacak şekilde ayarlayın.
- Kompanzasyonları manuel olarak ayarlamak için tek renk kontrolleri edinin (pozitif ve negatif popülasyonların medyanı hizalanmalıdır) veya otomatik hesaplama yazılımını kullanın (eğim ölçümleri). Kompanzasyon kontrollerinin deneysel florokromlar ve dedektör ayarlarıyla eşleştiğinden emin olun. Hücreler için 10.000 olay ve boncuklar için 5.000 olay kaydedin.
- Şekil 3A'da gösterilen geçit stratejisini kullanarak ilgilenilen hücre popülasyonlarını tanımlamak için numune tüpünü (yani çok lekeli hücreler) kullanın. 4 - 6 arasındaki adımları izleyin (aşağıda).
- İlgilenilen üç kemik iliği HSPC'sini (HSC, CMP ve GMP) tanımlamak için, lökositleri geçmek için boyut (FSC-A) ve taneciklik (SSC-A), ardından çiftleri ayırt etmek için FSC-H/FSC-A'yı kullanarak geçitlemeye başlayın.
- SSC-A / ölü hücre işaretleyicisine dayanarak, canlı hücreleri geçit edin. Köken negatif olan ve orta ila yüksek düzeyde c-Kit ifade eden hücreleri seçmek için Köken/c-Kit'i kullanın. c-Kit/Sca-1 aracılığıyla, ilgilenilen üç popülasyondan biri olan soy-c-Kit+ Sca-1+ (LKS+) HSC'lere geçit.
- Miyeloid progenitörler (soy-c-Kit+Sca-1-) arasında, CD34-FcγR-megakaryosit ve eritroid progenitörleri (MEP) dışlamak için FcγR/CD34 kullanılırken, CD34+ FcγR-CMP'nin yanı sıra CD34+FcγR+ GMP'yi de dahil edin sıralanacak hücre popülasyonlarında.
- Akışın ve sapmanın sabit olduğundan emin olun.
- Yan akış kamerasında, test sıralamasını açın, voltaj AÇIK ve sol tarafa takılan 1.5 mL'lik bir tüpte doğru damla sıralamasını onaylayın.
- Sıralama Düzeni penceresinde, ilgilendiğiniz popülasyonları seçin (yani, bu örnekte gösterilen "LKS+" ve "CD34+ miyeloid progenitörler"). Cihaz'ın altında 2 Tüp'ü seçin. Kesinlik altında, Saflık'ı seçin. Hedef Olaylar'da, 160.000 ile 200.000 LKS+ ve CD34+ miyeloid progenitörleri arasında sıralamak için Sürekli'yi seçin.
- Hücre süspansiyonuna 500 μL FACS tamponu ekleyin ve tüm hücrelerin alımdan hemen önce tek bir süspansiyonda olmasını sağlamak için numunenin 1 mL'sini yeni bir 35 μm hücre süzgeci kapaklı FACS tüpüne filtreleyerek aktarın. Bu, cihazı tıkayabilecek hücre kümelerini ortadan kaldırır.
- Hazır olduğunuzda, sıralamaya başlamak için Sırala ve Tamam'ı tıklayın. Hızı saniyede 10.000 olayın altında tutmak için Akış Hızını ayarlayın.
NOT: LKS+ 'nın CD34+ miyeloid progenitörlere beklenen oranı, kararlı bir durumda yetişkin (8-12 haftalık) bir C57BL/6J dişi fare için 1:3'tür. Hedeflenen sıralanmış hücre numaralarına genellikle sıralamadan sonraki 30 dakika içinde ulaşılır.
- Sıralanan hücrelerin kalite kontrolü ve sayımı
NOT: Bu adım, çekirdek izolasyonu için kullanılacak sıralanmış hücrelerin saflığını test etmek amacıyla, yalnızca numune hazırlama adımlarının optimizasyonu için pilot deney sırasında yapılmalıdır. Protokol tamamen optimize edildikten sonra, çekirdek izolasyonu için düşük sayılarda bulunabilecek başlangıç materyalinin gereksiz israfını önlemek için takip deneylerinde bu kalite kontrol adımının gerçekleştirilmesi tavsiye edilmez.- Akış sitometrisi ile saflık kontrolü
- Sıralanan hücrelerin 10 μL'sini 90 μL FACS tamponu içeren yeni bir FACS tüpüne aktarın.
- Sıralama saflığını ve canlılığını doğrulamak için sıralama sonrası verileri alın ve kaydedin. Hücrelerin en az %95'inin 3 - 6'da tanımlandığı ve Şekil 3B'de gösterildiği gibi ilgilenilen kapıda göründüğünden emin olun.
- Akış sitometrisi ile saflık kontrolü
- Sıralanmış kemik iliği HSPC'lerinden çekirdek izolasyonu
- Çekirdek geri kazanımını optimize etmek için aşağıdaki değişikliklerle birlikte 10X Genomik Gösterilen Protokol - Tek Hücreli Çoklu ATAC + GEX dizilimi için Çekirdek İzolasyonu (CG000365 - Rev C)27'den Ek'in "Düşük Hücre Girdili Çekirdek İzolasyonu" protokolünü kullanın:
- Lizis zamanı: Çekirdek izolasyonu için en iyi lizis zamanını belirlemek için bu protokol için bir pilot deney çalıştırın. Sağlam çekirdekleri korurken tam bir hücre lizisi elde ettiğinizden emin olun.
NOT: Yukarıda belirtilen 10X Genomik protokolü27'nin f adımı, "[Lizis Tamponunda] buz üzerinde 3-5 dakika inkübe etme" talimatını verir. Pilot deney sırasında, en az 3 dakika, 4 dakika ve 5 dakika boyunca test edin ve optimum lizis süresini seçmek için akış sitometrisi ve mikroskopi görüntüleme ile sayım ve kalite ile geri kazanılan çekirdek miktarını değerlendirin (aşağıdaki bu kalite kontrol kontrollerinin açıklamasına bakın). Reaktifleri yedeklemek için, pilot deneyde seyreltilmiş çekirdek tamponunu PBS %0.04 BSA ile değiştirin. Kemik iliği HSPC'leri için optimal lizis süresi 3 dakika olarak belirlendi. - Hücre santrifüjleri: Tüm hücre süspansiyon santrifüjleri için, 300 ° C'de 7 dakika boyunca (CG000365 - Rev C'de 5 dakika yerine) 27 x g'de 4 x g'da santrifüjleyin.
- Çekirdek santrifüjleri: Tüm çekirdek süspansiyon santrifüjlerini 500 x g'de 5 dakika boyunca CG000365 - Rev C27'ye göre gerçekleştirin.
- Çekirdek toplama: B adımında, 50 μL PBS %0.04 BSA içinde yeniden süspanse edildikten ve 0.2 mL'lik bir tüpe aktarıldıktan sonra, orijinal tüpe 50 μL PBS %0.04 BSA ekleyin ve kalan hücreleri toplamak için pipetle karıştırın. Toplam 100 μL hacme ulaşmak için 0,2 mL'lik tüpe aktarın.
- Bundan böyle, toplam hacim protokolün 50 μL'si yerine 100 μL olacaktır. Aşağı akış adımlarını buna göre ayarlayın (örneğin, adım d için 45 μL yerine 90 μL çıkarın; adım e için 90 μL yerine 45 μL lizis tamponu ekleyin).
- Adım m için, çekirdek peletini 7 μL yerine 12 μL seyreltilmiş çekirdek tamponunda yeniden süspanse edin.
- İzole edilmiş çekirdekleri sayın. Boş bir 0.5 mL tüpe 10 μL %0.4 tripan mavisi ve 8 μL PBS %0.04 BSA ekleyin.
- Tüpe 2 μL çekirdek ekleyin ve 1.3.8'de açıklandığı gibi çekirdekleri sayın. Tedarikçinin tavsiyelerine uygun olarak otomatik bir hücre sayacı kullanın.
- Lizis zamanı: Çekirdek izolasyonu için en iyi lizis zamanını belirlemek için bu protokol için bir pilot deney çalıştırın. Sağlam çekirdekleri korurken tam bir hücre lizisi elde ettiğinizden emin olun.
- Çekirdek geri kazanımını optimize etmek için aşağıdaki değişikliklerle birlikte 10X Genomik Gösterilen Protokol - Tek Hücreli Çoklu ATAC + GEX dizilimi için Çekirdek İzolasyonu (CG000365 - Rev C)27'den Ek'in "Düşük Hücre Girdili Çekirdek İzolasyonu" protokolünü kullanın:
- Akış sitometrisi ile saflık kontrolü
NOT: Bu adım, yalnızca 10X Chromium çipine yüklenecek çekirdeklerin saflığını test etmek için numune hazırlama adımlarının optimizasyonu için pilot deney sırasında yapılmalıdır. Protokol tamamen optimize edildikten sonra, düşük sayılarda bulunabilecek toplanan çekirdeklerin gereksiz yere israfını önlemek için takip deneylerinde bu kalite kontrol adımının gerçekleştirilmesi tavsiye edilmez.- Çekirdek izolasyonunu tamamladıktan sonra, 150 μL FACS tamponu ile önceden doldurulmuş yeni bir FACS tüpüne 6 μL çekirdek resüspansiyonu aktarın. 3 μL 7-AAD ekleyin ve buz üzerinde 5 dakika inkübe edin.
- Sıralama saflığını ve canlılığını doğrulamak için sıralama sonrası verileri alın ve kaydedin. Çekirdeklerin en az %95'inin Protokol 1 adım 4.2'de tanımlandığı gibi ilgilenilen kapıda göründüğünden emin olun (bkz. Şekil 4).
- Mikroskopi ile saflaştırılmış çekirdeklerin kalite kontrolü:
NOT: Bu adım, yalnızca 10X Chromium çipine yüklenecek çekirdeklerin kalitesini test etmek için numune hazırlama adımlarının optimizasyonu için pilot deney sırasında yapılmalıdır. Protokol tamamen optimize edildikten sonra, düşük sayılarda bulunabilecek toplanan çekirdeklerin gereksiz yere israfını önlemek için takip deneylerinde bu kalite kontrol adımının gerçekleştirilmesi tavsiye edilmez.- Adım 1.5.3'te açıklandığı gibi devam edin.
- Çoklu tahlil gerçekleştirin
- Hemen Chromium Next GEM Tek Hücreli Çoklu ATAC + Gen İfadesi Kullanıcı Kılavuzuna (CG000338 - Rev F)25'e geçin.
Sonuçlar
Yukarıda açıklanan iki protokol, iki farklı doku türünden başlayarak çekirdeklerin izolasyonunu detaylandırır. İki protokol arasındaki farklılıklar ve benzerlikler Şekil 1'de şematik olarak gösterilmiştir.
Fare beyninden çekirdeklerin saflaştırılması
Burada açıklanan protokolde, beyin örneklerinden çekirdek hazırlığı için nazik bir yöntem öneriyoruz. Beyin dokusunun bir lizis tamponunda mekanik olarak ayrışması ile başlar, ardından kalan dokuyu süspansiyondan çıkaran yıkama ve süzgeç filtreleme adımları ile devam eder. Enkazın, parçalanmamış hücrelerin ve küçük parçacıkların daha sonra uzaklaştırılması, aşağı akış Multiome protokolü için yalnızca saflaştırılmış çekirdeklerin yüklenmesini garanti etmek için FACS tarafından sağlanır. Şekil 2 , sıralamadan önce ve sonra çekirdeklerin profilini göstermektedir. Filtrelemeden sonra ve çekirdek tasnifinden önce, numune yüksek miktarda enkaz içerir ve "singletlerin" %99'undan fazlası nükleer leke (7-AAD) için pozitiftir ve bu da optimal hücre lizizini gösterir (Şekil 2A). Çekirdekler, 7-AAD pozitif kapısına göre sıralanır. Hazırlanan çekirdeklerin saflığını doğrulamak için sıralanmış malzemenin bir kısmı elde edilir. Şekil 2B , sıralamadan sonra beyin çekirdeğinin profilini göstermektedir. Çekirdek sıralaması, çekirdek saflığında başlangıçtaki %36'dan (Şekil 2A) neredeyse %100'e (Şekil 2B) bir artışa izin verdi.
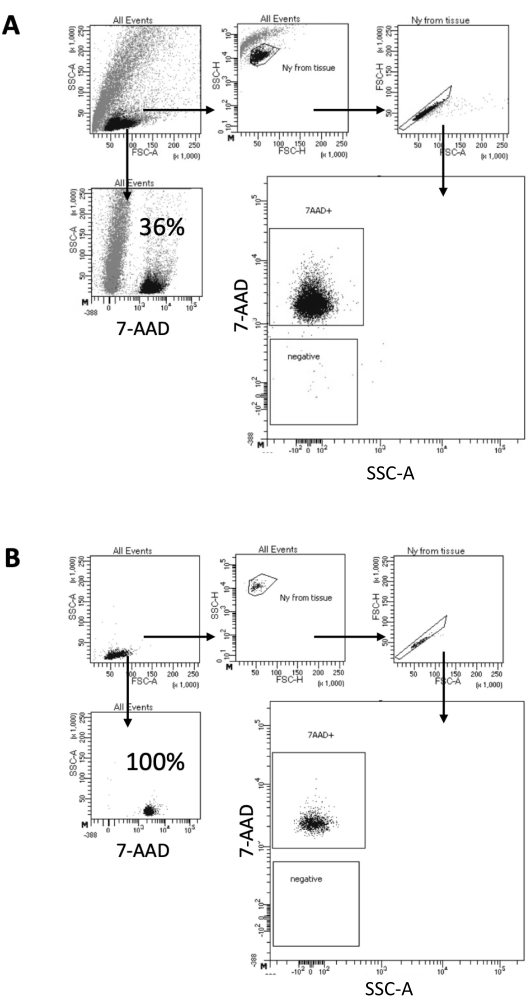
Şekil 2: Çekirdek ayıklama ve ayırma sonrası saflık testi için geçit stratejisi. Çekirdekler 7-AAD ile boyandı ve hücre sıralayıcısı tarafından elde edildi. (A) Çekirdekler ilk olarak boyutlarına ve taneciklerine göre kapılanır (sırasıyla FSC-A ve SSC-A). Tek parçacıklar daha sonra FSC-A / FSC-H özelliklerine ve 7-AAD boyamalarına göre seçilir. (B) Hücre tasnifinden sonra, toplama tüpünden alınan çekirdeklerin bir kısmı, A'dakiyle aynı geçit stratejisi kullanılarak saflık açısından test edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Fare kemik iliği hematopoetik kök hücre progenitörlerinin (HSPC'ler) saflaştırılması
Kemik iliğinden izole edildikten sonra, Şekil 3A'da gösterilen geçit stratejisine göre 2 x 105 HSPC'ye kadar FACS ile sıralanır. Ayıklama etkinliği ve numune saflığı değerlendirilir (Şekil 3B).
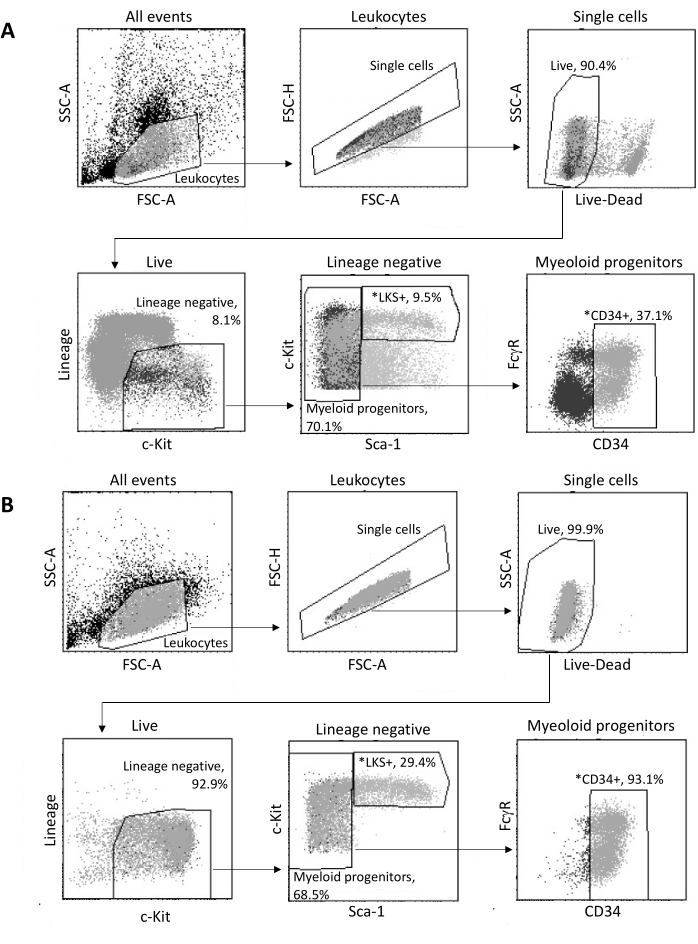
Şekil 3: Kemik iliği HSPC'lerinin sınıflandırılması için geçit stratejisi. (A) Çekirdek izolasyonu için canlı LKS+ hematopoietik kök hücreleri ve CD34+ miyeloid progenitörleri sıralamak için temsili bir FACS geçit stratejisi. (B) Sıralanmış hücre popülasyonu saflığının doğrulanması için kullanılan temsili FACS grafikleri. Gösterilen, ana popülasyona göre farklı hücre alt kümelerinin oranlarıdır. *Sıralanan iki popülasyon. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
"Düşük Hücre Girdili Çekirdek İzolasyonu" protokolü, maksimum 105 hücreli numunelerden çekirdek izolasyonuna izin verir. Az sayıda santrifüj adımı içerir, böylece hücre/çekirdek kaybını en aza indirir. Lizis ve yıkama tamponlarının hacmini hücre girdisiyle orantılı olarak ayarladık ve maksimum çekirdek geri kazanımı için santrifüj süresini artırdık. Geri kazanılan çekirdeklerin miktarını sayarak ve kalitelerini akış sitometrisi ve mikroskopi görüntüleme ile değerlendirmek için bir pilot deney gerçekleştirdik. Şekil 4 , hücre lizizinden sonra HSPC örneğini göstermektedir. Bu protokol, Şekil 5A'da gözlemlendiği gibi, aşağı akış multiom protokolünü etkileyebilecek herhangi bir kalıntı olmaksızın yüksek kaliteli çekirdekler üretti.
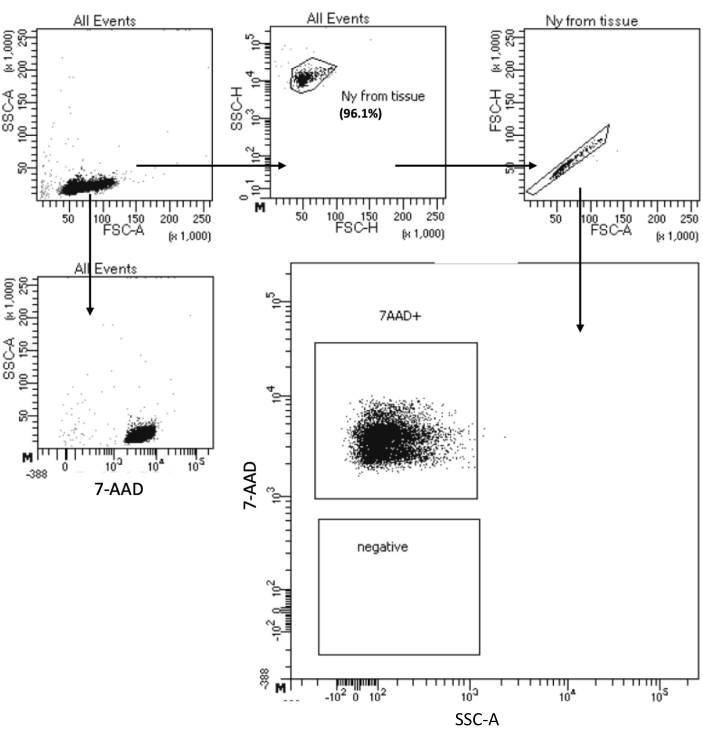
Şekil 4: İzole kemik iliği HSPC çekirdeklerinin saflık testi sıralaması. Çekirdekler 7-AAD ile boyandı ve hücre sıralayıcısı tarafından elde edildi. Çekirdekler, numunenin saflığını değerlendirmek için önce boyutlarına ve tanecikliklerine (sırasıyla FSC-A ve SSC-A) göre kapılandı. Çekirdeklerin oranı, ana popülasyona göre belirtilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Tüp numarası | Tüp adı | Lekeli varlık | Lekeli varlık miktarı | Antikor/boya (μL) | Toplama Tamponu (μL) |
| 1 | Lekesiz | Hücre | 5,00,000 | YOK | 200 |
| 2 | CANLI/ÖLÜ Sabitlenebilir Aqua Ölü Hücre Lekesi | Hücre | 5,00,000 | 0.5 | |
| 3 | APC/Siyanin 7 anti-fare CD16/32 (FcγR) | OneComp eBoncuklar | 15 μL | 1 | |
| 4 | Pasifik Mavisi anti-fare Lineage Kokteyli | OneComp eBoncuklar | 15 μL | 1 | |
| 5 | PE anti-fare Ly-6A/E (Sca-1) | OneComp eBoncuklar | 15 μL | 1 | |
| 6 | APC anti-fare CD117 (c-Kit) | OneComp eBoncuklar | 15 μL | 1 | |
| 7 | FITC anti-fare CD34 | OneComp eBoncuklar | 15 μL | 1 |
Tablo 1: Akış sitometresindeki kompanzasyon ayarları için tek leke kontrolleri. Gerekli tek leke kontrolleri, boyanacak hücre veya boncuk sayısı ve antikor miktarları belirtilir.
| Ana Karışım | Reaktif | Son seyreltme | Antikor/boya (μL) | Tampon tipi | Tampon (μL) |
| Karışım 1 | APC/Siyanin 7 anti-fare CD16/32 (FcγR) | 1/500 | 1.2 | DPBS (DPBS) | 300 |
| CANLI/ÖLÜ Sabitlenebilir Aqua Ölü Hücre Lekesi | 1/250 | 2.4 | |||
| Karışım 2 | Pasifik Mavisi anti-fare Lineage Kokteyli | 1/20 | 30 | FACS arabelleği | 300 |
| PE anti-fare Ly-6A/E (Sca-1) | 1/200 | 3 | |||
| APC anti-fare CD117 (c-Kit) | 1/200 | 3 | |||
| FITC anti-fare CD34 | 1/50 | 12 | |||
| Toplam boyama hacmi | 600 |
Tablo 2: Kemik iliği HSPC'leri için boyama karışımının bileşimi. 40 milyon hücre içeren bir numunenin boyanması için gerekli olan reaktif hacimleri gösterilmiştir. Daha fazla sayıda numuneyi boyamak için, belirtilen hacmi gerekli numune sayısıyla çarpın ve yeterli miktarda ana karışım sağlamak için fazladan numune hacminin yarısını ekleyin.
Ek Şekil 1: Kemik iliği hücre izolasyon protokolü. (A) Peritonu açın. Beyaz noktalı çizgiler kesilecek çizgiyi gösterir. (B) Arka bacağın derisini soyduktan sonra, uyluk kemiğini kesmeden bacağı kesmek için makası kalça ekleminde omurga boyunca hizalayın. (C) Kasın çıkarılmasından önce bacağın vücuttan ayrılmış görünümü. (D) Kasın çıkarılmasından sonra bacağın görünümü. (E) Femuru diz ekleminde, daha sonra kalça ekleminde, femurun kesilmemesine dikkat edilerek ayırma prosedürü. Beyaz kavisli oklar gerekli hareketi gösterir. Beyaz noktalı oklar, sıkıştırmak için makas kullanarak nazikçe ayrılacak alanı gösterir. (F) Kıkırdak ve distal epifizi makasla güvenli bir şekilde yakalayarak ve kemik iliğini ortaya çıkarmak için geri çevirerek femurun distal kısmını (yani diz ekleminde daha önce tibiaya bağlı olan kısmı) açma prosedürü. (G) Siyah oklarla gösterilen dört çıkıntı, açıkta kalan fizis ucunda görünür olmalıdır. (H) 150 μL FACS tamponu içeren 1,5 mL'lik bir tüpün içine yerleştirilmiş hazırlanmış 0,5 mL'lik tüpe açık ucu aşağı bakacak şekilde bir femurun görünümü. (I) 12.000 x g'da hızlı santrifüjlemeden sonra peletlenmiş kemik iliği hücrelerinin ve şimdi beyaz olan femurun görünümü. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Yüksek kaliteli hücre veya çekirdek süspansiyonunun hazırlanması, tek hücreli veya tek çekirdekli RNA-Seq ve tek hücreli multi-omik analizlerin başarısı için çok önemlidir 29,30,31. Burada, beyin ve kemik iliği olmak üzere iki tip dokudan multiom tahlilleri için numune hazırlama ve çekirdek izolasyonu protokollerini tanımladık.
Bu yazıda açıklanan beyin protokolü, taze dondurulmuş beyin dokusundan yüksek kaliteli çekirdeklerin geri kazanılmasına izin verir. Aşağıdaki adımları içerir: donmuş doku bozulması, çekirdeklerin izolasyonu, çekirdeklerin saflaştırılması ve hazırlanan materyalin kalite kontrolü. Beyin dokusu birçok farklı hücre tipinden oluşur ve doku ayrışması ve çekirdek izolasyonu prosedürü, ilk dokuda bulunan hücre popülasyonlarının oranlarını korumalıdır. Burada, lizis tamponu bileşimi ve inkübasyon süresi, dokuyu oluşturan tüm hücre popülasyonlarının tam ve nazik bir şekilde parçalanmasını sağlamak için optimize edildi.
Kemik iliği HSPCs protokolü biraz farklıdır, çünkü deneyin başlangıcında ilgilenilen hücre popülasyonunu heterojen bir hücresel süspansiyondan izole etmek için ek bir adım gerektirir. Taze doku toplandıktan sonra, kırmızı kan hücreleri parçalanır ve numune, ilgilenilen hücre alt kümesi için zenginleştirilir. Hedeflenen hücreler parçalanır, çekirdekler izole edilir ve hazırlanan malzemenin kalitesi kontrol edilir.
10X Genomics, çok sayıda farklı dokuda çekirdek izolasyonu için doğrulanmış çeşitli protokoller sağlar32,33. Şirket ayrıca, çekirdekleri doğrulanmış dokulardan izole etmek için basit bir boru hattına sahip bir çekirdek izolasyon kitini ticarileştirmektedir34. Bununla birlikte, bu protokollerin belirli örneklerin özelliklerini uyarlamak için ek optimizasyona ihtiyacı vardır. Bir örnek, düşük hücre girdisi ile çalışmayı gerektiren örneklerdir. Bu numuneler için en zorlu adımlar, numuneyi temizlemek için yeterince katı ve hücre/çekirdek kaybını önlemek için yeterince yumuşak olması gereken santrifüjlerdir. Burada açıklanan protokolle, bu iki gereksinim arasında ince bir denge bulmak için 10X Genomik Gösterilmiş Protokolü - Tek Hücreli Çoklu ATAC + GEX Dizileme (CG000365 - Rev C)27 için Çekirdek İzolasyonu'nu uyarladık. Sıralanmış HSPC'lerden çekirdeklerin hazırlanması örneğinde gösterildiği gibi, numunenin kalitesi üzerinde hiçbir etkisi olmadan çekirdek geri kazanımını iyileştirdik.
Ek bir zorluk, çekirdek izolasyonu için saflaştırılmış hücrelerin parçalanması adımıdır. Daha sert lizis koşulları ve daha uzun inkübasyon süreleri çekirdeklere zarar verebilir ve böylece dizileme verilerinin kalitesini etkileyebilir. Şekil 5 , lizis tamponu ile farklı inkübasyon süreleri üzerine kemik iliği örneklerinden temsili çekirdek görüntülemeyi gösterir ve hücre lizizine bağlı olarak çekirdeklerin durumunun ne kadar farklı olabileceğini gösterir. HSPC'ler örneğinde, sağlıklı görünümlü, sağlam çekirdeklerin en yüksek oranı ve hasarlı çekirdeklerin en düşük oranı ile sonuçlanan durum olarak 3 dakikalık lizizi belirledik. Lizis inkübasyon süreleri, her yeni numune türü için optimize edilmelidir.
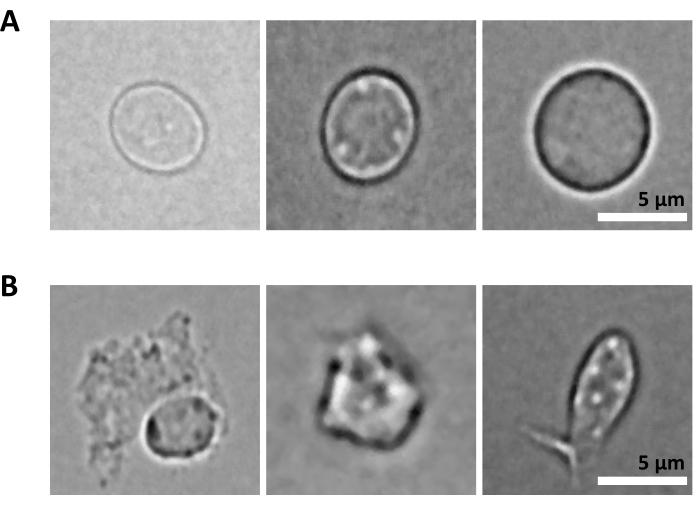
Şekil 5: Mikroskopi ile çekirdek kalite kontrolü. Fare kemik iliğinden izole edilmiş çekirdeklerin (A) sağlam ve (B) hasarlı çekirdeklere sahip temsili parlak alan görüntüleri gösterilmiştir. Ölçek çubuğu 5 μm. Görüntüler, 40x ELWD NA 0.60 objektif ve 1.5x dijital zoom kullanılarak ters mikroskopla çekildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Bu çalışmada detaylandırılan her iki protokol de, hedeflenen hücrelerin veya çekirdeklerin yüksek verimli FACS cihazları ile saflaştırılmasına dayanır. Bu adım, nadir hücre alt kümelerinin heterojen süspansiyonlardan izole edileceği tek hücreli/çekirdek hazırlama protokolleri için çok önemlidir. Bunlarda, HSPC'lerin sınıflandırılması için burada gösterilen örnekte olduğu gibi, ilgilenilen hücre popülasyonu üzerinde "geçitlemeyi" etkinleştirmek için yüksek boyutlu bir akış sitometri paneli gerekebilir. Sıralama son derece hızlı ve doğrudur, bu da sıralanan hücre alt kümelerinin %95'in üzerinde saflığa yol açar. Bu yaklaşım, hücresel süspansiyonu 70 psi'ye kadar bir basınca maruz bırakır ve bu nedenle, hücre zarlarının yırtılmasına neden olabileceğinden, kırılgan hücrelerin (örneğin, dendritik hücreler, nötrofiller) sınıflandırılması için sınırlayıcı olabilir. Bu durumlarda, manyetik ayıklama, yeni nesil aletlerin uygulanması (örneğin, CellenOne, Cellenion; MACSQuant Tyto, Miltenyi)35,36 veya damlacık tabanlı sistemler (ör. ODIN, Sensific)37. Bununla birlikte, dakikalar yerine saatlerce süren hücre sıralaması ile bu teknolojilerin yavaş sıralama hızı, bu yaklaşımların Multiome ve büyük hücre sayılarının analizine dayanan diğer tek hücreli uygulamalar için canlı hücrelerin hazırlanmasında uygulanması için güçlü bir sınırlayıcı faktördür.
Dokudan izole edilen çekirdeklerin saflaştırılması için FACS, verimi ve izole edilen materyalin saflığı nedeniyle tercih edilen yöntemdir. Çekirdekler basınca duyarlı değildir ve filtrelenmiş doku izolatları hücre sıralayıcısı aracılığıyla kolayca saflaştırılabilir. Laboratuvarda bir FACS cihazı yoksa, biraz daha az verimli ancak yeterince iyi olan başka alternatifler de mevcuttur. Örnekler arasında ultrasantrifüjleme veya akustik dalgalar kullanarak parçacıkları boyut farklılıklarına göre ayıran MARS (Uygulamalı Hücre) gibi küçük ekipmanların kullanımı; Hücre/çekirdek süspansiyonlarının hidrofobik özelliklerini kullanan CURIOX laminer yıkayıcı; veya hücrelerin enkazdan ayrılması için fiziksel özelliklerine (levitasyon) dayanan LEVITAS bio.
Burada, çok sayıda çekirdek ve aşağı akış Multiome protokolü için en iyi saflığı elde etmek için protokolleri açıklıyoruz. FACS ayıklama ve tekrarlanan santrifüj adımları, ilk malzemenin önemli ölçüde kaybolmasına neden olur. Bu nedenle, burada tarif ettiğimiz beyinden çekirdek hazırlama protokolünde, FACS sıralamasından sonra en az 500.000 çekirdeğin toplanmasıyla sonuçlanacak kadar bol miktarda başlangıç materyali gerekir. Bu kriterin karşılanamaması durumunda alternatif protokoller uygulanmalıdır. Nadir hücre popülasyonları veya küçük doku bölümleri ile çalışırken, mevcut başlangıç materyali miktarı sınırlayıcı bir faktör olabilir. Bu sorunu çözmek için, (a) lizis hacmini azaltarak, (b) yıkama hacmini azaltarak, (c) düşük hücre girdili çekirdek izolasyonu için 10X Genomik protokollerinde belirtildiği gibi geri kazanımı iyileştirmeye çalışmak için uzatılmış santrifüj süresine sahip tek bir yıkama kullanarak çekirdek geri kazanımını iyileştirmek mümkündür. Düşük içerikli malzemenin multiomik analizi için, çok daha az girdi numunesi gerektiren scNMT, SNARE-seq ve Paired-seq38 gibi plaka tabanlı uygulamaları dikkate almaya değer.
Özetle, beyinden çekirdeklerin hazırlanması ve aşağı akış Multiom analizi için kemik iliği HSPC'leri için iki sağlam protokol tanımladık. Bu protokoller, sorulan bilimsel sorudan bağımsız olarak, bu iki doku türünden yüksek kaliteli tek çekirdekli süspansiyonlar gerektiren herhangi bir bilimsel projede uygulanabilir. Grubumuz, çeşitli hedeflenen genlerin inaktivasyonu üzerine beyin gelişimi çalışmalarında ve nörolojik hastalıklar bağlamında immün yanıt çalışmalarında beyin çekirdeği izolasyon protokolünü uygulamaktadır. Kemik iliği çekirdeği izolasyon protokolünü çeşitli hematopoietik alt popülasyonların immün sistemin oluşumuna katılımını deşifre etmek için kullanıyoruz.
Açıklamalar
Yazarların açıklayacak hiçbir şeyi yok.
Teşekkürler
Ana Jeemin Choi, Pasteur - Paris Üniversitesi (PPU) Uluslararası Doktora Programı'ndan bir bursla desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 18 G x 1 ½ (1.2 mm x 38 mm) Agani needles | Terumo | AN*1838S1 | |
| 15 mL tubes | Falcon | 352097 | |
| 5 mL round bottom FACS tube with cell strainer cap 35 µm | falcon | 352235 | |
| 50 mL tubes | Falcon | 352070 | |
| 7-AAD | BD pharmagen | 559925 | |
| ACK Lysing Buffer | Gibco | A10492-01 | |
| APC anti-mouse CD117 (c-Kit) | BioLegend | 105812 | Clone: 2B8 |
| APC/Cyanine 7 anti-mouse CD16/32 (FcγR) | BioLegend | 101328 | Clone: 93 |
| BD FACSAria III | BD Biosciences | non-applicable | |
| BD FACSDiva Software v8.0.1 | BD Biosciences | non-applicable | |
| Bovine Serum Albumin stock solution 10% | Miltenyi Biotec | 130-091-376 | |
| Cell staining buffer | Biolegend | 420201 | |
| CFI Suprplan Fluor ELWD 40XC ON 0.6 | Nikon | non-applicable | |
| CMOS camera Prime 95B 25 mm | Photometrix | non-applicable | |
| Countess II FL Automated Cell Counter | Invitrogen | AMQAF1000 | |
| Countess cell counting chamber slide | Invitrogen | C10283 | |
| Coverglass 24 mm x 24 mm 0.13-0.17 mm | Brand | BR470819 | |
| Digitonine 5% | Invitrogen | BN2006 | |
| Disposable Scalpels | Swann-Morton | 0508 | |
| DMEM (1x) + GlutaMAX-I | Gibco | 31966-021 | |
| DPBS (10x) | Gibco | 14200-067 | |
| DTT | Sigma aldrich | 646563 | |
| Epifluorescence inverted microscope Nikon Ti2 -E | Nikon | non-applicable | |
| Eppendorf Safe-Lock Tubes 0.5 mL | Eppendorf | 30123603 | |
| Ethanol 70% | VWR | 83801.290 | |
| FITC anti-mouse CD34 | Invitrogen | 11-0341-85 | Clone: RAM34 |
| Forceps for dissection | FST | 11152-10 | |
| Heat-inactivated Fetal Bovine Serum (FBS) | Gibco | 11533387 | |
| Dounce Homogeniser 2 mL | Bellco glass | 1984-10002 | Pestle “A” Large Clearance: .0030-.0050″ and Pestle “B” Small Clearance: .0005-.0025″ |
| LIVE/DEAD fixable aqua dead cell stain kit | Invitrogen | L34957 | |
| Magnesium chloride solution 1 M | Sigma aldrich | M1028 | |
| Microcentrifuge | Eppendorf | 5424R | |
| Mounting medium Fluoromount-G | invitrogen | 00-4958-02 | |
| Nonidet P40 substitute | Sigma aldrich | 74385 | |
| Nuclease free water | ThermoFischer | AM9932 | |
| Nuclei buffer 20x | 10X Genomics | 2000153/2000207 | |
| Nuclei isolation kit EZ prep | Sigma Aldrich | NUC-101 | |
| OneComp eBeads compensation beads | Invitrogen | 01-1111-41 | |
| Pacific Blue anti-mouse lineage cocktail (including anti-mouse CD3, Ly-6G/Ly-6C, CD11b, CD45R/B220, TER-119) | BioLegend | 133310 | Clones (in the same order as the antibodies listed): 17A2, RB6-8C5, M1/70, RA3-6B2, Ter-119 |
| PCR Tube Strips 0.2 mL | Eppendorf | 951010022 | |
| PE anti-mouse Ly-6A/E (Sca-1) | BioLegend | 122507 | Clone: E13-161.7 |
| Petri dish 100 mm x 20 mm OPTILUX | Falcon | 353003 | |
| Ply-L-lysine 0.01% sterile-filtered suitable for cell culture | Sigma | P4707 | |
| Printed microscope slides 8 well 6 mm numbered | Epredia | ER-301B-CE24 | |
| Protein LoBind Tubes 1.5 mL | Eppendorf | 30108116 | |
| Recombinant Rnase inhibitor 5000 U | Takara | 2313A | |
| Scissors for dissection | FST | 14090-09 | |
| Sodium chloride solution 5 M | Sigma aldrich | 59222C | |
| Syringe filters, PES, 0.2 µm | Fisher Scientific | 15206869 | |
| Transparent nail polish | any | non-applicable | |
| Trizma Hydrochloride solution pH 7.4 | Sigma aldrich | T2194 | |
| Trypan Blue 0.4% | gibco | 15250061 | |
| Tween 20 | Biorad | 1662404 | |
| UltraPure Distilated Water Dnase/Rnase Free | Invitrogen | 10977-035 |
Referanslar
- Clark, S. J., et al. scNMT-seq enables joint profiling of chromatin accessibility DNA methylation and transcription in single cells. Nature Communications. 9 (1), 781(2018).
- Lee, J., Hyeon, D. Y., Hwang, D. Single-cell multiomics: technologies and data analysis methods. Experimental & Molecular Medicine. 52 (9), 1428-1442 (2020).
- Cerrizuela, S., et al. High-throughput scNMT protocol for multiomics profiling of single cells from mouse brain and pancreatic organoids. STAR Protocols. 3 (3), 101555(2022).
- Dimitriu, M. A., Lazar-Contes, I., Roszkowski, M., Mansuy, I. M. Single-cell multiomics techniques: From conception to applications. Frontiers in Cell and Developmental Biology. 10, 854317(2022).
- Stoeckius, M., et al. Simultaneous epitope and transcriptome measurement in single cells. Nature Methods. 14 (9), 865-868 (2017).
- Cao, J., et al. Joint profiling of chromatin accessibility and gene expression in thousands of single cells. Science (New York, N.Y.). 361 (6409), 1380-1385 (2018).
- Narayanan, A., et al. Nuclei Isolation from Fresh Frozen Brain Tumors for Single-Nucleus RNA-seq and ATAC-seq. Journal of Visualized Experiments: JoVE. (162), e61542(2020).
- Kim, M., et al. Single-nucleus transcriptomics reveals functional compartmentalization in syncytial skeletal muscle cells. Nature Communications. 11 (1), 6375(2020).
- Santos, M. D., et al. Extraction and sequencing of single nuclei from murine skeletal muscles. STAR Protocols. 2 (3), 100694(2021).
- Safabakhsh, S., et al. Isolating nuclei from frozen human heart tissue for single-nucleus RNA sequencing. Current Protocols. 2 (7), e480(2022).
- Lau, S. -F., Cao, H., Fu, A. K. Y., Ip, N. Y. Single-nucleus transcriptome analysis reveals dysregulation of angiogenic endothelial cells and neuroprotective glia in Alzheimer's disease. Proceedings of the National Academy of Sciences of the United States of America. 117 (41), 25800-25809 (2020).
- Armand, E. J., Li, J., Xie, F., Luo, C., Mukamel, E. A. Single-cell sequencing of brain cell transcriptomes and epigenomes. Neuron. 109 (1), 11-26 (2021).
- Morabito, S., et al. Single-nucleus chromatin accessibility and transcriptomic characterization of Alzheimer's disease. Nature Genetics. 53 (8), 1143-1155 (2021).
- Chen, S., et al. Spatially resolved transcriptomics reveals genes associated with the vulnerability of middle temporal gyrus in Alzheimer's disease. Acta Neuropathologica Communications. 10 (1), 188(2022).
- Paul, F., et al. Transcriptional heterogeneity and lineage commitment in myeloid progenitors. Cell. 163 (7), 1663-1677 (2015).
- Kaufmann, E., et al. BCG educates hematopoietic stem cells to generate protective innate immunity against tuberculosis. Cell. 172 (1-2), 176-190.e19 (2018).
- Christ, A., et al. Western diet triggers NLRP3-dependent innate immune reprogramming. Cell. 172 (1-2), 162-175.e14 (2018).
- Moorlag, S. J. C. F. M., et al. β-Glucan Induces protective trained immunity against mycobacterium tuberculosis infection: A key role for IL-1. Cell Reports. 31 (7), 107634(2020).
- de Laval, B., et al. C/EBPβ-dependent epigenetic memory induces trained immunity in hematopoietic stem cells. Cell Stem Cell. 26 (5), 657-674.e8 (2020).
- Renthal, W., et al. Characterization of human mosaic Rett syndrome brain tissue by single-nucleus RNA sequencing. Nature Neuroscience. 21 (12), 1670-1679 (2018).
- Yang, A. C., et al. A human brain vascular atlas reveals diverse mediators of Alzheimer's risk. Nature. 603 (7903), 885-892 (2022).
- Lee, D. R., Zhang, Y., Rhodes, C. T., Petros, T. J. Generation of single-cell and single-nuclei suspensions from embryonic and adult mouse brains. STAR Protocols. 4 (1), 101944(2022).
- Corces, M. R., et al. Lineage-specific and single-cell chromatin accessibility charts human hematopoiesis and leukemia evolution. Nature Genetics. 48 (10), 1193-1203 (2016).
- Ranzoni, A. M., et al. Integrative single-cell RNA-seq and ATAC-seq analysis of human developmental hematopoiesis. Cell Stem Cell. 28 (3), 472-487.e7 (2021).
- 10X Genomics Chromium Next GEM Single Cell Multiome ATAC + Gene Expression User Guide, Document Number CG000338 Rev F. , At https://www.10xgenomics.com/support/single-cell-multiome-atac-plus-gene-expression/documentation/steps/library-prep/chromium-next-gem-single-cell-multiome-atac-plus-gene-expression-reagent-kits-user-guide (2022).
- Meyerhoff,, et al. Microdissection of mouse brain into functionally and anatomically different regions. Journal of Visualized Experiments: JoVE. (168), e61941(2021).
- 10X Genomics 10X Genomics Demonstrated Protocol - Nuclei Isolation for Single Cell Multiome ATAC + GEX sequencing (CG000365 - Rev C). , At https://www.10xgenomics.com/support/single-cell-multiome-atac-plus-gene-expression/documentation/steps/sample-prep/nuclei-isolation-for-single-cell-multiome-atac-plus-gene-expression-sequencing (2022).
- Haag, S., Murthy, A. Murine monocyte and macrophage culture. Bio-Protocol. 11 (6), e3928(2021).
- Haque, A., Engel, J., Teichmann, S. A., Lönnberg, T. A practical guide to single-cell RNA-sequencing for biomedical research and clinical applications. Genome Medicine. 9 (1), 75(2017).
- Jiang, P. Quality control of single-cell RNA-seq. Methods in Molecular Biology (Clifton, N.J). 1935, 1-9 (2019).
- Regan, C., Preall, J. Practical considerations for single-cell genomics. Current Protocols. 2 (8), e498(2022).
- 10X Genomics 10X Genomics Demonstrated Protocol - Nuclei Isolation for Single Cell ATAC Sequencing (CG000169 - Rev E). , At https://www.10xgenomics.com/support/single-cell-atac/documentation/steps/sample-prep/nuclei-isolation-for-single-cell-atac-sequencing (2022).
- 10X Genomics 10X Genomics Demonstrated Protocol - Nuclei Isolation from Complex Tissues for Single Cell Multiome ATAC + Gene Expression Sequencing. (CG000375 - Rev C). , At https://www.10xgenomics.com/support/single-cell-multiome-atac-plus-gene-expression/documentation/steps/sample-prep/nuclei-isolation-from-complex-tissues-for-single-cell-multiome-atac-plus-gene-expression-sequencing (2022).
- 10X Genomics 10X Genomics - Chromium Nuclei Isolation Kit (CG000505 - Rev A). , At https://www.10xgenomics.com/support/single-cell-gene-expression/documentation/steps/sample-prep/chromium-nuclei-isolation-kit-sample-prep-user-guide (2022).
- Shomroni, O., et al. A novel single-cell RNA-sequencing approach and its applicability connecting genotype to phenotype in ageing disease. Scientific Reports. 12 (1), 4091(2022).
- Ocañas, S. R., Pham, K. D., Blankenship, H. E., Machalinski, A. H., Chucair-Elliott, A. J., Freeman, W. M. Minimizing the ex vivo confounds of cell-isolation techniques on transcriptomic and translatomic profiles of purified microglia. eNeuro. 9 (2), (2022).
- Gérard, A., et al. High-throughput single-cell activity-based screening and sequencing of antibodies using droplet microfluidics. Nature Biotechnology. 38 (6), 715-721 (2020).
- Vandereyken, K., Sifrim, A., Thienpont, B., Voet, T. Methods and applications for single-cell and spatial multi-omics. Nature Reviews. Genetics. 24, 494-515 (2023).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır