Method Article
Préparation de noyaux de cerveau et de moelle osseuse de haute qualité pour les dosages multiomes à noyau unique
Dans cet article
Résumé
Le succès de la transcriptomique unicellulaire/mononoyau et de la multi-omique dépend en grande partie de la qualité des cellules/noyaux. Par conséquent, l’isolement des cellules/noyaux des tissus et leur purification doivent être hautement standardisés. Ce protocole décrit la préparation des noyaux du cerveau et de la moelle osseuse pour l’essai multiome à noyau unique en aval.
Résumé
L’analyse unicellulaire est devenue l’approche de choix pour démêler la complexité des processus biologiques qui nécessitent d’évaluer la variabilité des réponses cellulaires individuelles au traitement ou à l’infection avec une résolution unicellulaire.
De nombreuses techniques de profilage moléculaire unicellulaire ont été développées au cours des 10 dernières années, et plusieurs technologies dédiées ont été commercialisées. Le profilage unicellulaire à base de gouttelettes 10X Genomics est une technologie répandue qui offre des réactifs prêts à l’emploi pour le profilage transcriptomique et multi-omique de cellules uniques. La technologie comprend des flux de travail pour le séquençage de l’ARN unicellulaire et mononoyau (scRNA-Seq et snRNA-Seq, respectivement), le scATAC-Seq, le profilage immunitaire unicellulaire (séquençage BCR/TCR) et le multiome. Ce dernier combine des informations transcriptionnelles (scRNA-Seq) et épigénétiques (scATAC-Seq) provenant de la même cellule.
La qualité (viabilité, intégrité, pureté) des suspensions unicellulaires ou mononoyaux isolées des tissus et analysées par l’une ou l’autre de ces approches est essentielle pour générer des données de haute qualité. Par conséquent, les protocoles de préparation des échantillons doivent être adaptés aux particularités de chaque tissu biologique et assurer la génération de suspensions cellulaires et noyaux de haute qualité.
Cet article décrit deux protocoles de préparation d’échantillons de cerveau et de moelle osseuse pour le pipeline multiome 10X Genomics en aval. Les protocoles sont exécutés par étapes et couvrent la dissociation des tissus, le tri cellulaire, l’isolement des noyaux et le contrôle de la qualité de la suspension des noyaux préparés qui est utilisée comme matériau de départ pour le partitionnement cellulaire et le codage à barres, la préparation de la bibliothèque et le séquençage. Ces protocoles standardisés produisent des banques de noyaux de haute qualité et des données robustes et fiables.
Introduction
Depuis de nombreuses années, les techniques unicellulaires sont la référence en matière d’analyse des processus biologiques. Ils ont d’abord été limités au phénotypage unicellulaire par microscopie, cytométrie en flux et tests similaires. Une percée dans l’analyse unicellulaire est venue avec le développement d’approches pour le profilage moléculaire de cellules uniques, en particulier le séquençage de l’ARN unicellulaire (scRNA-Seq) qui a permis de caractériser l’ensemble du transcriptome des cellules individuelles. Très puissant, scRNA-Seq génère des informations sur l’état transcriptionnel d’une cellule dans une condition et un moment spécifiques. Cependant, il n’offre pas de visibilité sur la régulation des gènes qui régit la transcription, ni sur les modifications moléculaires qui se produisent au fil du temps. Pour surmonter cette limitation, de nombreux efforts ont été investis dans le développement de tests multi-omiques unicellulaires qui permettent l’analyse de plusieurs facteurs et processus à partir d’une même cellule 1,2,3,4. La première mesure réussie de deux modalités au sein de cellules individuelles a été obtenue en reliant des modèles d’expression de protéines de surface multiplex avec le transcriptome complet de cellules individuelles dans l’approche CITE-Seq5. Des évolutions plus récentes combinent l’expression des gènes avec l’accessibilité de la chromatine (Assay for Transposase-Accessible Chromatin using sequencing, ATAC-Seq), capturant ainsi simultanément les modalités transcriptomiques et épigénomiques dans les mêmes cellules (par exemple, sci-CAR)6. Les premières solutions commerciales permettant d’associer la transcriptomique au phénotype cellulaire ou aux modifications épigénétiques d’une même cellule sont issues de 10X Genomics.
Les expériences de profilage moléculaire unicellulaire comportent les étapes suivantes : (1) dissociation tissulaire ou préparation de suspensions unicellulaires ; (2) la purification cellulaire et/ou l’isolement des noyaux ; (3) le cloisonnement et les codes à barres ; (4) la construction de bibliothèques et le contrôle de la qualité ; (5) le séquençage de nouvelle génération ; (6) Analyse des données. Bien que les étapes (3) à (6) puissent varier considérablement en fonction de la technologie utilisée, les étapes initiales sont généralement communes à toutes. La qualité de la suspension cellule/noyaux préparée déterminera le résultat global de l’expérience. Selon le type de tissu, il peut être difficile d’obtenir des suspensions unicellulaires/noyaux de haute qualité. Les particularités de certains tissus, tels que le cœur, le muscle, le cerveau, le poumon, l’intestin, etc., nécessitent des méthodes de rupture tissulaire et d’isolement des noyaux adaptées à chaque type d’échantillon afin de garantir la production de noyaux de haute qualité pour l’analyse moléculaire 7,8,9,10 . Les méthodes de perturbation tissulaire et les protocoles de dissociation peuvent être mécaniques, enzymatiques (par exemple, un mélange de collagénases et de DNase) ou une combinaison des deux, et peuvent être effectués manuellement ou par des instruments (par exemple, Qiagen DSC-400, gentleMACS).
Les techniques unicellulaires sont devenues un outil de choix pour la recherche biomédicale. En neurobiologie, la diversité cellulaire dans le cerveau et la complexité de leurs fonctions nécessitent une analyse à haute résolution et à haut débit pour la visualisation des populations de cellules rares et pour l’évaluation de leur hétérogénéité 11,12,13,14. Le lien entre l’identité cellulaire et les mécanismes de régulation des gènes des cellules individuelles permet de mieux comprendre le développement et la physiologie du cerveau. Un autre exemple est celui des études sur la réponse immunitaire dans le contexte des maladies infectieuses, auto-immunes ou cancéreuses, qui reposent fortement sur des analyses unicellulaires. L’hétérogénéité des sous-ensembles de cellules immunitaires et la complexité de leur activité et de leurs interactions avec d’autres types de cellules nécessitent une résolution unicellulaire pour déchiffrer les mécanismes sous-jacents à la réponse immunitaire. Les cellules immunitaires proviennent de la moelle osseuse, où les progéniteurs hématopoïétiques sont composés de cellules qui se différencient progressivement et qui acquièrent et perdent des marqueurs de surface cellulaire tout au long d’un processus par étapes avant de quitter la moelle osseuse pour s’installer à la périphérie. L’analyse unicellulaire permet une caractérisation minutieuse des stades de développement cellulaire. Il peut être obtenu par phénotypage unicellulaire, classiquement réalisé par cytométrie en flux multiparamétrique. Cependant, il a été démontré que les signatures transcriptomiques d’une seule cellule révèlent une identification plus précise des sous-types de cellules progénitrices, car ces cellules sont distribuées en grappes qui s’imbriquent les unes dans les autres et peuvent donc être mal identifiées lors de l’utilisation d’une approche de marqueur de surface cellulaire grossière15. De plus en plus d’études mettent en évidence les modifications épigénétiques que les cellules souches et progénitrices hématopoïétiques (HSPC) peuvent acquérir lors de l’exposition à divers agents, ce qui a un impact significatif sur la réactivité à long terme du système immunitaire 16,17,18,19. Les nouvelles technologies multi-omiques permettent d’étudier ces processus avec une résolution à cellule unique.
De nombreux protocoles d’isolement de cellules et de noyaux ont été décrits pour les échantillons de cerveau 11,20,21,22 et de moelle osseuse 23,24. Pour minimiser les biais dus à la variabilité expérimentale, il est nécessaire de valider des protocoles optimisés de préparation de noyaux uniques pour le séquençage transcriptomique et épigénomique unicellulaire conjoint, assurant ainsi la reproductibilité des tests multiomiques unicellulaires.
Ici, deux protocoles robustes pour la préparation de noyaux à partir (1) de tissus cérébraux frais congelés et (2) de HSPC de moelle osseuse fraîche pour l’analyse Multiome unicellulaire en aval sont décrits (Figure 1).
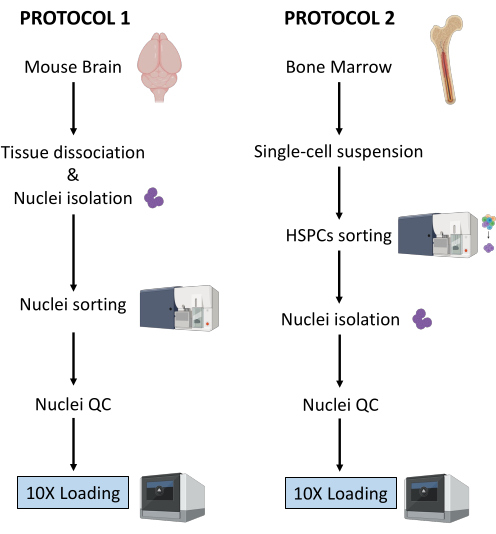
Figure 1 : Représentation schématique des protocoles d’isolement des noyaux à partir de tissus de cerveau et de moelle osseuse fraîchement congelés. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocole
Les procédures expérimentales ont été menées dans le strict respect réglementaire des protocoles approuvés par le Comité d’éthique de l’expérimentation animale (CETEA). Pour l’isolement des noyaux cérébraux, des souris C57BL/6 âgées de 3 mois ont été utilisées. Pour l’isolement de la moelle osseuse, des souris femelles C57BL/6J âgées de 8 semaines pesant 18 g ont été utilisées.
1. Purification des noyaux du cerveau de souris
REMARQUE : Portez des gants en latex ou en nitrile en tout temps pendant la procédure. Il est fortement conseillé d’avoir deux personnes pour réaliser l’expérience, pour que les étapes 1 à 3 (c’est-à-dire la préparation de la suspension de noyaux uniques) soient effectuées par une seule personne, et que l’étape 4 (c’est-à-dire la préparation du trieur) soit effectuée en parallèle par une autre personne. Étant donné que le protocole est très sensible au facteur temps, il est essentiel de minimiser le temps de traitement des échantillons en préparant le trieur dès que la suspension de noyaux uniques est préparée.
- Préparation des réactifs et des matériaux
- Stérilisez soigneusement les outils de dissection en autoclave (à 121 °C pendant 20 min) et lavez-les à l’éthanol à 70% juste avant utilisation. Préparez une boîte de Pétri par échantillon, remplie de 2 à 3 mL de solution saline glacée 1x Dulbecco’s phosphate-buffered (DPBS).
- Refroidissez la microcentrifugeuse à 4 °C, remplissez un seau de glace et mettez l’homogénéisateur à dounce en verre sur de la glace.
- Préparer le tampon de lyse des noyaux en ajoutant de la digitonine pour obtenir une concentration finale de 0,01 %, 10 mL par échantillon.
- Préparer le tampon de coloration en ajoutant des inhibiteurs de la RNase au tampon de coloration cellulaire pour obtenir une concentration finale de 0,2 U/μL, 20 mL par échantillon.
- Préparer le DPBS 0,04 % BSA en ajoutant des inhibiteurs de la RNase pour une concentration finale de 0,2 U/μL, 2 mL par échantillon.
- Préparer 1 mL de tampon de noyaux dilués selon le protocole Multiome25.
- Conservez tous les réactifs et les échantillons sur de la glace.
- Dissection tissulaire
- Sacrifiez les souris en utilisant des protocoles approuvés par l’établissement. Dans ce protocole, les souris ont été décapitées après une surdose de kétamine/xylazine.
- Coupez la tête de la souris avec des ciseaux et retirez le cerveau du crâne comme décrit dans Meyerhoff et al.26. Transférez immédiatement le cerveau dans une boîte de Pétri préparée avec le 1x DPBS glacé sous un stéréomicroscope éclairé par diodes électroluminescentes (LED).
- Coupez le tissu cérébral à l’aide d’un scalpel pour séparer les zones d’intérêt du cerveau (par exemple, le cortex entorhinal, l’hippocampe, le cortex préfrontal) et transférez chaque région dans une boîte de Pétri séparée contenant 1x DPBS glacé. Garder sur la glace.
- À l’aide d’un scalpel, émincez le tissu en morceaux de <0,5 cm pour faciliter l’homogénéisation à l’étape suivante.
- À l’aide d’une micropipette P1000, transférez le tissu haché et le 1x DPBS de la boîte de Pétri dans un tube de 1,5 ml. Assurez-vous d’utiliser des tubes en plastique à faible liaison aux protéines. Laissez les morceaux de tissu se séparer par gravité. Retirez délicatement l’excédent de 1x DPBS à l’aide d’une micropipette P1000.
REMARQUE : Après cette étape, il est possible de congeler le tissu haché en transférant les tubes à faible liaison protéique sur de la glace sèche, puis en les stockant à -80 °C jusqu’à ce que l’on procède à l’isolement des noyaux.
- Isolement des noyaux
- Remplir la cuvette en verre avec 2 mL de tampon de lyse des noyaux glacés avec 0,01 % de digitonine. Ajoutez les morceaux de mouchoirs dans la dounce.
REMARQUE : si vous travaillez avec des tissus frais congelés, ajoutez le tissu congelé haché directement dans le tampon de lyse des noyaux 0,01% digitonine ; Ne laissez pas le tissu décongeler avant. - Homogénéiser à l’aide d’un homogénéisateur de tissu en verre 25 fois avec le pilon A, puis 25 fois avec le pilon B. Transférer l’homogénéat dans un tube de 15 mL.
- Ajouter 2 mL supplémentaires de tampon de lyse des noyaux glacés avec 0,01 % de digitonine et incuber sur glace pendant 5 minutes. Centrifuger les noyaux à 500 x g pendant 5 min à 4 °C.
- Retirer le surnageant à l’aide d’une micropipette et ajouter 4 mL de tampon de lyse des noyaux glacés contenant 0,01 % de digitonine. Incuber sur de la glace pendant 5 min et filtrer à travers une passoire à cellules de 40 μm.
- Centrifuger les noyaux à 500 x g pendant 5 min à 4 °C et retirer le surnageant à l’aide d’une micropipette.
- Ajouter 4 mL de tampon colorant pour laver les noyaux et centrifuger à 500 x g pendant 5 min à 4 °C. Retirer le surnageant à l’aide d’une micropipette et remettre la pastille en suspension dans 4 mL de tampon de coloration.
- Filtrer à travers une crépine de 40 μm et centrifuger à 500 x g pendant 5 min à 4 °C. Remettre en suspension dans 1 mL de PBS avec 0,04 % de BSA.
- Compter les noyaux pour assurer l’uniformité de la préparation des tissus/noyaux dans les différents échantillons. On s’attend à ce qu’il obtienne un nombre de noyaux similaire à partir des mêmes régions du cerveau :
- Ajouter 10 μL de bleu de trypan à 0,4 % dans un tube vide de 0,5 mL. Ajouter 10 μL de noyaux et mélanger 5 fois par pipetage.
- Compter les noyaux à l’aide d’un compteur de cellules automatisé en suivant les recommandations du fournisseur. Gardez les noyaux sur de la glace.
- Préparer les noyaux pour le tri.
REMARQUE : Les noyaux extraits incorporent du 7-AAD, et cette coloration est utilisée pour leur purification par trieur de cellules activées par fluorescence (FACS).- Transférez 100 μL de noyaux dans un tube FACS pour le contrôle non coloré. Ajouter 10 μL de 7-AAD aux noyaux restants et maintenir 5 min à 4 °C.
- Trier un minimum de 0,5 x 106 noyaux par FACS pour éliminer les doublets et les débris.
- Remplir la cuvette en verre avec 2 mL de tampon de lyse des noyaux glacés avec 0,01 % de digitonine. Ajoutez les morceaux de mouchoirs dans la dounce.
- Tri des noyaux à l’aide d’un FACS
REMARQUE : Bien que le tri des noyaux puisse être effectué sur une grande variété de trieurs de cellules, la procédure d’utilisation des instruments BD FACSAria Fusion ou BD FACSAria III est décrite ici. Il est fortement recommandé que l’étalonnage et la configuration du trieur de cellules soient effectués sous la supervision ou par un utilisateur expérimenté de l’instrument. Pour réduire le temps de traitement des échantillons, il est essentiel que le trieur soit prêt dès que la suspension de noyaux uniques est préparée.- Étalonnage de l’instrument FACS
- Allumez le trieur de cellules et l’ordinateur. Une fois le logiciel connecté à l’instrument, lancez la procédure de démarrage fluidique. Sélectionnez Cytomètre > démarrage fluidique dans le menu principal et suivez les quatre étapes. Cliquez sur Terminé après avoir terminé chacune d’entre elles.
- Insérez la buse de 70 μm, allumez le jet et laissez le jet se stabiliser pendant 15 min. Ajustez l’amplitude pour obtenir la formation de gouttes et cliquez sur Sweet Spot.
- Placez le filtre à densité neutre (N.D) 1.0 et ouvrez l’interface de configuration et de suivi du cytomètre (CST).
- Contrôle de qualité quotidien : Diluer les billes de CST dans un milieu FACS (voir les recommandations du fournisseur) et effectuer le contrôle CST. Une fois terminé, remplacez le N.D 1.0 par le N.D 2.0.
- Diluez Accudrops dans un milieu FACS (voir les recommandations du fournisseur) et effectuez un délai de goutte comme décrit aux étapes 6 à 10.
- Dans le modèle d’expérience, sélectionnez l’expérience Accudrop Drop Delay et ouvrez la mise en page de tri du tube.
- Dans la fenêtre inférieure de la caméra, cliquez sur Tension , puis sur Filtre optique pour activer l’application de la charge sur les plaques de déviation et l’utilisation d’un filtre optique spécifique devant la caméra. Assurez-vous que le quadrant sur le côté droit indique 100. Si nécessaire, ajustez la vis laser rouge pour optimiser l’impact du laser.
- Ajustez le débit pour atteindre la vitesse de 1 000 à 3 000 événements par seconde.
- Cliquez sur Trier et annuler. Assurez-vous que le quadrant gauche est égal à 100 et que le quadrant droit est égal à 0. Si le quadrant gauche est inférieur à 95, effectuez l’option Délai automatique.
- Cliquez sur Tension, puis sur Tri des tests. Contrôlez la qualité du dépôt des flux latéraux dans les tubes de collecte. Si nécessaire, ajustez la position des flux latéraux en déplaçant les curseurs.
- Mise en place de l’instrument FACS pour le tri des noyaux.
- Commencer l’acquisition des noyaux non colorés. Ceux-ci sont utilisés pour définir les diffusions directes et latérales, ainsi que la tension du détecteur pour le paramètre 7-ADD. Réglez les paramètres de manière à ce que le signal 7-AAD de l’échantillon non coloré se situe à l’intérieur de la première décade de l’échelle logarithmique sur le graphique à points.
- Commencez à acquérir le tube des noyaux colorés par 7-AAD et définissez les populations de noyaux en utilisant une stratégie de déclenchement basée sur (1) FSC-A/SCC-A puis FSC-H/SSC-H pour la taille et la granularité, (2) FSC-H/FSC-A pour la discrimination des doublets, et (3) SSC-A/7-AAD pour les noyaux positifs 7-AAD (voir Figure 2A).
- Assurez-vous que le jet et la déviation sont stables.
- Dans la caméra à flux latéral, activez le tri de test, la tension activée et confirmez le tri précis des gouttes dans un tube de 1,5 ml monté sur le côté gauche.
- Dans la fenêtre Mise en page de tri , sélectionnez la population d’intérêt, telle que définie à l’étape 2 (ci-dessus). Dans Evénements cibles, sélectionnez le seuil dans Continu pour obtenir un minimum de 0,5 x 106 noyaux par échantillon. Sous Précision, sélectionnez Pureté à 4 voies.
- Une fois prêt, cliquez sur Trier et sur OK pour commencer le tri des noyaux.
- Étalonnage de l’instrument FACS
- Contrôle de la qualité et comptage des noyaux purifiés
REMARQUE : Cette étape ne doit être effectuée que pendant l’expérience pilote pour l’optimisation des étapes de préparation des échantillons, dans le but de tester la pureté des noyaux triés qui doivent être chargés sur la puce de chrome 10X. Une fois que le protocole est entièrement optimisé, il n’est pas conseillé d’effectuer cette étape de contrôle de la qualité dans les expériences de suivi afin d’éviter le gaspillage inutile des noyaux collectés qui peuvent être disponibles en faible nombre.- Contrôle de la pureté par cytométrie en flux
- Transférer 10 μL des noyaux triés dans un nouveau tube FACS contenant 90 μL de DPBS avec 2 % de sérum de veau fœtal inactivé par la chaleur (HI-FBS).
- Acquérir et enregistrer les données post-tri pour vérifier la pureté et la viabilité du tri. S’assurer qu’au moins 98 % des noyaux apparaissent dans la porte d’intérêt, telle que définie à la section 4.2 (voir la figure 2B).
- Compter les noyaux purifiés
- Centrifuger les noyaux triés pendant 5 min à 500 x g et à 4 °C et retirer soigneusement le surnageant à l’aide d’une micropipette. Remise en suspension dans 100 μL de tampon de noyaux dilués.
- Ajouter 10 μL de bleu de trypan à 0,4 % dans un tube vide de 0,5 mL. Ajouter 10 μL des noyaux triés et mélanger 5x par pipetage.
- Compter les noyaux à l’aide d’un compteur de cellules automatisé en suivant les recommandations du fournisseur. Ajustez la concentration des noyaux à 3,5 x 106/mL, c’est-à-dire 16 000 noyaux par 5 μL.
- Contrôle de la qualité des noyaux purifiés par microscopie
REMARQUE : Cette étape ne doit être effectuée que pendant l’expérience pilote pour optimiser les étapes de préparation des échantillons afin de tester la qualité des noyaux qui doivent être chargés sur la puce de chrome 10X. Une fois que le protocole est entièrement optimisé, il n’est pas conseillé d’effectuer cette étape de contrôle de la qualité dans les expériences de suivi afin d’éviter le gaspillage inutile des noyaux collectés qui peuvent être disponibles en faible nombre.- Assurez-vous que les lames de microscope et les lamelles de recouvrement sont propres et exemptes de poussière. Si nécessaire, lavez et rincez les lamelles avec de l’éthanol absolu et séchez-les avec des lingettes non pelucheuses.
- Distribuer 25 μL de poly-l-lysine dans les puits coulissants qui seront utilisés et incuber pendant 10 min à température ambiante (RT), à l’abri de la poussière.
- Retirez l’excès de poly-l-lysine et ajoutez 10 μL de suspension de noyaux purifiés. Incuber pendant 5 min à RT, à l’abri de la poussière.
- Ajoutez une goutte de milieu de montage dans chaque puits, en évitant les bulles.
- Placez une lamelle au-dessus des puits ensemencés. Couvrir de lingettes en papier et appuyer fermement sur la lamelle pour retirer l’excédent de support de montage. Veillez à ne pas déplacer la lamelle et à ne pas nettoyer l’excès de support de montage.
- Prenez plusieurs images avec un microscope inversé avec une lumière à fond clair et un grossissement minimum de 40x.
- Contrôle de la pureté par cytométrie en flux
- Effectuer un test multiome.
- Passez immédiatement au Guide de l’utilisateur de Chromium Next GEM Single Cell Multiome ATAC + Gene Expression (CG000338 - Rev F)25.
2. Purification des noyaux des cellules souches hématopoïétiques et progénitrices de la moelle osseuse de souris (HSPC)
NOTE Ce protocole décrit la purification des noyaux de trois sous-ensembles de cellules souches hématopoïétiques (CSH) de la lignée c-Kit + Sca-1+ Sca-1+, des progéniteurs myéloïdes communs (CMP) de la lignée c-Kit + Sca-1-CD34 + FcγR - et de la lignée c-Kit + Sca-1-CD34 + FcγR+ progéniteurs granulocytes-monocytes (GMP). Portez des gants en latex ou en nitrile en tout temps pendant la procédure. Ce protocole est une adaptation du 10X Genomics Demonstration Protocol - Nuclei Isolation for Single Cell Multiome ATAC + GEX sequencing (CG000365 - Rev C)27. Des modifications ont été introduites dans le protocole original afin de maximiser la récupération des noyaux. Il est fortement conseillé d’avoir deux personnes qui réalisent l’expérience, pour avoir les étapes 1. à 3. (c’est-à-dire la préparation de la solution unicellulaire) effectuée par une personne, et l’étape 4 (c’est-à-dire la préparation du trieur) effectuée en parallèle par une autre personne. Étant donné que le protocole est très sensible au facteur temps, il est essentiel de minimiser le temps de traitement des échantillons en préparant le trieur dès que la suspension à cellule unique est préparée.
- Préparation des réactifs et des matériaux
- Remplissez un seau de glaçons.
- Préparer le tampon FACS : DPBS avec une solution HI-FBS à 2 % (environ 500 mL pour 6 échantillons) et filtrer à travers un filtre de 0,2 μm.
- Préparer le milieu de prélèvement : DPBS avec une solution HI-FBS à 10 % (500 μL par échantillon) et filtrer à travers un filtre de 0,2 μm.
- Isolement des cellules de la moelle osseuse
- Sacrifiez les souris en utilisant des protocoles approuvés par l’établissement. Dans cette expérience, les souris ont été sacrifiées par luxation cervicale après une surdose de kétamine/xylazine.
- Vaporisez l’abdomen et les pattes arrière des souris avec 70 % d’éthanol.
- À l’aide d’une pince et de ciseaux stériles, faites une petite incision au milieu du bas-ventre et ouvrez le péritoine de la base des pattes postérieures jusqu’au diaphragme (figure supplémentaire 1).
- Faites une incision supplémentaire pour chaque patte arrière perpendiculaire au péritoine ouvert, puis saisissez l’un ou l’autre côté de l’une de ces entailles supplémentaires et écartez-la pour décoller la peau des deux pattes arrière au-delà de l’articulation de la cheville afin d’exposer les muscles des deux pattes arrière (figure supplémentaire 1A).
- Alignez les ciseaux le long de la colonne vertébrale au niveau de l’articulation de la hanche d’une patte arrière pour couper la patte sans couper le fémur (figure supplémentaire 1B, C). Répétez la même chose pour l’autre jambe.
- Pour isoler le fémur, découpez la majeure partie du tissu musculaire, puis tenez le fémur et le tibia dans chaque main avec le bout des doigts au niveau de l’articulation (figure supplémentaire 1D, E). Pliez doucement la jambe contre la courbure naturelle pour disloquer le tibia du fémur (figure supplémentaire 1E), puis coupez soigneusement le tissu conjonctif avec des ciseaux pour séparer le fémur et le tibia.
- Utilisez les ciseaux avec de légers mouvements de torsion pour disloquer le morceau de colonne vertébrale de l’extrémité supérieure du fémur (figure supplémentaire 1E).
- Nettoyez le fémur isolé avec du papier de soie pour enlever le muscle et le tissu conjonctif restants.
- Conserver au froid sur de la glace dans un puits à plaque de 12 puits rempli de 2 mL de DMEM (1x) + GlutaMAX-I.
- Une fois que tous les fémurs sont prélevés, assurez-vous que les tissus musculaires et fibreux sont complètement retirés de l’os. Ne coupez pas l’os pour (a) garder la moelle à l’intérieur stérile et (b) éviter de perdre des cellules dans le puits. Utilisez les étapes suivantes pour rincer les cellules de deux fémurs d’une souris, adaptées de Haag et Murthy28.
- Préparez un tube de 1,5 ml et un tube de 0,5 ml. Ajoutez 150 μL du tampon FACS dans le tube de 1,5 mL, puis percez un trou au fond du tube de 0,5 mL à l’aide d’une aiguille de 18 G et insérez le tube de 0,5 mL dans le tube de 1,5 mL.
- Ouvrez la partie distale de chaque fémur à l’aide de ciseaux chirurgicaux de souris (Figure supplémentaire 1F) : Verrouillez l’épiphyse distale entre les lames et appliquez une légère pression tout en retournant les ciseaux pour détacher en douceur l’épiphyse distale sans ouvrir l’os durement. En cas de succès, 4 protubérances devraient être visibles à l’extrémité de la physe maintenant exposée (figure supplémentaire 1G).
- Insérez les deux fémurs avec l’extrémité ouverte vers le bas dans le tube préparé de 0,5 mL placé à l’intérieur d’un tube de 1,5 mL contenant un tampon FACS (Figure supplémentaire 1H).
- Placez une crépine de 70 μm sur un tube de 50 ml et prémouillez la crépine avec 2 mL de tampon FACS.
- Pour rincer la moelle osseuse, centrifugez les tubes (bouchons ouverts) à 12 000 x g jusqu’à ce que la centrifugeuse atteigne la valeur de 12 000 x g , puis arrêtez immédiatement la centrifugeuse.
- Vérifier que les cellules de la moelle osseuse sont enrobées dans le tube de 1,5 mL et que les fémurs sont blancs (avant le rinçage des cellules, ils sont rouges) (Figure supplémentaire 1I). Jeter les tubes de 0,5 ml avec les 2 fémurs.
- Jeter le surnageant de 150 μL à l’aide d’une pipette.
- Remettre la pastille en suspension à l’aide d’une micropipette dans 1 mL de tampon de lyse au chlorure d’ammonium-potassium (ACK) pendant 1 à 2 minutes à la température RT pour lyser les globules rouges. Évitez les temps d’incubation plus longs car ils peuvent entraîner une diminution de la viabilité des cellules nucléées.
- Transvaser dans le tube de 50 mL à travers la crépine de cellules pré-humidifiée de 70 μm.
- Ajouter 10 mL de tampon FACS pour diluer le tampon de lyse ACK et ainsi arrêter la lyse.
- Centrifuger à 400 x g pendant 5 min à 4 °C. Remettre en suspension dans 10 mL de tampon FACS en remettant d’abord en suspension dans 1 mL, puis en complétant avec 9 mL.
- Préparez les cellules pour le comptage comme décrit au point 1.3.8.
- Comptez les cellules à l’aide d’un compteur de cellules automatisé en suivant les recommandations du fournisseur. On s’attend à ce qu’il prélève environ 40 millions de cellules de 2 fémurs.
- Coloration de la moelle osseuse HSPC
- Centrifuger les cellules à 400 x g pendant 5 min à 4 °C et remettre en suspension la pastille à l’aide d’une micropipette dans un tampon FACS jusqu’à une concentration finale de 1 x 107 cellules/mL.
- À l’aide d’une micropipette P1000, transférez la suspension dans un tube FACS, en filtrant à travers un capuchon de filtre à cellules de 35 μm.
- Préparez des échantillons de tube à essai à coloration unique pour chaque anticorps répertorié dans le tableau 1 afin de mettre en place des compensations de fluorochromes sur le trieur de cellules :
- Préparez un tube FACS par anticorps et remplissez les tubes avec 200 μL de PBS.
- Ajouter 15 μL de billes de compensation fluorochrome dans chaque tube FACS d’anticorps conjugué au fluorochrome. Dans les tubes FACS pour les cellules colorées simples non colorées et pour les cellules colorées vivantes/mortes, ajoutez 500 000 cellules au lieu de billes.
- Ajouter 1 μL de chaque anticorps conjugué au fluorochrome (voir le tableau 1) dans le tube FACS correspondant. Ajouter 0,5 μL de colorant vivant/mort dans le tube FACS à coloration unique vivant/mort.
- Conserver sur glace pendant 15 min à l’abri de la lumière.
- Préparer les mélanges 1 et 2 comme indiqué dans le tableau 2.
REMARQUE : Les volumes d’anticorps indiqués dans le tableau 2 sont valides pour les anticorps référencés dans le tableau des matériaux. Ils doivent être optimisés pour toute nouvelle référence d’anticorps ou un lot différent de la même référence d’anticorps. - Ajouter 300 μL de Mix 1 dans le tube d’échantillon, remettre en suspension et conserver pendant 15 minutes sur de la glace à l’abri de la lumière.
- Ajouter 300 μL de Mix 2 dans le tube d’échantillon, remettre en suspension et conserver pendant 20 minutes sur de la glace à l’abri de la lumière.
- Ajouter 3 mL de tampon FACS dans les tubes à coloration unique et les tubes d’échantillon colorés au mélange. Essorer à 400 x g pendant 5 min à 4°C.
- Jeter délicatement le surnageant à l’aide d’une micropipette et remettre la pastille en suspension dans 500 μL du tampon FACS.
- Préparez un tube de 1,5 mL prérempli de 500 μL de milieu de collecte.
REMARQUE : Le mélange 1 est préparé dans le DPBS car il contient la coloration vivante/morte significativement affectée par HI-FBS. Une fois que les cellules sont colorées par Live/Dead, le mélange 2 est ajouté, qui contient les anticorps conjugués au fluorochrome remis en suspension dans un tampon FACS contenant HI-FBS. La seule exception est l’anticorps anti-CD16/32 qui est inclus dans le mélange d’anticorps 1 pour servir de bloqueur des récepteurs Fc qui empêche la liaison non spécifique des autres anticorps ajoutés à l’étape suivante.
- Tri des cellules à l’aide d’un FACS
REMARQUE : Bien que le tri cellulaire puisse être effectué sur une grande variété de trieurs de cellules, la procédure d’utilisation des instruments BD FACSAria Fusion ou BD FACSAria III est décrite ici. Il est fortement recommandé que l’étalonnage et la configuration du trieur de cellules soient effectués sous supervision ou par un utilisateur expérimenté de l’instrument.- Étalonnage de l’instrument FACS : Reportez-vous à l’étape 4.1 du protocole 1.
- Mise en place de l’instrument FACS pour le tri des cellules :
- Commencez l’acquisition des cellules non colorées. Ceux-ci sont utilisés pour définir les diffusions directes et latérales et la tension du détecteur pour chaque fluorophore. Définissez les paramètres de manière à ce que le signal fluorescent de chaque fluorophore se situe à l’intérieur de la première décade de l’échelle logarithmique sur le graphique à points.
- Acquérez des contrôles de couleur unique pour configurer manuellement les compensations (la médiane des populations positives et négatives doit être alignée) ou utilisez le logiciel de calcul automatique (mesures de pente). Assurez-vous que les commandes de compensation correspondent aux fluorochromes expérimentaux et aux paramètres du détecteur. Enregistrez 10 000 événements pour les cellules et 5 000 événements pour les perles.
- Utilisez le tube d’échantillon (c’est-à-dire les cellules multi-colorées) pour définir les populations cellulaires d’intérêt en utilisant la stratégie de déclenchement illustrée à la figure 3A. Suivez les étapes 4 à 6 (ci-dessous).
- Pour identifier les trois HSPC de moelle osseuse d’intérêt (HSC, CMP et GMP), commencez le déclenchement en utilisant la taille (FSC-A) et la granularité (SSC-A) pour porter sur les leucocytes, puis FSC-H/FSC-A pour discriminer les doublets.
- Sur la base du marqueur SSC-A/cellules mortes, porte les cellules vivantes. Utilisez Lineage/c-Kit pour sélectionner des cellules qui sont négatives pour la lignée et qui expriment des niveaux intermédiaires à élevés de c-Kit. Par l’intermédiaire de c-Kit/Sca-1, porte sur les CSH de la lignée-c-Kit+ Sca-1+ (LKS+), l’une des trois populations d’intérêt.
- Parmi les progéniteurs myéloïdes (lignée-c-Kit+Sca-1-), utiliser FcγR/CD34 pour exclure les progéniteurs mégacaryocytaires et érythroïdes (MEP) CD34-FcγR- tout en incluant CD34+ FcγR- CMP, ainsi que CD34+FcγR+ GMP dans les populations cellulaires à trier.
- Assurez-vous que le jet et la déviation sont stables.
- Dans la caméra à flux latéral, activez le tri de test, la tension activée et confirmez le tri précis des gouttes dans un tube de 1,5 ml monté sur le côté gauche.
- Dans la fenêtre Disposition de tri , sélectionnez la ou les populations d’intérêt (c’est-à-dire « LKS+ » et « progéniteurs myéloïdes CD34+ » illustrés dans cet exemple). Sous Appareil, sélectionnez 2 tubes. Sous Précision, sélectionnez Pureté. Dans Événements cibles, sélectionnez Continu pour trier entre 160 000 et 200 000 progéniteurs myéloïdes LKS+ et CD34+ .
- Ajouter 500 μL de tampon FACS à la suspension cellulaire et transférer 1 mL de l’échantillon en le filtrant dans un nouveau tube FACS à couvercle de crépine de 35 μm pour s’assurer que toutes les cellules sont dans une seule suspension juste avant l’acquisition. Cela permet d’éliminer les amas de cellules qui pourraient obstruer l’instrument.
- Une fois prêt, cliquez sur Trier et sur OK pour lancer le tri. Ajustez le débit pour maintenir la vitesse en dessous de 10 000 événements par seconde.
REMARQUE : Le rapport attendu entre les progéniteurs myéloïdes LKS+ et CD34+ est de 1 :3 pour une souris femelle C57BL/6J adulte (âgée de 8 à 12 semaines) à l’état d’équilibre. Les numéros de cellules triées ciblés sont généralement atteints dans les 30 minutes suivant le tri.
- Contrôle de la qualité et comptage des cellules triées
REMARQUE : Cette étape ne doit être effectuée que pendant l’expérience pilote d’optimisation des étapes de préparation des échantillons, dans le but de tester la pureté des cellules triées qui doivent être utilisées pour l’isolement des noyaux. Une fois le protocole entièrement optimisé, il n’est pas conseillé d’effectuer cette étape de contrôle de la qualité dans les expériences de suivi afin d’éviter le gaspillage inutile de matière première qui peut être disponible en faible nombre pour l’isolement des noyaux.- Contrôle de la pureté par cytométrie en flux
- Transférer 10 μL des cellules triées dans un nouveau tube FACS contenant 90 μL de tampon FACS.
- Acquérir et enregistrer les données post-tri pour vérifier la pureté et la viabilité du tri. Assurez-vous qu’au moins 95 % des cellules apparaissent dans la porte d’intérêt, telle que définie aux points 3 à 6 et illustrée à la figure 3B.
- Contrôle de la pureté par cytométrie en flux
- Isolement de noyaux à partir de HSPC triés dans la moelle osseuse
- Utiliser le protocole « Low Cell Input Nuclei Isolation » de l’annexe du 10X Genomics Demonstration Protocol - Nuclei Isolation for Single Cell Multiome ATAC + GEX sequencing (CG000365 - Rev C)27, avec les modifications suivantes apportées pour optimiser la récupération des noyaux :
- Temps de lyse : Effectuez une expérience pilote pour ce protocole afin d’identifier le meilleur moment de lyse pour l’isolement des noyaux. Assurez-vous d’obtenir une lyse cellulaire complète tout en maintenant des noyaux intacts.
REMARQUE : L’étape f du protocole 10X Genomics27 mentionné ci-dessus indique de « incuber [dans un tampon de lyse] pendant 3 à 5 minutes sur de la glace ». Au cours de l’expérience pilote, testez au moins pendant 3 min, 4 min et 5 min et évaluez la quantité de noyaux récupérés par comptage et qualité par cytométrie en flux et imagerie microscopique pour choisir la durée optimale de lyse (voir la description de ces contrôles de qualité ci-dessous). Pour épargner les réactifs, remplacer le tampon de noyaux dilués par du PBS 0,04 % BSA dans l’expérience pilote. Pour les HSPC de la moelle osseuse, 3 min ont été identifiés comme la durée optimale de la lyse. - Centrifugations cellulaires : Pour toutes les centrifugations cellulaires en suspension, centrifuger à 300 x g pendant 7 min (au lieu des 5 min en CG000365 - Rev C)27 à 4 °C.
- Centrifugations des noyaux : Effectuer toutes les centrifugations en suspension des noyaux à 500 x g pendant 5 min conformément à CG000365 - Rev C27.
- Prélèvement des noyaux : À l’étape b, après avoir remis en suspension 50 μL de PBS 0,04 % BSA et transféré dans un tube de 0,2 mL, ajouter 50 μL de PBS 0,04 % BSA dans le tube d’origine et mélanger la pipette pour recueillir les cellules restantes. Transférer dans le tube de 0,2 mL pour atteindre un volume total de 100 μL.
- Dorénavant, le volume total sera de 100 μL au lieu des 50 μL du protocole. Ajustez les étapes en aval en conséquence (p. ex., pour l’étape d, retirer 90 μL au lieu de 45 μL ; pour l’étape e, ajouter 90 μL de tampon de lyse au lieu de 45 μL).
- Pour l’étape m, remettre en suspension la pastille de noyaux dans 12 μL de tampon de noyaux dilués au lieu de 7 μL.
- Comptez les noyaux isolés. Dans un tube vide de 0,5 mL, ajouter 10 μL de bleu de trypan à 0,4 % et 8 μL de PBS à 0,04 % BSA.
- Ajouter 2 μL de noyaux dans le tube et compter les noyaux comme décrit au point 1.3.8. Utilisez un compteur de cellules automatisé en suivant les recommandations du fournisseur.
- Temps de lyse : Effectuez une expérience pilote pour ce protocole afin d’identifier le meilleur moment de lyse pour l’isolement des noyaux. Assurez-vous d’obtenir une lyse cellulaire complète tout en maintenant des noyaux intacts.
- Utiliser le protocole « Low Cell Input Nuclei Isolation » de l’annexe du 10X Genomics Demonstration Protocol - Nuclei Isolation for Single Cell Multiome ATAC + GEX sequencing (CG000365 - Rev C)27, avec les modifications suivantes apportées pour optimiser la récupération des noyaux :
- Contrôle de la pureté par cytométrie en flux
REMARQUE : Cette étape ne doit être effectuée que pendant l’expérience pilote pour optimiser les étapes de préparation des échantillons afin de tester la pureté des noyaux qui doivent être chargés sur la puce de chrome 10X. Une fois que le protocole est entièrement optimisé, il n’est pas conseillé d’effectuer cette étape de contrôle de la qualité dans les expériences de suivi afin d’éviter le gaspillage inutile des noyaux collectés qui peuvent être disponibles en faible nombre.- Après avoir terminé l’isolement des noyaux, transférer 6 μL de noyaux remis en suspension dans un nouveau tube FACS prérempli de 150 μL de tampon FACS. Ajouter 3 μL de 7-AAD et incuber 5 min sur glace.
- Acquérir et enregistrer les données post-tri pour vérifier la pureté et la viabilité du tri. S’assurer qu’au moins 95 % des noyaux apparaissent dans la porte d’intérêt, tel que défini à l’étape 4.2 du protocole 1 (voir la figure 4).
- Contrôle de la qualité des noyaux purifiés par microscopie :
REMARQUE : Cette étape ne doit être effectuée que pendant l’expérience pilote pour l’optimisation des étapes de préparation des échantillons afin de tester la qualité des noyaux qui doivent être chargés sur la puce de chrome 10X. Une fois que le protocole est entièrement optimisé, il n’est pas conseillé d’effectuer cette étape de contrôle de la qualité dans les expériences de suivi afin d’éviter le gaspillage inutile des noyaux collectés qui peuvent être disponibles en faible nombre.- Procédez comme décrit à l’étape 1.5.3.
- Effectuer un test multiome
- Passez immédiatement au Guide de l’utilisateur de Chromium Next GEM Single Cell Multiome ATAC + Gene Expression (CG000338 - Rev F)25.
Résultats
Les deux protocoles décrits ci-dessus détaillent l’isolement de noyaux à partir de deux types de tissus différents. Les différences et les similitudes entre les deux protocoles sont représentées schématiquement à la figure 1.
Purification des noyaux du cerveau de souris
Dans le protocole décrit ici, nous proposons une méthode douce pour la préparation des noyaux à partir d’échantillons de cerveau. Cela commence par une dissociation mécanique du tissu cérébral dans un tampon de lyse, suivie d’étapes de lavage et de filtrage à tamis qui éliminent le tissu restant de la suspension. L’élimination ultérieure des débris, des cellules non lysées et des petites particules est réalisée par FACS pour garantir que seuls les noyaux purifiés sont chargés pour le protocole Multiome en aval. La figure 2 montre le profil des noyaux avant et après le tri. Après le filtrage et avant le tri des noyaux, l’échantillon contient une grande quantité de débris, avec plus de 99 % des « singulets » positifs pour la coloration nucléaire (7-AAD), ce qui indique une lyse cellulaire optimale (Figure 2A). Les noyaux sont triés en fonction de la grille positive 7-AAD. Une fraction de matière triée est acquise pour vérifier la pureté des noyaux préparés. La figure 2B montre le profil des noyaux cérébraux après tri. Le tri des noyaux a permis d’augmenter la pureté des noyaux de 36 % (Figure 2A) à près de 100 % (Figure 2B).
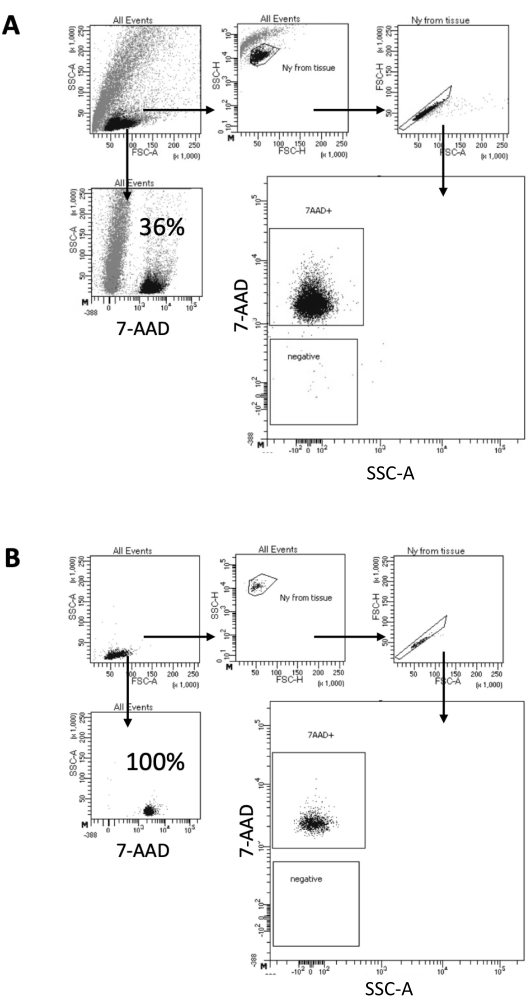
Figure 2 : Stratégie de contrôle pour le tri des noyaux et test de pureté après tri. Les noyaux ont été colorés avec du 7-AAD et acquis par le trieur de cellules. (A) Les noyaux sont d’abord contrôlés en fonction de leur taille et de leur granularité (FSC-A et SSC-A, respectivement). Les particules individuelles sont ensuite sélectionnées en fonction de leurs propriétés FSC-A/FSC-H et de leur coloration 7-AAD. (B) Après le tri cellulaire, la pureté d’une fraction des noyaux du tube de prélèvement est testée en utilisant la même stratégie de contrôle que dans A. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Purification des progéniteurs de cellules souches hématopoïétiques (HSPC) de la moelle osseuse de souris
Lors de l’isolement de la moelle osseuse, jusqu’à 2 x 105 HSPC sont triés par FACS, selon la stratégie de contrôle illustrée à la figure 3A. L’efficacité du tri et la pureté de l’échantillon sont évaluées (figure 3B).
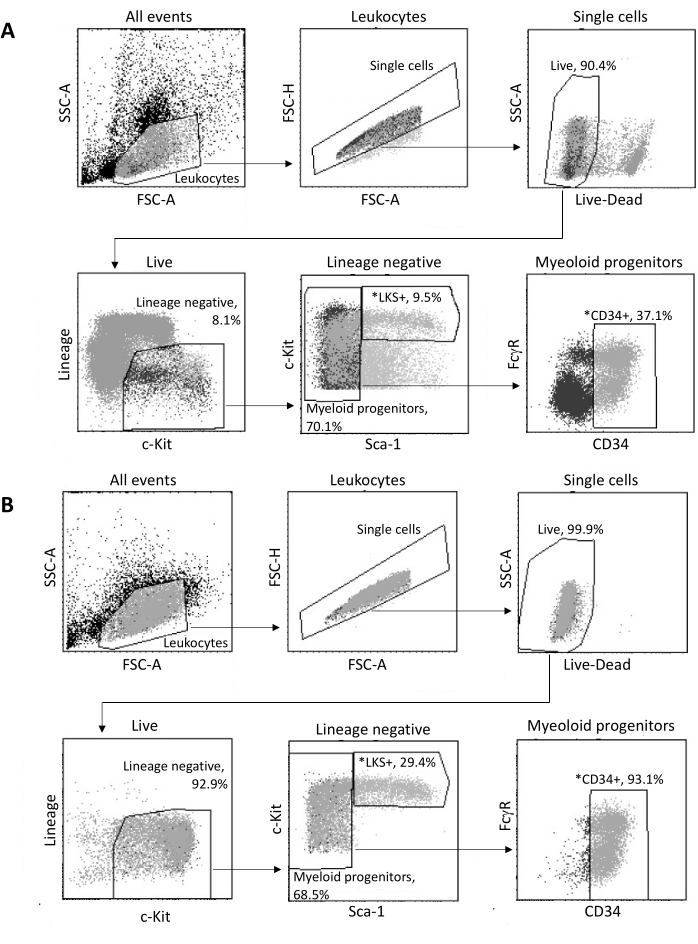
Figure 3 : Stratégie de contrôle pour le tri des HSPC de moelle osseuse. (A) Une stratégie de contrôle FACS représentative pour le tri des cellules souches hématopoïétiques LKS+ viables et des progéniteurs myéloïdes CD34+ pour l’isolement des noyaux. (B) Tracés FACS représentatifs utilisés pour la vérification de la pureté de la population de cellules triées. Les proportions des différents sous-ensembles cellulaires par rapport à la population parente sont indiquées. *Les deux populations triées. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Le protocole « Low Cell Input Nuclei Isolation » permet d’isoler les noyaux à partir d’échantillons avec un maximum de 10 à5 cellules. Il comprend un faible nombre d’étapes de centrifugation, minimisant ainsi la perte de cellules/noyaux. Nous avons ajusté le volume des tampons de lyse et de lavage proportionnellement à l’entrée des cellules et augmenté le temps de centrifugation pour une récupération maximale des noyaux. Nous avons réalisé une expérience pilote pour évaluer la quantité de noyaux récupérés par comptage et leur qualité par cytométrie en flux et imagerie microscopique. La figure 4 montre l’échantillon de HSPC après lyse cellulaire. Ce protocole a généré des noyaux de haute qualité, comme l’a observé la figure 5A, sans aucun débris susceptible d’avoir un impact sur le protocole multiome en aval.
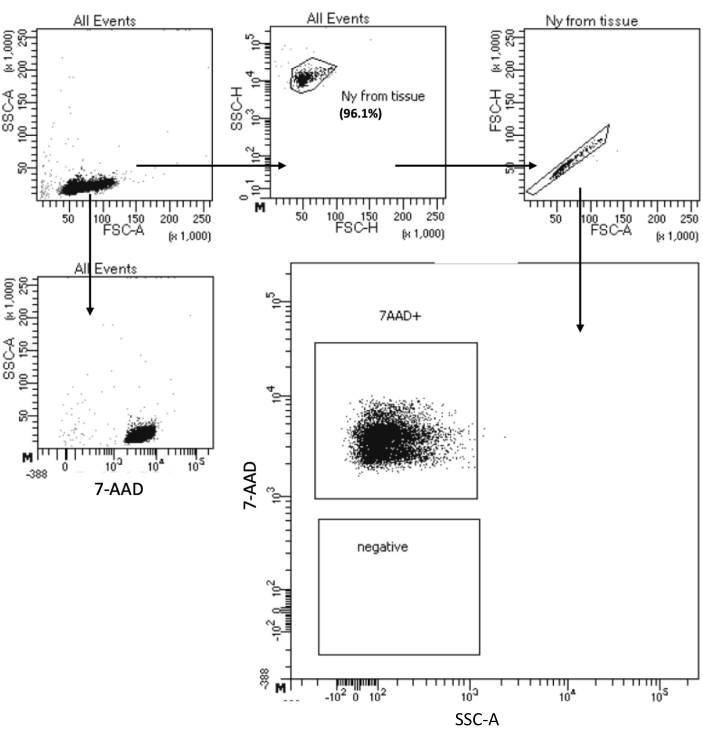
Figure 4 : Tri par test de pureté des noyaux HSPC isolés de la moelle osseuse. Les noyaux ont été colorés avec du 7-AAD et acquis par le trieur de cellules. Les noyaux ont d’abord été contrôlés en fonction de leur taille et de leur granularité (FSC-A et SSC-A, respectivement) afin d’évaluer la pureté de l’échantillon. La proportion de noyaux est indiquée par rapport à la population parente. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Numéro de tube | Nom du tube | Entité tachée | Quantité d’entité colorée | Anticorps/colorant (μL) | Tampon de collecte (μL) |
| 1 | Non taché | Cellules | 5,00,000 | N/A | 200 |
| 2 | LIVE/DEAD Fixable Aqua Dead Cell Stain | Cellules | 5,00,000 | 0.5 | |
| 3 | APC/Cyanine 7 anti-souris CD16/32 (FcγR) | OneComp eBeads (en anglais seulement) | 15 μL | 1 | |
| 4 | Cocktail de lignage anti-souris bleu Pacifique | OneComp eBeads (en anglais seulement) | 15 μL | 1 | |
| 5 | PE anti-souris Ly-6A/E (Sca-1) | OneComp eBeads (en anglais seulement) | 15 μL | 1 | |
| 6 | APC anti-souris CD117 (c-Kit) | OneComp eBeads (en anglais seulement) | 15 μL | 1 | |
| 7 | FITC anti-souris CD34 | OneComp eBeads (en anglais seulement) | 15 μL | 1 |
Tableau 1 : Contrôles à coloration unique pour les réglages de compensation sur le cytomètre en flux. Les contrôles de coloration unique requis, le nombre de cellules ou de billes à colorer et les quantités d’anticorps sont indiqués.
| Mixage principal | Réactif | Dilution finale | Anticorps/colorant (μL) | Type de tampon | Tampon (μL) |
| Mélange 1 | APC/Cyanine 7 anti-souris CD16/32 (FcγR) | 1/500 | 1.2 | Le DPBS | 300 |
| LIVE/DEAD Fixable Aqua Dead Cell Stain | 1/250 | 2.4 | |||
| Mélange 2 | Cocktail de lignage anti-souris bleu Pacifique | 1/20 | 30 | Tampon FACS | 300 |
| PE anti-souris Ly-6A/E (Sca-1) | 1/200 | 3 | |||
| APC anti-souris CD117 (c-Kit) | 1/200 | 3 | |||
| FITC anti-souris CD34 | 1/50 | 12 | |||
| Volume total de coloration | 600 |
Tableau 2 : Composition du mélange de coloration pour les HSPC de moelle osseuse. Les volumes de réactifs nécessaires à la coloration d’un échantillon contenant 40 millions de cellules sont indiqués. Pour colorer un plus grand nombre d’échantillons, multipliez le volume indiqué par le nombre d’échantillons requis et ajoutez la moitié d’un volume d’échantillon supplémentaire pour assurer un volume suffisant du mélange principal.
Figure supplémentaire 1 : Protocole d’isolement des cellules de la moelle osseuse. (A) Ouvrir le péritoine. Les pointillés blancs indiquent la ligne à couper. (B) Après avoir décollé la peau de la patte arrière, alignez les ciseaux le long de la colonne vertébrale au niveau de l’articulation de la hanche pour couper la patte sans couper le fémur. (C) L’apparence de la jambe séparée du corps avant l’ablation du muscle. (D) L’apparence de la jambe après l’ablation du muscle. (E) La procédure de séparation du fémur au niveau de l’articulation du genou, puis de l’articulation de la hanche, en prenant soin de ne pas ouvrir le fémur. Les flèches incurvées blanches indiquent le mouvement requis. Les flèches pointillées blanches indiquent la zone à séparer doucement à l’aide de ciseaux pour pincer. (F) Procédure pour ouvrir la partie distale du fémur (c’est-à-dire la partie précédemment attachée au tibia au niveau de l’articulation du genou) en saisissant solidement le cartilage et l’épiphyse distale avec des ciseaux et en les retournant pour exposer la moelle osseuse. (G) Quatre protubérances, indiquées par des flèches noires, doivent être visibles à l’extrémité de la physis exposée. (H) L’apparition d’un fémur dont l’extrémité ouverte est tournée vers le bas dans le tube préparé de 0,5 mL placé à l’intérieur d’un tube de 1,5 mL contenant 150 μL de tampon FACS. (I) L’apparition des cellules de moelle osseuse en granulés et du fémur maintenant blanc après centrifugation rapide à 12 000 x g. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
La préparation d’une suspension cellulaire ou noyautaire de haute qualité est d’une importance cruciale pour le succès des analyses RNA-Seq et multi-omiques unicellulaires ou mononoyaux 29,30,31. Ici, nous avons décrit les protocoles de préparation des échantillons et d’isolement des noyaux pour les dosages multiomes de deux types de tissus : le cerveau et la moelle osseuse.
Le protocole cérébral décrit dans cet article permet la récupération de noyaux de haute qualité à partir de tissus cérébraux fraîchement congelés. Il comprend les étapes suivantes : la perturbation des tissus congelés, l’isolement des noyaux, la purification des noyaux et le contrôle de la qualité du matériel préparé. Le tissu cérébral est composé de nombreux types de cellules différentes, et la procédure de dissociation tissulaire et d’isolement des noyaux doit préserver les proportions de populations cellulaires telles qu’elles sont présentes dans le tissu initial. Ici, la composition du tampon de lyse et le temps d’incubation ont été optimisés pour permettre une lyse complète et douce de toutes les populations cellulaires qui composent le tissu.
Le protocole HSPCs de la moelle osseuse est quelque peu différent puisqu’il nécessite une étape supplémentaire au début de l’expérience pour isoler la population cellulaire d’intérêt d’une suspension cellulaire hétérogène. Après le prélèvement de tissus frais, les globules rouges sont lysés et l’échantillon est enrichi pour le sous-ensemble cellulaire d’intérêt. Les cellules ciblées sont lysées, les noyaux sont isolés et la qualité du matériel préparé est contrôlée.
10X Genomics fournit plusieurs protocoles validés pour l’isolement des noyaux dans de nombreux tissus différents32,33. La société commercialise également un kit d’isolement de noyaux avec un pipeline simple pour isoler les noyaux de tissus validés34. Cependant, ces protocoles nécessitent une optimisation supplémentaire pour adapter les particularités de certains échantillons. Un exemple est celui des échantillons qui nécessitent de travailler avec une faible entrée de cellule. Pour ces échantillons, les étapes les plus difficiles sont les centrifugations qui doivent être suffisamment strictes pour nettoyer l’échantillon et suffisamment douces pour éviter la perte de cellules/noyaux. Avec le protocole décrit ici, nous avons adapté le protocole 10X Genomics Demonstration Protocol - Nuclei Isolation for Single Cell Multiome ATAC + GEX Sequencing (CG000365 - Rev C)27 pour trouver un équilibre subtil entre ces deux exigences. Comme le montre l’exemple de la préparation de noyaux à partir de HSPC triés, nous avons amélioré la récupération des noyaux sans impact sur la qualité de l’échantillon.
Un défi supplémentaire est l’étape de lyse des cellules purifiées pour l’isolement des noyaux. Des conditions de lyse plus difficiles et des temps d’incubation plus longs peuvent endommager les noyaux et ainsi avoir un impact sur la qualité des données de séquençage. La figure 5 montre l’imagerie de noyaux représentatifs à partir d’échantillons de moelle osseuse à différents temps d’incubation avec un tampon de lyse et illustre à quel point l’état des noyaux peut être différent en fonction de la lyse cellulaire. Dans l’exemple des HSPC, nous avons identifié la lyse de 3 min comme la condition qui se traduit par la plus forte proportion de noyaux intacts d’apparence saine et la plus faible proportion de noyaux endommagés. Les temps d’incubation de la lyse doivent être optimisés pour chaque nouveau type d’échantillon.
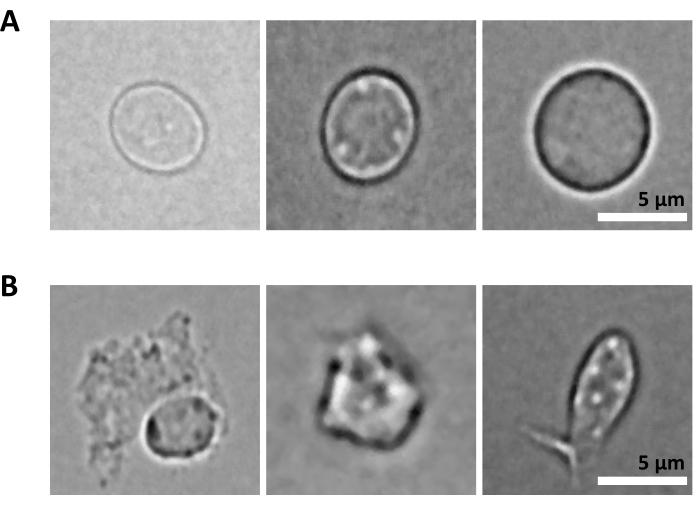
Figure 5 : Contrôle de la qualité des noyaux par microscopie. Des images en fond clair sont représentatives de noyaux isolés de la moelle osseuse de souris avec (A) des noyaux intacts et (B) endommagés. Barre d’échelle 5 μm. Les images ont été prises à l’aide d’un microscope inversé à l’aide d’un objectif ELWD NA 0,60 40x et d’un zoom numérique 1,5x. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Les deux protocoles détaillés dans ce travail reposent sur la purification de cellules ou de noyaux ciblés par des instruments FACS à haut débit. Cette étape est d’une importance cruciale pour les protocoles de préparation de cellules uniques/noyaux où de rares sous-ensembles de cellules doivent être isolés de suspensions hétérogènes. Dans ceux-ci, comme dans l’exemple présenté ici pour le tri des HSPC, un panel de cytométrie en flux de grande dimension peut être nécessaire pour activer le « gating » sur la population cellulaire d’intérêt. Le tri est extrêmement rapide et précis, ce qui permet d’obtenir une pureté de plus de 95 % des sous-ensembles de cellules triées. Cette approche expose la suspension cellulaire à une pression allant jusqu’à 70 psi et peut donc être limitante pour le tri des cellules fragiles (par exemple, les cellules dendritiques, les neutrophiles) car elle peut provoquer la rupture de leur membrane cellulaire. Dans ces cas, des solutions alternatives doivent être sélectionnées pour la purification cellulaire, y compris le tri magnétique, l’application d’instruments de nouvelle génération (par exemple, CellenOne, Cellenion ; MACSQuant Tyto, Miltenyi)35,36, ou des systèmes à base de gouttelettes (par exemple, ODIN, Sensific)37. Néanmoins, la lenteur de la vitesse de tri de ces technologies, avec un tri cellulaire qui dure des heures au lieu de quelques minutes, est un facteur limitant important pour l’application de ces approches dans la préparation de cellules viables pour Multiome et d’autres applications unicellulaires basées sur l’analyse de grands nombres de cellules.
Pour la purification des noyaux isolés du tissu, FACS est la méthode de choix en raison de son débit et de la pureté du matériau isolé. Les noyaux ne sont pas sensibles à la pression et les isolats de tissus filtrés peuvent facilement être purifiés par le trieur de cellules. Si le laboratoire n’est pas équipé d’un instrument FACS, d’autres alternatives existent, un peu moins performantes mais suffisamment performantes. Il s’agit par exemple de l’ultracentrifugation ou de l’utilisation de petits équipements tels que MARS (Applied Cell) qui sépare les particules en fonction de leur différence de taille, à l’aide d’ondes acoustiques ; Rondelle laminaire CURIOX qui utilise les propriétés hydrophobes des suspensions cellules/noyaux ; ou LEVITAS bio qui s’appuie sur les propriétés physiques des cellules (lévitation) pour les séparer des débris.
Ici, nous décrivons les protocoles permettant d’obtenir un nombre élevé de noyaux et la meilleure pureté pour le protocole Multiome en aval. Le tri FACS et les étapes répétées de centrifugation entraînent une perte substantielle de la matière initiale. Pour cette raison, dans le protocole de préparation des noyaux à partir du cerveau que nous décrivons ici, il faut un matériau de départ suffisamment abondant pour aboutir à la collecte d’au moins 500 000 noyaux après le tri FACS. D’autres protocoles doivent être appliqués si ce critère ne peut pas être respecté. Lorsque l’on travaille avec des populations de cellules rares ou de petites coupes de tissus, la quantité de matériel initial disponible peut être un facteur limitant. Pour résoudre ce problème, il est possible d’améliorer la récupération des noyaux en (a) réduisant le volume de lyse, (b) en réduisant le volume de lavage, (c) en utilisant un seul lavage avec un temps de centrifugation prolongé pour essayer d’améliorer la récupération comme indiqué dans les protocoles 10X Genomics pour l’isolement des noyaux à faible entrée cellulaire. Pour l’analyse multiomique de matériaux à faible teneur, il vaut la peine d’envisager des applications à base de plaques telles que scNMT, SNARE-seq et Paired-seq38 qui nécessitent beaucoup moins d’échantillons d’entrée.
En résumé, nous avons décrit deux protocoles robustes pour la préparation des noyaux des HSPC du cerveau et de la moelle osseuse pour l’analyse Multiome en aval. Ces protocoles sont applicables dans tout projet scientifique qui nécessite des suspensions de noyaux uniques de haute qualité à partir de ces deux types de tissus, quelle que soit la question scientifique posée. Notre groupe a appliqué le protocole d’isolement des noyaux cérébraux dans des études sur le développement du cerveau lors de l’inactivation de divers gènes ciblés et dans des études sur la réponse immunitaire dans le contexte de maladies neurologiques. Nous utilisons le protocole d’isolement des noyaux de moelle osseuse pour décrypter la participation de diverses sous-populations hématopoïétiques à la mise en place du système immunitaire.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ana Jeemin Choi a bénéficié d’une bourse du programme de doctorat international Pasteur - Université de Paris (PPU).
matériels
| Name | Company | Catalog Number | Comments |
| 18 G x 1 ½ (1.2 mm x 38 mm) Agani needles | Terumo | AN*1838S1 | |
| 15 mL tubes | Falcon | 352097 | |
| 5 mL round bottom FACS tube with cell strainer cap 35 µm | falcon | 352235 | |
| 50 mL tubes | Falcon | 352070 | |
| 7-AAD | BD pharmagen | 559925 | |
| ACK Lysing Buffer | Gibco | A10492-01 | |
| APC anti-mouse CD117 (c-Kit) | BioLegend | 105812 | Clone: 2B8 |
| APC/Cyanine 7 anti-mouse CD16/32 (FcγR) | BioLegend | 101328 | Clone: 93 |
| BD FACSAria III | BD Biosciences | non-applicable | |
| BD FACSDiva Software v8.0.1 | BD Biosciences | non-applicable | |
| Bovine Serum Albumin stock solution 10% | Miltenyi Biotec | 130-091-376 | |
| Cell staining buffer | Biolegend | 420201 | |
| CFI Suprplan Fluor ELWD 40XC ON 0.6 | Nikon | non-applicable | |
| CMOS camera Prime 95B 25 mm | Photometrix | non-applicable | |
| Countess II FL Automated Cell Counter | Invitrogen | AMQAF1000 | |
| Countess cell counting chamber slide | Invitrogen | C10283 | |
| Coverglass 24 mm x 24 mm 0.13-0.17 mm | Brand | BR470819 | |
| Digitonine 5% | Invitrogen | BN2006 | |
| Disposable Scalpels | Swann-Morton | 0508 | |
| DMEM (1x) + GlutaMAX-I | Gibco | 31966-021 | |
| DPBS (10x) | Gibco | 14200-067 | |
| DTT | Sigma aldrich | 646563 | |
| Epifluorescence inverted microscope Nikon Ti2 -E | Nikon | non-applicable | |
| Eppendorf Safe-Lock Tubes 0.5 mL | Eppendorf | 30123603 | |
| Ethanol 70% | VWR | 83801.290 | |
| FITC anti-mouse CD34 | Invitrogen | 11-0341-85 | Clone: RAM34 |
| Forceps for dissection | FST | 11152-10 | |
| Heat-inactivated Fetal Bovine Serum (FBS) | Gibco | 11533387 | |
| Dounce Homogeniser 2 mL | Bellco glass | 1984-10002 | Pestle “A” Large Clearance: .0030-.0050″ and Pestle “B” Small Clearance: .0005-.0025″ |
| LIVE/DEAD fixable aqua dead cell stain kit | Invitrogen | L34957 | |
| Magnesium chloride solution 1 M | Sigma aldrich | M1028 | |
| Microcentrifuge | Eppendorf | 5424R | |
| Mounting medium Fluoromount-G | invitrogen | 00-4958-02 | |
| Nonidet P40 substitute | Sigma aldrich | 74385 | |
| Nuclease free water | ThermoFischer | AM9932 | |
| Nuclei buffer 20x | 10X Genomics | 2000153/2000207 | |
| Nuclei isolation kit EZ prep | Sigma Aldrich | NUC-101 | |
| OneComp eBeads compensation beads | Invitrogen | 01-1111-41 | |
| Pacific Blue anti-mouse lineage cocktail (including anti-mouse CD3, Ly-6G/Ly-6C, CD11b, CD45R/B220, TER-119) | BioLegend | 133310 | Clones (in the same order as the antibodies listed): 17A2, RB6-8C5, M1/70, RA3-6B2, Ter-119 |
| PCR Tube Strips 0.2 mL | Eppendorf | 951010022 | |
| PE anti-mouse Ly-6A/E (Sca-1) | BioLegend | 122507 | Clone: E13-161.7 |
| Petri dish 100 mm x 20 mm OPTILUX | Falcon | 353003 | |
| Ply-L-lysine 0.01% sterile-filtered suitable for cell culture | Sigma | P4707 | |
| Printed microscope slides 8 well 6 mm numbered | Epredia | ER-301B-CE24 | |
| Protein LoBind Tubes 1.5 mL | Eppendorf | 30108116 | |
| Recombinant Rnase inhibitor 5000 U | Takara | 2313A | |
| Scissors for dissection | FST | 14090-09 | |
| Sodium chloride solution 5 M | Sigma aldrich | 59222C | |
| Syringe filters, PES, 0.2 µm | Fisher Scientific | 15206869 | |
| Transparent nail polish | any | non-applicable | |
| Trizma Hydrochloride solution pH 7.4 | Sigma aldrich | T2194 | |
| Trypan Blue 0.4% | gibco | 15250061 | |
| Tween 20 | Biorad | 1662404 | |
| UltraPure Distilated Water Dnase/Rnase Free | Invitrogen | 10977-035 |
Références
- Clark, S. J., et al. scNMT-seq enables joint profiling of chromatin accessibility DNA methylation and transcription in single cells. Nature Communications. 9 (1), 781(2018).
- Lee, J., Hyeon, D. Y., Hwang, D. Single-cell multiomics: technologies and data analysis methods. Experimental & Molecular Medicine. 52 (9), 1428-1442 (2020).
- Cerrizuela, S., et al. High-throughput scNMT protocol for multiomics profiling of single cells from mouse brain and pancreatic organoids. STAR Protocols. 3 (3), 101555(2022).
- Dimitriu, M. A., Lazar-Contes, I., Roszkowski, M., Mansuy, I. M. Single-cell multiomics techniques: From conception to applications. Frontiers in Cell and Developmental Biology. 10, 854317(2022).
- Stoeckius, M., et al. Simultaneous epitope and transcriptome measurement in single cells. Nature Methods. 14 (9), 865-868 (2017).
- Cao, J., et al. Joint profiling of chromatin accessibility and gene expression in thousands of single cells. Science (New York, N.Y.). 361 (6409), 1380-1385 (2018).
- Narayanan, A., et al. Nuclei Isolation from Fresh Frozen Brain Tumors for Single-Nucleus RNA-seq and ATAC-seq. Journal of Visualized Experiments: JoVE. (162), e61542(2020).
- Kim, M., et al. Single-nucleus transcriptomics reveals functional compartmentalization in syncytial skeletal muscle cells. Nature Communications. 11 (1), 6375(2020).
- Santos, M. D., et al. Extraction and sequencing of single nuclei from murine skeletal muscles. STAR Protocols. 2 (3), 100694(2021).
- Safabakhsh, S., et al. Isolating nuclei from frozen human heart tissue for single-nucleus RNA sequencing. Current Protocols. 2 (7), e480(2022).
- Lau, S. -F., Cao, H., Fu, A. K. Y., Ip, N. Y. Single-nucleus transcriptome analysis reveals dysregulation of angiogenic endothelial cells and neuroprotective glia in Alzheimer's disease. Proceedings of the National Academy of Sciences of the United States of America. 117 (41), 25800-25809 (2020).
- Armand, E. J., Li, J., Xie, F., Luo, C., Mukamel, E. A. Single-cell sequencing of brain cell transcriptomes and epigenomes. Neuron. 109 (1), 11-26 (2021).
- Morabito, S., et al. Single-nucleus chromatin accessibility and transcriptomic characterization of Alzheimer's disease. Nature Genetics. 53 (8), 1143-1155 (2021).
- Chen, S., et al. Spatially resolved transcriptomics reveals genes associated with the vulnerability of middle temporal gyrus in Alzheimer's disease. Acta Neuropathologica Communications. 10 (1), 188(2022).
- Paul, F., et al. Transcriptional heterogeneity and lineage commitment in myeloid progenitors. Cell. 163 (7), 1663-1677 (2015).
- Kaufmann, E., et al. BCG educates hematopoietic stem cells to generate protective innate immunity against tuberculosis. Cell. 172 (1-2), 176-190.e19 (2018).
- Christ, A., et al. Western diet triggers NLRP3-dependent innate immune reprogramming. Cell. 172 (1-2), 162-175.e14 (2018).
- Moorlag, S. J. C. F. M., et al. β-Glucan Induces protective trained immunity against mycobacterium tuberculosis infection: A key role for IL-1. Cell Reports. 31 (7), 107634(2020).
- de Laval, B., et al. C/EBPβ-dependent epigenetic memory induces trained immunity in hematopoietic stem cells. Cell Stem Cell. 26 (5), 657-674.e8 (2020).
- Renthal, W., et al. Characterization of human mosaic Rett syndrome brain tissue by single-nucleus RNA sequencing. Nature Neuroscience. 21 (12), 1670-1679 (2018).
- Yang, A. C., et al. A human brain vascular atlas reveals diverse mediators of Alzheimer's risk. Nature. 603 (7903), 885-892 (2022).
- Lee, D. R., Zhang, Y., Rhodes, C. T., Petros, T. J. Generation of single-cell and single-nuclei suspensions from embryonic and adult mouse brains. STAR Protocols. 4 (1), 101944(2022).
- Corces, M. R., et al. Lineage-specific and single-cell chromatin accessibility charts human hematopoiesis and leukemia evolution. Nature Genetics. 48 (10), 1193-1203 (2016).
- Ranzoni, A. M., et al. Integrative single-cell RNA-seq and ATAC-seq analysis of human developmental hematopoiesis. Cell Stem Cell. 28 (3), 472-487.e7 (2021).
- 10X Genomics Chromium Next GEM Single Cell Multiome ATAC + Gene Expression User Guide, Document Number CG000338 Rev F. , At https://www.10xgenomics.com/support/single-cell-multiome-atac-plus-gene-expression/documentation/steps/library-prep/chromium-next-gem-single-cell-multiome-atac-plus-gene-expression-reagent-kits-user-guide (2022).
- Meyerhoff,, et al. Microdissection of mouse brain into functionally and anatomically different regions. Journal of Visualized Experiments: JoVE. (168), e61941(2021).
- 10X Genomics 10X Genomics Demonstrated Protocol - Nuclei Isolation for Single Cell Multiome ATAC + GEX sequencing (CG000365 - Rev C). , At https://www.10xgenomics.com/support/single-cell-multiome-atac-plus-gene-expression/documentation/steps/sample-prep/nuclei-isolation-for-single-cell-multiome-atac-plus-gene-expression-sequencing (2022).
- Haag, S., Murthy, A. Murine monocyte and macrophage culture. Bio-Protocol. 11 (6), e3928(2021).
- Haque, A., Engel, J., Teichmann, S. A., Lönnberg, T. A practical guide to single-cell RNA-sequencing for biomedical research and clinical applications. Genome Medicine. 9 (1), 75(2017).
- Jiang, P. Quality control of single-cell RNA-seq. Methods in Molecular Biology (Clifton, N.J). 1935, 1-9 (2019).
- Regan, C., Preall, J. Practical considerations for single-cell genomics. Current Protocols. 2 (8), e498(2022).
- 10X Genomics 10X Genomics Demonstrated Protocol - Nuclei Isolation for Single Cell ATAC Sequencing (CG000169 - Rev E). , At https://www.10xgenomics.com/support/single-cell-atac/documentation/steps/sample-prep/nuclei-isolation-for-single-cell-atac-sequencing (2022).
- 10X Genomics 10X Genomics Demonstrated Protocol - Nuclei Isolation from Complex Tissues for Single Cell Multiome ATAC + Gene Expression Sequencing. (CG000375 - Rev C). , At https://www.10xgenomics.com/support/single-cell-multiome-atac-plus-gene-expression/documentation/steps/sample-prep/nuclei-isolation-from-complex-tissues-for-single-cell-multiome-atac-plus-gene-expression-sequencing (2022).
- 10X Genomics 10X Genomics - Chromium Nuclei Isolation Kit (CG000505 - Rev A). , At https://www.10xgenomics.com/support/single-cell-gene-expression/documentation/steps/sample-prep/chromium-nuclei-isolation-kit-sample-prep-user-guide (2022).
- Shomroni, O., et al. A novel single-cell RNA-sequencing approach and its applicability connecting genotype to phenotype in ageing disease. Scientific Reports. 12 (1), 4091(2022).
- Ocañas, S. R., Pham, K. D., Blankenship, H. E., Machalinski, A. H., Chucair-Elliott, A. J., Freeman, W. M. Minimizing the ex vivo confounds of cell-isolation techniques on transcriptomic and translatomic profiles of purified microglia. eNeuro. 9 (2), (2022).
- Gérard, A., et al. High-throughput single-cell activity-based screening and sequencing of antibodies using droplet microfluidics. Nature Biotechnology. 38 (6), 715-721 (2020).
- Vandereyken, K., Sifrim, A., Thienpont, B., Voet, T. Methods and applications for single-cell and spatial multi-omics. Nature Reviews. Genetics. 24, 494-515 (2023).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon