Method Article
用于单核多组学检测的高质量脑和骨髓核制备
摘要
单细胞/单核转录组学和多组学的成功很大程度上取决于细胞/细胞核的质量。因此,从组织中分离细胞/细胞核及其纯化必须高度标准化。该方案描述了从脑和骨髓制备细胞核,用于下游单核多组测定。
摘要
单细胞分析已成为解开生物过程复杂性的首选方法,这些过程需要以单细胞分辨率评估单个细胞对治疗或感染的反应的变异性。
在过去的10年中,已经开发了许多用于单细胞分子分析的技术,并且已经将一些专用技术商业化。10X Genomics基于液滴的单细胞分析是一种广泛的技术,为转录组学和多组学单细胞分析提供了即用型试剂。该技术包括单细胞和单核RNA测序(分别为scRNA-Seq和snRNA-Seq)、scATAC-Seq、单细胞免疫谱分析(BCR/TCR测序)和多组学的工作流程。后者结合了来自同一细胞的转录 (scRNA-Seq) 和表观遗传信息 (scATAC-Seq)。
从组织中分离并通过任何这些方法进行分析的单细胞或单核悬浮液的质量(活力、完整性、纯度)对于生成高质量数据至关重要。因此,样品制备方案应适应每种生物组织的特殊性,并确保产生高质量的细胞和细胞核悬浮液。
本文介绍了为下游多组组 10X 基因组学管道制备脑和骨髓样本的两种方案。这些方案是逐步执行的,涵盖组织解离、细胞分选、细胞核分离和制备的细胞核悬浮液的质量控制,这些细胞核悬液用作细胞分配和条形码、文库制备和测序的起始材料。这些标准化方案可产生高质量的细胞核文库和强大可靠的数据。
引言
多年来,单细胞技术一直是分析生物过程的黄金标准。它们最初仅限于通过显微镜、流式细胞术和类似测定进行单细胞表型分析。单细胞分析的突破伴随着单细胞分子分析方法的发展,特别是单细胞RNA测序(scRNA-Seq),它能够表征单个细胞的整个转录组。scRNA-Seq功能强大,可生成有关特定条件和时间点细胞转录状态的信息。然而,它不能提供驱动转录的基因调控或随时间发生的分子修饰的可见性。为了克服这一局限性,人们投入了大量精力来开发单细胞多组学检测,能够分析来自同一细胞的多种因子和过程 1,2,3,4。通过在 CITE-Seq 方法5 中将多重表面蛋白表达模式与单个细胞的完整转录组联系起来,首次成功测量了单细胞内的两种模式。最近的进化将基因表达与染色质可及性相结合(使用测序测定转座酶可及染色质,ATAC-Seq),从而同时捕获同一细胞中的转录组学和表观基因组模式(例如,sci-CAR)6。第一个允许将转录组学与细胞表型或同一细胞的表观遗传变化相关联的商业解决方案来自10X Genomics。
单细胞分子谱分析实验包括以下步骤:(1)组织解离或制备单细胞悬浮液;(2)细胞纯化和/或细胞核分离;(3)分区和条形码;(4)图书馆建设与质量控制;(5)二代测序;(6)数据分析。虽然步骤(3)-(6)可能因所采用的技术而有很大差异,但初始步骤通常对所有步骤都是通用的。制备的细胞/细胞核悬浮液的质量将决定实验的总体结果。根据组织的类型,获得高质量的单细胞/细胞核悬浮液可能具有挑战性。某些组织(如心脏、肌肉、大脑、肺、肠等)的特殊性需要适用于每种样品的组织破坏和细胞核分离方法,以保证生产用于分子分析的高质量细胞核 7,8,9,10 .组织破坏方法和解离方案可以是机械的、酶促的(例如,胶原酶和DNase的混合物)或两者的组合,并且可以手动或通过仪器(例如,Qiagen DSC-400、gentleMACS)进行。
单细胞技术已成为生物医学研究的首选工具。在神经生物学中,大脑中的细胞多样性及其功能的复杂性需要高分辨率和高通量分析,以可视化稀有细胞群并评估其异质性11,12,13,14。将单个细胞的细胞身份和基因调控机制联系起来,可以深入了解大脑发育和生理学。另一个例子是在传染病、自身免疫或癌症疾病背景下的免疫反应研究,这些疾病强烈依赖于单细胞分析。免疫细胞亚群的异质性及其活性的复杂性以及与其他细胞类型的相互作用需要单细胞分辨率来破译免疫反应的潜在机制。免疫细胞起源于骨髓,其中造血祖细胞由逐渐分化的细胞组成,这些细胞在离开骨髓到外围之前,在整个逐步过程中获得和失去细胞表面标志物。单细胞分析可以对细胞发育阶段进行微小的表征。它可以通过单细胞表型分析来实现,通常通过多参数流式细胞术进行。然而,单细胞转录组学特征已被证明可以更精确地识别祖细胞亚型,因为这些细胞分布在彼此落入的簇中,因此在使用粗细胞表面标记方法15时可能会被错误识别。越来越多的研究揭示了造血干细胞和祖细胞 (HSPC) 可以通过暴露于各种药物获得的表观遗传修饰,从而对免疫系统的长期反应性产生重大影响 16,17,18,19。新颖的多组学技术能够以单细胞分辨率研究这些过程。
已经描述了许多用于脑11,20,21,22和骨髓样本23,24的细胞和细胞核分离方案。为了尽量减少由于实验变异性引起的偏差,有必要验证用于联合单细胞转录组学和表观基因组测序的优化单核制备方案,从而确保单细胞多组学检测的可重复性。
本文介绍了两种用于从(1)新鲜冷冻脑组织和(2)新鲜骨髓HSPC制备细胞核的稳健方案,用于下游单细胞多组分析(图1)。
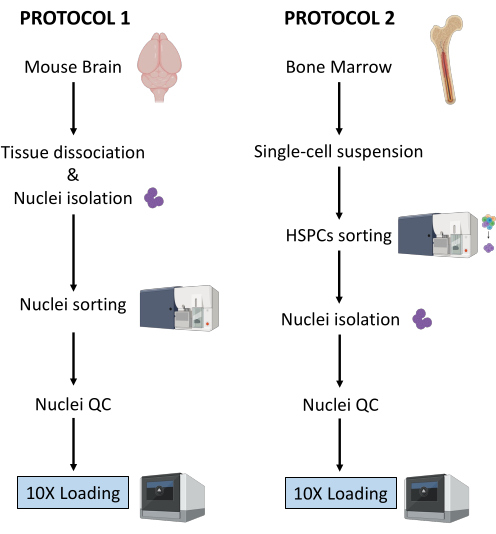
图 1:从新鲜冷冻的大脑和骨髓组织中分离细胞核的方案示意图。 请点击这里查看此图的较大版本.
研究方案
实验程序是在严格遵守动物实验伦理委员会 (CETEA) 批准的协议的情况下进行的。对于脑核分离,使用3个月大的C57BL / 6小鼠。对于骨髓分离,使用体重为18 g的8周龄雌性C57BL / 6J小鼠。
1. 从小鼠大脑中纯化细胞核
注意: 在手术过程中始终佩戴乳胶或丁腈手套。强烈建议由两个人进行实验,由一个人进行步骤1至3(即单核悬浮液的制备),步骤4(即分选仪的制备)由另一个人并行进行。由于该方案具有高度的时间敏感性,因此在制备单核悬浮液后立即准备好分选仪,从而最大限度地减少样品处理时间至关重要。
- 试剂和材料的制备
- 通过高压灭菌器(在121°C下20分钟)仔细灭菌解剖工具,并在使用前用70%乙醇洗涤。每个样品准备一个培养皿,装满 2-3 mL 冰冷的 1x Dulbecco 磷酸盐缓冲盐水 (DPBS)。
- 将微量离心机冷却至4°C,用冰块装满桶,然后将玻璃弹均质器放在冰上。
- 通过加入终浓度为 0.01% 的洋地黄皂苷制备细胞核裂解缓冲液,每个样品 10 mL。
- 通过向细胞染色缓冲液中加入 RNase 抑制剂来制备染色缓冲液,终浓度为 0.2 U/μL,每个样品 20 mL。
- 通过添加 RNase 抑制剂制备 DPBS 0.04% BSA,终浓度为 0.2 U/μL,每个样品 2 mL。
- 根据 Multiome 方案25 制备 1 mL 稀释的细胞核缓冲液。
- 将所有试剂和样品放在冰上。
- 组织解剖
- 使用该机构批准的方案处死小鼠。在该方案中,小鼠在氯胺酮/甲苯噻嗪过量后被斩首。
- 用剪刀剪掉老鼠的头部,然后从头骨中取出大脑,如Meyerhoff等人26所述。立即将大脑转移到在发光二极管(LED)照明体视显微镜下用冰冷的1x DPBS制备的培养皿中。
- 用手术刀切割脑组织以分离感兴趣的大脑区域(例如,内嗅皮层、海马体、前额叶皮层),并将每个区域转移到含有冰冷 1x DPBS 的单独培养皿中。保持在冰上。
- 用手术刀将组织切成 <0.5 厘米的小块,以方便在下一步中均质化。
- 使用 P1000 微量移液管,将切碎的组织和 1x DPBS 从培养皿转移到 1.5 mL 试管中。确保使用由蛋白质低结合塑料制成的管子。让组织碎片在重力作用下分离。使用P1000微量移液器小心地去除多余的1x DPBS。
注意:在此步骤之后,可以通过将蛋白质低结合管转移到干冰中,然后在-80°C下储存直至进行细胞核分离来快速冷冻切碎的组织。
- 细胞核分离
- 用含有 0.01% 洋地黄皂苷的 2 mL 冰冷细胞核裂解缓冲液填充玻璃杯。将纸巾片加入 dounce。
注意:如果使用新鲜冷冻组织,将切碎的冷冻组织直接加入细胞核裂解缓冲液0.01%洋地黄皂苷中;之前不要让组织解冻。 - 使用玻璃 dounce 组织均质器用研杵 A 匀浆 25 次,然后用研杵 B 匀浆 25 次,将匀浆转移到 15 mL 管中。
- 再加入 2 mL 含有 0.01% 洋地黄皂苷的冰冷细胞核裂解缓冲液,并在冰上孵育 5 分钟。在4°C下以500× g 离心原子核5分钟。
- 用微量移液管除去上清液,并加入 4 mL 含有 0.01% 洋地黄皂苷的冰冷细胞核裂解缓冲液。在冰上孵育5分钟,并通过40μm细胞过滤器过滤。
- 在4°C下以500× g 离心细胞核5分钟,并用微量移液管除去上清液。
- 加入4mL染色缓冲液洗涤细胞核,并在4°C下以500× g 离心5分钟。 用微量移液管除去上清液,并将沉淀重悬于4mL染色缓冲液中。
- 通过40μm细胞过滤器过滤,并在4°C下以500× g 离心5分钟。 重悬于含 0.04% BSA 的 1 mL PBS 中。
- 细胞核计数,以确保不同样品的组织/细胞核制备的一致性。预计从相同的大脑区域获得相似的细胞核计数:
- 将 10 μL 0.4% 台盼蓝加入 0.5 mL 空管中。加入 10 μL 细胞核并通过移液混合 5 倍。
- 按照供应商的建议,使用自动细胞计数器对细胞核进行计数。将细胞核放在冰上。
- 准备用于分选的细胞核。
注意:提取的细胞核掺入7-AAD,该染色用于通过荧光激活细胞分选仪(FACS)纯化。- 将 100 μL 细胞核转移到 FACS 管中用于未染色的对照。向剩余的细胞核中加入10μL7-AAD,并在4°C下保持5分钟。
- 通过 FACS 对至少 0.5 x 106 个细胞核进行分类,以消除双峰和碎片。
- 用含有 0.01% 洋地黄皂苷的 2 mL 冰冷细胞核裂解缓冲液填充玻璃杯。将纸巾片加入 dounce。
- 使用FACS进行细胞核分选
注意:虽然可以在各种细胞分选仪上进行细胞核分选,但此处描述了使用BD FACSAria Fusion或BD FACSAria III仪器的程序。强烈建议在监督下或由有经验的仪器用户进行细胞分选仪的校准和设置。为了减少样品处理时间,在制备单核悬浮液后立即准备好分选仪至关重要。- FACS仪器的校准
- 打开细胞分选仪和计算机。将软件连接到仪器后,启动流体启动程序。在主菜单中选择 Cytometer > Fluidic start-up,然后按照四个步骤操作。完成每个任务后单击 “完成 ”。
- 插入70μm喷嘴,打开流,让流稳定15分钟。调整振幅以获得液滴形成,然后单击 Sweet Spot。
- 将中性密度 (N.D) 过滤器 1.0 打开流式细胞仪设置和跟踪 (CST) 接口。
- 日常质量控制:在 FACS 培养基中稀释 CST 微珠(参见供应商的建议)并执行 CST 控制。完成后,将 N.D 1.0 替换为 N.D 2.0。
- 在FACS培养基中稀释Accudrops(参见供应商的建议)并按照步骤6至10中所述执行滴落延迟。
- 在实验模板中,选择 Accudrop Drop Delay 实验,然后打开试管的 分选布局 。
- 在相机下方窗口内,单击 “电压 ”,然后单击“ 光学滤光片 ”,以便在偏转板上施加电荷,并在相机前方使用特定的光学滤光片。确保右侧的象限指示 100。如有必要,调整红色激光螺钉以优化激光冲击。
- 调整流速以达到每秒 1,000 到 3,000 个事件的速度。
- 单击 排序 和 取消。确保左象限等于 100,右象限为 0。如果左象限低于 95,请执行 自动延迟。
- 单击 “电压”,然后单击 “测试排序”。控制收集管中沉积的侧流的质量。如果需要,通过移动滑块来调整侧流的位置。
- 设置用于细胞核分选的FACS仪器。
- 开始采集未染色的细胞核。这些用于定义前向和侧向散射,以及7-ADD参数的检测器电压。设置参数,使未染色样品的 7-AAD 信号落在点图上对数刻度的前十个十年内。
- 开始获取 7-AAD 染色的细胞核管,并使用基于 (1) FSC-A/SCC-A 的门控策略定义细胞核群,然后使用 FSC-H/SSC-H 的大小和粒度,(2) FSC-H/FSC-A 用于双峰鉴别,以及 (3) SSC-A/7-AAD 用于 7-AAD 阳性细胞核(见 图 2A)。
- 确保流和挠度稳定。
- 在侧流相机中,打开测试分选、电压 ON,并确认安装在左侧的 1.5 mL 试管中的准确液滴分选。
- 在 “排序布局 ”窗口中,选择感兴趣的总体,如步骤 2(上文)中所定义。在 “目标事件”中,选择 “连续 ”中的阈值,以获得每个样品至少 0.5 x 106 个原子核。在 “精度”下,选择 “4-Way Purity”。
- 准备就绪后,单击 “排序 ”和 “确定 ”以开始进行细胞核排序。
- FACS仪器的校准
- 纯化细胞核的质量控制和计数
注意:此步骤仅在中试实验期间进行,以优化样品制备步骤,目的是测试要加载到 10X 铬芯片上的分选核的纯度。一旦方案完全优化,不建议在后续实验中执行此质量控制步骤,以避免不必要的浪费可能少量收集的细胞核。- 通过流式细胞术进行纯度控制
- 将 10 μL 分选的细胞核转移到含有 90 μL DPBS 和 2% 热灭活胎牛血清 (HI-FBS) 的新 FACS 管中。
- 采集并记录分选后数据,以验证分选纯度和活力。确保至少 98% 的细胞核出现在 4.2 中定义的感兴趣门中(见 图 2B)。
- 计数纯化的细胞核
- 将细胞核在500× g 和4°C下离心5分钟,并使用微量移液管小心地完全除去上清液。重悬于100μL稀释的细胞核缓冲液中。
- 将 10 μL 0.4% 台盼蓝加入 0.5 mL 空管中。加入 10 μL 分选的细胞核,并通过移液混合 5 倍。
- 按照供应商的建议,使用自动细胞计数器对细胞核进行计数。将细胞核浓度调节至 3.5 x 106/mL,即每 5 μL 16,000 个细胞核。
- 通过显微镜对纯化细胞核进行质量控制
注意:此步骤仅在中试实验期间进行,以优化样品制备步骤,以测试要加载到 10X 铬芯片上的原子核的质量。一旦方案完全优化,不建议在后续实验中执行此质量控制步骤,以避免不必要的浪费可能少量收集的细胞核。- 确保显微镜载玻片和盖玻片清洁无尘。如果需要,用无水乙醇清洗和冲洗盖玻片,然后用无绒湿巾擦干。
- 将 25 μL 聚-l-赖氨酸分布在将使用的载玻片孔中,并在室温 (RT) 下孵育 10 分钟,避免灰尘。
- 除去过量的聚-l-赖氨酸,加入10μL纯化的细胞核悬浮液。在室温下孵育5分钟,避免灰尘。
- 在每个孔中加入一滴封固剂,避免气泡。
- 将盖玻片放在播种孔的顶部。用纸巾盖住盖子并用力按压盖玻片以去除多余的安装介质。注意不要移动盖玻片,也不要清洁多余的安装介质。
- 使用具有明场光的倒置显微镜拍摄多张图像,最小放大倍率为 40 倍。
- 通过流式细胞术进行纯度控制
- 进行多组测定。
- 立即前往 Chromium Next GEM 单细胞多组组 ATAC + 基因表达用户指南 (CG000338 - Rev F)25。
2. 从小鼠骨髓造血干细胞和祖细胞(HSPC)中纯化细胞核
注意 本方案描述了从骨髓HSPC的三个亚群纯化细胞核:谱系-c-Kit+Sca-1+造血干细胞(HSC),谱系-c-Kit+Sca-1-CD34+FcγR-共同髓系祖细胞(CMP)和谱系-c-Kit+Sca-1-CD34+FcγR+粒细胞-单核细胞祖细胞(GMP)。在手术过程中始终佩戴乳胶或丁腈手套。该协议是对 10X 基因组学演示协议 - 单细胞多组组 ATAC + GEX 测序的细胞核分离 (CG000365 - Rev C)27 的改编。在原始方案中引入了修改,以最大限度地提高细胞核回收率。强烈建议让两个人进行实验,以执行步骤 1。至 3.(即,单细胞溶液的制备)由一个人进行,步骤4(即,分选仪的制备)由另一个人并行进行。由于该方案对时间非常敏感,因此在制备单细胞悬浮液后立即准备好分选仪,从而最大限度地减少样品处理时间至关重要。
- 试剂和材料的制备
- 在桶里装满冰块。
- 制备 FACS 缓冲液:用 2% HI-FBS 溶液(6 个样品约 500 mL)的 DPBS,并通过 0.2 μm 过滤器过滤。
- 制备收集培养基:含有10%HI-FBS溶液(每个样品500μL)的DPBS,并通过0.2μm过滤器过滤。
- 骨髓细胞的分离
- 使用该机构批准的方案处死小鼠。在该实验中,小鼠在氯胺酮/甲苯噻嗪过量后因宫颈脱位而被处死。
- 用70%乙醇喷洒小鼠的腹部和后腿。
- 使用无菌镊子和剪刀在下腹部中间做一个小切口,从后腿根部到横膈膜打开腹膜(补充图1)。
- 为垂直于打开的腹膜的每条后腿做一个额外的切口,然后抓住其中一个额外切口的任一侧并将其拉开,从两条后腿的皮肤剥落到踝关节处,露出两条后腿的肌肉(补充图1A)。
- 将剪刀沿着一条后腿髋关节处的脊柱对齐,以在不切穿股骨的情况下剪出腿(补充图 1B、C)。对另一条腿重复相同的操作。
- 为了隔离股骨,切掉大部分肌肉组织,然后用指尖握住每只手的股骨和胫骨关节(补充图1D,E)。轻轻地将腿折叠在自然弯曲处,使胫骨与股骨脱位(补充图1E),然后用剪刀小心地剪断结缔组织,将股骨和胫骨分开。
- 使用剪刀轻轻扭转动作,使股骨顶端的脊柱脱位(补充图1E)。
- 用薄纸清洁孤立的股骨,以去除剩余的肌肉和结缔组织。
- 在装有 2 mL DMEM (1x) + GlutaMAX-I 的 12 孔板中保持冰冷。
- 收集所有股骨后,确保肌肉和纤维组织从骨骼中完全去除。不要将骨头切开,以(a)保持骨髓在内无菌,(b)避免在孔中丢失细胞。使用以下步骤冲洗一只小鼠的两个股骨中的细胞,改编自 Haag 和 Murthy28。
- 准备一个 1.5 mL 管和一个 0.5 mL 试管。向 1.5 mL 试管中加入 150 μL FACS 缓冲液,然后用 18 G 针头在 0.5 mL 试管底部戳一个孔,并将 0.5 mL 试管放入 1.5 mL 试管中。
- 使用小鼠手术剪刀打开每根股骨的远端部分(补充图1F):将远端骨骺锁定在刀片之间,并在翻转剪刀的同时轻轻按压,以平滑地分离远端骨骺,而不会严重切开骨头。如果成功,在现在暴露的骨骺末端应该可以看到 4 个突起(补充图 1G)。
- 将两个股骨的开口端朝下放入准备好的 0.5 mL 管中,该管放置在含有 FACS 缓冲液的 1.5 mL 管内(补充图 1H)。
- 将 70 μm 细胞过滤器放在 50 mL 试管上,并用 2 mL FACS 缓冲液预润湿过滤器。
- 要冲洗骨髓,请以 12,000 x g 的速度离心管(盖子打开),直到离心机达到 12,000 x g 值,然后立即停止离心机。
- 验证骨髓细胞在 1.5 mL 管中沉淀并且股骨是白色的(在细胞冲洗之前,它们是红色的)(补充图 1I)。丢弃带有 2 个股骨的 0.5 mL 管。
- 使用移液管弃去 150 μL 上清液。
- 用微量移液管将沉淀重悬于1mL氯化铵钾(ACK)裂解缓冲液中,室温裂解红细胞1-2分钟。避免较长的孵育时间,因为它们可能导致有核细胞的活力降低。
- 通过预润湿的 70 μm 细胞过滤器转移到 50 mL 管中。
- 加入 10 mL FACS 缓冲液以稀释 ACK 裂解缓冲液,并停止裂解。
- 在4°C下以400× g 离心5分钟。 首先重悬于 1 mL 中,然后加满 9 mL,重悬于 10 mL FACS 缓冲液中。
- 按照 1.3.8 中所述准备要计数的单元格。
- 按照供应商的建议,使用自动细胞计数器对细胞进行计数。预计将从 2 个股骨中收集约 4000 万个细胞。
- 骨髓HSPC染色
- 在4°C下以400×g离心细胞5分钟,并用微量移液管在FACS缓冲液中重悬沉淀至终浓度为1×107 个细胞/ mL。
- 使用P1000微量移液管,将悬浮液转移到FACS管中,通过35μm细胞过滤器盖过滤。
- 为 表1 中列出的每种抗体准备单色试管样品,以在细胞分选仪上设置荧光染料的补偿:
- 每个抗体准备一个 FACS 管,并用 200 μL PBS 填充管。
- 在每个荧光染料偶联抗体的 FACS 管中加入 15 μL 荧光染料补偿微珠。在未染色和活/死单染细胞的 FACS 管中,添加 500,000 个细胞而不是磁珠。
- 将每种荧光染料偶联抗体(见 表 1)加入 1 μL 到其相应的 FACS 管中。将 0.5 μL 活/死染色剂加入活/死单染色剂 FACS 管中。
- 在冰上保持 15 分钟避光。
- 如 表 2 所示准备混合物 1 和 2。
注: 表 2 中所示的抗体体积对 材料表中引用的抗体有效。它们需要针对任何新的抗体参比或不同批次的相同抗体参比进行优化。 - 将 300 μL 混合物 1 加入样品管中,重悬,并在避光的冰上保存 15 分钟。
- 将 300 μL 混合物 2 加入样品管中,重悬,并在避光的冰上保存 20 分钟。
- 向单染试管和混合染色样品管中加入 3 mL FACS 缓冲液。在 4°C 下以 400 x g 旋转 5 分钟。
- 使用微量移液管小心地弃去上清液,并将沉淀重悬于500μLFACS缓冲液中。
- 制备预装有 500 μL 收集培养基的 1.5 mL 试管。
注意:混合物 1 是在 DPBS 中制备的,因为它含有受 HI-FBS 显着影响的活/死染色剂。一旦细胞被活/死染色,加入混合物 2,其中包含重悬于含有 HI-FBS 的 FACS 缓冲液中的荧光染料偶联抗体。唯一的例外是抗体混合物 1 中包含的抗 CD16/32 抗体,可作为 Fc 受体阻滞剂,防止与以下步骤中添加的其他抗体进行非特异性结合。
- 使用FACS进行细胞分选
注意:虽然可以在各种细胞分选仪上进行细胞分选,但这里描述了使用BD FACSAria Fusion或BD FACSAria III仪器的程序。强烈建议在监督下或由有经验的仪器用户进行细胞分选仪的校准和设置。- FACS仪器的校准:请参阅协议1步骤4.1。
- 设置用于细胞分选的 FACS 仪器:
- 开始采集未染色的细胞。这些用于定义每个荧光团的前向和侧向散射以及检测器电压。设置参数,使每个荧光团的荧光信号落在点图上对数刻度的前十进制内。
- 获取单色控件以手动设置补偿(正和负总体的中位数应对齐)或使用自动计算软件(坡度测量)。确保补偿控制与实验荧光染料和检测器设置相匹配。记录 10,000 个细胞事件和 5,000 个磁珠事件。
- 使用样品管(即多染色细胞)通过 使用图3A所示的门控策略来定义感兴趣的细胞群。按照步骤 4 - 6(如下)操作。
- 为了识别感兴趣的三种骨髓 HSPC(HSC、CMP 和 GMP),使用大小 (FSC-A) 和粒度 (SSC-A) 开始门控白细胞,然后使用 FSC-H/FSC-A 来区分双峰。
- 基于SSC-A/死细胞标记物,门控活细胞。使用 Lineage/c-Kit 选择谱系阴性且表达中高水平 c-Kit 的细胞。通过 c-Kit/Sca-1,门接 lineage-c-Kit+ Sca-1+ (LKS+) HSC,三个感兴趣的群体之一。
- 在骨髓祖细胞(lineage-c-Kit+Sca-1-)中,使用FcγR/CD34排除CD34-FcγR-巨核细胞和红系祖细胞(MEP),同时在待分选的细胞群中包括CD34+ FcγR-CMP以及CD34+FcγR+ GMP。
- 确保流和偏转稳定。
- 在侧流热像仪中,打开测试分选,电压打开,并确认安装在左侧的 1.5 mL 试管中的准确液滴分选。
- 在 “排序布局 ”窗口中,选择感兴趣的群体(即本例中显示的“LKS+”和“CD34+ 髓系祖细胞”)。在 “设备”下,选择 “2 管”。在 “精度”下,选择“ 纯度”。在 “目标事件”中,选择 “连续 ”以对 160,000 到 200,000 个 LKS+ 和 CD34+ 髓系祖细胞进行排序。
- 将 500 μL FACS 缓冲液加入细胞悬液中,并通过过滤将 1 mL 样品转移到新的 35 μm 细胞过滤器盖的 FACS 管中,以确保所有细胞在采集前都处于单个悬浮液中。这消除了可能堵塞仪器的细胞团块。
- 准备就绪后,单击 “排序 ”和 “确定 ”开始排序。调整 流速 以将速度保持在每秒 10,000 个事件以下。
注意:对于处于稳定状态的成年(8-12 周龄)C57BL/6J 雌性小鼠,LKS + 与CD34 + 髓系祖细胞的预期比例为1:3。通常在分选后 30 分钟内达到目标分选的细胞编号。
- 分选细胞的质量控制和计数
注意:此步骤仅在优化样品制备步骤的中试实验期间进行,目的是测试用于细胞核分离的分选细胞的纯度。一旦方案完全优化,不建议在后续实验中执行此质量控制步骤,以避免不必要的起始材料浪费,这些起始材料可能以少量用于细胞核分离。- 通过流式细胞术进行纯度控制
- 将 10 μL 分选的细胞转移到含有 90 μL FACS 缓冲液的新 FACS 管中。
- 采集并记录分选后数据,以验证分选纯度和活力。确保至少95%的细胞出现在目标门中,如图 3-6所示,如图3B所示。
- 通过流式细胞术进行纯度控制
- 从分选的骨髓 HSPC 中分离细胞核
- 使用 10X Genomics 演示方案 - 单细胞多组组 ATAC + GEX 测序的细胞核分离 (CG000365 - Rev C)27 附录中的“低细胞输入细胞核分离”协议,并进行了以下修改以优化细胞核回收率:
- 裂解时间:运行该方案的试点实验,以确定细胞核分离的最佳裂解时间。确保在保持完整细胞核的同时实现完全的细胞裂解。
注意:上述10X Genomics协议27 的步骤f指示“在冰上孵育[在裂解缓冲液中]3-5分钟”。在中试实验期间,测试至少 3 分钟、4 分钟和 5 分钟,并通过计数和流式细胞术和显微镜成像评估回收的细胞核数量和质量,以选择最佳裂解持续时间(请参阅下面的这些质量控制检查的描述)。为了备用试剂,在中试实验中用PBS 0.04%BSA替换稀释的细胞核缓冲液。对于骨髓 HSPC,3 分钟被确定为最佳裂解持续时间。 - 细胞离心:对于所有细胞悬浮离心,在4°C下以300× g 离心7分钟(而不是CG000365 - Rev C中的5分钟)27 。
- 原子核离心:按照CG000365 - RevC 27,以500×g进行所有原子核悬浮离心5分钟。
- 细胞核收集:在步骤b中,重悬于50μL PBS 0.04%BSA中并转移到0.2 mL管中后,向原始管中加入50μL PBS 0.04%BSA并移液混合以收集任何剩余细胞。转移到 0.2 mL 管中,达到总体积 100 μL。
- 此后,总体积将为 100 μL,而不是方案的 50 μL。相应地调整下游步骤(例如,对于步骤d,去除90μL而不是45μL;对于步骤e,添加90μL裂解缓冲液而不是45μL)。
- 对于步骤m,将细胞核沉淀重悬于12μL稀释的细胞核缓冲液中,而不是7μL中。
- 计算分离的原子核。在 0.5 mL 空管中,加入 10 μL 0.4% 台盼蓝和 8 μL 0.04% BSA PBS。
- 向试管中加入 2 μL 细胞核并计数细胞核,如 1.3.8 中所述。按照供应商的建议使用自动细胞计数仪。
- 裂解时间:运行该方案的试点实验,以确定细胞核分离的最佳裂解时间。确保在保持完整细胞核的同时实现完全的细胞裂解。
- 使用 10X Genomics 演示方案 - 单细胞多组组 ATAC + GEX 测序的细胞核分离 (CG000365 - Rev C)27 附录中的“低细胞输入细胞核分离”协议,并进行了以下修改以优化细胞核回收率:
- 通过流式细胞术进行纯度控制
注意:此步骤仅在中试实验期间进行,以优化样品制备步骤,以测试要加载到 10X Chromium 芯片上的细胞核的纯度。一旦方案完全优化,不建议在后续实验中执行此质量控制步骤,以避免不必要的浪费可能少量收集的细胞核。- 完成细胞核分离后,将 6 μL 细胞核重悬转移到预装有 150 μL FACS 缓冲液的新 FACS 管中。加入 3 μL 7-AAD,在冰上孵育 5 分钟。
- 采集并记录分选后数据,以验证分选纯度和活力。确保至少 95% 的细胞核出现在目标门中,如协议 1 步骤 4.2 中所定义(见 图 4)。
- 通过显微镜对纯化细胞核进行质量控制:
注意:此步骤仅在中试实验期间进行,以优化样品制备步骤,以测试要加载到 10X Chromium 芯片上的细胞核的质量。一旦方案完全优化,不建议在后续实验中执行此质量控制步骤,以避免不必要的浪费可能少量收集的细胞核。- 按照步骤 1.5.3 中的说明继续操作。
- 进行多组测定
- 立即前往 Chromium Next GEM 单细胞多组组 ATAC + 基因表达用户指南 (CG000338 - Rev F)25。
结果
上述两种方案详细说明了从两种不同类型的组织开始分离细胞核。两种协议之间的差异和相似之处示意性地表示在 图 1 中。
从小鼠大脑中纯化细胞核
在这里描述的方案中,我们提出了一种从脑样本中制备细胞核的温和方法。它首先在裂解缓冲液中对脑组织进行机械解离,然后进行洗涤和过滤器过滤步骤,从悬浮液中去除剩余组织。随后通过FACS去除碎片、未裂解的细胞和小颗粒,以保证仅加载纯化的细胞核用于下游Multiome方案。 图 2 显示了分选前后的细胞核分布。在过滤之后和细胞核分选之前,样品中含有大量碎片,超过99%的“单线体”对细胞核染色(7-AAD)呈阳性,表明细胞裂解最佳(图2A)。细胞核根据 7-AAD 正门进行排序。采集一部分分选材料以验证制备的原子核的纯度。 图2B 显示了分选后的脑核轮廓。细胞核分选使细胞核纯度从最初的36%(图2A)增加到几乎100%(图2B)。
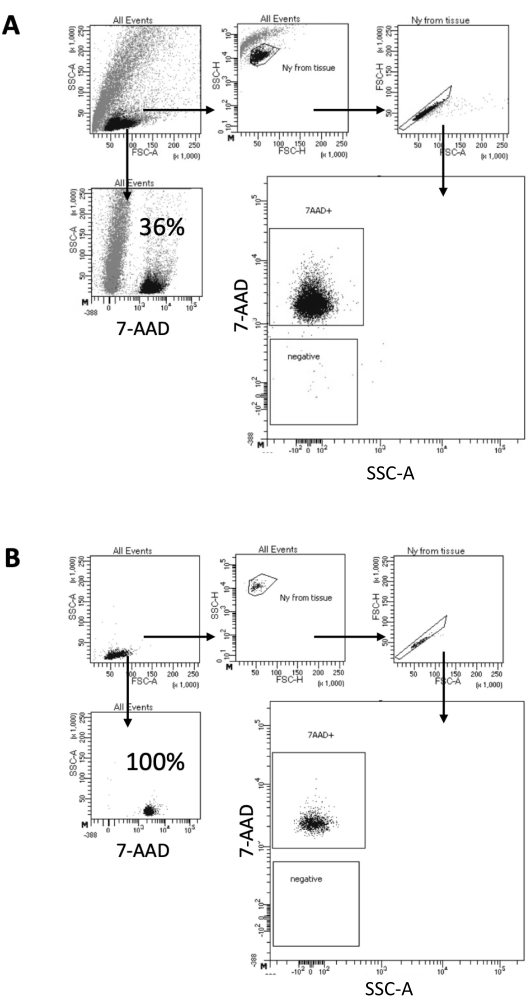
图2:细胞核分选和分选后纯度测试的门控策略。 细胞核用7-AAD染色,并由细胞分选仪采集。(A)首先根据原子核的大小和粒度(分别为FSC-A和SSC-A)对原子核进行门控。然后根据其FSC-A / FSC-H特性和7-AAD染色选择单个颗粒。(B)细胞分选后,使用与 A相同的门控策略测试来自收集管的细胞核的一部分的纯度。 请点击这里查看此图的较大版本.
小鼠骨髓造血干细胞祖细胞(HSPC)的纯化
从骨髓中分离后,根据图3A所示的门控策略,通过FACS对多达2 x 105个HSPC进行分类。评估分选效率和样品纯度(图3B)。
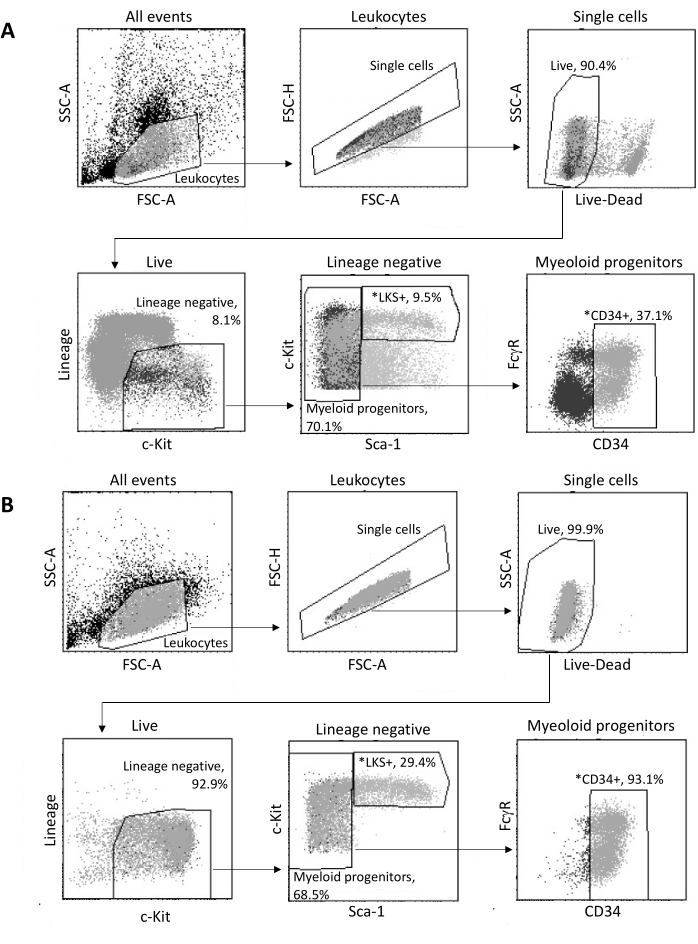
图 3:骨髓 HSPC 分选的门控策略。 (A) 一种具有代表性的 FACS 门控策略,用于分选活的 LKS+ 造血干细胞和 CD34+ 髓系祖细胞以进行细胞核分离。(B) 用于验证分选细胞群纯度的代表性 FACS 图。图中显示了不同细胞亚群相对于亲本群体的比例。*两个排序的种群。 请点击这里查看此图的较大版本.
“低细胞起始细胞核分离”方案允许从最多 105 个细胞的样品中分离细胞核。它包括少量的离心步骤,从而最大限度地减少细胞/细胞核损失。我们已根据细胞输入量按比例调整裂解和洗涤缓冲液的体积,并增加了离心时间,以实现最大的细胞核回收率。我们进行了一项初步实验,通过计数来评估回收细胞核的数量,并通过流式细胞术和显微镜成像来评估其质量。 图4 显示了细胞裂解后的HSPCs样品。如 图5A所示,该方案产生了高质量的原子核,没有任何可能影响下游多组方案的碎片。
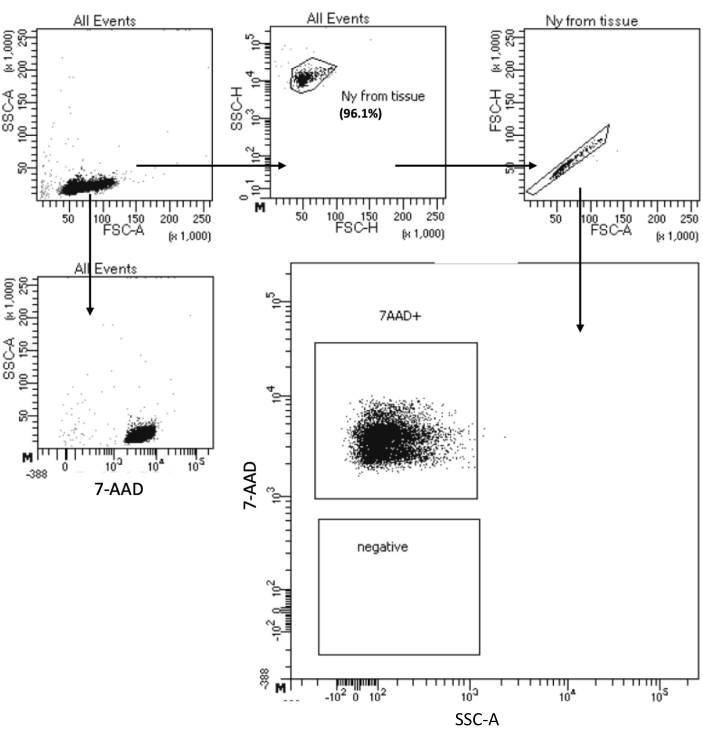
图 4:分离的骨髓 HSPC 细胞核的纯度测试分选。 细胞核用7-AAD染色,并由细胞分选仪采集。首先根据细胞核的大小和粒度(分别为FSC-A和SSC-A)对细胞核进行门控,以评估样品的纯度。细胞核的比例是相对于亲本群体表示的。 请点击这里查看此图的较大版本.
| 管号 | 管名称 | 染色实体 | 染色实体的数量 | 抗体/染料 (μL) | 收集缓冲液 (μL) |
| 1 | 未染色 | 细胞 | 5,00,000 | 不适用 | 200 |
| 2 | LIVE/DEAD 可修复水死细胞染色剂 | 细胞 | 5,00,000 | 0.5 | |
| 3 | APC/Cyanine 7 抗小鼠 CD16/32 (FcγR) | OneComp 电子珠 | 15 微升 | 1 | |
| 4 | Pacific Blue 抗鼠 Lineage 鸡尾酒 | OneComp 电子珠 | 15 微升 | 1 | |
| 5 | PE抗小鼠Ly-6A/E(Sca-1) | OneComp 电子珠 | 15 微升 | 1 | |
| 6 | APC抗小鼠CD117 (c-Kit) | OneComp 电子珠 | 15 微升 | 1 | |
| 7 | FITC抗小鼠CD34 | OneComp 电子珠 | 15 微升 | 1 |
表 1:流式细胞仪上补偿设置的单染色对照。 指示的是所需的单染色对照、要染色的细胞或微珠数量以及抗体数量。
| 预混液 | 试剂 | 最终稀释 | 抗体/染料 (μL) | 缓冲区类型 | 缓冲液 (μL) |
| 混合 1 | APC/Cyanine 7 抗小鼠 CD16/32 (FcγR) | 1/500 | 1.2 | DPBS的 | 300 |
| LIVE/DEAD 可修复水死细胞染色剂 | 1/250 | 2.4 | |||
| 混合 2 | Pacific Blue 抗鼠 Lineage 鸡尾酒 | 1/20 | 30 | FACS缓冲液 | 300 |
| PE抗小鼠Ly-6A/E(Sca-1) | 1/200 | 3 | |||
| APC抗小鼠CD117 (c-Kit) | 1/200 | 3 | |||
| FITC抗小鼠CD34 | 1/50 | 12 | |||
| 总染色量 | 600 |
表2:骨髓HSPC染色混合物的组成。 图中显示了对一个含有 4000 万个细胞的样品进行染色所需的试剂体积。要染色更多数量的样品,请将指示体积乘以所需样品数量,并添加额外样品体积的一半,以确保预混液的体积足够。
补充图1:骨髓细胞分离方案。 (A) 打开腹膜。白色虚线表示要切割的线。(B)将后腿的皮肤剥下后,将剪刀沿着髋关节处的脊柱划线,在不切穿股骨的情况下剪出腿。(C)腿部在去除肌肉之前与身体分离的外观。(D)去除肌肉后腿部的外观。(E) 在膝关节处分离股骨,然后在髋关节处分离股骨的程序,注意不要切开股骨。白色弯曲箭头表示所需的运动。白色虚线箭头表示使用剪刀轻轻捏住要分开的区域。 (F) 通过用剪刀牢固地抓住软骨和远端骨骺并将其向后翻转以露出骨髓来打开股骨远端部分(即先前连接到膝关节胫骨的部分)的程序。(G) 在暴露的骺端应可见四个突起,用黑色箭头表示。(H) 股骨的外观,其开口端朝下进入制备的 0.5 mL 管中,放置在含有 150 μL FACS 缓冲液的 1.5 mL 管内。(I) 以 12,000 x g 快速离心后沉淀的骨髓细胞和现在白色股骨的外观。 请点击此处下载此文件。
讨论
制备高质量的细胞或细胞核悬液对于单细胞或单核RNA-Seq和单细胞多组学分析的成功至关重要29,30,31。在这里,我们描述了用于从两种类型的组织(脑和骨髓)进行多组测定的样品制备和细胞核分离的方案。
本文中描述的大脑方案允许从新鲜冷冻的脑组织中回收高质量的细胞核。它包括以下步骤:冷冻组织破碎、细胞核分离、细胞核纯化和制备材料的质量控制。脑组织由许多不同的细胞类型组成,组织解离和细胞核分离的过程应保持初始组织中存在的细胞群比例。在这里,优化了裂解缓冲液组成和孵育时间,以实现组成组织的所有细胞群的完全和温和裂解。
骨髓HSPCs方案有些不同,因为它需要在实验开始时增加一个步骤,以从异质细胞悬浮液中分离感兴趣的细胞群。收集新鲜组织后,裂解红细胞,并富集样品以用于目标细胞亚群。裂解靶细胞,分离细胞核,控制制备材料的质量。
10X Genomics提供了几种经验证的方案,可用于在许多不同的组织中分离细胞核32,33。该公司还将一种细胞核分离试剂盒商业化,该试剂盒具有用于从经验证组织中分离细胞核的简单管道34。然而,这些方案需要额外的优化来定制某些样品的特殊性。例如,需要使用低单元输入的样品。对于这些样品,最具挑战性的步骤是离心,离心需要足够严格以清洁样品,并且需要足够温和以避免细胞/细胞核损失。通过此处描述的方案,我们调整了 10X 基因组学演示方案 - 单细胞多组组 ATAC + GEX 测序 (CG000365 - Rev C) 的细胞核分离,以在这两个要求之间找到微妙的平衡。正如从分选的HSPC制备细胞核的例子中所示,我们提高了细胞核回收率,而对样品的质量没有影响。
另一个挑战是裂解纯化细胞进行细胞核分离的步骤。更苛刻的裂解条件和更长的孵育时间会损坏细胞核,从而影响测序数据的质量。 图 5 显示了使用裂解缓冲液在不同孵育时间时骨髓样品的代表性细胞核成像,并说明了细胞核状态因细胞裂解的不同而可能有多大差异。在 HSPC 的例子中,我们已经确定 3 分钟的裂解是导致看起来健康、完整的细胞核比例最高和受损细胞核比例最低的条件。应针对每种新型样品优化裂解孵育时间。
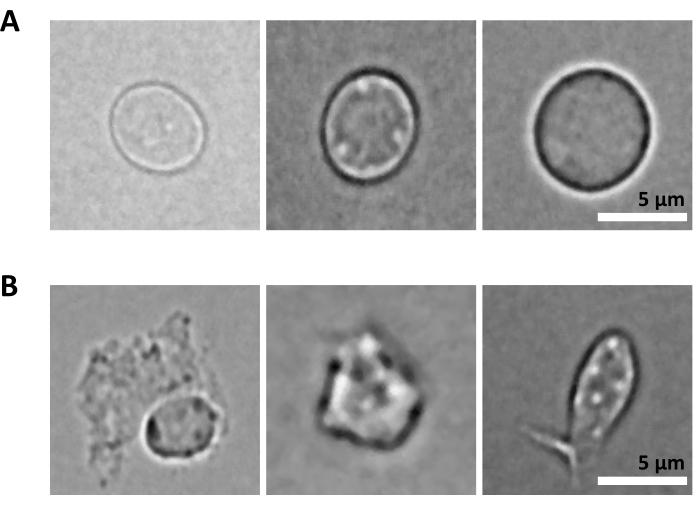
图5:通过显微镜进行细胞核质量控制。 图中显示了从小鼠骨髓中分离出的细胞核的代表性明场图像,其中(A)细胞核完整,(B)细胞核受损。比例尺 5 μm。使用倒置显微镜使用40倍ELWD NA 0.60物镜和1.5倍数码变焦拍摄图像。 请点击这里查看此图的较大版本.
本研究中详述的两种方案都依赖于通过高通量FACS仪器纯化靶细胞或细胞核。该步骤对于从异质悬浮液中分离稀有细胞亚群的单细胞/细胞核制备方案至关重要。在这些情况下,就像这里所示的HSPC分选示例一样,可能需要高维流式细胞术panel来对感兴趣的细胞群进行“门控”。分选速度极快、准确,分选细胞亚群纯度超过 95%。这种方法将细胞悬浮液暴露在高达 70 psi 的压力下,因此可能限制脆性细胞(例如树突状细胞、中性粒细胞)的分选,因为它可能导致其细胞膜破裂。在这些情况下,应选择替代溶液进行细胞纯化,包括磁性分选、应用新一代仪器(例如,CellenOne、Cellenion;MACSQuant Tyto、Miltenyi)35,36 或基于液滴的系统(例如 ODIN、Sensific)37。然而,这些技术的分选速度较慢,细胞分选持续数小时而不是数分钟,是将这些方法应用于基于大细胞数量分析的多组学和其他单细胞应用的活细胞制备的强大限制因素。
对于从组织中分离的细胞核的纯化,由于其通量和分离材料的纯度,FACS是首选方法。细胞核对压力不敏感,过滤后的组织分离物可以通过细胞分选仪轻松纯化。如果实验室没有配备 FACS 仪器,则存在其他替代方案,效率稍低但足够好。例子包括超速离心或使用小型设备,如MARS(应用细胞),使用声波根据颗粒的大小差异分离颗粒;CURIOX层流垫圈,利用细胞/细胞核悬浮液的疏水特性;或依靠细胞的物理特性(悬浮)将它们与碎片分离的 LEVITAS bio。
在这里,我们描述了获得大量细胞核和下游多组组协议的最佳纯度的方案。FACS分选和重复的离心步骤导致初始材料的大量损失。出于这个原因,在我们在这里描述的从大脑中制备细胞核的方案中,需要足够丰富的起始材料,以便在 FACS 分选后收集至少 500,000 个细胞核。如果此标准无法匹配,则应应用替代协议。当使用稀有细胞群或小组织切片时,初始材料的可用量可能是一个限制因素。为了解决这个问题,可以通过以下方法提高细胞核回收率:(a)减少裂解体积,(b)减少洗涤体积,(c)使用单次洗涤,延长离心时间,以尝试提高回收率,如10X Genomics方案中所示,用于低细胞输入细胞核分离。对于低内含材料的多组学分析,值得考虑基于板的应用,例如 scNMT、SNARE-seq 和 Paired-seq38 ,它们需要的起始样品要少得多。
总之,我们描述了两种稳健的方案,用于制备来自大脑和骨髓 HSPC 的细胞核以进行下游多组学分析。这些方案适用于任何需要来自这两种类型组织的高质量单核悬浮液的科学项目,无论提出的科学问题如何。我们小组一直在将脑核分离方案应用于各种靶基因失活后的大脑发育研究以及神经系统疾病背景下的免疫反应研究。我们正在使用骨髓核分离方案来破译各种造血亚群参与免疫系统的建立。
披露声明
作者没有什么可透露的。
致谢
Ana Jeemin Choi 得到了巴斯德-巴黎大学 (PPU) 国际博士项目的津贴支持。
材料
| Name | Company | Catalog Number | Comments |
| 18 G x 1 ½ (1.2 mm x 38 mm) Agani needles | Terumo | AN*1838S1 | |
| 15 mL tubes | Falcon | 352097 | |
| 5 mL round bottom FACS tube with cell strainer cap 35 µm | falcon | 352235 | |
| 50 mL tubes | Falcon | 352070 | |
| 7-AAD | BD pharmagen | 559925 | |
| ACK Lysing Buffer | Gibco | A10492-01 | |
| APC anti-mouse CD117 (c-Kit) | BioLegend | 105812 | Clone: 2B8 |
| APC/Cyanine 7 anti-mouse CD16/32 (FcγR) | BioLegend | 101328 | Clone: 93 |
| BD FACSAria III | BD Biosciences | non-applicable | |
| BD FACSDiva Software v8.0.1 | BD Biosciences | non-applicable | |
| Bovine Serum Albumin stock solution 10% | Miltenyi Biotec | 130-091-376 | |
| Cell staining buffer | Biolegend | 420201 | |
| CFI Suprplan Fluor ELWD 40XC ON 0.6 | Nikon | non-applicable | |
| CMOS camera Prime 95B 25 mm | Photometrix | non-applicable | |
| Countess II FL Automated Cell Counter | Invitrogen | AMQAF1000 | |
| Countess cell counting chamber slide | Invitrogen | C10283 | |
| Coverglass 24 mm x 24 mm 0.13-0.17 mm | Brand | BR470819 | |
| Digitonine 5% | Invitrogen | BN2006 | |
| Disposable Scalpels | Swann-Morton | 0508 | |
| DMEM (1x) + GlutaMAX-I | Gibco | 31966-021 | |
| DPBS (10x) | Gibco | 14200-067 | |
| DTT | Sigma aldrich | 646563 | |
| Epifluorescence inverted microscope Nikon Ti2 -E | Nikon | non-applicable | |
| Eppendorf Safe-Lock Tubes 0.5 mL | Eppendorf | 30123603 | |
| Ethanol 70% | VWR | 83801.290 | |
| FITC anti-mouse CD34 | Invitrogen | 11-0341-85 | Clone: RAM34 |
| Forceps for dissection | FST | 11152-10 | |
| Heat-inactivated Fetal Bovine Serum (FBS) | Gibco | 11533387 | |
| Dounce Homogeniser 2 mL | Bellco glass | 1984-10002 | Pestle “A” Large Clearance: .0030-.0050″ and Pestle “B” Small Clearance: .0005-.0025″ |
| LIVE/DEAD fixable aqua dead cell stain kit | Invitrogen | L34957 | |
| Magnesium chloride solution 1 M | Sigma aldrich | M1028 | |
| Microcentrifuge | Eppendorf | 5424R | |
| Mounting medium Fluoromount-G | invitrogen | 00-4958-02 | |
| Nonidet P40 substitute | Sigma aldrich | 74385 | |
| Nuclease free water | ThermoFischer | AM9932 | |
| Nuclei buffer 20x | 10X Genomics | 2000153/2000207 | |
| Nuclei isolation kit EZ prep | Sigma Aldrich | NUC-101 | |
| OneComp eBeads compensation beads | Invitrogen | 01-1111-41 | |
| Pacific Blue anti-mouse lineage cocktail (including anti-mouse CD3, Ly-6G/Ly-6C, CD11b, CD45R/B220, TER-119) | BioLegend | 133310 | Clones (in the same order as the antibodies listed): 17A2, RB6-8C5, M1/70, RA3-6B2, Ter-119 |
| PCR Tube Strips 0.2 mL | Eppendorf | 951010022 | |
| PE anti-mouse Ly-6A/E (Sca-1) | BioLegend | 122507 | Clone: E13-161.7 |
| Petri dish 100 mm x 20 mm OPTILUX | Falcon | 353003 | |
| Ply-L-lysine 0.01% sterile-filtered suitable for cell culture | Sigma | P4707 | |
| Printed microscope slides 8 well 6 mm numbered | Epredia | ER-301B-CE24 | |
| Protein LoBind Tubes 1.5 mL | Eppendorf | 30108116 | |
| Recombinant Rnase inhibitor 5000 U | Takara | 2313A | |
| Scissors for dissection | FST | 14090-09 | |
| Sodium chloride solution 5 M | Sigma aldrich | 59222C | |
| Syringe filters, PES, 0.2 µm | Fisher Scientific | 15206869 | |
| Transparent nail polish | any | non-applicable | |
| Trizma Hydrochloride solution pH 7.4 | Sigma aldrich | T2194 | |
| Trypan Blue 0.4% | gibco | 15250061 | |
| Tween 20 | Biorad | 1662404 | |
| UltraPure Distilated Water Dnase/Rnase Free | Invitrogen | 10977-035 |
参考文献
- Clark, S. J., et al. scNMT-seq enables joint profiling of chromatin accessibility DNA methylation and transcription in single cells. Nature Communications. 9 (1), 781(2018).
- Lee, J., Hyeon, D. Y., Hwang, D. Single-cell multiomics: technologies and data analysis methods. Experimental & Molecular Medicine. 52 (9), 1428-1442 (2020).
- Cerrizuela, S., et al. High-throughput scNMT protocol for multiomics profiling of single cells from mouse brain and pancreatic organoids. STAR Protocols. 3 (3), 101555(2022).
- Dimitriu, M. A., Lazar-Contes, I., Roszkowski, M., Mansuy, I. M. Single-cell multiomics techniques: From conception to applications. Frontiers in Cell and Developmental Biology. 10, 854317(2022).
- Stoeckius, M., et al. Simultaneous epitope and transcriptome measurement in single cells. Nature Methods. 14 (9), 865-868 (2017).
- Cao, J., et al. Joint profiling of chromatin accessibility and gene expression in thousands of single cells. Science (New York, N.Y.). 361 (6409), 1380-1385 (2018).
- Narayanan, A., et al. Nuclei Isolation from Fresh Frozen Brain Tumors for Single-Nucleus RNA-seq and ATAC-seq. Journal of Visualized Experiments: JoVE. (162), e61542(2020).
- Kim, M., et al. Single-nucleus transcriptomics reveals functional compartmentalization in syncytial skeletal muscle cells. Nature Communications. 11 (1), 6375(2020).
- Santos, M. D., et al. Extraction and sequencing of single nuclei from murine skeletal muscles. STAR Protocols. 2 (3), 100694(2021).
- Safabakhsh, S., et al. Isolating nuclei from frozen human heart tissue for single-nucleus RNA sequencing. Current Protocols. 2 (7), e480(2022).
- Lau, S. -F., Cao, H., Fu, A. K. Y., Ip, N. Y. Single-nucleus transcriptome analysis reveals dysregulation of angiogenic endothelial cells and neuroprotective glia in Alzheimer's disease. Proceedings of the National Academy of Sciences of the United States of America. 117 (41), 25800-25809 (2020).
- Armand, E. J., Li, J., Xie, F., Luo, C., Mukamel, E. A. Single-cell sequencing of brain cell transcriptomes and epigenomes. Neuron. 109 (1), 11-26 (2021).
- Morabito, S., et al. Single-nucleus chromatin accessibility and transcriptomic characterization of Alzheimer's disease. Nature Genetics. 53 (8), 1143-1155 (2021).
- Chen, S., et al. Spatially resolved transcriptomics reveals genes associated with the vulnerability of middle temporal gyrus in Alzheimer's disease. Acta Neuropathologica Communications. 10 (1), 188(2022).
- Paul, F., et al. Transcriptional heterogeneity and lineage commitment in myeloid progenitors. Cell. 163 (7), 1663-1677 (2015).
- Kaufmann, E., et al. BCG educates hematopoietic stem cells to generate protective innate immunity against tuberculosis. Cell. 172 (1-2), 176-190.e19 (2018).
- Christ, A., et al. Western diet triggers NLRP3-dependent innate immune reprogramming. Cell. 172 (1-2), 162-175.e14 (2018).
- Moorlag, S. J. C. F. M., et al. β-Glucan Induces protective trained immunity against mycobacterium tuberculosis infection: A key role for IL-1. Cell Reports. 31 (7), 107634(2020).
- de Laval, B., et al. C/EBPβ-dependent epigenetic memory induces trained immunity in hematopoietic stem cells. Cell Stem Cell. 26 (5), 657-674.e8 (2020).
- Renthal, W., et al. Characterization of human mosaic Rett syndrome brain tissue by single-nucleus RNA sequencing. Nature Neuroscience. 21 (12), 1670-1679 (2018).
- Yang, A. C., et al. A human brain vascular atlas reveals diverse mediators of Alzheimer's risk. Nature. 603 (7903), 885-892 (2022).
- Lee, D. R., Zhang, Y., Rhodes, C. T., Petros, T. J. Generation of single-cell and single-nuclei suspensions from embryonic and adult mouse brains. STAR Protocols. 4 (1), 101944(2022).
- Corces, M. R., et al. Lineage-specific and single-cell chromatin accessibility charts human hematopoiesis and leukemia evolution. Nature Genetics. 48 (10), 1193-1203 (2016).
- Ranzoni, A. M., et al. Integrative single-cell RNA-seq and ATAC-seq analysis of human developmental hematopoiesis. Cell Stem Cell. 28 (3), 472-487.e7 (2021).
- 10X Genomics Chromium Next GEM Single Cell Multiome ATAC + Gene Expression User Guide, Document Number CG000338 Rev F. , At https://www.10xgenomics.com/support/single-cell-multiome-atac-plus-gene-expression/documentation/steps/library-prep/chromium-next-gem-single-cell-multiome-atac-plus-gene-expression-reagent-kits-user-guide (2022).
- Meyerhoff,, et al. Microdissection of mouse brain into functionally and anatomically different regions. Journal of Visualized Experiments: JoVE. (168), e61941(2021).
- 10X Genomics 10X Genomics Demonstrated Protocol - Nuclei Isolation for Single Cell Multiome ATAC + GEX sequencing (CG000365 - Rev C). , At https://www.10xgenomics.com/support/single-cell-multiome-atac-plus-gene-expression/documentation/steps/sample-prep/nuclei-isolation-for-single-cell-multiome-atac-plus-gene-expression-sequencing (2022).
- Haag, S., Murthy, A. Murine monocyte and macrophage culture. Bio-Protocol. 11 (6), e3928(2021).
- Haque, A., Engel, J., Teichmann, S. A., Lönnberg, T. A practical guide to single-cell RNA-sequencing for biomedical research and clinical applications. Genome Medicine. 9 (1), 75(2017).
- Jiang, P. Quality control of single-cell RNA-seq. Methods in Molecular Biology (Clifton, N.J). 1935, 1-9 (2019).
- Regan, C., Preall, J. Practical considerations for single-cell genomics. Current Protocols. 2 (8), e498(2022).
- 10X Genomics 10X Genomics Demonstrated Protocol - Nuclei Isolation for Single Cell ATAC Sequencing (CG000169 - Rev E). , At https://www.10xgenomics.com/support/single-cell-atac/documentation/steps/sample-prep/nuclei-isolation-for-single-cell-atac-sequencing (2022).
- 10X Genomics 10X Genomics Demonstrated Protocol - Nuclei Isolation from Complex Tissues for Single Cell Multiome ATAC + Gene Expression Sequencing. (CG000375 - Rev C). , At https://www.10xgenomics.com/support/single-cell-multiome-atac-plus-gene-expression/documentation/steps/sample-prep/nuclei-isolation-from-complex-tissues-for-single-cell-multiome-atac-plus-gene-expression-sequencing (2022).
- 10X Genomics 10X Genomics - Chromium Nuclei Isolation Kit (CG000505 - Rev A). , At https://www.10xgenomics.com/support/single-cell-gene-expression/documentation/steps/sample-prep/chromium-nuclei-isolation-kit-sample-prep-user-guide (2022).
- Shomroni, O., et al. A novel single-cell RNA-sequencing approach and its applicability connecting genotype to phenotype in ageing disease. Scientific Reports. 12 (1), 4091(2022).
- Ocañas, S. R., Pham, K. D., Blankenship, H. E., Machalinski, A. H., Chucair-Elliott, A. J., Freeman, W. M. Minimizing the ex vivo confounds of cell-isolation techniques on transcriptomic and translatomic profiles of purified microglia. eNeuro. 9 (2), (2022).
- Gérard, A., et al. High-throughput single-cell activity-based screening and sequencing of antibodies using droplet microfluidics. Nature Biotechnology. 38 (6), 715-721 (2020).
- Vandereyken, K., Sifrim, A., Thienpont, B., Voet, T. Methods and applications for single-cell and spatial multi-omics. Nature Reviews. Genetics. 24, 494-515 (2023).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。