Method Article
単一核マルチオームアッセイのための高品質脳および骨髄核調製(英語)
要約
単一細胞/単一核のトランスクリプトミクスおよびマルチオミクスの成功は、細胞/核の品質に大きく依存します。したがって、組織からの細胞/核の分離とその精製は高度に標準化されなければなりません。このプロトコルは下流の単一核のmultiomeの試金のための頭脳および骨髄からの核の準備を記述する。
要約
シングルセル解析は、治療や感染に対する個々の細胞応答のばらつきをシングルセルの分解能で評価する必要がある生物学的プロセスの複雑さを解明するための最適なアプローチとなっています。
過去10年間に、単一細胞分子プロファイリングのための多くの技術が開発され、いくつかの専用技術が商業化されています。10X Genomicsの液滴ベースのシングルセルプロファイリングは、トランスクリプトームおよびマルチオミクスのシングルセルプロファイリングにすぐに使用できる試薬を提供する、広く普及している技術です。この技術には、シングルセルおよび単一核RNAシーケンシング(それぞれscRNA-SeqおよびsnRNA-Seq)、scATAC-Seq、シングルセル免疫プロファイリング(BCR/TCRシーケンシング)、およびマルチオームのワークフローが含まれます。後者は、同じ細胞に由来する転写情報(scRNA-Seq)とエピジェネティックな情報(scATAC-Seq)を組み合わせたものです。
組織から単離され、これらのアプローチのいずれかで分析された単一細胞または単一核懸濁液の品質(生存率、完全性、純度)は、高品質のデータを生成するために重要です。したがって、サンプル調製プロトコルは、各生体組織の特殊性に適合させ、高品質の細胞および核懸濁液を確実に生成する必要があります。
本稿では、ダウンストリームのマルチオーム10X Genomicsパイプライン用に脳および骨髄サンプルを調製するための2つのプロトコルについて説明します。プロトコルは段階的に行われ、組織解離、細胞選別、核単離、および細胞の分割とバーコード化、ライブラリ調製、およびシーケンシングの出発物質として使用される調製された核懸濁液の品質管理をカバーしています。これらの標準化されたプロトコルは、高品質の核ライブラリと堅牢で信頼性の高いデータを生成します。
概要
長年にわたり、シングルセル技術は生物学的プロセスの分析のゴールドスタンダードでした。当初は、顕微鏡検査、フローサイトメトリー、および同様のアッセイによる単一細胞表現型に限定されていました。シングルセル解析におけるブレークスルーは、シングルセル分子プロファイリングのアプローチ、特に個々の細胞のトランスクリプトーム全体の特性評価を可能にするシングルセルRNAシーケンシング(scRNA-Seq)の開発によってもたらされました。非常に強力なscRNA-Seqは、特定の条件と時点における細胞の転写状態に関する情報を生成します。しかし、転写を駆動する遺伝子制御や、時間の経過とともに起こる分子修飾については可視化できません。この制限を克服するために、同じ細胞から複数の因子やプロセスを解析できるシングルセルマルチオミクスアッセイの開発に多くの努力が払われてきました1,2,3,4。単一細胞内の2つのモダリティの測定に初めて成功したのは、CITE-Seqアプローチ5において、マルチプレックス表面タンパク質発現パターンを個々の細胞の完全なトランスクリプトームと結びつけることでした。最近の進化では、遺伝子発現とクロマチンアクセシビリティが組み合わされ(シーケンシングを用いたトランスポザーゼアクセス可能クロマチンアッセイ、ATAC-Seq)、それによって同じ細胞内のトランスクリプトームモダリティとエピゲノムモダリティを同時に捕捉するようになりました(例:sci-CAR)6。トランスクリプトミクスを細胞の表現型または同じ細胞のエピジェネティックな変化と関連付けることを可能にした最初の商用ソリューションは、10X Genomicsから生まれました。
単一細胞分子プロファイリングのための実験には、以下のステップが含まれます:(1)組織の解離または単一細胞懸濁液の調製;(2)細胞精製および/または核単離。(3)パーティショニングとバーコード化。(4)図書館の建設と品質管理。(5)次世代シーケンシング;(6)データ分析。ステップ(3)〜(6)は、採用する技術によって大きく異なる場合がありますが、最初のステップは一般的にそれらすべてに共通です。調製された細胞/核懸濁液の品質は、実験の全体的な結果を決定します。組織の種類によっては、高品質の単一細胞/核懸濁液を得ることが困難な場合があります。心臓、筋肉、脳、肺、腸などの一部の組織の特殊性により、分子分析用の高品質の核の産生を保証するために、各タイプのサンプルに適合した組織破壊および核分離の方法が必要です7,8,9,10 .組織破壊法および解離プロトコルは、機械的、酵素的(例えば、コラゲナーゼとDNaseの混合物)、または2つの組み合わせであり、手動または器具(例えば、Qiagen DSC-400、gentleMACS)によって行うことができる。
シングルセル技術は、生物医学研究に最適なツールとなっています。神経生物学では、脳内の細胞の多様性とその機能の複雑さにより、希少な細胞集団を可視化し、それらの不均一性を評価するために、高解像度およびハイスループット分析が必要です11,12,13,14。細胞の同一性と個々の細胞の遺伝子制御機構を結びつけることで、脳の発達と生理学に関する洞察が得られます。別の例としては、感染性疾患、自己免疫疾患、または癌性疾患における免疫応答の研究があり、これは単一細胞解析に強く依存しています。免疫細胞サブセットの不均一性、その活性の複雑さ、他の細胞タイプとの相互作用により、免疫応答の根底にあるメカニズムを解読するには、単一細胞の分解能が必要です。免疫細胞は骨髄に由来し、造血前駆細胞は徐々に分化する細胞で構成されており、骨髄から末梢の家に出る前に、段階的なプロセスを通じて細胞表面マーカーを獲得および喪失します。シングルセル解析により、細胞の発生段階を詳細に評価することができます。これは、従来マルチパラメーターフローサイトメトリーによって行われていたシングルセル表現型によって達成できます。しかしながら、単一細胞トランスクリプトームシグネチャーは、これらの細胞が互いに分類されるクラスターに分布しており、したがって粗い細胞表面マーカーアプローチを使用するときに誤認される可能性があるため、前駆細胞サブタイプのより正確な同定を明らかにすることが示されている15。造血幹細胞および前駆細胞(HSPC)がさまざまな薬剤への曝露から獲得できるエピジェネティックな修飾を明らかにする研究が増えており、免疫系の長期的な応答性に大きな影響を与えています16,17,18,19。新しいマルチオミクス技術により、これらのプロセスをシングルセル分解能で研究することができます。
細胞および核の分離のための多くのプロトコルは頭脳11,20,21,22および骨髄のサンプル23,24のために記述されている。実験のばらつきによるバイアスを最小限に抑えるには、単一細胞トランスクリプトームおよびエピゲノムシーケンシングの結合用に最適化された単一核調製プロトコルを検証し、それによって単一細胞マルチオミクスアッセイの再現性を確保する必要があります。
ここでは、(1)新鮮凍結脳組織および(2)下流のシングルセルマルチオーム解析用の新鮮骨髄HSPCからの核調製のための2つの堅牢なプロトコルについて説明します(図1)。
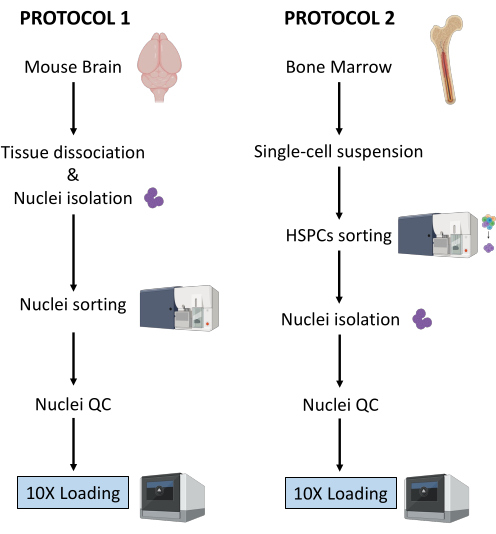
図1:新鮮凍結脳および骨髄組織からの核単離のプロトコルの概略図。 この図の拡大版をご覧になるには、ここをクリックしてください。
プロトコル
実験手順は、動物実験倫理委員会(CETEA)によって承認されたプロトコルの厳格な規制遵守の下で実施されました。脳核の単離には、3ヶ月齢のC57BL/6マウスを用いた。骨髄の単離には、体重18gの8週齢の雌のC57BL/6Jマウスを用いた。
1. マウス脳の核の精製
注意: 処置中は常にラテックスまたはニトリル手袋を着用してください。実験は2人で行い、ステップ1から3(単核懸濁液の調製)は1人で行い、ステップ4(ソーターの調製)はもう1人で並行して行うことを強くお勧めします。このプロトコルは時間的制約が大きいため、単核懸濁液が調製されたらすぐにソーターを準備して、サンプル処理時間を最小限に抑えることが重要です。
- 試薬・材料の調製
- 解剖器具はオートクレーブ(121°Cで20分間)で慎重に滅菌し、使用直前に70%のエタノールで洗浄してください。サンプルごとに1つのペトリ皿を準備し、2〜3 mLの氷冷1x Dulbeccoのリン酸緩衝生理食塩水(DPBS)で満たします。
- 微量遠心分離機を 4 °C に冷却し、バケツに氷を入れ、ガラス製ダウンスホモジナイザーを氷の上に置きます。
- ジギトニンを添加して核溶解バッファーを調製し、最終濃度が0.01%、サンプルあたり10 mLになります。
- RNase阻害剤を細胞染色バッファーに添加して、最終濃度が0.2 U/μL、サンプルあたり20 mLになるように染色バッファーを調製します。
- RNase阻害剤を添加してDPBS 0.04% BSAを調製し、最終濃度が0.2 U/μL、サンプルあたり2 mLになるようにします。
- Multiome プロトコル25 に従って 1 mL の希釈核バッファーを調製します。
- すべての試薬とサンプルを氷上に保管してください。
- 組織解剖
- 施設が承認したプロトコルを使用してマウスを生贄に捧げます。このプロトコルでは、ケタミン/キシラジンの過剰摂取後にマウスを斬首しました。
- マウスの頭をハサミで切り取り、頭蓋骨から脳を取り出します(Meyerhoff et al.26)。発光ダイオード(LED)照射実体顕微鏡の下で、氷のように冷やした1x DPBSで調製したペトリ皿に脳を直ちに移します。
- メスで脳組織を切断して、関心のある脳領域(例:嗅内皮質、海馬、前頭前野)を分離し、各領域を氷冷の1x DPBSを含む別々のペトリ皿に移します。氷の上に置いてください。
- メスで組織を<0.5cmの小片に細かく刻み、次のステップでの均質化を容易にします。
- P1000マイクロピペットを使用して、ミンチ組織と1x DPBSをペトリ皿から1.5 mLチューブに移します。タンパク質の低吸着性プラスチック製のチューブを必ず使用してください。組織片を重力で分離させます。P1000マイクロピペットを使用して、余分な1x DPBSを慎重に除去します。
注:このステップの後、タンパク質低結合チューブをドライアイスに移し、核単離に進むまで-80°Cで保存することにより、ミンチ組織を急速凍結することができます。
- 核の単離
- 0.01%ジギトニンを含む氷冷した核溶解バッファー2 mLをガラスダンプに充填します。ティッシュ片をダンスに追加します。
注:新鮮凍結組織を扱う場合は、みじん切りにした凍結組織を核溶解バッファー0.01%ジギトニンに直接添加します。前にティッシュを解凍させないでください。 - ガラス製の組織ホモジナイザーを使用して、乳棒Aで25回、次に乳棒Bで25回ホモジネートをホモジネートし、ホモジネートを15 mLチューブに移します。
- さらに2 mLの氷冷核溶解バッファーと0.01%ジギトニンを加え、氷上で5分間インキュベートします。核を500 x g で4°Cで5分間遠心分離します。
- マイクロピペットで上清を除去し、0.01%ジギトニンを含む氷冷核溶解バッファー4 mLを加えます。氷上で5分間インキュベートし、40 μmのセルストレーナーでろ過します。
- 核を500 x g で4°Cで5分間遠心分離し、マイクロピペットで上清を除去します。
- 4 mLの染色バッファーを加えて核を洗浄し、500 x g で4°Cで5分間遠心分離します。 マイクロピペットで上清を除去し、ペレットを4 mLの染色バッファーに再懸濁します。
- 40 μmのセルストレーナーでろ過し、500 x g で4°Cで5分間遠心分離します。 0.04% BSAを含むPBS1 mLに再懸濁します。
- 異なるサンプル間で組織/核調製の一貫性を確保するために、核をカウントします。同じ脳領域から同様の核数を得ることが期待されています。
- 空の0.5 mLチューブに0.4%トリパンブルー10 μLを加えます。核10 μLを加え、ピペッティングで5回混合します。
- サプライヤーの推奨事項に従って、自動セルカウンターを使用して核をカウントします。原子核を氷上に保管します。
- 選別用の核を準備します。
注:抽出された核には7-AADが組み込まれており、この染色は蛍光活性化セルソーター(FACS)による精製に使用されます。- 100 μLの核をFACSチューブに移し、未染色コントロールを行います。残りの核に7-AADを10 μL添加し、4°Cで5分間保持します。
- 最低 0.5 x 106 個の原子核を FACS で選別し、ダブレットやデブリを除去します。
- 0.01%ジギトニンを含む氷冷した核溶解バッファー2 mLをガラスダンプに充填します。ティッシュ片をダンスに追加します。
- FACSを用いた原子核選別
注:核選別はさまざまなセルソーターで実行できますが、BD FACSAria FusionまたはBD FACSAria III装置の使用手順をここで説明します。セルソーターの校正とセットアップは、監督下または装置の経験豊富なユーザーが行うことを強くお勧めします。サンプル処理時間を短縮するには、単一核懸濁液が調製されたらすぐにソーターを準備することが重要です。- FACS機器の校正
- セルソーターとコンピューターの電源を入れます。ソフトウェアを装置に接続したら、流体系スタートアップ手順を開始します。メインメニューでCytometer>Fluidic startup-upを選択し、4つのステップに従います。それぞれを完了したら、[ 完了 ]をクリックします。
- 70μmのノズルを挿入し、ストリームをオンにし、ストリームを15分間安定させます。振幅を調整してドロップを形成し、 スイートスポットをクリックします。
- NDフィルター1.0を装着し、サイトメーターのセットアップとトラッキング(CST)インターフェースを開きます。
- 日常の品質管理:CSTビーズをFACS培地で希釈し(サプライヤーの推奨を参照)、CST管理を実施します。完了したら、N.D 1.0 を N.D 2.0 に交換します。
- AccudropsをFACS培地で希釈し(サプライヤーの推奨事項を参照)、ステップ6〜10の説明に従って滴下遅延を実行します。
- 実験テンプレートで、 Accudrop Drop Delay 実験を選択し、チューブの [並べ替えレイアウト ] を開きます。
- 下部のカメラウィンドウ内で、[ 電圧 ]、[ 光学フィルター ]の順にクリックして、偏向板に電荷を印加し、カメラの前で特定の光学フィルターを使用できるようにします。右側の象限が 100 を示していることを確認します。必要に応じて、赤いレーザーネジを調整して、レーザーの衝撃を最適化します。
- 毎秒1,000〜3,000イベントの速度に達するように流量を調整します。
- [ 並べ替え て キャンセル]をクリックします。左の象限が 100 で、右の象限が 0 であることを確認します。左象限が 95 未満の場合は、 自動遅延を実行します。
- [Voltage]をクリックし、[Test Sort]をクリックします。コレクションチューブ内の副流堆積物の品質を制御します。必要に応じて、スライダーを動かしてサイドストリームの位置を調整します。
- 原子核選別のためのFACS装置のセットアップ。
- 未染色の核の取得を開始します。これらは、前方散乱と側方散乱、および7-ADDパラメータの検出器電圧を定義するために使用されます。未染色サンプルの 7-AAD シグナルがドットプロットの対数スケールの最初の 10 年以内に収まるようにパラメーターを設定します。
- (1)FSC-A/SCC-A と FSC-H/SSC-H でサイズと粒度、(2) FSC-H/FSC-A でダブレット識別、(3) SSC-A/7-AAD で 7-AAD 陽性核をベースとしたゲーティング戦略を使用して、7-AAD 染色核のチューブの取得を開始し、核集団を定義します( 図 2A を参照)。
- 流れとたわみが安定していることを確認してください。
- サイドストリームカメラで、テストソートをオンにし、電圧 をオンにして、左側に取り付けた1.5 mLチューブで正確な液滴ソーティングを確認します。
- [ 並べ替えレイアウト ] ウィンドウで、手順 2 (上記) で定義した対象の母集団を選択します。 [Target Events] で、[ Continuous ] のしきい値を選択して、サンプルあたり最小 0.5 x 106 個の核を取得します。 精度(Precision)で、 4 ウェイ純度(4-Way Purity)を選択します。
- 準備ができたら、[ 並べ替え ]と [OK ]をクリックして、原子核の並べ替えを開始します。
- FACS機器の校正
- 精製された核の品質管理と計数
注:このステップは、10Xクロムチップにロードされるソートされた核の純度をテストすることを目的として、サンプル調製ステップを最適化するためのパイロット実験中にのみ実行されます。プロトコルが完全に最適化されたら、追跡実験でこの品質管理ステップを実行して、収集された核が少数で不必要に無駄になるのを避けることはお勧めしません。- フローサイトメトリーによる純度制御
- 選別した核10 μLを、2%熱不活化ウシ胎児血清(HI-FBS)を含む90 μLのDPBSを含む新しいFACSチューブに移します。
- 選別後のデータを取得して記録し、選別純度と実行可能性を検証します。4.2で定義されているように、少なくとも98%の核が目的のゲートに現れるようにします( 図2Bを参照)。
- 精製された核を数える
- 選別した核を500 x g および4°Cで5分間遠心分離し、マイクロピペットを使用して上清を慎重に完全に除去します。希釈した核バッファー100 μLに再懸濁します。
- 空の0.5 mLチューブに0.4%トリパンブルー10 μLを加えます。選別した核を10 μL添加し、ピペッティングで5回混合します。
- サプライヤーの推奨事項に従って、自動セルカウンターを使用して核をカウントします。核濃度を 3.5 x 106/mL、つまり 5 μL あたり 16,000 核に調整します。
- 顕微鏡による精製核の品質管理
注:このステップは、10Xクロムチップにロードされる原子核の品質をテストするためのサンプル調製ステップを最適化するためのパイロット実験中にのみ実行する必要があります。プロトコルが完全に最適化されたら、追跡実験でこの品質管理ステップを実行して、収集された核が少数で不必要に無駄になるのを避けることはお勧めしません。- 顕微鏡のスライドとカバースリップが清潔でほこりがないことを確認してください。必要に応じて、カバーガラスを無水エタノールで洗ってすすぎ、糸くずの出ないワイプで乾かします。
- 使用するスライドウェルに25 μLのポリ-l-リジンを分配し、埃から保護して室温(RT)で10分間インキュベートします。
- 余分なポリ-l-リジンを除去し、精製した核懸濁液10 μLを加えます。埃から保護した室温で5分間インキュベートします。
- 気泡を避けながら、各ウェルに封入剤を一滴加えます。
- 種をまいた井戸の上にカバーガラスを置きます。紙ワイプで覆い、カバーガラスをしっかりと押して余分な封入剤を取り除きます。カバーガラスを動かさないように注意し、余分な封入剤を清掃しないでください。
- 明視野光と最小倍率40倍の倒立顕微鏡でいくつかの画像を撮影します。
- フローサイトメトリーによる純度制御
- マルチオームアッセイを実施します。
- ただちに Chromium Next GEM Single Cell Multiome ATAC + Gene Expression User Guide (CG000338 - Rev F)25 に進んでください。
2. マウス骨髄造血幹細胞および前駆細胞(HSPC)からの核の精製
注 このプロトコルは骨髄HSPCsの3つのサブセットからの核の浄化を記述する: 血統cキット+Sca1+のhematopoietic幹細胞(HSC)、血統cキット+Sca-1-CD34+FcγR-共通の骨髄性前駆細胞(CMP)、および血統cキット+Sca-1-CD34+FcγR+顆粒球 - 単球前駆細胞(GMP)。施術中は常にラテックスまたはニトリル手袋を着用してください。このプロトコルは10Xゲノミクスの適応である - 単一セルMultiome ATAC + GEXの配列(CG000365 - Rev C)27のための核の分離を実証した。元のプロトコルでは、核の回収率を最大化するための修正が導入されています。ステップ1の実験は2人で行うことを強くお勧めします。を 3 に。(すなわち、単一細胞溶液の調製)を1人によって行い、ステップ4(すなわち、ソーターの調製)を別の人によって並行して行う。このプロトコルは時間的制約が大きいため、シングルセル懸濁液が調製されたらすぐにソーターを準備して、サンプル処理時間を最小限に抑えることが重要です。
- 試薬・材料の調製
- バケツに氷を入れます。
- FACSバッファーを調製します:DPBSと2%HI-FBS溶液(6サンプルで約500 mL)と0.2 μmフィルターでろ過します。
- 10% HI-FBS溶液(サンプルあたり500 μL)を含むDPBSを採取し、0.2 μmフィルターでろ過します。
- 骨髄細胞の単離
- 施設が承認したプロトコルを使用してマウスを生贄に捧げます。この実験では、ケタミン/キシラジンの過剰摂取後の子宮頸部脱臼によってマウスが犠牲になりました。
- マウスの腹部と後ろ足に70%エタノールをスプレーします。
- 滅菌鉗子とハサミを使用して下腹部の真ん中を小さく切開し、後肢の付け根から横隔膜まで腹膜を開きます(補足図1)。
- 開いた腹膜に垂直な各後ろ脚に追加の切り込みを入れ、これらの追加の切り込みの1つの両側をつかんで引き離し、足首関節を過ぎて両後ろ足の皮膚を剥がし、両方の後ろ足の筋肉を露出させます(補足図1A)。
- 片方の後ろ足の股関節の脊椎に沿ってハサミを並べて、大腿骨を切らずに脚を切り取ります(補足図1B、C)。もう一方の脚についても同じことを繰り返します。
- 大腿骨を分離するには、筋肉組織の大部分を切り取り、大腿骨と脛骨を両手で指先で関節に保持します(補足図1D、E)。脛骨を大腿骨から脱臼させるために自然な曲がりに対して脚を静かに折りたたんでから(補足図1E)、結合組織をハサミで慎重に切断して大腿骨と脛骨を分離します。
- 軽くひねる動作でハサミを使用して、大腿骨の上端から背骨のビットを脱臼させます(補足図1E)。
- 孤立した大腿骨をティッシュペーパーで洗浄し、残りの筋肉と結合組織を取り除きます。
- 2 mLのDMEM(1x)+ GlutaMAX-Iで十分に満たされた12ウェルプレートで氷上で冷やしてください。
- すべての大腿骨が採取されたら、筋肉と線維組織が骨から完全に取り除かれていることを確認します。(a)骨髄を無菌状態に保ち、(b)井戸内の細胞を失わないようにするために、骨を切開しないでください。Haag and Murthy28から適応した1匹のマウスの2つの大腿骨から細胞を洗い流すには、次の手順を使用します。
- 1.5mLと0.5mLのチューブを1本ずつ用意します。1.5 mL チューブに 150 μL の FACS バッファーを添加し、18 G のニードルを使用して 0.5 mL チューブの底に穴を開け、0.5 mL のチューブを 1.5 mL のチューブに取り付けます。
- マウスの外科用ハサミを使用して各大腿骨の遠位部を開きます(補足図1F):ブレードの間に遠位骨端を固定し、ハサミをひっくり返しながら穏やかな圧力をかけて、骨を激しく切り開くことなく遠位骨端をスムーズに剥離します。成功すると、露出した物理末端に4つの突起が見えるはずです(補足図1G)。
- 2つの大腿骨を、開放端を下向きにして、FACS緩衝液を含む1.5 mLチューブ内に配置した準備した0.5 mLチューブに取り付けます(補足図1H)。
- 70 μmのセルストレーナーを50 mLのチューブにセットし、2 mLのFACSバッファーでストレーナーを事前に湿らせます。
- 骨髄を洗い流すには、遠心分離機が12,000 x gの値に達するまで12,000 x gでチューブを遠心分離し(キャップを開けて)、すぐに遠心分離を停止します。
- 骨髄細胞が1.5 mLチューブでペレット化され、大腿骨が白色(細胞洗浄前は赤色)であることを確認します(補足図1I)。2つの大腿骨と一緒に0.5 mLチューブを廃棄します。
- 150 μLの上清をピペットで廃棄します。
- ペレットをマイクロピペットで1 mLのアンモニウム-塩化物-カリウム(ACK)溶解バッファーに室温で1〜2分間再懸濁し、赤血球を溶解します。インキュベーション時間が長くなると、有核細胞の生存率が低下する可能性があるため、避けてください。
- あらかじめ湿潤させた70 μmのセルストレーナーを通して50 mLチューブに移します。
- 10 mLのFACSバッファーを添加してACK溶解バッファーを希釈し、溶解を停止します。
- 400 x g で4°Cで5分間遠心分離します。 最初に1 mLで再懸濁し、次に9 mLを補充して、10 mLのFACSバッファーに再懸濁します。
- 1.3.8の説明に従って、カウント用のセルを準備します。
- サプライヤーの推奨事項に従って、自動セルカウンターを使用してセルをカウントします。2つの大腿骨から約4,000万個の細胞を採取することが期待されています。
- 骨髄HSPCの染色
- 細胞を400 x gで4°Cで5分間遠心分離し、マイクロピペットでFACSバッファーにペレットを再懸濁し、最終濃度が1 x 107 cells/mLになるようにします。
- P1000マイクロピペットを使用して、懸濁液をFACSチューブに移し、35 μmのセルストレーナーキャップでろ過します。
- 表1にリストされている各抗体について、単一の染色試験管サンプルを調製し、セルソーターでの蛍光色素の補正を設定します。
- 抗体1本につきFACSチューブを1本用意し、チューブに200μLのPBSを充填します。
- 蛍光色素標識抗体の各FACSチューブに15 μLの蛍光色素補正ビーズを加えます。FACSチューブの未染色および生/死単染色細胞には、ビーズの代わりに500,000個の細胞を添加します。
- 各蛍光色素標識抗体( 表1参照)1 μLを対応するFACSチューブに加えます。0.5 μLの生/死染色を生/死単染色FACSチューブに加えます。
- 光から保護して15分間氷の上に保管してください。
- 表2に示すように、ミックス1と2を準備します。
注: 表2 に示されている抗体容量は、 材料表で参照されている抗体に対して有効です。これらは、新しい抗体リファレンスまたは同じ抗体リファレンスの異なるロットに対して最適化する必要があります。 - 300 μL の Mix 1 をサンプルチューブに添加し、再懸濁し、光から保護された氷上で 15 分間保持します。
- 300 μL の Mix 2 をサンプルチューブに添加し、再懸濁し、光から保護された氷上で 20 分間保持します。
- 3 mL の FACS バッファーをシングル染色チューブおよびミックス染色サンプルチューブに加えます。4°C、400 x g で5分間スピンダウンします。
- マイクロピペットを使用して上清を慎重に廃棄し、ペレットを500 μLのFACSバッファーに再懸濁します。
- 500 μL の収集培地をプレフィルドした 1.5 mL チューブを調製します。
注:ミックス1は、HI-FBSの影響を大きく受ける生染色/死染色を含むため、DPBSで調製されています。細胞がLive/Deadで染色されたら、HI-FBSを含むFACSバッファーに再懸濁した蛍光色素標識抗体を含むMix 2を添加します。唯一の例外は、抗体ミックス1に含まれる抗CD16/32抗体で、次のステップで添加される他の抗体の非特異的結合を防ぐFc受容体遮断薬として機能します。
- FACSを用いた細胞選別
注:セルソーティングはさまざまなセルソーターで実行できますが、ここではBD FACSAria FusionまたはBD FACSAria III装置の使用手順について説明します。セルソーターのキャリブレーションとセットアップは、監督下または機器の経験豊富なユーザーが行うことを強くお勧めします。- FACS機器の校正:プロトコル1のステップ4.1を参照してください。
- 細胞選別のためのFACS装置のセットアップ:
- 未染色細胞の取得を開始します。これらは、各蛍光色素の前方散乱と側方散乱、および検出器電圧を定義するために使用されます。各蛍光色素の蛍光シグナルがドットプロットの対数スケールの最初の 10 年以内に収まるようにパラメーターを設定します。
- 単色のコントロールを取得して補正を手動で設定するか (正と負の母集団の中央値を揃える必要があります)、自動計算ソフトウェア (傾斜角の計測値) を使用します。補正コントロールが実験用蛍光色素および検出器の設定と一致していることを確認します。セルで 10,000 イベント、ビーズで 5,000 イベントを記録します。
- サンプルチューブ(すなわち、マルチ染色細胞)を使用して、 図3Aに示すゲーティング戦略を用いて目的の細胞集団を定義します。手順 4 から 6 (下記) に従います。
- 目的の3つの骨髄HSPC(HSC、CMP、およびGMP)を特定するには、サイズ(FSC-A)と粒度(SSC-A)を使用して白血球にゲートし、次にFSC-H/FSC-Aを使用してダブレットを識別してゲーティングを開始します。
- SSC-A/死細胞マーカーに基づいて、生細胞をゲートします。Lineage/c-Kitを使用して、リネージ陰性で、中程度から高レベルのc-Kitを発現する細胞を選択します。c-Kit/Sca-1を介して、3つの対象集団の1つである系統-c-Kit+ Sca-1+ (LKS+)造血幹細胞のゲート。
- 骨髄前駆細胞(系統-c-Kit+Sca-1-)のうち、FcγR/CD34を使用してCD34-FcγR-巨核球および赤血球前駆細胞(MEP)を除外し、CD34+ FcγR-CMP、およびCD34+FcγR+ GMPを選別する細胞集団に含めます。
- 流れとたわみが安定していることを確認してください。
- サイドストリームカメラで、テストソートをオンにし、電圧をオンにし、左側に取り付けた1.5 mLチューブで正確な液滴ソーティングを確認します。
- Sorting Layoutウィンドウで、目的の母集団(例では「LKS+」および「CD34+骨髄前駆細胞」)を選択します。[デバイス] で [2 チューブ] を選択します。精度(Precision)で純度(Purity)を選択します。[Target Events] で [Continuous] を選択して、160,000 から 200,000 の LKS+ および CD34+ 骨髄前駆細胞の間で並べ替えます。
- 500 μL の FACS バッファーを細胞懸濁液に加え、1 mL のサンプルを新しい 35 μm セルストレーナーキャップ付き FACS チューブにろ過して移し、取り込み直前にすべての細胞が 1 つの懸濁液に含まれるようにします。これにより、装置を詰まらせる可能性のある細胞の凝集がなくなります。
- 準備ができたら、[ 並べ替え ] と [OK ] をクリックして並べ替えを開始します。 流量 を調整して、速度を毎秒 10,000 イベント未満に維持します。
注:定常状態の成体(8-12週齢)C57BL / 6J雌マウスのLKS+ とCD34+ 骨髄前駆細胞の予想される比率は1:3です。通常、ソート後30分以内にターゲットソートされた細胞数に到達します。
- 選別された細胞の品質管理とカウント
注:このステップは、核単離に使用される選別済み細胞の純度をテストすることを目的として、サンプル調製ステップを最適化するためのパイロット実験中にのみ実行する必要があります。プロトコルが完全に最適化されたら、核単離に利用できる出発物質が不必要に無駄になるのを避けるために、フォローアップ実験でこの品質管理ステップを実行することはお勧めしません。- フローサイトメトリーによる純度制御
- 選別した細胞10 μLを、90 μLのFACSバッファーを含む新しいFACSチューブに移します。
- 選別後のデータを取得して記録し、選別純度と実行可能性を検証します。セルの少なくとも95%が、3〜6で定義され、 図3Bに示されているように、目的のゲートに現れることを確認します。
- フローサイトメトリーによる純度制御
- 選別された骨髄HSPCからの核の単離
- 10X Genomics Demonstration Protocol - Nuclei Isolation for Single Cell Multiome ATAC + GEX sequencing (CG000365 - Rev C)27 の付録の「Low Cell Input Nuclei Isolation」プロトコルを使用し、核回収を最適化するために以下の変更を加えます。
- 溶解時間:このプロトコルのパイロット実験を実施して、核単離に最適な溶解時間を特定します。無傷の核を維持しながら、完全な細胞溶解を確実に達成してください。
注:上記の10X Genomicsプロトコル27 のステップfは、「氷上で3〜5分間[溶解バッファー中で]インキュベートする」ように指示しています。パイロット実験中は、少なくとも3分、4分、5分間試験し、フローサイトメトリーと顕微鏡イメージングによるカウントと品質によって回収された核の量を評価し、最適な溶解時間を選択します(以下のこれらの品質管理チェックの説明を参照)。試薬を節約するには、パイロット実験で希釈した核バッファーをPBS 0.04% BSAと交換します。骨髄HSPCでは、3分が最適な溶解時間として同定されました。 - 細胞遠心分離:すべての細胞懸濁液遠心分離では、300 x g で7分間遠心分離します(CG000365 - Rev Cでは5分間ではなく)27 、4°Cで遠心分離します。
- 核遠心分離:CG000365 - Rev C27に従って、500 x gで5分間、すべての核懸濁液遠心分離を行います。
- 核の採取:ステップbで、50 μLのPBS 0.04% BSAに再懸濁し、0.2 mLのチューブに移した後、50 μLのPBS 0.04% BSAを元のチューブに加え、ピペットミックスして残った細胞を回収します。0.2 mLチューブに移し替えて、合計100 μLの容量にします。
- 今後、総容量はプロトコルの 50 μL ではなく 100 μL になります。下流のステップを適宜調整します(例えば、ステップdでは45 μLではなく90 μLを除去し、ステップeでは45 μLではなく90 μLの溶解バッファーを添加します)。
- ステップmでは、核ペレットを7 μLではなく12 μLの希釈核バッファーに再懸濁します。
- 孤立した核を数えます。空の 0.5 mL チューブに、10 μL の 0.4% トリパンブルーと 8 μL の PBS 0.04% BSA を加えます。
- 2 μL の核をチューブに加え、1.3.8 の説明に従って核を数えます。サプライヤーの推奨事項に従って自動セルカウンターを使用してください。
- 溶解時間:このプロトコルのパイロット実験を実施して、核単離に最適な溶解時間を特定します。無傷の核を維持しながら、完全な細胞溶解を確実に達成してください。
- 10X Genomics Demonstration Protocol - Nuclei Isolation for Single Cell Multiome ATAC + GEX sequencing (CG000365 - Rev C)27 の付録の「Low Cell Input Nuclei Isolation」プロトコルを使用し、核回収を最適化するために以下の変更を加えます。
- フローサイトメトリーによる純度制御
注:このステップは、10X Chromiumチップにロードされる核の純度をテストするためのサンプル調製ステップを最適化するためのパイロット実験中にのみ実行する必要があります。プロトコルが完全に最適化されたら、追跡実験でこの品質管理ステップを実行して、収集された核が少数で不必要に無駄になるのを避けることはお勧めしません。- 核単離が完了したら、150 μLのFACSバッファーをプレフィルした新しいFACSチューブに6 μLの核再懸濁液を移します。3 μL の 7-AAD を加え、氷上で 5 分間インキュベートします。
- 選別後のデータを取得して記録し、選別純度と実行可能性を検証します。プロトコル 1 のステップ 4.2 で定義されているように、核の少なくとも 95% が目的のゲートに現れるようにします( 図 4 を参照)。
- 顕微鏡検査による精製核の品質管理:
注:このステップは、10X Chromiumチップにロードされる原子核の品質をテストするためのサンプル調製ステップを最適化するためのパイロット実験中にのみ実行する必要があります。プロトコルが完全に最適化されたら、追跡実験でこの品質管理ステップを実行して、収集された核が少数で不必要に無駄になるのを避けることはお勧めしません。- 手順1.5.3の説明に従って続行します。
- マルチオームアッセイの実施
- ただちに Chromium Next GEM Single Cell Multiome ATAC + Gene Expression User Guide (CG000338 - Rev F)25 に進んでください。
結果
上記の2つのプロトコルは、2つの異なるタイプの組織から始まる核の単離を詳述しています。2つのプロトコルの相違点と類似点を 図1に概略的に表します。
マウス脳からの核の精製
ここで説明するプロトコルでは、脳サンプルから核を調製するための穏やかな方法を提案します。まず、溶解緩衝液中で脳組織を機械的に解離し、その後、懸濁液から残りの組織を除去する洗浄およびストレーナーろ過ステップが続きます。その後の破片、非溶解細胞、および小粒子の除去は、精製された核のみが下流のマルチオームプロトコルにロードされることを保証します。 図2 は、ソーティング前後の核のプロファイルを示しています。濾過後、核選別前に、サンプルには大量の破片が含まれており、「シングレット」の99%以上が核染色(7-AAD)に陽性であり、最適な細胞溶解を示します(図2A)。核は、7-AADポジティブゲートに基づいてソートされます。選別された物質の一部分を取得して、調製した核の純度を確認します。 図2B は、選別後の脳核のプロファイルを示しています。核の選別により、核の純度を最初の36%(図2A)からほぼ100%(図2B)に向上させることができました。
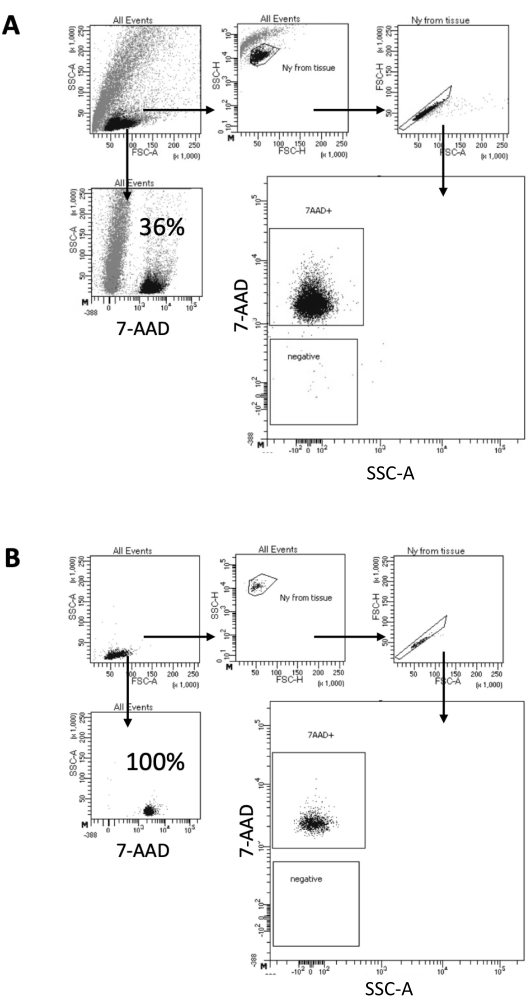
図2:核選別と選別後の純度試験のためのゲーティング戦略。 核を7-AADで染色し、セルソーターで取得しました。(A)核は、まずそのサイズと粒度(それぞれFSC-AとSSC-A)に基づいてゲーティングされます。次に、FSC-A/FSC-H特性と7-AAD染色に基づいて単一粒子を選択します。(B)細胞選別後、コレクションチューブからの核の一部を、 Aと同じゲーティング戦略を使用して純度を検査します。 この図の拡大版をご覧になるには、ここをクリックしてください。
マウス骨髄造血幹細胞前駆細胞(HSPC)の精製
骨髄から単離すると、図3Aに示すゲーティング戦略に従って、最大2 x 105 HSPCがFACSによってソートされます。選別効率とサンプルの純度を評価します(図3B)。
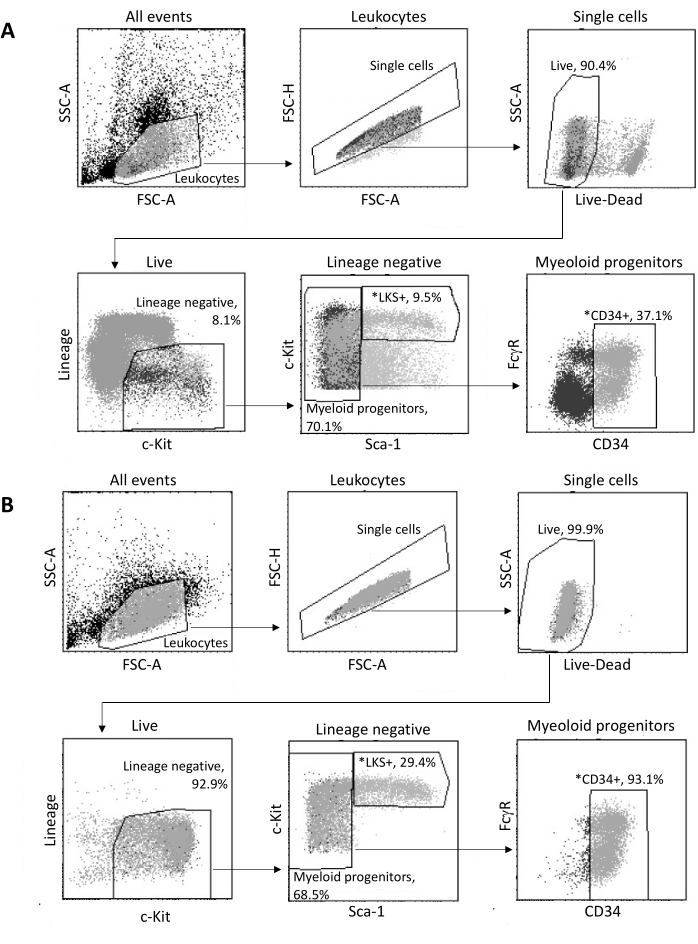
図3:骨髄HSPCの選別のためのゲーティング戦略。 (A)核単離のために生存可能なLKS+ 造血幹細胞とCD34+ 骨髄前駆細胞を選別するための代表的なFACSゲーティング戦略。(B)選別された細胞集団の純度の検証に使用した代表的なFACSプロット。親母集団に対する異なるセルサブセットの比率を示します。*ソートされた2つの母集団。 この図の拡大版をご覧になるには、ここをクリックしてください。
「Low Cell Input Nuclei Isolation」プロトコルにより、最大105 細胞のサンプルから核を単離できます。遠心分離ステップの数が少ないため、細胞/核の損失が最小限に抑えられます。溶解バッファーと洗浄バッファーの量を細胞投入量に比例して調整し、核回収率を最大化するために遠心分離時間を延長しました。私たちは、カウントによって回収された核の量と、フローサイトメトリーと顕微鏡イメージングによるそれらの品質を評価するためのパイロット実験を実施しました。 図4 に、細胞溶解後のHSPCサンプルを示します。このプロトコルでは、 図5Aに見られるように、下流のマルチオームプロトコルに影響を与える可能性のある破片がなく、高品質の核が生成されました。
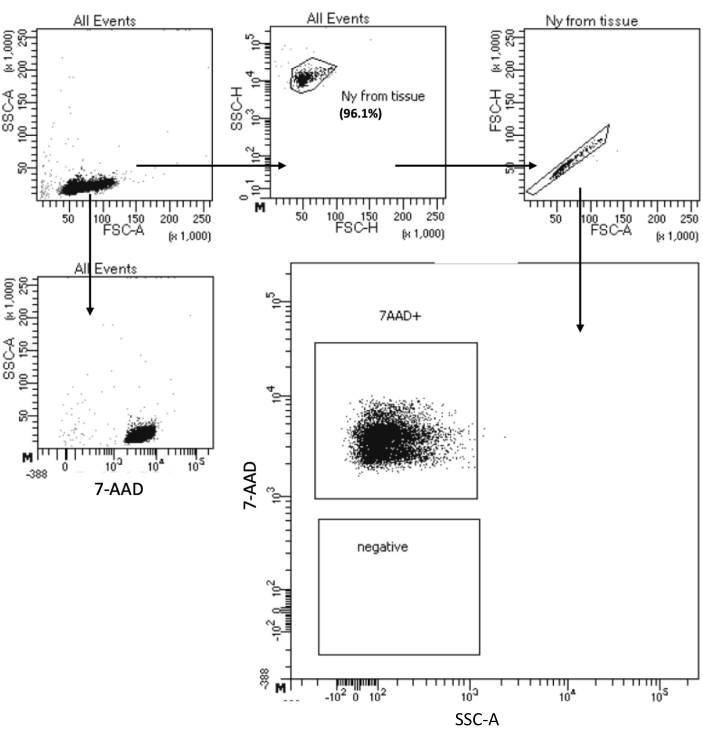
図4:単離された骨髄HSPC核の純度試験選別。 核を7-AADで染色し、セルソーターで取得しました。まず、核のサイズと粒度(それぞれFSC-AとSSC-A)に基づいてゲーティングを行い、サンプルの純度を評価しました。核の割合は、親集団に対して示されます。 この図の拡大版をご覧になるには、ここをクリックしてください。
| チューブ番号 | チューブ名 | ステンドエンティティ | 染色された実体の量 | 抗体/色素(μL) | 回収バッファー(μL) |
| 1 | 未染色 | 細胞 | 5,00,000 | 該当なし | 200 |
| 2 | LIVE/DEAD Fixable Aqua Dead Cell Stain(LIVE/DEAD固定可能アクア死細胞染色) | 細胞 | 5,00,000 | 0.5 | |
| 3 | APC/Cyanine 7 抗マウス CD16/32 (FcγR) | OneComp eBeads (ワンコンプ イービーズ) | 15 μL | 1 | |
| 4 | パシフィックブルーアンチマウスリネージュカクテル | OneComp eBeads (ワンコンプ イービーズ) | 15 μL | 1 | |
| 5 | PE抗マウスLy-6A/E(SCA-1) | OneComp eBeads (ワンコンプ イービーズ) | 15 μL | 1 | |
| 6 | APC抗マウスCD117(Cキット) | OneComp eBeads (ワンコンプ イービーズ) | 15 μL | 1 | |
| 7 | FITC抗マウスCD34 | OneComp eBeads (ワンコンプ イービーズ) | 15 μL | 1 |
表1:フローサイトメーターでの補正設定の単一染色コントロール。 必要な単一染色コントロール、染色する細胞またはビーズの数、および抗体の量を示します。
| マスターミックス | 試薬 | 最終希釈 | 抗体/色素(μL) | バッファーの種類 | バッファー (μL) |
| ミックス1 | APC/Cyanine 7 抗マウス CD16/32 (FcγR) | 1/500 | 1.2 | DPBSの | 300 |
| LIVE/DEAD Fixable Aqua Dead Cell Stain(LIVE/DEAD固定可能アクア死細胞染色) | 1/250 | 2.4 | |||
| ミックス2 | パシフィックブルーアンチマウスリネージュカクテル | 1/20 | 30 | FACSバッファ | 300 |
| PE抗マウスLy-6A/E(SCA-1) | 1/200 | 3 | |||
| APC抗マウスCD117(Cキット) | 1/200 | 3 | |||
| FITC抗マウスCD34 | 1/50 | 12 | |||
| 総染色量 | 600 |
表2:骨髄HSPCの染色ミックスの組成。 4,000万個の細胞を含む1つのサンプルの染色に必要な試薬の量を示しています。より多くのサンプルを染色する場合は、指示量に必要サンプル数を掛け、余分なサンプル量の半分を追加して、マスターミックスの十分な量を確保します。
補足図1:骨髄細胞分離プロトコル。 (A)腹膜を開きます。白い点線は、切断する線を示します。(B)後ろ足の皮膚を剥がした後、股関節の背骨に沿ってハサミを並べ、大腿骨を切らずに脚を切り取ります。(C)筋肉を除去する前の脚が体から分離した外観。(D)筋肉を除去した後の脚の外観。(E)大腿骨を膝関節で分離し、次に股関節で、大腿骨を切り開かないように注意しながら分離する手順。白い曲線の矢印は、必要なモーションを示します。白い点線の矢印は、ハサミでつまんでそっと分離する領域を示しています。 (F)大腿骨の遠位部(膝関節の脛骨に以前付着していた部分)をハサミでしっかりとつかみ、ひっくり返して骨髄を露出させることにより、開く手順。(G)黒い矢印で示された4つの突起が、露出したフィシスの端に見えるはずです。(H)150 μL の FACS バッファーを含む 1.5 mL チューブ内に置かれた、調製された 0.5 mL チューブにオープンエンドが下を向いている大腿骨の外観。(I)12,000 x gでの迅速な遠心分離後のペレット状の骨髄細胞と白色大腿骨の外観。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
高品質の細胞または核懸濁液の調製は、単一細胞または単一核のRNA-Seqおよび単一細胞のマルチオミクス解析の成功にとって非常に重要です29,30,31。ここでは、脳と骨髄の2種類の組織からのマルチオームアッセイのためのサンプル調製と核単離のプロトコルについて説明しました。
この論文で説明されている脳プロトコルは、新鮮凍結された脳組織から高品質の核を回収することを可能にします。これには、凍結組織破壊、核の単離、核の精製、および調製された材料の品質管理のステップが含まれます。脳組織は多くの異なる種類の細胞で構成されており、組織の解離と核の分離の手順により、初期組織に存在する細胞集団の割合が維持されるはずです。ここでは、溶解バッファーの組成とインキュベーション時間を最適化して、組織を構成するすべての細胞集団を完全かつ穏やかに溶解できるようにしました。
骨髄HSPCのプロトコルは、実験の開始時に、不均一な細胞懸濁液から目的の細胞集団を単離するために1つの追加ステップを必要とするため、多少異なります。新鮮な組織を採取した後、赤血球を溶解し、サンプルを目的の細胞サブセットに濃縮します。標的細胞を溶解し、核を単離し、調製した材料の品質を制御します。
10X Genomicsは、多数の異なる組織における核分離について検証されたいくつかのプロトコルを提供する32,33。同社はまた、検証された組織から核を単離するための簡単なパイプラインを備えた核分離キットを商品化している34。ただし、これらのプロトコルでは、特定のサンプルの特殊性を調整するために、追加の最適化が必要です。たとえば、低いセル入力で作業する必要があるサンプルです。これらのサンプルの場合、最も困難なステップは遠心分離であり、サンプルを洗浄するのに十分な厳格さと、細胞/核の損失を回避するのに十分なほど穏やかな遠心分離が必要です。ここで説明するプロトコルでは、10X Genomics Demonstrated Protocol - Nuclei Isolation for Single Cell Multiome ATAC + GEX Sequencing (CG000365 - Rev C)27 を適応させ、これら 2 つの要件の微妙なバランスを見つけました。選別したHSPCから核を作製した例で示したように、サンプルの品質に影響を与えることなく、核の回収率を向上させました。
さらなる課題は、核単離のための精製細胞の溶解のステップです。より厳しい溶解条件と長いインキュベーション時間は、核を損傷し、それによってシーケンシングデータの品質に影響を与える可能性があります。 図5 は、溶解バッファーとの異なるインキュベーション時間における骨髄サンプルからの代表的な核イメージングを示しており、細胞溶解によって核の状態がどのように異なるかを示しています。HSPCの例では、健康そうに見える無傷の核の割合が最も高く、損傷した核の割合が最も低くなる状態として、3分間の溶解を特定しました。溶解インキュベーション時間は、新しいタイプのサンプルごとに最適化する必要があります。
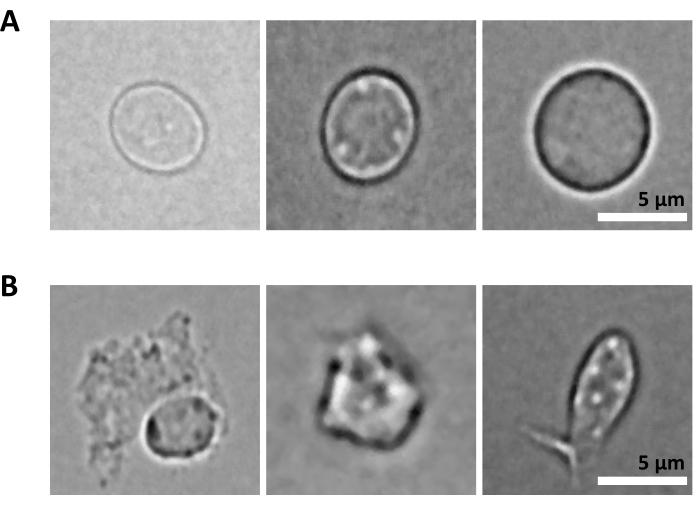
図5:顕微鏡による核の品質管理。 (A)無傷の核と(B)損傷した核を持つマウス骨髄から単離された核の代表的な明視野画像を示します。スケールバー5μm。画像は倒立顕微鏡で撮影し、40倍ELWD NA 0.60対物レンズと1.5倍デジタルズームを使用しました。 この図の拡大版をご覧になるには、ここをクリックしてください。
この作業で詳述されている両方のプロトコルは、ハイスループットFACS装置による標的細胞または核の精製に依存しています。このステップは、細胞のまれなサブセットを不均一な懸濁液から単離する単一細胞/核調製プロトコルにとって非常に重要です。これらのケースでは、HSPCのソーティングに示した例のように、目的の細胞集団の「ゲーティング」を可能にするために、高次元のフローサイトメトリーパネルが必要になる場合があります。選別は非常に高速かつ正確で、選別された細胞サブセットの純度は95%を超えます。このアプローチは、細胞懸濁液を最大70psiの圧力にさらすため、細胞膜の破裂を引き起こす可能性があるため、脆弱な細胞(樹状細胞、好中球など)の選別を制限する可能性があります。このような場合、細胞精製には、磁気選別、新世代機器(CellenOne、Cellenionなど)の適用など、代替溶液を選択する必要があります。MACSQuant Tyto, Miltenyi)35,36、または液滴ベースのシステム(ODIN、Sensificなど)37。それにもかかわらず、これらの技術のソーティング速度は遅く、細胞の選別は数分ではなく数時間続くため、多数の細胞の解析に基づくMultiomeやその他のシングルセルアプリケーション用の生細胞の調製にこれらのアプローチを適用する際の強力な制限要因となっています。
組織から単離された核の精製には、そのスループットと単離された材料の純度から、FACSが最適な方法です。核は圧力に敏感ではなく、ろ過された組織分離株はセルソーターで簡単に精製できます。実験室にFACS機器が装備されていない場合は、他の代替手段が存在し、やや効率は劣りますが、十分に優れています。例としては、超遠心分離や、音波を使用して粒子のサイズの違いに基づいて粒子を分離するMARS(アプライドセル)などの小型機器の使用が含まれます。細胞/核懸濁液の疎水性を利用したCURIOX層流洗浄機。または、細胞の物理的特性(浮遊)に依存して細胞を破片から分離するLEVITAS bio。
ここでは、ダウンストリームのMultiomeプロトコルに多数の核と最適な純度を得るためのプロトコルについて説明します。FACSによる選別と遠心分離の繰り返しは、最初の材料の大幅な損失をもたらします。このため、ここで説明する脳からの核調製プロトコルでは、FACSソーティング後に少なくとも500,000個の核を収集するのに十分な量の出発物質が必要です。この基準が一致しない場合は、代替プロトコルを適用する必要があります。稀な細胞集団や小さな組織切片を扱う場合、利用可能な初期物質の量が制限要因となる可能性があります。この問題に対処するために、(a)溶解量を減らす、(b)洗浄量を減らす、(c)遠心分離時間を延長した1回の洗浄で回収率を向上させることで、低細胞入力核単離のための10X Genomicsプロトコルに示されているように、核の回収率を向上させることができます。低含有量材料のマルチオミクス解析には、scNMT、SNARE-seq、Paired-seq38 など、必要なインプットサンプルがはるかに少ないプレートベースのアプリケーションを検討する価値があります。
要約すると、ダウンストリームマルチオーム解析用の脳および骨髄HSPCからの核調製のための2つの堅牢なプロトコルについて説明しました。これらのプロトコルは、提起された科学的な問題に関係なく、これら2種類の組織から高品質の単核懸濁液を必要とするあらゆる科学プロジェクトに適用できます。私たちのグループでは、脳核単離プロトコルを、様々な標的遺伝子の不活性化による脳の発生研究や、神経疾患における免疫応答の研究に応用しています。私たちは、骨髄核単離プロトコルを使用して、免疫系の確立におけるさまざまな造血亜集団の関与を解読しています。
開示事項
著者は何も開示していません。
謝辞
Ana Jeemin Choiは、パスツール-パリ大学(PPU)国際博士課程プログラムからの奨学金を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 18 G x 1 ½ (1.2 mm x 38 mm) Agani needles | Terumo | AN*1838S1 | |
| 15 mL tubes | Falcon | 352097 | |
| 5 mL round bottom FACS tube with cell strainer cap 35 µm | falcon | 352235 | |
| 50 mL tubes | Falcon | 352070 | |
| 7-AAD | BD pharmagen | 559925 | |
| ACK Lysing Buffer | Gibco | A10492-01 | |
| APC anti-mouse CD117 (c-Kit) | BioLegend | 105812 | Clone: 2B8 |
| APC/Cyanine 7 anti-mouse CD16/32 (FcγR) | BioLegend | 101328 | Clone: 93 |
| BD FACSAria III | BD Biosciences | non-applicable | |
| BD FACSDiva Software v8.0.1 | BD Biosciences | non-applicable | |
| Bovine Serum Albumin stock solution 10% | Miltenyi Biotec | 130-091-376 | |
| Cell staining buffer | Biolegend | 420201 | |
| CFI Suprplan Fluor ELWD 40XC ON 0.6 | Nikon | non-applicable | |
| CMOS camera Prime 95B 25 mm | Photometrix | non-applicable | |
| Countess II FL Automated Cell Counter | Invitrogen | AMQAF1000 | |
| Countess cell counting chamber slide | Invitrogen | C10283 | |
| Coverglass 24 mm x 24 mm 0.13-0.17 mm | Brand | BR470819 | |
| Digitonine 5% | Invitrogen | BN2006 | |
| Disposable Scalpels | Swann-Morton | 0508 | |
| DMEM (1x) + GlutaMAX-I | Gibco | 31966-021 | |
| DPBS (10x) | Gibco | 14200-067 | |
| DTT | Sigma aldrich | 646563 | |
| Epifluorescence inverted microscope Nikon Ti2 -E | Nikon | non-applicable | |
| Eppendorf Safe-Lock Tubes 0.5 mL | Eppendorf | 30123603 | |
| Ethanol 70% | VWR | 83801.290 | |
| FITC anti-mouse CD34 | Invitrogen | 11-0341-85 | Clone: RAM34 |
| Forceps for dissection | FST | 11152-10 | |
| Heat-inactivated Fetal Bovine Serum (FBS) | Gibco | 11533387 | |
| Dounce Homogeniser 2 mL | Bellco glass | 1984-10002 | Pestle “A” Large Clearance: .0030-.0050″ and Pestle “B” Small Clearance: .0005-.0025″ |
| LIVE/DEAD fixable aqua dead cell stain kit | Invitrogen | L34957 | |
| Magnesium chloride solution 1 M | Sigma aldrich | M1028 | |
| Microcentrifuge | Eppendorf | 5424R | |
| Mounting medium Fluoromount-G | invitrogen | 00-4958-02 | |
| Nonidet P40 substitute | Sigma aldrich | 74385 | |
| Nuclease free water | ThermoFischer | AM9932 | |
| Nuclei buffer 20x | 10X Genomics | 2000153/2000207 | |
| Nuclei isolation kit EZ prep | Sigma Aldrich | NUC-101 | |
| OneComp eBeads compensation beads | Invitrogen | 01-1111-41 | |
| Pacific Blue anti-mouse lineage cocktail (including anti-mouse CD3, Ly-6G/Ly-6C, CD11b, CD45R/B220, TER-119) | BioLegend | 133310 | Clones (in the same order as the antibodies listed): 17A2, RB6-8C5, M1/70, RA3-6B2, Ter-119 |
| PCR Tube Strips 0.2 mL | Eppendorf | 951010022 | |
| PE anti-mouse Ly-6A/E (Sca-1) | BioLegend | 122507 | Clone: E13-161.7 |
| Petri dish 100 mm x 20 mm OPTILUX | Falcon | 353003 | |
| Ply-L-lysine 0.01% sterile-filtered suitable for cell culture | Sigma | P4707 | |
| Printed microscope slides 8 well 6 mm numbered | Epredia | ER-301B-CE24 | |
| Protein LoBind Tubes 1.5 mL | Eppendorf | 30108116 | |
| Recombinant Rnase inhibitor 5000 U | Takara | 2313A | |
| Scissors for dissection | FST | 14090-09 | |
| Sodium chloride solution 5 M | Sigma aldrich | 59222C | |
| Syringe filters, PES, 0.2 µm | Fisher Scientific | 15206869 | |
| Transparent nail polish | any | non-applicable | |
| Trizma Hydrochloride solution pH 7.4 | Sigma aldrich | T2194 | |
| Trypan Blue 0.4% | gibco | 15250061 | |
| Tween 20 | Biorad | 1662404 | |
| UltraPure Distilated Water Dnase/Rnase Free | Invitrogen | 10977-035 |
参考文献
- Clark, S. J., et al. scNMT-seq enables joint profiling of chromatin accessibility DNA methylation and transcription in single cells. Nature Communications. 9 (1), 781(2018).
- Lee, J., Hyeon, D. Y., Hwang, D. Single-cell multiomics: technologies and data analysis methods. Experimental & Molecular Medicine. 52 (9), 1428-1442 (2020).
- Cerrizuela, S., et al. High-throughput scNMT protocol for multiomics profiling of single cells from mouse brain and pancreatic organoids. STAR Protocols. 3 (3), 101555(2022).
- Dimitriu, M. A., Lazar-Contes, I., Roszkowski, M., Mansuy, I. M. Single-cell multiomics techniques: From conception to applications. Frontiers in Cell and Developmental Biology. 10, 854317(2022).
- Stoeckius, M., et al. Simultaneous epitope and transcriptome measurement in single cells. Nature Methods. 14 (9), 865-868 (2017).
- Cao, J., et al. Joint profiling of chromatin accessibility and gene expression in thousands of single cells. Science (New York, N.Y.). 361 (6409), 1380-1385 (2018).
- Narayanan, A., et al. Nuclei Isolation from Fresh Frozen Brain Tumors for Single-Nucleus RNA-seq and ATAC-seq. Journal of Visualized Experiments: JoVE. (162), e61542(2020).
- Kim, M., et al. Single-nucleus transcriptomics reveals functional compartmentalization in syncytial skeletal muscle cells. Nature Communications. 11 (1), 6375(2020).
- Santos, M. D., et al. Extraction and sequencing of single nuclei from murine skeletal muscles. STAR Protocols. 2 (3), 100694(2021).
- Safabakhsh, S., et al. Isolating nuclei from frozen human heart tissue for single-nucleus RNA sequencing. Current Protocols. 2 (7), e480(2022).
- Lau, S. -F., Cao, H., Fu, A. K. Y., Ip, N. Y. Single-nucleus transcriptome analysis reveals dysregulation of angiogenic endothelial cells and neuroprotective glia in Alzheimer's disease. Proceedings of the National Academy of Sciences of the United States of America. 117 (41), 25800-25809 (2020).
- Armand, E. J., Li, J., Xie, F., Luo, C., Mukamel, E. A. Single-cell sequencing of brain cell transcriptomes and epigenomes. Neuron. 109 (1), 11-26 (2021).
- Morabito, S., et al. Single-nucleus chromatin accessibility and transcriptomic characterization of Alzheimer's disease. Nature Genetics. 53 (8), 1143-1155 (2021).
- Chen, S., et al. Spatially resolved transcriptomics reveals genes associated with the vulnerability of middle temporal gyrus in Alzheimer's disease. Acta Neuropathologica Communications. 10 (1), 188(2022).
- Paul, F., et al. Transcriptional heterogeneity and lineage commitment in myeloid progenitors. Cell. 163 (7), 1663-1677 (2015).
- Kaufmann, E., et al. BCG educates hematopoietic stem cells to generate protective innate immunity against tuberculosis. Cell. 172 (1-2), 176-190.e19 (2018).
- Christ, A., et al. Western diet triggers NLRP3-dependent innate immune reprogramming. Cell. 172 (1-2), 162-175.e14 (2018).
- Moorlag, S. J. C. F. M., et al. β-Glucan Induces protective trained immunity against mycobacterium tuberculosis infection: A key role for IL-1. Cell Reports. 31 (7), 107634(2020).
- de Laval, B., et al. C/EBPβ-dependent epigenetic memory induces trained immunity in hematopoietic stem cells. Cell Stem Cell. 26 (5), 657-674.e8 (2020).
- Renthal, W., et al. Characterization of human mosaic Rett syndrome brain tissue by single-nucleus RNA sequencing. Nature Neuroscience. 21 (12), 1670-1679 (2018).
- Yang, A. C., et al. A human brain vascular atlas reveals diverse mediators of Alzheimer's risk. Nature. 603 (7903), 885-892 (2022).
- Lee, D. R., Zhang, Y., Rhodes, C. T., Petros, T. J. Generation of single-cell and single-nuclei suspensions from embryonic and adult mouse brains. STAR Protocols. 4 (1), 101944(2022).
- Corces, M. R., et al. Lineage-specific and single-cell chromatin accessibility charts human hematopoiesis and leukemia evolution. Nature Genetics. 48 (10), 1193-1203 (2016).
- Ranzoni, A. M., et al. Integrative single-cell RNA-seq and ATAC-seq analysis of human developmental hematopoiesis. Cell Stem Cell. 28 (3), 472-487.e7 (2021).
- 10X Genomics Chromium Next GEM Single Cell Multiome ATAC + Gene Expression User Guide, Document Number CG000338 Rev F. , At https://www.10xgenomics.com/support/single-cell-multiome-atac-plus-gene-expression/documentation/steps/library-prep/chromium-next-gem-single-cell-multiome-atac-plus-gene-expression-reagent-kits-user-guide (2022).
- Meyerhoff,, et al. Microdissection of mouse brain into functionally and anatomically different regions. Journal of Visualized Experiments: JoVE. (168), e61941(2021).
- 10X Genomics 10X Genomics Demonstrated Protocol - Nuclei Isolation for Single Cell Multiome ATAC + GEX sequencing (CG000365 - Rev C). , At https://www.10xgenomics.com/support/single-cell-multiome-atac-plus-gene-expression/documentation/steps/sample-prep/nuclei-isolation-for-single-cell-multiome-atac-plus-gene-expression-sequencing (2022).
- Haag, S., Murthy, A. Murine monocyte and macrophage culture. Bio-Protocol. 11 (6), e3928(2021).
- Haque, A., Engel, J., Teichmann, S. A., Lönnberg, T. A practical guide to single-cell RNA-sequencing for biomedical research and clinical applications. Genome Medicine. 9 (1), 75(2017).
- Jiang, P. Quality control of single-cell RNA-seq. Methods in Molecular Biology (Clifton, N.J). 1935, 1-9 (2019).
- Regan, C., Preall, J. Practical considerations for single-cell genomics. Current Protocols. 2 (8), e498(2022).
- 10X Genomics 10X Genomics Demonstrated Protocol - Nuclei Isolation for Single Cell ATAC Sequencing (CG000169 - Rev E). , At https://www.10xgenomics.com/support/single-cell-atac/documentation/steps/sample-prep/nuclei-isolation-for-single-cell-atac-sequencing (2022).
- 10X Genomics 10X Genomics Demonstrated Protocol - Nuclei Isolation from Complex Tissues for Single Cell Multiome ATAC + Gene Expression Sequencing. (CG000375 - Rev C). , At https://www.10xgenomics.com/support/single-cell-multiome-atac-plus-gene-expression/documentation/steps/sample-prep/nuclei-isolation-from-complex-tissues-for-single-cell-multiome-atac-plus-gene-expression-sequencing (2022).
- 10X Genomics 10X Genomics - Chromium Nuclei Isolation Kit (CG000505 - Rev A). , At https://www.10xgenomics.com/support/single-cell-gene-expression/documentation/steps/sample-prep/chromium-nuclei-isolation-kit-sample-prep-user-guide (2022).
- Shomroni, O., et al. A novel single-cell RNA-sequencing approach and its applicability connecting genotype to phenotype in ageing disease. Scientific Reports. 12 (1), 4091(2022).
- Ocañas, S. R., Pham, K. D., Blankenship, H. E., Machalinski, A. H., Chucair-Elliott, A. J., Freeman, W. M. Minimizing the ex vivo confounds of cell-isolation techniques on transcriptomic and translatomic profiles of purified microglia. eNeuro. 9 (2), (2022).
- Gérard, A., et al. High-throughput single-cell activity-based screening and sequencing of antibodies using droplet microfluidics. Nature Biotechnology. 38 (6), 715-721 (2020).
- Vandereyken, K., Sifrim, A., Thienpont, B., Voet, T. Methods and applications for single-cell and spatial multi-omics. Nature Reviews. Genetics. 24, 494-515 (2023).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved