A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
نموذج الخنازير خارج الجسم الحي للاختبار الهيدروديناميكي لإجراءات الصمام الأبهري التجريبية والأجهزة الطبية الجديدة
In This Article
Summary
نقدم طريقة لتركيب صمام أبهري خنزيري على ناسخ نبضي لاختبار خصائصه الهيدروديناميكية. يمكن استخدام هذه الطريقة لتحديد التغير في الديناميكا المائية بعد تطبيق إجراء تجريبي أو جهاز طبي جديد قبل استخدامه في نموذج حيواني كبير.
Abstract
خيارات اختبار إجراءات القلب الجديدة والأجهزة الطبية الاستقصائية قبل استخدامها في نموذج حيواني محدودة. في هذه الدراسة ، نقدم طريقة لتركيب صمام أبهري خنزيري في ناسخ نبضي لتقييم خصائصه الهيدروديناميكية. يمكن بعد ذلك تقييم هذه الخصائص قبل وبعد تنفيذ الإجراء قيد التحقيق و / أو تطبيق الجهاز الطبي الاستقصائي. يمثل تأمين جزء التدفق بعض الصعوبة بسبب نقص عضلة القلب المحيطية في مجرى تدفق البطين الأيسر. تعالج هذه الطريقة هذه المشكلة عن طريق تأمين جزء التدفق باستخدام الوريقة الأمامية للصمام التاجي ثم خياطة الجدار الحر للبطين الأيسر حول تركيبات التدفق. يتم تأمين جزء التدفق الخارجي ببساطة عن طريق إدخال التركيب في شق في الجانب العلوي من قوس الأبهر. وجدنا أن العينات لها خصائص هيدروديناميكية مختلفة بشكل كبير قبل وبعد تثبيت الأنسجة. دفعتنا هذه النتيجة إلى استخدام عينات جديدة في اختباراتنا ويجب أخذها في الاعتبار عند استخدام هذه الطريقة. في عملنا ، استخدمنا هذه الطريقة لاختبار مواد رقعة جديدة داخل القلب لاستخدامها في وضع الصمامات عن طريق إجراء إجراء neocuspidization الصمام الأبهري (إجراء Ozaki) على الصمامات الأبهرية الخنازير المركبة. تم اختبار هذه الصمامات قبل وبعد الإجراء لتقييم التغير في الخصائص الهيدروديناميكية مقارنة بالصمام الأصلي. هنا ، نبلغ عن منصة للاختبار الهيدروديناميكي لإجراءات الصمام الأبهري التجريبية التي تتيح المقارنة مع الصمام الأصلي وبين الأجهزة والتقنيات المختلفة المستخدمة في الإجراء قيد البحث.
Introduction
يمثل مرض الصمام الأبهري عبئا كبيرا على الصحة العامة ، وخاصة تضيق الأبهر ، الذي يصيب 9 ملايين شخص في جميع أنحاء العالم1. تتطور حاليا استراتيجيات معالجة هذا المرض وتشمل إصلاح الصمام الأبهري واستبدال الصمام الأبهري. في الأطفال على وجه الخصوص ، هناك حافز كبير لإصلاح الصمام بدلا من استبداله لأن الأطراف الاصطناعية المتاحة حاليا عرضة لتنكس الصمام الهيكلي (SVD) ولا تتحمل النمو ، مما يتطلب إعادة التشغيل لإعادة الاستبدال مع نمو المريض. حتى إجراء روس ، الذي يستبدل الصمام الأبهري المصاب (AV) بالصمام الرئوي الأصلي (PV) ، يتطلب طرفا اصطناعيا أو طعما في الموضع الرئوي يخضع أيضا ل SVD وغالبا ما يكون تحمل النمومحدودا 2. ويجري تطوير نهج جديدة لمرض الصمام الأبهري، وهناك حاجة إلى الاختبار في سياق ذي صلة بيولوجية قبل تطبيقه في نموذج حيواني كبير.
لقد طورنا طريقة لاختبار AV الخنازير التي يمكن أن توفر نظرة ثاقبة لوظيفة الصمام قبل وبعد إجراء بحثي أو تطبيق جهاز طبي جديد. من خلال تركيب AV الخنازير على آلة ناسخة نبضية متاحة تجاريا ، يمكننا مقارنة الخصائص الهيدروديناميكية التي يشيع استخدامها في التحقيق والموافقة في النهاية على الأطراف الاصطناعية للصمام ، بما في ذلك جزء القلس (RF) ، ومنطقة الفتحة الفعالة (EOA) ، ومتوسط فرق الضغط الإيجابي (PPD) 3,4. يمكن بعد ذلك ضبط التدخل في سياق ذي صلة بيولوجية قبل استخدامه في نموذج حيواني كبير ، مما يحد من عدد اللازمة لإنتاج إجراء أو طرف اصطناعي يمكن استخدامه في البشر. يمكن الحصول على القلوب المستخدمة في هذه التجربة من المسلخ المحلي أو النفايات من تجارب أخرى ، لذلك ليس من الضروري التضحية بحيوان فقط لأغراض هذه التجربة.
في عملنا ، استخدمنا هذه الطريقة لتطوير مادة رقعة جديدة لإصلاح الصمام واستبداله. اختبرنا الوظيفة الهيدروديناميكية لمجموعة متنوعة من مواد التصحيح عن طريق إجراء عملية neocuspidization للصمام الأبهري (إجراءOzaki 5،6،7) على AVs الخنازير واختبارها في ناسخ النبض قبل الإجراء وبعده. وقد مكننا ذلك من ضبط المواد بناء على أدائها الهيدروديناميكي. وبالتالي ، توفر هذه الطريقة منصة للاختبار الهيدروديناميكي للإجراءات التجريبية والأجهزة الطبية الجديدة للاستخدام على AV قبل التطبيق في نموذج حيواني كبير.
Protocol
تم إجراء جميع الأبحاث وفقا للمبادئ التوجيهية المؤسسية لرعاية.
1. الاعتبارات والاستعدادات للتجربة
- استخدم ناسخ نبض مناسب (PD) لمحاكاة النتاج القلبي من خلال AV. يجب أن تكون بيانات الأداء قادرة على استيعاب المواد البيولوجية وأن تكون قادرة على التنظيف.
- استخدم إعدادات PD المناسبة لاختبار AV: حجم إزاحة 70 مل و 70 نبضة في الدقيقة (5 لتر / دقيقة نتاج قلبي) ، 35٪ من دورة القلب في الانقباض ، 100 مم زئبق متوسط تدرج الضغط عبر الصمامات ، 120 تدرج ضغط أقصى ، و 80 تدرج ضغط أدنى.
- استخدم درجة حرارة الغرفة (RT) محلول ملحي عادي (0.9٪ كلوريد الصوديوم) كوسط سائل.
- تحديد موقع أو إنشاء (باستخدام الطباعة 3D أو طريقة مماثلة) تركيبات مناسبة لتركيب AV الخنازير للاختبار على PD.
- استخدم التركيبات المصممة على غرار التركيبات المزودة مع ناسخ النبض بالمواصفات التالية: تأكد من أن القطر الداخلي للتركيبات مشابه لقطر AV قيد الدراسة ، وطول المرفق لا يقل عن 2 سم ، وعرض المرفق القابل للاستخدام لا يقل عن 4 سم (الشكل 1).
- استخدم الحلقات المطاطية على شكل حشيات على نهايات التركيبات.
- الحصول على عينة من القلب بعد استئصال القلب (الشكل 2 أ).
- استخدم عينات قلب الخنازير من المسلخ أو أنسجة النفايات من التي تتمتع بصحة جيدة ولم تكن جزءا من أي بروتوكولات تجريبية من شأنها أن تؤثر على قلوبهم.
- الحصول على عينة بعد استئصال القلب أو إجراء استئصال القلب بعد الوفاة ، بما في ذلك استئصال الوريد الأجوف العلوي ، والوريد الأجوف السفلي ، والشريان الرئوي الرئيسي (PA) ، وجميع الأوردة الرئوية ، والشريان الأورطي في الجانب البعيد من قوس الأبهر.
ملاحظة: يجب استخدام العينات الطازجة ، بعد أقل من 6 ساعات من الوفاة أو المخزنة في محلول ملحي معقم بمحلول حيوي 1٪ (البنسلين والستربتومايسين) في ثلاجة 4 درجةمئوية لمدة تصل إلى 7 أيام ، لهذه التجربة. الأنسجة المثبتة في الفورمالين أو الجلوتارالدهيد ستنتج نتائج هيدروديناميكية متغيرة بسبب زيادة الصلابة.

الشكل 1: تركيبات مطبوعة 3D مخصصة لتركيب الصمامات الأبهرية الخنازير على ناسخ النبض. كما هو مذكور في البروتوكول ، يجب ألا يقل طول المرفق عن 2 سم ، ويجب ألا يقل عرض المرفق القابل للاستخدام عن 4 سم. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
2. استئصال الهياكل اليمنى
- تشريح PA من الشريان الأورطي بمقص Metzenbaum حتى يصبح نسيج البطين مرئيا (الشكل 2B).
- تشريح وربط مع الحرير كل من الشرايين التاجية في أصلها من الجيوب الأنفية الأبهر ، مع الحرص على عدم تضييق الجيوب الأنفية.
- عبور الشرايين التاجية البعيدة إلى العلاقات الحريرية.
- شق البطين الأيمن (RV) بين الشريان الأورطي والسلطة الفلسطينية في قاعدة الصمام الرئوي باستخدام مقص Metzenbaum (الشكل 2C).
- بدءا من الأمام ، استمر في شق محيطي على طول الحاجز بين البطينين لإزالة الجدار الحر من RV (الشكل 2D ، E).
- استمر في شق الخلف من خلال حلقة الصمام ثلاثي الشرف على طول الحاجز بين الأذينين لإزالة كل الأنسجة الأذينية اليمنى (الشكل 2F).
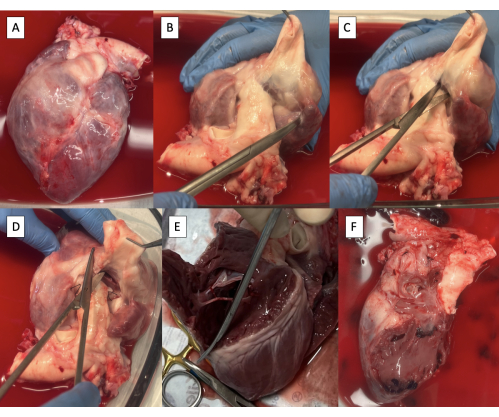
الشكل 2: عينة استئصال القلب واستئصال التراكيب اليمنى. أ: عينة استئصال القلب. ب: الشريان الرئوي الرئيسي يقطع الشريان الأورطي حتى يصبح النسيج البطيني مرئيا. ج: شق البطين الأيمن (RV) في قاعدة الصمام الرئوي. د: استمرار الشق على طول الحاجز بين البطينين أمامي. ه: إزالة الجدار الخالي من المركبات الميكروفونية عن طريق مواصلة الشق المحيطي على طول الحاجز بين البطينين. (و) عينة ذات هياكل يمنى مزيلت. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. إعداد مجرى تدفق البطين الأيسر (LVOT) للقنية مع تركيبات PD
- شق الأذين الأيسر (LA) من خلال عظم الوريد الرئوي الأيمن الموازي للشريان الأورطي باستخدام مقص Metzenbaum (الشكل 3A).
ملاحظة: على الرغم من وجود تباين محدود ، ينتهي تشريح الوريد الرئوي الخنازير عموما في اثنين من الوريد الرئوي أوستيا دخول LA8. - استمر في شق باتجاه الشق الأمامي الجانبي للصمام التاجي (MV) ، تاركا سوار 3 مم على الأقل من الأنسجة الأذينية على جانب الشريان الأورطي.
- تقليم أنسجة LA الزائدة ، والحفاظ على الكفة 3 مم من الأنسجة الأذينية على الشريان الأورطي وحلقة MV محيطيا (الشكل 3B).
- قم بتمديد الشق إلى البطين الأيسر (LV) من خلال المفصل الأمامي الجانبي لل MV ، مع الحرص على الحفاظ على العضلة الحليمية الأمامية الجانبية (الشكل 3C).
- قسم الأوتار الحبلية من العضلة الحليمية الأمامية الجانبية إلى نشرة MV الخلفية ، مع الحفاظ على المرفقات بنشرة MV الأمامية.
- استمر في شق قمة القلب.
- تقليم الأنسجة LV الزائدة أسفل العضلات الحليمية ، والحفاظ على كل من العضلات الحليمية (الشكل 3D).
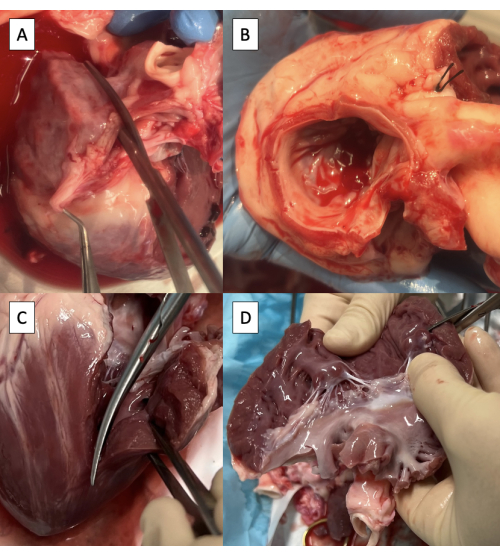
الشكل 3: تحضير مجرى تدفق البطين الأيسر للقنية باستخدام أداة ناسخ النبض. أ: شق الأذين الأيسر عبر عظم الوريد الرئوي الأيمن. (ب) قطع أنسجة LA الزائدة ، والحفاظ على سوار 3 مم على الأقل من الأنسجة الأذينية على الشريان الأورطي والحفاظ على حلقة الصمام التاجي محيطيا. ج: مد الشق إلى البطين الأيسر (LV) عبر الفتحة الأمامية الجانبية للصمام التاجي. د: إزالة الأنسجة LV الزائدة أسفل العضلات الحليمية. المقص مرئي في الزاوية اليمنى العليا من الصورة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. تحضير الشريان الأورطي للقنية باستخدام تركيبات PD
- قم بقص أي نسيج شرياني لمفاوي أو ضام أو رئوي زائد من الشريان الأورطي (الشكل 4 أ).
- شق الجانب العلوي من قوس الأبهر من الشريان الأبهري الهابط إلى الشريان تحت الترقوة الأيسر باستخدام مقص Metzenbaum (الشكل 4B).
- استمر في شق الجانب العلوي من قوس الأبهر من الشريان تحت الترقوة الأيسر إلى الجذع العضدي الرأسي (الشكل 4C ، D).
ملاحظة: تشمل فروع قوس الأبهر الخنازير من البعيد إلى القريب الشريان تحت الترقوة الأيسر والجذع العضدي الرأسي ، مما يؤدي إلى ظهور الشريان تحت الترقوة الأيمن والشريان السباتي الأيمن والشريان السباتي الأيسر9.
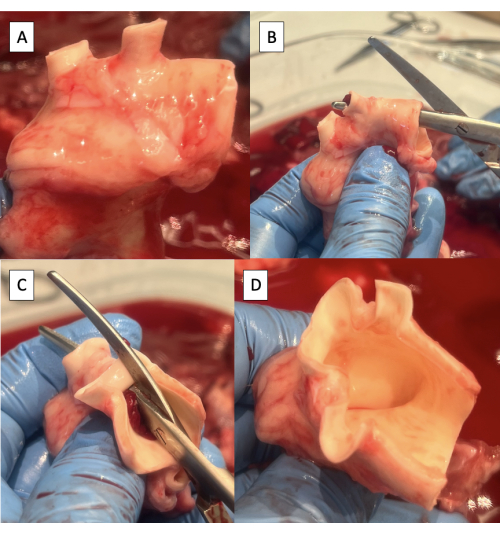
الشكل 4: تحضير الشريان الأورطي للقنية باستخدام أداة ناسخ النبض. أ: قوس الأبهر مع إزالة الأنسجة الزائدة. لاحظ الوعاءين المقوسين في قوس الأبهر الخنازير ، والجذع العضدي الرأسي ، والشريان تحت الترقوة الأيسر. ب: بدء الشق على طول الجانب العلوي من قوس الأبهر من الشريان الأبهري النازل إلى الشريان تحت الترقوة الأيسر. ج: استمرار الشق على طول الجانب العلوي من قوس الأبهر من الشريان تحت الترقوة الأيسر إلى الجذع العضدي الرأسي. د: اكتمال شق قوس الأبهر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. قنية LVOT مع تركيبات PD
- اختبر موضع التركيب في LVOT وقم بقص أنسجة LV الزائدة.
- أدخل التركيب في LVOT أسفل النشرة الأمامية ل MV.
- لف الجدار الخالي من الجهد المنخفض حول التركيبات.
- قم بقص أنسجة LV الزائدة للحفاظ على التفاف محكم حول التركيبات.
- قم بإزالة نصف سمك الجدار الحر LV بدءا من الحاجز بين البطينين ، مع الحفاظ على ما لا يقل عن 1 سم من النخاب عند الحافة الحرة للحفاظ على سلامة خط الخياطة (الشكل 5 أ).
- قم بقص 1 سم من الأنسجة من الزاوية العلوية لغلاف الحائط الخالي من الجهد المنخفض (الشكل 5 أ).
- ضع التركيبات في LVOT مع فتحة ربط قضيب الدعم 1 سم خلف شق LV (الشكل 5B).
- احرص على عدم إدخال التركيبات بعيدا جدا في LVOT بحيث توسع الحلقة الأذينية البطينية.
- اربط النشرة الأمامية ل MV بالتركيبات باستخدام واحد أو اثنين من الروابط المضغوطة مقاس 6 بوصات الموضوعة بين أوتار الحبال للنشرة (الشكل 5C).
- خياطة الجدار الحر LV حول لاعبا اساسيا (الشكل 5D).
- ابدأ بخياطة الكفة من أنسجة LA على الشريان الأورطي إلى حلقة MV باستخدام خياطة جري بسيطة بإبرة نقطة مستدقة.
- استمر في غرزة الجري على الجهد المنخفض ، وليس تمزيق أنسجة الجهد المنخفض.
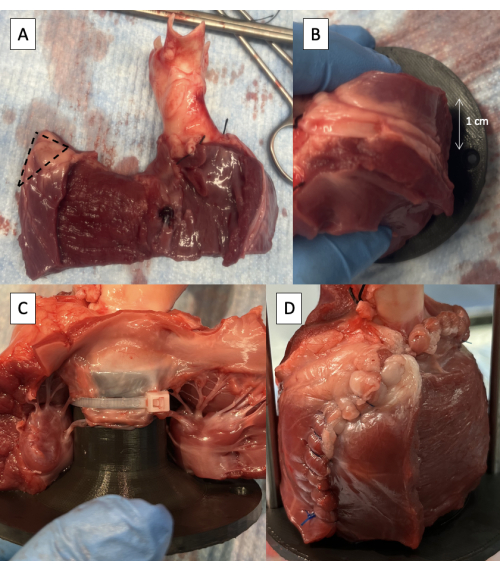
الشكل 5: قنية مجرى تدفق البطين الأيسر باستخدام أداة ناسخ النبض. (أ) إزالة نصف سمك الجدار الحر منخفض الجهد مع الحفاظ على 1 سم من النخاب عند الحافة الحرة. يشير الخط المنقط إلى المساحة التي يبلغ طولها 1 سم والتي سيتم إزالتها من الزاوية العلوية لغلاف الحائط الخالي من الجهد المنخفض. (ب) فتحة ربط قضيب داعمة موضوعة على بعد 1 سم خلف شق الجدار الخالي من الجهد المنخفض. (C) ربطة عنق بسحاب تثبت النشرة الأمامية للجهد المتوسط بالتركيبات القريبة. (د) جدار خال من الجهد المنخفض مخيط حول المباراة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
6. قنية الشريان الأورطي مع تركيبات PD والتحضير النهائي لاختبار PD
- قم بقياس قطر AV باستخدام موسعات Hegar للمساعدة في تفسير نتائج اختبار PD.
- حدد الموضع المحايد للشريان الأورطي عن طريق رفع العينة عن الطاولة عن طريق الإمساك بالشريان الأورطي (الشكل 6 أ).
- أدخل تركيبات PD في الشريان الأورطي ، مع الحرص على محاذاة فتحات ربط القضيب في الوضع المحايد للشريان الأورطي.
- تحقق من طول العينة عن طريق إدخال قضبان الدعم.
- قم بتثبيت تركيبات PD على الشريان الأورطي باستخدام واحد أو اثنين من الروابط المضغوطة مقاس 6 بوصات (الشكل 6B).
- قم بتأمين LVOT حول تركيبات PD باستخدام واحد أو اثنين من الروابط المضغوطة مقاس 8 بوصات.
- ثبت قضبان الدعم في مكانها باستخدام البراغي المرفقة مع مجموعة PD.
- ضع العينة في PD وابدأ الاختبار (الشكل 6C والفيديو 1 والفيديو 2).
- خياطة أي تسرب حسب الحاجة.
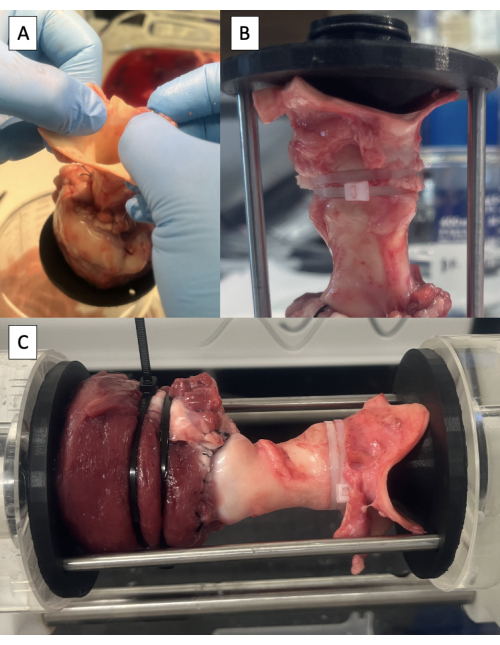
الشكل 6: قنية الشريان الأورطي واختباره في الناسخ النبضي. أ: رفع العينة عن الطاولة بواسطة الشريان الأورطي لتحديد الموضع المحايد للشريان الأورطي. (ب) تركيبات بعيدة مثبتة في الشريان الأورطي برباط مضغوط. (ج) عينة مركبة في الناسخ النبضي للاختبار الهيدرودينامي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
7. تنفيذ الإجراء التجريبي
ملاحظة: قم بإجراء إجراءات تجريبية مثل إجراء Ozaki كما هو موضح سابقا5،6،7 ، وكرر اختبار PD.
- إذا جفت الأنسجة أثناء العملية ، فقم بشد الروابط المضغوطة وعزز خط الخياطة حسب الحاجة.
8. تخزين طويل الأجل للعينة (إذا رغبت في ذلك)
- ضع العينة في الفورمالين 10٪ لمدة 168 ساعة (أسبوع واحد)10,11.
- بعد تثبيت الأنسجة ، اغسل العينة بالماء منزوع الأيونات وضعها في الإيثانول بنسبة 70٪ للتخزين طويل الأجل.
النتائج
تتضمن البيانات التمثيلية التي تم جمعها من ناسخ النبض جزء القلس (RF) ومنطقة الفتحة الفعالة (EOA) ومتوسط فرق الضغط الإيجابي (PPD). يتم استخدام RF و EOA، على وجه الخصوص، في معايير ISO للصمامات الاصطناعية (ISO 5840) وسيكون من المهم جمعها إذا كانت منتجات الصمامات الاصطناعية قيد التحقيق. يقدم PPD معلومات تتعلق ?...
Discussion
توفر الطريقة المعروضة هنا منصة للاختبار الهيدروديناميكي للمركبات من أجل فحص تأثير إجراء تجريبي أو جهاز طبي جديد. من خلال تركيب الصمام الأبهري الأصلي على جهاز ناسخ النبض ، يمكننا تحديد تأثير الإجراء التجريبي على جميع المعلمات الهيدروديناميكية المستخدمة في التحقيق والموافقة على الأطراف ?...
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح المالية ذات صلة للكشف عنها.
Acknowledgements
نود أن نشكر مختبر الدكتورة جوردانا فونجاك نوفاكوفيتش ، بما في ذلك جولي فان هاسل ومحمد ديان وبانبان تشين ، للسماح لنا باستخدام أنسجة النفايات القلبية من تجاربهم. تم دعم هذا العمل من قبل تحالف عيوب القلب الخلقية في بتلر ، نيوجيرسي ، والمعاهد الوطنية للصحة في بيثيسدا ، ماريلاند (5T32HL007854-27).
Materials
| Name | Company | Catalog Number | Comments |
| 3D Printer | Ultimaker | Ultimaker S5 | Used for printing custom fixtures for hydrodynamic testing |
| Crile-Wood Needle Driver | Emerald Instruments | 2.0638.15 | Used for suturing ventricle |
| Debakey Forceps | Jarit | 320-110 | Used for dissection and sample preparation (can use multiple if working with an assistant) |
| Ethanol 200 proof | Decon Labs Inc. | DSP-MD.43 | Used for fixed tissue storage |
| Formalin 10% | Epredia | 5701 | Used for tissue fixation |
| Gerald Forceps | Jarit | 285-126 | Used for dissection and sample preparation |
| Glass jars | QAPPDA | B07QCP54Z3 | Used for tissue storage |
| Glutaraldehyde 25% | Electron Microscopy Sciences | 16400 | Used for tissue fixation |
| HEPES 1 M buffer solution | Fisher | BP299-100 | Used to make glutaraldehyde 0.6% |
| Mayo Scissors | Jarit | 099-200 | Used for cutting suture |
| Metzenbaum Scissors | Jarit | 099-262 | Used for dissection and sample preparation |
| O-ring | Sterling Seal & Supply Inc. | AS568-117 | Used as a gasket on the end of the 3D printed fixtures |
| Polylactic acid resin | Ultimaker | 1609 | Used for 3D printing fixtures |
| Polyproplene suture | Covidien | VP-762-X | Used for suturing ventricle, tapered needle |
| Pulse Duplicator | BDC Laboratories | HDTi-6000 | Used for hydrodynamic testing |
| Silk ties | Covidien | S-193 | Used for ligating coronary arteries |
| Tonsil Clamp | Aesculap | BH957R | Used for coronary artery dissection |
| Zip ties (6 inch) | Advanced Cable Ties, Inc. | AL-06-18-9-C | Used for securing sample to fixtures, 157.14 mm long (6 inches), 2.5 mm wide |
| Zip ties (8 inch) | GTSE | GTSE-20025B.1000 | Used for securing sample to fixtures, 203 mm long (8 inches), 2.5 mm wide |
References
- Aluru, J. S., Barsouk, A., Saginala, K., Rawla, P., Barsouk, A. Valvular heart disease epidemiology. Medical Science. 10 (2), 32 (2022).
- Herrmann, J. L., Brown, J. W. Seven decades of valved right ventricular outflow tract reconstruction: The most common heart procedure in children. The Journal of Thoracic and Cardiovascular Surgery. 160 (5), 1284-1288 (2020).
- Rotman, O. M., Bianchi, M., Ghosh, R. P., Kovarovic, B., Bluestein, D. Principles of TAVR valve design, modelling, and testing. Expert Review of Medical Devices. 15 (11), 771-791 (2018).
- Pibarot, P., et al. Imaging for predicting and assessing prosthesis-patient mismatch after aortic valve replacement. JACC Cardiovascular Imaging. 12 (1), 149-162 (2019).
- Ozaki, S., et al. Aortic valve reconstruction using self-developed aortic valve plasty system in aortic valve disease. Interactive Cardiovascular and Thoracic Surgery. 12 (4), 550-553 (2011).
- Krane, M., Amabile, A., Ziegelmüller, J. A., Geirsson, A., Lange, R. Aortic valve neocuspidization (the Ozaki procedure). Multimedia Manual of Cardiothoracic Surgery. , (2021).
- Ozaki, S., et al. A total of 404 cases of aortic valve reconstruction with glutaraldehyde-treated autologous pericardium. The Journal of Thoracic and Cardiovascular Surgery. 147 (1), 301-306 (2014).
- Vandecasteele, T., et al. The pulmonary veins of the pig as an anatomical model for the development of a new treatment for atrial fibrillation. Anatomia Histollogia Embryologia. 44 (1), 1-12 (2015).
- Góes, A. M. O., et al. Comparative angiotomographic study of swine vascular anatomy: contributions to research and training models in vascular and endovascular surgery. Journal Vascular Brasilerio. 20, 20200086 (2021).
- Hołda, M. K., Klimek-Piotrowska, W., Koziej, M., Piątek, K., Hołda, J. Influence of different fixation protocols on the preservation and dimensions of cardiac tissue. Journal of Anatomy. 229 (2), 334-340 (2016).
- Hołda, M. K., Klimek-Piotrowska, W., Koziej, M., Tyrak, K., Hołda, J. Penetration of formaldehyde based fixatives into heart. Folia Medica Cracoviensia. 57 (4), 63-70 (2017).
- Spampinato, R. A., et al. Grading of aortic regurgitation by cardiovascular magnetic resonance and pulsed Doppler of the left subclavian artery: harmonizing grading scales between imaging modalities. International Journal of Cardiovascular Imaging. 36 (8), 1517-1526 (2020).
- Capps, S. B., Elkins, R. C., Fronk, D. M. Body surface area as a predictor of aortic and pulmonary valve diameter. The Journal of Thoracic and Cardiovascular Surgery. 119 (5), 975-982 (2000).
- Baumgartner, H., et al. Recommendations on the echocardiographic assessment of aortic valve stenosis: a focused update from the European Association of Cardiovascular Imaging and the American Society of Echocardiography. European Heart Journal - Cardiovascular Imaging. 18 (3), 254-275 (2017).
- Saisho, H., et al. An ex vivo evaluation of two different suture techniques for the Ozaki aortic neocuspidization procedure. Interactive Cardiovascular and Thoracic Surgery. 33 (4), 518-524 (2021).
- Saisho, H., et al. Ex vivo evaluation of the Ozaki procedure in comparison with the native aortic valve and prosthetic valves. Interactive Cardiovascular and Thoracic Surgery. 35 (3), (2022).
- Paulsen, M. J., et al. Comprehensive ex vivo comparison of 5 clinically used conduit configurations for valve-sparing aortic root replacement using a 3-dimensional-printed heart simulator. Circulation. 142 (14), 1361-1373 (2020).
- Al-Atassi, T., et al. Impact of aortic annular geometry on aortic valve insufficiency: Insights from a preclinical, ex vivo, porcine model. The Journal of Thoracic and Cardiovascular Surgery. 150 (3), 656-664 (2015).
- Sun, M., et al. A biomimetic multilayered polymeric material designed for heart valve repair and replacement. Biomaterials. 288, 121756 (2022).
- Waller, B. F., McKay, C., Van Tassel, J., Allen, M. Catheter balloon valvuloplasty of stenotic porcine bioprosthetic valves: Part I: Anatomic considerations. Clinical Cardiology. 14 (8), 686-691 (1991).
- Crick, S. J., Sheppard, M. N., Ho, S. Y., Gebstein, L., Anderson, R. H. Anatomy of the pig heart: comparisons with normal human cardiac structure. Journal of Anatomy. 193, 105-119 (1998).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved