Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ein ex vivo Schweinemodell für die hydrodynamische Erprobung experimenteller Aortenklappenverfahren und neuartiger Medizinprodukte
In diesem Artikel
Zusammenfassung
Wir stellen eine Methode vor, um eine Schweineaortenklappe auf einem Pulsduplikator zu montieren, um ihre hydrodynamischen Eigenschaften zu testen. Mit dieser Methode kann die Änderung der Hydrodynamik nach der Anwendung eines experimentellen Verfahrens oder eines neuartigen Medizinprodukts vor dem Einsatz in einem Großtiermodell bestimmt werden.
Zusammenfassung
Die Möglichkeiten, neue kardiologische Verfahren und untersuchende Medizinprodukte vor dem Einsatz im Tiermodell zu testen, sind begrenzt. In dieser Arbeit stellen wir eine Methode vor, mit der eine porcine Aortenklappe in einem Pulsduplikator montiert werden kann, um ihre hydrodynamischen Eigenschaften zu bewerten. Diese Eigenschaften können dann vor und nach der Durchführung des zu untersuchenden Verfahrens und/oder der Anwendung des zu untersuchenden Medizinprodukts bewertet werden. Die Sicherung des Zuflusssegments ist aufgrund des Fehlens eines umlaufenden Myokards im linksventrikulären Ausflusstrakt mit einigen Schwierigkeiten verbunden. Diese Methode löst dieses Problem, indem das Zuflusssegment mit dem vorderen Segel der Mitralklappe gesichert und dann die linksventrikuläre freie Wand um die Zuflussvorrichtung vernäht wird. Das Abflusssegment wird einfach durch Einführen der Halterung in einen Schnitt im oberen Bereich des Aortenbogens gesichert. Wir fanden heraus, dass die Proben vor und nach der Gewebefixierung signifikant unterschiedliche hydrodynamische Eigenschaften aufwiesen. Diese Erkenntnis veranlasste uns, frische Proben für unsere Tests zu verwenden, und sollte bei der Anwendung dieser Methode berücksichtigt werden. In unserer Arbeit haben wir diese Methode verwendet, um neuartige intrakardiale Pflastermaterialien für den Einsatz in der Herzklappenposition zu testen, indem wir eine Aortenklappen-Neokuspidisierung (Ozaki-Verfahren) an den montierten Schweineaortenklappen durchgeführt haben. Diese Ventile wurden vor und nach dem Verfahren getestet, um die Veränderung der hydrodynamischen Eigenschaften im Vergleich zum nativen Ventil zu bewerten. In dieser Arbeit berichten wir über eine Plattform zur hydrodynamischen Prüfung experimenteller Aortenklappenverfahren, die einen Vergleich mit der nativen Klappe und zwischen verschiedenen Geräten und Techniken ermöglicht, die für das zu untersuchende Verfahren verwendet werden.
Einleitung
Aortenklappenerkrankungen stellen eine erhebliche Belastung für die öffentliche Gesundheit dar, insbesondere die Aortenklappenstenose, von der weltweit 9 Millionen Menschen betroffen sind1. Strategien zur Behandlung dieser Krankheit werden derzeit weiterentwickelt und umfassen die Reparatur der Aortenklappe und den Ersatz der Aortenklappe. Insbesondere in der pädiatrischen Population besteht ein erheblicher Anreiz, die Klappe zu reparieren und nicht zu ersetzen, da die derzeit verfügbaren Prothesen anfällig für strukturelle Klappendegeneration (SVD) und nicht wachstumstolerant sind, so dass eine erneute Operation erforderlich ist, um sie mit zunehmendem Wachstum des Patienten erneut zu ersetzen. Auch das Ross-Verfahren, bei dem die erkrankte Aortenklappe (AV) durch die native Pulmonalklappe (PV) ersetzt wird, erfordert eine Prothese oder ein Transplantat in Lungenposition, die ebenfalls einer SVD und oft einer eingeschränkten Wachstumstoleranz unterliegt2. Es werden neue Ansätze für Aortenklappenerkrankungen entwickelt, und es besteht die Notwendigkeit, vor der Anwendung in einem Großtiermodell in einem biologisch relevanten Kontext zu testen.
Wir haben eine Methode zum Testen eines porcinen AV entwickelt, die Einblicke in die Funktion der Klappe vor und nach einem Prüfverfahren oder der Anwendung eines neuartigen Medizinprodukts geben kann. Durch die Montage des porcinen AV auf einer handelsüblichen Pulsvervielfältigungsmaschine sind wir in der Lage, die hydrodynamischen Eigenschaften zu vergleichen, die üblicherweise bei der Untersuchung und letztendlich der Zulassung von Klappenprothesen verwendet werden, einschließlich der Regurgitationsfraktion (RF), der effektiven Öffnungsfläche (EOA) und der mittleren positiven Druckdifferenz (PPD)3,4. Die Intervention kann dann vor dem Einsatz in einem Großtiermodell in einem biologisch relevanten Kontext fein abgestimmt werden, wodurch die Anzahl der Tiere, die für die Herstellung eines Verfahrens oder einer Prothese benötigt werden, die beim Menschen eingesetzt werden kann, begrenzt wird. Die Herzen, die für dieses Experiment verwendet werden, können aus dem örtlichen Schlachthof oder aus Abfallgewebe aus anderen Versuchen gewonnen werden, so dass es nicht notwendig ist, ein Tier ausschließlich für die Zwecke dieses Versuchs zu opfern.
In unserer Arbeit haben wir diese Methode genutzt, um ein neuartiges Patch-Material für die Reparatur und den Austausch von Ventilen zu entwickeln. Wir testeten die hydrodynamische Funktion einer Vielzahl von Patch-Materialien, indem wir eine Aortenklappen-Neokuspidisierung (Ozaki-Verfahren 5,6,7) an porcinen AVs durchführten und diese vor und nach dem Eingriff im Pulsduplikationor testeten. Dies ermöglichte es uns, das Material auf der Grundlage seiner hydrodynamischen Leistung zu verfeinern. Somit bietet diese Methode eine Plattform für die hydrodynamische Erprobung von experimentellen Verfahren und neuartigen medizinischen Geräten für den Einsatz auf dem AV vor der Anwendung in einem Großtiermodell.
Protokoll
Alle Untersuchungen wurden in Übereinstimmung mit den institutionellen Richtlinien für die Pflege von Tieren durchgeführt.
1. Überlegungen und Vorbereitungen für das Experiment
- Verwenden Sie einen geeigneten Pulsduplikator (PD) für die Simulation des Herzzeitvolumens durch das AV. Die PD muss in der Lage sein, biologische Materialien aufzunehmen und gereinigt zu werden.
- Verwenden Sie PD-Einstellungen, die für die Prüfung des AV geeignet sind: 70 ml Verdrängungsvolumen und 70 Schläge pro Minute (5 l/min Herzzeitvolumen), 35 % des Herzzyklus in der Systole, 100 mmHg mittlerer transvalvulärer Druckgradient, 120 maximaler Druckgradient und 80 minimaler Druckgradient.
- Verwenden Sie bei Raumtemperatur (RT) normale Kochsalzlösung (0,9 % NaCl) als flüssiges Medium.
- Suchen oder erstellen Sie (mittels 3D-Druck oder einer ähnlichen Methode) geeignete Vorrichtungen für die Montage des Schweine-AV für Tests am PD.
- Verwenden Sie Vorrichtungen, die den mit dem Impulsduplikator gelieferten Vorrichtungen mit den folgenden Spezifikationen nachempfunden sind: Stellen Sie sicher, dass der Innendurchmesser der Vorrichtung dem Durchmesser des zu untersuchenden AV entspricht, die Aufsatzlänge mindestens 2 cm beträgt und die nutzbare Vorsatzbreite mindestens 4 cm beträgt (Abbildung 1).
- Verwenden Sie Gummi-O-Ringe als Dichtungen an den Enden der Vorrichtungen.
- Entnahme einer Herzprobe nach Kardiektomie (Abbildung 2A).
- Verwenden Sie Herzproben von Schweinen aus dem Schlachthof oder Gewebeabfälle von Tieren, die ansonsten gesund sind und nicht Teil von Versuchsprotokollen waren, die ihr Herz beeinträchtigen.
- Entnahme einer Probe nach Kardiektomie oder postmortale Kardiektomie, einschließlich Durchtrennung der oberen Hohlvene, der unteren Hohlvene, der Hauptpulmonalarterie (PA), aller Lungenvenen und der Aorta an der distalen Seite des Aortenbogens.
HINWEIS: Für dieses Experiment sollten frische Proben verwendet werden, die weniger als 6 Stunden post mortem oder in steriler Kochsalzlösung mit einer 1%igen antibiotischen Lösung (Penicillin und Streptomycin) in einem 4 -°C-Kühlschrank für bis zu 7 Tage gelagert wurden. Gewebe, die in Formalin oder Glutaraldehyd fixiert sind, führen aufgrund der erhöhten Steifigkeit zu veränderten hydrodynamischen Ergebnissen.

Abbildung 1: Maßgeschneiderte 3D-gedruckte Vorrichtungen für die Montage der Schweineaortenklappen am Pulsduplikator. Wie im Protokoll vermerkt, sollte die Aufsatzlänge mindestens 2 cm und die nutzbare Aufsatzbreite mindestens 4 cm betragen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Resektion rechtsseitiger Strukturen
- Sezieren Sie die PA von der Aorta mit einer Metzenbaum-Schere, bis Ventrikelgewebe sichtbar ist (Abbildung 2B).
- Präpariert und ligiert mit Seidenbändern beide Koronararterien an ihrem Ursprung in den Aortenhöhlen, wobei darauf zu achten ist, dass die Nebenhöhlen nicht verengt werden.
- Durchtrennen Sie die Koronararterien distal der Seidenbänder.
- Schneiden Sie den rechten Ventrikel (RV) zwischen der Aorta und dem PA an der Basis der Pulmonalklappe mit einer Metzenbaum-Schere ein (Abbildung 2C).
- Beginnen Sie anterior und setzen Sie die Inzision in Umfangsrichtung entlang des interventrikulären Septums fort, um die RV-freie Wand zu entfernen (Abbildung 2D, E).
- Setzen Sie die Inzision posterior durch den Trikuspidalklappenanulus entlang der Vorhofscheidewand fort, um das gesamte rechte Vorhofgewebe zu entfernen (Abbildung 2F).
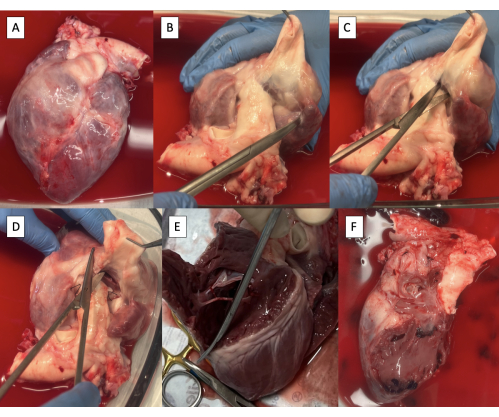
Abbildung 2: Kardiektomie-Präparat und Resektion rechtsseitiger Strukturen. (A) Kardiektomie-Präparat. (B) Die Hauptpulmonalarterie wird von der Aorta abgetrennt, bis das ventrikuläre Gewebe sichtbar ist. (C) Inzision des rechten Ventrikels (RV) an der Basis der Pulmonalklappe. (D) Fortsetzung der Inzision entlang des interventrikulären Septums anterior. (E) Entfernung der RV-freien Wand durch Fortsetzung der Inzision in Umfangsrichtung entlang des interventrikulären Septums. (F) Probe mit entfernten rechtsseitigen Strukturen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Vorbereitung des linksventrikulären Ausflusstraktes (LVOT) für die Kanülierung mit der PD-Halterung
- Inzisieren Sie den linken Vorhof (LA) durch das rechte Pulmonalvenenostium parallel zur Aorta mit einer Metzenbaum-Schere (Abbildung 3A).
HINWEIS: Obwohl eine begrenzte Variabilität besteht, endet die Anatomie der Pulmonalvene von Schweinen im Allgemeinen in zwei Pulmonalvenenostien, die in die LA8 eintreten. - Setzen Sie die Inzision in Richtung der anterolateralen Kommissur der Mitralklappe (MV) fort und lassen Sie auf der Aortenseite mindestens eine 3 mm große Manschette aus Vorhofgewebe übrig.
- Schneiden Sie überschüssiges LA-Gewebe ab, wobei die 3 mm lange Manschette des Vorhofgewebes an der Aorta und dem MV-Anulus umfangsweise erhalten bleibt (Abbildung 3B).
- Verlängern Sie den Schnitt auf den linken Ventrikel (LV) durch die anterolaterale Kommissur des MV und achten Sie darauf, den anterolateralen Papillarmuskel zu erhalten (Abbildung 3C).
- Die Chordae tendineae wird vom anterolateralen Papillarmuskel in das hintere MV-Segel geteilt, wobei die Anheftungen an das vordere MV-Segel erhalten bleiben.
- Setzen Sie den Schnitt bis zur Herzspitze fort.
- Schneiden Sie überschüssiges LV-Gewebe unterhalb der Papillarmuskeln ab, wobei beide Papillarmuskeln erhalten bleiben (Abbildung 3D).
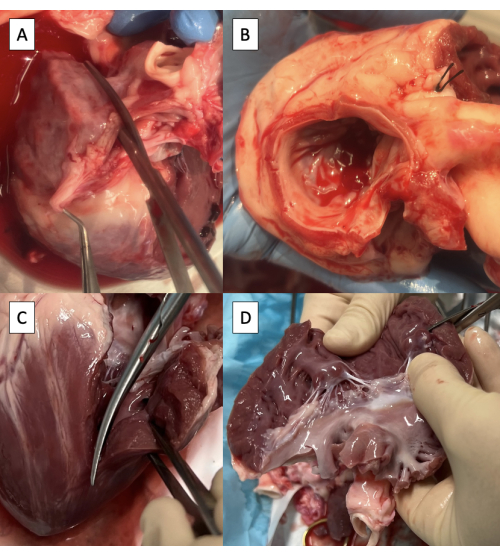
Abbildung 3: Vorbereitung des linksventrikulären Ausflusstraktes für die Kanülierung mit der Pulsduplikatorvorrichtung. (A) Inzision des linken Vorhofs (LA) durch das Ostium der rechten Pulmonalvene. (B) Überschüssiges LA-Gewebe wird gekürzt, wobei mindestens eine 3 mm lange Manschette aus Vorhofgewebe an der Aorta erhalten bleibt und der Mitralklappenanulus umlaufend erhalten bleibt. (C) Verlängerung der Inzision auf den linken Ventrikel (LV) durch die anterolaterale Kommissur der Mitralklappe. (D) Entfernung von überschüssigem LV-Gewebe unterhalb der Papillarmuskeln. Die Schere ist in der oberen rechten Ecke des Bildes zu sehen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
4. Vorbereitung der Aorta für die Kanülierung mit der PD-Halterung
- Schneiden Sie überschüssiges Lymph-, Binde- oder Lungenarteriengewebe von der Aorta ab (Abbildung 4A).
- Schneiden Sie den oberen Aspekt des Aortenbogens von der absteigenden Aorta bis zur linken Schlüsselbeinarterie mit einer Metzenbaum-Schere ein (Abbildung 4B).
- Setzen Sie die Inzision an der oberen Seite des Aortenbogens von der linken Arteria subclavia bis zum Truncus brachiocephalicus fort (Abbildung 4C, D).
HINWEIS: Zu den Ästen des Porcinaortenbogens von distal nach proximal gehören die linke Arteria subclavia und der Truncus brachiocephalicus, aus denen die rechte Arteria subclavia, die rechte Halsschlagader und die Arteria carotis links entstehen9.
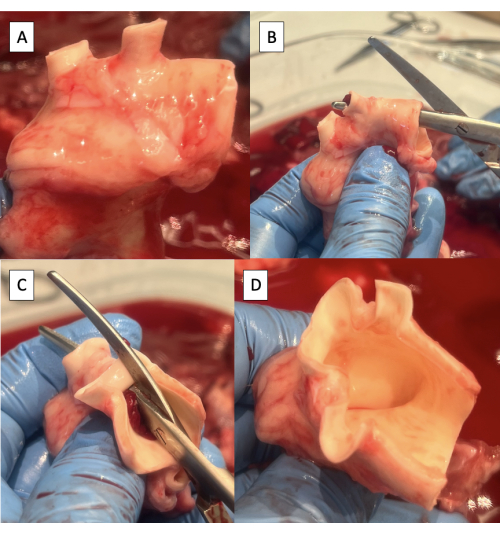
Abbildung 4: Vorbereitung der Aorta für die Kanülierung mit der Pulsduplikator-Vorrichtung. (A) Aortenbogen mit entferntem überschüssigem Gewebe. Man beachte die beiden Bogengefäße im porcinen Aortenbogen, den Truncus brachiocephalicus und die linke Arteria subclavia. (B) Beginn der Inzision entlang des oberen Aspekts des Aortenbogens von der absteigenden Aorta zur linken Schlüsselbeinarterie. (C) Fortsetzung der Inzision entlang des oberen Aspekts des Aortenbogens von der linken Arteria subclavia bis zum Truncus brachiocephalicus. (D) Abgeschlossene Inzision des Aortenbogens. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
5. Kanülierung des LVOT mit der PD-Halterung
- Testen Sie die Positionierung der Vorrichtung im LVOT und schneiden Sie überschüssiges LV-Gewebe ab.
- Setzen Sie die Halterung unter dem vorderen Segel des MV in das LVOT ein.
- Wickeln Sie die LV-freie Wand um die Leuchte.
- Schneiden Sie überschüssiges LV-Gewebe ab, um eine enge Wicklung um die Vorrichtung zu erhalten.
- Entfernen Sie die Hälfte der Dicke der LV-freien Wand, beginnend am interventrikulären Septum, wobei mindestens 1 cm Epikard am freien Rand beibehalten wird, um die Integrität der Nahtlinie zu erhalten (Abbildung 5A).
- Schneiden Sie 1 cm Gewebe von der oberen Ecke der LV-freien Wandhülle ab (Abbildung 5A).
- Positionieren Sie die Halterung im LVOT mit dem Befestigungsloch der Stützstange 1 cm hinter dem LV-Einschnitt (Abbildung 5B).
- Achten Sie darauf, die Leuchte nicht zu weit in den LVOT einzuführen, so dass sich der AV-Ringraum erweitert.
- Befestigen Sie das vordere Segel des MV an der Halterung mit einem oder zwei 6-Zoll-Kabelbindern, die zwischen den Chordae tendineae des Segels positioniert sind (Abbildung 5C).
- Vernähen Sie die LV-freie Wand um die Vorrichtung herum (Abbildung 5D).
- Beginnen Sie damit, die Manschette aus LA-Gewebe an der Aorta mit einer einfachen laufenden Naht mit einer konischen Spitzennadel an den MV-Anulus zu nähen.
- Setze den Laufstich auf dem LV fort, ohne das LV-Gewebe zu zerreißen.
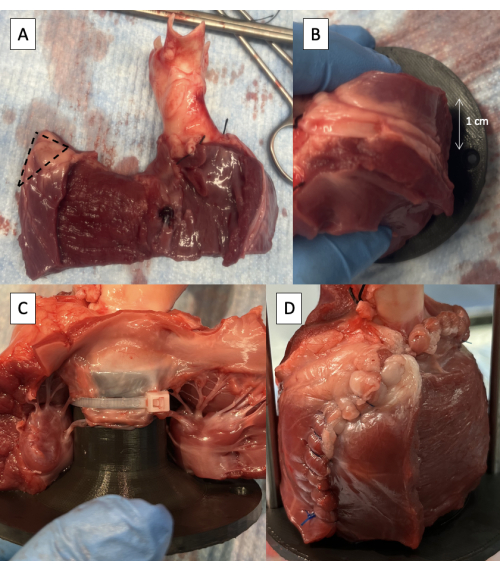
Abbildung 5: Kanülierung des linksventrikulären Ausflusstraktes mit der Pulsduplikatorhalterung. (A) Die halbe Dicke der LV-freien Wand wurde entfernt, wobei 1 cm Epikard am freien Rand erhalten blieb. Die gestrichelte Linie zeigt den 1 cm großen Bereich an, der von der oberen Ecke der LV-freien Wandverkleidung entfernt werden soll. (B) Befestigungsloch für die Stützstange, das 1 cm hinter dem Einschnitt der LV-freien Wand positioniert ist. (C) Kabelbinder, mit dem das vordere Segel des MV an der proximalen Halterung befestigt wird. (D) LV-freie Wand, die um die Leuchte herum vernäht ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
6. Kanülierung der Aorta mit PD-Halterung und abschließende Vorbereitung für die PD-Prüfung
- Messen Sie den Durchmesser des AV mit Hegar-Dilatatoren, um die Interpretation der Ergebnisse der TE-Tests zu unterstützen.
- Ermitteln Sie die neutrale Position der Aorta, indem Sie die Probe vom Tisch heben, indem Sie die Aorta greifen (Abbildung 6A).
- Setzen Sie die PD-Halterung in die Aorta ein und achten Sie darauf, dass die Befestigungslöcher der Stange in der neutralen Position der Aorta ausgerichtet sind.
- Überprüfen Sie die Länge der Probe, indem Sie die Stützstangen einsetzen.
- Befestigen Sie die PD-Halterung mit einem oder zwei 6-Zoll-Kabelbindern an der Aorta (Abbildung 6B).
- Befestigen Sie das LVOT mit einem oder zwei 8-Zoll-Kabelbindern um die PD-Halterung.
- Befestigen Sie die Stützstangen mit den mitgelieferten Schrauben.
- Platzieren Sie die Probe in PD und starten Sie den Test (Abbildung 6C, Video 1 und Video 2).
- Nähen Sie alle Lecks nach Bedarf.
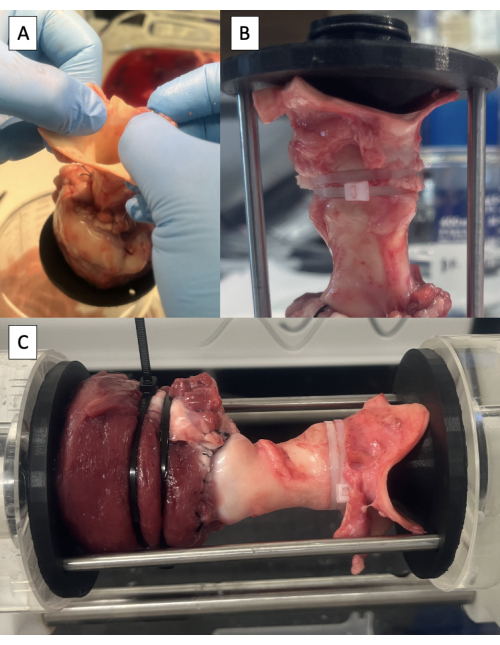
Abbildung 6: Kanülierung der Aorta und Prüfung im Pulsduplikationsgerät. (A) Abheben der Probe vom Tisch an der Aorta, um die neutrale Position der Aorta zu identifizieren. (B) Distale Fixierung in der Aorta mit Kabelbindern gesichert. (C) Probe zur hydrodynamischen Prüfung im Impulsvervielfältiger montiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
7. Führen Sie ein experimentelles Verfahren durch
HINWEIS: Führen Sie experimentelle Verfahren wie das zuvor beschriebene Ozaki-Verfahren 5,6,7 durch und wiederholen Sie den PD-Test.
- Wenn das Gewebe während des Eingriffs ausgetrocknet ist, ziehen Sie die Kabelbinder fest und verstärken Sie die Nahtlinie nach Bedarf.
8. Langzeitlagerung der Probe (falls gewünscht)
- Probe 168 h (1 Woche) in Formalin 10% legen10,11.
- Waschen Sie die Probe nach der Gewebefixierung mit deionisiertem Wasser und legen Sie sie zur Langzeitlagerung in 70%iges Ethanol.
Ergebnisse
Zu den repräsentativen Daten, die vom Impulsduplikator gesammelt werden, gehören die Regurgitationsfraktion (RF), die effektive Öffnungsfläche (EOA) und die mittlere positive Druckdifferenz (PPD). Insbesondere RF und EOA werden in den ISO-Normen für Klappenprothesen (ISO 5840) verwendet und sind wichtig zu erfassen, wenn Prothesenklappenprodukte untersucht werden. Die PPD gibt Auskunft darüber, wie viel Druck erforderlich ist, um die Klappe zu öffnen, und wird häufig herangezogen, wenn es um den Austausch von pro...
Diskussion
Die hier vorgestellte Methode bietet eine Plattform für die hydrodynamische Prüfung des AV, um die Wirkung eines experimentellen Verfahrens oder eines neuartigen Medizinprodukts zu untersuchen. Durch die Montage der nativen Aortenklappe auf einer Pulsvervielfältigungsmaschine sind wir in der Lage, den Einfluss des experimentellen Vorgehens auf alle hydrodynamischen Parameter zu bestimmen, die bei der Untersuchung und Zulassung neuartiger Klappenprothesen (ISO 5840) verwendet werden. Dies bietet die Möglichkeit, Verfa...
Offenlegungen
Die Autoren haben keine relevanten finanziellen Interessenkonflikte offenzulegen.
Danksagungen
Wir danken dem Labor von Dr. Gordana Vunjak-Novakovic, einschließlich Julie Van Hassel, Mohamed Diane und Panpan Chen, für die Erlaubnis, Herzabfälle aus ihren Experimenten zu verwenden. Diese Arbeit wurde von der Congenital Heart Defect Coalition in Butler, NJ, und den National Institutes of Health in Bethesda, MD, unterstützt (5T32HL007854-27).
Materialien
| Name | Company | Catalog Number | Comments |
| 3D Printer | Ultimaker | Ultimaker S5 | Used for printing custom fixtures for hydrodynamic testing |
| Crile-Wood Needle Driver | Emerald Instruments | 2.0638.15 | Used for suturing ventricle |
| Debakey Forceps | Jarit | 320-110 | Used for dissection and sample preparation (can use multiple if working with an assistant) |
| Ethanol 200 proof | Decon Labs Inc. | DSP-MD.43 | Used for fixed tissue storage |
| Formalin 10% | Epredia | 5701 | Used for tissue fixation |
| Gerald Forceps | Jarit | 285-126 | Used for dissection and sample preparation |
| Glass jars | QAPPDA | B07QCP54Z3 | Used for tissue storage |
| Glutaraldehyde 25% | Electron Microscopy Sciences | 16400 | Used for tissue fixation |
| HEPES 1 M buffer solution | Fisher | BP299-100 | Used to make glutaraldehyde 0.6% |
| Mayo Scissors | Jarit | 099-200 | Used for cutting suture |
| Metzenbaum Scissors | Jarit | 099-262 | Used for dissection and sample preparation |
| O-ring | Sterling Seal & Supply Inc. | AS568-117 | Used as a gasket on the end of the 3D printed fixtures |
| Polylactic acid resin | Ultimaker | 1609 | Used for 3D printing fixtures |
| Polyproplene suture | Covidien | VP-762-X | Used for suturing ventricle, tapered needle |
| Pulse Duplicator | BDC Laboratories | HDTi-6000 | Used for hydrodynamic testing |
| Silk ties | Covidien | S-193 | Used for ligating coronary arteries |
| Tonsil Clamp | Aesculap | BH957R | Used for coronary artery dissection |
| Zip ties (6 inch) | Advanced Cable Ties, Inc. | AL-06-18-9-C | Used for securing sample to fixtures, 157.14 mm long (6 inches), 2.5 mm wide |
| Zip ties (8 inch) | GTSE | GTSE-20025B.1000 | Used for securing sample to fixtures, 203 mm long (8 inches), 2.5 mm wide |
Referenzen
- Aluru, J. S., Barsouk, A., Saginala, K., Rawla, P., Barsouk, A. Valvular heart disease epidemiology. Medical Science. 10 (2), 32 (2022).
- Herrmann, J. L., Brown, J. W. Seven decades of valved right ventricular outflow tract reconstruction: The most common heart procedure in children. The Journal of Thoracic and Cardiovascular Surgery. 160 (5), 1284-1288 (2020).
- Rotman, O. M., Bianchi, M., Ghosh, R. P., Kovarovic, B., Bluestein, D. Principles of TAVR valve design, modelling, and testing. Expert Review of Medical Devices. 15 (11), 771-791 (2018).
- Pibarot, P., et al. Imaging for predicting and assessing prosthesis-patient mismatch after aortic valve replacement. JACC Cardiovascular Imaging. 12 (1), 149-162 (2019).
- Ozaki, S., et al. Aortic valve reconstruction using self-developed aortic valve plasty system in aortic valve disease. Interactive Cardiovascular and Thoracic Surgery. 12 (4), 550-553 (2011).
- Krane, M., Amabile, A., Ziegelmüller, J. A., Geirsson, A., Lange, R. Aortic valve neocuspidization (the Ozaki procedure). Multimedia Manual of Cardiothoracic Surgery. , (2021).
- Ozaki, S., et al. A total of 404 cases of aortic valve reconstruction with glutaraldehyde-treated autologous pericardium. The Journal of Thoracic and Cardiovascular Surgery. 147 (1), 301-306 (2014).
- Vandecasteele, T., et al. The pulmonary veins of the pig as an anatomical model for the development of a new treatment for atrial fibrillation. Anatomia Histollogia Embryologia. 44 (1), 1-12 (2015).
- Góes, A. M. O., et al. Comparative angiotomographic study of swine vascular anatomy: contributions to research and training models in vascular and endovascular surgery. Journal Vascular Brasilerio. 20, 20200086 (2021).
- Hołda, M. K., Klimek-Piotrowska, W., Koziej, M., Piątek, K., Hołda, J. Influence of different fixation protocols on the preservation and dimensions of cardiac tissue. Journal of Anatomy. 229 (2), 334-340 (2016).
- Hołda, M. K., Klimek-Piotrowska, W., Koziej, M., Tyrak, K., Hołda, J. Penetration of formaldehyde based fixatives into heart. Folia Medica Cracoviensia. 57 (4), 63-70 (2017).
- Spampinato, R. A., et al. Grading of aortic regurgitation by cardiovascular magnetic resonance and pulsed Doppler of the left subclavian artery: harmonizing grading scales between imaging modalities. International Journal of Cardiovascular Imaging. 36 (8), 1517-1526 (2020).
- Capps, S. B., Elkins, R. C., Fronk, D. M. Body surface area as a predictor of aortic and pulmonary valve diameter. The Journal of Thoracic and Cardiovascular Surgery. 119 (5), 975-982 (2000).
- Baumgartner, H., et al. Recommendations on the echocardiographic assessment of aortic valve stenosis: a focused update from the European Association of Cardiovascular Imaging and the American Society of Echocardiography. European Heart Journal - Cardiovascular Imaging. 18 (3), 254-275 (2017).
- Saisho, H., et al. An ex vivo evaluation of two different suture techniques for the Ozaki aortic neocuspidization procedure. Interactive Cardiovascular and Thoracic Surgery. 33 (4), 518-524 (2021).
- Saisho, H., et al. Ex vivo evaluation of the Ozaki procedure in comparison with the native aortic valve and prosthetic valves. Interactive Cardiovascular and Thoracic Surgery. 35 (3), (2022).
- Paulsen, M. J., et al. Comprehensive ex vivo comparison of 5 clinically used conduit configurations for valve-sparing aortic root replacement using a 3-dimensional-printed heart simulator. Circulation. 142 (14), 1361-1373 (2020).
- Al-Atassi, T., et al. Impact of aortic annular geometry on aortic valve insufficiency: Insights from a preclinical, ex vivo, porcine model. The Journal of Thoracic and Cardiovascular Surgery. 150 (3), 656-664 (2015).
- Sun, M., et al. A biomimetic multilayered polymeric material designed for heart valve repair and replacement. Biomaterials. 288, 121756 (2022).
- Waller, B. F., McKay, C., Van Tassel, J., Allen, M. Catheter balloon valvuloplasty of stenotic porcine bioprosthetic valves: Part I: Anatomic considerations. Clinical Cardiology. 14 (8), 686-691 (1991).
- Crick, S. J., Sheppard, M. N., Ho, S. Y., Gebstein, L., Anderson, R. H. Anatomy of the pig heart: comparisons with normal human cardiac structure. Journal of Anatomy. 193, 105-119 (1998).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten