A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מודל חזירי Ex Vivo לבדיקות הידרודינמיות של פרוצדורות ניסיוניות של מסתם אבי העורקים ומכשירים רפואיים חדשניים
In This Article
Summary
אנו מציגים שיטה להרכבת שסתום אבי העורקים החזירי על משכפל פולסים כדי לבדוק את תכונותיו ההידרודינמיות. שיטה זו יכולה לשמש כדי לקבוע את השינוי בהידרודינמיקה לאחר יישום של הליך ניסיוני או מכשיר רפואי חדשני לפני השימוש במודל של בעלי חיים גדולים.
Abstract
האפשרויות לבדיקת פרוצדורות לב חדשות ומכשירים רפואיים חקירתיים לפני השימוש במודל של בעלי חיים מוגבלות. במחקר זה אנו מציגים שיטה להרכבת שסתום אבי העורקים החזירי במשכפל פולסים כדי להעריך את תכונותיו ההידרודינמיות. לאחר מכן ניתן להעריך מאפיינים אלה לפני ואחרי ביצוע ההליך הנחקר ו / או הפעלת המכשיר הרפואי החקירתי. אבטחת מקטע הזרימה מציגה קושי מסוים בשל היעדר שריר הלב ההיקפי במערכת זרימת החדר השמאלי. שיטה זו מטפלת בבעיה זו על ידי אבטחת מקטע הזרימה באמצעות העלון הקדמי של המסתם המיטרלי ולאחר מכן תפירת דופן החדר השמאלי החופשי סביב מתקן הזרימה. מקטע היציאה מאובטח פשוט על ידי הכנסת המקבע לחתך באספקט העליון של קשת אבי העורקים. מצאנו שלדגימות היו תכונות הידרודינמיות שונות באופן משמעותי לפני ואחרי קיבוע רקמות. ממצא זה גרם לנו להשתמש בדגימות טריות בבדיקות שלנו ויש לשקול זאת בעת השימוש בשיטה זו. בעבודתנו, השתמשנו בשיטה זו כדי לבדוק חומרי תיקון תוך לבביים חדשניים לשימוש במצב המסתם על ידי ביצוע הליך neocuspidization מסתם אבי העורקים (הליך אוזאקי) על מסתמי אבי העורקים החזיריים הרכובים. שסתומים אלה נבדקו לפני ואחרי ההליך כדי להעריך את השינוי בתכונות הידרודינמיות בהשוואה לשסתום הטבעי. כאן אנו מדווחים על פלטפורמה לבדיקה הידרודינמית של פרוצדורות ניסיוניות של מסתם אבי העורקים המאפשרת השוואה עם המסתם המקורי ובין מכשירים וטכניקות שונות המשמשים להליך הנחקר.
Introduction
מחלת מסתם אבי העורקים מהווה נטל משמעותי על בריאות הציבור, במיוחד היצרות אבי העורקים, המשפיעה על 9 מיליון אנשים ברחבי העולם1. אסטרטגיות לטיפול במחלה זו מתפתחות כיום וכוללות תיקון מסתם אבי העורקים והחלפת מסתם אבי העורקים. באוכלוסיית הילדים במיוחד, קיים תמריץ משמעותי לתקן ולא להחליף את המסתם מכיוון שהתותבות הקיימות כיום מועדות לניוון מסתם מבני (SVD) ואינן סובלניות לצמיחה, מה שמצריך ניתוח חוזר להחלפה חוזרת ככל שהמטופל גדל. אפילו הליך רוס, המחליף את המסתם האאורטלי החולה (AV) במסתם הריאתי המקורי (PV), דורש תותבת או שתל במצב הריאתי שגם הוא כפוף ל- SVD ולעתים קרובות סובלנות גדילה מוגבלת2. גישות חדשות למחלת מסתם אבי העורקים מפותחות, ויש צורך בבדיקה בהקשר רלוונטי ביולוגית לפני יישום במודל של בעלי חיים גדולים.
פיתחנו שיטה לבדיקת AV חזירי שיכולה לספק תובנות לגבי תפקוד המסתם לפני ואחרי הליך ניסיוני או יישום של מכשיר רפואי חדשני. על ידי הרכבת AV חזירי על מכונת משכפל פולסים זמינה מסחרית, אנו יכולים להשוות את המאפיינים ההידרודינמיים המשמשים בדרך כלל בחקירה ובסופו של דבר אישור של תותבות שסתום, כולל מקטע regurgitation (RF), שטח פתח יעיל (EOA), והפרש לחץ חיובי ממוצע (PPD)3,4. לאחר מכן ניתן לכוונן את ההתערבות בהקשר רלוונטי ביולוגית לפני השימוש במודל של בעלי חיים גדולים, ובכך להגביל את מספר בעלי החיים הדרושים לייצור הליך או תותבת שניתן להשתמש בהם בבני אדם. את הלבבות המשמשים לניסוי זה ניתן להשיג מבית המטבחיים המקומי או רקמת פסולת מניסויים אחרים, ולכן אין צורך להקריב בעל חיים אך ורק למטרות ניסוי זה.
בעבודתנו השתמשנו בשיטה זו כדי לפתח חומר טלאי חדשני לתיקון והחלפת שסתומים. בדקנו את התפקוד ההידרודינמי של מגוון חומרי טלאי על ידי ביצוע הליך neocuspidization מסתם אבי העורקים (הליך Ozaki 5,6,7) על AVs חזיריים ובדיקתם במשכפל הדופק לפני ואחרי ההליך. זה איפשר לנו לכוונן את החומר בהתבסס על הביצועים ההידרודינמיים שלו. לפיכך, שיטה זו מספקת פלטפורמה לבדיקות הידרודינמיות של פרוצדורות ניסיוניות ומכשירים רפואיים חדשניים לשימוש על AV לפני היישום במודל בעלי חיים גדולים.
Protocol
כל המחקר בוצע בהתאם להנחיות המוסדיות לטיפול בבעלי חיים.
1. שיקולים והכנות לניסוי
- השתמש במשכפל דופק מתאים (PD) לסימולציה של תפוקת הלב באמצעות AV. מחלת הפרקינסון תצטרך להיות מסוגלת להכיל חומרים ביולוגיים ולהיות מסוגלת לניקוי.
- השתמש בהגדרות PD המתאימות לבדיקת AV: נפח תזוזה של 70 מ"ל ו- 70 פעימות לדקה (פלט לב של 5 ליטר לדקה), 35% ממחזור הלב בסיסטולה, שיפוע לחץ טרנסוולרי ממוצע של 100 מ"מ כספית, שיפוע לחץ מרבי של 120 ושיפוע לחץ מינימלי של 80.
- יש להשתמש במי מלח רגילים בטמפרטורת החדר (0.9% NaCl) כמדיום נוזלי.
- אתר או צור (באמצעות הדפסה תלת מימדית או שיטה דומה) גופי תאורה מתאימים להרכבת AV חזירי לבדיקה על PD.
- השתמש בגופי תאורה המעוצבים על גופי התאורה שסופקו עם משכפל הפולסים עם המפרטים הבאים: ודא שהקוטר הפנימי של גוף התאורה דומה לקוטר ה- AV הנחקר, אורך החיבור הוא לפחות 2 ס"מ ורוחב החיבור השמיש הוא לפחות 4 ס"מ (איור 1).
- השתמשו באורינגים מגומי כאטמים בקצות גופי התאורה.
- השיגו דגימת לב לאחר כריתת לב (איור 2A).
- השתמש בדגימות לב חזיריות מבית המטבחיים או פסולת רקמות מבעלי חיים בריאים אחרת שלא היו חלק מפרוטוקולים ניסיוניים כלשהם שישפיעו על ליבם.
- יש לקבל דגימה לאחר כריתת הלב או לבצע כריתת לב לאחר המוות, כולל טרנסקציה של הווריד הנבוב העליון, הווריד הנבוב הנחות, עורק הריאה הראשי (PA), כל ורידים ריאתיים, ואבי העורקים באספקט הדיסטלי של קשת אבי העורקים.
הערה: יש להשתמש בדגימות טריות, פחות מ-6 שעות לאחר המוות או מאוחסנות במי מלח סטריליים עם תמיסה אנטיביוטית 1% (פניצילין וסטרפטומיצין) במקרר 4 oC למשך עד 7 ימים. רקמות המקובעות בפורמלין או גלוטראלדהיד יפיקו תוצאות הידרודינמיות משתנות עקב קשיחות מוגברת.

איור 1: גופי תאורה מודפסים בתלת-ממד מותאמים אישית להרכבת שסתומי אבי העורקים החזירי על משכפל הדופק. כפי שצוין בפרוטוקול, אורך הקובץ המצורף צריך להיות לפחות 2 ס"מ, ורוחב הקובץ המצורף הניתן לשימוש צריך להיות לפחות 4 ס"מ. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
2. כריתת מבנים ימניים
- נתחו את אבי העורקים בעזרת מספריים של מצנבאום עד להופעת רקמת החדר (איור 2B).
- מנתחים ומקשרים עם קשרי משי את שני העורקים הכליליים במקורם מהסינוסים של אבי העורקים, תוך הקפדה שלא להצר את הסינוסים.
- חצו את העורקים הכליליים דיסטליים לקשרי המשי.
- חותכים את החדר הימני (RV) בין אבי העורקים לרשות הפלסטינית בבסיס המסתם הריאתי באמצעות מספריים של מצנבאום (איור 2C).
- מתחילים קדמית, ממשיכים את החתך באופן היקפי לאורך המחיצה הבין-חדרית כדי להסיר את הדופן החופשית של הקרוואן (איור 2D, E).
- המשיכו את החתך אחורית דרך טבעת המסתם הטריקוספיד לאורך המחיצה הבין-פרוזדורית כדי להסיר את כל הרקמה הפרוזדורית הימנית (איור 2F).
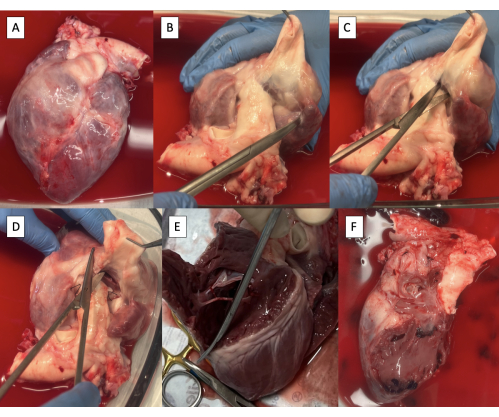
איור 2: דגימת לב-לב-כריתה וכריתה של מבנים ימניים. (A) דגימת לב. (B) עורק ריאתי ראשי מנותח מאבי העורקים עד לנראות רקמת החדר. (C) חיתוך החדר הימני (RV) בבסיס המסתם הריאתי. (D) המשך החתך לאורך המחיצה הבין-חדרית קדמית. (E) הסרת הדופן נטולת ה-RV על ידי המשך החתך לאורך המחיצה הבין-חדרית. (F) דגימות עם מבנים בצד ימין הוסרו. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
3. הכנת מערכת יציאת החדר השמאלי (LVOT) לקנולציה עם מתקן PD
- חותכים את האטריום השמאלי (LA) דרך האוסטיום של וריד הריאה הימני במקביל לאבי העורקים באמצעות מספריים של מצנבאום (איור 3A).
הערה: למרות שקיימת שונות מוגבלת, אנטומיה של ורידים ריאתיים חזיריים מסתיימת בדרך כלל בשני ורידים ריאתיים אוסטיה הנכנסים ללוס אנג'לס8. - המשך את החתך לכיוון המסתם האנטרולטרלי של המסתם המיטרלי (MV), תוך השארת שרוול 3 מ"מ לפחות של רקמת פרוזדורים בצד אבי העורקים.
- חותכים רקמת LA עודפת, תוך שמירה על שרוול 3 מ"מ של רקמת פרוזדורים על אבי העורקים ועל טבעת MV באופן היקפי (איור 3B).
- הרחיבו את החתך לחדר השמאלי (LV) דרך השריר האנטרולטרלי של ה-MV, תוך הקפדה על שימור השריר הפפילרי האנטרולטרלי (איור 3C).
- מחלקים את גידי האקורדים מהשריר הפפילרי האנטרולטרלי לעלון ה-MV האחורי, תוך שימור החיבורים לעלון ה-MV הקדמי.
- ממשיכים את החתך עד לקודקוד הלב.
- חתוך רקמת LV עודפת מתחת לשרירים הפפילריים, תוך שמירה על שני השרירים הפפילריים (איור 3D).
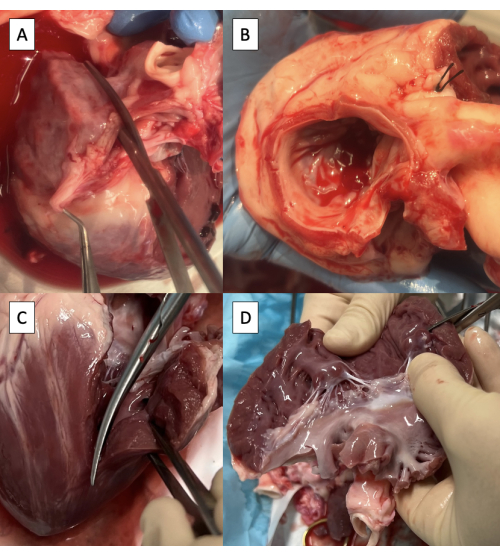
איור 3: הכנת מערכת זרימת החדר השמאלי לקנולציה עם מתקן משכפל הדופק. (A) חיתוך האטריום השמאלי (LA) דרך האוסטיום של וריד הריאה הימני. (B) עודף רקמת LA גזוז, שמירה על שרוול 3 מ"מ לפחות של רקמת פרוזדורים על אבי העורקים ושמירה על טבעת המסתם המיטרלי באופן היקפי. (C) הרחבת החתך לחדר שמאל (LV) דרך הקומיסורה האנטרולטרלית של המסתם המיטרלי. (D) הסרת רקמת LV עודפת מתחת לשרירים הפפילריים. מספריים גלויים בפינה הימנית העליונה של התמונה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
4. הכנת אבי העורקים לקנולציה עם מתקן PD
- חתכו עודפי רקמת לימפה, חיבור או עורק ריאתי מאבי העורקים (איור 4A).
- חותכים את האספקט העליון של קשת אבי העורקים מאבי העורקים היורד לעורק התת-קלאבי השמאלי באמצעות מספריים של מצנבאום (איור 4B).
- המשיכו את החתך באספקט העליון של קשת אבי העורקים מהעורק התת-קלאבי השמאלי אל הגו הברכיוצפלי (איור 4C, D).
הערה: ענפים של קשת אבי העורקים החזירי מדיסטלית לפרוקסימלית כוללים את העורק הסובקלבי השמאלי ואת הגזע הברכיוצפאלי, המוליד את העורק הסובקלבי הימני, עורק התרדמה הימני ועורק התרדמה השמאלי9.
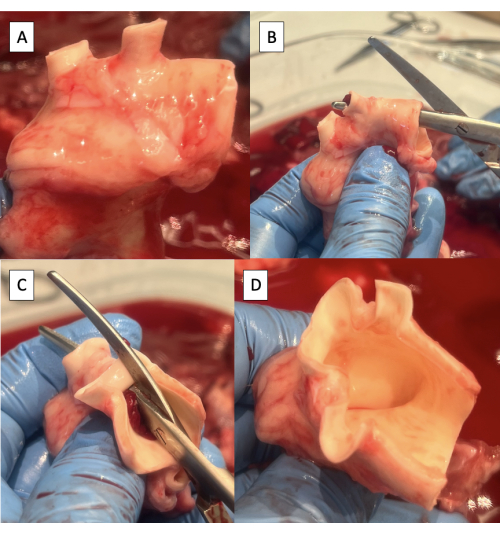
איור 4: הכנת אבי העורקים לקנולציה עם מתקן משכפל הדופק. (A) קשת אבי העורקים עם רקמה עודפת שהוסרה. שימו לב לשני כלי הקשת בקשת אבי העורקים החזירי, הגזע הברכיוצפלי והעורק התת-קלאבי השמאלי. (B) התחלת החתך לאורך האספקט העליון של קשת אבי העורקים מאבי העורקים היורד לעורק התת-קלאבי השמאלי. (C) המשך החתך לאורך האספקט העליון של קשת אבי העורקים מהעורק התת-קלאבי השמאלי ועד לגזע הברכיוצפלי. (D) חתך בקשת אבי העורקים הושלם. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
5. קנולציה של LVOT עם מתקן PD
- בדוק את מיקום המתקן ב- LVOT וחתוך רקמת LV עודפת.
- הכנס את המתקן לתוך LVOT מתחת לעלון הקדמי של MV.
- עטפו את הקיר ללא LV סביב גוף התאורה.
- חתוך רקמת LV עודפת כדי לשמור על עטיפה הדוקה סביב גוף התאורה.
- הסר מחצית מעובי הדופן החופשית של LV החל מהמחיצה הבין-חדרית, תוך שמירה על לפחות 1 ס"מ של אפיקרדיום בקצה החופשי כדי לשמור על שלמות קו התפר (איור 5A).
- חתכו 1 ס"מ של רקמה מהפינה העליונה של עטיפת הקיר ללא LV (איור 5A).
- מקמו את גוף התאורה ב-LVOT עם חור חיבור המוט התומך 1 ס"מ מאחורי חתך ה-LV (איור 5B).
- יש להקפיד לא להכניס את גוף התאורה רחוק מדי לתוך ה-LVOT כך שירחיב את ביטול ה-AV.
- הדקו את העלון הקדמי של ה-MV למתקן באמצעות אזיקון אחד או שניים בקוטר 6 אינץ' הממוקמים בין גידי האקורדים של העלון (איור 5C).
- תפרו את הקיר החופשי LV סביב גוף התאורה (איור 5D).
- התחל על ידי תפירת השרוול של רקמת LA על אבי העורקים לביטול MV באמצעות תפר ריצה פשוט עם מחט נקודה מחודדת.
- המשך את תפר הריצה על LV, לא לקרוע את רקמת LV.
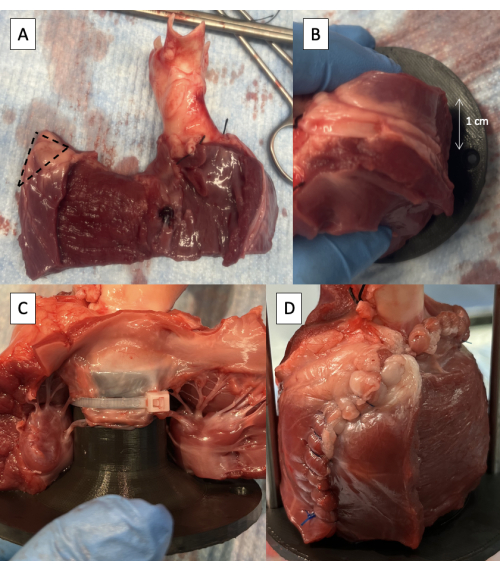
איור 5: קנולציה של מערכת זרימת החדר השמאלי עם מתקן משכפל הדופק. (A) חצי עובי של דופן חופשית LV הוסר עם 1 ס"מ של אפיקרדיום נשמר בקצה החופשי. הקו המקווקו מציין את השטח של 1 ס"מ שיש להסיר מהפינה העליונה של מעטפת הקיר נטולת LV. (B) חור חיבור מוט תומך הממוקם 1 ס"מ מאחורי חתך הקיר החופשי LV. (C) אזיקון רוכסן המחבר את העלון הקדמי של ה-MV למתקן הפרוקסימלי. (D) קיר ללא LV שנתפר סביב גוף התאורה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
6. קנולציה של אבי העורקים עם מתקן PD והכנה סופית לבדיקת PD
- מדוד את קוטר ה- AV באמצעות מרחיבי הגר כדי לסייע בפענוח תוצאות בדיקת פרקינסון.
- זהו את המיקום הניטרלי של אבי העורקים על-ידי הרמת הדגימה מהשולחן על-ידי אחיזת אבי העורקים (איור 6A).
- הכנס את מתקן PD לתוך אבי העורקים, תוך הקפדה על יישור חורי חיבור המוט במצב ניטרלי של אבי העורקים.
- בדוק את אורך הדגימה על ידי הכנסת מוטות התמיכה.
- הדקו את מתקן PD לאבי העורקים באמצעות אזיקון אחד או שניים בקוטר 6 אינץ' (איור 6B).
- אבטחו את ה-LVOT סביב מתקן ה-PD באמצעות אזיקון אחד או שניים בקוטר 8 אינץ'.
- אבטח את מוטות התמיכה במקומם באמצעות ברגים שסופקו עם ערכת PD.
- הניחו את הדגימה במחלת פרקינסון והתחילו את הבדיקה (איור 6C, וידאו 1 ווידאו 2).
- תפרו דליפות לפי הצורך.
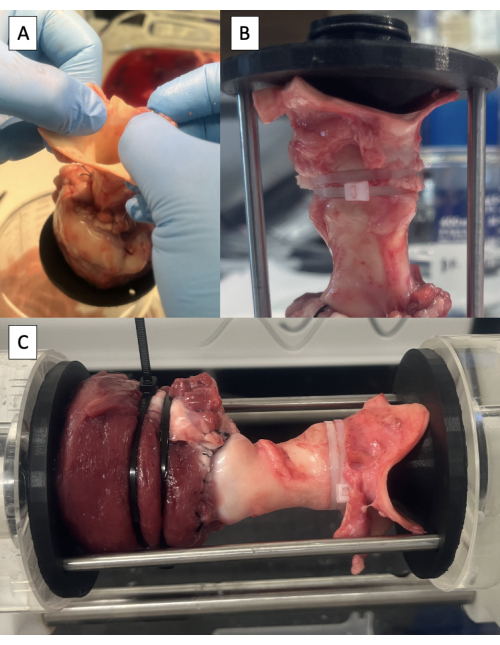
איור 6: קנולציה של אבי העורקים ובדיקה במשכפל הדופק. (A) הרמת הדגימה מהשולחן על ידי אבי העורקים כדי לזהות את המיקום הניטרלי של אבי העורקים. (B) מתקן דיסטלי מאובטח באבי העורקים עם אזיקונים. (C) דגימה המותקנת במשכפל הדופק לצורך בדיקה הידרודינמית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
7. בצע הליך ניסיוני
הערה: בצע פרוצדורות ניסיוניות כמו, הליך אוזאקי כפי שתואר קודם לכן 5,6,7, ובדיקות PD חוזרות.
- אם הרקמה התייבשה במהלך ההליך, הדקו את האזיקונים וחזקו את קו התפרים לפי הצורך.
8. אחסון לטווח ארוך של דגימה (אם תרצה)
- יש להניח את הדגימה בפורמלין 10% למשך 168 שעות (שבוע אחד)10,11.
- לאחר קיבוע רקמות, לשטוף את הדגימה עם מים deionized ומניחים אותו אתנול 70% לאחסון לטווח ארוך.
תוצאות
הנתונים המייצגים שנאספו משכפל הדופק כוללים מקטע רגורגיטציה (RF), אזור פתח יעיל (EOA) והפרש לחץ חיובי ממוצע (PPD). ה- RF וה- EOA, בפרט, משמשים בתקני ISO עבור שסתומים תותבים (ISO 5840) ויהיה חשוב לאסוף אם מוצרי שסתומים תותבים נמצאים תחת חקירה. PPD מציע מידע לגבי כמה לחץ נדרש כדי לפתוח את השסתום והוא מוזכר בדרך כ...
Discussion
השיטה המוצגת כאן מספקת פלטפורמה לבדיקה הידרודינמית של ה-AV לצורך בחינת ההשפעה של הליך ניסיוני או מכשיר רפואי חדשני. על ידי הרכבת שסתום אבי העורקים המקורי על מכונת משכפל דופק, אנו מסוגלים לקבוע את השפעת ההליך הניסיוני על כל הפרמטרים ההידרודינמיים המשמשים לחקירה ואישור של תותבות שסתום חדשות...
Disclosures
למחברים אין ניגודי עניינים כספיים רלוונטיים לחשוף.
Acknowledgements
ברצוננו להודות למעבדה של ד"ר גורדנה וונג'אק-נובקוביץ', כולל ג'ולי ואן האסל, מוחמד דיאן ופנפן צ'ן, שאפשרה לנו להשתמש ברקמת פסולת לב מהניסויים שלהם. עבודה זו נתמכה על ידי הקואליציה למומי לב מולדים בבאטלר, ניו ג'רזי, והמכונים הלאומיים לבריאות בבת'סדה, מרילנד (5T32HL007854-27).
Materials
| Name | Company | Catalog Number | Comments |
| 3D Printer | Ultimaker | Ultimaker S5 | Used for printing custom fixtures for hydrodynamic testing |
| Crile-Wood Needle Driver | Emerald Instruments | 2.0638.15 | Used for suturing ventricle |
| Debakey Forceps | Jarit | 320-110 | Used for dissection and sample preparation (can use multiple if working with an assistant) |
| Ethanol 200 proof | Decon Labs Inc. | DSP-MD.43 | Used for fixed tissue storage |
| Formalin 10% | Epredia | 5701 | Used for tissue fixation |
| Gerald Forceps | Jarit | 285-126 | Used for dissection and sample preparation |
| Glass jars | QAPPDA | B07QCP54Z3 | Used for tissue storage |
| Glutaraldehyde 25% | Electron Microscopy Sciences | 16400 | Used for tissue fixation |
| HEPES 1 M buffer solution | Fisher | BP299-100 | Used to make glutaraldehyde 0.6% |
| Mayo Scissors | Jarit | 099-200 | Used for cutting suture |
| Metzenbaum Scissors | Jarit | 099-262 | Used for dissection and sample preparation |
| O-ring | Sterling Seal & Supply Inc. | AS568-117 | Used as a gasket on the end of the 3D printed fixtures |
| Polylactic acid resin | Ultimaker | 1609 | Used for 3D printing fixtures |
| Polyproplene suture | Covidien | VP-762-X | Used for suturing ventricle, tapered needle |
| Pulse Duplicator | BDC Laboratories | HDTi-6000 | Used for hydrodynamic testing |
| Silk ties | Covidien | S-193 | Used for ligating coronary arteries |
| Tonsil Clamp | Aesculap | BH957R | Used for coronary artery dissection |
| Zip ties (6 inch) | Advanced Cable Ties, Inc. | AL-06-18-9-C | Used for securing sample to fixtures, 157.14 mm long (6 inches), 2.5 mm wide |
| Zip ties (8 inch) | GTSE | GTSE-20025B.1000 | Used for securing sample to fixtures, 203 mm long (8 inches), 2.5 mm wide |
References
- Aluru, J. S., Barsouk, A., Saginala, K., Rawla, P., Barsouk, A. Valvular heart disease epidemiology. Medical Science. 10 (2), 32 (2022).
- Herrmann, J. L., Brown, J. W. Seven decades of valved right ventricular outflow tract reconstruction: The most common heart procedure in children. The Journal of Thoracic and Cardiovascular Surgery. 160 (5), 1284-1288 (2020).
- Rotman, O. M., Bianchi, M., Ghosh, R. P., Kovarovic, B., Bluestein, D. Principles of TAVR valve design, modelling, and testing. Expert Review of Medical Devices. 15 (11), 771-791 (2018).
- Pibarot, P., et al. Imaging for predicting and assessing prosthesis-patient mismatch after aortic valve replacement. JACC Cardiovascular Imaging. 12 (1), 149-162 (2019).
- Ozaki, S., et al. Aortic valve reconstruction using self-developed aortic valve plasty system in aortic valve disease. Interactive Cardiovascular and Thoracic Surgery. 12 (4), 550-553 (2011).
- Krane, M., Amabile, A., Ziegelmüller, J. A., Geirsson, A., Lange, R. Aortic valve neocuspidization (the Ozaki procedure). Multimedia Manual of Cardiothoracic Surgery. , (2021).
- Ozaki, S., et al. A total of 404 cases of aortic valve reconstruction with glutaraldehyde-treated autologous pericardium. The Journal of Thoracic and Cardiovascular Surgery. 147 (1), 301-306 (2014).
- Vandecasteele, T., et al. The pulmonary veins of the pig as an anatomical model for the development of a new treatment for atrial fibrillation. Anatomia Histollogia Embryologia. 44 (1), 1-12 (2015).
- Góes, A. M. O., et al. Comparative angiotomographic study of swine vascular anatomy: contributions to research and training models in vascular and endovascular surgery. Journal Vascular Brasilerio. 20, 20200086 (2021).
- Hołda, M. K., Klimek-Piotrowska, W., Koziej, M., Piątek, K., Hołda, J. Influence of different fixation protocols on the preservation and dimensions of cardiac tissue. Journal of Anatomy. 229 (2), 334-340 (2016).
- Hołda, M. K., Klimek-Piotrowska, W., Koziej, M., Tyrak, K., Hołda, J. Penetration of formaldehyde based fixatives into heart. Folia Medica Cracoviensia. 57 (4), 63-70 (2017).
- Spampinato, R. A., et al. Grading of aortic regurgitation by cardiovascular magnetic resonance and pulsed Doppler of the left subclavian artery: harmonizing grading scales between imaging modalities. International Journal of Cardiovascular Imaging. 36 (8), 1517-1526 (2020).
- Capps, S. B., Elkins, R. C., Fronk, D. M. Body surface area as a predictor of aortic and pulmonary valve diameter. The Journal of Thoracic and Cardiovascular Surgery. 119 (5), 975-982 (2000).
- Baumgartner, H., et al. Recommendations on the echocardiographic assessment of aortic valve stenosis: a focused update from the European Association of Cardiovascular Imaging and the American Society of Echocardiography. European Heart Journal - Cardiovascular Imaging. 18 (3), 254-275 (2017).
- Saisho, H., et al. An ex vivo evaluation of two different suture techniques for the Ozaki aortic neocuspidization procedure. Interactive Cardiovascular and Thoracic Surgery. 33 (4), 518-524 (2021).
- Saisho, H., et al. Ex vivo evaluation of the Ozaki procedure in comparison with the native aortic valve and prosthetic valves. Interactive Cardiovascular and Thoracic Surgery. 35 (3), (2022).
- Paulsen, M. J., et al. Comprehensive ex vivo comparison of 5 clinically used conduit configurations for valve-sparing aortic root replacement using a 3-dimensional-printed heart simulator. Circulation. 142 (14), 1361-1373 (2020).
- Al-Atassi, T., et al. Impact of aortic annular geometry on aortic valve insufficiency: Insights from a preclinical, ex vivo, porcine model. The Journal of Thoracic and Cardiovascular Surgery. 150 (3), 656-664 (2015).
- Sun, M., et al. A biomimetic multilayered polymeric material designed for heart valve repair and replacement. Biomaterials. 288, 121756 (2022).
- Waller, B. F., McKay, C., Van Tassel, J., Allen, M. Catheter balloon valvuloplasty of stenotic porcine bioprosthetic valves: Part I: Anatomic considerations. Clinical Cardiology. 14 (8), 686-691 (1991).
- Crick, S. J., Sheppard, M. N., Ho, S. Y., Gebstein, L., Anderson, R. H. Anatomy of the pig heart: comparisons with normal human cardiac structure. Journal of Anatomy. 193, 105-119 (1998).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved