需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
用于实验性主动脉瓣手术和新型医疗设备流体动力学测试的 离体 猪模型
摘要
我们提出了一种将猪主动脉瓣安装在脉冲复制器上以测试其流体动力学特性的方法。该方法可用于确定在大型动物模型中使用实验程序或新型医疗设备之前应用实验程序或新型医疗设备后流体动力学的变化。
摘要
在动物模型中使用之前测试新的心脏程序和研究性医疗设备的选择是有限的。在这项研究中,我们提出了一种在脉冲复制器中安装猪主动脉瓣以评估其流体动力学特性的方法。然后,可以在执行所调查的程序和/或应用调查医疗设备之前和之后评估这些特性。由于左心室流出道中缺乏环形心肌,因此固定流入段存在一些困难。这种方法通过使用二尖瓣的前叶固定流入段,然后在流入固定装置周围缝合左心室游离壁来解决这个问题。只需将夹具插入主动脉弓上侧的切口即可固定流出段。我们发现,标本在组织固定前后具有显着不同的流体动力学特性。这一发现促使我们在测试中使用新鲜标本,在使用这种方法时应予以考虑。在我们的工作中,我们使用这种方法通过在安装的猪主动脉瓣上执行主动脉瓣新尖瓣手术(尾崎手术)来测试用于瓣膜位置的新型心内贴片材料。这些阀门在手术前后进行了测试,以评估与天然阀门相比流体动力学特性的变化。在此,我们报告了一个用于实验性主动脉瓣手术的流体动力学测试平台,该平台可以与天然瓣膜以及用于所研究手术的不同设备和技术进行比较。
引言
主动脉瓣疾病是一个重大的公共卫生负担,尤其是主动脉瓣狭窄,影响着全世界900万人1。目前,解决这种疾病的策略正在不断发展,包括主动脉瓣修复和主动脉瓣置换术。特别是在儿科人群中,修复而不是更换瓣膜有很大的动机,因为目前可用的假体容易发生结构性瓣膜变性 (SVD) 并且不耐生长,需要随着患者的成长再次手术以重新更换。即使是用自体肺动脉瓣 (PV) 替换患病主动脉瓣 (AV) 的 Ross 手术,也需要在肺位置安装假体或移植物,该位置也受到 SVD 的影响,并且通常生长耐受性有限2。正在开发治疗主动脉瓣疾病的新方法,在应用于大型动物模型之前,需要在生物学相关背景下进行测试。
我们开发了一种用于测试猪 AV 的方法,该方法可以深入了解新型医疗设备的研究程序或应用之前和之后的瓣膜功能。通过将猪 AV 安装在市售的脉冲复制机上,我们能够比较用于研究并最终批准瓣膜假体的流体动力学特性,包括反流分数 (RF)、有效孔口面积 (EOA) 和平均正压差 (PPD)3,4.然后,在大型动物模型中使用之前,可以在生物学相关的背景下对干预进行微调,从而限制了生产可用于人类的程序或假体所需的动物数量。用于该实验的心脏可以从当地的屠宰场获得,也可以从其他实验中获得废物组织,因此没有必要仅仅为了这个实验的目的而牺牲动物。
在我们的工作中,我们使用这种方法开发了一种用于瓣膜修复和更换的新型贴片材料。我们通过对猪 AV 进行主动脉瓣新尖瓣手术(尾崎手术5、6、7)并在手术前后在脉冲复制器中对其进行测试,测试了各种贴片材料的流体动力学功能。这使我们能够根据材料的流体动力学性能对材料进行微调。因此,该方法为在大型动物模型中应用之前在AV上使用的实验程序和新型医疗设备的流体动力学测试提供了一个平台。
研究方案
所有研究均按照动物护理的机构指南进行。
一、实验的注意事项和准备工作
- 使用合适的脉冲复制器 (PD) 通过 AV 模拟心输出量。PD需要能够容纳生物材料并能够进行清洁。
- 利用适合测试 AV 的 PD 设置:70 mL 位移容积和 70 次/分钟心跳(5 L/min 心输出量)、收缩期心动周期的 35%、100 mmHg 平均经瓣压梯度、120 个最大压力梯度和 80 个最小压力梯度。
- 使用室温 (RT) 生理盐水 (0.9% NaCl) 作为流体介质。
- 找到或创建(使用 3D 打印或类似方法)合适的夹具,用于安装猪 AV 以在 PD 上进行测试。
- 使用以脉冲拷贝机随附的夹具为模型的夹具,并具有以下规格:确保夹具的内径与所研究的 AV 的直径相似,连接长度至少为 2 cm,可用连接宽度至少为 4 cm(图 1)。
- 使用橡胶 O 形圈作为夹具末端的垫圈。
- 心脏切除术后获取心脏标本(图2A)。
- 使用来自屠宰场的猪心脏标本或来自其他方面健康的动物的废物组织,并且没有参与任何会影响其心脏的实验方案。
- 在心脏切除术后获取标本或进行死后心脏切除术,包括上腔静脉、下腔静脉、主肺动脉 (PA)、所有肺静脉和主动脉弓远端主动脉的横断术。
注意:新鲜标本,死后不到6小时或储存在含有1%抗生素溶液(青霉素和链霉素)的无菌盐水中,在4 °C冰箱中最多7天,应用于该实验。固定在福尔马林或戊二醛中的组织由于刚度增加而产生改变的流体动力学结果。

图 1:用于将猪主动脉瓣安装在脉冲复制机上的定制 3D 打印夹具。 如协议中所述,附件长度应至少为 2 厘米,可用的附件宽度应至少为 4 厘米。 请 点击这里查看此图的较大版本.
2.右侧结构切除术
- 用 Metzenbaum 剪刀解剖主动脉外的 PA,直到可见心室组织(图 2B)。
- 从主动脉窦开始,用丝带解剖和结扎两条冠状动脉,注意不要让鼻窦变窄。
- 横断丝带远端的冠状动脉。
- 使用 Metzenbaum 剪刀在肺动脉瓣底部的主动脉和 PA 之间切开右心室 (RV)(图 2C)。
- 从前方开始,沿室间隔继续沿圆周切口以去除 RV 游离壁(图 2D、E)。
- 沿着房间隔继续通过三尖瓣环向后切口,以去除所有右心房组织(图2F)。
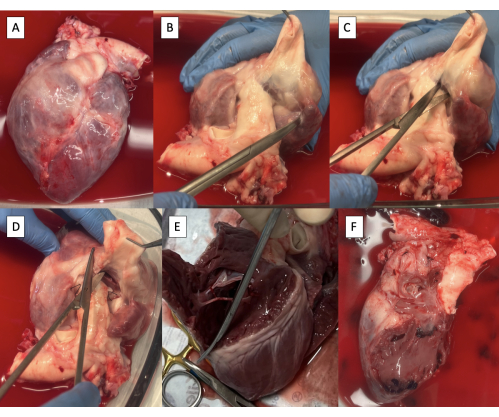
图 2:心脏切除术标本和右侧结构切除术。 (A) 心脏切除术标本。(B) 从主动脉解剖主动脉,直到心室组织可见。(C) 在肺动脉瓣底部切开右心室 (RV)。(D) 沿室间隔前方继续切口。(E) 通过沿室间隔沿圆周方向继续切口来移除无 RV 壁。(F) 去除右侧结构的试样。 请点击这里查看此图的较大版本.
3. 准备左心室流出道 (LVOT) 以使用 PD 夹具进行插管
- 使用Metzenbaum剪刀通过平行于主动脉的右肺静脉口切开左心房(LA)(图3A)。
注意:尽管存在有限的变异性,但猪肺静脉解剖结构通常终止于进入 LA8 的两条肺静脉口。 - 继续切开二尖瓣 (MV) 的前外侧连合,在主动脉侧留下至少 3 毫米的心房组织袖带。
- 修剪多余的LA组织,将心房组织的3毫米袖带保持在主动脉和MV环上(图3B)。
- 通过MV的前外侧连合将切口延伸到左心室(LV),注意保留前外侧肌(图3C)。
- 将腱索从前外侧肌分割到MV后小叶,保留与前MV小叶的附着。
- 继续切口至心脏顶点。
- 修剪肌下方多余的左心室组织,保留两块肌(图3D)。
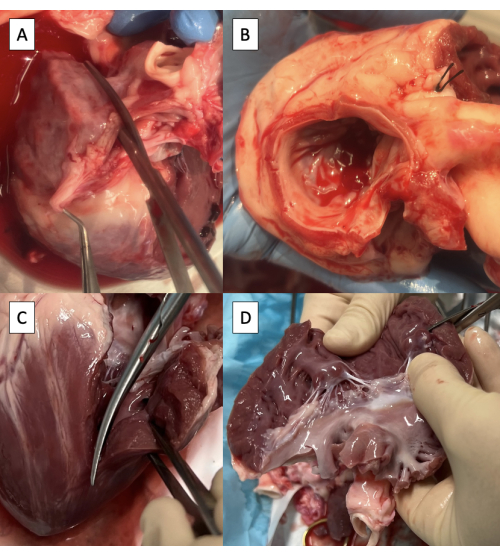
图 3:使用脉冲拷贝机夹具准备插管的左心室流出道。 (A) 通过右肺静脉的口切开左心房 (LA)。(B) 修剪多余的 LA 组织,在主动脉上保持至少 3 毫米的心房组织袖带,并沿圆周方向维持二尖瓣环。(C) 通过二尖瓣的前外侧连合将切口延伸到左心室 (LV)。(D) 去除肌下方多余的左心室组织。剪刀在图像的右上角可见。 请点击这里查看此图的较大版本.
4. 用 PD 夹具准备插管的主动脉
- 修剪主动脉上多余的淋巴、结缔或肺动脉组织(图4A)。
- 使用 Metzenbaum 剪刀将主动脉弓的上侧从降主动脉切开到左锁骨下动脉(图 4B)。
- 从左锁骨下动脉到头臂干的主动脉弓上侧继续切口(图4C,D)。
注:猪主动脉弓从远端到近端的分支包括左锁骨下动脉和头臂干,后者产生右锁骨下动脉、右颈动脉和左颈动脉9。
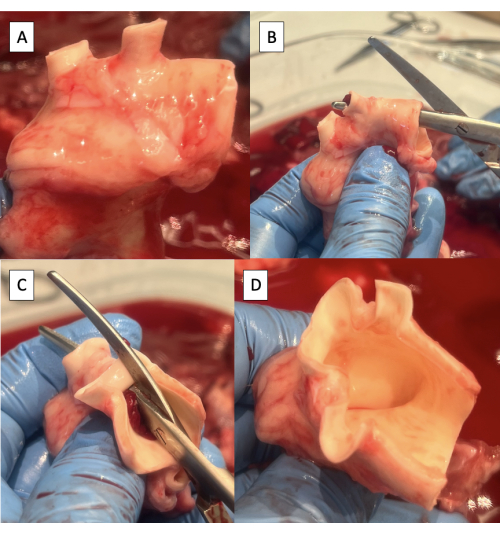
图 4:使用脉冲拷贝机夹具准备用于插管的主动脉。 (A) 去除多余组织的主动脉弓。注意猪主动脉弓、头臂干和左锁骨下动脉中的两条弓血管。(B) 从降主动脉到左锁骨下动脉沿主动脉弓上侧开始切口。(C) 从左锁骨下动脉沿主动脉弓上侧继续切口至头臂干。(D) 完成主动脉弓切口。 请点击这里查看此图的较大版本.
5. 用PD夹具对LVOT进行插管
- 测试夹具在 LVOT 中的位置并修剪多余的 LV 组织。
- 将夹具插入 MV 前叶下方的 LVOT。
- 将无 LV 的墙缠绕在灯具周围。
- 修剪多余的 LV 组织以保持紧紧包裹在夹具周围。
- 从室间隔开始去除左心室游离壁厚度的一半,在游离边缘保持至少 1 cm 的心外膜以保持缝合线的完整性(图 5A)。
- 从 LV 自由墙膜的上角修剪 1 厘米的组织(图 5A)。
- 将夹具放置在 LVOT 中,支撑杆连接孔位于 LV 切口后 1 cm 处(图 5B)。
- 注意不要将夹具插入 LVOT 太远,以免扩张房室环。
- 使用位于小叶脊索肌腱之间的一个或两个 6 英寸的扎带将 MV 的前小叶固定到固定装置上(图 5C)。
- 在夹具周围缝合 LV 自由壁(图 5D)。
- 首先使用带有锥尖针的简单缝合线将主动脉上的 LA 组织袖带缝合到 MV 环。
- 继续在左心室缝合,不要撕裂左心室组织。
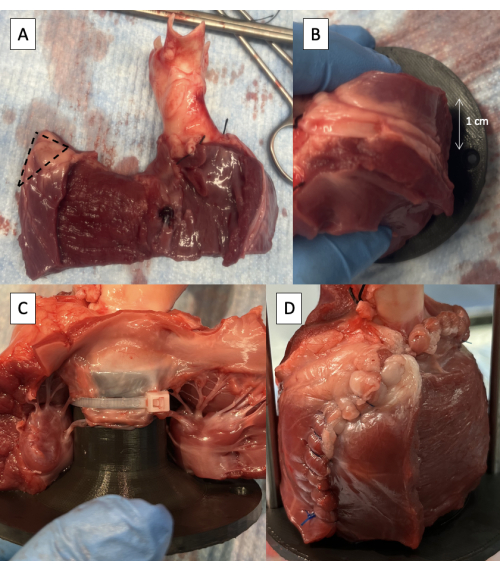
图 5:使用脉冲复制器夹具对左心室流出道进行插管。 (A) 去除左心室游离壁的一半厚度,在游离边缘保持 1 cm 的心外膜。虚线表示要从 LV 自由墙膜的上角移除的 1 cm 区域。(B) 支撑杆连接孔位于 LV 游离壁切口后方 1 cm 处。(C) 扎带将 MV 的前叶固定到近端固定装置上。(D) 在夹具周围缝合 LV 自由墙。 请点击这里查看此图的较大版本.
6. 使用PD夹具插管主动脉和PD测试的最后准备
- 使用 Hegar 扩张器测量 AV 的直径,以帮助解释 PD 测试的结果。
- 通过抓住主动脉将标本从桌子上抬起来确定主动脉的中立位置(图6A)。
- 将 PD 夹具插入主动脉,注意将杆连接孔对齐在主动脉的中立位置。
- 通过插入支撑杆检查试样的长度。
- 使用一个或两个 6 英寸的扎带将 PD 夹具固定到主动脉上(图 6B)。
- 使用一个或两个 8 英寸扎带将 LVOT 固定在 PD 夹具周围。
- 使用 PD 套件随附的螺钉将支撑杆固定到位。
- 将试样置于PD中并开始测试(图6C,视频1 和 视频2)。
- 根据需要缝合任何泄漏。
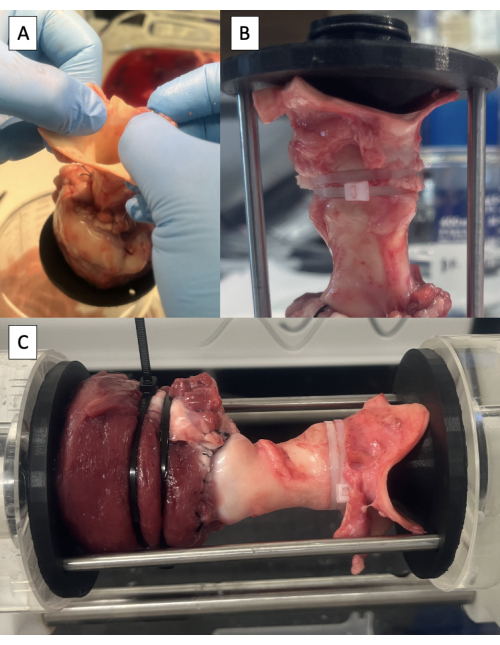
图 6:主动脉插管和脉冲拷贝机中的测试。 (A) 通过主动脉将标本从桌子上抬起,以确定主动脉的中立位置。(B) 用扎带固定在主动脉中的远端固定装置。(C) 安装在脉冲拷贝机中的试样,用于流体动力学测试。 请点击这里查看此图的较大版本.
7. 执行实验程序
注意:执行实验程序,如前面描述的尾崎程序 5、6、7,并重复 PD 测试。
- 如果组织在手术过程中变得干燥,请根据需要收紧扎带并加固缝合线。
8. 标本的长期储存(如果需要)
- 将标本置于福尔马林10%中168小时(1周)10,11。
- 组织固定后,用去离子水洗涤标本,并将其置于70%的乙醇中长期储存。
结果
从脉冲拷贝机收集的代表性数据包括反流分数 (RF)、有效孔口面积 (EOA) 和平均正压差 (PPD)。特别是 RF 和 EOA,用于 ISO 人工瓣膜标准 (ISO 5840),如果人工瓣膜产品正在接受调查,收集这些标准非常重要。PPD 提供了有关打开瓣膜所需的压力的信息,在讨论人工瓣膜置换术时通常被引用 3,4。本实验中使用的 HDTi-6000 脉冲拷贝机(BDC Laboratories,Wheat...
讨论
这里介绍的方法为AV的流体动力学测试提供了一个平台,以检查实验程序或新型医疗设备的效果。通过将天然主动脉瓣安装在脉冲复制机上,我们能够确定实验程序对用于研究和批准新型瓣膜假体(ISO 5840)的所有流体动力学参数的影响。这提供了一个机会,可以在大型动物模型中使用之前对程序和假体进行微调。
由于左心室流出道中缺乏环形心肌,因此固定流入段存在一些?...
披露声明
作者没有需要披露的相关财务利益冲突。
致谢
我们要感谢 Gordana Vunjak-Novakovic 博士的实验室,包括 Julie Van Hassel、Mohamed Diane 和 Panpan Chen,他们允许我们使用他们实验中的心脏废物组织。这项工作得到了新泽西州巴特勒的先天性心脏缺陷联盟和马里兰州贝塞斯达的美国国立卫生研究院(5T32HL007854-27)的支持。
材料
| Name | Company | Catalog Number | Comments |
| 3D Printer | Ultimaker | Ultimaker S5 | Used for printing custom fixtures for hydrodynamic testing |
| Crile-Wood Needle Driver | Emerald Instruments | 2.0638.15 | Used for suturing ventricle |
| Debakey Forceps | Jarit | 320-110 | Used for dissection and sample preparation (can use multiple if working with an assistant) |
| Ethanol 200 proof | Decon Labs Inc. | DSP-MD.43 | Used for fixed tissue storage |
| Formalin 10% | Epredia | 5701 | Used for tissue fixation |
| Gerald Forceps | Jarit | 285-126 | Used for dissection and sample preparation |
| Glass jars | QAPPDA | B07QCP54Z3 | Used for tissue storage |
| Glutaraldehyde 25% | Electron Microscopy Sciences | 16400 | Used for tissue fixation |
| HEPES 1 M buffer solution | Fisher | BP299-100 | Used to make glutaraldehyde 0.6% |
| Mayo Scissors | Jarit | 099-200 | Used for cutting suture |
| Metzenbaum Scissors | Jarit | 099-262 | Used for dissection and sample preparation |
| O-ring | Sterling Seal & Supply Inc. | AS568-117 | Used as a gasket on the end of the 3D printed fixtures |
| Polylactic acid resin | Ultimaker | 1609 | Used for 3D printing fixtures |
| Polyproplene suture | Covidien | VP-762-X | Used for suturing ventricle, tapered needle |
| Pulse Duplicator | BDC Laboratories | HDTi-6000 | Used for hydrodynamic testing |
| Silk ties | Covidien | S-193 | Used for ligating coronary arteries |
| Tonsil Clamp | Aesculap | BH957R | Used for coronary artery dissection |
| Zip ties (6 inch) | Advanced Cable Ties, Inc. | AL-06-18-9-C | Used for securing sample to fixtures, 157.14 mm long (6 inches), 2.5 mm wide |
| Zip ties (8 inch) | GTSE | GTSE-20025B.1000 | Used for securing sample to fixtures, 203 mm long (8 inches), 2.5 mm wide |
参考文献
- Aluru, J. S., Barsouk, A., Saginala, K., Rawla, P., Barsouk, A. Valvular heart disease epidemiology. Medical Science. 10 (2), 32 (2022).
- Herrmann, J. L., Brown, J. W. Seven decades of valved right ventricular outflow tract reconstruction: The most common heart procedure in children. The Journal of Thoracic and Cardiovascular Surgery. 160 (5), 1284-1288 (2020).
- Rotman, O. M., Bianchi, M., Ghosh, R. P., Kovarovic, B., Bluestein, D. Principles of TAVR valve design, modelling, and testing. Expert Review of Medical Devices. 15 (11), 771-791 (2018).
- Pibarot, P., et al. Imaging for predicting and assessing prosthesis-patient mismatch after aortic valve replacement. JACC Cardiovascular Imaging. 12 (1), 149-162 (2019).
- Ozaki, S., et al. Aortic valve reconstruction using self-developed aortic valve plasty system in aortic valve disease. Interactive Cardiovascular and Thoracic Surgery. 12 (4), 550-553 (2011).
- Krane, M., Amabile, A., Ziegelmüller, J. A., Geirsson, A., Lange, R. Aortic valve neocuspidization (the Ozaki procedure). Multimedia Manual of Cardiothoracic Surgery. , (2021).
- Ozaki, S., et al. A total of 404 cases of aortic valve reconstruction with glutaraldehyde-treated autologous pericardium. The Journal of Thoracic and Cardiovascular Surgery. 147 (1), 301-306 (2014).
- Vandecasteele, T., et al. The pulmonary veins of the pig as an anatomical model for the development of a new treatment for atrial fibrillation. Anatomia Histollogia Embryologia. 44 (1), 1-12 (2015).
- Góes, A. M. O., et al. Comparative angiotomographic study of swine vascular anatomy: contributions to research and training models in vascular and endovascular surgery. Journal Vascular Brasilerio. 20, 20200086 (2021).
- Hołda, M. K., Klimek-Piotrowska, W., Koziej, M., Piątek, K., Hołda, J. Influence of different fixation protocols on the preservation and dimensions of cardiac tissue. Journal of Anatomy. 229 (2), 334-340 (2016).
- Hołda, M. K., Klimek-Piotrowska, W., Koziej, M., Tyrak, K., Hołda, J. Penetration of formaldehyde based fixatives into heart. Folia Medica Cracoviensia. 57 (4), 63-70 (2017).
- Spampinato, R. A., et al. Grading of aortic regurgitation by cardiovascular magnetic resonance and pulsed Doppler of the left subclavian artery: harmonizing grading scales between imaging modalities. International Journal of Cardiovascular Imaging. 36 (8), 1517-1526 (2020).
- Capps, S. B., Elkins, R. C., Fronk, D. M. Body surface area as a predictor of aortic and pulmonary valve diameter. The Journal of Thoracic and Cardiovascular Surgery. 119 (5), 975-982 (2000).
- Baumgartner, H., et al. Recommendations on the echocardiographic assessment of aortic valve stenosis: a focused update from the European Association of Cardiovascular Imaging and the American Society of Echocardiography. European Heart Journal - Cardiovascular Imaging. 18 (3), 254-275 (2017).
- Saisho, H., et al. An ex vivo evaluation of two different suture techniques for the Ozaki aortic neocuspidization procedure. Interactive Cardiovascular and Thoracic Surgery. 33 (4), 518-524 (2021).
- Saisho, H., et al. Ex vivo evaluation of the Ozaki procedure in comparison with the native aortic valve and prosthetic valves. Interactive Cardiovascular and Thoracic Surgery. 35 (3), (2022).
- Paulsen, M. J., et al. Comprehensive ex vivo comparison of 5 clinically used conduit configurations for valve-sparing aortic root replacement using a 3-dimensional-printed heart simulator. Circulation. 142 (14), 1361-1373 (2020).
- Al-Atassi, T., et al. Impact of aortic annular geometry on aortic valve insufficiency: Insights from a preclinical, ex vivo, porcine model. The Journal of Thoracic and Cardiovascular Surgery. 150 (3), 656-664 (2015).
- Sun, M., et al. A biomimetic multilayered polymeric material designed for heart valve repair and replacement. Biomaterials. 288, 121756 (2022).
- Waller, B. F., McKay, C., Van Tassel, J., Allen, M. Catheter balloon valvuloplasty of stenotic porcine bioprosthetic valves: Part I: Anatomic considerations. Clinical Cardiology. 14 (8), 686-691 (1991).
- Crick, S. J., Sheppard, M. N., Ho, S. Y., Gebstein, L., Anderson, R. H. Anatomy of the pig heart: comparisons with normal human cardiac structure. Journal of Anatomy. 193, 105-119 (1998).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。