È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un modello suino ex vivo per test idrodinamici di procedure sperimentali di valvole aortiche e nuovi dispositivi medici
In questo articolo
Riepilogo
Presentiamo un metodo per montare una valvola aortica suina su un duplicatore di impulsi per testarne le proprietà idrodinamiche. Questo metodo può essere utilizzato per determinare il cambiamento dell'idrodinamica dopo l'applicazione di una procedura sperimentale o di un nuovo dispositivo medico prima dell'uso in un modello animale di grandi dimensioni.
Abstract
Le opzioni per testare nuove procedure cardiache e dispositivi medici investigativi prima dell'uso in un modello animale sono limitate. In questo studio, presentiamo un metodo per il montaggio di una valvola aortica suina in un duplicatore di impulsi per valutarne le proprietà idrodinamiche. Queste proprietà possono quindi essere valutate prima e dopo l'esecuzione della procedura in esame e/o l'applicazione del dispositivo medico in esame. La messa in sicurezza del segmento di afflusso presenta alcune difficoltà a causa della mancanza di miocardio circonferenziale nel tratto di efflusso ventricolare sinistro. Questo metodo risolve questo problema fissando il segmento di afflusso utilizzando il lembo anteriore della valvola mitrale e quindi suturando la parete libera del ventricolo sinistro attorno al dispositivo di afflusso. Il segmento di deflusso viene fissato semplicemente inserendo il dispositivo in un'incisione nella parte superiore dell'arco aortico. Abbiamo scoperto che i campioni avevano proprietà idrodinamiche significativamente diverse prima e dopo la fissazione dei tessuti. Questa scoperta ci ha indotto a utilizzare campioni freschi nei nostri test e dovrebbe essere presa in considerazione quando si utilizza questo metodo. Nel nostro lavoro, abbiamo utilizzato questo metodo per testare nuovi materiali per cerotti intracardiaci da utilizzare in posizione valvolare eseguendo una procedura di neocuspidizzazione della valvola aortica (procedura di Ozaki) sulle valvole aortiche suine montate. Queste valvole sono state testate prima e dopo la procedura per valutare il cambiamento delle proprietà idrodinamiche rispetto alla valvola nativa. Di seguito, riportiamo una piattaforma per il test idrodinamico delle procedure sperimentali della valvola aortica che consente il confronto con la valvola nativa e tra i diversi dispositivi e tecniche utilizzate per la procedura in esame.
Introduzione
La valvulopatia aortica rappresenta un onere significativo per la salute pubblica, in particolare la stenosi aortica, che colpisce 9 milioni di persone in tutto il mondo1. Le strategie per affrontare questa malattia sono attualmente in evoluzione e includono la riparazione della valvola aortica e la sostituzione della valvola aortica. Nella popolazione pediatrica in particolare, c'è un incentivo significativo a riparare piuttosto che sostituire la valvola poiché le protesi attualmente disponibili sono soggette a degenerazione valvolare strutturale (SVD) e non sono tolleranti alla crescita, richiedendo un reintervento per la sostituzione man mano che il paziente cresce. Anche la procedura di Ross, che sostituisce la valvola aortica malata (AV) con la valvola polmonare nativa (PV), richiede una protesi o un innesto in posizione polmonare anch'essa soggetta a SVD e spesso a tolleranza alla crescita limitata2. Sono in fase di sviluppo nuovi approcci alla malattia della valvola aortica e vi è la necessità di testare in un contesto biologicamente rilevante prima dell'applicazione in un modello animale di grandi dimensioni.
Abbiamo sviluppato un metodo per testare un AV suino in grado di fornire informazioni sulla funzione della valvola prima e dopo una procedura sperimentale o l'applicazione di un nuovo dispositivo medico. Montando l'AV suino su una macchina duplicatrice di impulsi disponibile in commercio, siamo in grado di confrontare le caratteristiche idrodinamiche comunemente utilizzate nello studio e infine nell'approvazione delle protesi valvolari, tra cui la frazione di rigurgito (RF), l'area dell'orifizio effettivo (EOA) e la differenza di pressione positiva media (PPD)3,4. L'intervento può quindi essere messo a punto in un contesto biologicamente rilevante prima dell'uso in un modello animale di grandi dimensioni, limitando così il numero di animali necessari per produrre una procedura o una protesi che può essere utilizzata nell'uomo. I cuori utilizzati per questo esperimento possono essere ottenuti dal macello locale o tessuti di scarto da altri esperimenti, quindi non è necessario sacrificare un animale solo ai fini di questo esperimento.
Nel nostro lavoro, abbiamo utilizzato questo metodo per sviluppare un nuovo materiale patch per la riparazione e la sostituzione delle valvole. Abbiamo testato la funzione idrodinamica di una varietà di materiali per cerotti eseguendo una procedura di neocuspidizzazione della valvola aortica (procedura di Ozaki 5,6,7) su AV suini e testandoli nel duplicatore di impulsi prima e dopo la procedura. Questo ci ha permesso di mettere a punto il materiale in base alle sue prestazioni idrodinamiche. Pertanto, questo metodo fornisce una piattaforma per i test idrodinamici di procedure sperimentali e nuovi dispositivi medici da utilizzare sull'AV prima dell'applicazione in un modello animale di grandi dimensioni.
Protocollo
Tutte le ricerche sono state condotte nel rispetto delle linee guida istituzionali per la cura degli animali.
1. Considerazioni e preparativi per l'esperimento
- Utilizzare un duplicatore di impulsi (PD) adatto per la simulazione della gittata cardiaca attraverso l'AV. Il PD dovrà essere in grado di ospitare materiali biologici ed essere in grado di essere pulito.
- Utilizzare le impostazioni PD appropriate per testare l'AV: volume di spostamento di 70 mL e 70 battiti al minuto (5 L/min di gittata cardiaca), 35% del ciclo cardiaco in sistole, gradiente di pressione transvalvolare medio di 100 mmHg, gradiente di pressione massima di 120 e gradiente di pressione minimo di 80.
- Utilizzare soluzione fisiologica normale a temperatura ambiente (RT) (0,9% NaCl) come mezzo fluido.
- Individuare o creare (utilizzando la stampa 3D o un metodo simile) dispositivi adatti per il montaggio dell'AV suino per il test sul PD.
- Utilizzare dispositivi modellati sui dispositivi forniti con il duplicatore di impulsi con le seguenti specifiche: assicurarsi che il diametro interno dell'apparecchio sia simile al diametro dell'AV studiato, che la lunghezza dell'attacco sia di almeno 2 cm e che la larghezza utile dell'attacco sia di almeno 4 cm (Figura 1).
- Utilizzare O-ring in gomma come guarnizioni alle estremità degli infissi.
- Ottenere un campione cardiaco dopo la cardiectomia (Figura 2A).
- Utilizzare campioni cardiaci suini provenienti dal macello o tessuti di scarto di animali che sono altrimenti sani e non hanno fatto parte di alcun protocollo sperimentale che influenzerà i loro cuori.
- Prelevare un campione dopo la cardiectomia o eseguire la cardiectomia post-mortem, compresa la transezione della vena cava superiore, della vena cava inferiore, dell'arteria polmonare principale (PA), di tutte le vene polmonari e dell'aorta in corrispondenza dell'aspetto distale dell'arco aortico.
NOTA: Per questo esperimento devono essere utilizzati campioni freschi, meno di 6 ore post-mortem o conservati in soluzione salina sterile con una soluzione antibiotica all'1% (penicillina e streptomicina) in un frigorifero a 4 °C per un massimo di 7 giorni. I tessuti fissati in formalina o glutaraldeide produrranno risultati idrodinamici alterati a causa dell'aumento della rigidità.

Figura 1: Dispositivi stampati in 3D personalizzati per il montaggio delle valvole aortiche suine sul duplicatore di impulsi. Come indicato nel protocollo, la lunghezza dell'attacco deve essere di almeno 2 cm e la larghezza utile dell'attacco deve essere di almeno 4 cm. Fare clic qui per visualizzare una versione più grande di questa figura.
2. Resezione di strutture di lato destro
- Sezionare il PA dall'aorta con le forbici Metzenbaum fino a quando il tessuto ventricolare non è visibile (Figura 2B).
- Sezionare e legare con legature di seta entrambe le arterie coronarie alla loro origine dai seni aortici, facendo attenzione a non restringere i seni paranasali.
- Trascinare le arterie coronarie distali alle fascette di seta.
- Incidere il ventricolo destro (RV) tra l'aorta e il PA alla base della valvola polmonare utilizzando le forbici Metzenbaum (Figura 2C).
- Iniziando anteriormente, continuare l'incisione circonferenzialmente lungo il setto interventricolare per rimuovere la parete libera da RV (Figura 2D, E).
- Continuare l'incisione posteriormente attraverso l'anulus della valvola tricuspide lungo il setto interatriale per rimuovere tutto il tessuto atriale destro (Figura 2F).
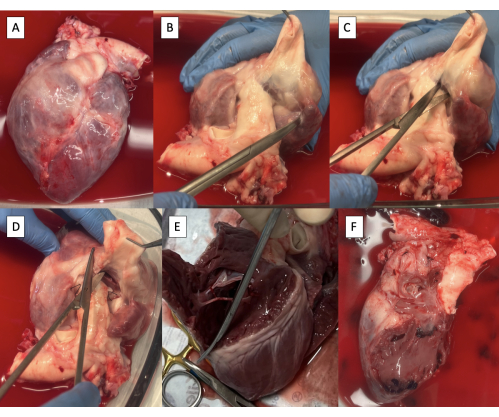
Figura 2: Campione di cardiectomia e resezione delle strutture del lato destro. (A) Campione di cardiectomia. (B) Arteria polmonare principale sezionata dall'aorta fino a quando il tessuto ventricolare è visibile. (C) Incisione del ventricolo destro (RV) alla base della valvola polmonare. (D) Continuare l'incisione lungo il setto interventricolare anteriormente. (E) Rimozione della parete priva di RV continuando l'incisione circonferenzialmente lungo il setto interventricolare. (F) Esemplare con strutture sul lato destro rimosse. Fare clic qui per visualizzare una versione più grande di questa figura.
3. Preparazione del tratto di efflusso ventricolare sinistro (LVOT) per l'incannulamento con il dispositivo PD
- Incidere l'atrio sinistro (LA) attraverso l'ostio della vena polmonare destra parallelamente all'aorta utilizzando le forbici Metzenbaum (Figura 3A).
NOTA: Sebbene esista una variabilità limitata, l'anatomia della vena polmonare suina termina generalmente con due osti venosi polmonari che entrano nel LA8. - Continuare l'incisione verso la commessura anterolaterale della valvola mitrale (MV), lasciando almeno una cuffia di 3 mm di tessuto atriale sul lato dell'aorta.
- Tagliare il tessuto LA in eccesso, mantenendo la cuffia di 3 mm di tessuto atriale sull'aorta e l'anulus MV circonferenzialmente (Figura 3B).
- Estendere l'incisione sul ventricolo sinistro (LV) attraverso la commessura anterolaterale del MV, avendo cura di preservare il muscolo papillare anterolaterale (Figura 3C).
- Dividere le corde tendinee dal muscolo papillare anterolaterale al lembo MV posteriore, preservando gli attacchi al lembo MV anteriore.
- Continuare l'incisione fino all'apice del cuore.
- Tagliare il tessuto ventricolare sinistro in eccesso al di sotto dei muscoli papillari, preservando entrambi i muscoli papillari (Figura 3D).
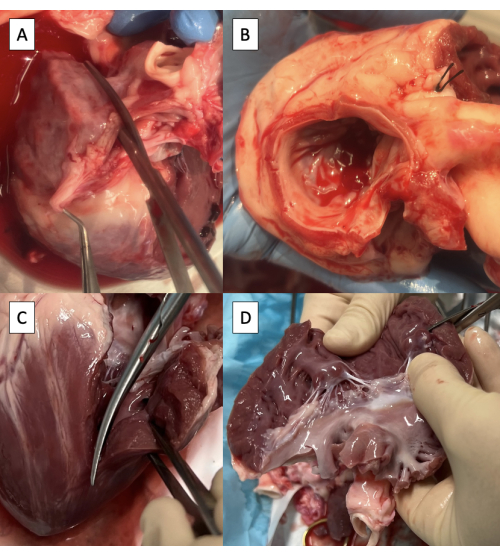
Figura 3: Preparazione del tratto di efflusso ventricolare sinistro per l'incannulamento con il dispositivo duplicatore di impulsi. (A) Incisione dell'atrio sinistro (LA) attraverso l'ostio della vena polmonare destra. (B) Tessuto LA in eccesso tagliato, mantenendo almeno una cuffia di 3 mm di tessuto atriale sull'aorta e mantenendo la valvola mitrale anulus circonferenziale. (C) Estensione dell'incisione sul ventricolo sinistro (LV) attraverso la commessura anterolaterale della valvola mitrale. (D) Rimozione del tessuto LV in eccesso al di sotto dei muscoli papillari. Le forbici sono visibili nell'angolo in alto a destra dell'immagine. Fare clic qui per visualizzare una versione più grande di questa figura.
4. Preparazione dell'aorta per l'incannulamento con il dispositivo PD
- Tagliare il tessuto linfatico, connettivo o polmonare in eccesso dall'aorta (Figura 4A).
- Incidere l'aspetto superiore dell'arco aortico dall'aorta discendente all'arteria succlavia sinistra utilizzando le forbici Metzenbaum (Figura 4B).
- Continuare l'incisione sulla faccia superiore dell'arco aortico dall'arteria succlavia sinistra al tronco brachiocefalico (Figura 4C, D).
NOTA: I rami dell'arco aortico suino da distale a prossimale includono l'arteria succlavia sinistra e il tronco brachiocefalico, che dà origine all'arteria succlavia destra, all'arteria carotide destra e all'arteria carotide sinistra9.
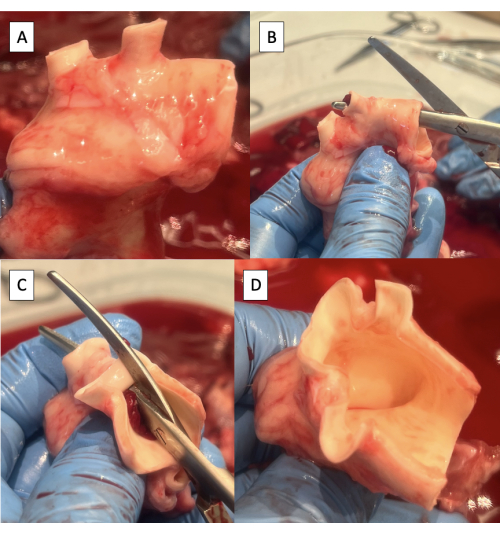
Figura 4: Preparazione dell'aorta per l'incannulamento con il dispositivo duplicatore di impulsi. (A) Arco aortico con il tessuto in eccesso rimosso. Si notino i due vasi dell'arco nell'arco aortico suino, nel tronco brachiocefalico e nell'arteria succlavia sinistra. (B) Iniziare l'incisione lungo l'aspetto superiore dell'arco aortico dall'aorta discendente all'arteria succlavia sinistra. (C) Continuare l'incisione lungo l'aspetto superiore dell'arco aortico dall'arteria succlavia sinistra al tronco brachiocefalico. (D) Incisione dell'arco aortico completata. Fare clic qui per visualizzare una versione più grande di questa figura.
5. Incannulamento del LVOT con l'apparecchio PD
- Testare il posizionamento del dispositivo nell'LVOT e tagliare il tessuto LV in eccesso.
- Inserire l'apparecchio nell'LVOT sotto il foglietto anteriore del MV.
- Avvolgere la parete priva di LV attorno all'apparecchio.
- Tagliare il tessuto ventricolato sinistro in eccesso per mantenere un avvolgimento stretto attorno all'apparecchio.
- Rimuovere metà dello spessore della parete libera del ventricolo sinistro a partire dal setto interventricolare, mantenendo almeno 1 cm di epicardio sul bordo libero per mantenere l'integrità della linea di sutura (Figura 5A).
- Tagliare 1 cm di tessuto dall'angolo superiore dell'involucro murale LV free (Figura 5A).
- Posizionare l'apparecchio nell'LVOT con il foro di fissaggio dell'asta di supporto 1 cm dietro l'incisione LV (Figura 5B).
- Fare attenzione a non inserire l'apparecchio troppo all'interno dell'LVOT in modo tale da dilatare l'anulus AV.
- Fissare il lembo anteriore del MV all'apparecchio utilizzando una o due fascette da 6 pollici posizionate tra le corde tendinee del foglietto illustrativo (Figura 5C).
- Suturare la parete libera LV attorno all'apparecchio (Figura 5D).
- Iniziare suturando la cuffia del tessuto LA sull'aorta all'anulus MV utilizzando una semplice sutura a corsa con un ago a punta conica.
- Continuare il punto filza sul ventricolo sinistro, senza strappare il tessuto del ventricolo sinistro.
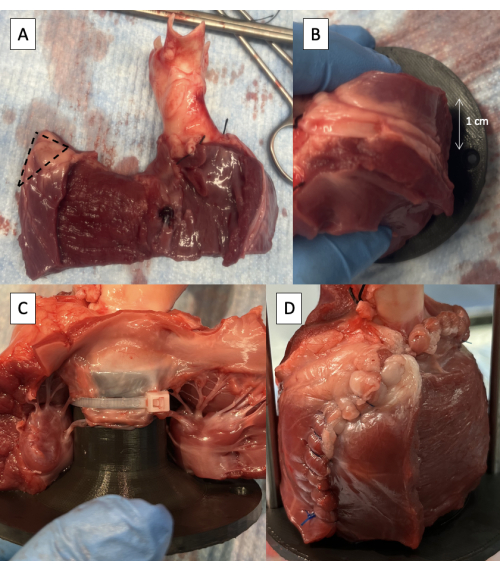
Figura 5: Incannulamento del tratto di efflusso ventricolare sinistro con il dispositivo duplicatore di impulsi. (A) Metà dello spessore della parete libera del ventricolo sinistro rimosso con 1 cm di epicardio mantenuto sul bordo libero. La linea tratteggiata indica l'area di 1 cm da rimuovere dall'angolo superiore dell'involucro murale LV free. (B) Foro di fissaggio dell'asta di supporto posizionato 1 cm dietro l'incisione della parete libera LV. (C) Fascetta che fissa il lembo anteriore del MV al dispositivo prossimale. (D) Parete libera LV suturata attorno all'apparecchio. Fare clic qui per visualizzare una versione più grande di questa figura.
6. Incannulamento dell'aorta con fixture PD e preparazione finale per il test PD
- Misurare il diametro dell'AV utilizzando i dilatatori Hegar per facilitare l'interpretazione dei risultati del test PD.
- Identificare la posizione neutra dell'aorta sollevando il campione dal tavolo afferrando l'aorta (Figura 6A).
- Inserire il dispositivo PD nell'aorta, avendo cura di allineare i fori di attacco dell'asta in posizione neutra dell'aorta.
- Controllare la lunghezza del provino inserendo le aste di supporto.
- Fissare il dispositivo PD all'aorta utilizzando una o due fascette da 6 pollici (Figura 6B).
- Fissare l'LVOT attorno all'apparecchio PD utilizzando una o due fascette da 8 pollici.
- Fissare le aste di supporto in posizione utilizzando le viti fornite con il set PD.
- Posizionare il campione nel PD e avviare il test (Figura 6C, Video 1 e Video 2).
- Suzionare eventuali perdite secondo necessità.
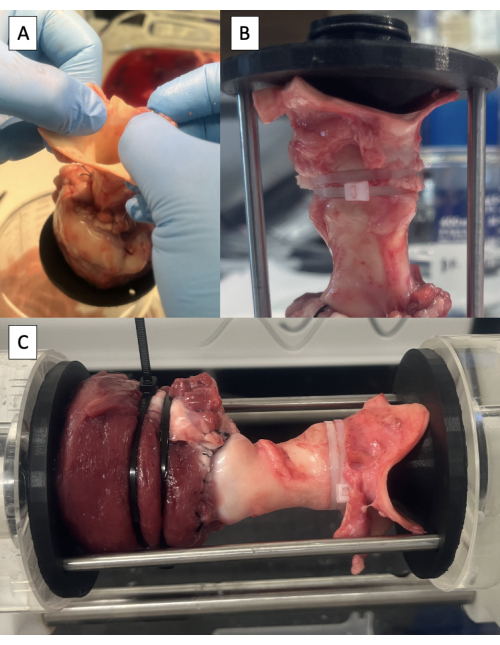
Figura 6: Incannulamento dell'aorta e test nel duplicatore di impulsi. (A) Sollevare il campione dal tavolo dall'aorta per identificare la posizione neutra dell'aorta. (B) Dispositivo distale fissato nell'aorta con fascette. (C) Provino montato nel duplicatore di impulsi per le prove idrodinamiche. Fare clic qui per visualizzare una versione più grande di questa figura.
7. Eseguire la procedura sperimentale
NOTA: Eseguire procedure sperimentali come la procedura di Ozakicome descritto in precedenza 5,6,7 e ripetere il test PD.
- Se il tessuto si è seccato durante la procedura, stringere le fascette e rinforzare la linea di sutura secondo necessità.
8. Conservazione a lungo termine del campione (se lo si desidera)
- Porre il campione in formalina al 10% per 168 ore (1 settimana)10,11.
- Dopo la fissazione del tessuto, lavare il campione con acqua deionizzata e metterlo in etanolo al 70% per la conservazione a lungo termine.
Risultati
I dati rappresentativi raccolti dal duplicatore di impulsi includono la frazione di rigurgito (RF), l'area effettiva dell'orifizio (EOA) e la differenza di pressione positiva media (PPD). L'RF e l'EOA, in particolare, sono utilizzati negli standard ISO per le valvole protesiche (ISO 5840) e saranno importanti da raccogliere se i prodotti delle valvole protesiche sono in fase di studio. Il PPD offre informazioni sulla pressione necessaria per aprire la valvola ed è comunemente citato quando si parla di sostituzione della...
Discussione
Il metodo qui presentato fornisce una piattaforma per i test idrodinamici dell'AV al fine di esaminare l'effetto di una procedura sperimentale o di un nuovo dispositivo medico. Montando la valvola aortica nativa su una macchina duplicatrice di impulsi, siamo in grado di determinare l'effetto della procedura sperimentale su tutti i parametri idrodinamici utilizzati nello studio e nell'approvazione di nuove protesi valvolari (ISO 5840). Ciò offre l'opportunità di mettere a punto procedure e protesi prima dell'uso in un m...
Divulgazioni
Gli autori non hanno conflitti di interesse finanziari rilevanti da rivelare.
Riconoscimenti
Vorremmo ringraziare il laboratorio della dottoressa Gordana Vunjak-Novakovic, tra cui Julie Van Hassel, Mohamed Diane e Panpan Chen, per averci permesso di utilizzare il tessuto di scarto cardiaco dei loro esperimenti. Questo lavoro è stato sostenuto dalla Congenital Heart Defect Coalition di Butler, NJ, e dal National Institutes of Health di Bethesda, MD (5T32HL007854-27).
Materiali
| Name | Company | Catalog Number | Comments |
| 3D Printer | Ultimaker | Ultimaker S5 | Used for printing custom fixtures for hydrodynamic testing |
| Crile-Wood Needle Driver | Emerald Instruments | 2.0638.15 | Used for suturing ventricle |
| Debakey Forceps | Jarit | 320-110 | Used for dissection and sample preparation (can use multiple if working with an assistant) |
| Ethanol 200 proof | Decon Labs Inc. | DSP-MD.43 | Used for fixed tissue storage |
| Formalin 10% | Epredia | 5701 | Used for tissue fixation |
| Gerald Forceps | Jarit | 285-126 | Used for dissection and sample preparation |
| Glass jars | QAPPDA | B07QCP54Z3 | Used for tissue storage |
| Glutaraldehyde 25% | Electron Microscopy Sciences | 16400 | Used for tissue fixation |
| HEPES 1 M buffer solution | Fisher | BP299-100 | Used to make glutaraldehyde 0.6% |
| Mayo Scissors | Jarit | 099-200 | Used for cutting suture |
| Metzenbaum Scissors | Jarit | 099-262 | Used for dissection and sample preparation |
| O-ring | Sterling Seal & Supply Inc. | AS568-117 | Used as a gasket on the end of the 3D printed fixtures |
| Polylactic acid resin | Ultimaker | 1609 | Used for 3D printing fixtures |
| Polyproplene suture | Covidien | VP-762-X | Used for suturing ventricle, tapered needle |
| Pulse Duplicator | BDC Laboratories | HDTi-6000 | Used for hydrodynamic testing |
| Silk ties | Covidien | S-193 | Used for ligating coronary arteries |
| Tonsil Clamp | Aesculap | BH957R | Used for coronary artery dissection |
| Zip ties (6 inch) | Advanced Cable Ties, Inc. | AL-06-18-9-C | Used for securing sample to fixtures, 157.14 mm long (6 inches), 2.5 mm wide |
| Zip ties (8 inch) | GTSE | GTSE-20025B.1000 | Used for securing sample to fixtures, 203 mm long (8 inches), 2.5 mm wide |
Riferimenti
- Aluru, J. S., Barsouk, A., Saginala, K., Rawla, P., Barsouk, A. Valvular heart disease epidemiology. Medical Science. 10 (2), 32 (2022).
- Herrmann, J. L., Brown, J. W. Seven decades of valved right ventricular outflow tract reconstruction: The most common heart procedure in children. The Journal of Thoracic and Cardiovascular Surgery. 160 (5), 1284-1288 (2020).
- Rotman, O. M., Bianchi, M., Ghosh, R. P., Kovarovic, B., Bluestein, D. Principles of TAVR valve design, modelling, and testing. Expert Review of Medical Devices. 15 (11), 771-791 (2018).
- Pibarot, P., et al. Imaging for predicting and assessing prosthesis-patient mismatch after aortic valve replacement. JACC Cardiovascular Imaging. 12 (1), 149-162 (2019).
- Ozaki, S., et al. Aortic valve reconstruction using self-developed aortic valve plasty system in aortic valve disease. Interactive Cardiovascular and Thoracic Surgery. 12 (4), 550-553 (2011).
- Krane, M., Amabile, A., Ziegelmüller, J. A., Geirsson, A., Lange, R. Aortic valve neocuspidization (the Ozaki procedure). Multimedia Manual of Cardiothoracic Surgery. , (2021).
- Ozaki, S., et al. A total of 404 cases of aortic valve reconstruction with glutaraldehyde-treated autologous pericardium. The Journal of Thoracic and Cardiovascular Surgery. 147 (1), 301-306 (2014).
- Vandecasteele, T., et al. The pulmonary veins of the pig as an anatomical model for the development of a new treatment for atrial fibrillation. Anatomia Histollogia Embryologia. 44 (1), 1-12 (2015).
- Góes, A. M. O., et al. Comparative angiotomographic study of swine vascular anatomy: contributions to research and training models in vascular and endovascular surgery. Journal Vascular Brasilerio. 20, 20200086 (2021).
- Hołda, M. K., Klimek-Piotrowska, W., Koziej, M., Piątek, K., Hołda, J. Influence of different fixation protocols on the preservation and dimensions of cardiac tissue. Journal of Anatomy. 229 (2), 334-340 (2016).
- Hołda, M. K., Klimek-Piotrowska, W., Koziej, M., Tyrak, K., Hołda, J. Penetration of formaldehyde based fixatives into heart. Folia Medica Cracoviensia. 57 (4), 63-70 (2017).
- Spampinato, R. A., et al. Grading of aortic regurgitation by cardiovascular magnetic resonance and pulsed Doppler of the left subclavian artery: harmonizing grading scales between imaging modalities. International Journal of Cardiovascular Imaging. 36 (8), 1517-1526 (2020).
- Capps, S. B., Elkins, R. C., Fronk, D. M. Body surface area as a predictor of aortic and pulmonary valve diameter. The Journal of Thoracic and Cardiovascular Surgery. 119 (5), 975-982 (2000).
- Baumgartner, H., et al. Recommendations on the echocardiographic assessment of aortic valve stenosis: a focused update from the European Association of Cardiovascular Imaging and the American Society of Echocardiography. European Heart Journal - Cardiovascular Imaging. 18 (3), 254-275 (2017).
- Saisho, H., et al. An ex vivo evaluation of two different suture techniques for the Ozaki aortic neocuspidization procedure. Interactive Cardiovascular and Thoracic Surgery. 33 (4), 518-524 (2021).
- Saisho, H., et al. Ex vivo evaluation of the Ozaki procedure in comparison with the native aortic valve and prosthetic valves. Interactive Cardiovascular and Thoracic Surgery. 35 (3), (2022).
- Paulsen, M. J., et al. Comprehensive ex vivo comparison of 5 clinically used conduit configurations for valve-sparing aortic root replacement using a 3-dimensional-printed heart simulator. Circulation. 142 (14), 1361-1373 (2020).
- Al-Atassi, T., et al. Impact of aortic annular geometry on aortic valve insufficiency: Insights from a preclinical, ex vivo, porcine model. The Journal of Thoracic and Cardiovascular Surgery. 150 (3), 656-664 (2015).
- Sun, M., et al. A biomimetic multilayered polymeric material designed for heart valve repair and replacement. Biomaterials. 288, 121756 (2022).
- Waller, B. F., McKay, C., Van Tassel, J., Allen, M. Catheter balloon valvuloplasty of stenotic porcine bioprosthetic valves: Part I: Anatomic considerations. Clinical Cardiology. 14 (8), 686-691 (1991).
- Crick, S. J., Sheppard, M. N., Ho, S. Y., Gebstein, L., Anderson, R. H. Anatomy of the pig heart: comparisons with normal human cardiac structure. Journal of Anatomy. 193, 105-119 (1998).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon